基于人工智能的动脉硬化斑块风险评估的方法及系统
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及图像处理技术领域,尤其涉及一种基于人工智能的动脉硬化斑块风险评估的方法及系统。
背景技术
在相关技术中,CN116245867A公开了一种基于无监督学习的血管斑块和血栓识别方法及系统,涉及图像处理技术领域,该方法为:将血管超声图像输入到动静脉分割模型中,对血管超声图像进行动静脉分割,得到动静脉分割图;根据动静脉分割图,分别生成动脉掩膜和静脉掩膜;利用动脉掩膜和静脉掩膜,分别得到动脉区域图像和静脉区域图像;将动脉区域图像和静脉区域图像均输入到血管病灶定位模型中,动脉区域图像检测出的病灶即为斑块,静脉区域图像检测出的病灶即为血栓。该方法能够在超声血管扫查过程中快速准确的识别出血管病灶,具体包括斑块和血栓,显著提升模型的检测精度和泛化性,降低误检,节约超声医生的诊断时间,提高诊断效率。
CN114240841A公开了一种模拟化三维血管狭窄分析模型的建立方法,包括:获取血管部位的亮血图像组和增强黑血图像组;对每个亮血图像以对应的增强黑血图像为基准利用基于互信息和图像金字塔的配准方法进行图像配准得到配准后亮血图像组;利用配准后亮血图像组建立血管模拟三维模型;针对血管模拟三维模型中的每一段血管,从预设的三个方位进行切分获得各方位的二维切面图;将每个方位的二维切面图中的血管进行腐蚀操作,记录血管腐蚀至单个像素时的目标腐蚀次数;根据该段血管在三个方位分别对应的目标腐蚀次数,得到表征该段血管狭窄程度的目标参数的数值;利用各段血管的目标参数的数值对血管模拟三维模型进行标记,得到模拟化三维血管狭窄分析模型。
因此,相关技术中可通过超声图像或者CT(Computed Tomography,电子计算机断层扫描)血管造影图像来自动判断血管中是否包括血管狭窄,或斑块和血栓等动脉硬化病灶,但易于破裂的高危病灶与较为稳定的病灶截然不同,例如,高危病灶的形态、尺寸等特征与稳定的病灶截然不同,而相关技术中仅可判断病灶是否存在,并未对高危病灶和稳定的病灶进行区分和识别,因此需要人工付出更多的时间和精力来进行判断,而人工判断不仅需要复杂的专业知识,培养专业人士的难度较大,成本较高,而且还可能由于人工的经验差异而造成误诊。
公开于本申请背景技术部分的信息仅仅旨在加深对本申请的一般背景技术的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域技术人员所公知的现有技术。
发明内容
本发明提供一种基于人工智能的动脉硬化斑块风险评估的方法及系统,能够解决区别高危病灶与较为稳定的病灶的技术问题。
根据本发明的第一方面,提供一种基于人工智能的动脉硬化斑块风险评估的方法,包括:
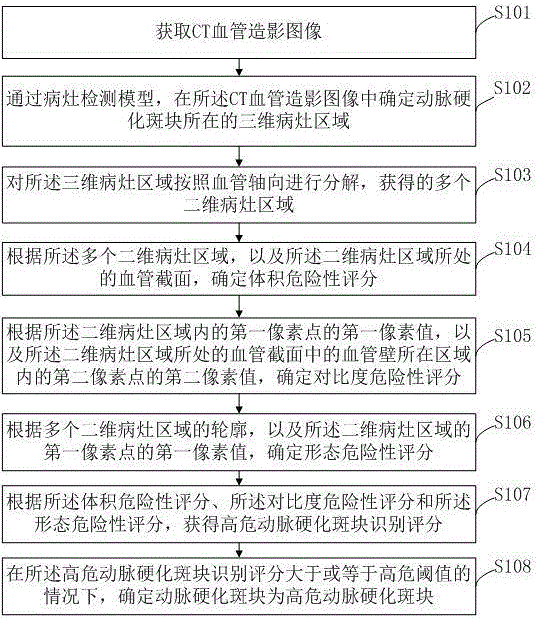
获取CT血管造影图像;
通过病灶检测模型,在所述CT血管造影图像中确定动脉硬化斑块所在的三维病灶区域;
对所述三维病灶区域按照血管轴向进行分解,获得的多个二维病灶区域;
根据所述多个二维病灶区域,以及所述二维病灶区域所处的血管截面,确定体积危险性评分;
根据所述二维病灶区域内的第一像素点的第一像素值,以及所述二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值,确定对比度危险性评分;
根据多个二维病灶区域的轮廓,以及所述二维病灶区域的第一像素点的第一像素值,确定形态危险性评分;
根据所述体积危险性评分、所述对比度危险性评分和所述形态危险性评分,获得高危动脉硬化斑块识别评分;
在所述高危动脉硬化斑块识别评分大于或等于高危阈值的情况下,确定动脉硬化斑块为高危动脉硬化斑块。
根据本发明,根据所述多个二维病灶区域,以及所述二维病灶区域所处的血管截面,确定体积危险性评分,包括:
确定多个二维病灶区域的轮廓,以及所述二维病灶区域所处的血管截面的轮廓;
根据所述二维病灶区域的轮廓,确定二维病灶区域的第一面积;
根据所述血管截面的轮廓,确定血管截面的第二面积;
根据所述第一面积和所述第二面积,确定所述体积危险性评分。
根据本发明,根据所述第一面积和所述第二面积,确定所述体积危险性评分,包括:
根据公式
确定体积危险性评分
根据本发明,根据所述二维病灶区域内的第一像素点的第一像素值,以及所述二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值,确定对比度危险性评分,包括:
确定各个二维病灶区域内的第一像素点的第一像素值的第一平均值;
确定各个二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值的第二平均值;
根据所述第一平均值和所述第二平均值,确定所述对比度危险性评分。
根据本发明,根据所述第一平均值和所述第二平均值,确定所述对比度危险性评分,包括:
根据公式
确定所述对比度危险性评分
根据本发明,根据多个二维病灶区域的轮廓,以及所述二维病灶区域的第一像素点的第一像素值,确定形态危险性评分,包括:
获取二维病灶区域的轮廓的最小外接矩形;
确定所述最小外接矩形的形心位置;
根据最小外接矩形的边长,确定所述最小外接矩形的长度方向和宽度方向;
确定所述二维病灶区域的轮廓与所述宽度方向的两个矩形边的交点,其中,两个交点将所述二维病灶区域的轮廓划分为两部分;
在所述两个交点之间,确定两部分轮廓的中线,其中,所述中线上的点与两部分轮廓的距离相等;
获取二维病灶区域所处的血管截面中,除所述二维病灶区域之外的其他区域中的像素点的最小像素值;
根据所述中线、所述中线上的像素点的第一像素值、所述最小像素值和所述形心位置,确定所述形态危险性评分。
根据本发明,根据所述中线、所述中线上的像素点的第一像素值、所述最小像素值和所述形心位置,确定所述形态危险性评分,包括:
根据公式
确定形态危险性评分
根据本发明的第二方面,提供一种基于人工智能的动脉硬化斑块风险评估的系统,包括:
获取模块,用于获取CT血管造影图像;
检测模块,用于通过病灶检测模型,在所述CT血管造影图像中确定动脉硬化斑块所在的三维病灶区域;
分解模块,用于对所述三维病灶区域按照血管轴向进行分解,获得的多个二维病灶区域;
体积危险性评分模块,用于根据所述多个二维病灶区域,以及所述二维病灶区域所处的血管截面,确定体积危险性评分;
对比度危险性评分模块,用于根据所述二维病灶区域内的第一像素点的第一像素值,以及所述二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值,确定对比度危险性评分;
形态危险性评分模块,用于根据多个二维病灶区域的轮廓,以及所述二维病灶区域的第一像素点的第一像素值,确定形态危险性评分;
高危动脉硬化斑块识别评分模块,用于根据所述体积危险性评分、所述对比度危险性评分和所述形态危险性评分,获得高危动脉硬化斑块识别评分;
确定模块,用于在所述高危动脉硬化斑块识别评分大于或等于高危阈值的情况下,确定动脉硬化斑块为高危动脉硬化斑块。
根据本发明,可在识别到CT血管造影图像中动脉硬化斑块所在的区域后,通过该病灶区域的体积、像素值的对比度和形态等多个方面综合评价动脉硬化斑块病灶的危险性,从而为专业人士提供更准确的参考,减少人工判断需要付出的时间和精力,降低误诊的可能性。在确定体积危险性评分时,可通过第一面积和第二面积之比,来确定该斑块病灶最多占据血管截面的百分比,从而判断该斑块堵塞血管或使血管破裂的风险,进而与高危病灶的标准进行比较,来确定所述体积危险性评分,提升体积危险性评分的准确性,使得体积危险性评分可客观地表示病灶的危险性。在确定对比度危险性评分时,可通过二维病灶区域内的平均像素值与血管壁所在区域内的平均像素值来对比,消除成像视角问题造成的像素值偏差,获得准确的对比结果,并对各个二维病灶区域的对比结果进行加权平均,可获得对比度危险性评分,可准确且客观地描述三维病灶区域内的像素点的像素值与脉硬化斑块的危险性之间的关系。在确定形态危险性评分时,可通过中线上的像素点与形心的连线与二维病灶区域的轮廓是否有交点来确定二维病灶区域的形状是否具有凹形图形的特征,并可结合中线上的像素点的像素值是否高于钙化斑块位置处的像素点的最小像素值,来共同确定二维病灶区域与餐巾环征之间的相似性,进而获得动脉硬化斑块整体与餐巾环征的相似性,从而通过形态危险性评分准确且客观地确定动脉硬化斑块的危险性。
应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,而非限制本发明。根据下面参考附图对示例性实施例的详细说明,本发明的其它特征及方面将更清楚。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的实施例,
图1示例性地示出根据本发明实施例的基于人工智能的动脉硬化斑块风险评估的方法的流程图;
图2示例性地示出根据本发明实施例的二维病灶区域的示意图;
图3示例性地示出根据本发明实施例的基于人工智能的动脉硬化斑块风险评估的系统的框图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下面以具体地实施例对本发明的技术方案进行详细说明。下面这几个具体的实施例可以相互结合,对于相同或相似的概念或过程可能在某些实施例不再赘述。
图1示例性地示出根据本发明实施例的基于人工智能的动脉硬化斑块风险评估的方法的流程图,所述方法包括:
步骤S101,获取CT血管造影图像;
步骤S102,通过病灶检测模型,在所述CT血管造影图像中确定动脉硬化斑块所在的三维病灶区域;
步骤S103,对所述三维病灶区域按照血管轴向进行分解,获得的多个二维病灶区域;
步骤S104,根据所述多个二维病灶区域,以及所述二维病灶区域所处的血管截面,确定体积危险性评分;
步骤S105,根据所述二维病灶区域内的第一像素点的第一像素值,以及所述二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值,确定对比度危险性评分;
步骤S106,根据多个二维病灶区域的轮廓,以及所述二维病灶区域的第一像素点的第一像素值,确定形态危险性评分;
步骤S107,根据所述体积危险性评分、所述对比度危险性评分和所述形态危险性评分,获得高危动脉硬化斑块识别评分;
步骤S108,在所述高危动脉硬化斑块识别评分大于或等于高危阈值的情况下,确定动脉硬化斑块为高危动脉硬化斑块。
根据本发明的实施例的基于人工智能的动脉硬化斑块风险评估的方法,可在识别到CT血管造影图像中动脉硬化斑块所在的区域后,通过该病灶区域的体积、像素值的对比度和形态等多个方面综合评价动脉硬化斑块病灶的危险性,从而为专业人士提供更准确的参考,减少人工判断需要付出的时间和精力,降低误诊的可能性。
根据本发明的一个实施例,在步骤S101中,可和获取CT血管造影图像,CT血管造影图像通常为三维图像。并在步骤S102中,可通过病灶检测模型,在CT血管造影图像中确定动脉硬化斑块所在的三维病灶区域。所述病灶检测模型可以是已训练的深度学习神经网络模型,可用于检测病灶所在区域,例如,使用已标注动脉硬化斑块所在位置的血管造影图像作为样本,对卷积神经网络模型进行训练,完成训练后,可获得病灶检测模型,本发明对病灶检测模型的类型不做限制。所述三维病灶区域为在三维的CT血管造影图像中将动脉硬化斑块所在的区域进行框选的三维区域,在确定三维病灶区域后,可将三维病灶区域截取出来,作为独立的图像块,也可不进行截取,保留在原CT血管造影图像中,本发明对此不做限制。
根据本发明的一个实施例,在步骤S103中,由于CT血管造影图像为三维图像,因此,三维病灶区域的图像块也为三维图像,在三维图像中可包括多个在空间中按规律分布的像素点,该三维图像可看作由多层二维图像(在平面中按规律分布多个像素点的图像)组成,因此,三维图像也可分解为多个二维图像。例如,可按照血管轴向进行分解,即,每个二维图像所在的层与血管轴向垂直,可获得多个二维图像,并且,在每个二维图像中,均包括径向的血管截面,也包括二维图像中的病灶所在区域,即,二维病灶区域。
根据本发明的一个实施例,在步骤S104中,可根据多个二维病灶区域,以及二维病灶区域所处的血管截面,确定体积危险性评分。高危病灶的特点之一为体积较大,易于堵塞血管,或者易于使血管发生破裂,例如,斑块可占据血管截面的70%以上,因此,可基于二维病灶区域和血管截面之间的比例来确定体积危险性评分,从而判断斑块的体积是否较大,是否具有较大的危险性。
根据本发明的一个实施例,步骤S104可包括:确定多个二维病灶区域的轮廓,以及所述二维病灶区域所处的血管截面的轮廓;根据所述二维病灶区域的轮廓,确定二维病灶区域的第一面积;根据所述血管截面的轮廓,确定血管截面的第二面积;根据所述第一面积和所述第二面积,确定所述体积危险性评分。
根据本发明的一个实施例,上述病灶检测模型可获取二维病灶区域的轮廓以及血管截面的轮廓。并且,由于轮廓内的面积越大,则轮廓内的像素点数量越多,轮廓内的面积与轮廓内的像素点的数量成正比,因此,二维病灶区域的第一面积和血管截面的第二面积,则可分别通过二维病灶区域的轮廓内的像素点的数量以及血管截面的轮廓内的像素点的数量来表示。
根据本发明的一个实施例,根据所述第一面积和所述第二面积,确定所述体积危险性评分,包括:根据公式(1)确定体积危险性评分,
(1)
其中,
根据本发明的一个实施例,在公式(1)中,体积危险性评分可通过条件函数的值来表示,该条件函数的条件为
根据本发明的一个实施例,
通过这种方式,可通过第一面积和第二面积之比,来确定该斑块病灶最多占据血管截面的百分比,从而判断该斑块堵塞血管或使血管破裂的风险,进而与高危病灶的标准进行比较,来确定所述体积危险性评分,提升体积危险性评分的准确性,使得体积危险性评分可客观地表示病灶的危险性。
根据本发明的一个实施例,在步骤S105中,危险性较高的斑块富含脂质,在CT血管造影图像中像素值较低,因此,可基于二维病灶区域内的第一像素点的第一像素值来判断斑块的危险性,并且,由于血管壁的像素值相对稳定,因此,为了减少成像视角问题引起的二维病灶区域内的像素值的偏差,可采用二维病灶区域内的第一像素值与血管壁所在区域内的第二像素点的第二像素值之间的对比度来判断病灶的危险性。
根据本发明的一个实施例,步骤S105可包括:确定各个二维病灶区域内的第一像素点的第一像素值的第一平均值;确定各个二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值的第二平均值;根据所述第一平均值和所述第二平均值,确定所述对比度危险性评分。
根据本发明的一个实施例,二维病灶区域内的第一像素点的第一像素值的第一平均值可以是上述二维病灶区域的轮廓范围之内的第一像素点的像素值的平均值。进一步地,可确定血管壁所在区域的轮廓,并确定该轮廓内的第二像素点的第二平均值。
根据本发明的一个实施例,根据所述第一平均值和所述第二平均值,确定所述对比度危险性评分,包括:根据公式(2)确定所述对比度危险性评分
(2)
其中,
根据本发明的一个实施例,在公式(2)中,条件函数可表示,如果第一平均值低于第二平均值,则可表示二维病灶区域的轮廓范围之内的第一像素点的像素值较低,具有一定危险性,可通过
通过这种方式,可通过二维病灶区域内的平均像素值与血管壁所在区域内的平均像素值来对比,消除成像视角问题造成的像素值偏差,获得准确的对比结果,并对各个二维病灶区域的对比结果进行加权平均,可获得对比度危险性评分,可准确且客观地描述三维病灶区域内的像素点的像素值与脉硬化斑块的危险性之间的关系。
根据本发明的一个实施例,如果动脉硬化斑块具备一些特殊形态的轮廓,则可能代表其危险性较高,例如,具有较高危险性的餐巾环征的形态为凹形图形,因此,可判断二维病灶区域的轮廓与凹形图形的餐巾环征的相似性,从而判断该斑块是否具有较高的危险性。
根据本发明的一个实施例,在步骤S106中,可通过二维病灶区域的轮廓确定其形态是否具有凹形图形的特征,从而确定二维病灶区域的轮廓是否具有与餐巾环征的相似性,并且,餐巾环征内的像素点的像素值稍高于像素值最低的钙化斑块的像素点,因此,可基于上述形态的特征和像素值的特征,来判断动脉硬化斑块与餐巾环征的相似性,进而确定其危险性。
根据本发明的一个实施例,步骤S106可包括:获取二维病灶区域的轮廓的最小外接矩形;确定所述最小外接矩形的形心位置;根据最小外接矩形的边长,确定所述最小外接矩形的长度方向和宽度方向;确定所述二维病灶区域的轮廓与所述宽度方向的两个矩形边的交点,其中,两个交点将所述二维病灶区域的轮廓划分为两部分;在所述两个交点之间,确定两部分轮廓的中线,其中,所述中线上的点与两部分轮廓的距离相等;获取二维病灶区域所处的血管截面中,除所述二维病灶区域之外的其他区域中的像素点的最小像素值;根据所述中线、所述中线上的像素点的第一像素值、所述最小像素值和所述形心位置,确定所述形态危险性评分。
图2示例性地示出根据本发明实施例的二维病灶区域的示意图。
根据本发明的一个实施例,在图2中,在二维病灶区域的轮廓外围,可确定对二维病灶区域的轮廓进行框选的最小外接矩形,并确定最小外接矩形的形心,例如,最小外接矩形的对角线交点。
根据本发明的一个实施例,最小外接矩形的长度方向上的边为两条长边,宽度方向上的边为两条短边,可确定二维病灶区域的轮廓与宽度方向的两个矩形边的交点,即,二维病灶区域的轮廓与两条短边的交点,这两个交点可将二维病灶区域的轮廓划分为两部分,可在两个交点之间确定中线,如图2中的虚线所示的中线,该中线上的点与两部分轮廓的距离相等。
根据本发明的一个实施例,可获取二维病灶区域所处的血管截面中,除所述二维病灶区域之外的其他区域中的像素点的最小像素值,例如,在其他区域中包括钙化斑块的像素点,在钙化斑块位置处的像素值最低,即,钙化斑块位置处的像素点具有最小像素值。
根据本发明的一个实施例,根据所述中线、所述中线上的像素点的第一像素值、所述最小像素值和所述形心位置,确定所述形态危险性评分,包括:根据公式(3)确定形态危险性评分
(3)
其中,
根据本发明的一个实施例,在公式(3)中,条件函数的条件为
根据本发明的一个实施例,如果二维病灶区域的轮廓具有凹形图形的特征,则上述中线上的点与形心之间的连线与二维病灶区域的轮廓存在交点,否则,如果二维病灶区域的轮廓不具有凹形图形的特征,则上述形心位于二维病灶区域的轮廓内部,则中线上的点与形心之间的连线与二维病灶区域的轮廓不存在交点。因此,如果二维病灶区域的轮廓具有凹形图形的特征,则条件函数的值为内层条件函数,否则,二维病灶区域的轮廓具有凹形图形的特征,则动脉硬化斑块与餐巾环征不具有相似性,则形态危险性为0。
根据本发明的一个实施例,如果二维病灶区域的轮廓具有凹形图形的特征,则可通过内层条件函数确定中线上的像素点的像素值是否高于钙化斑块位置处的像素点的最小像素值,如果高于最小像素值,则内层条件函数的值为
根据本发明的一个实施例,公式(3)可对每个二维病灶区域的轮廓与餐巾环征之间的相似性进行平均,获得动脉硬化斑块整体与餐巾环征的相似性,从而获得形态危险性评分。
通过这种方式,可通过中线上的像素点与形心的连线与二维病灶区域的轮廓是否有交点来确定二维病灶区域的形状是否具有凹形图形的特征,并可结合中线上的像素点的像素值是否高于钙化斑块位置处的像素点的最小像素值,来共同确定二维病灶区域与餐巾环征之间的相似性,进而获得动脉硬化斑块整体与餐巾环征的相似性,从而通过形态危险性评分准确且客观地确定动脉硬化斑块的危险性。
根据本发明的一个实施例,在步骤S107中,可对以上获得的体积危险性评分、对比度危险性评分和形态危险性评分进行加权求和,获得高危动脉硬化斑块识别评分,从而从多个角度来综合评价动脉硬化斑的危险性。
根据本发明的一个实施例,在步骤S108中,如果高危动脉硬化斑块识别评分大于或等于高危阈值(例如,0.6),则可确定动脉硬化斑块为高危动脉硬化斑块。
根据本发明的实施例的基于人工智能的动脉硬化斑块风险评估的方法,可在识别到CT血管造影图像中动脉硬化斑块所在的区域后,通过该病灶区域的体积、像素值的对比度和形态等多个方面综合评价动脉硬化斑块病灶的危险性,从而为专业人士提供更准确的参考,减少人工判断需要付出的时间和精力,降低误诊的可能性。在确定体积危险性评分时,可通过第一面积和第二面积之比,来确定该斑块病灶最多占据血管截面的百分比,从而判断该斑块堵塞血管或使血管破裂的风险,进而与高危病灶的标准进行比较,来确定所述体积危险性评分,提升体积危险性评分的准确性,使得体积危险性评分可客观地表示病灶的危险性。在确定对比度危险性评分时,可通过二维病灶区域内的平均像素值与血管壁所在区域内的平均像素值来对比,消除成像视角问题造成的像素值偏差,获得准确的对比结果,并对各个二维病灶区域的对比结果进行加权平均,可获得对比度危险性评分,可准确且客观地描述三维病灶区域内的像素点的像素值与脉硬化斑块的危险性之间的关系。在确定形态危险性评分时,可通过中线上的像素点与形心的连线与二维病灶区域的轮廓是否有交点来确定二维病灶区域的形状是否具有凹形图形的特征,并可结合中线上的像素点的像素值是否高于钙化斑块位置处的像素点的最小像素值,来共同确定二维病灶区域与餐巾环征之间的相似性,进而获得动脉硬化斑块整体与餐巾环征的相似性,从而通过形态危险性评分准确且客观地确定动脉硬化斑块的危险性。
图3示例性地示出根据本发明实施例的基于人工智能的动脉硬化斑块风险评估的系统的框图,所述系统包括:
获取模块,用于获取CT血管造影图像;
检测模块,用于通过病灶检测模型,在所述CT血管造影图像中确定动脉硬化斑块所在的三维病灶区域;
分解模块,用于对所述三维病灶区域按照血管轴向进行分解,获得的多个二维病灶区域;
体积危险性评分模块,用于根据所述多个二维病灶区域,以及所述二维病灶区域所处的血管截面,确定体积危险性评分;
对比度危险性评分模块,用于根据所述二维病灶区域内的第一像素点的第一像素值,以及所述二维病灶区域所处的血管截面中的血管壁所在区域内的第二像素点的第二像素值,确定对比度危险性评分;
形态危险性评分模块,用于根据多个二维病灶区域的轮廓,以及所述二维病灶区域的第一像素点的第一像素值,确定形态危险性评分;
高危动脉硬化斑块识别评分模块,用于根据所述体积危险性评分、所述对比度危险性评分和所述形态危险性评分,获得高危动脉硬化斑块识别评分;
确定模块,用于在所述高危动脉硬化斑块识别评分大于或等于高危阈值的情况下,确定动脉硬化斑块为高危动脉硬化斑块。
本领域的技术人员应理解,上述描述及附图中所示的本发明的实施例只作为举例而并不限制本发明。本发明的目的已经完整并有效地实现。本发明的功能及结构原理已在实施例中展示和说明,在没有背离所述原理下,本发明的实施方式可以有任何变形或修改。
