用RAF抑制剂治疗癌症
文献发布时间:2024-04-18 20:00:50
相关申请的交叉引用
本申请要求于2021年4月23日提交的美国专利申请第63/178,922号的权益,其通过引用整体并入于此。
背景技术
RAF激酶在Ras-Raf-MEK-ERK促分裂原激活蛋白激酶(MAPK)途径(也称为MAPK/ERK途径)中通过磷酸化和激活MEK发挥作用,并且转录程序的最终MAPK依赖性激活驱动细胞增殖和存活。MAPK活性的失调经常发生在肿瘤中。因此,靶向RAF激酶活性的疗法被期望用于治疗以异常MAPK/ERK途径信号传导为特征的癌症和其他病症。
发明内容
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物。
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用药物组合物,该药物组合物包含(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物,以及至少一种药学上可接受的赋形剂。
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用:
(a)组合物,该组合物包含(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物;以及
(b)至少一种肿瘤学治疗剂,其选自MEK抑制剂、免疫检查点抑制剂、CDK抑制剂、EGFR激酶抑制剂、EGFR抗体、EGFR PROTAC治疗剂、FGFR抑制剂、SOS1抑制剂、SHP2抑制剂、KRAS抑制剂、紫杉烷、拓扑异构酶抑制剂、ERK抑制剂、基于铂的化疗、亚叶酸、5-氟尿嘧啶或抗VEGF治疗剂。
附图说明
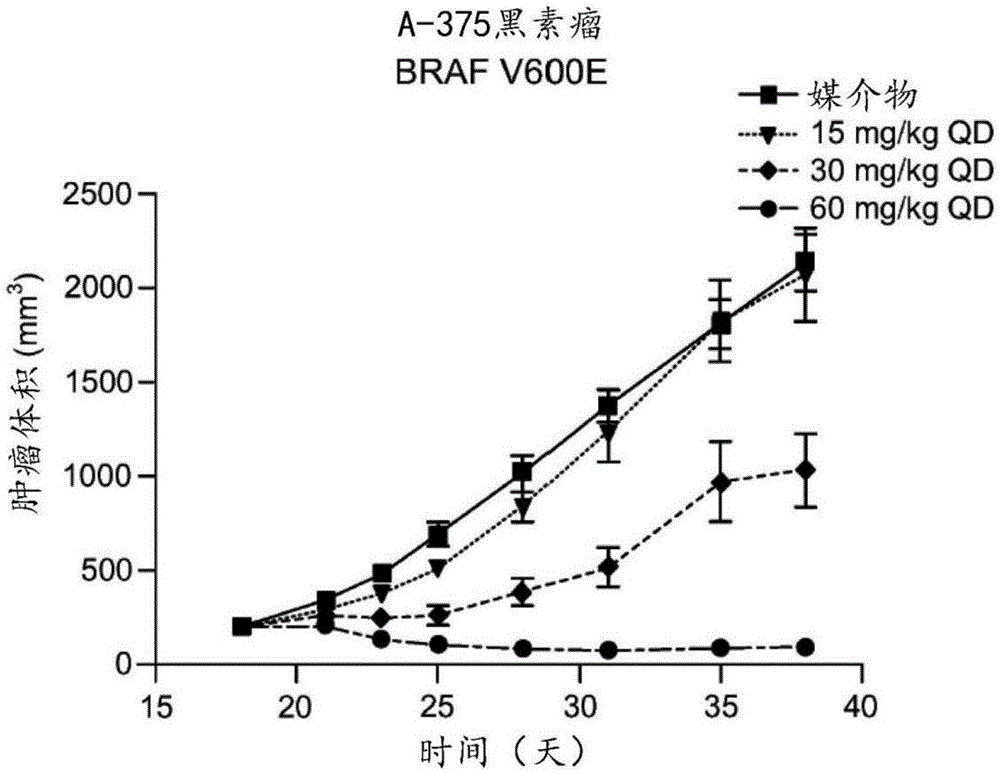
图1A-图1C示出了用化合物1治疗后的A-375(I类BRAF突变型黑素瘤)异种移植肿瘤体积(图1A)、小鼠体重(图1B)和研究结束时异种移植肿瘤体积相对于基线的变化百分比(图1C)。
图2A-图2D示出了用化合物1治疗期间的BxPC-3(II类BRAF突变型PDAC)和WM3629(III类BRAF突变型黑素瘤)异种移植肿瘤体积(图2A,图2C)和小鼠体重(图2B,图2D)。
图3A和图3B分别示出了单独的BxPC-3肿瘤和WM3629肿瘤异种移植反应的瀑布图。
图4A-图4C示出了如实施例3C中所述的WM3629肿瘤异种移植对化合物1和贝美替尼组合疗法的反应。
图5示出了如实施例4中所述的化合物1与贝美替尼组合在NRAS突变型黑素瘤中的细胞活性。
图6示出了如实施例5中所述的化合物1在人SK-MEL-2(NRAS Q61R突变型)黑素瘤异种移植模型中与贝美替尼组合时的抗肿瘤活性。
图7示出了如实施例5中所述的化合物1在人SK-MEL-2(NRAS Q61R突变型)黑素瘤异种移植模型中与贝美替尼组合时的抗肿瘤活性。
图8A-图8C示出了如实施例6中所述的化合物1在WM3629黑素瘤异种移植模型中与贝美替尼组合时的抗肿瘤活性。
图9A-图9C示出了如实施例7中所述的化合物1在NSCLC异种移植模型中的抗肿瘤活性。
援引并入
本说明书中提及的所有出版物、专利和专利申请通过引用并入于此,用于本文所确定的特定目的。
具体实施方式
某些术语
除非上下文另有明确规定,否则如本文和所附权利要求中所用,单数形式“一个(a/an)”、“一种(a/an)”和“所述”包括复数指代。因此,例如提及“一种试剂”包括多个这种试剂,提及“所述细胞”包括提及一种或多种细胞(或者多个细胞)以及本领域技术人员所知的同等含义等。当范围在本文中用于物理特性(例如分子量)或化学特性(例如化学式)时,旨在包括所有范围的组合和子组合以及其中的具体实施方案。在提及数量或数值范围时,术语“约”是指提及的数量或数值范围是在实验可变范围内(或在统计实验误差范围内)的近似值,因此在一些情况下,数量或数值范围将在陈述的数量或数值范围的1%与15%之间变化。术语“包含”(以及相关术语,例如“含有”或“具有”或“包括”等)不旨在排除在其他某些实施方案中,例如,本文所述的物质的任何组合物、组合物、方法或过程等的实施方案,“由所述特征组成”或“基本上由所述特征组成”。
如本说明书和所附权利要求中所用,除非有相反的说明,否则以下术语具有下文指示的含义:
“药学上可接受的盐”同时包括酸加成盐和碱加成盐。本文所述的杂环RAF抑制剂的药学上可接受的盐旨在涵盖任何和所有药学上合适的盐形式。本发明所述化合物的优选药学上可接受的盐是药学上可接受的酸加成盐和药学上可接受的碱加成盐。
“药学上可接受的酸加成盐”是指保留游离碱的生物有效性和特性的那些盐,其不是生物学上或其他方面不期望的,并且其由无机酸形成,无机酸例如盐酸、氢溴酸、硫酸、硝酸、磷酸、氢碘酸、氢氟酸、亚磷酸等。还包括由有机酸形成的盐,有机酸例如脂肪族单羧酸和脂肪族二羧酸、苯基取代的链烷酸、羟基链烷酸、链烷二酸、芳族酸、脂肪族磺酸和芳族磺酸等,并且包括例如乙酸、三氟乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。因此,示例性盐包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、三氟乙酸盐、丙酸盐、辛酸盐、异丁酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、扁桃酸盐、苯甲酸盐、氯代苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、邻苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、苯乙酸盐、柠檬酸盐、乳酸盐、苹果酸盐、酒石酸盐、甲磺酸盐等。还考虑了氨基酸的盐,例如精氨酸盐、葡糖酸盐和半乳糖醛酸盐(参见,例如,BergeS.M.等人,“Pharmaceutical Salts,”Journal of Pharmaceutical Science,66:1-19(1997))。在一些实施方案中,根据技术人员熟悉的方法和技术,通过使游离碱形式与足够量的所需酸接触以产生盐来制备碱性化合物的酸加成盐。
“药学上可接受的碱加成盐”是指保留游离酸的生物有效性和特性的那些盐,其不是生物学上或其他方面不期望的。这些盐通过向游离酸中加入无机碱或有机碱来制备。在一些实施方案中,药学上可接受的碱加成盐由金属或者胺类制备,例如碱金属和碱土金属或者有机胺。衍生自无机碱的盐包括但不限于钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝盐等。衍生自有机碱的盐包括但不限于伯胺、仲胺和叔胺、取代的胺(包括天然存在的取代的胺)、环胺和碱性离子交换树脂的盐,例如,异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、二乙醇胺、2-二甲氨基乙醇、2-二乙氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、N,N-二苄基乙二胺、氯普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、乙二胺、亚乙基二苯胺、N-甲基葡糖胺、葡糖胺、甲基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、N-乙基哌啶、多胺树脂等。参见Berge等人,同上。
“药学上可接受的溶剂化物”是指呈溶剂加成形式的物质的组合物。在一些实施方案中,溶剂化物含有化学计量或非化学计量量的溶剂,并且在制备过程期间由药学上可接受的溶剂(例如水、乙醇等)形成。当溶剂是水时形成水合物,或当溶剂是醇时形成醇化物。本文所述化合物的溶剂化物在本文所述的过程期间方便制备或形成。本文提供的化合物任选地以非溶剂化以及溶剂化形式存在。
术语“对象”或“患者”涵盖哺乳动物。哺乳动物的实例包括但不限于哺乳动物纲的任何成员:人、非人灵长类动物(例如黑猩猩)以及其他猿和猴物种;农场动物,例如牛、马、绵羊、山羊、猪;家畜动物,例如兔、狗和猫;实验动物,包括啮齿动物,例如大鼠、小鼠和豚鼠等。在一方面,哺乳动物是人。
如本文所用,“治疗”或“减轻”或“改善”可互换使用。这些术语是指获得有益或期望结果的方法,包括但不限于治疗性益处和/或预防性益处。“治疗性益处”是指根除或改善所治疗的潜在病症。此外,治疗性益处通过根除或改善与潜在病症相关的生理症状中的一种或多种来实现,使得在患者中观察到改善,尽管患者仍患有该潜在病症。对于预防性益处,在一些实施方案中,将组合物施用至处于发展特定疾病风险中的患者、或报告疾病生理症状中一种或多种的患者,即使尚未对该疾病作出诊断。如本文所用,除非另有说明,否则术语“治疗”是指逆转、减轻、抑制此类术语适用的病症或状况或此类病症或状况的一种或多种症状的进展,或预防此类术语适用的病症或状况或此类病症或状况的一种或多种症状。在一些实施方案中,术语“治疗”包括减缓或延迟该术语适用的疾病或病症的进展。另外,在一些实施方案中,术语“治疗”适用于由该术语适用的疾病或病症引起的并发症中的一种或多种。如本文所用,除非另有说明,否则术语“治疗”是指如上文刚刚定义的“治疗”的治疗行为。
如本文所用,除非另有说明,否则术语“肿瘤”或“癌症”是指赘生性细胞生长,包括癌前和癌细胞和组织。肿瘤通常表现为病变或肿块。如本文所用,“治疗”肿瘤是指疾病的一种或多种症状减少、改善、抑制、置于缓解状态或维持在缓解状态,例如肿瘤本身、肿瘤的血管化或表征疾病的其他参数。“治疗”肿瘤还指通过治疗可以消除、减少或预防肿瘤的一个或多个标志。此类标志的非限制性实例包括基底膜和近端细胞外基质的不受控降解、内皮细胞迁移、分裂和组织成新功能性毛细血管,以及此类功能性毛细血管的持续存在。
术语“难治的”或“疗法难治的”表示患者从未对疗法有反应。
术语“复发”或“疗法后复发”表示患者在最初对先前疗法有反应后,由于获得性抗性和/或不耐受性而患有进行性疾病。
术语“对疗法的抗性”或“对疗法的获得性抗性”表示患者在最初对先前疗法有反应后,由于对疗法的临床或分子抗性而患有进行性疾病。获得性抗性可能由疗法的分子靶标中出现抗性突变或生理功能(例如外排泵)的发展引起。
如本文所用,短语“治疗有效量”是指将引发研究者、兽医、医生或其他人员所寻求的组织、系统、动物或人的生物或医学反应的药物或药剂的量。
本发明的其他方面、优点和特征将通过下文的详细描述变得显而易见。
RAF家族激酶
RAF家族激酶(ARAF、BRAF和RAF1)作用于受体酪氨酸激酶(RTK)的下游,经由MAPK信号传导途径的调节来调控关键细胞功能。在正常细胞中,RTK的外部配体刺激激活RASGTP酶,其促进RAF二聚体形成、原体反式激活和最终驱动细胞增殖和生存的转录程序的MAPK依赖性激活(Zaman等人2019)。RTK-RAS-RAF-MAPK途径的突变激活经常在人类癌症中观察到,并且代表治疗性干预的公认靶(Roberts&Der 2007,Imperial等人2017)。
致癌性BRAF改变发生在所有人类癌症的约4-8%中,并且基于它们独特的结构和信号传导特性在功能上可以分为三类(Davies,2002;Owsley,2020)。I类BRAF V600突变导致活性BRAF单体,其信号不依赖于RAS募集和RAF二聚化/原体反式激活(Yaeger&Corcoran,2019)。II类BRAF突变导致RAS非依赖性BRAF二聚化和原体反式激活。III类BRAF突变损害BRAF激酶活性,但促进其与RAS的缔合。在这种情况下,放大的MAPK信号传导仍依赖于上游RAS激活和与野生型RAF(ARAF或RAF1)的异源二聚化。与很少与其他MAPK途径改变共发生的组成型活性I类和II类BRAF突变相反,经常观察到III类BRAF改变经由RTK调节异常、RAS突变或NF1功能丧失与异常RAS激活相关(Yeager&Corcoran,2019)。
第一代BRAF抑制剂(例如,维罗非尼、达拉菲尼)靶向I类突变,并且作为单一疗法为BRAF V600突变驱动的转移性黑素瘤患者(~50%的客观反应率;5-6个月的中位无进展生存期)以及作为组合疗法方案的一部分为其他癌症类型患者提供了显著的临床益处(Chapman,2011;Hauschild,2012;Subbiah,2020)。然而,目前批准的BRAF抑制剂尚未证明在携带II类和III类BRAF突变的患者中是有效的,II类和III类BRAF突变占BRAF突变的很大比例(例如,在NSCLC中为65%,在黑素瘤患者中为21%;Owsley,2021)。虽然设计为在所有类型的BRAF突变中有效的RAF抑制剂是期望的,但II类和III类BRAF改变的肿瘤对目前FDA批准的疗法具有抗性,并且代表了未满足临床需求的患者群体。
杂环RAF抑制剂
本文所述的杂环RAF抑制剂是指化合物1,其具有以下结构,并且化学名称为(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺。
化合物1是可逆的小分子RAF抑制剂。在整个本公开中,当提及杂环RAF抑制剂或其药学上可接受的盐或溶剂化物时,该提及是指化合物1及其药学上可接受的盐或溶剂化物。
癌症和治疗方法
在一个实施方案中,一种用于抑制RAF酶的方法,该方法包括使所述酶与如本文所公开的化合物1或其药学上可接受的盐或溶剂化物接触。在某些方面,本文公开了一种治疗有需要的个体的癌症的方法,该方法包括向个体施用有效量的本文所述的杂环RAF抑制剂。在某些方面,本文公开了本文所述的杂环RAF抑制剂用于治疗癌症。在某些方面,本文公开了本文所述的杂环RAF抑制剂用于制备治疗癌症的药物。
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物。另一个实施方案提供了方法,其中癌症的特征为具有致癌性BRAF改变。另一个实施方案提供了方法,其中致癌性BRAF改变是I类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是II类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是III类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是BRAF V600突变。另一个实施方案提供了方法,其中BRAF V600突变是V600E或V600K突变。另一个实施方案提供了方法,其中癌症的特征为具有野生型BRAF。另一个实施方案提供了方法,其中癌症是实体瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型肿瘤。另一个实施方案提供了方法,其中癌症选自黑素瘤、胰腺癌、胰腺腺癌、卵巢癌、结肠直肠癌、神经胶质瘤、朗格汉斯细胞组织细胞增多症、白血病、毛细胞白血病、甲状腺癌、未分化甲状腺癌、乳头状甲状腺癌、滤泡性甲状腺癌或甲状腺髓样癌。另一个实施方案提供了方法,其中癌症选自小细胞肺癌、非小细胞肺癌、前列腺癌、胃癌和食道癌。另一个实施方案提供了方法,其中癌症是黑素瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型黑素瘤。另一个实施方案提供了方法,其中癌症是胰腺癌。另一个实施方案提供了方法,其中癌症是胰腺腺癌。另一个实施方案提供了方法,其中癌症是卵巢癌。另一个实施方案提供了方法,其中癌症是结肠直肠癌。另一个实施方案提供了方法,其中癌症是神经胶质瘤。另一个实施方案提供了方法,其中癌症是朗格汉斯细胞组织细胞增多症。另一个实施方案提供了方法,其中癌症是白血病。另一个实施方案提供了方法,其中癌症是毛细胞白血病。另一个实施方案提供了方法,其中癌症是甲状腺癌。另一个实施方案提供了方法,其中癌症是未分化甲状腺癌。另一个实施方案提供了方法,其中癌症是乳头状甲状腺癌。另一个实施方案提供了方法,其中癌症是滤泡性甲状腺癌。另一个实施方案提供了方法,其中癌症是甲状腺髓样癌。另一个实施方案提供了方法,其中癌症是小细胞肺癌。另一个实施方案提供了方法,其中癌症是非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型肺癌。另一个实施方案提供了方法,其中癌症是前列腺癌。另一个实施方案提供了方法,其中癌症是胃癌。另一个实施方案提供了方法,其中癌症是胆管癌。另一个实施方案提供了方法,其中癌症是食道癌。另一个实施方案提供了方法,其中癌症是转移性的。另一个实施方案提供了方法,其中该方法是手术切除后的辅助疗法。另一个实施方案提供了方法,其中患者在先前疗法后复发。另一个实施方案提供了方法,其中患者对先前疗法具有获得性抗性。另一个实施方案提供了方法,其中患者是疗法难治的。另一个实施方案提供了方法,其中(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物口服施用。另一个实施方案提供了方法,其中口服施用每隔一天一次、每天一次、每天两次或每天三次。
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用药物组合物,该药物组合物包含(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物,以及至少一种药学上可接受的赋形剂。另一个实施方案提供了方法,其中癌症的特征为具有致癌性BRAF改变。另一个实施方案提供了方法,其中致癌性BRAF改变是I类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是II类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是III类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是BRAF V600突变。另一个实施方案提供了方法,其中BRAF V600突变是V600E或V600K突变。另一个实施方案提供了方法,其中癌症的特征为具有野生型BRAF。另一个实施方案提供了方法,其中癌症是实体瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型肿瘤。另一个实施方案提供了方法,其中癌症选自黑素瘤、胰腺癌、胰腺腺癌、卵巢癌、结肠直肠癌、神经胶质瘤、朗格汉斯细胞组织细胞增多症、白血病、毛细胞白血病、甲状腺癌、未分化甲状腺癌、乳头状甲状腺癌、滤泡性甲状腺癌或甲状腺髓样癌。另一个实施方案提供了方法,其中癌症选自小细胞肺癌、非小细胞肺癌、前列腺癌、胃癌和食道癌。另一个实施方案提供了方法,其中癌症选自黑素瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型黑素瘤。另一个实施方案提供了方法,其中癌症是胰腺癌。另一个实施方案提供了方法,其中癌症是胰腺腺癌。另一个实施方案提供了方法,其中癌症是卵巢癌。另一个实施方案提供了方法,其中癌症是结肠直肠癌。另一个实施方案提供了方法,其中癌症是神经胶质瘤。另一个实施方案提供了方法,其中癌症是朗格汉斯细胞组织细胞增多症。另一个实施方案提供了方法,其中癌症是白血病。另一个实施方案提供了方法,其中癌症是毛细胞白血病。另一个实施方案提供了方法,其中癌症是甲状腺癌。另一个实施方案提供了方法,其中癌症是未分化甲状腺癌。另一个实施方案提供了方法,其中癌症是乳头状甲状腺癌。另一个实施方案提供了方法,其中癌症是滤泡性甲状腺癌。另一个实施方案提供了方法,其中癌症是甲状腺髓样癌。另一个实施方案提供了方法,其中癌症是小细胞肺癌。另一个实施方案提供了方法,其中癌症是非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型肺癌。另一个实施方案提供了方法,其中癌症是前列腺癌。另一个实施方案提供了方法,其中癌症是胃癌。另一个实施方案提供了方法,其中癌症是胆管癌。另一个实施方案提供了方法,其中癌症是食道癌。另一个实施方案提供了方法,其中癌症是转移性的。另一个实施方案提供了方法,其中该方法是手术切除后的辅助疗法。另一个实施方案提供了方法,其中患者在先前疗法后复发。另一个实施方案提供了方法,其中患者对先前疗法具有获得性抗性。另一个实施方案提供了方法,其中患者是疗法难治的。另一个实施方案提供了方法,其中(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物口服施用。另一个实施方案提供了方法,其中口服施用每隔一天一次、每天一次、每天两次或每天三次。
一个实施方案提供了一种治疗有需要的患者的癌症的方法,该方法包括向患者施用:
(a)组合物,该组合物包含(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物;以及
(b)至少一种肿瘤学治疗剂,其选自MEK抑制剂、免疫检查点抑制剂、CDK抑制剂、EGFR激酶抑制剂、EGFR抗体、EGFR PROTAC治疗剂、FGFR抑制剂、SOS1抑制剂、SHP2抑制剂、KRAS抑制剂、紫杉烷、拓扑异构酶抑制剂、ERK抑制剂、基于铂的化疗、亚叶酸、5-氟尿嘧啶或抗VEGF治疗剂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是MEK抑制剂。另一个实施方案提供了方法,其中MEK抑制剂选自贝美替尼、曲美替尼、考比替尼、司美替尼、匹玛舍替或米达美替尼(mirdametinib)。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是免疫检查点抑制剂。另一个实施方案提供了方法,其中免疫检查点抑制剂是CTLA-4抑制剂、PD-1抑制剂或PD-L1抑制剂。另一个实施方案提供了方法,其中CTLA-4抑制剂是伊匹单抗。另一个实施方案提供了方法,其中PD-1抑制剂是斯巴达珠单抗、纳武单抗、派姆单抗或西米普利单抗。另一个实施方案提供了方法,其中PD-L1抑制剂是阿特珠单抗、阿维单抗或德瓦鲁单抗。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是CDK抑制剂。另一个实施方案提供了方法,其中CDK抑制剂是CDK4/6抑制剂。另一个实施方案提供了方法,其中CDK4/6抑制剂是帕博西尼、阿贝西利或瑞博西尼。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是EGFR激酶抑制剂或抗体。另一个实施方案提供了方法,其中EGFR激酶抑制剂是那扎替尼、吉非替尼、埃罗替尼、阿法替尼、布格替尼、埃克替尼、来那替尼、奥希替尼、达克替尼或拉帕替尼。另一个实施方案提供了方法,其中EGFR抗体是西妥昔单抗、帕尼单抗、扎芦木单抗、尼妥珠单抗或马妥珠单抗。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是SHP2抑制剂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是SOS1抑制剂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是FGFR抑制剂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是KRAS抑制剂。另一个实施方案提供了方法,其中KRAS抑制剂是索托拉西布、阿达格拉西布或BI-1701963。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是紫杉烷。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是拓扑异构酶抑制剂。另一个实施方案提供了方法,其中拓扑异构酶抑制剂是伊立替康、拓扑替康或贝洛替康。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是ERK抑制剂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是基于铂的化疗。另一个实施方案提供了方法,其中基于铂的化疗是奥沙利铂、顺铂或卡铂。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是亚叶酸。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是5-氟尿嘧啶。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂包括亚叶酸和亚叶酸。另一个实施方案提供了方法,该方法还包括施用拓扑异构酶抑制剂或基于铂的化疗或其组合。另一个实施方案提供了方法,其中至少一种肿瘤学治疗剂是抗VEGF治疗剂。另一个实施方案提供了方法,其中抗VEGF治疗剂是贝伐单抗或阿柏西普。另一个实施方案提供了方法,其中癌症的特征为具有致癌性BRAF改变。另一个实施方案提供了方法,其中致癌性BRAF改变是I类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是II类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是III类BRAF突变。另一个实施方案提供了方法,其中致癌性BRAF改变是BRAF V600突变。另一个实施方案提供了方法,其中BRAF V600突变是V600E或V600K突变。另一个实施方案提供了方法,其中癌症的特征为具有野生型BRAF。另一个实施方案提供了方法,其中癌症是实体瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型肿瘤。另一个实施方案提供了方法,其中癌症选自黑素瘤、胰腺癌、胰腺腺癌、卵巢癌、结肠直肠癌、神经胶质瘤、朗格汉斯细胞组织细胞增多症、白血病、毛细胞白血病、甲状腺癌、未分化甲状腺癌、乳头状甲状腺癌、滤泡性甲状腺癌或甲状腺髓样癌。另一个实施方案提供了方法,其中癌症选自小细胞肺癌、非小细胞肺癌、前列腺癌、胃癌和食道癌。另一个实施方案提供了方法,其中癌症选自黑素瘤。另一个实施方案提供了方法,其中癌症是NRAS突变型肿瘤。另一个实施方案提供了方法,其中癌症是胰腺癌。另一个实施方案提供了方法,其中癌症是胰腺腺癌。另一个实施方案提供了方法,其中癌症是卵巢癌。另一个实施方案提供了方法,其中癌症是结肠直肠癌。另一个实施方案提供了方法,其中癌症是神经胶质瘤。另一个实施方案提供了方法,其中癌症是朗格汉斯细胞组织细胞增多症。另一个实施方案提供了方法,其中癌症是白血病。另一个实施方案提供了方法,其中癌症是毛细胞白血病。另一个实施方案提供了方法,其中癌症是甲状腺癌。另一个实施方案提供了方法,其中癌症是未分化甲状腺癌。另一个实施方案提供了方法,其中癌症是乳头状甲状腺癌。另一个实施方案提供了方法,其中癌症是滤泡性甲状腺癌。另一个实施方案提供了方法,其中癌症是甲状腺髓样癌。另一个实施方案提供了方法,其中癌症是小细胞肺癌。另一个实施方案提供了方法,其中癌症是非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型非小细胞肺癌。另一个实施方案提供了方法,其中癌症是NRAS突变型肺癌。另一个实施方案提供了方法,其中癌症是前列腺癌。另一个实施方案提供了方法,其中癌症是胃癌。另一个实施方案提供了方法,其中癌症是胆管癌。另一个实施方案提供了方法,其中癌症是食道癌。另一个实施方案提供了方法,其中癌症是转移性的。另一个实施方案提供了方法,其中该方法是手术切除后的辅助疗法。另一个实施方案提供了方法,其中患者在先前疗法后复发。另一个实施方案提供了方法,其中患者对先前疗法具有获得性抗性。另一个实施方案提供了方法,其中患者是疗法难治的。另一个实施方案提供了方法,其中(S)-N-(3-(2-(((R)-1-羟基丙-2-基)氨基)-6-吗啉代吡啶-4-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺或其药学上可接受的盐或溶剂化物口服施用。另一个实施方案提供了方法,其中口服施用每隔一天一次、每天一次、每天两次或每天三次。
药物组合物
在某些实施方案中,本文所述的杂环RAF抑制剂作为纯化学品施用。在其他实施方案中,本文所述的杂环RAF抑制剂与药学上合适的或可接受的载体(本文也称为药学上合适的或可接受的赋形剂、生理学上合适的或可接受的赋形剂或生理学上合适的或可接受的载体)组合,该载体基于所选择的施用途径和标准药学实践来选择。
本文提供了一种药物组合物,该药物组合物包含如本文所述的杂环RAF抑制剂或其立体异构体、药学上可接受的盐、水合物或溶剂化物,以及一种或多种药学上可接受的载体。如果载体与组合物的其他成分相容并且对组合物的接受者(即,对象或患者)无害,则载体(或赋形剂)是可接受的或合适的。
一个实施方案提供了一种制备药物组合物的方法,该方法包括将如本文所述的杂环RAF抑制剂或其立体异构体、药学上可接受的盐、水合物或溶剂化物与药学上可接受的载体混合。
本文提供了方法,其中药物组合物口服施用。合适的口服剂型包括例如片剂、丸剂、小药囊,或硬明胶或软明胶、甲基纤维素或易于溶解于消化道中的另一合适材料的胶囊。在一些实施方案中,使用合适的无毒固体载体,包括例如药品级甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁等。(参见,例如,Remington:TheScience and Practice of Pharmacy(Gennaro,第21版,Mack Pub.Co.,Easton,PA(2005))。
本文提供了方法,其中药物组合物通过注射施用。在一些实施方案中,如本文所述的杂环RAF抑制剂或其药学上可接受的盐或溶剂化物经配制用于通过注射施用。在一些情况下,注射制剂是水性制剂。在一些情况下,注射制剂是非水性制剂。在一些情况下,注射制剂是基于油的制剂,例如芝麻油等。
包含如本文所述的杂环RAF抑制剂或其立体异构体、药学上可接受的盐、水合物或溶剂化物的组合物的剂量根据对象或患者(例如,人)的状况而不同。在一些实施方案中,此类因素包括一般健康状态、年龄和其他因素。药物组合物以适于待治疗(或预防)的疾病的方式施用。适当的剂量以及合适的施用持续时间和频率将由例如患者的状况、患者疾病的类型和严重程度、活性成分的具体形式和施用方法等因素确定。通常,适当的剂量和治疗方案以足以提供治疗性益处和/或预防性益处(例如,改善的临床结果,例如更频繁的完全或部分缓解,或更长的无疾病期和/或总生存期,或减轻症状严重程度)的量提供组合物。最佳剂量通常使用实验模型和/或临床试验来确定。最佳剂量取决于患者的身体质量、体重或血量。
实施例
提供这些实施例仅用于说明性目的,而不限制本文提供的权利要求的范围。
实施例1:化合物1的RAF抑制活性
方法
化合物1对BRAF和RAF1(CRAF)激酶的抑制分别在BRAF和CRAF的17和18次独立实验中通过ADP-Glo测定来测量,如表1所示。在测定中,ATP在底物存在下通过测试激酶转化为ADP。然后测定试剂将剩余ADP转化为ATP,并产生与相对激酶活性成比例的荧光素酶反应和发光读数。将化合物1在DMSO中稀释,用于两种测定的10点、3倍剂量曲线。测试1μM高剂量和0.05nM低剂量。最终浓度为6nM的BRAF(CarnaBio,货号09-122)或3nM的RAF1(CarnaBio,货号09-125)和30nM的MEK1底物(Millipore,货号14-420)与3μM ATP、10mM MgCl
表1
Reaction Biology(Malvern,PA)激酶筛选服务使用放射性
表2
用Caliper LabChip3000测定(Caliper Life Science,Hopkinton,MA)针对CarnaBiosciences(Kobe,Japan)的299个激酶的Carna Biosciences激酶谱中的人激酶组在1μMATP(如果可用)下测试化合物1,Caliper LabChip3000测定是一种结合微流体环境中毛细管电泳的基本原理的迁移率变动测定(Perrin等人2010)。用试剂盒缓冲液(20mM HEPES、0.01% Triton X-100、5mM DTT,pH 7.5)制备4x底物/ATP/金属溶液,并用测定缓冲液(20mM HEPES、0.01% Triton X-100、1mM DTT,pH 7.5)制备2x激酶溶液。将5μL的4x化合物溶液、5mL的4x底物/ATP/金属溶液和10mL的2x激酶溶液混合,并在室温下在聚丙烯384孔微孔板的孔中孵育1或5小时*。(*取决于激酶)。将70mL终止缓冲液(QuickScout ScreeningAssist MSA;Carna Biosciences)加入孔中。将反应混合物施加至LabChip
表3
结论
使用一系列生物化学测定来确定化合物1的生物化学效力和激酶选择性。化合物1对迅速加快的纤维肉瘤(Rapidly Accelerated Fibrosarcoma,RAF)激酶的抑制效力在二磷酸腺苷(ADP)-Glo筛选测定以及放射性激酶测定中进行了描绘。化合物1被证明是RAF1、BRAF、ARAF激酶的有效抑制剂,IC
实施例2:化合物1在细胞培养物中抑制细胞增殖
化合物1是RAF激酶的选择性和有效抑制剂,设计为靶向II类和III类BRAF突变以及I类BRAF突变。在此,我们评估了化合物1在代表以下四类BRAF突变状态的多种细胞模型中的体外药效学生物标志物活性:I类(A-375)、II类(BxPC-3、OV-90、NCI-H2405)、III类(WM3629和CAL12-T)和野生型(MIA PaCa-2、CHL、NCI-H358)。
方法
将A-375、BxPC-3、OV-90、NCI-H2405、CAL-12T、MIA PaCa-2、NCI-H358和CHL-1细胞以8000个细胞/孔接种在384孔板中的24μl生长培养基中,并使其在37℃、5% CO
如表4A中所示,在治疗1小时后,化合物1在BRAF突变型和野生型模型上表现出一系列细胞活性,如通过pERK生物标志物药效学调节所确定的。在携带III类BRAF改变的肿瘤细胞模型WM3629和CAL-12T中,化合物1的平均EC
表4A
表4B
ATC:未分化甲状腺癌;PTC:乳头状甲状腺癌;NSCLC:非小细胞肺癌
结论
总之,化合物1在BRAF突变型和野生型模型上表现出一系列细胞活性,如通过pERK生物标志物调节所确定的。当用化合物1治疗时,II类和III类突变型模型表现出最有效的细胞反应,而野生型BRAF模型反应最少。
实施例3:异种移植模型中抗增殖活性的确定
方法
如结果部分所示,当平均肿瘤体积达到200-335mm
A.化合物1在I类BRAF突变型人类癌症中的抗肿瘤活性的评估
首先在具有I类BRAF V600E突变的人A-375黑素瘤异种移植模型中评估化合物1的抗肿瘤活性。当肿瘤体积达到约200mm
表5
在携带突变型A-375BRAF I类黑素瘤肿瘤的小鼠中,在最后一次给药后24小时内口服给药时,化合物1治疗导致11,900-156,000h*ng/mL的全身血浆暴露(AUC最后)。相对于对照(媒介物治疗)肿瘤,用化合物1治疗观察到异种移植肿瘤生长的剂量依赖性抑制(图1A)。所有测试剂量耐受均良好,在用60mg/kg治疗的动物中观察到一些体重减轻(平均体重减轻5.6%;图1B)。60mg/kg群组的一只动物在治疗过程期间体重减轻>10%,但在研究结束时恢复了。
单独肿瘤反应的瀑布图(定义为肿瘤体积从基线开始的变化)示于图1C中。用30mg/kg和60mg/kg日剂量实现的平均TGI分别为57%和106%(p≤0.0001;图1C),后一组的9只动物中有8只(89%)表现出肿瘤消退。最低测试剂量15mg/kg不导致显著的TGI。
B.化合物1在II/III类BRAF突变型人类癌症中的抗肿瘤活性的评估
接下来在表现出II/III类BRAF突变的人异种移植模型中评估化合物1的抗肿瘤活性。将具有II类BRAF插入-缺失(indel;V487_P492delinsA)和III类BRAF D594G突变的BxPC-3胰腺癌和WM3629黑素瘤细胞系衍生的异种移植物分别用每天总共3-20mg/kg的化合物1(硫酸盐形式)治疗2周。当肿瘤体积为~240-280mm
表6
在携带突变型BRAF II类BxPC-3胰腺和III类WM3629黑素瘤异种移植物的小鼠中,在最后一次给药后24小时内BID或QD口服给药时,化合物1治疗分别导致4,030-42,100h*ng/mL和5,200-53,700h*ng/mL的全身血浆暴露(AUC
单独的BxPC-3肿瘤和WM3629肿瘤异种移植反应的瀑布图分别示于图3A和图3B中。在每天高达10mg/kg总化合物1的所有测试剂量下实现了BxPC-3肿瘤生长的统计学上显著减少(51-88%抑制;p≤0.0001;图3A)。另外,在20mg/kg QD和3-10mg/kg BID治疗组的动物中观察到肿瘤消退(在20mg/kg QD和10mg/kg BID下分别为109%和118% TGI;p≤0.0001)。类似地,在WM3629模型中用所有测试剂量和时间表观察TGI(47-101%抑制;p≤0.04-0.0001);在最高日剂量下观察到一些消退情况(图3B)。与BxPC-3模型一致,当BID施用时,在较低剂量(5mg/kg)下在一只动物中也实现了消退。
C.化合物1与MEK抑制的组合在III类BRAF突变型人类癌症中的抗肿瘤活性的评估
在人WM3629(III类BRAF突变型)黑素瘤异种移植模型中评估化合物1与贝美替尼组合时的抗肿瘤活性,贝美替尼是一种MEK抑制剂,批准用于与康奈非尼组合治疗具有BRAFV600E/K突变的晚期黑素瘤。当肿瘤体积达到约335mm
表7
在测试剂量下,用化合物1和/或贝美替尼治疗分别实现了31,100-123,000hr*ng/mL和11,000-26,700hr*ng/mL范围的全身血浆暴露(AUC
结论
化合物1在BRAF突变型人类癌症的无胸腺裸鼠异种移植模型中在每天高达60mg/kg的剂量下耐受良好并且有效。每天用化合物1治疗观察到A-375(BRAF I类突变)、BxPC-3(BRAF II类突变)或WM3629(BRAF III类突变)异种移植肿瘤生长的剂量依赖性抑制。与每天一次给药化合物1相比,每天两次观察到更强的肿瘤反应趋势,然而,两种给药方案在相等的总日剂量下导致类似的肿瘤生长抑制(TGI)和消退(平均TGI高达101-118%;p≤0.0001)。化合物1在与MEK抑制剂组合时也是耐受良好并且有效的,导致WM3629异种移植肿瘤消退(平均TGI 101-106%;p≤0.0001)。这些数据表明化合物1作为单一药剂具有有效的抗肿瘤活性,并且还可以安全地与其他靶向疗法组合,用于治疗BRAF驱动的癌症。
实施例4:化合物1与贝美替尼的组合在NRAS突变型黑素瘤中的细胞活性的评估
目的:评估化合物1与促分裂原激活蛋白激酶(MEK)抑制剂贝美替尼的组合的细胞效力和活性,化合物1是迅速加快的纤维肉瘤(RAF)激酶的选择性和有效抑制剂。
方法:在7天生长测定中,在人成神经细胞瘤大鼠肉瘤病毒癌基因同系物(NRAS)突变型黑素瘤细胞中评估RAF抑制剂化合物1和贝美替尼的组合活性。SK-MEL-2人黑素瘤细胞获自美国菌种保藏中心,并保持在DMEM+10% FBS+1%青霉素/链霉素中。将所有细胞保持在37℃、5%二氧化碳(CO
表8
使用多种可用的协同作用模型评估SK-MEL-2细胞中化合物1和贝美替尼之间的潜在协同作用。组合的多维协同作用(MuSyC)模型考虑了在其模型中的效力(α)和功效(β)两者;评分>0表示在所示参数中两种药物之间具有协同作用。评估最高单一药剂(HSA)、Bliss和Loewe协同作用模型,并利用其找到最大协同区域评分,其中评分>10表示两种药物之间的相互作用可能是协同的。使用多种协同作用模型分析7天生长测定的结果,参见表9。MuSyC模型产生的β评分为0.44和α评分为10.61,这表明在SK-MEL-2研究中具有协同组合功效和协同效力。HSA、Bliss和Loewe模型计算的最大协同区域评分分别对应于21.6、16.2和11.6,这表明表9中所示范围内的协同作用。总之,这项细胞研究和随后的协同作用分析证明了在SK-MEL-2人NRAS突变型黑素瘤细胞系中化合物1和贝美替尼具有协同组合益处。
表9
结果总结:化合物1表现出对NRAS突变型人黑素瘤肿瘤细胞模型的有效抑制,如通过在7天生长测定中对细胞增殖的抑制所证明的。化合物1生长抑制效力通过与MEK抑制剂贝美替尼组合而增强,如通过随着贝美替尼剂量的增加半数最大有效浓度(EC50)值降低所证明的。
实施例5:化合物1与MEK抑制的组合在NRAS突变型人黑素瘤中的抗肿瘤活性的评估
在人SK-MEL-2(NRAS Q61R突变型)黑素瘤异种移植模型中评估化合物1与贝美替尼组合时的抗肿瘤活性。当肿瘤体积达到约307mm
表10
在测试剂量下,用化合物1和/或贝美替尼治疗分别实现了29,900-96,100hr*ng/mL和7,500-10,100hr*ng/mL的全身血浆暴露(AUC
实施例6:化合物1与贝美替尼的组合在NRAS突变型、BRAF突变型黑素瘤异种移植模型中的抗肿瘤活性的评估
目的:在成神经细胞瘤大鼠肉瘤病毒癌基因同系物(NRAS)突变型和迅速加快的纤维肉瘤激酶同系物B(BRAF)突变型人癌细胞系衍生异种移植模型中评估化合物1和促分裂原激活蛋白激酶激酶(MEK)抑制剂贝美替尼的耐受性和抗肿瘤活性,化合物1是迅速加快的纤维肉瘤(RAF)激酶的选择性和有效抑制剂。
方法:在无胸腺BALB/c裸鼠右胁腹皮下接种1×10
当平均TV达到约300mm
表11
在小鼠右胁腹皮下接种在0.1mL 1∶1培养基/基底膜基质(Matrigel)中的1×10
使用以下等式计算TGI:
%T/C=100%×(TV
%TGI=(1-T/C)×100%
其中“TV
如果动物表现出明显的严重痛苦和/或疼痛体征,身体质量显著损失(体重损失>20%),不能获得足够的食物或水,或者观察到处于持续恶化的状态,或如果肿瘤大小超过2,500mm
结果:在人WM3629(NRAS突变型、III类BRAF突变型)黑素瘤异种移植模型中评估化合物1与贝美替尼组合时的抗肿瘤活性。当TV达到约300mm
观察对化合物1单一疗法的剂量依赖性反应(图8A和8C)。1.5mg/kg BID和3mg/kgBID化合物1的平均TGI分别为66%和79%(表13)。用贝美替尼(3mg/kg BID)作为单一药剂治疗导致37%的平均TGI(图8A和8C;表13)。向贝美替尼中加入化合物1导致异种移植物生长抑制得到改善:3mg/kg贝美替尼/1.5mg/kg化合物1BID和3mg/kg贝美替尼/3mg/kg化合物1BID为90%和96% TGI;图8A和8C;表13。
在所有治疗后,TGI在统计学上显著大于媒介物治疗的动物(对于贝美替尼单一疗法,p=0.0041;对于所有其他治疗,p<0.0001;表12),并且用化合物1和贝美替尼组合治疗后的TGI显著大于用贝美替尼单一疗法观察到的TGI(对于组合疗法的两个剂量水平,p<0.0001)。重要的是,用化合物1和贝美替尼治疗耐受良好,在3mg/kg贝美替尼/1.5mg/kg化合物1BID剂量水平下仅两只动物表现出≥10%的体重损失,而在3mg/kg贝美替尼/3mg/kg化合物1BID剂量水平下无动物表现出≥10%的体重损失,参见图8B。
表12
ANOVA=方差分析;BID=每天两次;BRAF=迅速加快的纤维肉瘤同系物B;C=对照;MEK=促分裂原激活蛋白激酶激酶;RM=重复测量;SEM=平均值的标准误差;T=经治疗的;TGI=肿瘤生长抑制;TV=肿瘤体积
a
b
c
d
结果总结:当在NRAS突变型和BRAF突变型黑素瘤异种移植模型WM3629中BID口服给药14天时,低剂量化合物1(1.5或3mg/kg BID)作为单一疗法或与MEK抑制剂贝美替尼(3mg/kg BID)组合是耐受良好并且有效的。低剂量化合物1单一疗法导致中度肿瘤生长抑制(TGI;平均66-79%),而化合物1与贝美替尼的组合与单独的贝美替尼(平均TGI 37%)相比导致显著增强的TGI(平均90-96%;p<0.0001)。这些数据表明化合物1可以安全有效地与MEK抑制剂疗法组合,在NRAS突变型黑素瘤中用于组合抗肿瘤益处。
结论:用化合物1和贝美替尼(MEK抑制剂)的组合治疗耐受良好,并且在NRAS突变型、III类BRAF突变型黑素瘤异种移植模型WM3629中导致显著的肿瘤抑制(3/1.5mg/kg BID和3/3mg/kg BID贝美替尼/化合物1的平均TGI分别为90%和96%)。化合物1/贝美替尼组合治疗的肿瘤抑制显著大于贝美替尼单一疗法(p<0.0001)。这项研究证明了在携带NRAS突变的人黑素瘤模型中,将MEK抑制剂加入化合物1疗法中具有抗肿瘤组合益处。
实施例7:化合物1在BRAF突变型NSCLC异种移植模型中的抗肿瘤活性的评估
目的:在RAF激酶同系物B(BRAF)突变型人非小细胞肺癌(NSCLC)细胞系衍生异种移植模型中评估化合物1的耐受性和抗肿瘤活性,化合物1是迅速加快的纤维肉瘤(RAF)激酶的选择性和有效抑制剂。
方法:在无胸腺小鼠右胁腹皮下接种1×10
当平均TV达到约300mm
表13
在小鼠右胁腹皮下接种在0.1mL 1∶1培养基/基底膜基质中的1×10
使用以下等式计算TGI:
%T/C=100%×(TV
%TGI=(1-T/C)×100%
其中“TV
如果动物表现出明显的严重痛苦和/或疼痛体征,身体质量显著损失(体重损失>20%),不能获得足够的食物或水,或者观察到处于持续恶化的状态,或如果肿瘤大小超过2,500mm
结果:在人NCI-H2405(II类BRAF突变型)NSCLC异种移植模型中评估化合物1的抗肿瘤活性。当TV达到约300mm
观察剂量依赖性暴露和对化合物1治疗的抗肿瘤反应。在测试剂量下,实现了2878-50799hr*ng/mL范围的AUC
表14
ANOVA=方差分析;C=对照;RM=重复测量;SEM=平均值的标准误差;T=经治疗的;TGI=肿瘤生长抑制;TV=肿瘤体积
a
b
c
d
结果总结:当在BRAF突变型NSCLC异种移植模型NCI-H2405中口服给药21天时,化合物1(1.5至15mg/kg BID)是耐受良好并且有效的。每天两次(BID)化合物1治疗观察到剂量依赖性肿瘤生长抑制(TGI),低剂量化合物1(1.5-3.0mg/kg BID)导致中度TGI(平均42-58%),而较高剂量化合物1(10-15mg/kg BID)导致强TGI(平均85-107%)。所有化合物1治疗组中的TGI与媒介物治疗的动物在统计学上显著不同(p<0.0001)。这些数据表明化合物1可以安全有效地在BRAF突变型NSCLC中用于有效抗肿瘤益处。
实施例8:化合物1在人类临床试验中的用途
标题:研究化合物1在患有BRAF和/或NRAS突变阳性实体瘤的参与者中的安全性、耐受性、药代动力学和抗肿瘤活性的1/1b期开放标签、多中心研究
研究阶段:1/1b期
适应症:BRAF突变阳性实体瘤和/或NRAS突变阳性实体瘤
介绍:这是对患有迅速加快的纤维肉瘤同系物B(BRAF)突变阳性和/或成神经细胞瘤RAS(NRAS)突变阳性肿瘤的参与者进行的一项2部分、开放标签、多中心、剂量递增和剂量扩展研究,其设计为评估化合物1(一种泛迅速加快的纤维肉瘤(RAF)小分子激酶抑制剂)的安全性、耐受性和药代动力学(PK);确定化合物1用于进一步临床开发的推荐2期剂量(RP2D);以及评估对化合物1单独疗法和与贝美替尼(一种促分裂原激活蛋白激酶(MEK)抑制剂)组合疗法的客观反应。
研究目的
A部分:本研究的A部分剂量递增化合物1单一疗法组分(下文称为A1部分)的主要目的是确定口服施用化合物1的安全性和耐受性,包括在患有BRAF突变阳性晚期或转移性实体瘤或具有NRAS突变的黑素瘤的参与者中的剂量限制性毒性(DLT),并鉴定最大耐受剂量(MTD)和/或用于B部分剂量扩展中的进一步临床研究的适当剂量。次要目的包括表征PK特性和食物对化合物1的PK的效应。本研究的A部分剂量递增:化合物1+贝美替尼组合组分(下文称为A2部分)的主要目的是确定口服施用化合物1+贝美替尼的安全性和耐受性,包括在患有BRAF II类或III类突变阳性晚期或转移性实体瘤或具有NRAS突变的黑素瘤的参与者中的DLT,并鉴定MTD和/或用于进一步临床研究的适当剂量。次要目的包括表征化合物1和贝美替尼组合的PK特性。
B部分:本研究的B部分剂量扩展部分的主要目的是评估化合物1在患有具有II类或III类BRAF基因组改变的晚期或转移性实体癌的参与者中的抗癌活性的初步证据。次要目的包括进一步评估化合物1在RP2D下的安全性、耐受性和PK。
研究设计
本研究将分为2部分进行。A部分包含2个组分:1)剂量递增:化合物1单一疗法(A1部分);以及2)剂量递增:化合物1+贝美替尼组合(A2部分)。B部分剂量扩展将评估化合物1在患有晚期或转移性实体癌的参与者中的抗癌活性的初步证据。
A部分(剂量递增)
在A部分中,患有具有任何BRAF I类、II类或III类突变和/或NRAS突变阳性黑素瘤的实体瘤的参与者将被纳入研究,前提是满足所有方案定义的资格要求。持续监测参与本研究A部分的患有BRAF I类突变肿瘤的参与者数量。
A1部分将评估化合物1在患有BRAF突变阳性晚期或转移性实体瘤和/或具有NRAS突变的黑素瘤的参与者中的安全性、耐受性、PK和药效学(PD)。该组分将结合加速滴定设计(单个参与者剂量水平),随后结合传统的3+3剂量递增方案,以鉴定化合物1的MTD和/或RP2D。MTD定义为在28天DLT评估期期间<33%的参与者经历DLT时的最大日口服剂量。在28天治疗周期中,化合物1将以每天两次(BID)口服剂量施用,持续28天。
起始剂量,剂量水平1(DL1),将是每天50mg(以25mg BID施用),并且剂量递增增量将遵循改良的斐波纳契数列。计划的化合物1剂量水平在方案中指出。
将采用加速滴定剂量递增设计原则,其中将评估每个群组的1名参与者,直至观察到生物学活性证据,此时该群组将扩展2名参与者。该群组和所有随后的剂量水平群组将使用3+3剂量递增设计继续进行。出于上述讨论的目的,“生物活性证据”定义为(1)DLT或(2)至少1例不明确归因于基础疾病或无关病因的≥2级不良事件(AE)(不包括研究者认为无临床意义的2级实验室研究AE)。
从DL3开始,化合物1的剂量将使用传统的3+3研究设计递增,继续直至满足停止规则或直至实现预期最大药理学活性(由PK和PD生物标志物获知)的MTD或剂量。采用这种3+3设计,从DL3开始,每个剂量水平至少有3名参与者参与。如果一个剂量水平的3名参与者在DLT期(对于所有剂量水平,从化合物1的第一次给药开始28天)内都未经历DLT,则另外3名参与者将在下一更高剂量水平下接收治疗。如果在第1周期中有2名或更多处于给定剂量水平的参与者出现DLT,则不会有其他参与者在该剂量水平下接受治疗。
对于以指定剂量水平接受化合物1的前2名参与者,在第一名和第二名参与者中化合物1的第一次剂量之间将存在至少24小时。继续剂量递增,直至确定最高计划剂量水平是安全和可耐受的,在该剂量水平(即被认为是RP2D的剂量水平)下至少有6名DLT可评估的参与者,或直至达到MTD。估计MTD和/或RP2D将需要多达约26名参与者。
由研究者和申办者代表组成的剂量审查委员会(DRC)将在下一剂量水平开始参与之前审查所有可用的安全性、PK和PD数据。在特定剂量水平下参与者完成至少1个完整周期后,DRC将审查化合物1单一疗法每个剂量水平的安全性和耐受性。继续A部分,直至满足停止规则或直至达到预期最大药理学活性(例如,RP2D)的MTD或剂量。DRC还将评估所有可用的安全性数据和PK/PD数据,以确定B部分的RP2D。
如果正在接受化合物1单一疗法的参与者在治疗时出现疾病进展,则可基于参与者对组合治疗的资格、化合物1疗法的经历、反应的特征或其他相关考虑给予参与者接受化合物1+贝美替尼组合的选项。该决定由研究者判断,但应与申办者协商。
在单一疗法剂量递增群组中,只有满足机制初步证明(PPOM)临床标准才会开始A2部分。资格将限于患有II/III类BRAF和/或NRAS突变肿瘤的参与者。用化合物1和贝美替尼(贝美替尼以45mg剂量BID口服[PO])开始平行递增。根据DRC的判断,组合中化合物1的起始剂量(指定的组合剂量水平1)将比已经满足PPOM标准的剂量水平低1个剂量水平或比认为安全的最高剂量水平低1个剂量水平。剂量递增将遵循方案中所述的3+3设计。在患有II/III类BRAF和NRAS突变肿瘤的参与者中,化合物1和贝美替尼将在28天治疗周期中以每天BID的口服剂量一起施用。
在每个给药群组结束时,DRC将负责确定是否已满足PPOM标准,并建议是否应开始组合剂量递增。一旦开始组合剂量递增,具体的化合物1剂量将根据改良的斐波纳契设计增加,并且在实践中可以选择中间剂量。
在A1部分中,根据研究者的判断和与申办者协商后,允许进行内部参与者(intra-participant)剂量递增和回填。只有当参与者满足所有方案规定的标准,才可考虑内部参与者剂量递增。
在A1部分期间,在DL3、DL4和DL5下的参与者中,使用随机交叉设计在至少6名参与者中评估食物对化合物1的PK的效应。
B部分(剂量扩展)
一旦在A部分中确定了化合物1单一疗法组的MTD和/或生物学活性剂量(即RP2D),则可以开始研究的剂量扩展部分(B部分)。B部分将在以下群组中评估化合物1在A部分确定的RP2D下的抗肿瘤活性:
·第1组:患有具有任何BRAF II类或III类突变的不可切除的局部晚期(美国癌症联合委员会[AJCC]III期)或转移性(AJCC IV期)非小细胞肺癌(NSCLC)的参与者
·第2组:患有具有任何BRAF II类或III类突变的不可切除的局部晚期(AJCC III期)或转移性(AJCC IV期)黑素瘤的参与者
·第3组:患有具有任何BRAF II类或III类突变的任何不可切除的局部晚期(AJCCIII期,或与其他分期体系类似的阶段)或转移性(AJCC IV期)实体瘤(除了NSCLC或黑素瘤之外)的参与者剂量扩展群组参与者的参与将同时发生。
在第3组中,将在本研究过程期间监测患有具有BRAF II类或III类突变的各种肿瘤类型的参与者的参与;可限制特定肿瘤类型的参与,以确保该群组中各种实体瘤的广泛代表性。
研究终点
主要的
安全性终点包括:
·DLT的发生率
·AE的发生率,包括治疗突发的不良事件和治疗相关的AE
·生命体征、身体检查、心电图和临床实验室测试的临床显著变化
功效(如研究者评估的)将通过以下进行测量:
·客观反应率,如研究者评估的,根据实体瘤疗效评价标准(RECIST)v1.1定义为部分反应加完全反应的比率。
·疾病控制率
·总反应的持续时间
·疾病稳定的持续时间
次要的
·化合物1和化合物1+贝美替尼的药代动力学参数,包括但不限于观察到的最大血浆浓度(Cmax)、实现Cmax的时间(tmax),以及血浆浓度-时间曲线下的面积(AUC),包括进食和禁食状态。
探索性
·化合物1和化合物1+贝美替尼暴露/安全性和暴露/功效关系
·化合物1在血浆和尿中的潜在代谢物的表征
·无进展生存期和总生存期
·通过血液和/或肿瘤样品的生物化学和/或遗传分析的生物标志物定量,包括但不限于对磷酸化细胞外信号调节激酶(ERK)、DUSP6核糖核酸(RNA)和增生标志物Ki-67的药效学作用。
·循环肿瘤来源(血液)核酸(ctDNA)浓度和突变谱的变化
·通过血液和/或肿瘤样品的生物化学和/或遗传分析的潜在生物标志物
·群体PK分析
样品大小
计划约155名参与者参与这项研究。
A部分(剂量递增):
在A1部分中,多达41名参与者将参与单一疗法剂量递增期。约26名参与者可参与估计MTD和/或RP2D,从中评估6名参与者对化合物1的PK的食物效应。
对于A2部分,多达36名参与者将参与组合剂量递增期。可能需要约24名参与者来估计化合物1+贝美替尼组合的MTD。
对于A1部分和A2部分的回填,约30名另外的参与者可参与。
B部分(剂量扩展):
约75名参与者将参与B部分,包括3个具有BRAF II类或III类突变的参与者群组,包括患有NSCLC、黑素瘤和其他实体瘤的参与者。对于第1组和第2组,计划Simon 2阶段优化设计。十二名参与者将参与第一阶段。如果≥3名参与者有反应,则将进入第2阶段,再招募13名参与者,群组中总样品大小为25。在第2阶段结束时,如果25名参与者中有≥8人有反应,则化合物1将被认为有希望用于进一步评估。在每个群组中,该设计的有效性为80%,最大1型错误率为0.1,以测试反应率为≤20%的零假设与≥40%的备择假设。对于第1阶段的无效评估,反应可能不要求确认。根据DRC和申办者的判断,还可包括反应率之外的其他考虑。
关键纳入和排除标准
关键纳入标准包括:
组织学或细胞学确诊为转移性或晚期恶性肿瘤的成年参与者(≥18岁)将有资格参与这项研究。A部分(剂量递增)将招募患有任何类型的晚期或转移性实体瘤的参与者。B部分(剂量扩展)将招募患有不可切除的局部晚期(AJCC III期)或转移性(AJCC IV期)NSCLC、不可切除的局部晚期(AJCC III期)或转移性(AJCC IV期)黑素瘤或除了NSCLC或黑素瘤之外的任何不可切除的局部晚期(AJCC III期,或与其他分期体系类似的阶段)或转移性(AJCC IV期)实体瘤的参与者。此外,按照纳入标准中的规定,需要BRAF和/或NRAS的遗传异常。参与者必须接受过适合其肿瘤类型和疾病阶段的先前标准疗法,或根据研究者的意见,不太可能耐受或从适当的护理标准疗法获得临床上有意义的益处。在A1部分中,患有由BRAF I类突变驱动的特定癌症(NSCLC、黑素瘤、结肠直肠癌[CRC]和未分化甲状腺癌)的参与者应先前接受过经批准的BRAF抑制剂(如果经授权且可用,则联合或不联合经批准的MEK抑制剂)。
参与者的肿瘤必须具有BRAF突变或是具有NRAS突变的黑素瘤,该NRAS突变通过先前在经临床实验室改进修正案(CLIA)认证的实验室(在美国[US])或根据当地监管要求(在其他国家)进行的肿瘤组织或ctDNA的基因组分析来鉴定。参与者将提供在过去5年内获得的存档的肿瘤组织标本(福尔马林固定石蜡包埋[FFPE]标本)(如果可用),并且如果医学上可行,将进行强制性治疗前肿瘤活检。方案中包括纳入/排除标准的完整列表。
关键排除标准包括:
具有已知的来自非脑肿瘤的活动性脑转移的参与者不符合资格。A部分中患有由BRAF I类突变驱动的其他实体瘤(除了NSCLC、黑素瘤、CRC和未分化甲状腺癌之外)的参与者可能先前未用任何经批准或正在开发的小分子BRAF-、MEK-或促分裂原激活蛋白激酶(MAPK)-指导的抑制剂疗法治疗。在DRC作出并传送这样做的决定之前,将不会实施该标准。在B部分中,排除先前用任何经批准或正在开发的小分子BRAF-、MEK-或MAPK-指导的抑制剂疗法的治疗。参与者可能不具有来自先前抗肿瘤疗法的任何未解决的毒性。参与者可能不具有来自先前抗肿瘤疗法的任何未解决的毒性。方案中详述了排除性伴随用药、避孕要求以及将参与者排除在研究之外的疾病和其他病况。
治疗持续时间参与者将在28天周期内接受化合物1或化合物1+贝美替尼,直至有疾病进展、不可接受的毒性、对研究药物的不耐受性、癌症新全身疗法的开始、撤回同意、研究者决定、申办者决定或死亡的证据。
将按剂量、剂量时间表和时间(视情况而定)为选定的人口统计学、安全性、PK、功效和生物标志物数据提供统计学考虑因素描述性统计。连续数据的描述性统计将包括平均值、中值、标准差和范围,而分类数据将使用频率计数和百分比进行总结。客观反应率将以95%的精确置信区间表示。也可以示出数据的图形总结。
- 电子设备的显示控制方法、装置、电子设备和存储介质
- 电子设备控制方法及装置、电子设备及存储介质
- 数据分布存储方法、装置、存储介质及电子设备
- 存储清理方法、装置、电子设备及存储介质
- 多版本数据存储管理方法及装置、电子设备、存储介质
- 无线通信连接方法、装置、电子设备及存储介质
- 一种无线通信连接方法、电子设备及存储介质
