一种氢氧化细菌S-1-4及其筛选方法
文献发布时间:2023-06-19 09:46:20
技术领域
本发明属于土壤微生物技术领域,涉及一种氢氧化细菌S-1-4及其筛选方法。
背景技术
随着现代化进程的不断发展,城市化进程加快,人类开始过度开垦土地或者各种建筑工地的兴起使得土壤结构遭到了破坏,土壤肥力和养分也都下降。而化肥和杀虫剂的使用虽然可以提升农作物产量,但是使用不当时,就会影响人类健康并污染地下水,从而对水生系统造成影响,并导致遗传多样性的丧失。此外,它们所需的大量能源和水的大量使用也会导致自然资源的枯竭以及全球变暖等问题。而长期频繁使用的话会使土壤板结,肥力下降,使生态系统遭到破环,并且影响了农作物的可持续发展。这使得许多全球公司越来越多地生产和商业化以细菌为基础的生物肥料,植物有益菌市场在世界各地不断增长,新的绿色革命已经到来。
氢氧化细菌作为一种植物促生菌,可通过不同的促生机制对植物的生长发育产生积极影响,并对豆科和非豆科植物都有好处。将氢氧化细菌接种于植物根系、块根、茎或者土壤时,对植物具有直接促生作用的效果,并且为植物提供营养物质。因此,将含有氢氧化细菌的豆科植物应用于农业中,既能保持土壤肥力,又能增加产量,满足现代人类对粮食的需求。但是,目前国内对氢氧化细菌特性的研究还没有进行详细的研究。对于一部分实验室来说氢氧化细菌的研究还处于起步阶段,因此,积极进行氢氧化细菌菌株的特性研究,并且探究其与植物之间的相互作用,进一步筛选和培养优良的氢氧化细菌菌株等工作已经成为现阶段研究的重点,这将为以后实现氢氧化细菌产业化应用提供强大的理论基础,同时还可以从根本上解决土壤污染,人类生存以及健康问题,具有非常重要的研究价值。
在现代农业的发展中,微生物肥料以其环保、高效、对人类健康的低风险性、低成本以及自我繁殖等优点成为当前肥料研究的热点。微生物肥料的主要优势包括发芽率、根系生长、产量(包括籽粒、叶面积、叶绿素含量、镁含量、氮含量、蛋白质含量、水力活性、抗旱性、地上部和根重)以及延缓叶片衰老。另一个优势是赋予植物抗病性,即“生物防治”。氢氧化细菌作为一类PGPR,其“氢肥理论”可满足我们未来农业的需求,并进一步推动绿色农业的发展。
发明内容
本发明的一个目的是提供一种氢氧化细菌S-1-4,能够促进植物根茎和苞芽的生长。
本发明的另一个目的是提供一种氢氧化细菌S-1-4的筛选方法。
本发明所采用的第一技术方案是,一种氢氧化细菌S-1-4,该菌株分离于陕西省西北大学果园内,基于生理生化特性和16SrDNA分 析被归为微杆菌属细菌,分类命名为微杆菌属S-1-4(Microbacterium sp.S-1-4),于2020年7月10日由中国典型培养物保藏中心保藏, 保藏地点在武汉大学,保藏编号为CCTCC No:M 2020301。
本发明的技术特征还在于,
氢氧化细菌S-1-4的生态学特征为:透明,圆形,边缘整齐,小,革兰氏阳性。
本发明所采用的第二技术方案是,一种氢氧化细菌S-1-4的筛选方法,包括以下步骤:
步骤1,样品采集:采集生长旺盛且不含吸氢酶的结瘤豆科植物根际土壤;
步骤2,土壤富集:将采集的土壤样品置于持续通H
步骤3,菌种分离与纯化:土壤稀释涂布于矿质盐培养基平板,置入密闭容器,室温倒置培养,待平板长出明显菌落,挑取单菌落用稀释涂布法进一步纯化;
步骤4,菌种筛选:对纯化后的菌株进行氢化酶活性测定和菌株自养能力的鉴定。
菌种分离与纯化,包括将采集的根际土壤制成土壤悬液,在超净工作台上将土壤悬液连续梯度稀释,将每个梯度的稀释液都均匀涂布在MSA矿质盐平板培养基上,倒置培养于气体循环体系,室温条件下培养三周,观察培养基上细菌的生长情况,挑取大小形态颜色不同的菌落,划线到矿质盐培养基上连续培养,每个菌落纯化三次以上,获得最初的氢氧化细菌S-1-4疑似菌株,将其转接到牛肉膏蛋白胨试管斜面上,4℃保藏备用。
MSA矿质盐平板培养基组成为:4.9g~5.1g(NH
本发明的氢氧化细菌S-1-4为在28℃的MSA培养基中培养的革兰氏阳性杆状细菌。
其鉴定特征如下:
1、生理生化特征
菌株S-1-4呈短杆状,革兰氏染色阳性。在MSA半固体培养基上28℃培养可形成菌落,呈圆形、透明。
S-1-4的生理生化特征如表1所示:
表1菌株生理生化特征
2、序列分析
将菌株送往西安擎科泽西生物技术有限公司进行测序分析,菌种鉴定。
菌种鉴定结果:将测序得到的菌种序列在NCBI上进行Blast序列比对,比对结果显示,菌株S-1-4的序列与Microbacterium序列相似度为100%,据此可以确定菌S-1-4在分子系统发育分类学上属于Microbacterium。
本发明的氢氧化细菌的分离培养方法首先是利用持续通H
本发明的有益效果是,本发明氢氧化细菌S-1-4是一种新型的氢氧化细菌,丰富了氢氧化细菌资源,可将其制备成处理种子的菌液或有机肥料,能够促进植物生长,提高农作物产量;本发明从传统的微生物学入手,以三叶草根际土壤为研究材料,对土壤中的氢氧化细菌进行分离培养,了解氢氧化细菌生理生态特性、自然生态条件,探索Hup-根瘤固氮作用中放氢效应促进植物生长机理,为土壤改良、生物固氮资源的合理开发提供科学依据。
附图说明
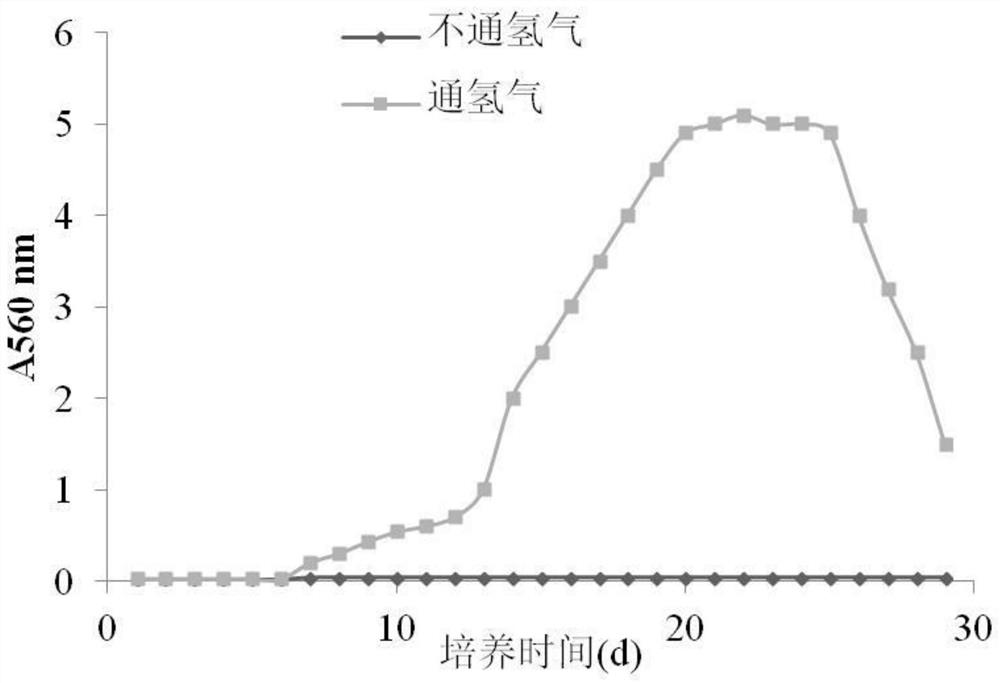
图1是本发明实施例中的菌株S-1-4生长曲线;
图2是本发明实施例中的牛血清蛋白标准曲线;
图3是本发明实施例中的α-丁酮酸标准曲线;
图4是本发明实施例中的IAA标准曲线。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明。
实施例1土壤微生物S-1-4的分离培养
1、样品采集
在陕西省西安市西北大学果园内使用抖落法采集土样,首先去掉土壤表层的枯枝残叶,再用土壤刀从三叶草基部开始逐层挖,直到距离土壤表层10 cm,将根部剪下后轻轻抖落掉非根际土,用毛刷收集附着在根瘤附近的根际土。将收集到的土壤样品分成三等份,分别编号装入到聚乙烯塑料袋中,密封保存于4℃冰箱中。
2、土壤氢氧化细菌的富集与分离
准确称量10g土壤样品放入到装有25个玻璃珠的锥形瓶中,然后再加入90mL无菌水,最后将锥形瓶放置于摇床,调整转速为180r/min,时间为30min。经摇床震荡结束之后将土壤悬液依次稀释,直至为初始浓度的 10
3、菌株筛选
在矿质盐培养基上接种需要检测的菌株,培养2-3天,待出现较为明显的菌落之后将原来试管上的棉花塞换成密闭无菌的橡胶塞,对照组以未接菌的试管为空白对照,每个菌株三个重复。然后使用微量进样器将100μL纯氢气注入斜面试管中,按住橡胶塞上下摇晃使其中的气体充分混合,再用微量进样器抽取混合气体注入到进样口,检测3分钟即得试管内的初始氢气浓度。检测完毕后将斜面试管置于转速为80r/min的摇床中,培养2-3天,最后再检测斜面试管中的氢气终浓度,对照为不接菌的试管斜面,每株菌三个重复。根据初始氢气浓度和最终的氢气浓度的差值就可计算出每个菌株的吸氢值。(气相色谱检测条件:5A分子筛色谱柱,高纯N
4、细菌的自养生长能力检测
鉴定菌株能否以H
(1)摇瓶培养
将筛选出的吸氢值较高的菌株用接种环挑取,分别接种于矿质盐液体培养基中制成菌悬液,无菌橡皮塞密闭之后用气密针注入100μL纯氢气,使瓶内气体中的氢气含量为2.4mmol/L(每隔两天重新注入氢气),然后摇床培养,并设定温度为30℃,转速为120r/min,然后以不通氢气为空白对照,每隔两天用紫外分光光度计测定菌悬液吸光度值(A560 nm),判断菌株是否可以进行自养生长,并绘制菌株生长曲线,如图1所示。
(2)平板培养
将筛选出的吸氢值较高的菌株进行稀释,然后将各个梯度的稀释液涂布在MSA固体培养基上。将平板倒置于含有H
按上述实施方法分离筛选出菌株S-1-4,表2是菌株S-1-4的氧化H
表2菌株S-1-4氧化氢能力及自养能力
注:平均值+S.D.取自三次重复,**表示与对照具有显著差异(p<0.01).
实施例2菌株S-1-4解磷能力测定
将待测菌株在新鲜的PVK培养基中划线3-4次,得到纯培养物,并进行形态学检查。再用无菌牙签在PVK培养基上接种,每组三个重复,对照组为不接菌的PVK培养基。若菌落周围出现清晰的晕圈区域,则证明该菌株具有磷酸盐的增溶作用,并在30℃培养箱培养5d后,测量溶磷圈直径(D) 和菌落的直径(d),以D/d的比值作为判断菌株溶磷能力的标准,测量结果如表3所示。
表3菌株S-1-4溶磷能力测量结果
实施例3产铁载体能力测定
铁载体能力测定:将活化菌株S-1-4接种于CAS培养基,28℃置于生化培养箱培养48h,而具有产铁载体能力的菌株四周会出现橙黄色晕圈。与此同时记录菌落直径和晕圈直径,计算晕圈比例也就是可溶性指数来对菌株的产铁载体能力进行比较,可溶性指数越大说明菌株产铁载体能力越强,菌株 S-1-4的产铁载体能力测定结果如表4所示。
表4产铁载体能力测定结果
实施例4产ACC脱氨酶活性测定
测定菌株ACC脱氨酶活力步骤:将待测菌株于牛肉膏蛋白胨培养基活化之后接种到7.5mL LB培养液中,30℃,200r/min摇床上培养24h。8000 r/min离心10min,弃上清,收集菌体沉淀,然后接入5mL DF无氮培养基, 5000r/min,20min洗涤菌体,重复两次之后用7.5mL DF无氮培养液(不含 (NH
标准曲线制作步骤:首先用0.1mol/L Tris-HCl缓冲液(pH 8.5)配制α- 丁酮酸标准溶液(0、0.2、0.4、0.6、0.8、1)mmol/L,并向其中分别加入 300μL 2,4-二硝基苯肼(2mo1/L HCI溶解,质量浓度为2g/L),充分混匀后放置30℃水浴锅中30min再加入2mL NaOH(2mo1/L),而NaOH,α- 丁酮酸以及2,4-二硝基苯肼反应会变色,然后在540nm处测每个梯度的吸光值。根据α-丁酮酸溶液浓度和其对应的吸光值来制作标准曲线,空白对照为Tris-HCl(pH8.5)溶液,制作的α-丁酮酸标准曲线如图3所示。
实施例5产IAA能力的检测
将活化以后的菌株S-1-4接种于LB液体培养基中置于摇床,28℃,180 r/min培养24h,移液枪吸取1mL菌液到无菌离心管中离心10min,转速为 10000r/min。无菌水洗涤离心沉淀2次并稀释。稀释后的菌悬液取出100μL 接种到50mL KingB-Trp培养基(L-Trp终浓100mg/L)中,然后置于摇床培养72h,设置转速180r/min,温度28℃。再离心20min(5000r/min)后取1mL上清液到已加2mL Salkowski's溶液的比色管中,在漩涡震荡仪上震荡30s混匀后避光静置20min,观察比色管中的颜色变化,若变为粉红色则说明其菌株可以产IAA,若无变化则说明菌株不可以产IAA。并于530nm 处测定比色管中物质的吸光值。空白对照为未接菌的溶液混合Salkowski's 溶液,每个菌株三个重复。
IAA标准曲线:首先配制10、20、40、60、80、100μg/mL IAA标准溶液,然后用移液枪吸取6个梯度的标准溶液与等量Salkowski's溶液,充分混匀后静置20min(避光),将蒸馏水与Salkowski's混合作为对照组,分别测定吸光值(A 530nm),每组三个重复,以此绘制生长曲线,如图4所示。
表5氢氧化细菌S-1-4促生特征表
注:每个值三次重复,平均值±标准差,数值上标字母表示实验组之间的差异 (p<0.01)
实施例6菌株S-1-4对小麦种子生长的影响
小麦种子在5%次氯酸钠(NaClO)无菌烧瓶中漂洗搅拌3min,即可获得无菌小麦种子。3min后,用20mL无菌水清洗种子5次,然后在无菌水中清洗2h,在此期间至少更换3次水,以去除次氯酸钠。再用30℃温水浸种8h使得种子活力达到最高,然后将种子浸泡于75%的乙醇中,浸泡l min。接着用无菌水反复冲洗多次,浸泡于0.1%酸性升汞中5min,再次冲洗之后备用。
将菌株S-1-4在牛肉膏蛋白胨培养基上进行活化,然后接种于MSA培养基,倒置于不同氢气浓度的气体循环装置中(氢气浓度分别为2.4mmol/L, 7.2mmol/L,12.0mmol/L),培养一周左右。用移液枪吸取等量的菌液分别接种于MSA培养基中摇床培养(25℃,200r/min)制备菌悬液。然后在每个MSA固体培养基内接种20粒健康均匀的种子,再分别加入15mL菌悬液,对照组为未经氢气处理的菌株S-1-4制备的菌悬液,重复4次。最后放置于光照培养箱(28℃),接种后10d进行取样和形态学观察。对长度大于0.2mm的萌发种子的根长和芽长进行了测量和记录,并测定各组的生物量 (鲜重和干重)。
表6菌株S-1-4对小麦生长的影响
附注:表中数值均为4次重复的平均值,“±”后面的数值为标准差,*表示差异显著(p<0.05),**表示差异极显著(p<0.01)
从上表中可看出,菌株S-1-4能够显著促进小麦根芽的生长,相比氢气浓度为2.4mmol/L和12.0mmol/L培养环境,7.2mmol/L的气体循环装置中培养的菌株S-1-4对小麦生长的促进作用最为明显。
- 一种氢氧化细菌S-1-4及其筛选方法
- 一株细菌纤维素产生菌株、筛选方法及细菌纤维素的制备
