包含交联聚合物的水凝胶组合物
文献发布时间:2023-06-19 09:47:53
本发明涉及包含交联聚合物的无菌水凝胶组合物及其用途和用于制备其的方法,其中所述交联聚合物是巯基修饰的透明质酸的氧化产物。
背景技术
透明质酸(Hyaluronan,缩写为HA,也称为hyaluronic acid)及其盐(例如透明质酸钠)是天然存在的阴离子非硫酸化的糖胺聚糖,其具有重复的由D-葡糖醛酸和N-乙酰基-D-葡萄糖胺构成的二糖。
高分子量的透明质酸天然存在于皮肤中,并以其粘弹性和非常高的吸水性而著称。其性质在很大程度上促进了皮肤的弹性。鉴于其特性及其生物相容、耐受和无毒的性质,已经在医学和美容领域,特别是在美学手术的许多应用中利用该化合物的优点超过10年。例如,透明质酸被用于通过直接注射到所考虑区域的真皮中来填充皱纹(用作皮肤填充物)。
生物发酵来源的高度纯化的未修饰的HA具有极好的生物相容性,并且与内源性透明质酸相同。然而,尽管具有与人体组织高度相容、与水具有高亲和力并且发挥强的保湿功能的优点,但是HA不具有足够的生物力学特性。当将HA注射到皮肤组织中时,其通过人体组织中存在的透明质酸酶(酶降解)和自由基(化学降解)在体内迅速降解。
已经提出了许多解决方案来减慢HA在体内的降解并改变其化学、物理和生物学特性,另外提供制剂对储存过程、对热以及因此对灭菌的降解的抵抗提高。
这些方法通常涉及HA的化学修饰,包括例如通过化学、酶促或光化学方法使HA交联。这些交联透明质酸凝胶可以通过多种制备方法获得。通常,这些方法需要两个主要步骤,第一步由使透明质酸水合以使其转化为水性溶液(水凝胶)组成,并且第二步旨在在能够诱导其交联的试剂(也称为“交联剂”)的存在下使所述水性溶液的HA分子交联。交联剂的实例包括甲醛、二乙烯基砜、双碳二亚胺和环氧化物。
为了生产皮肤填充物,交联剂最通常选自环氧化物如1,4-丁二醇二缩水甘油醚(BDDE)或1,2,7,8-二环氧辛烷(DEO)、醛、或聚乙烯基砜如二乙烯基砜(DVS),因此本质上是合成的。
遗憾的是,化学修饰会导致利用天然具有低免疫原性且无毒性的未修饰HA时未观察到的副作用和异物反应。在大多数市售的HA软组织填充物中,BDDE被用作交联剂。由于BDDE中存在的环氧基的反应性质,皮肤填充物中残留的未反应BDDE可能具有遗传毒性作用。因此,需要将皮肤填充物中的BDDE保持在痕量(<百万分之二份),因此在生产过程中需要昂贵的额外纯化和测试步骤。尽管BDDE交联的填充物的安全性特性得到了长期临床经验的支持(De Boulle,Glogau等人,2013,A review of the metabolism of 1,4-butanedioldiglycidyl ether-crosslinked hyaluronic acid soft tissue fillers,DermatolSurg(39):1758-1766),BDDE仍可能引起一些安全性担忧(Choi,Yoo等人,2015,Modulationof biomechanical properties of hyaluronic acid hydrogels by crosslinkingagents,J Biomed Mater Res Part A(103A):3072-3080)。
由于与BDDE相关的遗传毒性风险,可以在患者的一生中施用的皮肤填充物产品(例如
化学修饰的另一个问题是透明质酸在交联反应中实现期望的交联度而需要经历的必要的严苛反应条件,例如碱性pH值和高温(高于50℃)。已知由于在暴露于酸性(pH低于4)或碱性pH(pH高于10)期间的水解性降解,HA的分子量降低。此外,透明质酸在高于40℃的较高温度下降解(Troncoso等人,2016,A kinetic study of the degradation ofHyaluronic acid at high concentrations of sodium hydroxide,student thesis,通过http://uu.diva-portal.org/smash/get/diva2:954372/FULLTEXT01.pdf在线访问;Stern等人,2007.The many ways to cleave hyaluronan,Biotechnology Advances(25):537-557;Tokita和Okamoto,1996,Degradation of hyaluronic acid–kinetic study andthermodynamics,Eur.Polym.J.(32):1011-1014)。还已知分子量小于约200kDa的低分子量透明质酸片段具有促炎作用(Naor,2016,Editorial:Interaction Between HyaluronicAcid and Its Receptors(CD44,RHAMM)Regulates the Activity of Inflammation andCancer,Frontiers in immunology 7:39;Monslow等人,2015,Hyaluronan–a functionaland structural sweet spot in the tissue microenvironment,Frontiers inimmunology 6:231)。
Shu等人首先描述了二硫化物交联的透明质酸水凝胶(Biomacromolecules 3,1304-1311,2002)。
巯基修饰的透明质酸(HA-SH)的二硫化物交联衍生物可以通过自交联机制获得。交联透明质酸聚合物的网络在巯基之间形成二硫键(HA-S-S-HA)时建立。形成二硫键的巯基可以连接共同的HA骨架分子或相邻的HA分子的侧基,即交联可以分别是分子内或分子间的。由游离巯基形成二硫键是一种氧化反应,该氧化反应可以例如由于普遍存在的氧自发地发生或在添加氧化剂之后发生。
WO 2004/037164进一步研究了用3,3'-二硫代双(丙二酰肼)(DTP)或4,4'-二硫代双(丁二酰肼)(DTB)修饰的透明质酸。评价了通过二硫化物形成和使用巯基反应剂如聚乙二醇二(甲基)丙烯酸进行交联获得的凝胶在组织工程(即作为用于生长和培养用于植入的细胞的骨架)中的潜力。在WO 2005/056608中,采用相同的技术使巯基化酰肼修饰的羧甲基透明质酸交联以获得大分子细胞骨架。Serban等人描述了2-硫代乙基醚透明质酸衍生物的合成(Biomaterials 29,1388-1399;2008),但是其不适合通过所研究的交联剂进行交联。EP 2103631描述了其中通过酰肼偶联法引入巯基的巯基修饰的大分子,包括透明质酸,及其交联产物。交联产物用交联剂或通过二硫化物形成而获得。
Kafedjiiski等人(Kafedjiiski)也描述了巯基化透明质酸的合成及其在药物递送、伤口愈合和组织修复中的潜在用途。CN101367884A公开了包含游离巯基和二硫化物基团二者的HA-半胱胺缀合物的合成。EP 2 614 828描述了具有低修饰度的巯基修饰的生物相容性聚合物衍生物及其交联的材料。WO 2008/077172描述了用于组织增强的巯基化透明质酸。在一个实例中,WO 2008/077172描述了具有2g含巯基的透明质酸(巯基修饰的透明质酸)的无菌水凝胶制剂的皮内施用,其中由含巯基的透明质酸形成的贮库可以在两周内经触觉方式检测到;然而,该文件未提及在该实施例中使用的巯基修饰的透明质酸的具体特征。
本发明的发明人还研究了自交联的巯基修饰的透明质酸水凝胶作为软组织填充物的潜力。
然而,使用基于自交联的巯基修饰的透明质酸的水凝胶组合物的初步体内研究显示与具有外部交联剂的皮肤填充物相比在植入后更快的降解行为。因此,本发明的目的是提供包含二硫化物交联的聚合物的组合物,其中该二硫化物交联的聚合物是巯基修饰的透明质酸(HA-SH)的氧化产物,具有改善的性质,尤其是用作软组织填充物施用。
发明的简要描述
本发明提供了一种包含交联聚合物的无菌水凝胶组合物,
其中所述交联聚合物是巯基修饰的透明质酸的氧化产物,
其中所述巯基修饰的透明质酸具有大于约80μmol/克聚合物、优选大于约105μmol/克聚合物、更优选大于约120μmol/克聚合物的巯基基团的修饰度,
其中所述巯基修饰的透明质酸具有小于约280μmol/克聚合物、优选小于约240/克聚合物、更优选小于200μmol/克聚合物的巯基基团的修饰度,并且
其中所述组合物具有相对于所述巯基修饰的透明质酸的修饰度小于20%的残留巯基含量。
根据本发明的无菌水凝胶组合物是基于具有巯基基团的修饰的透明质酸(HA-SH)的水凝胶,其中所述透明质酸在修饰的透明质酸的巯基基团之间通过二硫键交联(巯基修饰的透明质酸的氧化产物)。氧化产物是由未修饰的透明质酸的部分和修饰的透明质酸的部分组成的共聚物,修饰的透明质酸通过二硫键连接。水凝胶不含任何其他外部的双官能交联剂,例如二乙烯基砜。水凝胶组合物被表征为包含初始修饰度在约80μmol巯基基团/克聚合物至约280μmol巯基基团/克聚合物之间的巯基修饰的透明质酸的氧化产物。
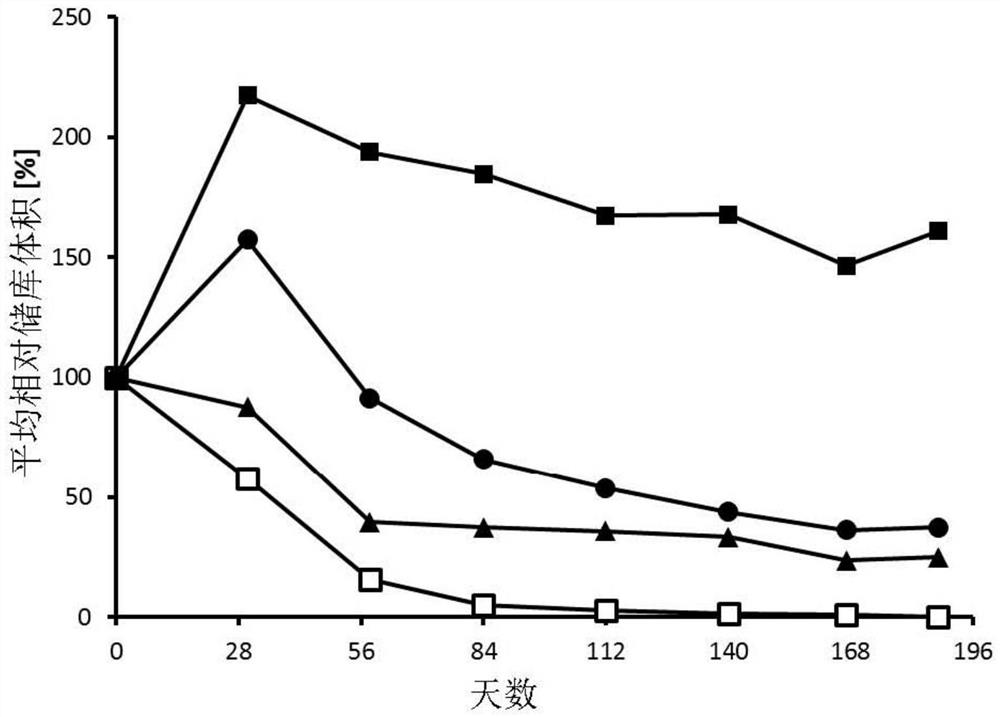
发明人发现,巯基基团对透明质酸的修饰度是影响无菌水凝胶的体内停留时间的重要特征。为了使软组织填充物丰盈,期望植入的水凝胶的体积(贮库体积)在一段时间内保持恒定,并且因此由于缓慢降解而获得可持续的效果。此外,可能期望所施用的水凝胶在施用之后显示出一些初始溶胀,即,由于将水吸收到填充物储库中而导致体积增加。
在下面的实施例7至9中举例说明了表征无菌水凝胶组合物的体内性能的研究。计算相对于起点以%表示的储库体积,以补偿施用体积中的潜在差异。在t=0时(植入后立即)的储库体积相当于100%。可以例如通过磁共振成像(MRI)扫描来监测储库容积。将理解的是,优选地在动物模型中确定的作为生物学参数的储库体积具有大的个体差异。因此,个体数据点的信息性较小,并且仅平均值(考虑多个施用部位和/或多个研究对象)才给出结论性数据。当然,性能将进一步取决于诸如植入部位的组织类型、用于测量贮库体积的所用方法以及所研究的生物体的物种等因素。数据的定量可转移性(例如在人类中施用)可能会受到限制。但是,在另一项小鼠体内研究中观察到了与大鼠中的数据相当的结果(数据未显示)。因此,体内表征提供了用于彼此间个体水凝胶组合物的评估和比较的有价值的工具。停留时间可以用作描述一段时间内平均贮库体积的存在、优选一段时间内约100%(甚至更大)的贮库体积的存在的参数。丰盈效果可以被定义为通过在施用水凝胶之后的某个时间点约100%(或更大)的储库体积,例如在植入后第5周(例如,在第30天)或优选地在第12周(例如,在第81至84天)并且最后甚至在第24周测量(例如在165至168天测量)。优选地,在施用后的前12周或3个月期间或前24周或6个月期间(停留时间)可检测到约100%(或更大)的储库体积。在示例的研究条件下,根据本发明的水凝胶组合物在植入后12周(在第81至84天测量)显示出丰盈效果。因此,根据本发明的水凝胶组合物显示出期望的体内性能,有望具有用作例如人中的软组织填充物的适用性。此外,交联聚合物的性质提供了良好的毒理学安全性谱,并且与其他稳定化的透明质酸填充物相比可以施用更大的体积(每次施用量超过50mL)。
影响水凝胶组合物的丰盈效果的最关键参数是“巯基基团的修饰度”,其表示每克(g)巯基修饰的透明质酸的巯基基团的初始量(通常以μmol给出),并且可以缩写为DoM。该巯基基团的量是巯基修饰的透明质酸原料的特征,并且指示在组合物的生产过程中可用于交联的巯基基团的量。巯基基团或部分(thiol groups or moieties)也可以称为巯基基团(mercapto group)或氢硫基基团(sulfhydryl group)。基于各种实例,发明人确定了修饰度的最佳范围为约80μmol/g聚合物至280μmol/g聚合物。一方面,大于80μmol/g聚合物的修饰度对于生产具有植入后超过12周的丰盈效果的组合物是必要的。令人惊讶地,另一方面,使用具有更高修饰度的巯基修饰的透明质酸不会导致所产生的水凝胶即储库体积增加(例如,≥335μmol/g聚合物,如实施例7所示)的丰盈效应。不希望受理论的束缚,假设更高的修饰度(并且因此更高的交联率)导致水凝胶的致密结构,其阻止了水的引入并因此抑制溶胀效果。因此,含巯基基团的巯基修饰的透明质酸的初始修饰度被确定为影响无菌水凝胶组合物的软组织填充特性的关键因素。仅用包含初始修饰度在80至280、优选100至240、更优选120至200μmol巯基基团/g聚合物的窄范围的交联的巯基修饰的透明质酸的组合物才获得了用于软组织填充的丰盈效果。
高交联度(通过巯基基团的氧化)有利于获得具有适合于丰盈的软组织填充物的弹性性能的水凝胶组合物。为了提供具有可再现且稳定的特性(例如流变性质)的水凝胶组合物,巯基修饰的透明质酸的交联(即,二硫键的形成)应主要在水凝胶被进一步加工(即经历进一步的加工步骤,例如筛分、均质化、填充到注射器中和灭菌)之前完成。然而,一小部分巯基基团可能由于诸如空间位阻等因素而不能用于二硫键形成。
根据本发明的无菌水凝胶组合物具有相对于巯基修饰的透明质酸的修饰度小于20%的残留巯基含量。这对应于巯基修饰的透明质酸中超过80%的可用巯基基团在水凝胶生产过程中被氧化。交联聚合物中未交联巯基基团的分数可以通过以μmol/g聚合物表示的残留巯基含量来确定。如实施例17所公开的,在生产方法的氧化步骤中,通过使用氧化剂如过氧化氢,可以获得无菌水凝胶组合物中高且均匀的氧化率和因此可再现的低残留巯基含量。
在一个优选的实施方案中,根据本发明的水凝胶组合物具有相对于巯基修饰的透明质酸的修饰度小于15%的残留巯基含量。
除了修饰度之外,显著影响水凝胶的流变学和体内性质的参数是交联的巯基修饰的透明质酸的浓度以及透明质酸链的分子量分布。
优选的浓度被确定为约11mg/mL至约20mg/mL。
优选地,水凝胶组合物包含浓度为约11mg/mL至约20mg/mL、更优选约13mg/mL至约18mg/mL的巯基修饰的透明质酸的氧化产物。
巯基修饰的透明质酸的浓度通过相对于无菌水凝胶组合物的体积的重量以mg/mL给出。浓度优选地是指盐(例如交联的巯基修饰的透明质酸的钠盐)的浓度。因此,提供了等量的巯基修饰的透明质酸用于制备。认为更高的浓度是不合适的,因为其导致具有高粘度而无可接受注射性的水凝胶组合物。9mg/mL或更低的浓度被认为是不合适的,因为对于这种水凝胶组合物观察到低的弹性模量G’。在约14mg/mL至约18mg/mL的范围内,在例如15或17mg/mL,观察到良好的流变性质。
优选地,巯基修饰的透明质酸的平均分子量(MMW)为至少约400kDa,优选至少约500kDa,更优选至少约600kDa,例如约700kDa。
在另一个实施方案中,优选地,交联聚合物的平均还原灭菌后分子量大于约250kDa,优选大于约300kDa,更优选大于约350kDa,其中平均还原灭菌后分子量被定义为在将所述交联聚合物暴露于还原条件后来自所述无菌水凝胶组合物的还原的巯基修饰的透明质酸的平均分子量。交联聚合物的“平均还原灭菌后分子量”被认为是影响植入后水凝胶的丰盈效果的另一个关键因素,并且在下文中将缩写为MRPMW。MRPMW被确定为制备步骤之后交联的巯基修饰的透明质酸(交联聚合物)的分子量,在制备步骤中将水凝胶组合物的交联聚合物暴露于还原条件。在水凝胶中,交联聚合物代表其分子量可能无法确定的复杂网络。因此,需要还原交联聚合物,即在确定分子量之前将交联的二硫键裂解。MRPMW是与水凝胶组合物中交联聚合物的聚合物链的平均分子量有关的值。MRPMW被定义为来自无菌水凝胶组合物的还原的巯基修饰的透明质酸的平均分子量(MMW),即表示在灭菌后且还原后从组合物确定或可获得的巯基修饰的透明质酸级分的MMW。通常,与原料(即,用于生产相应组合物的巯基修饰的透明质酸)的平均分子量(MMW)相比,为来自无菌水凝胶组合物的巯基修饰的透明质酸确定的MRPMW更低(参见表1)。与原料的MMW相比,MRPMW的降低被认为是水凝胶生产过程(包括灭菌)的结果。因此,与使用原料的MMW相比,使用交联聚合物的MRPMW更适合表征水凝胶组合物。
然而,发明人发现,当使用平均分子量(MMW)为至少约400kDa、优选至少约500kDa、更优选至少约600kDa、例如约700kDa的巯基修饰的透明质酸用于水凝胶组合物的生产时,水凝胶组合物中交联聚合物的MRPMW为约250kDa或更高。例如,实施例中概述的以约600kDa的巯基修饰的透明质酸开始的生产程序导致交联聚合物的MRPMW在约350kDa或更高的最优选区域的水凝胶组合物。反之亦然,约250kDa或更高的MRPMW是相应的巯基修饰的透明质酸的MMW为至少约400kDa的证据,尽管定量关系取决于生产程序。
如上所述,在根据本发明的组合物中,交联聚合物的MRPMW优选为约250kDa或更高。利用包含MRPMW小于250kDa,例如200kDa(ID10)的交联聚合物的组合物的示例没有显示出优选的弹性模量G’以及在足够长的时间内的大于100%的平均相对储库体积,然而包含MRPMW为300kDa的交联聚合物的示例性组合物显示大于100%的平均相对储库体积持续133天。包含MRPMW为480kDa的交联聚合物的组合物显示大于100%的平均相对储库体积持续188天。特别地,MRPMW优选大于300kDa,更优选大于约350kDa。根据发明人的知识,现有技术没有公开MRPMW及其在植入软组织后影响水凝胶的体内性能的作用。MRPMW通过相当间接的测量方法表征为水凝胶组合物中的交联聚合物,即非均匀网络。因此,结果通常显示±10%或者有时甚至更高的偏差是不足为奇的。实施例5指定了确定MRPMW的示例性方法。本领域技术人员将认识到,其他方法可以为该参数获得可比较值。例如,琼脂糖凝胶电泳可使用水平凝胶室和作为参考的HA分子量梯状物用于在琼脂糖凝胶中分离透明质酸的不同MW的级分。对染色的凝胶进行光密度分析,然后进行分子量计算。
另一方面,巯基修饰的透明质酸优选具有至多约4,500kDa的平均分子量(MMW),特别是至多4,000kDa至4,200kDa的平均分子量。已经发现,具有甚至更高分子量规格的透明质酸起始原料在必要用于制备适合于制备工业规模和/或用作皮肤填充物的无菌水凝胶组合物的巯基修饰的透明质酸的数量和质量方面均不可用。更优选地,巯基修饰的透明质酸的平均分子量为至多3,500kDa或至多2,000kDa。例如,巯基修饰的透明质酸的平均分子量可以在约700kDa至约2,000kDa的范围内。
本发明还提供了一种用于制备根据本发明的水凝胶组合物的方法,包括以下步骤:
a)提供在水性溶液中的巯基修饰的透明质酸,
其中所述巯基修饰的透明质酸具有大于约80μmol/克聚合物、优选大于约105μmol/克聚合物、更优选大于约120μmol/克聚合物的巯基基团的修饰度,并且
其中所述巯基修饰的透明质酸具有小于约280μmol/克聚合物、优选小于约240/克聚合物、更优选小于200μmol/克聚合物的巯基基团的修饰度,
b)通过将先前获得的水性溶液暴露于允许所述巯基修饰的透明质酸形成二硫化物交联的聚合物的条件氧化所述巯基修饰的透明质酸,其中或由此所述水性溶液变成水凝胶,该水凝胶具有相对于所述巯基修饰的透明质酸的修饰度小于20%的残留巯基含量,
任选地,c)向先前获得的水凝胶或先前获得的溶液中添加未修饰的聚合物,所述未修饰的聚合物选自生物相容性多糖的组,
任选地,d)筛分先前获得的水凝胶以获得具有特定粒径分布的水凝胶,
e)将先前获得的水凝胶填充到容器中,优选注射器中,并且将填充的容器暴露于允许对水凝胶灭菌的条件,
f)获得包含交联聚合物的容器中的无菌水凝胶组合物。
在用于制备水凝胶的方法中,步骤可以以不同的顺序进行。尤其是,交联(氧化)、添加未修饰的聚合物和筛分的步骤可以以不同的顺序进行,而不会必然影响水凝胶的质量。优选地,步骤以顺序a)、c)、b)、d)、e)和f)进行,其中溶液的制备(步骤a)和未修饰的聚合物的添加(步骤c)可以同时进行,并且任选地,同一时间可以添加另外的组分(例如局部麻醉剂)。
二硫键的形成(交联)在氧(例如通过周围空气供应或溶解在水性溶液中)的存在下在生理pH值下自然发生。但是,优选添加氧化剂以确保步骤b)中的条件足以达到氧化的程度,这确保了水凝胶具有相对于巯基修饰的透明质酸的修饰度小于20%的残留巯基含量。氧化剂的主动添加加速并完成了二硫化物的形成,以获得所需的低程度的残留巯基含量。而且,事实证明在步骤b)中添加氧化剂对于确保工业过程(即包括大物料体积)中的可再现且均匀的结果特别相关。
因此,在一个优选的实施方案中,在步骤b)中向先前获得的水性溶液中添加氧化剂。
合适且良好建立的氧化剂是例如过氧化氢(或其他过氧化物)、抗坏血酸、二甲基亚砜和次氯酸(次氯酸钠)。在超压条件下,纯氧气或高氧气混合物可用于增加聚合物水性溶液中可用作氧化剂的氧的浓度。优选的添加量取决于氧化剂和巯基修饰的透明质酸中巯基基团的量。示例性地,对于过氧化氢,在步骤b)中,巯基修饰的透明质酸的游离巯基基团与过氧化氢的摩尔比应优选至多为4:1;更优选至多2:1。
在另一方面,本发明提供了根据本发明的组合物,用于作为药物使用,特别是用于在治疗和预防软组织疾病中使用。此外,本发明涉及根据本发明的组合物的美容用途。这样的用途(治疗或美容)可以涉及根据本发明的组合物作为软组织填充物或用于组织增强的用途。这样的用途优选包括例如通过注射或植入施用于人类,而适用性不限于人物种。
在另一个方面,本发明涉及一种方法,其中该方法包括在特定的软组织部位引入根据本发明的组合物,例如通过从注射器注射。该方法涉及组合物作为软组织填充物或用于组织增强以用于治疗以及美容目的的用途。
在一个实施方案中,根据这些方面的用途或方法包括,将水凝胶组合物通过皮内、腹膜下或皮下从注射器注射到人类中来引入至组织部位。
附图的简要描述
附图示出了:
图1:作为示例性的巯基修饰的透明质酸的透明质酸-半胱胺亚结构的示意图。
图2:作为随时间的平均贮库体积的不同水凝胶组合物的体内性能,其中植入后的贮库体积相对于第0天的初始体积(对应于100%)指示:组合物ID 5(实心正方形)、组合物ID 4(空正方形)、组合物ID 6(实心三角形)、组合物ID 10(实心圆)。表1和表2列出了不同组合物的特性。从图2所示的水凝胶组合物来看,只有组合物ID 5是根据本发明的水凝胶组合物。
图3:其他示例性的巯基修饰的透明质酸的示意图,即透明质酸-高半胱氨酸亚结构(A)、透明质酸-甘氨酰-半胱胺亚结构(B)和N-巯基-正丁基透明质酰胺亚结构(C)和HA-DGDTPDH亚结构(D)。
发明的详细描述
在一个实施方案中,根据本发明的无菌水凝胶组合物优选具有使用1Hz剪切速率在25℃测量的至少约900Pa、优选至少约1,000Pa的弹性模量G’。
在水凝胶的情况下,水凝胶组合物的弹性模量G’通常用于表征它的弹性性质,并表示剪切储能模量,如利用流变仪施加剪切力(例如通过旋转(锥形)板)确定的。用于确定弹性模量G’的标准方法是本领域已知的(Stocks D.,Sundaram H.,Michaels J.,DurraniM.J.,Wortzman M.S.,Nelson D.B.,Rheological Evaluation of the PhysicalProperties of Hyaluronic Acid Dermal Fillers,2011,Journal of Drugs inDermatology,10(9),974-980)。弹性模量G’用于表征凝胶的坚度(硬度)或柔软度。同时,它是凝胶抵抗变形能力的量度。因此,预期具有高G’值的皮肤填充物水凝胶在植入后提供更好的支撑和丰盈度(Stocks等人,2011)。除了旋转板的温度和频率外,其他可变的测试条件也会影响弹性模量G’的定量可比性。重复测试通常会导致相对于平均值的约±10%(例如8%)的标准偏差。在一些情况下,观察到当通过针或没有针的情况下挤出而提供水凝胶时,弹性模量变化高至20%。因此,建议保持接近下面实施例4中概述的方案来评估弹性模量G’。
根据本发明的多种水凝胶组合物(具有指示的巯基修饰的透明质酸的修饰度和任选地聚合物的浓度)显示出大于1,000Pa的弹性模量G’。弹性模量G’小于900Pa的水凝胶在足够长的时间内没有表现出高于100%的平均相对储库体积(实施例6中的水凝胶组合物ID10),然而弹性模量为1,385Pa的组合物(包含MRPMW为480kDa的交联聚合物,水凝胶组合物ID2)显示出高于100%的平均相对储库体积持续188天。先前对由交联的巯基修饰的透明质酸形成的水凝胶的研究并未特别关注无菌水凝胶组合物或它们作为软组织填充物的适用性。因此,现有技术对它们的弹性模量G’及其影响在植入软组织后基于二硫化物交联的聚合物的水凝胶的体内性能的作用没有报道。此外,市售皮肤填充物的可获得数据(Stocks等人,2011)表明,包含至少20mg/mL的BDDE交联的透明质酸的这些产品的弹性模量在约75Pa至约660Pa的范围内。尽管在不同的测试条件下测量,这些值表明已建立的交联的透明质酸水凝胶的弹性模量G’远低于900Pa或甚至1,000Pa,因此低于本发明的优选范围。
根据本发明的水凝胶组合物的性质受到巯基修饰的透明质酸(尤其是其修饰度)的影响。用于确定修饰度的已建立方法包括Ellman方法或测量2,2’-二硫代二吡啶与含巯基的试剂反应时发色性硫酮的释放(参见实施例1)。本领域技术人员还将知道产生相似值的替代方法。在本文中,修饰度以每克聚合物中巯基的μmol给出。替代地,修饰度可以表示为百分比,其中修饰的重复单元的量除以聚合物(D-葡糖醛酸和N-乙酰基-D-葡萄糖胺)中HA-重复单元的总量。通过考虑到HA重复单元的400g/mol的分子量,可以将以μmol巯基/克聚合物计的修饰度转化为百分比。在这种转化中,通常忽略由修饰引起的分子量变化。因此,对于根据本发明的组合物中的巯基修饰的透明质酸指示的修饰度可以表示为在3.2%至12.0%、优选4.0%或11.2%或4.8%至10%的范围。
“巯基修饰的透明质酸”(HA-SH)是透明质酸(HA)的含巯基基团的衍生物。其具有如上所述的修饰度的特征,并且可以通过已知的合成方法得到,该方法从可以以不同分子量(或分子量范围)获得的透明质酸开始。在科学和专利文献中可以找到用带有巯基的配体进行HA修饰的许多实例:Griesser等人提供了巯基化透明质酸聚合物的综述(Griesser等人,Polymers 10(2018)243)。Aeschlimann(EP 1 115 433 B1)描述了一种HA官能化的方法,其不损害HA的分子量,并且进一步提供了在体内具有良好耐受性且可生物降解的HA分子。该方法用于产生具有用于交联的不同末端官能团(例如巯基基团)的HA。使用活性酯中间体,通过含(保护的)巯基的伯胺或含二硫键的二氨基或二酰肼配体与葡糖醛酸部分的羧基进行的碳二亚胺介导的偶联将这些侧链引入HA。然后还原具有二硫键的中间产物,然后通过除去保护基使具有保护的巯基的中间产物脱保护。Bulpitt等人(US 6,884,788)描述了另一种方法,其包括HA羧基与含二硫键的碳二亚胺(例如2,2'-二硫代双(N-乙基-(N'-乙基碳二亚胺))直接反应,然后用还原剂还原二硫键。WO 2008/008857 A2公开了2-硫代乙基醚衍生的透明质酸的合成方法。EP 0587715公开了如何合成水不溶性阴离子多糖,其通过以下进行:将至少一种聚阴离子多糖(例如HA)溶解在水性混合物;用活化剂(例如二酰亚胺,如EDC或ETC或BOP)活化聚阴离子多糖;用修饰化合物(例如1-羟基苯并三唑水合物(HOBt)或1-羟基苯并三唑一水合物)修饰活化的聚阴离子多糖;以及使活化的聚阴离子多糖与合适的亲核试剂(例如氨基硫醇)反应以形成期望的不溶性组合物。发明人指出,聚阴离子多糖的BOP活化的一个主要优点是,在与亲核试剂偶联后聚阴离子多糖的分子量不会降低。EP 1 790 665 B1描述了一种水溶性修饰的透明质酸,其通过使用在非质子极性溶剂中的BOP缩合剂经由酰胺键将取代基引入到透明质酸的葡糖醛酸的羧基中而制备。具有二硫键的二胺是在列出的取代基中。Borke等人描述了用DMT-MM进行的三嗪介导的酰胺化,用于用半胱胺对透明质酸进行有效且受控的官能化,其中与其他偶联剂(例如EDC-介导的取代)相比,温和的反应条件和多糖链的最低降解被列为使用这组偶联剂的优点(Borke等人,Carbohydrate Polymers 116(2015)42–50)。Liang等人描述了在CDMT和NMM的存在下通过侧羧酸盐与胱胺的酰胺化反应然后用DTT进行还原反应来将巯基引入HA(Liang等人Carbohydrate Polymers 132(2015)472–480)。Kafedjiiski等人(Int J Pharm 343,48-58;2007)描述了通过双催化体系(碳二亚胺/N-羟基琥珀酰亚胺)用L-半胱氨酸乙酯盐酸盐对HA进行巯基修饰。在WO 2004/037164中,用3,3'-二硫代双(丙二酰肼)(DTP)或4,4'-二硫代双(丁二酰肼)(DTB)修饰透明质酸。在用还原剂如DTT还原后,得到相应的巯基化HA衍生物HA-DTPH和HA-DTBH。EP 2103631也描述了通过酰肼偶联方法通过HA的羧基引入带有巯基的配体。合成了不同的巯基化HA聚合物(HA-DGDTPDH、HA-DPDTPDH、HA-DSCDH)。
根据本发明,巯基修饰的透明质酸优选是与透明质酸连接的修饰剂的缀合物。
优选地通过在透明质酸的葡糖醛酸部分的羧基与修饰剂之间形成酯键、酰胺键或酰肼键来引入修饰剂。在合成过程中,修饰剂可以包含二硫键形式的或作为受保护巯基基团的巯基基团。
在一个优选的实施方案中,修饰剂通过酰胺键与透明质酸中的葡糖醛酸部分的羧基连接。因此,修饰剂包含至少一个能够与透明质酸中的葡糖醛酸部分的羧基形成酰胺键的氨基,并且修饰剂包含巯基。例如,巯基修饰的透明质酸是透明质酸-半胱胺缀合物,其中半胱胺通过酰胺键与透明质酸连接(参见图1)。
类似地,其他带有巯基的修饰剂可以用于在修饰剂的氨基基团(伯氨基团或仲氨基团,优选伯氨基团)与透明质酸中的葡糖醛酸部分的羧基之间通过酰胺键形成来合成巯基修饰的透明质酸。
利用其独特的巯基保护作为硫代内酯,通过高半胱氨酸硫代内酯对透明质酸钠的酰胺化来合成透明质酸-高半胱氨酸缀合物(图3A)。随后在还原剂的存在下通过碱水解成功地释放了游离的巯基,以避免由二硫化物形成引起的不希望的胶凝。
其他修饰剂包括例如半胱胺、半胱氨酸或高半胱氨酸的衍生物,其中半胱胺、半胱氨酸或高半胱氨酸的N-末端与氨基酸的羧基偶联。这些衍生物优选地通过半胱胺、半胱氨酸或高半胱氨酸酰胺对N-保护的氨基酸的酰胺化来合成,其使用常规的肽偶联剂,优选能够容易地进行产物纯化的那些,例如通过在反应后进行水性提取来除去反应物和副产物(参见实施例12A-带有巯基的修饰剂的合成)。替代地,使半胱胺、半胱氨酸或高半胱氨酸与N-保护的氨基酸的相应的活性酯在有机溶剂(例如琥珀酰亚胺酯)中反应。透明质酸-甘氨酰-半胱胺缀合物(图3B)是通过这种方法合成的巯基修饰的透明质酸的实例。
优选低分子量的修饰剂,以尽可能保留透明质酸的独特物理化学性质。以便获得可用于根据本发明组合物的可交联的巯基修饰的透明质酸的合适的低分子量的修饰剂优选地进一步选自包含以下的组:谷胱甘肽、半胱氨酸、包含线性或支化C
氨基烷基硫醇接头可通过相应的对称二胺方便地引入,该对称二胺包含作为一种类型的固有保护基团的二硫键,其是在用透明质酸进行酰胺合成后开发的。继而可以从N-保护的氨基醇开始获得二硫化物:在例如按照Mitsunobu方案引入硫酯部分之后,在氧化条件下对硫酯进行皂化实现期望的目标化合物(例如实施例12C)。N-巯基正丁基透明质酸酰胺(图3C)是通过这种方法合成的巯基修饰的透明质酸的一个实例。
在另一个优选的实施方案中,修饰剂通过酰肼键与透明质酸中的葡糖醛酸部分的羧基连接。因此,修饰剂包含至少一个能够与透明质酸中的葡糖醛酸部分的羧基形成酰胺键的酰肼基,并且修饰剂包含巯基。例如,巯基修饰的透明质酸是透明质酸-3-巯基-丙酸酰肼缀合物(HA-DTPH)或透明质酸-2-巯基-乙基-羰基-氨基-乙酸酰肼缀合物(HA-DGDTPDH;参见实施例12B、图3D)。
本文所用的术语“无菌的”根据本领域被理解为说明符合用于美容或药物产品的微生物标准(如美国药典(USP)、欧洲药典(Ph.Eur.)或其他国家标准)的组合物。典型地,将透明质酸凝胶在填充到注射器中之后灭菌。用高压灭菌器进行湿热灭菌是标准方法之一,其包括使HA凝胶经受121℃的高压饱和蒸汽约15至20分钟。较短时间(例如,约1分钟至5分钟)和较高温度(例如,约130℃至135℃)的高压灭菌可能会更好地保留凝胶中HA分子的分子量(参见M.L.Bernuzzi,A.Giori,“An innovative way to thermally sterilizehyaluronic acid pre-filled syringes”,2016白皮书,可在以下获得:https://www.fedegari.com/wp-content/uploads/2019/03/WP-Fedegari-Thermal-sterilization-PFS-w ith-Hyaluronic-Acidv-2.pdf,US 2016/0220729)。其他高压灭菌参数的优化(例如确保产品快速冷却)对于保留聚合物的分子量可能也是有利的(http://www.steriflow.com/en/news/Sterilization-hyaluronic-acid)。
本文所用的术语“水凝胶”应理解为描述兼具固体和流体(液体)特性的组合物。一方面,水凝胶可以是可注射的,即其表现出流体样行为。另一方面,水凝胶可以足够坚硬(或刚性)以保持某种形式,例如水凝胶可以以预成型的植入物、线或细丝的形式提供。因此,单独的术语水凝胶不以定量方式限制组合物的流变性质。
然而,在一个优选的实施方案中,水凝胶具有使用1Hz剪切速率的流变仪在25℃测量的至少约900Pa、优选至少约1,000Pa的弹性模量G’。水凝胶的弹性模量G’受以下因素的直接影响
-交联度(由临界修饰度定义,即根据本发明的特性),
-交联聚合物的浓度,和
-MRPMW(取决于巯基修饰的透明质酸的平均分子量)。
示例性部分提供了多种组合物,其指导本领域技术人员改变这些因素以获得至少约1,000Pa的期望的弹性模量G’。应当理解,低浓度可以用较高的分子量补偿。反之亦然。然而,交联聚合物的浓度和MPRMW的优选范围提供了本领域技术人员如何能够获得具有至少约1,000Pa的优选弹性模量的水凝胶的明确指导。弹性模量G’代表有价值的参数以表征根据本发明的水凝胶,其可以基于最终的水凝胶进行验证,而无需进行复杂的技术努力。
在一个优选的实施方案中,所述组合物还包含选自生物相容性多糖的组的未修饰的聚合物。优选地,未修饰的多糖是未修饰的透明质酸(HA)。未修饰(未交联)的或也称为游离的透明质酸可以补充水凝胶组合物。通常将未修饰的HA作为润滑剂添加到软组织填充物中,以通过降低通过针或套管注射产品所需的挤压力来确保易于注射。优选地,用于生产组合物的游离透明质酸原料的分子量为约500kDa至约3,500kDa的范围。然而,由于不稳定的透明质酸的快速降解,本领域技术人员将理解,组合物作为软组织填充物的体内性能在很大程度上受交联聚合物和根本的巯基修饰的透明质酸的性质驱动。优选地,未修饰的多糖以低于交联聚合物的浓度被包含。示例性地,未修饰的透明质酸以3mg/mL至7mg/mL,例如5mg/mL的浓度包含在组合物中,其中该浓度优选是指盐(例如透明质酸钠)的浓度。
水凝胶组合物可包含局部麻醉剂和/或选自以下多种其他组分的一种或多种组分:例如生长因子、维生素、多元醇、碱金属卤化物、矿物质、抗氧化剂、氨基酸、辅酶、陶瓷颗粒(例如羟基磷灰石钙颗粒)、聚合物颗粒、聚合物(例如聚乙二醇、糖胺聚糖、润滑素(lubricin)、多糖及其衍生物)、蛋白质(例如弹性蛋白、胶原蛋白、角蛋白、丝素蛋白)、抗脂肪剂、抗瘢痕形成剂、抗炎剂、抗刺激剂、血管收缩剂、抗出血剂(例如止血剂和抗纤维蛋白溶解剂)、张力剂、抗痤疮剂、色素沉着剂、抗色素沉着剂、消炎剂、抗风湿剂、抗病毒剂、抗感染剂、防腐剂、化学治疗剂、细胞抑制剂、抗过敏剂、抗静脉曲张剂、镇痛剂、抗生素、抗真菌剂、解痉剂、抗组胺剂、治疗痔疮的药剂、治疗皮肤的治疗剂和保湿剂。
考虑到其减轻注射时的疼痛的能力,向水凝胶组合物中添加局部麻醉剂是特别期望的。优选地,麻醉剂是利多卡因,例如酸加成盐的形式,例如盐酸利多卡因。
在一种用于生产水凝胶的方法中,可以在不同的生产步骤中添加局部麻醉剂和/或一种或多种组分,即,在一个实施方案中,在任选的步骤c)中添加局部麻醉剂和/或一种或多种组分,或在另一个实施方案中,独立于添加未修饰的聚合物,例如将其添加到步骤a)期间的溶液或者步骤c)或d)中获得的水凝胶中。在一个优选的实施方案中,在步骤a)或步骤c)期间添加麻醉剂,例如盐酸利多卡因。在一个实施方案中,其中步骤c)在步骤b)之前,即其中在交联之前添加未修饰的透明质酸,优选地在交联步骤之前还包含局部麻醉剂和/或一种或多种其他组分。
此外,将理解的是,水凝胶组合物的主要组分是水。优选地,使用注射用水或纯净水用于生产组合物。此外,将认识到,可以缓冲组合物以显示在6.7至7.8范围内的生理可接受的pH。合适的缓冲剂是本领域技术人员已知的,并且包括例如磷酸盐缓冲剂。该组合物还表现出生理学上可接受的同渗重摩(osmolality),这与待治疗的受试者(例如人)中细胞外液的正常同渗重摩相似。因此,该组合物可以具有在250-350mOsmol/kg范围内的同渗重摩,并且可以包括其他溶质以调节同渗重摩,例如氯化钠、氯化钙和/或氯化钾。
水凝胶组合物是无菌的,并且可以使用(在方法中),其中水凝胶组合物是药物、化妆品或医疗装置。优选地通过针或套管的注射将水凝胶植入在施用部位,优选软组织。替代地,可以通过外科手术植入水凝胶。一旦施用,水凝胶就可被称为(水凝胶)植入物或储库。根据本发明的水凝胶组合物是生物相容性的,并形成可吸收的(即可生物降解的)植入物。因此,根据本发明的水凝胶组合物可用作软组织填充物。在植入大鼠和小鼠的软组织后,根据本发明的特征性水凝胶组合物确实显示出良好的耐受性和体内丰盈效果。这些研究支持水凝胶是用于多种应用的有价值的软组织填充物。
将包含生物材料(例如稳定的透明质酸)的软组织填充物递送至其中期望借助可注射的水凝胶组合物来增强的组织部位。涉及软组织填充的用途或方法的目的包括增强软(皮肤)组织,矫正先天性异常、获得性缺陷或美容缺陷。
水凝胶组合物的主要作用纯粹是物理性的,因为其具有基于植入物的原始体积和膨胀的填充作用。因此,在没有任何生理或药理学相互作用的情况下,该用途可以被分类为美容,并且该组合物可以被认为是化妆品或医疗装置。其中可以将根据本发明的水凝胶组合物的用途视为美容的应用包括,例如,减少年龄的痕迹,例如:
-应用于外阴和阴道组织,以用于非手术的女性生殖器恢复目的
-应用于真皮、皮下或骨膜上的应用。
示例性地,水凝胶组合物可用于美容目的(在方法中),例如用于填充皱纹、治疗皮肤缺陷、恢复面部或身体(例如乳房、耳垂)的损失体积、减小蜂窝织炎中的凹陷、治疗泪槽畸形、塑造面部或身体的轮廓(例如丰臀、臀部增强、小腿增强)、用于阴茎增大(阴茎周长增大、龟头增大)。
在另一些情况下,软组织的填充和增强可导致疾病的治疗或预防,即,其中疾病症状的降低、减轻和/或预防(再)发生。由软组织缺损引起的疾病可受益于所施用的水凝胶对周围组织的暂时和/或局部结构填充、阻尼、支撑或增强。其中水凝胶组合物可用于治疗或预防的疾病包括例如
-跖骨痛,即跖骨球的脂肪垫的疼痛疾病,对于该用途,可以将根据本发明的水凝胶组合物施用于跖骨球软组织的脂肪垫,
-小便或大便失禁,对于该适应症,可以将根据本发明的水凝胶组合物施用于限定括约肌的组织,
-外阴阴道萎缩(也是更年期生殖泌尿综合症),对于该适应症,可以通过注射到阴道粘膜和前庭而将本发明的水凝胶组合物施用于外阴阴道区域,和/或用于大阴唇增强,其中重建大阴唇将确保两个大阴唇之间紧密接触,以保护外阴的内部结构,
-声带受损,
-静脉瓣膜功能不全,或
-面部脂肪萎缩、衰竭性瘢痕或形态不对称或变形(先天性或由于创伤或手术所致(例如胸部或面部)),对于该适应症,可以施用水凝胶以用于重建目的。
实施例
用作制备水凝胶组合物的原料的巯基修饰的透明质酸(HA-SH)中巯基的定量是基于使用2,2’-二硫代二吡啶(DTDP)的湿化学方法。与聚合物骨架共价键合的游离巯基部分与DTDP进行巯基-二硫键交换反应,而释放出一当量的发色硫酮。在缓冲的酸性介质(pH=4)中,可以在343nm处以光度法测量所得硫酮的吸光度。
精确称量约420mg的巯基修饰的透明质酸,并在连续磁力搅拌2-3小时溶解在于30g的0.01N HCl中,以制备储备溶液。然后,精确称取约310mg的储备溶液,并在eppendorf离心管中与4200mg pH 4的乙酸盐缓冲液混合,以制备样品溶液。从每个储备溶液制备三个样品溶液。精确称量25.0mg N-乙酰半胱氨酸并溶解在25.0mL乙酸盐缓冲液(pH 4)中。然后将该溶液用乙酸盐缓冲液(pH 4)进一步稀释以制备校准曲线。乙酸盐缓冲液用作空白值。将500μL含0.125mg/mL DTDP的乙酸盐缓冲液(pH 4)溶液添加到500μL每个样品溶液中(校准曲线、样品溶液和空白值)。将溶液短暂地均质化并在室温下孵育30分钟。最后,将每个样品(校准曲线、样品溶液和空白值)转移到微比色皿中,并在分光光度计中于342nm处相对于空白值进行测量。
为了确定水凝胶组合物中交联聚合物(即交联和产生组合物后的HA-SH聚合物)的残留巯基含量,使用如上所述的类似方法。
精确称量约50mg的每种样品水凝胶,并与1.3mL含0.125mg/mL DTDP的乙酸盐缓冲液(pH 4)溶液混合。精确称量25.0mg N-乙酰半胱氨酸并溶解在200.0mL乙酸盐缓冲液(pH4)中。然后将该溶液用乙酸盐缓冲液(pH 4)进一步稀释以制备校准曲线。乙酸盐缓冲液用作空白值。将500μL含0.125mg/mL DTDP的乙酸盐缓冲液(pH 4)溶液加到校准曲线和空白的各500μL样品中。将所有样品在室温连续搅拌下孵育120分钟。将所有样品离心后,用500μL乙酸盐缓冲液稀释500μL每种上清液,并在分光光度计中于342nm处相对于空白值进行测量。
方法A
溶解:将巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因同时溶解在水性溶液中。
交联:将pH调节至约6.8至7.6后,通过氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:任选地,将包含交联的巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法B
溶解:将巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因同时溶解在酸性水性溶液中。
交联:将pH调节至约6.8至7.6后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:任选地,将包含交联的巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法C
溶解:将巯基修饰的透明质酸溶解在水性溶液中;制备在磷酸盐缓冲液(pH 6.8-7.6)中包含未修饰的透明质酸和盐酸利多卡因的单个溶液。
交联:将pH调节至约6.8至7.6后,通过氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸的水凝胶和包含未修饰的透明质酸和盐酸利多卡因的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法D
溶解:将巯基修饰的透明质酸溶解在水性溶液中;制备在磷酸盐缓冲液(pH 6.8-7.6)中包含未修饰的透明质酸和盐酸利多卡因的单个溶液。
交联:将pH调节至约6.8至7.6后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸的水凝胶和包含未修饰的透明质酸和盐酸利多卡因的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法E
溶解:将巯基修饰的透明质酸和盐酸利多卡因溶解在水性溶液中;制备在磷酸盐缓冲液(pH 6.8-7.6)中包含未修饰的透明质酸的单个溶液。
交联:将pH调节至约6.8至7.6后,通过氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸和盐酸利多卡因的水凝胶和包含未修饰的透明质酸的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法F
溶解:将巯基修饰的透明质酸和盐酸利多卡因溶解在酸性水性溶液中;制备在磷酸盐缓冲液(pH 6.8-7.6)中包含未修饰的透明质酸的单个溶液。
交联:将pH调节至约6.8至7.6后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸和盐酸利多卡因的水凝胶和包含未修饰的透明质酸的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法G
溶解:将巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因相继溶解在水性溶液中。
交联:将pH调节至约6.8至7.6后,通过氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:任选地,将包含交联的巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法H
溶解:将巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因相继溶解在酸性水性溶液中。
交联:将pH调节至约6.8至7.6后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:任选地,将包含交联的巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法I
溶解溶液1:将巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因同时溶解在水中。
交联溶液1:将pH值调节至约6.8至7.6后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
溶解溶液2:将巯基修饰的透明质酸、未修饰的透明质酸和任选的盐酸利多卡因同时溶解在水中。
交联:将溶液2的pH值调节至约6.8至7.6,然后立即将等份的交联溶液1和溶液2混合。通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:任选地,将包含交联的巯基修饰的透明质酸、未修饰的透明质酸和盐酸利多卡因的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法J
溶解:将巯基修饰的透明质酸和未修饰的透明质酸溶解在水性溶液中;制备包含盐酸利多卡因的单个溶液。
交联:将pH调节至约6.7至7.8后,通过氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸和未修饰的透明质酸的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸和未修饰的透明质酸的水凝胶和包含盐酸利多卡因的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
方法K
溶解:将巯基修饰的透明质酸和未修饰的透明质酸溶解在水性溶液中;制备包含盐酸利多卡因的单个溶液。
交联:将pH调节至约6.7至7.8后,通过氧化剂和氧将巯基基团氧化为二硫桥而使巯基修饰的透明质酸交联。
筛分:将包含交联的巯基修饰的透明质酸和未修饰的透明质酸的水凝胶挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
均质化:将包含交联的巯基修饰的透明质酸和未修饰的透明质酸的水凝胶和包含盐酸利多卡因的溶液均质化,并且任选地挤压通过具有限定筛孔尺寸的滤板(一次或多次)。
灭菌:将水凝胶填充到注射器中后进行高压灭菌。
使用具有锥板系统的Anton Paar MCR 102流变仪进行所有组合物的振荡流变学测量。经27G针(或在没有针的情况下)通过注射将组合物转移到流变仪中。在频率测试期间,在25℃的温度和1Hz的频率下在水凝胶的线性粘弹性区内以恒定变形获得弹性模量。
使用Viscotek TDAmax温度控制的多检测器SEC系统进行测量,该系统包括串联的高灵敏度检测器——光电二极管阵列UV、光散射(RALS和LALS二者)、折射率仪和粘度计。折射率检测器记录样品的浓度,得到各自的分布曲线。结合光散射检测器,确定分子量(MW)。对于尺寸排阻色谱(SEC)分析,将样品用PBS稀释,得到的最终聚合物浓度为0.1mg/mL。
在此测试期间发生的错误或波动通常导致约10%的偏差。
通过将约200mg研究的无菌水凝胶组合物分散在1.8mL磷酸盐缓冲盐水(PBS)中并在室温下孵育2小时来制备用于确定平均还原灭菌后分子量(MRPMW)的样品。通过离心将交联的巯基修饰的透明质酸与游离透明质酸分离。将沉淀物重新分散在PBS中。重复提取/离心步骤后,将残留的凝胶用还原剂(TCEP.HCl(三(2-羧乙基)膦盐酸盐))处理3小时以裂解二硫桥,然后用5N HCl酸化所得溶液(还原)。将还原的巯基修饰的透明质酸用乙醇沉淀,并通过离心回收(来自无菌水凝胶组合物的巯基修饰的透明质酸)。将沉淀物溶解在4mL的水性溶液中,该水性溶液包含浓度为2mg/ml的用于游离巯基部分的封端剂(2-(2-氨基乙基二硫烷基)吡啶-3-羧酸)。室温下孵育3小时之后,用PBS进一步稀释样品。
替代地,通过减法确定交联聚合物的MRPMW。两种方法得到了类似的值。在对包含交联聚合物和游离透明质酸的水凝胶组合物进行灭菌之后,将还原剂添加至水凝胶中以定量地破坏二硫键。然后同时确定其还原形式的巯基修饰的透明质酸和游离透明质酸的MW分布(M
通过确定游离透明质酸的分子量(M
表1中给出了与用于水凝胶生产的HA-SH原料的相应平均分子量(MMW)比较的结果。通常,MRPMW低于MMW。水凝胶组合物的产生影响分子量分布。
表1列出了多种无菌水凝胶组合物,其中组合物之间的主要区别在于交联聚合物的特性,交联聚合物是巯基修饰的透明质酸(HA-半胱胺)的氧化产物。用类似的方法(比较上述方法B和方法H)制得了包含17mg/mL交联HA-半胱胺、5mg/mL未修饰的透明质酸钠和3mg/mL盐酸利多卡因的水凝胶。如上描述确定作为巯基修饰的透明质酸(HA-SH)原料的性质的MMW和修饰度(DoM)以及作为交联聚合物的性质的MRPMW、弹性模量G’和残留巯基含量。
表1:各自包含不同的交联聚合物的10种无菌水凝胶组合物的列表
星号(*)表示未落入权利要求的范围但是被纳入以用于比较的那些实例。S.D.是标准偏差的缩写。
通过测量交联聚合物的残留巯基含量并与巯基修饰的透明质酸聚合物原料的初始修饰度进行比较来监测二硫键的形成。发现在所有10种组合物中,超过98%的聚合物初始可利用巯基在生产过程中被氧化。
交联聚合物的MRPMW和巯基修饰的透明质酸原料中巯基的初始修饰度二者均影响具有相同浓度的交联透明质酸的水凝胶的弹性性质。使用具有较高修饰度的巯基修饰的透明质酸聚合物来生产水凝胶组合物导致更高的交联率,如通过水凝胶的增加的弹性性质清楚表明的。当比较用具有在119μmol/g聚合物至150μmol/g聚合物的范围内的中等巯基修饰度的巯基修饰的透明质酸制备的水凝胶组合物(水凝胶组合物ID2、ID5、ID8和ID10)时,MRPMW对水凝胶的弹性性质的影响是显而易见的。水凝胶组合物ID2、ID5和ID8的弹性模量高于1,000Pa。当比较用具有低修饰度的巯基修饰的透明质酸制备的水凝胶组合物(水凝胶组合物ID1*、ID4*和ID7*)时,观察到相同的效果。对于用具有高修饰度的巯基修饰的透明质酸制备的水凝胶组合物(水凝胶组合物ID3*、ID6*和ID9*),聚合物MRPMW对弹性性质的影响不太明显。
研究了根据本发明的多种组合物以及对比组合物在通过注射植入后随时间的平均贮库体积的发展。测试了表1中总结的十种不同的水凝胶组合物。
使用16只测试动物,将组合物皮内注射到雌性Sprague Dawley大鼠的背部皮肤中,每种组合物平均施用12次。每只大鼠施用8个储库。使用25G针将50μL相应的组合物注射至每个储库,并在188天的总时间段内的不同时间点通过MRI(Siemens Espree 1.5T MRT装置)监测产生的储库的体积。
根据MRI扫描计算各个水凝胶储库体积(mm
表2:第84天和第188天测量的以百分比计的平均相对储库体积
星号(*)表示未落入权利要求的范围但是被纳入用于比较的那些实例。
除了包含初始修饰度低于50μmol巯基/克聚合物的交联巯基修饰的透明质酸的两种组合物(水凝胶组合物ID 1*和ID 4*)外,所有水凝胶储库在至少6个月都可检测到。然而,仅包含具有中等巯基修饰度的巯基修饰的透明质酸并且弹性模量大于1,000Pa(MPRMW大于200kDa)的三种组合物(水凝胶组合物ID 2、ID 5和ID 8)在研究期间的6个月内显示出丰盈效果。在此时间范围内,所有其他组合物的储库体积降低了50%或更多。
根据方法G制备包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸钠的无菌水凝胶组合物。简单地说,将3580mg HA-半胱胺钠盐(干重,MMW 730kDa,修饰度151μmol/g聚合物)、600mg盐酸利多卡因(干重)和1160mg NaCl溶解在185g注射用水中,在室温下机械搅拌约3小时。然后将1000mg透明质酸钠(干重,MW2400kDa)添加到溶液中,在室温下继续再搅拌约3小时。然后将pH 11的磷酸盐缓冲液添加至最终量200g的组合物。将该溶液均质化约15分钟。在室温下孵育过夜后,将现在交联的水凝胶挤压通过筛孔尺寸为200μm的滤板。然后将水凝胶填充到1mL玻璃注射器中,并通过高压灭菌法(121℃/15分钟)进行灭菌。类似于实施例4来确定弹性模量。将水凝胶直接从注射器(无针附接)施加到流变仪上,并且确定G’为1,619±143Pa。无菌水凝胶的pH为7.34,并且同渗重摩为337mOsmol/kg(水凝胶ID11)。
如上描述确定修饰度(DoM)、MRPMW和残留巯基含量并且总结在表3中。
表3:水凝胶组合物的特征
缩写S.D.代表标准偏差。
分别根据如实施例4描述的方法A(未筛分)、方法A(筛分)、方法B(未筛分)和方法E(筛分),使用相同的巯基修饰的透明质酸(MMW 730kDa,修饰度151μmol/g聚合物)制备四种包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸的无菌水凝胶组合物。
所有组合物具有在270至330mOsmol/kg的范围内的同渗重摩和生理上可接受的pH(参见表4)。如上所述测定组合物的弹性模量G’(通过27G针注射后确定)、水凝胶中交联聚合物的MRPMW和残留巯基含量。未测定组合物ID14中的交联聚合物的残留巯基含量和MRPMW。组合物ID12和ID14由同一水凝胶批次生产,唯一的区别是筛分步骤。由于预期筛分不会影响交联聚合物的MRPMW和残留巯基含量,对于组合物ID14可以假定获得与组合物ID12相同的值。结果列于表4。
类似于实施例7中所述的测试设置以每种组合物12次皮内施用对这些组合物进行体内测试。所有组合物在研究的前142天具有丰盈效果(数据未显示),如通过在该时间点和所有先前时间点(第28天、第61天、第84天、第114天)测量的100%或更高的平均相对储库体积证明的。在研究持续168天后,测得组合物ID14和ID15的平均相对储库体积小于100%。在一定时间之后,由于组合物是可生物降解的,所以预期贮库体积减小。表4显示了第84天和第168天的平均相对储库体积的比较。
表4:在第84天和第168天测量的以百分比计的平均相对储库体积
缩写S.D.代表标准偏差。
将修饰度为176μmol巯基/g聚合物的巯基修饰的透明质酸(MMW 750kDa)用于制备包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸钠的无菌水凝胶组合物。根据方法A在具有筛分步骤的情况下制备水凝胶组合物ID16。组合物中交联聚合物的平均还原灭菌后分子量(MRPMW)为408kDa。类似于实施例6测定弹性模量。将水凝胶直接从注射器(没有针附接)施加到流变仪上,并且确定G’为2,052,100mPa。无菌水凝胶的pH为7.17并且同渗重摩为316mOsmol/kg。
类似于实施例7中所述的测试设置以12次皮内施用对组合物进行体内测试。该组合物在81天的研究持续时间内具有丰盈效果(数据未显示),如通过在该时间点和所有先前时间点(第23天、第53天)测量的100%或更高的平均相对储库体积证明的。
将修饰度为142μmol巯基/g聚合物的巯基修饰的透明质酸(MMW 710kDa)用于制备包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸钠的无菌水凝胶组合物。根据方法A在具有筛分步骤的情况下制备水凝胶组合物ID17。组合物中交联聚合物的平均还原灭菌后分子量(MRPMW)为300kDa。类似于实施例4测定弹性模量。将水凝胶直接从注射器(没有针附接)施加到流变仪上,并且确定G’为1,243,500mPa。无菌水凝胶的pH为7.65并且同渗重摩为287mOsmol/kg。类似于实施例7中所述的测试设置以12次皮内施用对组合物进行体内测试。该组合物在133天的研究持续时间内具有丰盈效果(数据未显示),如通过在该时间点和所有先前时间点(第23天、第53天、第81天、第107天)测量的100%或更高的平均相对储库体积证明的。
根据方法B制备包含14mg/mL交联HA-半胱胺、3mg/mL盐酸利多卡因和7mg/mL未修饰的透明质酸钠的无菌水凝胶组合物(ID 18)。简单地说,将2100mg HA-半胱胺(干重,MMW700kDa,修饰度131μmol/g聚合物)、450mg盐酸利多卡因(干重)和1050mg透明质酸钠(干重,MMW 2238kDa)溶解在130g 10mM磷酸盐缓冲液pH 7.1(包含88mM NaCl)中,室温下机械搅拌约17小时。用1M氢氧化钠溶液将pH调节至约pH 7.1后,添加10mM磷酸盐缓冲液pH 7.1(包含88mM NaCl)至最终量为150g组合物。将该溶液均质化约60分钟。然后,添加1.6ml的0.307%(v/v)的过氧化氢溶液。在室温下孵育过夜后,将交联水凝胶填充到1mL玻璃注射器中,并通过高压灭菌法进行灭菌。无菌水凝胶的pH为约7,并且同渗重摩为约270mOsmol/kg。
如上所述确定修饰度(DoM)、MMW、MRPMW和弹性模量G’并且总结在表5中。为确定弹性模量G’,将水凝胶直接从注射器(无针附接)直接施加到流变仪上。
表5:水凝胶组合物的特征
A.双(甘氨酰)-胱胺二盐酸盐的制备:
向胱胺二盐酸盐(1g,4.44mmol)和N-(叔丁氧基羰基)甘氨酸(1.59g,9.10mmol)在无水二氯甲烷:THF=1:1(20mL)中的混合物中首先添加三乙胺(1270μL,9.16mmol),然后添加EDC*HCl(1.75g,9.10mmol)的二氯甲烷溶液。将反应溶液在环境温度下搅拌5小时,然后在减压下蒸发挥发物。将残余物收集到乙酸乙酯(250mL)中,并用1N HCl(2x50mL)、半饱NaHCO
向N-Boc保护的双(甘氨酰)-胱胺(300mg,0.64mmol)的MeOH(5mL)溶液中添加乙酰氯(300μL,4.20mmol)。放热反应停止后,将混合物在密封烧瓶中于环境温度下搅拌5小时,然后添加甲苯(2mL)并蒸发挥发物,直至产物沉淀出来。将白色固体通过抽滤分离,并用正戊烷(2x5mL)洗涤。产量:146mg(67%)。m.p.=184℃(分解);
这种修饰剂允许制备透明质酸-甘氨酰-半胱胺缀合物(图3B)。
B.二硫代二乙烷二基二羰基二氨基二乙酸二酰肼(DGDTPDH)的制备:
向3,3’二硫代二丙酸(2g,9.5mmol)和甘氨酸乙酯盐酸盐(2.66g,19.0mmol)在无水二氯甲烷:THF=1:1(20mL)中的混合物中添加三乙胺(2.78μL,20.0mmol),然后添加EDC*HCl(3.83g,20.0mmol)的二氯甲烷溶液。将反应在环境温度下搅拌5小时,然后用乙酸乙酯(400mL)稀释。将有机层用1N HCl(2x50mL)、半饱和NaHCO
将二乙酯(500mg,1.32mmol)和80%水性水合肼(0.5mL,12.7mmol)在96%EtOH中的混合物回流5小时。冷却至室温后,产物结晶,并通过抽滤收集,并用冷EtOH(2x15mL)充分洗涤。产量:335mg(72%),白色针状。m.p.=197℃(分解)
这种修饰剂允许制备透明质酸-2-巯基-乙基-羰基-氨基-乙酸酰肼缀合物(图3D)。
C.4,4’-二硫代双[1-丁胺]二盐酸盐的制备
根据文献报道的方案(Aufort,M.等人,ChemBioChem,12(4),583-592,2011),由4-氨基丁-1-醇制备4,4’-二硫代双[1-丁胺]二盐酸盐,最后采用N-Boc脱保护并且用MeOH/HCl进行以得到作为二盐酸盐形式的产物:向双氨基甲酸酯(550mg,1.35mmol)的甲醇(6mL)溶液中滴加乙酰氯(0.6mL,8.4mmol)。当放热反应停止时,将混合物回流5小时。然后添加甲苯(6mL),并将混合物减压浓缩。将粗产物与甲苯(6mL)反复共沸,然后通过抽滤分离并用正戊烷(2x6mL)洗涤。产量:340mg(90%),白色固体。m.p.=249℃(分解);
这种修饰剂允许制备N-巯基-正丁基透明质酸酰胺(图3C)。
根据方法B在不添加盐酸利多卡因的情况下制备包含17.9mg/mL交联透明质酸-甘氨酰-半胱胺钠盐(HA-GLYC)和5mg/mL的未修饰的透明质酸钠的水凝胶组合物(ID 19)。简单地说,将537mg HA-GLYC(干重,MMW 610kDa,修饰度162μmol/g聚合物,图3B)和150mg透明质酸钠(干重,MMW 2.4MDa)溶解在26g 0.01M HCl(包含NaCl)中,在室温下机械搅拌约5小时。向19.02g的该溶液中添加2.115mL的100mM磷酸盐缓冲液pH 11.85,这将pH调节至约pH7.4。然后添加273μL的0.3%H
如上所述确定修饰度(DoM)、MMW、残留巯基含量和弹性模量G’并且总结在表6中。为确定弹性模量G’,将水凝胶直接从注射器(无针附接)施加到流变仪。
表6:水凝胶组合物的特征
根据方法A在不添加盐酸利多卡因的情况下制备包含17.9mg/mL交联透明质酸-高半胱氨酸钠盐(HA-HCYS)和5mg/mL的未修饰的透明质酸钠的水凝胶组合物(ID 20)。简单地说,将537mg HA-HCYS(图3A,干重,MMW 610kDa,修饰度136μmol/g聚合物,图3A)和150mg透明质酸钠(干重,MMW 2.4MDa)溶解在26g 0.01M HCl(包含NaCl)中,在室温下机械搅拌约5小时,然后静置1小时以除去气泡。向23.68g的该溶液中添加2.63ml 100mM磷酸盐缓冲液pH12.04,这将溶液的pH调节至约pH 7.2。将混合物在室温下放置48小时以进行交联,然后将交联的水凝胶填充到1mL玻璃注射器中,并通过高压灭菌法进行灭菌。无菌水凝胶的pH为约7.0。
如上所述确定修饰度(DoM)、MMW、残留巯基含量和弹性模量G’并且总结在表7中。为确定弹性模量G’,将水凝胶直接从注射器(无针附接)施加到流变仪。
表7:水凝胶组合物的特征
根据方法B在不添加盐酸利多卡因的情况下制备包含17.9mg/mL交联透明质酸-2-巯基-乙基-羰基-氨基-乙酸酰肼钠盐(HA-DGDTPDH)和5mg/mL的未修饰的透明质酸钠的无菌水凝胶组合物(ID 21)。简单地说,将537mg HA-DGDTPDH(图3D,干重,MMW 770kDa,修饰度134μmol/g聚合物)和150mg透明质酸钠(干重,MMW 2.4MDa)溶解在26g 0.01M HCl(包含192mg NaCl)中,在室温下机械搅拌约5小时。向20.20g的该溶液中添加含有0.041%H
如上所述确定修饰度(DoM)、MMW、残留巯基含量和弹性模量G’,并且总结在表8中。为确定弹性模量G’,将水凝胶直接从注射器(无针附接)施加到流变仪。
表8:水凝胶组合物的特征
根据方法B在不添加盐酸利多卡因的情况下制备包含17.9mg/mL交联的N-巯基-正丁基透明质酸酰胺钠盐和5mg/mL的未修饰的透明质酸钠的无菌水凝胶组合物(ID 22)。简单地说,将537mg N-巯基-正丁基透明质酸酰胺钠盐(图3C,干重,MMW 767kDa,修饰度98μmol/g聚合物)和150mg透明质酸钠(干重,MMW 2.4MDa)溶解在26g 0.01M HCl(包含NaCl)中,在室温下机械搅拌约5小时。向23.48g的该溶液中添加含有0.029%H
如上所述确定修饰度(DoM)、MMW、残留巯基含量和弹性模量G’,并且将平均值总结在表9中。为确定弹性模量G’,将水凝胶直接从注射器(无针附接)施加到流变仪。
表9:水凝胶组合物的特征
将修饰度为140μmol巯基/g聚合物的巯基修饰的透明质酸(MMW 820kDa)用于以工业规模(批量大小17.5kg)制备包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸钠的水凝胶组合物。通过在室温下搅拌约8小时将HA-半胱胺钠盐、盐酸利多卡因、未修饰的透明质酸钠和氯化钠溶解在0.01M HCl中后,将溶液分为两部分。
将溶液的一部分(7560g)在容器B中在真空下孵育过夜。通过向9份溶液中添加1份100mM磷酸盐缓冲液pH 12.3来起始交联,然后添加包含过氧化氢的溶液,使得巯基修饰的透明质酸的游离巯基与过氧化氢的摩尔比为2:1(比较方法B)。容器B中溶液的所得pH为7.7,并且同渗重摩为316mOsmol/kg。
还将溶液的第二部分(5800g)在容器A中在真空下孵育过夜,随后通过向9份溶液中添加1份100mM磷酸盐缓冲液pH 12.3来进行交联(比较方法A;容器A)。代替包含过氧化氢的溶液,将注射用水以相应量添加到物料中。容器A中溶液的所得pH为7.7,并且同渗重摩为312mOsmol/kg。
通过搅拌短暂均质化10分钟后,将两个容器保持在室温下。为了提供用于交联的氧,在10天的整个交联期间向容器A施加+1巴的过量气压(在交联起始后的72小时至96小时的时间段内短暂中断是出于技术问题)。在下表中列出的时间点和位置抽取样品。表面样品取自容器中靠近表面的水凝胶,然而底部样品取自靠近容器底部的水凝胶的下部。如实施例4中所述测量弹性模量(样品未填充在注射器中)。
表10:比较不同交联条件下生产的水凝胶的弹性性质
弹性模量用作监测水凝胶坚度的参数,已知其会因交联而增强。交联起始后直接获得第一个样品。从容器A获得的样品的弹性模量G’为33,729mPa。相比之下,从容器B获得的样品的弹性模量为2,475,700mPa,表明在氧化剂过氧化氢的存在下交联进行快得多。表10中列出的数据进一步证明,当以工业规模使用生产方法A时,在10天的孵育时间内,交联反应在整个物料中没有均匀地进行。向容器施加过量的气压仅在容器A内的物料表面产生更加有效的交联。相比之下,通过添加过氧化氢提供足够量的氧导致几乎瞬时且均匀的交联反应(方法B;容器B)。
将修饰度为140μmol巯基/g聚合物的巯基修饰的透明质酸(MMW 820kDa)用于制备包含17.9mg/mL交联HA-半胱胺钠盐、3mg/mL盐酸利多卡因和5mg/mL未修饰的透明质酸钠的水凝胶组合物。通过在室温下搅拌约16小时将HA-半胱胺钠盐、盐酸利多卡因、未修饰的透明质酸钠和氯化钠溶解在0.01M HCl中后,将溶液分成四等份,每份重约160g。在搅拌下向每份溶液添加约20g 100mM磷酸盐缓冲液pH 12。在均质化15分钟后,将20g稀释的过氧化氢溶液添加到这四份溶液中的每一份中,使得巯基修饰的透明质酸的游离巯基与过氧化氢的摩尔比为2:1以生产水凝胶E100;在水凝胶E50(包含E100的过氧化氢浓度的50%)的生产过程中,巯基修饰的透明质酸的游离巯基与过氧化氢的摩尔比为4:1;在水凝胶E30(包含E100的过氧化氢浓度的30%)的生产过程中,巯基修饰的透明质酸的游离巯基与过氧化氢的摩尔比为约7:1;在水凝胶E10(包含E100的过氧化氢浓度的10%)的生产过程中,巯基修饰的透明质酸的游离巯基与过氧化氢的摩尔比为20:1。在短暂的均质化之后,交联反应在室温下进行而无需进一步搅拌。
在下表中列出的时间点抽取样品。如上所述测量残留巯基含量和弹性模量(样品未填充到注射器中)。由巯基修饰的透明质酸的初始修饰度(140μmol巯基/g聚合物)计算以%计的残留巯基含量。
表11:通过测量样品的残留巯基含量和弹性模量G’监测交联效率
当水凝胶中的残留巯基含量小于20%时,观察到样品的弹性模量G’达到平台(G’在2400Pa至3000Pa范围内)。水凝胶E100的交联在2天内完成。当使用低50%的过氧化氢浓度进行交联(水凝胶E50)时,交联反应进行约3天。使用低90%的过氧化氢浓度进行交联(水凝胶E10),即使在7天后交联也没有完成。
- 包含交联聚合物的水凝胶组合物
- 包含EVA共聚物和EMA共聚物的聚合物共混物的可交联聚合物组合物
