用于新型冠状病毒检测的引物探针组合、试剂盒及方法
文献发布时间:2023-06-19 10:19:37
技术领域
本申请涉及生物检测技术领域,尤其涉及一种用于新型冠状病毒检测的引物探针组合、试剂盒及方法。
背景技术
新型冠状肺炎(Coronavirus Disease 2019,COVID-19)的致病病原体被命名为新型冠状病毒(SARS-CoV-2),患者往往以发热、干咳、乏力为主要表现,重症可导致急性呼吸综合征、多器官功能衰竭甚至死亡,传染途径主要为经呼吸道飞沫和密切接触传播,且人群普遍易感,因此建立一种快速、精准的检测方法就显得尤为重要。
核酸检测作为目前新型冠状病毒检测方法的金标准,在快速诊断、疗效评估以及疫情防控过程中发挥着至关重要的作用。但是常规的核酸检测方法所使用的检测试剂盒不仅需要在一定等级的实验室内进行使用,而且需要有一定检测设备基础和受过相关培训的操作人员,有时候很难快速完成对大规模人群的筛查,或者是小批量样本的快速随到随检,往往需要半天乃至隔天才能得到检测报告,这都增加了患者确诊的时间成本,对于疫情的及时防控产生了阻碍作用。此外,相关技术中也有针对新型冠状病毒抗原抗体的相关检测,检测耗时往往在半小时左右,但是可被检测到的抗体通常在患者感染病毒数天以后,因此受限于其检测的灵敏度和精确性,抗原抗体的快速检测往往被用于快速筛查阶段,核酸检测依旧是公认的确诊新型冠状病毒的标准。
现有的新型冠状病毒的核酸检测试剂盒在使用过程中,往往单次循环耗时久,使得检测往往需要等大批量样本收集齐后才能开始实验,即集中型延迟检测,这种集中型延迟检测往往会给了病毒再次传播的机会;并且,这种检测方法需要专用的PCR(聚合酶链式反应)实验室才能完成检测,无法满足随到随检的快速检测,这也使得被检测人员的流动性变得更加广泛,限制了现有的核酸检测产品的应用范围,无法推动生物分子诊断的普适性。
发明内容
本申请的目的在于提供一种用于新型冠状病毒检测的引物探针组合、试剂盒及方法,以实现对新型冠状病毒的高效准确检测。
本申请是通过以下技术方案实现的:
第一方面,本申请提供一种用于新型冠状病毒检测的引物探针组合,包括:
用于检测新型冠状病毒ORF1ab基因的第一引物探针组,包括如SEQ ID NO.1所示的第一正向引物、如SEQ ID NO.2所示的第一反向引物,和如SEQ ID NO.3所示的第一探针;
用于检测新型冠状病毒N基因的第二引物探针组,包括如SEQ ID NO.4所示的第二正向引物、如SEQ ID NO.5所示的第二反向引物,和如SEQ ID NO.6所示的第二探针;以及,
用于检测内标基因的第三引物探针组,包括如SEQ ID NO.7所示的第三正向引物、如SEQ ID NO.8所示的第三反向引物,和如SEQ ID NO.9所示的第三探针。
进一步地,如SEQ ID NO.3所示的第一探针的5’端标记的荧光基团为FAM;如SEQID NO.6所示的第二探针的5’端标记的荧光基团为HEX;如SEQ ID NO.9所示的第三探针的5’端标记的荧光基团为CY5。
第二方面,本申请提供一种上述的引物探针组合在制备用于新型冠状病毒检测的试剂盒方面的应用。
第三方面,本申请提供一种用于新型冠状病毒检测的试剂盒,包括包括核酸快速扩增反应液、核酸快速扩增酶混合液、样本释放剂、阳性对照和阴性对照,其中,所述核酸快速扩增反应液包括上述的引物探针组合。
进一步地,所述引物探针组合中的每种引物在所述核酸快速扩增反应液中的浓度为0.2-1μM,所述引物探针组合中的每种探针在所述核酸快速扩增反应液的浓度为0.2-1μM。
进一步地,所述核酸快速扩增反应液还包括MgCl2、缓冲液和dNTP溶液。
进一步地,所述核酸快速扩增酶混合液包括逆转录酶、核酸酶抑制剂以及具有热启动特性的DNA快速聚合酶;其中,所述逆转录酶为RNaseH活性缺失的逆转录酶,所述具有热启动特性的DNA快速聚合酶的扩增速度不低于50bp/s。
进一步地,所述逆转录酶在所述核酸快速扩增酶混合液中的浓度为4-12U/μL,所述DNA快速聚合酶在所述核酸快速扩增酶混合液中的浓度为0.02-0.2U/μL。
进一步地,所述阳性对照包括含有ORF1ab基因、N基因以及内标基因RnaseP的体外转录RNA片段;所述阴性对照为经焦炭酸二乙酯处理过的无核酶水。
第四方面,本申请提供一种新型冠状病毒的检测方法,利用上述的试剂盒进行新型冠状病毒核酸的检测。
实施本申请的上述技术方案,具有如下有益效果:
本申请的引物探针组合如SEQ ID NO.1-9所示,利用本申请的引物探针组合能够检测新型冠状病毒核酸的ORF1ab基因片段和N基因片段,从而可以实现新型冠状病毒的精确检测;本申请的试剂盒适用于常规的荧光定量PCR方法以及数字PCR方法等,采用本申请的试剂盒进行新型冠状病毒的检测具有快速精准的特点,能够大大缩短整个核酸扩增过程的时间,从而能够实现对新型冠状病毒的高效准确检测。
附图说明
为了更清楚地说明本申请实施例或现有技术中的技术方案和优点,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它附图。
图1为本申请实施例中采用荧光定量方法进行新型冠状病毒检测的流程示意图;
图2为基于本实施例中的试剂盒与现有技术中的试剂盒的荧光定量PCR检测结果对比示意图;
图3为ORF1ab基因片段的扩增曲线检测结果;
图4为N基因片段的扩增曲线检测结果;
图5表示ORF1ab基因片段扩增结果的熔解曲线;
图6表示N基因片段扩增结果的熔解曲线;
图7为本申请实施例中采用数字PCR方法进行新型冠状病毒检测的流程示意图;
图8为利用本申请实施例的试剂盒检测ORF1ab靶标的重复性及稳定性的结果图;
图9为利用本申请实施例的试剂盒检测N靶标的重复性及稳定性的结果图;
图10为利用本申请实施例的试剂盒检测RNase P靶标的重复性及稳定性的结果图;
图11为基于本申请实施例的试剂盒的数字PCR检测与现有技术中的试剂盒进行荧光定量检测的结果对比图;
图12为本申请实施例临床样本的检测结果;
图13为图12对应的临床样本的浓度结果;
图14为三重靶标在不同荧光通道下的结果;
图15为图14对应的时间温度曲线。
具体实施方式
为使本申请的目的、技术方案和优点更加清楚,下面将结合实施例对本申请作进一步地详细描述。显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本申请保护的范围。
需要说明的是,本申请的说明书和权利要求书及上述附图中的术语“第一”、“第二”、“第三”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本申请的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或服务器不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
实施例
针对现有技术中的无法快速精准高效地进行新型冠状病毒核酸检测的缺陷,研发一种能够快速精准检测新型冠状病毒的诊断试剂,以实现对待测样本高效、准确的检测,是疫情防控的迫切需求。
为此,本申请实施例提供一种用于新型冠状病毒检测的引物探针组合,新型冠状病毒具体为SARS-CoV-2,本实施例中的引物和探针的序列如下:
用于检测新型冠状病毒ORF1ab基因的第一引物探针组合,包括:
第一正向引物序列(5’-3’):GTGARATGGTCATGTGTGGCGG(SEQ ID No.1),
第一反向引物序列(5’-3’):CARATGTTAAASACACTATTAGCATA(SEQ ID NO.2),
第一探针(5’-3’):CAGGTGGAACCTCATCAGGAGATGC(SEQ ID NO.3),
其中,第一探针为Taqman探针,5’端的荧光报告基团为FAM,3’端的淬灭基团为BHQ1。
用于检测新型冠状病毒N基因的第二引物探针组合,包括:
第二正向引物序列(5’-3’):GGGGAACTTCTCCTGCTAGAAT(SEQ ID No.4),
第二反向引物序列(5’-3’):CAGACATTTTGCTCTCAAGCTG(SEQ ID NO.5),
第二探针(5’-3’):TTGCTGCTGCTTGACAGATT(SEQ ID NO.6),
其中,第二探针为Taqman探针,5’端的荧光报告基团为HEX,3’端的淬灭基团为BHQ1。
用于检测内标基因的第三引物探针组合,内标基因具体为Rnase P基因,包括:
第三正向引物序列(5’-3’):AGATTTGGACCTGCGAGCG(SEQ ID No.7),
第三反向引物序列(5’-3’):GAGCGGCTGTCTCCACAAGT(SEQ ID NO.8),
第三探针(5’-3’):TTCTGACCTGAAGGCTCTGCGCG(SEQ ID NO.9),
其中,第三探针为Taqman探针,5’端的荧光报告基团为CY5,3’端的淬灭基团为BHQ2。
本实施例中,如SEQ ID NO.3/SEQ ID NO.6/SEQ ID NO.9所示的探针核苷酸序列的5’端标记荧光基团,依次标记FAM、HEX、CY5。利用本申请的引物探针组合能够检测新型冠状病毒核酸的ORF1ab基因片段和N基因片段,从而可以实现新型冠状病毒的精确检测。
本申请的另一实施例提供一种上述实施例中的引物探针组合在制备用于新型冠状病毒检测的试剂盒方面的应用,能够实现新型冠状病毒的精确检测。
本申请的另一实施例提供一种用于新型冠状病毒检测的试剂盒,包括核酸快速扩增反应液、核酸快速扩增酶混合液、样本释放剂、阳性对照和阴性对照,其中,核酸快速扩增反应液包括上述实施例中的引物探针组合。
在一个具体的实施方式中,核酸快速扩增反应液中包括待测靶标ORF1ab、N以及内标RNaseP的特异性引物和探针。具体地,引物探针组合中的每种引物在核酸快速扩增反应液中的浓度为0.2-1μM,引物探针组合中的每种探针在核酸快速扩增反应液的浓度为0.2-1μM。
在一个具体的实施方式中,核酸快速扩增反应液还包括MgCl
本领域技术人员可以理解的是,在其他的一些实施方式中,还可以根据具体情况和实际需要,向核酸快速扩增反应液中加入其他的成分,本申请实施例对此不作具体限定。
在一个具体的实施方式中,核酸快速扩增酶混合液包括逆转录酶、核酸酶抑制剂以及具有热启动特性的DNA快速聚合酶。DNA快速聚合酶是一种扩增速度不低于50bp/s的DNA聚合酶,其是常规的DNA聚合酶扩增速度的4-5倍,因此在靶标核酸扩增过程中,常规的退火、延伸步骤的时间能够缩短至常规反应时间的五分之一,这样就能使得常规耗时约1min甚至更长的PCR单次循环减少缩短至十几秒甚至是几秒,总计的35至45个循环消耗的总时间将被缩短近30min;如果配备有快速的升降温平台来继续缩短PCR热循环过程中的升降温耗时,将能大大缩小整个PCR检测耗时,将传统耗时数小时(一般在2h左右)的核酸检测反应过程缩短至分钟数量级,从而能够及时有效地检测新型冠状病毒。
具体地,逆转录酶为RNaseH活性缺失的逆转录酶,逆转录酶在核酸快速扩增酶混合液中的浓度为4-12U/μL。
具体地,具有热启动特性的DNA快速聚合酶的扩增速度不低于50bp/s,DNA快速聚合酶在核酸快速扩增酶混合液中的浓度为0.02-0.2U/μL。
在一个具体的实施方式中,阳性对照为阳性标准品,包括含有ORF1ab基因、N基因以及内标基因RnaseP的体外转录RNA片段,阴性对照为阴性质控品,为经焦炭酸二乙酯处理过的无核酶水。
在一个具体的实施方式中,试剂盒包装规格可以为24反应/盒,其中每盒包括核酸快速扩增反应液,其规格为300μL/管;核酸快速扩增酶混合液,其规格为60μL/管;样本释放剂,其规格为1mL/管;阳性对照,其规格为200μL/管;阴性对照,其规格为200μL/管。当然,在其他的一些实施方式中,本领域技术人员还可以对试剂盒的规格作出任意适当的调节,本申请实施例对此不作限定。
本申请的另一实施例还提供一种新型冠状病毒的检测方法,利用上述实施例中的试剂盒进行新型冠状病毒核酸的检测。
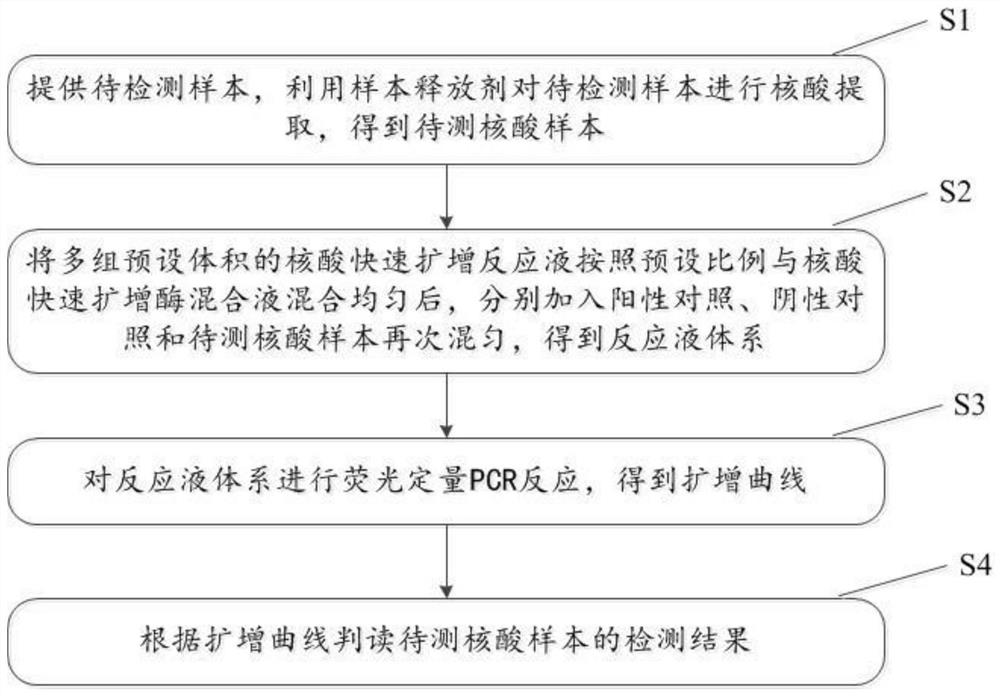
在一个具体的实施方式中,参阅图1,本实施例中的检测方法包括以下步骤:
S1:提供待检测样本,利用样本释放剂对待检测样本进行核酸提取,得到待测核酸样本;
在一个具体的实施方式中,待检测样本包括血清、血浆样本、鼻咽拭子样本、痰液、肺泡灌洗液等,其中,鼻咽拭子样本保存在TE缓冲液/生理盐水基质中。
具体地,在样本处理区进行本实施例中的样本处理操作,首先取出试剂盒中的样本释放剂,待平衡至室温后,混匀待用。
对于血清、血浆、鼻咽拭子样本,吸取10μL样本释放剂加入到PCR反应管中,每管加入待检测样本5μL-15μL,优选地为10μL,若样本比较浑浊或可见明显沉淀,可以离心处理,例如2000rpm离心30秒后吸取10μL上层清液,用移液器吸打3-5次混匀,室温静置10分钟,即得待测核酸样本。
对于痰液、肺泡灌洗液等样本,取100-200μL混合均匀的待检测样本于1.5ml离心管中,12000rpm离心10分钟;弃上清液后向沉淀中加入50μL样本释放剂,并震荡混匀,静置10分钟,作为待测核酸样本备用。
S2:将多组预设体积的核酸快速扩增反应液按照预设比例与核酸快速扩增酶混合液混合均匀后,分别加入阳性对照、阴性对照和待测核酸样本再次混匀,得到反应液体系。
具体地,将试剂盒中所需组分解冻,振荡混匀并短暂离心后备用。根据待测核酸样本数量、阳性对照和阴性对照数量,配制核酸快速扩增反应混合液。以10μL待测核酸样本为例,配制总体积为15μL的核酸快速扩增反应混合液,其主要包含12.5μL的核酸快速扩增反应液和2.5μL的核酸快速扩增酶混合液,即预设比例为5:1。将15μL的核酸快速扩增反应混合液加入到一定数量标记好的PCR扩增管内待用,分别加入与管标记对应的10μL阳性对照(无需抽提直接使用)、10μL阴性对照(无需抽提直接使用)和10μL待测核酸样本混合均匀,形成终体积为25μL/管的反应液体系,盖紧反应管,瞬时低速离心以待上机检测。
需要说明的是,此处以10μL待测核酸样本,形成25μL的反应液体系为例,确定核酸快速扩增反应液的预设体积为12.5μL,在其他的一些实施例中,本领域技术人员可以根据待测核酸样本的体积以及反应液体系的体积,对核酸快速扩增反应液的预设体积进行适当的调节,以实现与本实施例中相同的作用。
S3:对反应液体系进行荧光定量PCR反应,得到扩增曲线。
在一个具体的实施方式中,将配制好的反应液体系加入到PCR扩增管中,在荧光PCR仪器上完成实时荧光定量PCR的检测;分别选择FAM、HEX及CY5通道检测新冠病毒核酸中特异性靶标ORF1ab、N及内标RNaseP。
在一个具体的实施方式中,荧光定量PCR反应依次包括逆转录、预变性和变性延伸。鉴于使用了优选的具有热启动特性的DNA快速聚合酶,因此在PCR循环过程中的时间设置可以相较于常规获得明显的缩短。
具体地,逆转录为温度42℃-50℃,时间30s-1min,循环数1;预变性温度95℃,时间30s-1min,循环数1;两步法PCR程序可以设置为温度95℃,时间2-5s;温度58℃,时间4-10s,循环数45;或者,三步法PCR程序设置为温度95℃,时间2-5s;温度58℃,时间4-6s;温度72℃,时间2-4s,循环数45。
需要说明的是,对于上述的荧光定量PCR反应中涉及的具体参数,例如温度、时间等,本领域技术人员可以根据具体情况和实际需要进行任意适当的调节,本申请实施例对此不作具体限定。
S4:根据扩增曲线判读待测核酸样本的检测结果。
在一个具体的实施方式中,在被测样品结果有效的前提下,当被测样品在FAM通道或HEX通道下出现明显的S型扩增曲线,且Ct值≤40,则表明该样品为阳性;当被测样品在CY5通道内出现明显的S型扩增曲线,且Ct值≤40,当时FAM通道和HEX通道下均无明显的S型扩增曲线或无Ct值,则表明该样品为阴性。
首先,需在同一次检测实验中同时满足以下要求,检测结果才有效,否则本次检测无效,需重新进行检测:阴性对照结果为FAM、HEX通道及CY5通道均无Ct值或Ct值>40;阳性对照结果为FAM、HEX通道及CY5通道均Ct值<35。
对于待测核酸样本,可能出现的检测结果如下:
(a)阳性:待测核酸样本在FAM或HEX通道检测到典型的S型扩增曲线且Ct值≤40;
(b)阴性:待测核酸样本在FAM或HEX通道均未检测到典型的S型扩增曲线或Ct值>40,CY5通道有扩增曲线,且Ct值≤40;
(c)无效:待测核酸样本在FAM、HEX、CY5通道均未检测到典型的S型曲线或Ct>40,可能是待测核酸样本中靶标含量过低或者是其他干扰物导致反应被抑制,因此判定为无效结果,应排查原因后重新采样进行检测实验。
需要说明的是,在根据扩增曲线判读待测核酸样本的检测结果时,本领域技术人员可以根据具体情况对上述Ct值进行任意适当的调节,本申请实施例对此不作限定。
本实施例中,利用本申请实施例中的试剂盒,采用常规的荧光定量PCR方法进行检测,检测结果如图2中的a所示,图2中的b所示为现有技术中的新型冠状病毒检测试剂盒扩增过程温度曲线,RT-PCR(Reverse Transcription-Polymerase Chain Reaction,逆转录PCR)过程耗时约为2h,通过图2可以看出,利用本申请实施例中的试剂盒,能将常规数小时的RT-PCR过程缩短至45min以内,相比于现有技术,具有快速精准的特点。
为了验证上述实验的准确性和重复性,根据上述步骤,对梯度稀释的国家计量院标准品进行测试,本标准品通过体外转录获得了新型冠状病毒重要特征基因,其中包含ORF1ab基因片段和N基因等,从中国计量科学研究院购置。具体地,实时荧光PCR仪器型号为罗氏480,其参数设置为逆转录温度为42℃,时间1min,循环数1;预变性温度95℃,时间1min,循环数1;变性温度95℃,时间2s,退火及延伸温度58℃,时间4s,循环数45,图3-4为检测结果,图3为ORF1ab基因片段的扩增曲线检测结果,图4为N基因片段的扩增曲线检测结果,均表现出标准的S型扩增曲线,且梯度曲线之间的Ct值间隔均匀,证明了扩增体系的效率及均一性良好,实验的准确性及重复性优良。此外,也表明本申请实施例中的快速检测试剂盒在常规的荧光PCR仪上具有优良的检测效果。
另外,使用所设计的引物组合和SYBR Green染料,同样对梯度稀释的系列标准品进行检测,采用与上述获得扩增曲线中相同的仪器设置参数,以获得熔解曲线,结果如图5-6所示。图5表示ORF1ab基因片段扩增结果的熔解曲线,图6表示N基因片段扩增结果的熔解曲线,可以看出,均表现特异性的单峰现象,进一步证明本申请实施例中试剂盒内的引物序列具有优良的特异性。
在一个可选的实施方式中,在上述步骤S2之后,还可以采用快速定量检测新型冠状病毒的数字PCR(Digital PCR,简称dPCR)方法进行检测,参阅图7,具体为:
S5:对反应液体系进行数字PCR反应。
在一个具体的实施方式中,通过快速绝对定量的数字PCR系统即快速PCR仪器进行新型冠状病毒核酸的绝对定量检测,在进行PCR热循环过程中,升温速率和降温速率均达到10℃/s以上的就可以被称作快速PCR仪器,该系统包括样本反应芯片和用于对样本反应芯片加热的微加热盘阵列,以及与微加热盘连接实现温度控制的温控系统,该系统可实现大于100℃/s的升温速度和大于50℃/s的降温速度。具体地,在上述的步骤S2配制好反应液体系后,使用数字PCR仪器进行进样,生成20000-100000个微米量级的小型反应单元,包括但不限于微滴、微腔、微阵列;随后设置PCR循环过程参数,具体地,逆转录为温度42-50℃,时间15s-1min,循环数1;预变性温度95℃,时间15s-1min,循环数1;两步法PCR程序可以设置为温度95℃,时间1-3s;温度58℃,时间4-10s,循环数45;或者,三步法PCR程序可以设置为温度95℃,时间1-3s;温度58℃,时间4-6s;温度72℃,时间2-4s,循环数45。
S6:对数字PCR反应进行结果判读,得到待测核酸样本的检测结果。
在被测样品结果有效的前提下按照以下方式进行结果判读,其中,“P”指阳性微滴数≥4,“N”指阳性微滴数为0,“ND”指0<阳性微滴数<4,结果判读具体可以包括以下几种情况:
(a)待测核酸样本FAM(ORF1ab)为P,HEX(N)为P,CY5(内标RNaseP)为P或ND;或者,待测核酸样本FAM(ORF1ab)和HEX(N)单通道为P,CY5(内标RNaseP)为P或ND,则报告为检测到新型冠状病毒。
(b)待测核酸样本FAM(ORF1ab)和HEX(N)单或双通道为ND,CY5(内标RNaseP)为P,则复检:如果结果与之前一致则报告为检测到新型冠状病毒;如不一致报告为未检出。
(c)待测核酸样本FAM(ORF1ab)和HEX(N)为N,CY5(内标RNaseP)为P,则报告为未检测到新型冠状病毒。
(d)待测核酸样本CY5(内标RNaseP)为N,则报告为结果无效,重新实验。
需要说明的是,对于上述的数字PCR反应中涉及的具体参数,例如温度、时间等,以及,对于上述结果判读时“P”和“ND”的具体数值,本领域技术人员可以根据具体情况和实际需要进行任意适当的调节,本申请实施例对此不作具体限定。
利用本申请实施例中的试剂盒进行新型冠状病毒的检测,结合本实施例中的数字PCR系统,可以实现单个循环少于10s,总耗时在5-10min完成对新冠病毒核酸的绝对定量检测,从而达到快速精准定量检测样品中新型冠状病毒的目的,大大提升2019新型冠状病毒的检测效率。
为了验证本申请实施例中试剂盒的重复性及稳定性,配合核酸快速绝对定量数字PCR系统进行了梯度稀释标准品重复性测试。由于国家计量院标准品内仅有ORF1ab和N双重靶标,为了更好地模拟真实的病例样本检测,将从人唾液核酸提取到的靶标RNase P与初始浓度的标准品模板进行均匀混合,随后将其进行梯度稀释。根据国家计量院标准品内说明书提供的初始模板浓度,稀释后的ORF1ab靶标和N靶标的浓度为10、50、100、1000、5000copies/μL,而由于未定量RNase P靶标的浓度,因此将稀释梯度作为绘制其重复性及稳定性测试结果的横坐标,稀释梯度为10
进一步地,本申请实施例基于本申请试剂盒进行数字PCR检测的检测结果,与现有技术中的一试剂盒基于qPCR仪器(型号为罗氏480)的检测结果进行了对比,对比结果见图11,从图中可以看出,基于本申请实施例中试剂盒通过数字PCR方法进行检测的检测结果,与基于现有技术中的试剂盒通过实时荧光定量方法进行检测的检测结果,具有较好的一致性。
另外,本申请实施例中的试剂盒,配合基于核酸快速绝对定量的数字PCR系统,对临床样本进行测试,不仅能够判断样本的阴阳性,还能计算获得样本内的病毒载量。例如,提供9个待检测的临床样本,对临床样本进行检测的过程具体如下:
加样:使用与快速数字PCR系统相匹配的微流控芯片形成20000-30000个微米级的液滴反应单元。
扩增:程序设置为:执行42℃的逆转录15s,然后95℃的预变性15s,最后实现快速PCR反应40个循环,约5min。
结果判读:选择FAM、HEX和CY5通道进行检测,在系统稳定的情况下进行结果的判读,其中,系统稳定是指内标基因RNase P在CY5通道下能观察到明显的阳性液滴,且阳性对照和阴性对照的结果均正常。可能出现的结果如下:
(1)检测结果呈阳性:在FAM或HEX通道内检测到明显的阳性液滴,并可以通过计算获得样品内病毒拷贝数,计算依据为泊松分布方程。
(2)检测结果呈阴性:在FAM以及HEX通道内都未检测到明显的阳性液滴。
图12-13示出了上述9个待检测的临床样本的检测结果,图12中的A为阴性对照,B为阳性对照,对已经确诊的6例新型冠状病毒患者的核酸样本1-6均准确检测出阳性,而3例健康人的核酸样本7-9均未在FAM和HEX通道下检测到阳性液滴,表1为根据泊松分布方程计算的各样本内病毒拷贝数结果。
表1.确诊病人及健康人样本核酸检测结果
进一步地,基于本申请实施例中的快速检测试剂盒体系,结合快速绝对定量的数字PCR系统,对RT-PCR中的每个步骤耗时进行缩短测试,以获得超快的定性分析检测,定性分析是指通过发现有明显的阳性液滴信号出现,证明此次进样样本中存在靶基因即新冠特异性基因片段,从而表明样本是阳性样本。在一个具体的实施方式中,单次循环总耗时被缩短至4s以内,总计循环数设置为28个,实现了2分钟内的超快RT-PCR反应,如图14所示分别是三重靶标(新型冠状病毒特异性靶基因ORF1ab基因片段和N基因片段、内标基因RNase P基因片段)在不同荧光通道(FAM、HEX以及Cy5)下的结果,液滴有明显的阴阳性之分,阳性液滴灰度明显高于阴性液滴。此外,时间温度曲线如图15所示,整个检测的耗时小于2分钟,说明本申请试剂盒在快速定性分析检测新型冠状病毒时,还具有更快的检测效率潜力,结合数字PCR系统可以快速实现2分钟内的RT-PCR反应,完成阴阳性样本的区分。因此,本申请实施例中的试剂盒具有新型冠状病毒核酸快速筛查、定性分析样本的能力,且配合快速PCR仪器能将这种定性分析缩短至5分钟以内。
本申请的上述实施例,具有如下有益效果:
本申请实施例中的引物探针组合如SEQ ID NO.1-9所示,利用本申请的引物探针组合能够检测新型冠状病毒核酸的ORF1ab基因片段和N基因片段,从而可以实现新型冠状病毒的精确检测。
本申请实施例中的试剂盒适用于常规的荧光定量PCR方法以及数字PCR方法等,采用本申请的试剂盒进行新型冠状病毒的检测具有快速精准的特点,能够大大缩短整个核酸扩增过程的时间,从而能够实现对新型冠状病毒的高效准确检测。
本申请能将常规数小时的PCR过程缩短至45min以内,配合快速PCR仪器甚至可以将整个核酸扩增过程缩短至5min左右,从而达到快速精准定量检测样品中新型冠状病毒的目的,大大提升2019新型冠状病毒的检测效率。
需要说明的是:上述本申请实施例先后顺序仅仅为了描述,不代表实施例的优劣。且上述对本申请特定实施例进行了描述。其它实施例在所附权利要求书的范围内。在一些情况下,在权利要求书中记载的动作或步骤可以按照不同于实施例中的顺序来执行并且仍然可以实现期望的结果。
以上所述是本申请的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本申请的保护范围。
序列表
<110> 中国科学院上海微系统与信息技术研究所
<120> 用于新型冠状病毒检测的引物探针组合、试剂盒及方法
<160> 9
<170> SIPOSequenceListing 1.0
<210> 1
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
gtgaratggt catgtgtggc gg 22
<210> 2
<211> 26
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
caratgttaa asacactatt agcata 26
<210> 3
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
caggtggaac ctcatcagga gatgc 25
<210> 4
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ggggaacttc tcctgctaga at 22
<210> 5
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
cagacatttt gctctcaagc tg 22
<210> 6
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
ttgctgctgc ttgacagatt 20
<210> 7
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
agatttggac ctgcgagcg 19
<210> 8
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
gagcggctgt ctccacaagt 20
<210> 9
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
ttctgacctg aaggctctgc gcg 23
- 一种用于新型冠状病毒突变株检测的引物探针组合、试剂盒及分型检测方法
- 用于新型冠状病毒检测的引物探针组合、试剂盒及方法
