骨缺损修复组织工程支架及其制备方法
文献发布时间:2023-06-19 11:24:21
技术领域
本发明涉及骨修复领域,特别涉及骨缺损修复组织工程支架及其制备方法。
背景技术
骨关节置换是一种常见的骨关节治疗手段,例如,全髋关节翻修术(revisiontotal hip arthroplasties,RTHA)通常用于治疗晚期髋关节疾病,利用骨缺损修复组织工程支架(又称关节假体)和宿主骨床之间进行骨整合,使宿主骨床和关节假体之间直接成骨,从而达到治疗的目的。
Ti6Al4V合金具有耐腐蚀性、高机械强度和断裂韧性等特点,通常用作支架材料。为了改善Ti6Al4V的生物学功能,相关技术利用Ti6Al4V经3D打印技术制备得到具有渐变多孔结构的梯度化3D打印Ti支架,在Ti支架的纤维表面形成PDA涂层,以及在PDA涂层表面吸附的BMP-2,形成Ti6Al4V支架。
在实现本发明的过程中,本发明人发现现有技术中至少存在以下问题:
相关技术提供的Ti6Al4V支架制备方法复杂,并且,其与宿主骨床之间的骨整合强度还有待提高。
发明内容
鉴于此,本发明提供一种骨缺损修复组织工程支架及其制备方法,能够解决上述技术问题。
具体而言,包括以下的技术方案:
一方面,本发明实施例提供了一种骨缺损修复组织工程支架,所述骨缺损修复组织工程支架包括:金属支架本体、接枝于所述金属支架本体上的BMSC亲和肽和BMP-2模拟肽。
在一些可能的实现方式中,金属支架本体的表面全部被所述BMSC亲和肽和所述BMP-2模拟肽所占据。
在一些可能的实现方式中,所述BMSC亲和肽与所述BMP-2模拟肽的附着量比例为1:0.5-2。
在一些可能的实现方式中,所述金属支架本体的材质为钛、钛合金、铌、铌合金、或者不锈钢。
在一些可能的实现方式中,所述金属支架本体的材质为钛合金。
另一方面,本发明实施例还提供了上述任一项骨缺损修复组织工程支架的制备方法,所述制备方法包括:
利用胺化剂对金属支架本体进行胺化处理,获得胺化的支架本体;
使所述胺化的支架本体在交联剂溶液中孵育第一设定时间,获得交联基团修饰的支架;
使所述交联基团修饰的支架浸入肽溶液中第二设定时间,得到所述骨缺损修复组织工程支架,其中,所述肽溶液中包括BMSC亲和肽和BMP-2模拟肽。
在一些可能的实现方式中,所述胺化剂为1,6-己二胺、甲胺、二甲胺、乙胺、二乙胺、正丙胺、异丙胺、或者环己胺。
在一些可能的实现方式中,所述交联剂溶液为质量浓度为1mg/m-2mg/mL的Sulfo-SMCC交联剂溶液。
在一些可能的实现方式中,所述胺化处理在30℃-40℃下进行。
在一些可能的实现方式中,所述交联基团修饰的支架在所述肽溶液中的浸泡温度为在1℃-5℃。
本发明实施例提供的技术方案的有益效果至少包括:
本发明实施例提供的骨缺损修复组织工程支架包括:金属支架本体、接枝于金属支架本体上的BMSC亲和肽和BMP-2模拟肽。通过使BMSC亲和肽和BMP-2模拟肽同步结合到金属支架本体的表面,利于在宿主骨床和关节假体表面之间的界面上募集足够多的BMSC细胞,并且,这些BMSC细胞还能够获得良好的成骨分化能力,利于显著改善宿主骨床和关节假体之间的骨整合强度。另外,BMSC亲和肽和BMP-2模拟肽可以通过化学接枝的方式偶联于金属支架本体的表面,使得该工程支架的制备方法较为简单,便于规模化推广应用。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例提供的不同支架的表面图像;
图2为本发明实施例提供的TBABM-FITC/RD支架的三维图像;
图3为本发明实施例提供的各支架的XPS图;
图4为本发明实施例提供的BMSC亲和肽、玻璃、BMP-2模拟肽的XRD衍射图;
图5为本发明实施例提供的不同支架的XRD衍射图;
图6为本发明实施例提供的不同支架的水接触角图像;
图7为本发明实施例提供的不同支架的AFM图像;
图8为本发明实施例提供的用于示意BMSC特性的光学显微镜图像;
图9为本发明实施例提供的不同支架通过CCK-8测定法测量得到的BMSC增殖示意图;
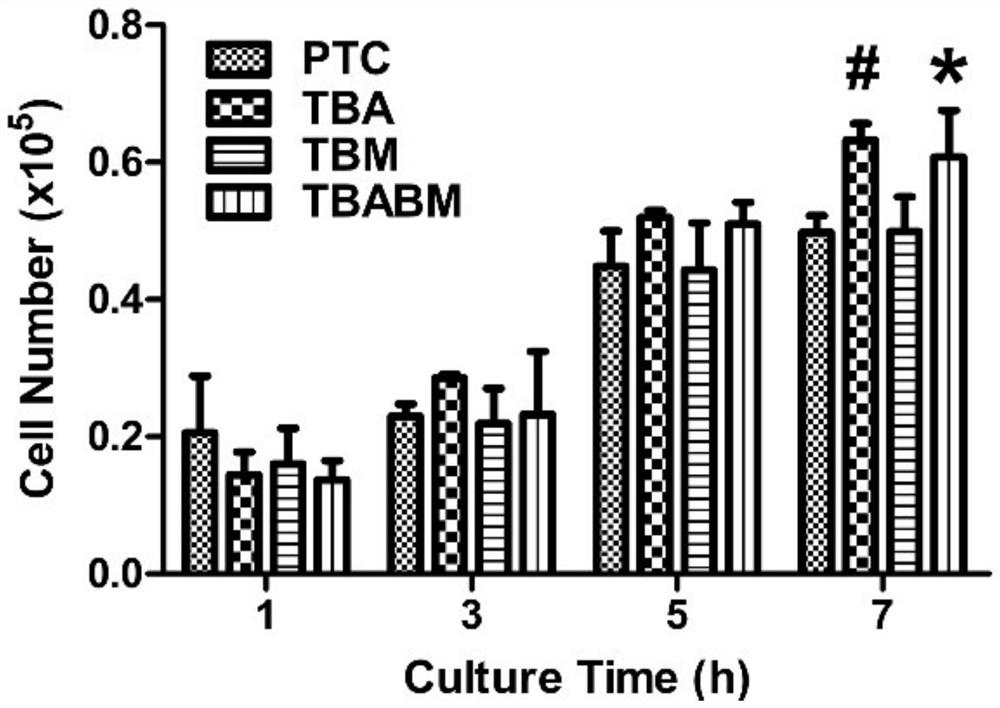
图10为本发明实施例提供的最初附着在不同支架中的BMSC的数量示意图;
图11为本发明实施例提供的各支架在孵育24小时后,BMSC在不同的支架中伸展形态示意图;其中,标号a-d为CFM图像,示出了使用CFM观察FITC-鬼笔环肽染色的BMSC的细胞骨架。标号e-h为SEM图像,示出了使用SEM检测BMSC的伸展形态;
图12-1为本发明实施例提供的不同支架中BMSC成骨基因ALP表达的RT-qPCR分析示意图;
图12-2为本发明实施例提供的不同支架中BMSC成骨基因COL I表达的RT-qPCR分析示意图;
图12-3为本发明实施例提供的不同支架中BMSC成骨基因OCN表达的RT-qPCR分析示意图;
图12-4为本发明实施例提供的不同支架中BMSC成骨基因OPN表达的RT-qPCR分析示意图;
图13-1为本发明实施例提供的免疫荧光分析不同支架中BMSC成骨蛋白OCN的合成效果示意图;
图13-2为本发明实施例提供的免疫荧光分析不同支架中BMSC成骨蛋白OPN的合成效果示意图;
图14-1为本发明实施例提供的将支架植入兔右膝内侧股骨髁,行X线检查得到的前后X线片;
图14-2为本发明实施例提供的将支架植入兔右膝内侧股骨髁,行X线检查得到的侧面X光片;
图14-3为本发明实施例提供的支架植入兔右膝内侧股骨髁12周后,各支架的骨整合的组织学分析;其中,a-d,HE染色的代表性图像;e-h,Masson三色染色的代表图像;图i-l,VG染色的代表性图像。比例尺=400μm;
图14-4为本发明实施例提供的不同支架和宿主骨之间骨整合的机械强度示意图;其中,A为最大负荷;B为刚度;C为最大负载的能量。
具体实施方式
为使本发明的技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
骨关节置换是一种常见的骨关节治疗手段,例如,全髋关节翻修术(revisiontotal hip arthroplasties,RTHA)通常用于治疗晚期髋关节疾病,利用骨缺损修复组织工程支架(又称关节假体)和宿主骨床之间进行骨整合,使宿主骨床和关节假体之间直接成骨,从而达到治疗的目的。
Ti6Al4V合金,又称Ti-6Al-4V合金,具有耐腐蚀性、高机械强度和断裂韧性等特点,通常用作支架材料。为了改善Ti6Al4V的生物学功能,相关技术利用Ti6Al4V经3D打印技术制备得到具有渐变多孔结构的梯度化3D打印Ti支架,在Ti支架的纤维表面形成PDA涂层,以及在PDA涂层表面吸附的BMP-2,形成Ti6Al4V支架。
然而,相关技术提供的Ti6Al4V支架制备方法复杂,并且,其与宿主骨床之间的骨整合强度还有待提高。特别地,Paprosky III型和Paprosky IV型股骨缺损患者行髋关节翻修术后,股骨侧大块骨缺损,导致股骨假体与骨床之间骨整合强度较差,使股骨侧假体失败率过高,可见,为了提高骨缺损修复效果,如何提高骨整合强度是关键。
一方面,本发明实施例提供了一种骨缺损修复组织工程支架,该骨缺损修复组织工程支架包括:金属支架本体、接枝于金属支架本体上的BMSC亲和肽和BMP-2模拟肽。
研究发现,骨髓间充质干细胞(bone marrow mesenchyml stem cell,BMSC)能有效促进缺血组织的血流灌注,促进创伤组织愈合。BMSC亲和肽,又称BMSC特异性亲和短肽,其中,该短肽的氨基酸组成序列为EPLQLKM。BMSC亲和肽能够在体外和体内高效地特异性募集BMSC细胞。发明人设想,如若在宿主骨床和关节假体表面之间的界面上募集足够多的BMSC细胞,BMSC细胞能够分化为成骨细胞,成骨细胞继续分泌骨基质,利于实现宿主骨床和关节假体之间的骨整合。
特别地,对于Paprosky III型和Paprosky IV型股骨缺损患者,骨缺损导致BMSC来源减少。可见,为了促进宿主骨床和关节假体之间的骨整合,将更多的BMSC充分和高效地募集到宿主骨床和关节假体之间是非常重要的。
除了BMSC细胞的数量,BMSC细胞的成骨分化对骨整合也非常重要。在骨组织工程中,骨形态发生蛋白2(BMP-2)是最常用的促进BMSC分化为成骨细胞的生物因子。研究发现,BMP-2模拟肽(CKIPKASSVPTELSAISMLYL)能够促进BMSC细胞的成骨分化,并且,BMP-2模拟肽比全长BMP-2蛋白更稳定,且更便宜,具有更强的应用潜力。
基于上述思路,本发明实施例提供的骨缺损修复组织工程支架包括:金属支架本体、接枝于金属支架本体上的BMSC亲和肽和BMP-2模拟肽。通过使BMSC亲和肽和BMP-2模拟肽同步结合到金属支架本体的表面,利于在宿主骨床和关节假体表面之间的界面上募集足够多的BMSC细胞,并且,这些BMSC细胞还能够获得良好的成骨分化能力,利于显著改善宿主骨床和关节假体之间的骨整合强度。另外,BMSC亲和肽和BMP-2模拟肽可以通过化学接枝的方式偶联于金属支架本体的表面,使得该工程支架的制备方法较为简单,便于规模化推广应用。
本发明实施例中,至少使金属支架本体的部分表面上接枝有BMSC亲和肽和BMP-2模拟肽,例如,BMSC亲和肽和BMP-2模拟肽所占据的面积为金属支架本体的表面总面积的3/5-1,优选地,使金属支架本体的表面全部被BMSC亲和肽和BMP-2模拟肽所占据。
在一些可能的实现方式中,使BMSC亲和肽在金属支架本体表面上的附着量与BMP-2模拟肽在金属支架本体表面上的附着量比例为1:0.5-2,例如为1:0.8、1:1、1:1.5等,在该范围内,BMSC亲和肽和BMP-2模拟肽能够更好地协同作用,获得更佳的BMSC细胞分化效果。
对于本发明实施例提供的骨缺损修复组织工程支架,所使用的金属支架本体的材质包括但不限于:钛、钛合金、铌、铌合金、或者不锈钢。
在一些可能的实现方式中,金属支架本体的材质为钛合金,具有良好的耐腐蚀性、人体亲和性、良好的韧性、以及较低的成本等优点。示例地,该钛合金可以为Ti-6Al-4V合金。
另一方面,本发明实施例还提供了上述骨缺损修复组织工程支架的制备方法,该制备方法包括:
利用胺化剂对金属支架本体进行胺化处理,获得胺化的支架本体。
使胺化的支架本体在交联剂溶液中孵育第一设定时间,获得交联基团修饰的支架。
使交联基团修饰的支架浸入肽溶液中第二设定时间,得到骨缺损修复组织工程支架,其中,肽溶液中包括BMSC亲和肽和BMP-2模拟肽。
本发明实施例提供的骨缺损修复组织工程支架的制备方法,首先利用胺化剂对金属支架本体进行胺化处理,以在胺化的支架本体上接枝铵根离子,铵根离子能够与交联剂溶液中的交联基团进行化学接枝,同时,利用该交联基团还能够实现与BMSC亲和肽和BMP-2模拟肽的稳定接枝,这样,能够将BMSC亲和肽和BMP-2模拟肽稳定地接枝于金属支架本体上。该制备方法操作简便,便于实施,且能够使BMSC亲和肽和BMP-2模拟肽与金属支架本体之间稳定结合,获得具有高效修复效果的骨缺损修复组织工程支架。
在一些可能的实现方式中,本发明实施例所适用的胺化剂为1,6-己二胺、甲胺、二甲胺、乙胺、二乙胺、正丙胺、异丙胺、或者环己胺,例如,为1,6-己二胺。
应用时,可以将胺化剂,例如1,6-己二胺溶解在异丙醇中,形成浓度为8wt%-15wt%的胺化剂溶液。
为了提高胺化效果,使胺化处理在30℃-40℃下进行,例如在30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃等温度下进行。
在一些可能的实现方式中,本发明实施例所使用的交联剂溶液为质量浓度为1mg/m-2mg/mL的Sulfo-SMCC交联剂溶液。
其中,Sulfo-SMCC是一款水溶性的双功能基团的交联剂,该交联剂一端含有琥珀酰亚胺酯,另外一端含有马来酰亚胺,这两个基团分别可以与氨基、巯基、羧基等反应,形成稳定的共价键,进而能够将胺化的支架本体与BMSC亲和肽和BMP-2模拟肽稳定地结合在一起,实现稳定的化学接枝。
为了确保肽的活性,使交联基团修饰的支架在肽溶液中的浸泡温度为在1℃-5℃。
以下结合具体实例进一步地描述本发明实施例提供的骨缺损修复组织工程支架的有益效果:
(1)提供Ti6Al4V支架本体
选用市售的Ti6Al4V支架作为金属支架本体,其结构为圆柱形杆状结构,厚度为5毫米,直径5.5毫米,购自上海三友医疗有限公司。对该Ti6Al4V支架进行抛光,至表面光滑,在超声波清洗机中完全冲洗。冲洗完毕干燥后,将该Ti6Al4V支架于4℃下储存以作备用。
(2)提供BMSC亲和肽和BMP-2模拟肽
BMSC亲和肽和BMP-2模拟肽均购自Scilight生物技术有限公司,其中,BMSC亲和肽和BMP-2模拟肽的末端均连接一个额外的半胱氨酸,以促进随后的共价交联。
对部分BMSC亲和肽用荧光素-5-异硫氰酸盐进行标记,简称FITC-BMSC亲和肽;对部分BMP-2模拟肽用罗丹明进行标记,简称罗丹明-BMP-2模拟肽。两种肽通过利用上述荧光基团进行标记,利于在荧光显微镜下进行监测。
(3)低聚肽与Ti6Al4V支架本体的共价交联
采用以下方法来使低聚肽与Ti6Al4V支架的共价交联:
首先,提供胺化剂溶液和交联剂溶液,其中,将1,6-己二胺溶解在异丙醇溶液中,并使1,6-己二胺在其中的浓度为10wt%,得到胺化剂溶液。将磺基-琥珀酰亚胺基4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(简称Sulfo-SMCC)作为交联剂,购自Thermo FisherScientific,Rockford,USA,将该Sulfo-SMCC交联剂溶解于PBS缓冲液中,使Sulfo-SMCC交联剂的浓度为2mg/mL,得到交联剂溶液。
其次,将Ti6Al4V支架本体浸泡于胺化剂溶液中,在37℃的温度下孵育1小时,取出,并用PBS缓冲液洗涤,获得胺化的支架本体。
将该胺化的支架本体浸泡于交联剂溶液中,于室温下孵育1小时,获得交联基团修饰的支架。
将交联基团修饰的支架浸泡于肽溶液中,例如1ml的肽溶液中,在4℃下稳定放置12小时,使BMSC亲和肽和BMP-2模拟肽均接枝到支架上,形成骨缺损修复组织工程支架。最后,将骨缺损修复组织工程支架进行冷冻干燥并储存在-20℃的环境中以作备用。
为了考察接枝于金属支架本体上的肽的种类对骨缺损修复组织工程支架的效果的影响,参见如下表1,按照上述制备方法制备多种类型的组织工程支架:
表1
其中,表1中,在将各BMSC亲和肽和各BMP-2模拟肽接枝于Ti6Al4V支架本体上时,所使用的肽溶液的浓度均为5mg/ml。
通过以下项目考察了上述各支架的物理性质和生物性能,并通过各支架之间的对比来进一步证实TBA支架、TBM支架和TBABM支架的物理性质和生物性能,具体如下所示:
(1)肽和Ti6Al4V支架本体之间的结合状态
为了验证肽与Ti6Al4V支架本体之间的结合状态,利用Leica激光扫描共聚焦显微镜观察TBA-FITC支架、TBM-RD支架和TBABM-FITC/RD支架。其中,对于荧光素-5-异硫氰酸盐FITC的检测,激发波长为488nm,发射波长为525nm。对于罗丹明的检测,激发波长为540nm,发射波长为610nm。同时,使用扫描电镜观察PTC支架,以说明其表面形态,因为它不含BMSC亲和肽和BMP-2模拟肽。
利用X射线光电子能谱分析肽和Ti6Al4V支架本体之间的结合状态(XPS,AXISSURV)。具体而言,入射光源为Alka射线,管电压为15kV,管电流为10mA,测定的最大横向尺寸为700μm,实验数据用CasaXPS软件进行分析。
为了进一步确定不同支架的表面结构,使用X射线衍射(XRD)分析PTC支架,TBA支架,TBM支架和TBABM支架。具体而言,使用Dmax-2500 X射线衍射仪测试不同支架,以及肽和空白玻璃样品。其中,管电压为40kV,管电流为150mA,入射光源为Cu-kα(λ=0。154nm),扫描角度范围为2θ=3°-50°,扫描速度为4°/min,使用Jade 6.5软件分析实验数据。
测试结果如下所示:
图1为本发明实施例提供的不同支架的表面图像;其中,标号A示出了PTC支架的SEM图像,显示其表面光滑;标号B示出了TBA-FITC支架的CFM图像,显示FITC-BMSC亲和肽均匀分布在TBA-FITC支架上;标号C示出了TBM-RD支架的CFM图像,显示罗丹明-BMP-2模拟肽均匀地分布在TBM-RD支架上;标号D示出了TBABM-FITC/RD支架的CFM图像,显示FITC-BMSC亲和肽和罗丹明-BMP-2模拟肽均匀地分布在TBABM-FITC/RD支架上。
图2为本发明实施例提供的TBABM-FITC/RD支架的三维图像。其中,标号a所示图像显示FITC-BMSC-亲和肽均匀地结合在TBABM-FITC/RD支架上;标号b所示图像显示罗丹明-BMP-2模拟肽均匀地结合在TBABM-FITC/RD支架上;标号c示出了Ti6Al4V支架本体的图像;标号d示出了FITC-BMSC-亲和肽和罗丹明-BMP-2模拟肽均匀地结合在TBABM-FITC/RD支架上。
如图1所示,在TBA-FITC支架中观察到均匀的绿色荧光(附图作了灰度处理,并没有显示绿色,实际上为绿色荧光),这表明FITC-BMSC亲和肽均匀地分布在TBA支架表面。
TBM支架中观察到均匀的红色荧光(附图作了灰度处理,并没有显示红色,实际上为红色荧光),表明罗丹明-BMP-2模拟肽均匀地分布在TBM支架表面。
如附图1和附图2所示,在TBABM支架上观察到均匀的绿色和红色荧光(同上,附图作了灰度处理,实际上为红色绿色均匀掺杂),这表明FITC-BMSC亲和肽和罗丹明-BMP-2模拟肽成功地结合到TBABM支架上。
如图3所示,通过XPS在所有支架组中都清楚地观察到Ti和O的特征峰。特别地,在TBA支架组、TBM支架组和TBABM支架组中,于400.26eV处观察到了其他一些特征峰,可归结为N元素,这可能是由于低聚肽的原因,因为PTC组没有N元素。此外,在TBA支架组、TBM支架组和TBABM支架组表面的Ti含量大大降低(参见表2),这也表明了低聚肽覆盖了Ti6Al4V合金的表面,低聚肽成功地耦连到了支架上。
表2
XRD检测进一步验证了低聚肽与Ti6Al4V合金之间的结合状态。如图4所示,仅玻璃样品为无定形结构,而沉积在玻璃上的BMSC亲和肽在32.1°处有衍射峰,沉积在玻璃上的BMP-2模拟肽在32.1°和46°处有衍射峰,说明这些衍射峰是由两种低聚肽形成的。
如图5所示,PTC支架的衍射峰属于Ti6Al4V合金的衍射峰,而在TBA支架、TBM支架和TBABM支架中没有观察到低聚肽的衍射峰。因此,低聚肽与Ti6Al4V支架本体接枝后,其肽的化学结构发生变化,晶型消失,足以成功地证明BMSC亲和肽和BMP-2模拟肽均与Ti6Al4V支架之间共价耦连成功。
(2)各支架的亲水性和表面粗糙度
为了测定接枝了BMSC亲和肽和/或BMP-2模拟肽的支架相对于Ti6Al4V支架本体的亲水性变化,利用接触角测试仪对每一支架上的水滴的水接触角进行测定,特别地,测定了PTC支架、TBA支架、TBM支架和TBABM支架的亲水性。具体而言,将一个水滴滴在每个支架上,5秒钟后拍摄水滴图像,用分析软件对水滴图像进行分析,确定不同支架的水接触角。
利用MultiMOde IV原子力显微镜(AFM,Bruker),在敲击模式下对PTC支架、TBA支架、TBM支架和TBABM支架的表面粗糙度进行分析。其中,表面粗糙度由Ra值计算,即,表面高度偏差与平均平面的绝对值的算术平均值。
测试结果如下所示:
如图6和表3所示,TBA支架、TBM支架和TBABM支架的水接触角均小于PTC支架的水接触角,这表明,BMSC亲和肽和BMP-2模拟肽改善了Ti6Al4V支架本体的亲水性。TBA支架、TBM支架和TBABM支架均比PTC支架更粗糙,但是,TBA支架、TBM支架和TBABM支架之间的粗糙度没有差异(参见图7)。
表3
(3)BMSC细胞的培养和接种
从成熟的Sprague-Dawley大鼠(180g,雄性)的股骨和胫骨中分离出BMSC,并根据常规培养手段对其进行培养。具体而言,将BMSC培养在DMEM培养基中,该DMEM培养基中含有质量浓度为10%的胎牛血清(FBS,Hyclone,Logan,Utah,USA),2mmol/L的L-谷氨酰胺和100U/mL的青霉素/链霉素。将BMSC以80%-90%的汇合度进行亚培养,用三系诱导法鉴定第二代的BMSC特征,将第二代BMSC(密度为3.0×10
从SD大鼠中提取的BMSC具有典型的纺锤形形态(图8中的A),并测试了细胞的三系分化潜能(图8中的B-D)。这些结果表明,提取的细胞是BMSC,可用于后续实验。
(4)各支架的生物相容性
为了确定PTC支架、TBA支架、TBM支架和TBABM支架的生物相容性,在孵化1、3和7天后,根据制造商的说明进行CCK8检测细胞增殖/毒性分析。具体而言,将负载有细胞的支架在500μL的质量浓度为10%的CCK-8试剂培养基中于37℃孵育3小时。随后,将这些100μL培养基转移到96孔板中,并使用微孔板读数器在450nm的波长下测量。
使用CCK-8试验检测肽修饰的支架的生物相容性。如图9所示,在孵育7天后,所有四个支架组中的BMSC细胞的增殖速率均增加,表明肽修饰的支架具有优异的生物相容性并且没有细胞毒性。
(5)BMSC在不同支架上的粘附数目和伸展状态
为了确定BMSC在不同支架上的初始粘附力,测定BMSC的初始粘附数目和伸展状态。细胞计数时,将PTC支架、TBA支架、TBM支架和TBABM支架上的BMSC分别孵育1、3、5和7小时,用PBS缓冲液洗涤两次,以去除未结合的细胞,然后将粘附在不同支架上的BMSC进行胰蛋白酶处理,用血细胞仪计数。
为了进一步分析细胞形态,在孵化24小时后,用FITC-phalloidin对不同支架上的BMSC进行细胞骨架染色,并且,在孵育24h后,用SEM观察不同支架上BMSC的伸展状态。
通过细胞计数测定,温育7小时后,TBA支架和TBABM支架上的BMSC的数目显着大于PTC支架和TBM支架。但是,TBA支架和TBABM支架之间的BMSC数量没有显著差异(参见图10,其中,图10中,#p<0.05每个时间点的PTC支架组和TBM支架组相比,*p<0.05每个时间点的PTC支架组和TBM支架组相比)。实验证实,不论细胞数量的差异如何,在孵育24小时后,TBA支架和TBABM支架的细胞骨架染色均显示出伸展状态更好的细胞骨架网络(参见图11)。此外,使用SEM观察BMSC伸展的状态。如图11所示,TBA支架和TBABM支架中的BMSC比PTC支架和TBM支架具有更好的伸展形态,这与通过细胞骨架染色获得的结果一致。以上所有数据表明,TBA支架和TBABM支架对BMSC的黏附和伸展更有利。
(6)骨特异性基因在不同支架上的表达分析
为了分析不同支架的成骨能力,在培养21天后,采用实时定量PCR(RT-qPCR)测定骨特异性基因的表达,这些骨特异性基因包括:碱性磷酸酶(简称ALP)、胶原蛋白I(简称COLI)、骨钙素(简称OCN)和骨松素(简称OPN)。具体而言,根据产品说明书,用RNA提取试剂盒分离RNA,使用Applied Biosystems 7300系统进行RT-qPCR,扩增程序如下:95℃下10分钟,95℃下40个循环15秒,60℃下1分钟。所有引物均设计并购买自AuGCT有限公司(参见表4)。RT-qPCR结果采用2-ΔΔCt法计算,以GAPDH蛋白作为参考基因。
表4
孵育21天后,通过RT-qPCR确定ALP,COL I,OCN和OPN基因的表达。如图12-1至图12-4所示,TBABM组中ALP,COL I,OCN和OPN的基因表达显着高于PTC,TBA和TBM组,这表明TBABM支架可以促进BMSC的成骨分化。
(7)不同支架上的骨特异性基质形成分析
对于负载BMSC细胞的PTC支架、TBA支架、TBM支架和TBABM支架,采用免疫荧光染色法测定OCN蛋白和OPN蛋白的合成,这是成骨的特异性标志。
具体而言,对于OCN的测定,标本用PBS清洗,并在孵化21天后用质量浓度为5%的BSA封闭液阻断。然后,将标本分别浸泡在小鼠抗OCN抗体(ab13420;Abcam Inc.,Cambridge,MA,USA)中,在4℃下过夜。用PBS缓冲液洗涤后,用Dylight 488山羊抗小鼠IgG(A23210,Abbkine Inc.,California,USA)在37℃下孵育60分钟。最后,用Hoechst 33258对细胞核进行染色。
OPN的检测与OCN的检测相似,区别在于:标本用兔抗OPN抗体(ab91655;AbcamInc.,Cambridge,MA,USA)和Dylight 594山羊抗兔IgG(A23420,Abbkine Inc.,California,USA)孵育。
为了进一步确定不同组中骨特异性基质的形成,孵育21天后,采用了免疫荧光测定法检测OCN和OPN蛋白。如图13-1至图13-2所示,TBABM支架组中OCN和OPN蛋白的量明显大于PTC支架组,TBA支架组和TBM支架组,这也表明TBABM支架可以促进BMSC的成骨分化。
(8)动物体内研究
所有动物实验均按照伦理委员会的要求进行,使用24只新西兰白兔(体重2.5-3.0kg,6-9月龄)。兔子被随机分配到PTC支架组、TBA支架组、TBM支架组和TBABM支架组,每组6只兔子。
具体而言,将新西兰白兔用氨基甲酸乙酯(0.2g/mL)麻醉后,在右股骨内侧髁用环钻制作骨缺损(缺损区的深度为5mm,直径为5.5mm)。随后,用PTC支架、TBA支架、TBM支架和TBABM支架填充相应组的骨缺损区域。通过正面和侧面的X光片验证支架的植入位置(参见图14-1至图14-2)。12周后,将所有动物处死,进行进一步的组织学和力学检查。
为了确定不同支架与宿主骨之间骨结合的机械强度,用MTS 858Mini Bionix Ⅱ型力学性能测试仪(MTS Systems Ltd,MN,USA)进行拉拔试验,分析了不同组的最大负荷、刚度和最大负荷能量等参数。
结果表明,如图14-4所示,TBABM支架组中最大负荷,刚度和最大负载能量最大,这表明TBABM支架与宿主骨之间的骨整合强度大于其他组,也就是说,TBABM支架与宿主骨之间的骨整合具有出色的机械强度。
(9)组织学检查
为了确定不同支架与宿主骨之间的骨结合状态,对每组的3个标本进行了未脱钙组织学分析。具体而言,标本在质量浓度为4%的多聚甲醛固定和酒精脱水后,嵌入甲基丙烯酸甲酯中。随后,用硬组织切片机将样品加工成50μm的载玻片,最后,用苏木精和伊红(HE),Masson染色和VG染色对载玻片进行分析。
如图14-3所示,HE染色显示,TBABM支架与宿主骨界面的骨组织数量大于其他组。Masson染色和VG染色表明,TBABM支架与宿主骨界面比其他组产生更多的胶原纤维。
PS:上述涉及的所有测试实验均进行3次,所有数据均采用SPSS 19.0软件进行单因素方差分析,以平均值±标准差表示。P<0.05为有统计学意义。
以上所述仅是为了便于本领域的技术人员理解本发明的技术方案,并不用以限制本发明。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 骨缺损修复组织工程支架及其制备方法
- 3D打印Ti-PDA-BMP-2骨缺损修复组织工程支架的制备方法
