分析物的多重荧光检测
文献发布时间:2023-06-19 11:26:00
相关申请的交叉引用
本申请要求2019年3月1日提交的美国临时申请号62/812,883,以及2019年6月17日提交的荷兰申请号2023327的优先权的权益。前述申请中的每一个的全部内容均据此以引用方式并入。
背景技术
合成测序(SBS)技术使用包含终止子的经修饰的脱氧核糖核苷酸三磷酸(dNTP),以及具有发射光谱的荧光染料。荧光染料与dNTP共价连接。荧光染料在被光照射之后的输出(即,荧光)可以由相机检测。当使用单一荧光颜色时,在DNA合成与成像的单独循环中添加四种碱基中的每一种。在一些具体实施中,可以将单独的荧光染料用于四种碱基中的每一种。在另外的具体实施中,双通道SBS技术和四通道SBS技术可以使用染料标记的dNTP的混合物。可以使用具有不同波段的光源以及来自具有相应发射光谱的适当荧光染料的输出来拍摄每个DNA簇的图像。
发明内容
本公开描述了可以通过使用两个或更多个颜色通道对样品同时成像而在SBS系统中提供改进的成像通量的系统或方法的示例。所用染料和颜色通道的特性可以有利于颜色通道之间的低串扰或无串扰,使得多重荧光可以用于快速、有效和可靠地识别核苷酸。与可能需要按顺序捕获图像,从而提供较低通量的其他方法相比,这可以提供明显的改进。可以使用多个颜色通道中的任一个,包括但不限于蓝色通道和绿色通道。本发明描述了可以基于多重荧光用于执行SBS的系统或技术的示例。本发明描述了可以基于多重荧光用于标记样品以执行SBS的染料的示例。
在第一方面,一种方法包括提供样品,该样品包含第一核苷酸和第二核苷酸;使样品与第一荧光染料和第二荧光染料接触,第一荧光染料响应于第一激发照明光而发射在第一波段内的第一发射光,第二荧光染料响应于第二激发照明光而发射在第二波段内的第二发射光;使用一个或多个图像检测器来同时收集包括第一发射光和第二发射光的多重荧光,第一发射光是对应于第一波段的第一颜色通道,并且第二发射光是对应于第二波段的第二颜色通道;以及基于第一颜色通道的第一波段识别第一核苷酸,并且基于第二颜色通道的第二波段识别第二核苷酸。
具体实施可以包括下列任何或所有特征。第一波段对应于蓝色,并且第二波段对应于绿色。第一波段被包括在约450nm至约525nm的范围内,并且其中第二波段被包括在约525nm至约650nm的范围内。针对第一荧光染料的第一发射光谱限定第一平均或峰值波长,并且针对第二荧光染料的第二发射光谱限定第二平均或峰值波长,第一平均或峰值波长和第二平均或峰值波长彼此至少具有预定的间隔。第一波段具有比第二波段短的波长,其中第二波段与第一波长相关联,并且其中第一荧光染料和第二荧光染料之间的波长发射间隔被限定成使得第一荧光染料的发射光谱最多包括预定量的处于或高于第一波长的光。同时收集多重荧光包括:使用用于第一颜色通道的第一光学子系统检测第一发射光,并且使用用于第二颜色通道的第二光学子系统检测第二发射光,其中发射二向色滤光器将第一颜色通道的第一发射光引导至第一光学子系统,并且将第二颜色通道的第二发射光引导至第二光学子系统。第一光学子系统和第二光学子系统中的至少一者包括成角度的光学路径。第一荧光染料的发射光谱在第一波段中具有峰值。该样品还包含第三核苷酸,并且该方法还包括:使样品与第三荧光染料接触,该第三荧光染料响应于第一激发照明光而发射在第一波段内的第三发射光,并且响应于第二激发照明而发射在第二波段内的第四发射光,其中多重荧光还包括第三发射光和第四发射光;以及基于第一颜色通道的第一波段和第二颜色通道的第二波段识别第三核苷酸。该样品还包含第三核苷酸,并且其中该方法还包括:使样品与第三荧光染料接触,该第三荧光染料响应于第三激发照明光而发射在第三波段内的第三发射光,其中多重荧光还包括第三发射光;以及基于第三波段识别第三核苷酸。
在第二方面,设备包括:容纳样品的流动池,该样品包含第一核苷酸和第二核苷酸,其中第一核苷酸偶联到第一荧光染料,其中第二核苷酸偶联到第二荧光染料,第一荧光染料响应于第一激发照明光而发射在第一波段内的第一发射光,第二荧光染料响应于第二激发照明光而发射在第二波段内的第二发射光;照明系统,该照明系统向流动池同时提供第一激发照明光和第二激发照明光;以及光收集系统,该光收集系统同时收集包括第一发射光和第二发射光的多重荧光,第一发射光是对应于第一波段的第一颜色通道,并且第二发射光是对应于第二波段的第二颜色通道。
具体实施可以包括下列任何或所有特征。第一波段对应于蓝色,并且第二波段对应于绿色。第一波段被包括在约450nm至约525nm的范围内,并且其中第二波段被包括在约525nm至约650nm的范围内。针对第一荧光染料的第一发射光谱限定第一平均或峰值波长,并且针对第二荧光染料的第二发射光谱限定第二平均或峰值波长,第一平均或峰值波长和第二平均或峰值波长彼此至少具有预定的间隔。第一波段具有比第二波段短的波长,其中第二波段与第一波长相关联,并且其中第一荧光染料和第二荧光染料之间的波长发射间隔被限定成使得第一荧光染料的发射光谱最多包括预定量的处于或高于第一波长的光。该光收集系统包括:用于第一颜色通道的第一光学子系统,该第一光学子系统检测第一发射光;和用于第二颜色通道的第二光学子系统,该第二光学子系统检测第二发射光,其中发射二向色滤光器将第一颜色通道的第一发射光引导至第一光学子系统,并且将第二颜色通道的第二发射光引导至第二光学子系统。第一光学子系统和第二光学子系统中的至少一者包括成角度的光学路径。第一荧光染料的发射光谱在第一波段中具有峰值。该样品还包含第三核苷酸,该第三核苷酸偶联到第三荧光染料,该第三荧光染料响应于第一激发照明光而发射在第一波段内的第三发射光,并且响应于第二激发照明而发射在第二波段内的第四发射光,并且其中多重荧光还包括第三发射光和第四发射光。该样品还包含第三核苷酸,该第三核苷酸偶联到第三荧光染料,该第三荧光染料响应于第三激发照明光而发射在第三波段内的第三发射光,其中多重荧光还包括第三发射光。
具体实施的一个或多个示例的细节在附图和下文的描述中进行阐述。根据说明书和附图以及权利要求书,其他特征将显而易见。
附图说明
图1是包括仪器、管状柱和流动池的系统的示意图。
图2是根据示例具体实施的包括流动池的照明系统的示意图。
图3是根据示例具体实施的包括红色染料和绿色染料的发射光谱的曲线图的示意图。
图4是展示使用图3的绿色染料和红色染料进行顺序成像的双通道测序分析的散点图。
图5是展示使用图3的绿色染料和红色染料进行同时多重成像的双通道测序分析的散点图。
图6是描绘图4至图5的双通道测序分析的量度的示意图。
图7是根据示例具体实施的包括蓝色染料和绿色染料的发射光谱的曲线图的示意图。
图8是展示使用图7的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图。
图9是根据示例具体实施的包括替代性的蓝色染料和绿色染料的发射光谱的曲线图的另一个示意图。
图10是展示使用图9的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图。
图11是展示使用其他的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图。
图12是展示使用其他的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图。
图13是根据示例具体实施的包括替代性的蓝色染料和绿色染料的发射光谱的曲线图和对应的滤光器范围的另一个示意图。
图14是展示使用图13的蓝色染料和绿色染料,使用第一滤光器范围进行同时多重成像的双通道测序分析的散点图。
图15是展示使用图13的蓝色染料和绿色染料,使用第二滤光器范围进行同时多重成像的双通道测序分析的散点图。
图16是展示使用图9的蓝色染料和绿色染料和图13的第二滤光器范围进行同时多重成像的双通道测序分析的散点图。
图17是描绘图16的双通道测序分析的量度的示意图。
图18是表示可以涉及产生多重荧光图像并对其进行分析的示例顺序步骤的时间线的示意图。
图19是表示可以涉及产生多重荧光图像并对其进行分析的示例顺序步骤的另一时间线的示意图。
图20是表示在利用SIM成像产生同时图像时所涉及的事件的时间线的示意图。
图21是展示根据示例具体实施的对样品同时成像的方法的流程图。
图22是展示执行测序操作的方法的流程图。
图23是展示执行测序操作的方法的另一个流程图。
图24是展示用本文所述的染料I-4标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图。
图25是展示用本文所述的染料I-5标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图。
图26是展示用本文所述的染料I-6标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图。
具体实施方式
本文档描述了可以通过使用两个或更多个颜色通道对DNA簇同时成像来提供稳健的合成测序(SBS)结果的系统和技术的示例。此类系统/技术可以提供优于现有方法的一个或多个优点,例如如本文所述。
一些执行SBS的方法涉及按顺序对来自相应荧光染料的发射光的每个波段进行成像。也就是说,对发射光的与第一核苷酸相对应的第一波段成像、对发射光的与第二核苷酸相对应的第二波段成像、对发射光的与第三核苷酸相对应的第三波段成像,以及对发射光的与第四核苷酸相对应的第四波段成像。
在一些情况下,由于对发射光的四个不同波段分别成像,所以这种顺序成像过程可能导致低数据通量。在一些具体实施中,发射光的两个波段已经用于通过减少图像的数量来识别每个核苷酸,以将核苷酸类型推断为两个,诸如双通道合成测序。例如,第一波段可以与两个核苷酸(诸如腺嘌呤和胸腺嘧啶)相关联。第二波段可以与一个重叠核苷酸和第三核苷酸(诸如腺嘌呤和胞嘧啶)相关联。
波段可以经由响应于激发光而发射在对应波段内的光的荧光染料来实现。在一些具体实施中,两种染料(一种用于第一波段,另一种用于第二波段)可以各自偶联到腺嘌呤的核酸区段的对应部分。在给定通过扩增生成的一群核酸区段的情况下,这群核酸区段的簇的至少一些部分可以偶联到用于第一波段的染料和用于第二波段的染料。因此,当第一染料暴露于第一激发光时,该簇发射在第一波段中的光。当第二染料暴露于不同于第一激发光的第二激发光时,该簇发射在第二波段中的光。类似地,在第一波段中发射的染料可以与胸腺嘧啶的核酸区段的对应部分偶联,并且在第二波段中发射的染料可以与胞嘧啶的核酸区段的对应部分偶联。
当使用对应的激发光对第一波段进行成像时,可以采集第一波段发射光的图像。当使用对应的激发光对第二波段进行成像时,可以采集第二波段发射光的图像。这些图像的采集在时间上间隔开,使得对发射光的第一波段的图像采集不与发射光的第二波段重叠。
两个图像的在这两个图像中描绘的部分可以被确定为对应于重叠核苷酸,诸如腺嘌呤。两个图像的仅在第一图像中描绘(并且在第二图像中不发射光)的部分可以被确定为对应于与第一波段发射染料相关联的非重叠核苷酸,诸如胸腺嘧啶。两个图像的仅在第二图像中描绘(并且在第一图像中不发射光)的部分可以被确定为对应于与第二波段发射染料相关联的非重叠核苷酸,诸如胞嘧啶。两个图像的在第一图像或第二图像中不发射光的部分可以被确定为对应于第四核苷酸,诸如鸟嘌呤。
在前述系统中,利用两个或更多个顺序(即,在时间上间隔开的)图像来确定对应的核苷酸。如本文所述,可以在单个成像步骤期间实现同时捕获发射光的两个或更多个不同的波段,从而消除在时间上间隔开的第二组图像,并且从而通过将成像步骤减少到用于成像的单个序列来提高测序通量。然而,由于发射光的波段重叠,可能难以实现同时采集两个或更多个通道的发射光。例如,在一些情况下,当发射光波段彼此过于靠近时(例如,蓝色波段和绿色波段),不同荧光染料的相应发射光谱可能重叠。在这种情况下,可能发生光谱“串扰”,导致难以进行处理来确定对应的核苷酸。
本文描述了用于合成测序过程的系统和方法,这些系统和方法在单个成像步骤中同时捕获发射光的两个或更多个波长,然后可以处理这些波长以确定对应的核苷酸。具体地讲,第一波段可以与两个核苷酸(诸如腺嘌呤和胸腺嘧啶)相关联。第二波段可以与一个核苷酸(与这两个核苷酸重叠)和第三核苷酸(诸如腺嘌呤和胞嘧啶)相关联。第一波段可以具有第一下波长和第一上波长。第二波段可以具有第二下波长和第二上波长。在一些具体实施中,第一下波长与第二上波长相差至少50nm。在一些具体实施中,第一下波长和第二上波长被设定为使得串扰低于第一预定值,诸如20%。
染料之间的间隔可以采用一种或多种其他方式来限定。这可以基于波段、颜色通道或荧光染料中的一者或多者。波段可以包括第一波长和第二波长之间的所有频率(例如,基本上连续的频率范围)。例如,可以选择第一波长和第二波长,使得波段包括蓝光或另一种颜色的光。颜色通道表示正在由检测器检测的一个或多个频率。例如,发射光的不在颜色通道内的频率可以在到达检测器之前被滤除。在一些具体实施中,颜色通道可以包括一个或多个波段。荧光染料可以以多种方式表征,包括但不限于通过其化学结构和/或通过其光学特性来表征。在一些具体实施中,荧光染料可以被表征为仅在一个或多个波段中发射荧光,或者被表征为在某个频率处或在某个波段内具有平均或峰值波长。
在一些具体实施中,该间隔可以基于来自对应染料的比预定波长高或低的发射光的量来限定。该间隔可以被限定为使得发射光的量至多比与另一种染料的波段相关联的预定波长高或低预定的百分比。例如,染料的荧光的至多X%在另一种染料的预定波长以上或以下发射。在一些具体实施中,前述示例中的数字X可以是任何合适的数字,诸如值的范围。例如,该范围可以是荧光的约0%至10%。又如,该范围可以是荧光的约0.5%至5%。又如,该范围可以是荧光的约0.1%至1%。在一些具体实施中,可以使用染料之间的平均或峰值波长间隔。例如,如果两种染料的平均或峰值波长至少间隔预定的量度(例如,一定距离,或任一波长的百分比),则可以认为它们满足间隔度量。
可以利用一种或多种荧光染料来发射前述波段内的光。例如,本文所述的一些染料可以具有定位在蓝色波段中的发射光谱,以发射蓝色通道的光。类似地,本文所述的一些染料可以具有定位在绿色波段中的发射光谱,以发射绿色通道的光。类似地,本文所述的一些染料可以具有定位在红色波段中的发射光谱,以发射红色通道的光。例如,可以检测蓝色通道和绿色通道。又如,可以检测蓝色通道、绿色通道和红色通道。这些染料的发射光谱可以被选择为使得每一者均充分地分别位于蓝色光谱区和绿色光谱区中,以便具有减小的发射波长重叠。
图1是系统10的示意图,该系统包括仪器12、管状柱14和流动池16。系统10可以用于生物分析和/或化学分析。系统10可以连同本文别处所述的一个或多个其他示例一起使用,或者在本文别处所述的一个或多个其他示例的具体实施中使用。
管状柱14可以用作一个或多个样品的载体,诸如经由流动池16。管状柱14可以被构造成保持流动池16,并且将流动池16传送到与仪器12发生直接相互作用的位置以及将流动池从与仪器发生直接相互作用的位置运出。例如,仪器12包括容座18(例如,其外壳中的开口),以至少在从样品采集信息期间接收并容纳管状柱14。管状柱14可以由任何合适的材料制成。在一些具体实施中,管状柱14包括模制塑料或其他耐用材料。例如,管状柱14可以形成用于支撑或保持流动池16的框架。
本文的示例提及被分析的样品。此类样品可以包括遗传物质。在一些具体实施中,样品包括遗传物质的一条或多条模板链。例如,使用本文所述的技术和/或系统,可以对一条或多条模板DNA链执行SBS。
流动池16可以包括一个或多个基底,所述基底被构造用于保持待由仪器12分析的样品。任何合适的材料均可以用于基底,包括但不限于玻璃、丙烯酸和/或另一种塑性材料。流动池14可以允许液体或其他流体相对于样品选择性地流动。在一些具体实施中,流动池16包括可以保持样品的一个或多个流动结构。在一些具体实施中,流动池12可以包括至少一个流动通道。例如,流动通道可以包括一个或多个流体端口以有利于流体的流动。
仪器12可以操作以获得与至少一种生物物质和/或化学物质相关的任何信息或数据。这些操作可以由中央单元或者由一个或多个分布式控制器控制。此处,展示了仪器控制器20。例如,控制器20可以使用至少一个处理器、至少一个保持用于仪器12的操作的指令的存储介质(例如,存储器和/或驱动器)以及一个或多个其他部件(例如如下文所述)来实现。在一些具体实施中,仪器12可以执行光学操作,包括但不限于对样品的照明和/或成像。例如,仪器12可以包括一个或多个光学子系统(例如,照明子系统和/或成像子系统)。在一些具体实施中,仪器12可以执行热处理,包括但不限于对样品的热调节。例如,仪器12可以包括一个或多个热子系统(例如,加热器和/或冷却器)。在一些具体实施中,仪器12可以执行流体管理,包括但不限于添加和/或移除与样品接触的流体。例如,仪器12可以包括一个或多个流体子系统(例如,泵和/或储液槽)。
图2是示例照明系统100的示意图。照明系统100包括光源组件110、激发二向色滤光器128、物镜134、流动池136、发射二向色滤光器138、第一光学检测子系统156和第二光学检测子系统158。照明系统100使得能够同时对两个颜色通道成像。在一些具体实施中,另一个照明系统可以被配置成使得能够同时对多于两个颜色通道(例如,三个颜色通道、四个颜色通道或更多个颜色通道)成像。需注意,可以存在能够产生对多个颜色通道的类似的同时成像的其他光学配置。
光源组件110产生入射在流动池136上的激发照明。该激发照明进而将从一种或多种荧光染料产生发射照明或荧光照明,该发射照明或荧光照明将使用投影透镜142和148来收集。如图2所示,光源组件110包括第一激发照明源112和对应的会聚透镜114、第二激发照明源116和对应的会聚透镜118,以及二向色滤光器120。
第一激发照明源112和第二激发照明源116例示了可以同时为样品提供相应的激发照明光(例如,对应于相应的颜色通道)的照明系统。在一些具体实施中,第一激发照明源112和第二激发照明源116中的每一者包括发光二极管(LED)。在一些具体实施中,第一激发照明源112和第二激发照明源116中的至少一者包括激光器。在一些具体实施中,第一激发照明源112产生绿光,即,具有对应于绿色的峰值波长或平均波长(例如,约560nm)的窄带光。在一些具体实施中,第二激发照明源116产生蓝光,即,具有对应于蓝色的峰值波长或平均波长(例如,约490nm)的窄带光。
会聚透镜114和118各自被设定为与相应的激发照明源112和116相距一定距离,使得从会聚透镜114/118中的每一者出射的照明聚焦在场孔122处。
二向色滤光器120反射来自第一激发照明源112的照明并且透射来自第二激发照明源116的照明。在一些具体实施中,在第一激发照明源112产生绿光并且第二激发照明源116产生蓝光的情况下,二向色滤光器反射绿光并且透射蓝光。二向色滤光器120输出具有两种波长(在本示例中为蓝色和绿色)的混合体的混合照明,向前穿过光学路径以由物镜134发射。
在一些具体实施中,从二向色滤光器120输出的混合激发照明可以直接朝物镜134传播。在其他具体实施中,混合激发照明在从物镜134发射之前,可以通过附加的居间光学部件来进一步修改和/或控制。在图1所示的示例中,混合激发照明穿过场孔122中的焦点到达蓝色/绿色滤光器124,然后到达颜色校正的准直透镜126。来自透镜126的准直激发照明入射到反射镜128上,在该反射镜上反射并且入射到激发/发射二向色滤光器130上。激发/发射二向色滤光器130反射从光源组件110发射的激发照明,同时允许发射照明(将在下文进一步描述)穿过激发/发射二向色滤光器130以被一个或多个光学子系统156、158接收。光学子系统156和158例示了可以同时收集多重荧光的光收集系统。从激发/发射二向色滤光器130反射的激发照明然后入射到反射镜132上,激发照明从该反射镜朝向流动池136入射到物镜134上。
物镜134将来自反射镜132的准直激发照明聚焦到流动池136上。在一些具体实施中,物镜134是具有例如1X、2X、4X、5X、6X、8X、10X或更高的指定放大系数的显微镜物镜。物镜134将从反射镜132入射的激发照明以由放大系数确定的锥形角度或数值孔径聚焦到流动池136上。在一些具体实施中,物镜134能够在与流动池正交的轴线(“z轴”)上移动。在一些具体实施中,照明系统100独立地调节镜筒透镜148和镜筒透镜142的z位置。例如,这可以使绿色通道聚焦在检测器154上,并且使蓝色通道完美地聚焦在检测器146上,而不必在z方向上移动物镜。在z方向上对镜筒透镜148和142的独立调节可以是在第一次对准仪器时进行的“一次性调节”。
流动池136容纳待分析的样品,诸如核苷酸序列。流动池136可以包括一个或多个通道160(此处借助于放大的横截面视图示意性地展示),所述通道被构造成保持样品材料并且有利于对样品材料采取行动,包括但不限于触发化学反应或者添加或移除材料。物镜134的物平面162(此处使用虚线示意性地展示)延伸穿过流动池136。例如,物平面162可以被限定为与通道160相邻。
物镜134可以限定视场。视场可以限定流动池136上的区域,图像检测器使用物镜134从该区域捕获发射光。可以使用一个或多个图像检测器,例如检测器146和154。例如,当第一激发照明源112和第二激发照明源116生成具有不同波长(或不同波长范围)的相应激发照明时,照明系统100可以包括用于发射光的相应波长(或波长范围)的独立的图像检测器146和154。图像检测器146和154中的至少一者可以包括电荷耦合器件(CCD),诸如时间延迟集成CCD相机;或者基于互补金属氧化物半导体(CMOS)技术制造的传感器,诸如化学敏感场效应晶体管(chemFET)、离子敏感场效应晶体管(ISFET)和/或金属氧化物半导体场效应晶体管(MOSFET)。
在一些具体实施中,照明系统100可以包括结构化照明显微镜(SIM)。SIM成像基于空间结构化的照明光和重建,以得到比仅使用来自物镜134的放大所产生的图像更高分辨率的图像。例如,该结构可以由中断照明激发光的图案或光栅组成或者包括中断照明激发光的图案或光栅。在一些具体实施中,该结构可以包括条纹图案。通过将光束照射在衍射光栅上,使得发生反射衍射或透射衍射,可以生成光的条纹。可以将结构化光投影到样品上,从而根据可以根据一些周期性出现的相应条纹来照明样品。为了使用SIM来重建图像,使用了两个或更多个图案化图像,其中激发照明的图案相对于彼此处于不同的相位角。例如,可以在结构化光中的条纹的不同相位(有时称为图像的相应图案相位)处采集样品的图像。这可以允许样品上的各种位置暴露于多种照明强度。可以将一组所得的发射光图像组合,来重建较高分辨率的图像。
使流动池136中的样品材料与偶联到对应核苷酸的荧光染料接触。荧光染料在用从物镜134入射在流动池136上的对应激发照明照射时发射荧光照明。所发射的照明用波段来识别,这些波段中的每个波段可以被分类为相应的颜色通道。例如,所发射照明的波段可以对应于蓝色(例如,450nm至525nm)、绿色(例如,525nm至570nm)、黄色(例如,570nm至625nm)、红色(例如,625nm至750nm)等。在一些具体实施中,可以基于在同时照明期间存在的两个或更多个光波长来定义波段。例如,当仅分析蓝色和绿色时,对应于蓝色和绿色的波段可以被定义为与前述范围不同的波段。例如,蓝色波段可以被设定为从约450nm至510nm(诸如486nm至506nm)的发射光。在一些情况下,蓝色波段可以简单地具有上限,诸如约500nm至510nm或约506nm。类似地,绿色波段可以被设定为从约525nm至650nm(诸如584nm至637nm)的发射光。虽然前述绿色波段扩展到上文指出的黄色和红色中,但是当分析预期仅在蓝色和绿色的范围中的发射光时,波段的上端和/或下端可以扩展以捕获在该颜色的波长以上或以下发射的附加发射光。在一些情况下,绿色波段可以简单地具有下限,诸如约550nm至600nm或约584nm。
荧光染料与相应的核苷酸化学连接,例如,包含相应的核碱基。这样,当用荧光染料标记的dNTP被图像检测器146、154检测到时,可以基于发射光波长在对应的波段内来进行识别。也就是说,如上文所讨论的,用蓝色染料标记的第一dNTP可以响应于图像检测器146、154接收到在限定的蓝色波段内的发射光来进行识别。类似地,如上文所讨论的,用绿色染料标记的另一种核苷酸可以响应于图像检测器146、154接收到在限定的绿色波段内的发射光来进行识别。用于同时对DNA簇成像的染料标记的核苷酸的其他颜色组合也可以结合适当的照明光源和光学设置用于测序(例如,蓝色和黄色;蓝色和红色;绿色和红色;黄色和红色;蓝色、绿色和红色;蓝色、绿色和黄色;蓝色、黄色和红色;绿色、黄色和红色;蓝色、绿色、黄色和红色;等等)。
荧光染料的组成在下文中描述各种染料的第III部分中进一步详细讨论。在一些具体实施中,荧光染料被构造成使得可以使用由照明系统100启用的同时成像平台,用颜色通道稳健地识别每种核苷酸。通过选择染料发射光谱并过滤,可以实现来自染料的多重发射光。具体地讲,由于相近或相似的颜色的波段(诸如蓝色通道和绿色通道)可以相对靠近在一起,所以选择具有重叠足够小的对应发射光谱的某些荧光染料可以有助于减少核苷酸的潜在错误识别,并且因此减少测序中的错误。此外,使用波段过滤可以进一步有助于区分可能具有类似颜色的某些荧光染料。
在一些具体实施中,可以使用两个颜色通道来识别四种类型的核苷酸。在那种情况下,第一核苷酸可以仅与第一颜色通道相关联,第二核苷酸可以仅与第二颜色通道相关联,第三核苷酸可以与这两个颜色通道相关联,并且第四核苷酸可以与这两个颜色通道均不相关联。
物镜134还捕获由流动池136中的荧光染料分子发射的荧光。在捕获该发射光时,物镜134收集并且传送包括两个颜色通道的准直光。该发射光然后沿着初始的激发照明从照明源110到达的路径往回传播。需注意,由于发射光和激发照明之间缺乏相干,所以沿着该路径在发射照明和激发照明之间预期几乎不存在或完全不存在干涉。也就是说,发射光是单独来源的结果,即是与流动池136中的样品材料接触的荧光染料的结果。
发射光在被反射镜132反射时,入射在激发/发射二向色滤光器130上。滤光器130将发射光透射到蓝色/绿色二向色滤光器138。
在一些具体实施中,蓝色/绿色二向色滤光器138透射与蓝色通道相关联的照明并且反射与绿色通道相关联的照明。在一些具体实施中,蓝色/绿色二向色滤光器138被选择为使得二向色滤光器138将发射照明反射到在限定的绿色波段内的光学子系统156,并且将发射照明透射到在限定的蓝色波段内的光学子系统158,如上文所讨论的。光学子系统156包括镜筒透镜142、滤光器144和图像检测器146。光学子系统158包括镜筒透镜148、滤光器150和图像检测器154。
在一些具体实施中,二向色滤光器138和二向色滤光器120彼此类似地操作(例如,两者均可以反射一种颜色的光并且透射另一种颜色的光)。在其他具体实施中,蓝色/绿色二向色滤光器138和二向色滤光器120彼此不同地操作(例如,二向色滤光器138可以透射二向色滤光器120反射的颜色的光,反之亦然)。
假设蓝色/绿色二向色滤光器138透射被包括在蓝色通道中的发射照明,则被包括在绿色通道中的发射照明可以从蓝色/绿色二向色滤光器138反射到光学子系统156中。反射镜140然后反射被包括在绿色通道中的发射照明,以入射在光学子系统156的镜筒透镜142上。光学子系统156的滤光器144于是为绿色滤光器,其被设计成透射发射照明的绿色通道中的波长并且吸收或反射所有其他波长。滤光器144可以提供在蓝色/绿色二向色滤光器138处不可用的附加滤光。例如,如果蓝色/绿色二向色滤光器138反射相对宽的绿光波长范围,则滤光器144可以进一步限制该波长范围,使得仅相对较窄波长范围的绿光到达图像检测器146。滤光器144可以阻挡任何泄漏的激发光并且/或者限定相对紧密的波段。
同时,蓝色/绿色二向色滤光器138透射被包括在蓝色通道中的发射照明,以入射在光学子系统158的镜筒透镜148上。光学子系统158的滤光器150为蓝色滤光器,其被设计成透射发射照明的蓝色通道中的波长并且吸收或反射所有其他波长。滤光器150可以提供在蓝色/绿色二向色滤光器138处不可用的附加滤光。例如,如果蓝色/绿色二向色滤光器138透射相对宽的蓝光波长范围,则滤光器150可以进一步限制该波长范围,使得仅相对较窄波长范围的蓝光到达图像检测器154。滤光器150可以阻挡任何泄漏的激发光并且/或者限定相对紧密的波段。
在一些具体实施中,并且如图2所示,被包括在蓝色通道中的发射照明在到达图像检测器154之前遇到反射镜152。在所示的示例中,光学子系统158中的光学路径成角度,使得照明系统100作为整体可以满足空间或体积的要求。在一些具体实施中,此类子系统156和158均具有成角度的光学路径。在一些具体实施中,子系统156和158中的光学路径都不是成角度的。因此,多个光学子系统中的一个或多个光学子系统可以具有至少一个成角度的光学路径。
每个镜筒透镜142和148将入射在其上的发射照明聚焦到相应的图像检测器146和154上。在一些具体实施中,每个检测器146和154包括电荷耦合器件(CCD)阵列。在一些具体实施中,每个图像检测器146和154包括互补金属氧化物半导体(CMOS)传感器。
如前所述,照明系统100不必如图2所示。例如,反射镜128、132、140中的每一个可以用棱镜或改变照明方向的一些其他光学装置代替。每个透镜都可以用衍射光栅、衍射光学器件、菲涅耳透镜或者由入射照明产生准直或聚焦照明的一些其他光学装置来代替。此外,照明系统100可以被设计用于在除了蓝色/绿色之外的不同波段(例如,红色/绿色或蓝色/红色)上分离。本文所讨论的若干蓝色染料、绿色染料和红色染料进一步详述于下文的名称为“示例性荧光染料”的第III部分中。
图3是根据示例具体实施的包括红色染料和绿色染料的发射光谱的曲线图的示意图300。荧光相对于垂直轴线测量,并且波长在水平轴线上指示。荧光可以根据发射光的强度来测量。在一些具体实施中,可以使用确定光强度的一种或多种方式。例如,可以使用相对于校准基准的任意强度单位。光谱302和304可以被表征为绿色染料,并且光谱306和308可以被表征为红色染料。示意图300包括颜色通道310和312。颜色通道310可以与绿色发射滤光器相关联。例如,颜色通道310可以被认为是绿色通道。颜色通道312可以与红色发射滤光器相关联。例如,颜色通道312可以被认为是红色通道。
通道之间的光谱串扰可能是个问题。当顺序地和同时地照亮颜色通道时,均可能发生串扰。在一些具体实施中,较低波长通道进入较高波长通道中的串扰可以被视为较差的情况。例如,这可以涉及光谱302或304溢出到颜色通道312中。此处,光谱302至308在顺序照明中可能具有2.4%的串扰,并且在同时照明中可能具有2.8%的串扰。例如,这可以被视为同时采集和顺序采集之间的相对最小的串扰差值。
图4是展示使用图3的绿色染料和红色染料进行顺序成像的双通道测序分析的散点图400。在绿色通道中检测到的发射光的量在垂直轴线上指示,并且在红色通道中检测到的发射光的量在水平轴线上指示。发射402对应于绿色通道中的大量发射和红色通道中的极少发射或无发射。发射404对应于红色通道中的大量发射和绿色通道中的极少发射或无发射。发射406对应于绿色通道和红色通道这两者中的大量发射。发射408对应于绿色通道和红色通道这两者中的极少发射或无发射。因此,发射908为下述荧光染料的示例:该荧光染料不发射绿色通道的波段内的大量的光,并且不发射红色通道的波段内的大量的光。
发射402至408中的每个发射可以对应于检测到对应的核苷酸。例如,发射402可以对应于检测到胸腺嘧啶。例如,发射404可以对应于检测到胞嘧啶。例如,发射406可以对应于检测到腺嘌呤。例如,发射408可以对应于检测到鸟嘌呤。在本示例的顺序成像中,发射402至408彼此相对分开并且示出最小或可忽略不计的串扰。
图5是展示使用图3的绿色染料和红色染料进行同时多重成像的双通道测序分析的散点图。在绿色通道中检测到的发射光的量在垂直轴线上指示,并且在红色通道中检测到的发射光的量在水平轴线上指示。发射502对应于绿色通道中的大量发射和红色通道中的极少发射或无发射。发射504对应于红色通道中的大量发射和绿色通道中的极少发射或无发射。发射506对应于绿色通道和红色通道这两者中的大量发射。发射508对应于绿色通道和红色通道这两者中的极少发射或无发射。发射502至508中的每个发射可以对应于检测到对应的核苷酸。例如,发射502可以对应于检测到胸腺嘧啶。例如,发射504可以对应于检测到胞嘧啶。例如,发射506可以对应于检测到腺嘌呤。例如,发射508可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射502至508彼此相对分开并且示出最小或可忽略不计的串扰。
图6是描绘图4至图5的双通道测序分析的量度的示意图。量度600涉及顺序照明,并且量度602涉及同时照明。
也就是说,上述示例表明红色/绿色系统中的串扰水平可能相对低,即使在同时采集中也是如此。然而,对于其他颜色通道,串扰的量可能带来更多挑战。
图7是根据示例具体实施的包括蓝色染料和绿色染料的发射光谱的曲线图的示意图700。荧光相对于垂直轴线测量,并且波长在水平轴线上指示。光谱702和704可以被表征为蓝色染料,并且光谱706和708可以被表征为绿色染料。例如,光谱702可以对应于在蓝色照明中检测到腺嘌呤。例如,光谱704可以对应于检测到胞嘧啶。例如,光谱706可以对应于在绿色照明中检测到腺嘌呤。例如,光谱708可以对应于检测到胸腺嘧啶。
示意图700包括颜色通道710和712。颜色通道710可以与蓝色发射滤光器相关联。例如,颜色通道710可以被认为是蓝色通道。颜色通道712可以与绿色发射滤光器相关联。例如,颜色通道712可以被认为是绿色通道。
示意图700示出了光谱704(其可以对应于用于识别胞嘧啶碱基的蓝色发射)在颜色通道712中显著溢出。在一些具体实施中,这可能由于绿色激发波长和蓝色激发波长之间的间隔(其可以为例如约70nm)比红色波长和绿色波长之间的间隔(其可以为例如约140nm,参见图3)相对小得多而发生。也就是说,蓝色染料的发射光谱发射与绿色染料的发射光谱重叠的波长分量。因此,蓝色/绿色场景(例如,示意图700)中的荧光发射可能比红色/绿色场景(例如,示意图300)中的荧光发射接近得多。在采用蓝色/绿色照明的顺序照明中,串扰的量可以相对最小或可忽略不计。然而,在同时照明中,串扰可能相对显著。例如,串扰可以为约40%。
图8是展示使用图7的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图800。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射802对应于蓝色通道和绿色通道这两者中的极少发射或无发射。因此,发射802为下述荧光染料的示例:该荧光染料不发射蓝色通道的波段内的大量的光,并且不发射绿色通道的波段内的大量的光。发射804对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射806对应于蓝色通道和绿色通道这两者中的大量发射。发射808在散点图800中展开,并且至少与发射802和806的一部分重合。指示了发射808的质心808A。发射802至808中的每个发射可以对应于检测到对应的核苷酸。例如,发射802可以对应于检测到鸟嘌呤。例如,发射804可以对应于检测到胸腺嘧啶。例如,发射806可以对应于检测到腺嘌呤。例如,发射808可以对应于检测到胞嘧啶。在本示例的同时成像中,发射802至808具有相对显著的串扰。
图9是根据示例具体实施的包括替代性的蓝色染料和绿色染料的发射光谱的曲线图的另一个示意图900。荧光相对于垂直轴线测量,并且波长在水平轴线上指示。光谱902和904可以被表征为蓝色染料,并且光谱906可以被表征为绿色染料。示意图900包括颜色通道908和910。颜色通道908可以与蓝色发射滤光器相关联。例如,颜色通道908可以被认为是蓝色通道。颜色通道910可以与绿色发射滤光器相关联。例如,颜色通道910可以被认为是绿色通道。光谱902至906中的每个光谱可以对应于检测到对应的核苷酸。例如,光谱902可以对应于检测到胞嘧啶。例如,光谱904可以对应于检测到腺嘌呤。例如,光谱906可以对应于检测到胸腺嘧啶或腺嘌呤。
示意图900中的光谱发射示出了支持同时多色成像的染料。例如,与图7中的示意图700相比,光谱902的峰(其对应于胞嘧啶碱基测序染料的蓝色发射)发生严重蓝移。此处,光谱904在颜色通道908中具有峰值,而光谱902的峰值不在光谱908内。光谱906的峰值位于颜色通道910的下端的稍下方。示意图900可以指示顺序照明中的相对最小或可忽略不计的串扰。例如,示意图900可以指示同时照明中约12%的串扰。
示意图900中相对低水平的串扰可能与相应的染料彼此充分分开相关联。在一些具体实施中,间隔可以基于发射光谱的峰值波长或平均波长来限定。峰值波长可以对应于发射光强度的局部或全局最大值。平均波长可以对应于发射光谱范围内的平均波长。在一些具体实施中,染料可以被选择成使得它们相应的峰值波长或平均波长彼此至少具有预定的间隔。例如,光谱902的峰值波长可以与光谱906的峰值波长至少具有预定的间隔。又如,光谱904的峰值波长可以与光谱906的峰值波长至少具有预定的间隔。
在一些具体实施中,间隔可以基于重叠波长范围中的光量来限定。颜色通道910的左边缘910'可以对应于颜色通道910的波长范围的特定波长。可能期望的是确保光谱902或904不显著延伸到颜色通道910中。在一些具体实施中,可以将相应荧光染料之间的间隔限定为使得光谱902或904最多包括预定量的处于或高于与边缘910'相对应的波长的光。预定量可以被定义为绝对数(例如,作为发射光的量或其强度的上限阈值)或相对数(例如,作为由染料发射的荧光的总量的比例)。
参考图9至图16所述的蓝色染料及其变体在下文更详细地描述。
图10是展示使用图9的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图1000。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射1002对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射1004对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1006对应于蓝色通道和绿色通道这两者中的大量发射。发射1008对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射1002至1008中的每个发射可以对应于检测到对应的核苷酸。例如,发射1002可以对应于检测到胞嘧啶。例如,发射1004可以对应于检测到胸腺嘧啶。例如,发射1006可以对应于检测到腺嘌呤。例如,发射1008可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1002至1008彼此相对分开并且示出最小或可忽略不计的串扰。
图11是展示使用其他的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图1100。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射1102对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射1104对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1106对应于蓝色通道和绿色通道这两者中的大量发射。发射1108对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射1102至1108中的每个发射可以对应于检测到对应的核苷酸。例如,发射1102可以对应于检测到胞嘧啶。例如,发射1104可以对应于检测到胸腺嘧啶。例如,发射1106可以对应于检测到腺嘌呤。例如,发射1108可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1102至1108彼此相对分开并且示出最小或可忽略不计的串扰。
图12是展示使用其他的蓝色染料和绿色染料进行同时多重成像的双通道测序分析的散点图1200。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射1202对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射1204对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1206对应于蓝色通道和绿色通道这两者中的大量发射。发射1208对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射1202至1208中的每个发射可以对应于检测到对应的核苷酸。例如,发射1202可以对应于检测到胞嘧啶。例如,发射1204可以对应于检测到胸腺嘧啶。例如,发射1206可以对应于检测到腺嘌呤。例如,发射1208可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1202至1208彼此相对分开并且示出最小或可忽略不计的串扰。
可以使用不同的滤色器。可以选择用于同时采集的滤光器设计。在一些具体实施中,可以使用约583nm至660nm的绿色滤光器发射通带。例如,这可以表示与另一个绿色通带(诸如550nm至637nm)相比的偏移。
图13是根据示例具体实施的包括替代性的蓝色染料和绿色染料的发射光谱的曲线图和对应的滤光器范围的另一个示意图1300。荧光相对于垂直轴线测量,并且波长在水平轴线上指示。光谱1302和1304可以被表征为蓝色染料,并且光谱1306可以被表征为绿色染料。示意图1300包括颜色通道1308和1310。颜色通道1308可以与蓝色发射滤光器相关联并且可以与先前的滤光器1308'形成对比。例如,颜色通道1308可以被认为是蓝色通道。颜色通道1310可以与绿色发射滤光器相关联。例如,颜色通道1310可以被认为是绿色通道。光谱1302至1306中的每个光谱可以对应于检测到对应的核苷酸。例如,光谱1302可以对应于检测到胞嘧啶。例如,光谱1304可以对应于检测到腺嘌呤。例如,光谱1306可以对应于检测到胸腺嘧啶或腺嘌呤。
图14是展示使用图13的蓝色染料和绿色染料,使用第一滤光器范围进行同时多重成像的双通道测序分析的散点图1400。例如,第一滤光器范围可以对应于图13中的先前的滤光器1308'。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射1402对应于蓝色通道和绿色通道这两者中的大量发射。发射1404对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1406对应于蓝色通道和绿色通道这两者中的大量发射。发射1408对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射1402至1408中的每个发射可以对应于检测到对应的核苷酸。例如,发射1402可以对应于检测到胞嘧啶。例如,发射1404可以对应于检测到胸腺嘧啶。例如,发射1406可以对应于检测到腺嘌呤。例如,发射1408可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1402至1408彼此相对分开并且示出最小或可忽略不计的串扰。
图15是展示使用图13的蓝色染料和绿色染料,使用第二滤光器范围进行同时多重成像的双通道测序分析的散点图1500。例如,第二滤光器范围可以对应于图13中的颜色通道1308'。在蓝色通道中检测到的发射光的量在垂直轴线上指示,并且在绿色通道中检测到的发射光的量在水平轴线上指示。发射1502对应于蓝色通道和绿色通道这两者中的大量发射。发射1504对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1506对应于蓝色通道和绿色通道这两者中的大量发射。发射1508对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射1502至1508中的每个发射可以对应于检测到对应的核苷酸。例如,发射1502可以对应于检测到胞嘧啶。例如,发射1504可以对应于检测到胸腺嘧啶。例如,发射1506可以对应于检测到腺嘌呤。例如,发射1508可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1502至1508彼此相对分开并且示出最小或可忽略的串扰。
间隔可以采用一种或多种方式来限定。在一些具体实施中,波长发射间隔可以基于来自光谱1304的低于与颜色通道1310相关联的波长的发射光的量来限定。可以限定荧光染料之间的波长发射间隔,使得荧光染料之一的发射光谱最多包括预定量的处于或高于与另一种荧光染料相关联的波长(例如,最接近的边界波长,或特征波长)的光。例如,该量可以指示光谱1304的量X(例如,总荧光的百分比)出现在颜色通道1310的较低波长(例如,该颜色通道的下限)以下。在一些具体实施中,前述示例中的数字X可以是任何合适的数字,诸如值的范围。例如,该范围可以是荧光的约0%至10%。又如,该范围可以是荧光的约0.5%至5%。又如,该范围可以是荧光的约0.1%至1%。在一些具体实施中,该间隔可以基于光谱1306与光谱1302或1304中的任一者之间的平均或峰值波长间隔来限定。例如,如果光谱1304的平均波长(例如,荧光发射的平均波长)或光谱1304的峰值波长(例如,荧光强度最大处的波长)与光谱1306的平均波长或峰值波长分开的量大于预定量,则光谱1304和1306可以被认为是分开的。预定量可以是绝对值。例如,平均波长或峰值波长可以分开至少约50nm至100nm,诸如分开约70nm。预定量可以是相对值。例如,平均波长或峰值波长可以分开平均波长或峰值波长的至少约5%至20%,诸如分开较低或较高的平均波长或峰值波长的约13%。
总而言之,使用本文所述的改进可以实现多色图像采集,这先前被认为是极具挑战性的并且成功的机会非常小。现在将描述改进的一些更多的示例。
图16是展示使用图9的蓝色染料和绿色染料和图13的第二滤光器范围进行同时多重成像的双通道测序分析的散点图1600。在绿色通道中检测到的发射光的量在垂直轴线上指示,并且在蓝色通道中检测到的发射光的量在水平轴线上指示。发射1602对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射1604对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射1606对应于绿色通道和蓝色通道这两者中的大量发射。发射1608对应于绿色通道和蓝色通道这两者中的极少发射或无发射。发射1602至1608中的每个发射可以对应于检测到对应的核苷酸。例如,发射1602可以对应于检测到胸腺嘧啶。例如,发射1604可以对应于检测到胞嘧啶。例如,发射1606可以对应于检测到腺嘌呤。例如,发射1608可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射1602至1608彼此相对分开并且示出最小或可忽略不计的串扰。
上述发射1602至1608中的每一者表示在两个检测器146和154(图2)之一处收集的强度随时间推移的分布。如图13中的发射光谱的曲线图所指示,“C”核碱基与蓝色染料相关联,因此发射1604具有大量的高蓝色照明水平和低绿色照明水平。这就是识别“C”核碱基的方式。“T”核碱基经由具有大量的绿色照明水平和低蓝色照明水平的发射1602来识别;这就是识别“T”核碱基的方式。
由发射1606识别的“A”核碱基具有高蓝色照明水平和高绿色照明水平的混合体。需注意,光谱1304和1306(图13)均对应于“A”核碱基。类似地,“G”核碱基由具有低蓝色照明水平和低绿色照明水平的发射1608来识别。
发射1602至1608虽然具有关于具有显著量的展开的相应平均值的分布,但很大程度上不表现出显著量的串扰。这样,可以容易地识别核碱基中的每一种。
图17是描绘图16的双通道测序分析的量度的示意图。量度1700涉及运行汇总。度量1702涉及第一读段,并且度量1704涉及第二读段。
图18是表示作为本文所述的经改进技术的一部分的可以涉及产生多重荧光图像并对其进行分析的示例顺序步骤的时间线1800的示意图。时间线1800可以与本文别处所述的一个或多个示例一起使用。时间进程相对于水平轴线测量,并且相应的操作沿垂直轴线指示。
示意性地展示的多色图像捕获1802可以包括一个或多个成像时间块1804,以及一个或多个相机相关时间块1806。在一些具体实施中,成像时间块1804可以对应于系统执行激光二极管的升温、安排一次或多次曝光所需的时间,以及曝光的曝光时间。在成像时间块1804之后,可以跟随相机相关时间块1806。例如,相机相关时间块1806可以包括开销时间、与各个相机快照有关的相机响应时间,以及数据传输的时间。在相机相关时间块1806之后,可以跟随成像时间块1804中的另一个。因此,多色图像捕获1802可以包括在成像时间块1804和相机相关时间块1806之间交替的序列。例如,这可以涉及引入染料、曝光时间和图像的相机快照。
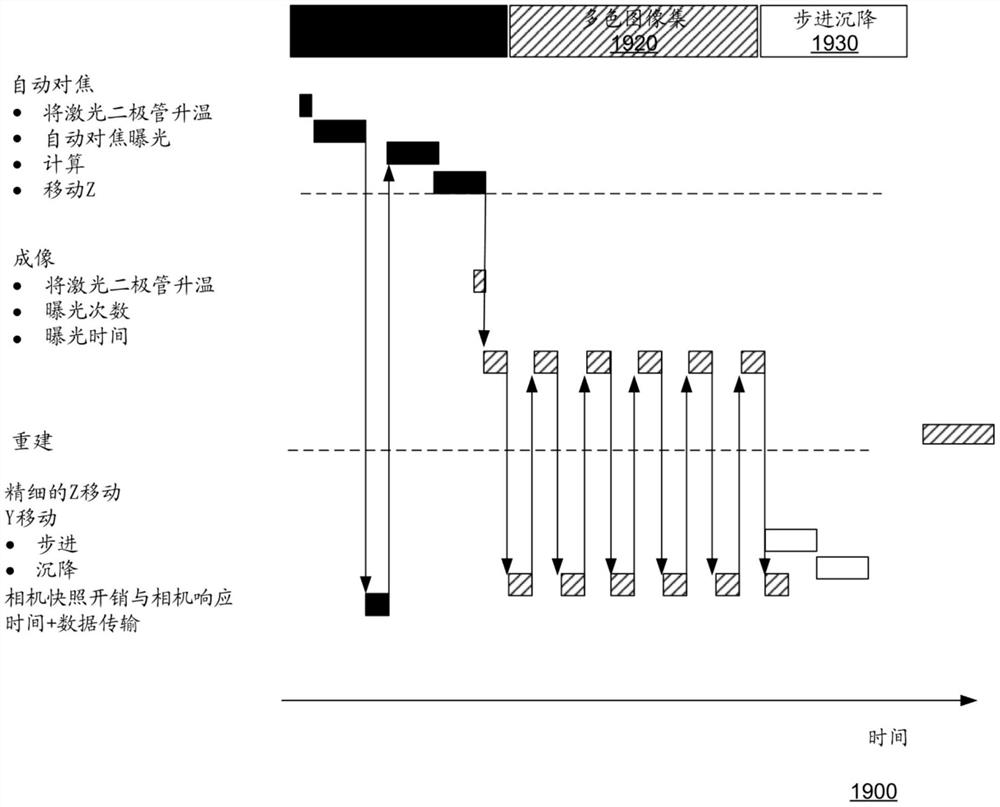
图19是表示作为本文所述的经改进技术的一部分的可以涉及产生多重荧光图像并对其进行分析的示例顺序步骤的时间线1900的示意图。如图19所示,时间线1900包括自动对焦过程1910、多色图像集采集过程1920,以及步进沉降过程1930。水平轴线表示实耗时间。下面的一些示例也将参考图2,仅为了进行示意性的说明。
自动对焦过程1910位于时间线1900的开端。首先,将激光二极管升温并且生成自动对焦曝光。基于相机(即,检测器)快照开销、响应时间和数据传输时间,确定了将物镜134沿其轴线(即,“z”方向)移动以建立物镜134的以下位置:在该位置处,聚焦的照明光束入射在相对于流动池136的期望的对象平面处。
在物镜134的该位置已被设定之后,可以开始多色图像集采集过程520。例如,这可以涉及使用蓝色通道和绿色通道、或红色通道和绿色通道、或颜色通道的另一种选择来捕获图像。对于蓝色图像检测器146和绿色图像检测器154中的每一者,在激光二极管已升温之后,然后将样品照明预定的时间,以使一种或多种染料发出荧光。
多重荧光图像由图像检测器146和154采集,并且所得的数据可以被传输到处理系统。如图19所示,此处针对两个检测器重复该过程六次,以便在每个检测器上采集六个图像。在一些具体实施中,图像集采集过程可以重复若干次,例如,两次、三次、四次、五次、七次、八次、九次、十次、十一次、十二次以及更多次,具体取决于该具体实施。传输的数据可以用于DNA序列的重建。遗传序列(例如,DNA序列)的重建和/或确定可以在捕获所有图像并且已调用核苷酸碱基之后发生。
在已采集了多色(例如,蓝色和绿色)图像及其数据之后,将流动池136的不同部分移动到用于成像的位置。此处,当流动池136在台上时,台被瓦片移开,瓦片可以是流动池136的限定的细分部分,然后发生步进沉降过程1930,以允许流动池136和任何其他机械部件在下一成像过程发生之前变得基本上静止。也就是说,流动池136在台上前进(步进),并且在移动流动池136之后,允许流动池136中的液体沉降一些时间。
图20是表示作为本文所述的经改进技术的一部分的可以涉及产生多重荧光图像并对其进行分析的示例顺序步骤的时间线2000的示意图。如图20所示,时间线2000包括自动对焦过程2010、多色(例如,蓝色和绿色)图像集采集过程2020,以及步进沉降过程2030。水平轴线表示实耗时间。下面的一些示例也将参考图2,仅为了进行示意性的说明。
自动对焦过程2010位于时间线2000的开端。首先,将激光二极管升温并且生成自动对焦曝光。基于相机(即,检测器)快照开销、响应时间和数据传输时间,确定了将物镜134沿其轴线(即,“z”方向)移动以建立物镜134的以下位置:在该位置处,聚焦的照明光束入射在相对于流动池136的期望的对象平面处。
在物镜134的该位置已被设定之后,可以开始多色图像集采集过程2020。对于蓝色图像检测器146和绿色图像检测器154中的每一者,在激光二极管已升温之后,然后将样品照明预定的时间,以使一种或多种染料发出荧光。在2040处,在利用结构化照明显微镜(SIM)的具体实施中,可以移动光栅或其他SIM部件以修改一个或多个条纹的相位。所述一个或多个条纹可以根据一些周期性出现。移动这些条纹以便为样品的不同部分提供照明,同时阻挡在其他部分照明。多重荧光图像由图像检测器146和154采集,并且所得的数据可以被传输到处理系统。如图20所示,此处针对两个检测器重复该过程六次,以便在每个检测器上采集六个图像。在一些具体实施中,图像集采集过程可以重复若干次,例如,两次、三次、四次、五次、七次、八次、九次、十次、十一次、十二次以及更多次,具体取决于该具体实施。在这些曝光和捕获期间,传输的数据用于DNA序列的重建。
在已采集了多色图像及其数据之后,将流动池136的不同部分移动到用于成像的位置。此处,当流动池136在台上时,台被瓦片移开,瓦片可以是流动池136的限定的细分部分,然后发生步进沉降过程2030,以允许流动池136和任何其他机械部件在下一成像过程发生之前变得基本上静止。也就是说,流动池136在台上前进(步进),并且在移动流动池136之后,允许流动池136中的液体沉降一些时间。
图21是展示根据本文所述的技术来执行测序操作的方法2100的流程图。方法2100可以使用本文所述的照明系统100来执行。方法2100可以包括比所示更多或更少的操作。除非另外指明,否则方法2100的操作中的两个或更多个操作能够以不同的顺序来执行。为了进行示意性的说明,将参考本文所述的其他示例的一些方面。
在2102处,提供包含第一核苷酸和第二核苷酸的样品。例如,此类核苷酸可以是图2的流动池136中的样品材料的一部分。
在2104处,使样品与第一荧光染料和第二荧光染料接触。第一荧光染料响应于第一激发照明光而发射在第一波段内的第一发射光,并且第二荧光染料响应于第二激发照明光而发射在第二波段内的第二发射光。例如,第一荧光染料可以包括具有图13所示的光谱1304的蓝色染料,而第二染料可以是具有图13所示的光谱1306的绿色染料。
在2106处,同时收集多重荧光。多重荧光至少包括第一发射光和第二发射光。第一发射光可以是对应于第一波段的第一颜色通道,并且第二发射光可以是对应于第二波段的第二颜色通道。例如,可以使用蓝色通道和绿色通道。又如,可以使用蓝色通道、绿色通道和红色通道。一种染料发射的峰(例如,蓝色染料的峰)应当在光谱上与另一种染料发射的峰(例如,绿色染料的峰)具有足够大的间隔,使得较低波长的发射光(例如,蓝色)不会在另一个(例如,绿色)发射检测通道中溢出。这将导致有时被称为串扰的现象,此时发射光(例如,光谱的尾部)被另一个颜色通道的检测器检测到。在光谱具有相对长的尾部的情况下,可以移动另一个发射滤光器的起始点,以消除或减少串扰量。
在2108处,可以识别第一核苷酸和第二核苷酸。第一核苷酸可以基于第一颜色通道的第一波段来识别,并且第二核苷酸可以基于第二颜色通道的第二波段来识别。
图22是展示根据本文所述的技术来执行测序操作的方法2200的流程图。方法2200可以使用本文所述的照明系统100来执行。方法2200可以包括比所示更多或更少的操作。除非另外指明,否则方法2200的操作中的两个或更多个操作能够以不同的顺序来执行。为了进行示意性的说明,将参考本文所述的其他示例的一些方面。
在2202处,可以捕获多重荧光图像。在一些具体实施中,这可以基于用多种类型的照明光同时对用染料标记的样品照明,以及从多于一个颜色通道中(包括但不限于蓝色通道和绿色通道中)的发射光捕获图像来进行。例如,图18中的成像时间块1804可以对应于当前操作。
在2204处,可以执行与图像捕获相关联的一个或多个操作。在一些具体实施中,这可以包括相机响应时间、数据传输和/或开销操作。例如,相机相关时间块1806可以对应于当前操作。
在2206处,可以执行2202和2204处的操作的零次或更多次重复。在一些具体实施中,2202和2204处的操作可以在多个周期中交替地执行。例如,可以执行六次,以在每个检测器上获取六个图像(参见例如图18)。
在2208处,可以基于多重荧光图像来识别核苷酸。例如,可以基于对应的颜色通道来识别每种核苷酸。
图23是展示根据本文所述的技术来执行测序操作的方法2300的流程图。方法2300可以使用本文所述的照明系统100来执行。方法2300可以包括比所示更多或更少的操作。除非另外指明,否则方法2300的操作中的两个或更多个操作能够以不同的顺序来执行。为了进行示意性的说明,将参考本文所述的其他示例的一些方面。
在2302处,可以发起自动对焦过程。在一些具体实施中,发起自动对焦过程2010(图20)。
在2304处,可以将一个或多个激光二极管升温。在一些具体实施中,这是自动对焦过程的一部分。
在2306处,可以执行自动对焦曝光。在一些具体实施中,这是自动对焦过程的一部分。
在2308处,可以计算位置。在一些具体实施中,这可以包括确定是否移动物镜。例如,可以确定是否沿着z方向移动物镜以及沿着z方向将物镜移动多少距离。这可以是自动对焦过程的一部分。
在2310处,可以移动物镜。在一些具体实施中,这可以是自动对焦过程的一部分。
在2312处,可以发起多色图像采集。在一些具体实施中,这可以涉及采集多于一个多重荧光图像。
在2314处,可以将一个或多个激光二极管升温。在一些具体实施中,这是多色图像采集过程的一部分。
在2316处,可以确定曝光的次数。在一些具体实施中,这是多色图像采集过程的一部分。
在2318处,可以捕获曝光。在一些具体实施中,这可以使用用于多个颜色通道中的每个颜色通道的单独的检测器来完成。例如,这是多色图像采集过程的一部分。
在2320处,可以移动一个或多个条纹。在一些具体实施中,使用SIM,并且可以移动光栅或其他SIM部件。例如,移动可以根据一些周期性来完成。这可以是多色图像采集过程的一部分。在不涉及SIM的具体实施中,该操作可以省略。
在2322处,可以发起步进沉降过程。
在2324处,可以进行精细的z方向移动。这可以是步进沉降过程的一部分。
在2326处,可以进行y方向移动。这可以涉及步进(例如,移动管状柱或其他样品载体)和沉降(例如,允许载体及其内容物停止移动,以便消除或最小化对下一次捕获的运动影响)的单独操作。
在2328处,可以执行数据传输。在一些具体实施中,可以转移一个或多个多重荧光图像进行分析。例如,可以进行该分析以识别样品中的核苷酸。
图24是展示用本文所述的染料I-4标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图2400。在蓝色通道中检测到的发射光的量在水平轴线上指示,并且在绿色通道中检测到的发射光的量在垂直轴线上指示。发射2402对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射2404对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射2406对应于蓝色通道和绿色通道这两者中的大量发射。发射2408对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射2402至2408中的每个发射可以对应于检测到对应的核苷酸。例如,发射2402可以对应于检测到胸腺嘧啶。例如,发射2404可以对应于检测到胞嘧啶。例如,发射2406可以对应于检测到腺嘌呤。例如,发射2408可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射2402至2408彼此相对分开并且示出最小或可忽略不计的串扰。
图25是展示用本文所述的染料I-5标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图2500。在蓝色通道中检测到的发射光的量在水平轴线上指示,并且在绿色通道中检测到的发射光的量在垂直轴线上指示。发射2502对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射2504对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射2506对应于蓝色通道和绿色通道这两者中的大量发射。发射2508对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射2502至2508中的每个发射可以对应于检测到对应的核苷酸。例如,发射2502可以对应于检测到胸腺嘧啶。例如,发射2504可以对应于检测到胞嘧啶。例如,发射2506可以对应于检测到腺嘌呤。例如,发射2508可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射2502至2508彼此相对分开并且示出最小或可忽略不计的串扰。
图26是展示用本文所述的染料I-6标记的完全官能化的A核苷酸在双通道测序分析中的可用性的散点图2600。在绿色通道中检测到的发射光的量在垂直轴线上指示,并且在蓝色通道中检测到的发射光的量在水平轴线上指示。发射2602对应于绿色通道中的大量发射和蓝色通道中的极少发射或无发射。发射2604对应于蓝色通道中的大量发射和绿色通道中的极少发射或无发射。发射2606对应于蓝色通道和绿色通道这两者中的大量发射。发射2608对应于蓝色通道和绿色通道这两者中的极少发射或无发射。发射2602至2608中的每个发射可以对应于检测到对应的核苷酸。例如,发射2602可以对应于检测到胸腺嘧啶。例如,发射2604可以对应于检测到胞嘧啶。例如,发射2606可以对应于检测到腺嘌呤。例如,发射2608可以对应于检测到鸟嘌呤。在本示例的同时成像中,发射2602至2608彼此相对分开并且示出最小或可忽略不计的串扰。
具有改进的荧光特性(诸如合适的荧光强度、形状,和荧光的波长最大值)的荧光染料分子可以提高核酸测序的速度和准确性。当在水基生物缓冲液中并且在较高温度下进行测量时,强荧光信号尤其重要,因为大多数染料的荧光强度在此类条件下显著较低。此外,染料所附接的碱基的性质也影响荧光最大值、荧光强度和染料的其他光谱特性。核碱基与荧光染料之间的序列特异性相互作用可以通过荧光染料的特异性设计来定制。荧光染料结构的优化可以提高核苷酸掺入的效率、降低测序误差的水平,并且减少核酸测序中试剂的使用,从而降低核酸测序的成本。
一些光学和技术的开发已引起图像质量的极大改善,但是最终受到光学分辨率差的限制。一般来讲,光学显微镜法的光学分辨率限于以所使用的光的波长的大约一半间隔开的对象。实际上,只有相距相当远(至少200nm至350nm)的对象才可以通过光学显微镜法分辨。提高图像分辨率并且增加每单位表面积的可分辨对象数量的一种方法是使用较短波长的激发光。例如,如果用相同的光学器件将光波长缩短Δλ约100nm,则分辨率将更好(约Δ50nm/(约15%)),将记录较少失真的图像,并且可识别区域上的对象的密度将增加约35%。
某些核酸测序方法采用激光来激发染料标记的核苷酸并对其进行检测。这些仪器使用较长波长的光,诸如红色激光,连同能够在660nm处激发的适当染料。为了在保持可用分辨率的同时检测更密集堆积的核酸测序簇,可以使用较短波长的蓝色光源(450nm至460nm)。在这种情况下,光学分辨率可以不受较长波长红色荧光染料的发射波长的限制,而是受能够由次长波长光源(例如,由532nm处的绿色激光)激发的染料的发射的限制。
以下是环外胺取代的香豆素衍生物的示例。这些化合物可以用作荧光标记,特别是用于核酸测序应用中的核苷酸标记。在一些方面,这些染料吸收短波长的光,最佳地吸收450nm至460nm波长的光,并且在使用具有450nm至460nm波长的蓝色波长激发源的情况下是特别有利的。由于荧光发射的波长较短,所以蓝色波长激发允许检测和分辨每单位面积较高密度的特征。当此类染料用于与核苷酸的缀合物中时,可以看到在核酸测序方法期间获得的测序读段的长度、强度、准确性和质量方面的改进。
本文的一些示例涉及特别适用于荧光检测和合成测序方法的环外胺取代的香豆素化合物。本文描述了式(I)结构的染料及其衍生物,以及它们的盐。
在一些方面,X为O。在一些方面,X为S。在一些方面,X为Se。在一些方面,X为NR
在一些方面,R为H、卤基、-CO
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,环A为3至7元单杂环。在一些另外的具体实施中,3至7元单杂环包含一个氮原子。在一些方面,环A为
式(I)的
式(I)的化合物的特定示例包括:其中X为O、S或NH;R、R
式(I)的化合物的特定示例包括:其中X为O、S或NH;R、R
式(I)的化合物的特定示例包括:其中X为O、S或NH;R、R
环外胺取代的香豆素染料的具体示例包括:
特别有用的化合物是用如本文所述的染料标记的核苷酸或寡核苷酸。标记的核苷酸或寡核苷酸可以经由羧基或烷基-羧基基团附接到本文所公开的染料化合物以形成酰胺或烷基-酰胺。例如,本文所公开的染料化合物经由式(I)的R
标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的封闭基团。该封闭基团可以附接在核糖或脱氧核糖上的任何位置处。在特定具体实施中,该封闭基团位于核苷酸的核糖或脱氧核糖的3’OH位置处。
本文还公开了特别适用于荧光检测和合成测序方法的叔胺取代的香豆素化合物。叔胺取代的香豆素染料的具体实施具有优异的水中溶解度,同时在水或极性溶剂/缓冲液中表现出强荧光,因此适用于水性环境中的核苷酸标记和测序应用。本文所述的具体实施涉及式(II)结构的染料及其衍生物,以及它们的盐。
在一些方面,X为O。在一些方面,X为S。在一些方面,X为Se。在一些方面,X为NR
在一些方面,R为H、卤基、-CO
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
式(II)的
-(CH
式(II)的化合物的特定示例包括:其中X为O、S或NH;R、R
叔胺取代的香豆素染料的具体示例包括:
具有仲胺取代的附加香豆素染料包括:
特别有用的化合物是用如本文所述的染料标记的核苷酸或寡核苷酸。标记的核苷酸或寡核苷酸可以经由羧基或烷基-羧基基团附接到本文所公开的染料化合物以形成酰胺或烷基-酰胺。例如,本文所公开的染料化合物经由式(II)的R
-CO
标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的封闭基团。该封闭基团可以附接在核糖或脱氧核糖上的任何位置处。在特定具体实施中,该封闭基团位于核苷酸的核糖或脱氧核糖的3’OH位置处。
本文所公开的化合物通常吸收低于500nm的区域中的光。本文示出的化合物或核苷酸可以用于检测、测量或识别生物系统(包括例如其过程或组分)。可以采用所述化合物或核苷酸的一些技术包括测序、表达分析、杂交分析、遗传分析、RNA分析、细胞测定(例如,细胞结合或细胞功能分析)或者蛋白质测定(例如,蛋白质结合测定或蛋白质活性测定)。该用途可以是在用于执行特定技术的自动化仪器(诸如自动化测序仪器)上。测序仪器可以包含在不同波长下操作的两个激光器。
本文公开了合成本公开的化合物的方法。根据本公开的染料可以由多种不同的合适起始物质合成。用于制备香豆素染料的方法是本领域熟知的。
除非另有定义,否则本文所用的所有技术术语和科学术语的含义均与本领域的普通技术人员通常理解的含义相同。如本文所用,术语“共价连接的”或“共价键合的”是指形成特征在于原子之间共用电子对的化学键合。例如,共价连接的聚合物涂层是指与基底的官能化表面形成化学键的聚合物涂层,这与经由其他方式(例如,粘附或静电相互作用)连接到该表面形成比较。应当理解,共价附接到表面的聚合物也可以经由除共价附接之外的方式键合。
如本文所用,术语“卤素”或“卤基”意味着元素周期表第7列的放射性稳定原子中的任一种,例如,氟、氯、溴或碘,其中氟和氯是优选的。
如本文所用,“烷基”是指完全饱和(即,不包含双键和三键)的直链或支链烃链。烷基基团可以具有1至20个碳原子(每当在本文中出现时,诸如“1至20”的数值范围是指给定范围内的每个整数;例如,“1至20个碳原子”意味着烷基基团可以由1个碳原子、2个碳原子、3个碳原子等,最多至并包括20个碳原子组成,但本定义还涵盖出现其中没有指定数值范围的术语“烷基”)。烷基基团还可以是具有1至9个碳原子的中等大小烷基。烷基基团还可以是具有1至6个碳原子的低级烷基。烷基基团可以被命名为“C
如本文所用,“烷氧基”是指式–OR(其中R为如上文所定义的烷基),诸如“C
如本文所用,“烯基”是指包含一个或多个双键的直链或支链烃链。烯基基团可以具有2至20个碳原子,但本定义还涵盖出现其中没有指定数值范围的术语“烯基”。烯基基团还可以是具有2至9个碳原子的中等大小烯基。烯基基团还可以是具有2至6个碳原子的低级烯基。烯基基团可以被命名为“C
如本文所用,“炔基”是指包含一个或多个三键的直链或支链烃链。炔基基团可以具有2至20个碳原子,但本定义还涵盖出现其中没有指定数值范围的术语“炔基”。炔基基团还可以是具有2至9个碳原子的中等大小炔基。炔基基团还可以是具有2至6个碳原子的低级炔基。炔基基团可以被命名为“C
如本文所用,“杂烷基”是指在链骨架中含有一个或多个杂原子(即,除碳之外的元素,包括但不限于氮、氧和硫)的直链或支链烃链。杂烷基基团可以具有1至20个碳原子,但本定义还涵盖出现其中没有指定数值范围的术语“杂烷基”。杂烷基基团还可以是具有1至9个碳原子的中等大小杂烷基。杂烷基基团还可以是具有1至6个碳原子的低级杂烷基。杂烷基基团可以被命名为“C
术语“芳族”是指具有共轭π电子体系的环或环系,并且包括碳环芳族基团(例如,苯基)和杂环芳族基团(例如,吡啶)这两者。该术语包括单环基团或稠环多环(即,共用相邻原子对的环)基团,前提条件是整个环系是芳族的。
如本文所用,“芳基”是指在环骨架中仅包含碳的芳族环或环系(即,共用两个相邻碳原子的两个或更多个稠环)。当芳基为环系时,该环系中的每个环均为芳族的。芳基基团可以具有6至18个碳原子,但本定义还涵盖出现其中没有指定数值范围的术语“芳基”。在一些具体实施中,芳基基团具有6至10个碳原子。芳基基团可以被命名为“C
“芳烷基”或“芳基烷基”为作为取代基经由亚烷基基团连接的芳基基团,诸如“C
如本文所用,“杂芳基”是指在环骨架中含有一个或多个杂原子(即,除碳之外的元素,包括但不限于氮、氧和硫)的芳族环或环系(即,共用两个相邻原子的两个或更多个稠环)。当杂芳基为环系时,该环系中的每个环均为芳族的。杂芳基基团可以具有5至18个环元(即,构成环骨架的原子(包括碳原子和杂原子)的数目),但本定义还涵盖出现其中没有指定数值范围的术语“杂芳基”。在一些具体实施中,杂芳基基团具有5至10个环元或者5至7个环元。杂芳基基团可以被命名为“5至7元杂芳基”、“5至10元杂芳基”或类似的名称。杂芳基环的示例包括但不限于呋喃基、噻吩基、酞嗪基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、三唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、喹啉基、异喹啉基、苯并咪唑基、苯并噁唑基、苯并噻唑基、吲哚基、异吲哚基和苯并噻吩基。
“杂芳烷基”或“杂芳基烷基”为作为取代基经由亚烷基基团连接的杂芳基基团。示例包括但不限于2-噻吩基甲基、3-噻吩基甲基、呋喃基甲基、噻吩基乙基、吡咯基烷基、吡啶基烷基、异噁唑基烷基和咪唑基烷基。在一些情况下,亚烷基基团为低级亚烷基基团(即,C
如本文所用,“碳环基”意味着在环系骨架中仅含有碳原子的非芳族环状环或环系。当碳环基为环系时,两个或更多个环可以以稠合、桥接或螺接的方式接合在一起。碳环基可以具有任何饱和度,前提条件是环系中的至少一个环不是芳族的。因此,碳环基包括环烷基、环烯基和环炔基。碳环基基团可以具有3至20个碳原子,但本定义还涵盖出现其中没有指定数值范围的术语“碳环基”。碳环基基团也可以是具有3至10个碳原子的中等大小碳环基。碳环基基团也可以是具有3至6个碳原子的碳环基。碳环基基团可以被命名为“C
如本文所用,“环烷基”意味着完全饱和的碳环基环或环系。示例包括环丙基、环丁基、环戊基和环己基。
如本文所用,“杂环基”意味着在环骨架中包含至少一个杂原子的非芳族环状环或环系。杂环基可以以稠合、桥接或螺接的方式接合在一起。杂环基可以具有任何饱和度,前提条件是环系中的至少一个环不是芳族的。杂原子可以存在于环系中的非芳族环或芳族环中。杂环基基团可以具有3至20个环元(即,构成环骨架的原子(包括碳原子和杂原子)的数目),但本定义还涵盖出现其中没有指定数值范围的术语“杂环基”。杂环基基团也可以是具有3至10个环元的中等大小杂环基。杂环基基团也可以是具有3至6个环元的杂环基。杂环基基团可以被命名为“3至6元杂环基”或类似的名称。在优选的六元单环杂环基中,杂原子选自O、N或S中的一个至最多三个,并且在优选的五元单环杂环基中,杂原子选自一个或两个选自O、N或S的杂原子。杂环基环的示例包括但不限于吖庚因基、吖啶基、咔唑基、噌啉基、二氧戊环基、咪唑啉基、咪唑烷基、吗啉基、环氧乙烷基、氧杂环庚烷基、硫杂环庚烷基、哌啶基、哌嗪基、二氧代哌嗪基、吡咯烷基、吡咯烷酮基、吡咯烷二酮基、4-哌啶酮基、吡唑啉基、吡唑烷基、1,3-二噁英基、1,3-二噁烷基、1,4-二噁英基、1,4-二噁烷基、1,3-氧硫杂环己烷基、1,4-氧硫杂环己烯基、1,4-氧硫杂环己烷基、2H-1,2-噁嗪基、三噁烷基、六氢-1,3,5-三嗪基、1,3-间二氧杂环戊烯基、1,3-二氧戊环基、1,3-二噻吩基、1,3-二噻烷基、异噁唑啉基、异噁唑烷基、噁唑啉基、噁唑烷基、噁唑烷酮基、噻唑啉基、噻唑烷基、1,3-氧硫杂环戊烷基、二氢吲哚基、异二氢吲哚基、四氢呋喃基、四氢吡喃基、四氢噻吩基、四氢噻喃基、四氢-1,4-噻嗪基、硫代吗啉基、二氢苯并呋喃基、苯并咪唑烷基和四氢喹啉。
“O-羧基”基团是指其中R选自氢、C
“C-羧基”基团是指其中R选自由氢、C
“磺酰基”基团是指其中R选自氢、C
“亚磺酸基”基团是指“-S(=O)OH”基团。
“S-亚磺酰氨基”基团是指其中R
“N-亚磺酰氨基”基团是指其中R
“C-酰氨基”基团是指其中R
“N-酰氨基”基团是指其中R
“氨基”基团是指其中R
“氨基烷基”基团是指经由亚烷基基团连接的氨基基团。
“烷氧基烷基”基团是指经由亚烷基基团连接的烷氧基基团,诸如“C
如本文所用,取代的基团衍生自未取代的母体基团,其中已存在一个或多个氢原子与另一个原子或基团的交换。除非另外指明,否则当基团被认为是“取代的”时,这意味着该基团被一个或多个取代基取代,所述取代基独立地选自:C
在一些具体实施中,取代的烷基基团、烯基基团或炔基基团被一个或多个选自由以下项组成的组的取代基取代:卤基、-CN、SO
本文所述的化合物可以表示为若干内消旋形式。在绘制单一结构的情况下,预期存在任何相关的内消旋形式。本文所述的香豆素化合物由单一结构表示,但同样可以被显示为任何相关的内消旋形式。一些内消旋结构在下面针对式(I)示出:
一些内消旋结构在下面针对式(II)示出:
在示出本文所述化合物的单一内消旋形式的每种情况下,同样设想了替代性的内消旋形式。
如本领域的普通技术人员所理解的,本文所述的化合物可以以离子化形式存在,例如,-CO2-或-SO3-。如果化合物包含带正电荷或带负电荷的取代基基团,例如,SO3-,则其还可以包含带负电荷或带正电荷的抗衡离子,使得该化合物整体为中性的。在其他方面,该化合物可以以盐形式存在,其中抗衡离子由共轭酸或碱提供。
应当理解,根据上下文,某些基团命名惯例可以包括单基或二基。例如,当取代基需要两个与分子其余部分的附接点时,应当理解,该取代基为二基。例如,被识别为需要两个附接点的烷基的取代基包括二基,诸如–CH
当两个“相邻的”R基团据称“连同它们所附接的原子一起”形成环时,这意味着原子、居间键和两个R基团的集合体为所述的环。例如,当存在以下子结构时:
并且R
其中A为含有所描绘的双键的芳环或碳环基。
根据本公开的一个方面,提供了适用于附接到底物部分的染料化合物,特别是包含连接基基团以使得能够附接到底物部分的染料化合物。底物部分事实上可以是本公开的染料可以与之缀合的任何分子或物质,并且以非限制性示例的方式,可以包括核苷、核苷酸、多核苷酸、碳水化合物、配体、颗粒、固体表面、有机聚合物和无机聚合物、染色体、核、活细胞,以及它们的组合或装配物。染料可以通过任选的连接基通过多种方式(包括疏水吸引、离子吸引和共价连接)缀合。在一些方面,染料通过共价连接缀合至底物。更具体地讲,共价连接借助于连接基基团实现。在一些情况下,此类标记的核苷酸也被称为“经修饰的核苷酸”。
本公开还提供了用本文所述染料中的一种或多种染料标记的核苷和核苷酸(经修饰的核苷酸)的缀合物。标记的核苷和核苷酸可用于标记通过诸如(以非限制性示例的方式)在PCR扩增、等温扩增、固相扩增、多核苷酸测序(例如,固相测序)、切口平移反应等中的酶促合成形成的多核苷酸。
与生物分子的附接可以经由式(I)的化合物的R、R
-CO
在一些具体实施中,染料化合物可以经由核苷酸碱基共价地附接到寡核苷酸或核苷酸。例如,标记的核苷酸或寡核苷酸可以具有通过连接基部分附接到嘧啶碱基的C5位置或7-脱氮嘌呤碱基的C7位置的标记。标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的3'-OH封闭基团。
如本文所述的荧光染料的特别有用的应用是用于标记生物分子,例如,核苷酸或寡核苷酸。本申请的一些具体实施涉及用如本文所述的荧光化合物标记的核苷酸或寡核苷酸。
如本文所公开的染料化合物可以在取代基位置之一处包括反应性连接基基团,用于将该化合物共价附接至底物或另一分子。反应性连接基团是能够形成键(例如,共价键或非共价键)、特别是共价键的部分。在一个特定具体实施中,连接基可以是可裂解的连接基。使用术语“可裂解的连接基”并不意在暗示需要除去整个连接基。裂解位点可以位于连接基上确保该连接基的一部分在裂解后保持附接到染料和/或底物部分的某个位置处。以非限制性示例的方式,可裂解的连接基可以是亲电可裂解的连接基、亲核可裂解的连接基、可光裂解的连接基、在还原条件下可裂解的(例如含有二硫化物或叠氮化物的连接基)、在氧化条件下可裂解的、通过使用安全捕获连接基可裂解的,以及通过消除机制可裂解的。使用可裂解的连接基将染料化合物附接到底物部分确保了如果需要的话,可以在检测后移除标记,从而避免下游步骤中的任何干扰信号。
可用的连接基基团可以见于PCT公布号WO 2004/018493(以引用方式并入本文)中,其示例包括可以使用水溶性膦或由过渡金属和至少部分水溶性的配体形成的水溶性过渡金属催化剂裂解的连接基。在水性溶液中,后者形成至少部分水溶性的过渡金属络合物。此类可裂解的连接基可以用于将核苷酸的碱基连接到标记,诸如本文所示的染料。
特定的连接基包括PCT公布号WO 2004/018493(以引用方式并入本文)中所公开的那些,诸如包括下式的部分的那些:
(其中X选自包括O、S、NH和NQ的组,其中Q为C1-10取代或未取代的烷基基团,Y选自包括O、S、NH和N(烯丙基)的组,T为氢或C
连接基的附加示例包括美国公布号2016/0040225(以引用方式并入本文)中所公开的那些,诸如包括下式的部分的那些:
(其中*指示所述部分与核苷酸或核苷的其余部分连接的位置)。本文所展示的连接基部分可以包括核苷酸/核苷与标记之间的全部或部分连接基结构。
在特定具体实施中,荧光染料(荧光团)和鸟嘌呤碱基之间的连接基的长度可以改变,例如,通过引入聚乙二醇间隔区基团,从而与通过本领域已知的其他键附接到鸟嘌呤碱基的相同荧光团相比增加了荧光强度。一些连接基及其特性在PCT公布号WO 2007/020457(以引用方式并入本文)中示出。连接基的设计,尤其是其增加的长度,可以允许当掺入到多核苷酸(诸如DNA)中时,改善附接到鸟苷核苷酸的鸟嘌呤碱基的荧光团的亮度。因此,当染料用于需要检测附接到含有鸟嘌呤的核苷酸的荧光染料标记的任何分析方法中时,有利的是连接基包含式–((CH
核苷和核苷酸可以在糖或核碱基上的位点处标记。如本领域所知的,“核苷酸”由含氮碱基、糖和一个或多个磷酸基团组成。在RNA中,糖为核糖,而在DNA中为脱氧核糖,即,缺乏存在于核糖中的羟基基团的糖。含氮碱基是嘌呤或嘧啶的衍生物。嘌呤为腺嘌呤(A)和鸟嘌呤(G),并且嘧啶为胞嘧啶(C)和胸腺嘧啶(T),或在RNA的情况下为尿嘧啶(U)。脱氧核糖的C-1原子与嘧啶的N-1或嘌呤的N-9键合。核苷酸也是核苷的磷酸酯,其中酯化发生在附接到糖的C-3或C-5的羟基基团上。核苷酸通常是单磷酸、二磷酸或三磷酸。
“核苷”在结构上类似于核苷酸,但缺少磷酸部分。核苷类似物的一个示例是其中标记与碱基连接并且没有磷酸基团附接到糖分子的核苷类似物。
虽然碱基通常被称为嘌呤或嘧啶,但是技术人员将理解,可获得不改变核苷酸或核苷经历Watson-Crick碱基配对的能力的衍生物和类似物。“衍生物”或“类似物”意味着这样的化合物或分子:其核心结构与母体化合物的核心结构相同或非常类似,但其具有允许衍生的核苷酸或核苷与另一分子连接的化学或物理修饰,诸如不同的或附加的侧基。例如,碱基可以为脱氮嘌呤。在特定具体实施中,这些衍生物应当能够经历Watson-Crick配对。“衍生物”和“类似物”还包括例如具有经修饰的碱基部分和/或经修饰的糖部分的合成核苷酸或核苷衍生物。此类衍生物和类似物在例如Scheit,Nucleotide analogs(John Wiley&Son,1980)和Uhlman等人,Chemical Reviews 90:543-584,1990中进行了讨论。核苷酸类似物还可以包括经修饰的磷酸二酯键,包括硫代磷酸酯键、二硫代磷酸酯键、烷基膦酸酯键、苯胺磷酸酯键、氨基磷酸酯键等。
染料可以例如通过连接基附接到核苷酸碱基上的任何位置。在特定具体实施中,仍然可以对所得的类似物进行Watson-Crick碱基配对。特定的核碱基标记位点包括嘧啶碱基的C5位置或7-脱氮嘌呤碱基的C7位置。如上所述,连接基基团可以用于将染料共价附接到核苷或核苷酸。
在特定具体实施中,标记的核苷或核苷酸可以是可酶促掺入的和可酶促延伸的。因此,连接基部分可以具有足够的长度以将核苷酸连接到化合物,使得该化合物不显著干扰核酸复制酶对核苷酸的总体结合与识别。因此,连接基还可以包含间隔区单元。间隔区距离为例如核苷酸碱基距裂解位点或标记的距离。
用本文所述的染料标记的核苷或核苷酸可以具有下式:
其中染料为染料化合物;B为核碱基,诸如尿嘧啶、胸腺嘧啶、胞嘧啶、腺嘌呤、鸟嘌呤等;L为可以存在或可以不存在的任选的连接基基团;R'可以为H、单磷酸根、二磷酸根、三磷酸根、硫代磷酸根、磷酸酯类似物、附接至反应性含磷基团的–O–,或者被封闭基团保护的–O–;R”可以为H、OH、亚磷酰胺或3'-OH封闭基团,并且R”'为H或OH。其中R”为亚磷酰胺,R'为酸可裂解的羟基保护基团,其允许随后在自动化合成条件下进行单体偶联。
在一个特定具体实施中,封闭基团是与染料化合物分开的并且独立于染料化合物,即,不与后者附接。替代性地,染料可以包含3'-OH封闭基团的全部或部分。因此,R”可以为可以构成或可以不构成染料化合物的3'-OH封闭基团。
在又一个替代性的具体实施中,戊糖的3'碳上不存在封闭基团,并且附接到碱基的染料(或染料和连接基构造)例如可以具有足以充当掺入另外的核苷酸的障碍的尺寸或结构。因此,该障碍可以归因于空间位阻或可以归因于尺寸、电荷和结构的组合,无论染料是否附接到糖的3’位置。
在还有一个替代性的具体实施中,该封闭基团存在于戊糖的2'或4'碳上,并且可以具有足以充当掺入另外的核苷酸的障碍的尺寸或结构。
使用封闭基团允许对聚合进行控制,诸如当掺入经修饰的核苷酸时通过停止延伸来控制。如果封闭效应是可逆的,例如,以非限制性示例的方式,则通过改变化学条件或通过除去化学障碍,可以在某些点处停止延伸,然后允许其继续。
在另一个具体实施中,3'-OH封闭基团将包括PCT公布号WO 2004/018497和WO2014/139596中所公开的部分,这些公布各自的公开内容全文以引用方式并入本文。例如,封闭基团可以为叠氮甲基(-CH
在一个特定具体实施中,连接基(在染料和核苷酸之间)和封闭基团均存在并且为单独的部分。在特定具体实施中,连接基和封闭基团在基本上类似的条件下都是可裂解的。因此,脱保护和脱封闭过程可能更有效,因为只需要单一处理就可以除去染料化合物和封闭基团这两者。然而,在一些具体实施中,连接基和封闭基团不需要可在类似条件下裂解,而是可在不同条件下单独裂解。
本公开还涵盖掺入了染料化合物的多核苷酸。此类多核苷酸可以为分别由以磷酸二酯键接合的脱氧核糖核苷酸或核糖核苷酸组成的DNA或RNA。多核苷酸可以包含与如本文示出的至少一种经修饰的核苷酸(例如,用染料化合物标记)组合的天然存在的核苷酸、除本文所述的标记的核苷酸之外的非天然存在的(或经修饰的)核苷酸或它们的任何组合。根据本公开的多核苷酸还可以包括非天然的骨架键和/或非核苷酸化学修饰。还设想了由包含至少一种标记的核苷酸的核糖核苷酸和脱氧核糖核苷酸的混合物组成的嵌合结构。
如本文所述的非限制性标记核苷酸包括:
其中L表示连接基并且R表示如上所述的糖残基。
在一些具体实施中,非限制性荧光染料缀合物在下文示出:
本公开还提供了包括用染料标记的经修饰的核苷和/或核苷酸的试剂盒。此类试剂盒通常将包括至少一种用本文示出的染料标记的经修饰的核苷酸或核苷,连同至少一种另外的组分。所述另外的组分可以是在本文示出的方法中或在下文的实施例部分中识别的组分中的一种或多种组分。可以结合到本公开的试剂盒中的组分的一些非限制性示例在下文示出。
在一个特定具体实施中,试剂盒可以包括至少一种用本文示出的任何染料标记的经修饰的核苷酸或核苷,连同经修饰或未经修饰的核苷酸或核苷。例如,用根据本公开的染料标记的经修饰的核苷酸可以与未标记的或天然的核苷酸和/或与荧光标记的核苷酸或它们的任何组合结合提供。因此,试剂盒可以包括用根据本公开的染料标记的经修饰的核苷酸,和用其他染料化合物(例如,现有技术染料化合物)标记的经修饰的核苷酸。核苷酸的组合可以作为独立的单独组分(例如,每个容器或管一个核苷酸类型)或作为核苷酸混合物(例如,在同一容器或管中混合的两种或更多种核苷酸)提供。
在试剂盒包括用染料化合物标记的多种,特别地是两种或三种、或者更特别地是四种经修饰的核苷酸的情况下,不同的核苷酸可以用不同的染料化合物标记,或者一种可以是暗色的,没有染料化合物。在不同的核苷酸用不同的染料化合物标记的情况下,试剂盒的一个特征是染料化合物是光谱上可区分的荧光染料。如本文所用,术语“光谱上可区分的荧光染料”是指当一个样品中存在两种或更多种此类染料时,以能够通过荧光检测设备(例如,商业的基于毛细管的DNA测序平台)区分的波长发射荧光能量的荧光染料。当用荧光染料化合物标记的两种经修饰的核苷酸以试剂盒形式提供时,一些具体实施的特征在于光谱上可区分的荧光染料能够以相同的波长激发,诸如,通过相同的激光器激发。当用荧光染料化合物标记的四种经修饰的核苷酸以试剂盒形式提供时,一些具体实施的特征在于光谱上可区分的荧光染料中的两种荧光染料均能够以一个波长激发,并且另外两种光谱上可区分的染料均能够以另一个波长激发。特定激发波长可以是488nm和532nm。
在一个具体实施中,试剂盒包括用本公开的化合物标记的经修饰的核苷酸和用第二染料标记的第二经修饰的核苷酸,其中染料具有至少10nm,特别地20nm至50nm的吸光度最大值差值。更具体地讲,这两种染料化合物具有介于15nm至40nm之间的斯托克斯位移,其中“斯托克斯位移”是峰值吸收波长和峰值发射波长之间的距离。
在一个另外的具体实施中,试剂盒还可以包括两种其他的用荧光染料标记的经修饰的核苷酸,其中这些染料由相同的激光器在532nm处激发。这些染料可以具有至少10nm,特别地20nm至50nm的吸光度最大值差值。更具体地讲,这两种染料化合物可以具有介于20nm至40nm之间的斯托克斯位移。与本公开的染料在光谱上可区分并且满足上述标准的特定染料是聚次甲基类似物,如美国专利号5,268,486中所述的(例如Cy3)或如PCT公布号WO2002/026891中所述的(Alexa 532;分子探针A20106);或非对称聚次甲基,如美国专利号6,924,372中所公开的,这些专利各自的公开内容全文以引用方式并入本文。替代性的染料包括罗丹明类似物,例如四甲基罗丹明及其类似物。
在一个替代性的具体实施中,本公开的试剂盒可以包含其中相同的碱基用两种不同的化合物标记的核苷酸。第一核苷酸可以用本公开的化合物标记。第二核苷酸可以用光谱上不同的化合物标记,例如在小于600nm处吸收的“绿色”染料。第三核苷酸可以被标记为本公开的化合物和光谱上不同的化合物的混合物,并且第四核苷酸可以是“暗色”并且不含标记。因此,简单地讲,核苷酸1至4可以被标记为“蓝色”、“绿色”、“蓝色/绿色”和暗色。为了进一步简化仪器,可以用单个激光器所激发的两种染料标记四种核苷酸,因此核苷酸1至4的标记可以是“蓝色1”、“蓝色2”、“蓝色1/蓝色2”和暗色。
核苷酸可以包含本公开的两种染料。试剂盒可以包含用本公开的染料标记的两种或更多种核苷酸。试剂盒可以包含另外的核苷酸,其中该核苷酸用在520nm至560nm的区域中吸收的染料标记。试剂盒还可以包含未标记的核苷酸。
尽管本文以具有用不同染料化合物标记的不同核苷酸的构型为例来说明试剂盒,但是应当理解,试剂盒可以包括具有相同染料化合物的2种、3种、4种或更多种不同核苷酸。
在特定具体实施中,试剂盒可以包括能够催化经修饰的核苷酸掺入到多核苷酸中的聚合酶。待被包括在此类试剂盒中的其他组分可以包括缓冲液等。用根据本公开的染料标记的经修饰的核苷酸,以及包括不同核苷酸的混合物在内的其他任何核苷酸组分,可以在试剂盒中以浓缩形式提供,在使用之前进行稀释。在此类具体实施中,还可以包括合适的稀释缓冲液。同样,在本文示出的方法中识别的组分中的一种或多种组分可以被包括在本公开的试剂盒中。
包含根据本公开的染料化合物的经修饰的核苷酸(或核苷)可以用于任何分析方法,诸如包括检测附接到核苷酸或核苷的荧光标记的方法,无论是以其本身使用,还是掺入到较大的分子结构或缀合物中或者与较大的分子结构或缀合物相关联。在该语境中,术语“掺入到多核苷酸中”可以意味着5'磷酸以磷酸二酯键与第二(经修饰或未经修饰的)核苷酸的3'羟基基团接合,该第二核苷酸本身可以形成较长多核苷酸链的一部分。本文示出的经修饰的核苷酸的3'端可以以磷酸二酯键或可以不以磷酸二酯键与另外的(经修饰或未经修饰的)核苷酸的5'磷酸接合。因此,在一个非限制性具体实施中,本公开提供了检测掺入到多核苷酸中的经修饰的核苷酸的方法,该方法包括:(a)将至少一种本公开的经修饰的核苷酸掺入到多核苷酸中,以及(b)通过检测来自附接到所述经修饰的核苷酸的染料化合物的荧光信号,来检测掺入到多核苷酸中的经修饰的核苷酸。
该方法可以包括:合成步骤(a),其中将根据本公开的一种或多种经修饰的核苷酸掺入到多核苷酸中;以及检测步骤(b),其中通过检测或定量测量掺入到多核苷酸中的一种或多种经修饰的核苷酸的荧光,来检测所述核苷酸。
本申请的一些具体实施涉及测序方法,包括:(a)将至少一种如本文所述的标记的核苷酸掺入到多核苷酸中;以及(b)通过检测来自附接到所述经修饰的核苷酸的荧光染料的荧光信号,来检测掺入到多核苷酸中的标记的核苷酸。
在一个具体实施中,至少一种经修饰的核苷酸在合成步骤中通过聚合酶的作用被掺入到多核苷酸中。然而,可以使用将经修饰的核苷酸接合到多核苷酸的其他方法,诸如,化学寡核苷酸合成或者将标记的寡核苷酸与未标记的寡核苷酸连接。因此,当术语“掺入”关于核苷酸和多核苷酸使用时,可以涵盖通过化学方法以及酶促方法进行的多核苷酸合成。
在一个特定具体实施中,进行了合成步骤并且该合成步骤可以任选地包括将模板多核苷酸链与包含本公开的荧光标记的经修饰核苷酸的反应混合物一起温育。还可以在允许在退火到模板多核苷酸链的多核苷酸链上的游离3'羟基基团和经修饰的核苷酸上的5'磷酸基团之间形成磷酸二酯键的条件下提供聚合酶。因此,合成步骤可以包括通过核苷酸与模板链的互补碱基配对来指导多核苷酸链的形成。
在所述方法的所有具体实施中,检测步骤可以在向其中掺入了标记的核苷酸的多核苷酸链退火到模板链上时进行,或者在其中将两条链分离的变性步骤之后进行。在合成步骤和检测步骤之间可以包括另外的步骤,例如化学反应步骤或酶促反应步骤,或者纯化步骤。具体地讲,可以分离或纯化掺入了标记的核苷酸的靶链,然后进一步加工或用于后续的分析。以举例的方式,在合成步骤中用如本文所述的经修饰的核苷酸标记的靶多核苷酸随后可以用作标记的探针或引物。在其他具体实施中,本文示出的合成步骤的产物可以经受进一步的反应步骤,并且如果需要,这些后续步骤的产物被纯化或分离。
用于合成步骤的合适条件将为熟悉标准分子生物学技术的人员所熟知。在一个具体实施中,合成步骤可以类似于标准引物延伸反应,该标准引物延伸反应在合适的聚合酶的存在下使用核苷酸前体(包括如本文所述的经修饰的核苷酸)形成与模板链互补的延伸的靶链。在其他具体实施中,合成步骤本身可以形成产生标记的双链扩增产物的扩增反应的一部分,该标记的双链扩增产物由来源于靶多核苷酸链和模板多核苷酸链的复制的退火互补链组成。其他合成步骤包括切口平移、链置换聚合、随机引发的DNA标记等。用于合成步骤的特别有用的聚合酶是能够催化如本文示出的经修饰的核苷酸的掺入的聚合酶。可以使用多种天然存在的或经修饰的聚合酶。以举例的方式,热稳定聚合酶可以用于使用热循环条件进行的合成反应,而热稳定聚合酶可能不是等温引物延伸反应所期望的。能够掺入根据本公开的经修饰的核苷酸的合适的热稳定聚合酶包括PCT公布号WO 2005/024010或WO2006/120433中所述的那些,这些公布各自的公开内容全文以引用方式并入本文。在较低温度诸如37℃处进行的合成反应中,聚合酶不必是热稳定聚合酶,因此对聚合酶的选择将取决于许多因素,诸如反应温度、pH、链置换活性等。
在具体的非限制性具体实施中,本公开涵盖以下的方法:核酸测序、重新测序、全基因组测序、单核苷酸多态性评分、涉及当用本文示出的染料标记的经修饰的核苷酸或核苷掺入到多核苷酸中时对其进行检测的任何其他应用。受益于使用用包含荧光染料的经修饰的核苷酸标记的多核苷酸的多种其他应用中的任一种应用可以使用具有本文示出的染料的经修饰的核苷酸或核苷。
在一个特定具体实施中,本公开提供了包含根据本公开的染料化合物的经修饰的核苷酸在多核苷酸合成测序反应中的用途。合成测序通常涉及使用聚合酶或连接酶在5'至3'方向上将一个或多个核苷酸或寡核苷酸顺序添加至生长的多核苷酸链,以便形成与待测序的模板核酸互补的延伸多核苷酸链。存在于一个或多个添加的核苷酸中的碱基的身份可以在如本文所述的检测或“成像”步骤中测定。添加的碱基的身份可以在每个核苷酸掺入步骤之后测定。然后可以使用常规的Watson-Crick碱基配对规则来推断模板的序列。使用用本文示出的染料标记的经修饰的核苷酸来测定单个碱基的身份可能是有用的,例如,在单核苷酸多态性的评分中,并且此类单碱基延伸反应在本公开的范围内。
在本公开的一个具体实施中,模板多核苷酸的序列通过检测附接到掺入的核苷酸的荧光标记,检测一个或多个核苷酸掺入到与待测序的模板多核苷酸互补的新生链中来确定。模板多核苷酸的测序可以用合适的引物(或制备成发夹构建体,其将包含引物作为发夹的一部分)引发,并且新生链通过在聚合酶催化的反应中向引物的3'端添加核苷酸而以逐个方式延伸。
在特定具体实施中,不同的核苷酸三磷酸(A、T、G和C)中的每一种可以用独特的荧光团进行标记,并且还在3'位置处包含封闭基团以防止不受控制的聚合。替代性地,四种核苷酸中的一种可以是未标记的(暗色)。聚合酶将核苷酸掺入到与模板多核苷酸互补的新生链中,并且封闭基团防止核苷酸的进一步掺入。任何未掺入的核苷酸都可以被洗掉,并且来自每个掺入的核苷酸的荧光信号可以通过合适的装置(诸如使用激光激发和合适的发射滤光器的电荷耦合器件)以光学方式“读取”。然后可以(同时或顺序地)除去(脱保护)3'-封闭基团和荧光染料化合物,以暴露新生链用于进一步掺入核苷酸。通常,将在每个掺入步骤之后确定所掺入的核苷酸的身份,但这不是严格必需的。类似地,美国专利号5,302,509(其公开内容全文以引用方式并入本文)公开了对固定在固体载体上的多核苷酸进行测序的方法。
如上文所例示,该方法利用了在DNA聚合酶的存在下将荧光标记的3'-封闭的核苷酸A、G、C和T掺入到与固定的多核苷酸互补的生长链中。聚合酶掺入与靶多核苷酸互补的碱基,但是被3'-封闭基团防止进一步添加。然后可以确定掺入的核苷酸的标记,并且通过化学裂解除去封闭基团以允许发生进一步的聚合。在合成测序反应中待测序的核酸模板可以是期望测序的任何多核苷酸。用于测序反应的核酸模板将通常包含具有游离的3'羟基基团的双链区域,该双链区域充当用于在测序反应中添加另外的核苷酸的引物或起始点。待测序模板的该区域将在互补链上悬垂该游离的3'羟基基团。待测序模板的悬垂区域可以是单链的,但也可以是双链的,前提条件是在与待测序的模板链互补的链上存在“切口”,以提供用于引发测序反应的游离3'OH基团。在此类具体实施中,测序可以通过链置换进行。在某些具体实施中,可以添加带有游离的3'羟基基团的引物,作为与待测序模板的单链区域杂交的单独组分(例如,短寡核苷酸)。替代性地,待测序的引物和模板链可以各自形成能够形成分子内双链体(诸如发夹环结构)的部分自身互补核酸链的一部分。发夹多核苷酸及其可以附接到固体载体的方法在PCT公布号WO 2001/057248和WO 2005/047301中公开,这些公布各自的公开内容全文以引用方式并入本文。核苷酸可以被连续地添加到生长引物,导致在5'至3'方向上合成多核苷酸链。可以确定已添加的碱基的性质,特别是但不必在每次添加核苷酸之后,从而提供核酸模板的序列信息。因此,通过经由与核苷酸的5'磷酸基团形成磷酸二酯键而将核苷酸接合到核酸链的游离的3'羟基基团,从而将该核苷酸掺入到核酸链(或多核苷酸)中。
待测序的核酸模板可以是DNA或RNA,或者甚至是由脱氧核苷酸和核糖核苷酸组成的杂合分子。核酸模板可以包含天然存在的和/或非天然存在的核苷酸以及天然或非天然的骨架键,前提条件是这些不阻止测序反应中模板的复制。
在某些具体实施中,待测序的核酸模板可以经由本领域已知的任何合适的连接方法(例如经由共价附接)附接到固体载体。在某些具体实施中,模板多核苷酸可以直接附接到固体载体(例如,基于二氧化硅的载体)。然而,在本公开的其他具体实施中,固体载体的表面可以以某种方式修饰,以便允许模板多核苷酸的直接共价附接,或者通过水凝胶或聚电解质多层来固定模板多核苷酸,所述多层本身可以非共价地附接到固体载体。
其中多核苷酸已直接附接到基于二氧化硅的载体的阵列是例如在PCT公布号WO2000/006770中所公开的那些,该PCT公布的公开内容全文以引用方式并入本文,其中通过玻璃上的环氧侧基与多核苷酸上的内部氨基基团之间的反应将多核苷酸固定在玻璃载体上。此外,可以通过硫基亲核物质与固体载体的反应将多核苷酸附接到固体载体,例如,如PCT公布号WO 2005/047301中所述,该PCT公布的公开内容全文以引用方式并入本文。固体支撑的模板多核苷酸的又一个示例是,其中模板多核苷酸附接到支撑在基于二氧化硅的固体载体或其他固体载体上的水凝胶,例如,如PCT公布号WO 2000/31148、WO 2001/01143、WO2002/12566、WO 2003/014392和WO 2000/53812以及美国专利号6,465,178中所述,这些专利各自的公开内容全文以引用方式并入本文。
模板多核苷酸可以固定于其上的特定表面是聚丙烯酰胺水凝胶。聚丙烯酰胺水凝胶描述于上文引用的参考文献和PCT公布号WO 2005/065814中,该PCT公布的公开内容全文以引用方式并入本文。可以使用的具体水凝胶包括描述于PCT公布号WO 2005/065814和美国公布号2014/0079923中的那些,这些公布各自的公开内容全文以引用方式并入本文。在一个具体实施中,水凝胶为PAZAM(聚(N-(5-叠氮基乙酰氨基戊基)丙烯酰胺-共-丙烯酰胺))。
DNA模板分子可以附接到珠粒或微粒,例如,如美国专利号6,172,218中所述,该专利的公开内容全文以引用方式并入本文。与珠粒或微粒的附接可以用于测序应用。可以制备珠粒文库,其中每个珠粒包含不同的DNA序列。一些文库及其产生方法描述于
待测序的模板可以形成固体载体上的“阵列”的一部分,在这种情况下,阵列可以采取任何方便的形式。因此,本公开的方法适用于所有类型的高密度阵列,包括单分子阵列、成簇阵列和珠粒阵列。用本公开的染料化合物标记的经修饰的核苷酸可以用于对基本上任何类型的阵列上的模板(包括但不限于通过将核酸分子固定在固体载体上而形成的那些)进行测序。
然而,用本公开的染料化合物标记的经修饰的核苷酸在对成簇阵列进行测序的背景中是特别有利的。在成簇阵列中,阵列上的不同区域(通常称为位点或特征)包含多个多核苷酸模板分子。一般来讲,所述多个多核苷酸分子不能通过光学手段单独地分辨,而是作为整体被检测到。取决于阵列的形成方式,阵列上的每个位点可以包含一个单独多核苷酸分子的多个拷贝(例如,该位点对于特定的单链核酸种类或双链核酸种类是同质的)或甚至少量不同多核苷酸分子的多个拷贝(例如,两个不同核酸种类的多个拷贝)。核酸分子的成簇阵列可以使用本领域中公知的技术产生。以举例的方式,PCT公布号WO 1998/44151和WO2000/18957(这些PCT公布各自的公开内容全文以引用方式并入本文)描述了扩增核酸的方法,其中模板和扩增产物均保持固定在固体载体上,以便形成由固定的核酸分子的簇或“集落”组成的阵列。根据这些方法制备的成簇阵列上存在的核酸分子是使用用本公开的染料化合物标记的经修饰的核苷酸进行测序的合适模板。
用本公开的染料化合物标记的经修饰的核苷酸也可用于对单分子阵列上的模板进行测序。如本文所用的术语“单分子阵列”或“SMA”,是指分布(或排列)在固体载体上的多核苷酸分子群,其中任何单独的多核苷酸与该分子群的所有其他多核苷酸的间距使得有可能单独地分辨单独的多核苷酸分子。因此,在一些具体实施中,固定到固体载体的表面上的靶核酸分子能够通过光学手段分辨。这意味着一个或多个不同的信号(每个信号代表一种多核苷酸)将出现在所用的特定成像装置的可分辨区域内。
可以实现单分子检测,其中阵列上的相邻多核苷酸分子之间的间距为至少100nm,更具体地讲至少250nm,还更具体地讲至少300nm,甚至更具体地讲至少350nm。因此,每个分子能够作为单分子荧光点来单独地分辨和检测,并且来自所述单分子荧光点的荧光也表现出单步光漂白。
术语“单独分辨的”和“单独分辨”在本文中用于规定,当可视化时,有可能将阵列上的一个分子与其相邻分子区分开。阵列上各个分子之间的间隔将部分地通过用于分辨各个分子的特定技术来确定。通过参考PCT公布号WO 2000/06770和WO 2001/57248将理解单分子阵列的一般特征,这些PCT公布各自的公开内容全文以引用方式并入本文。虽然本公开的经修饰的核苷酸的一种用途是用于合成测序反应,但这些经修饰的核苷酸的效用却不限于此类方法。事实上,这些核苷酸可以有利地用于需要检测附接于掺入到多核苷酸中的核苷酸的荧光标记的任何测序方法。
具体地讲,用本公开的染料化合物标记的经修饰的核苷酸可以用于自动化荧光测序方案,尤其是基于Sanger和同事的链终止测序方法的荧光染料-终止子循环测序。此类方法通常使用酶和循环测序将荧光标记的双脱氧核苷酸掺入引物延伸测序反应中。所谓的Sanger测序方法和相关方案(Sanger型)利用带有标记的双脱氧核苷酸的随机化链终止。
因此,本公开还涵盖用染料化合物标记的经修饰的核苷酸,这些染料化合物是在3'位置和2'位置处都缺乏羟基基团的双脱氧核苷酸,此类经修饰的双脱氧核苷酸适合在Sanger型测序方法等中使用。
应当理解,用掺入3'封闭基团的本公开的染料化合物标记的经修饰的核苷酸也可以用于Sanger方法和相关方案,因为通过使用具有3’-OH封闭基团的经修饰的核苷酸可以实现与通过使用经修饰的双脱氧核苷酸所实现的效果相同的效果:两者均防止随后的核苷酸的掺入。在根据本公开的并且具有3'封闭基团的核苷酸将用于Sanger型测序方法的情况下,应当理解,附接到核苷酸的染料化合物或可检测标记不需要经由可裂解的连接基连接,因为在掺入本公开的标记的核苷酸的每种情况下;随后不需要掺入核苷酸,因此不需要从核苷酸上除去标记。
在以下实施例中更详细地公开了附加的具体实施,这些实施例并非旨在以任何方式限制权利要求书的范围。
将3-(5-氯-苯并噁唑-2-基)-7-氟-香豆素(0.32g,1mmol)和3-羧基氮杂环丁烷(0.2g,2mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在120℃处搅拌7h并且在室温处静置1h之后,用水(15mL)稀释混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.25g(63%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值396.05。m/z实测值:(+)397(M+1)
将3-(苯并噁唑-2-基)-7-氟-香豆素(0.56g,2mmol)和3-羧基氮杂环丁烷(0.3g,3mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在125℃处搅拌9h并且在室温处静置1h之后,用水(10mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.41g(56%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值362.09。m/z实测值:(+)363(M+1)
将3-(苯并咪唑-2-基)-7-氟-香豆素(FC-2,0.56g,2mmol,1当量)和3-羧基氮杂环丁烷(AC-C4,0.3g,3mmol,1.5当量)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。将混合物在120℃处搅拌9h。添加附加部分的3-羧基氮杂环丁烷(0.3g,3mmol)和DIPEA(0.26g,2mmol)。在120℃处再搅拌3h并且在室温下静置1h之后,用水(10mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.26g(36%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值361.11。m/z实测值:(+)362(M+1)
将3-(苯并噻唑-2-基)-7-氟-香豆素(0.30g,1mmol)和3-羧基氮杂环丁烷(0.2g,2mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在120℃处搅拌8h并且在室温处静置1h之后,用水(10mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.28g(75%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值378.07。m/z实测值:(+)379(M+1)
将3-(苯并噻唑-2-基)-7-氟-香豆素(0.30g,1mmol)和3-羧基吡咯烷(0.23g,2mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在120℃处搅拌6h并且在室温处静置1h之后,用水(20mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.31g(80%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值392.08。m/z实测值:(+)393(M+1)
将3-(苯并噻唑-2-基)-7-氟-香豆素(0.30g,1mmol)和异哌啶甲酸(0.26g,2mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在120℃处搅拌6h并且在室温处静置1h之后,用水(20mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.34g(83%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值406.10m/z实测值:(+)407(M+1)
在约-5℃处,将7-(3-羧基氮杂环丁烷-1-基)-3-(苯并噻唑-2-基)香豆素(0.38g,1mmol)添加到20%发烟硫酸(0.5mL)中。将混合物冷却搅拌数小时,然后在室温处搅拌3h。在80℃处搅拌1h并且在室温处静置1h之后,用无水二乙醚(10mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。通过HPLC纯化产物。收率为0.1g(22%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值458.02。m/z实测值:(+)459(M+1)
将3-(6-磺酰氨基-苯并噁唑-2-基)-7-氟-香豆素(0.36g,1mmol)和3-羧基氮杂环丁烷(0.3g,3mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。在125℃处搅拌9h并且在室温处静置1h之后,用水(10mL)稀释反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.26g(60%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值441.06。m/z实测值:(+)442(M+1)
实施例9.荧光强度的比较
将一些染料溶液(在最大激发波长450nm处)的荧光强度与标准染料在相同光谱区进行比较。结果示于表1中,并且证明了用于基于荧光的分析应用的染料的显著优点。
将本文所公开的香豆素荧光染料与适当的氨基取代的腺嘌呤(A)核苷酸衍生物和胞嘧啶(C)核苷酸衍生物A-LN3-NH
在根据以下腺嘌呤方案用适当的试剂活化染料的羧基基团之后:
腺嘌呤偶联的一般产物如下所示:
ffA-LN3-染料是指具有LN3连接基并且用本文所公开的香豆素染料标记的完全官能化的A核苷酸。每个结构中的R基团是指缀合后的香豆素染料部分。
将染料(10μmol)置于5mL圆底烧瓶中干燥,并且溶解于无水二甲基甲酰胺(DMF,1mL)中,然后真空蒸馏出溶剂。将该规程重复两次。在室温处将干燥的染料溶解于无水N,N-二甲基乙酰胺(DMA,0.2mL)中。将N,N,N’,N’-四甲基-O-(N-琥珀酰亚胺基)脲四氟硼酸盐(TSTU,1.5当量,15μmol,4.5mg)添加到染料溶液中,然后经由微量移液管将DIPEA(3当量,30μmol,3.8mg,5.2μL)添加到该溶液中。将反应烧瓶在氮气下密封。通过TLC(洗脱剂:乙腈-水1:9)和HPLC监测反应进程。同时,将适当的氨基取代的核苷酸衍生物(A-LN3-NH
胞嘧啶偶联的一般产物如下所示,遵循上述类似的规程。
ffC-LN3-染料是指具有LN3连接基并且用本文所公开的香豆素染料标记的完全官能化的C核苷酸。每个结构中的R基团是指缀合后的香豆素染料部分。
本文所述的一些附加的具体实施涉及式(I)的化合物的酰胺衍生物及其制备方法,所述方法包括通过羧酸活化将式(Ia)的化合物转化成式(Ia′)的化合物:
以及使式(Ia′)的化合物与式(Am)的伯胺或仲胺反应,得到式(Ib)的酰胺衍生物:
其中变量X、R、R
将适当的式(Ia)染料(0.001mol)溶解于合适的无水有机溶剂(DMF,1.5mL)中。向该溶液中添加羧基活化试剂,诸如TSTU、BOP或PyBOP。将该反应混合物在室温处搅拌约20分钟,然后添加适当的胺衍生物。将反应混合物搅拌过夜,过滤,用0.1M TEAB水溶液淬灭过量的活化试剂。真空蒸发溶剂,将残余物再溶解于TEAB溶液中并且通过HPLC纯化。
用本文所述的染料标记的A核苷酸在测序应用中的效率在如本文所述的双通道检测方法中得到证实。关于本文所述的双通道方法,可以利用本文和/或在美国专利公布号2013/0079232中所述的方法和系统对核酸进行测序,该美国专利公布的公开内容全文以引用方式并入本文。
在双通道检测中,可以通过提供在第一通道中检测到的第一核苷酸类型、在第二通道中检测到的第二核苷酸类型、在第一通道和第二通道这两者中检测到的第三核苷酸类型,以及缺乏标记且在任一通道中未检测到或最低程度检测到的第四核苷酸类型,来对核酸进行测序。通过实验的RTA2.0.93分析生成散点图。图23至图25中所展示的散点图是在26次循环运行中的每一次运行的循环5处的散点图。
图23展示了完全官能化的核苷酸(ffN)混合物的散点图,该混合物包含:在含有Pol812的掺入缓冲液中的A-I-4(0.5μM)、A-NR550S0(1.5μM)、C-NR440(2μM)、暗色G(2μM)和T-AF550POPOS0(2μM)。蓝色曝光(通道1)500ms,绿色曝光(通道2)1000ms;以扫描混合物扫描)。
图24展示了完全官能化的核苷酸(ffN)混合物的散点图,该混合物包含:在含有Pol812的掺入缓冲液中的A-I-5(1μM)、A-NR550S0(1μM)、C-NR440(2μM)、暗色G(2μM)和T-AF550POPOS0(2μM)。蓝色曝光(通道1)500ms,绿色曝光(通道2)1000ms;以扫描混合物扫描。
图25展示了完全官能化的核苷酸(ffN)混合物的散点图,该混合物包含:在含有Pol812的掺入缓冲液中的A-I-6(1μM)、A-NR550S0(1μM)、C-NR440(2μM)、暗色G(2μM)和T-AF550POPOS0(2μM)。蓝色曝光(通道1)500ms,绿色曝光(通道2)1000ms;以扫描混合物扫描。
在图23至图25中的每一者中,“G”核苷酸是未标记的并且显示为左下方的云状物(“暗色G”)。来自由本文所述的染料标记的“A”核苷酸和绿色染料(NR550S0)的混合物的信号在图23至图25中分别以右上方的云状物示出。来自用染料AF550POPOS0标记的“T”核苷酸的信号由左上方的云状物指示,并且来自用染料NR440标记的“C”核苷酸的信号由右下方的云状物指示。X轴示出了一个(蓝色)通道的信号强度,并且Y轴示出了另一个(绿色)通道的信号强度。NR440、AF550POPOS0和NR550S0的化学结构分别公开于PCT公布号WO 2018/060482、WO 2017/051201和WO 2014/135221中,这些PCT公布各自的公开内容全文以引用方式并入本文。
图23至图25各自示出,用本文所述染料标记的完全官能化A-核苷酸缀合物提供了足够大的信号强度和大的云状物分离。
将3-(5-氯-苯并噁唑-2-基)-7-氟-香豆素(0.32g,1mmol)和双亚氨基丙酸(0.32g,2mmol)添加到无水DMSO(5mL)中。将所得的混合物在室温处搅拌数分钟,并且添加DIPEA(0.52g,4mmol)。将所得的混合物在130℃处搅拌6小时。在室温处静置约1h之后,用水(15mL)稀释浅黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.40g(88%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值456.07。m/z实测值:(+)427(M+1)。
将3-(5-羧基苯并噁唑-2-基)-7-氟-香豆素(0.33g,1mmol)和二乙胺(0.29g,4mmol)添加到无水DMSO(15mL)中。将所得的混合物在室温处搅拌数分钟,并且添加DIPEA(0.52g,4mmol)。将反应混合物用冷凝器在115℃处搅拌12小时。添加附加部分的二乙胺(0.14g,2mmol)和DIPEA(0.26g,2mmol),并且在115℃处继续搅拌5h。然后在真空下蒸馏出溶剂的一半体积,并且将所得的混合物在室温处静置1h。用水(15mL)稀释所得的混合物,并且搅拌过夜。通过抽滤收集所得的沉淀并且用水洗涤。收率为0.24g(62%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值378.12。m/z实测值:(+)379(M+1)
将(5-羧基苯并噁唑-2-基)乙酸乙酯(0.25g,1mmol)、二乙基氨基水杨醛(0.19g,1mmol)、哌啶(3滴)和乙酸(3滴)添加到圆底烧瓶中的无水乙醇(EtOH,5mL)中。将所得的混合物在室温处搅拌6h,然后在60℃至65℃处搅拌12h。通过抽滤收集所得的沉淀并且用水洗涤。收率:0.27g(72%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值378.12。m/z实测值:(+)379(M+1)
将3-(5-羧基苯并咪唑-2-基)-7-氟-香豆素(0.32g,1mmol)和二乙胺(0.29g,4mmol)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,15mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。将反应混合物用冷凝器在115℃处搅拌12小时。添加附加部分的二乙胺(0.14g,2mmol)和DIPEA(0.26g,2mmol),并且将混合物在115℃处再加热8h。在真空下蒸馏出溶剂的一半体积。在室温处静置1h之后,用水(15mL)稀释混合物,并且搅拌过夜。通过抽滤收集所得的沉淀并且用水洗涤。收率:0.17g(44%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值377.14。m/z实测值:(+)378(M+1)
将(5-羧基苯并咪唑-2-基)乙酸乙酯(0.25g,1mmol)、二乙基氨基水杨醛(0.19g,1mmol)、哌啶(3滴)和乙酸(3滴)添加到圆底烧瓶中的无水乙醇(EtOH,5mL)中。将所得的混合物在75℃处搅拌过夜。通过抽滤收集所得的沉淀并且用水洗涤。收率:0.26g(70%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值377.14。m/z实测值:(+)378(M+1)
将3-(苯并噻唑-2-基)-7-氟-香豆素(0.30g,1mmol)和4-(甲基氨基)丁酸(0.23g,2mmol)添加到圆底烧瓶中的无水DMSO(5mL)中。将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol)。将反应混合物在约120℃处搅拌8h,然后在室温处搅拌约1h。用水(15mL)稀释浅黄色混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率:0.19g(48%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值456.07。m/z实测值:(+)427(M+1)。
将3-(苯并噻唑-2-基)-7-氟-香豆素(0.3g,1mmol)和4-[N-(3-磺基)丙基]-氨基丁酸叔丁酯(0.56g,2mmol)添加到圆底烧瓶中的无水DMSO(3mL)中。将混合物在室温处搅拌数分钟,然后向该混合物中添加DIPEA(0.65g,5mmol)。将反应混合物在120℃处搅拌3h。在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1h,然后用水(10mL)稀释所得的混合物,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-5tBu作为三乙基铵盐分离。收率为0.5g(76%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值558.15。m/z实测值:(+)559(M+1)。
步骤2:将三氟乙酸(3mL)添加到三乙基铵基7-{N-[3-(叔丁氧羰基)丙基]-N-[(3-磺酸根基丙基]}氨基-3-(苯并噻唑-2-基)香豆素(0.66g,1mmol)在无水二氯甲烷(25mL)中的混合物中,并且将该混合物在室温处搅拌24h。通过蒸馏除去溶剂。将残余物溶解于乙腈-水混合物(1:1,10mL)中,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物作为化合物II-5的三乙基铵盐分离。收率:0.6g(97%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值502.09。m/z实测值:(+)503(M+1)
将3-(5-氯-苯并噁唑-2-基)-7-氟-香豆素(0.32g,1mmol)和4-[N-(3-磺基)丙基]-氨基丁酸叔丁酯(0.56g,2mmol)添加到圆底烧瓶中的无水DMSO(5mL)中。将所得的混合物在室温处搅拌数分钟,然后向该混合物中添加DIPEA(0.65g,5mmol)。在125℃处搅拌5小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1h,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-6tBu作为三乙基铵盐分离。收率:0.38g(56%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值576.13。m/z实测值:(+)577(M+1)。
步骤2.用三氟乙酸(3mL)处理三乙基铵基7-{N-[3-(叔丁氧羰基)丙基]-N-[(3-磺酸根基丙基]}氨基-3-(5-氯-苯并噁唑-2-基)香豆素(0.68g,1mmol)在无水二氯甲烷(25mL)中的混合物,并且将所得的混合物在室温处搅拌24h。蒸馏出溶剂,将残余物溶解于乙腈-水的1:1混合物(10mL)中,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物作为化合物II-6三乙基铵盐分离。收率:0.6g(96%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值520.07。m/z实测值:(+)521(M+1)
将3-(苯并噁唑-2-基)-7-氟-香豆素(0.28g,1mmol)和4-[N-(3-磺基)丙基]-氨基丁酸叔丁酯(0.56g,2mmol)添加到圆底烧瓶中的无水DMSO(5mL)中。将所得的混合物在室温处搅拌数分钟,然后向该混合物中添加DIPEA(0.65g,5mmol)。在120℃处搅拌8小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1h,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-7tBu分离。收率:0.15g(27%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值542.17。m/z实测值:(+)543(M+1)。
步骤2.用三氟乙酸(2mL)处理7-{N-[3-(叔丁氧羰基)丙基]-N-[(3-磺酸根基丙基]}氨基-3-(苯并噁唑-2-基)香豆素(0.27g,0.5mmol)在无水二氯甲烷(15mL)中的混合物,并且将所得的混合物在室温处搅拌24h。蒸馏出溶剂,将残余物溶解于乙腈-水的1:1混合物(10mL)中,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物作为三乙基铵盐分离。收率:87%。
将3-[6-(氨基磺酰基)苯并噁唑-2-基]-7-氟-香豆素(0.18g,0.5mmol)和4-[N-(3-磺基)丙基]-氨基丁酸叔丁酯(0.28g,1mmol)与无水DMSO(3mL)在圆底烧瓶中混合。将所得的混合物在室温处搅拌数分钟,然后添加DIPEA(0.65g,5mmol)。在120℃处搅拌7小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1小时,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-8tBu分离。在蒸发溶剂之后,滤出黄色沉淀。收率:0.31g(50%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值621.15。m/z实测值:(+)622(M+1)。
步骤2.向7-{N-[3-(叔丁氧羰基)丙基]-N-[(3-磺酸根基丙基]}氨基-3-[6-(氨基磺酰基)苯并噁唑-2-基]香豆素(0.31g,0.5mmol)在无水二氯甲烷(15mL)中的混合物中添加三氟乙酸(2mL),并且将所得的溶液在室温处搅拌24小时。蒸馏出溶剂,将残余物溶解于乙腈-水的1:1混合物(10mL)中,并且再次蒸馏出溶剂。滤出化合物II-8并且用乙腈洗涤。收率:0.25g(87%)。
将3-(5-氯苯并咪唑基-2-基)-7-氟-香豆素(0.32g,1mmol)和4-(N-3-磺丙基)氨基丁酸叔丁酯(0.56g,2mmol)添加到圆底烧瓶中的无水DMSO(5mL)中。将所得的混合物在室温处搅拌数分钟,然后向该混合物中添加DIPEA(0.65g,5mmol)。在120℃处搅拌15小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1h,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-9tBu作为三乙基铵盐分离。
步骤2.将上一步所得的三乙基铵基7-{N-[3-(叔丁氧羰基)丙基]-N-(3-磺酸根基丙基)}氨基-3-(5-氯苯并咪唑基-2-基)香豆素溶解于无水二氯甲烷(25mL)中,并且添加三氟乙酸(5mL)。将所得的混合物在室温处搅拌24h。蒸馏出溶剂,将残余物溶解于乙腈-水的1:1混合物(10mL)中,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物分离。收率:0.2g(35%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值519.09。m/z实测值:(+)520(M+1)
将3-(5-羧基苯并噁唑-2-基)-7-氟-香豆素(0.17g,0.5mmol)和4-(N-3-磺丙基)氨基丁酸叔丁酯(0.28g,1mmol)与无水DMSO(5mL)在圆底烧瓶中混合。将所得的混合物在室温处搅拌数分钟,然后添加DIPEA(0.65g,5mmol)。在110℃处搅拌17小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处静置1小时,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-10tBu分离。在蒸发溶剂之后,滤出黄色沉淀。收率:0.23g(80%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值586.16。m/z实测值:(+)587(M+1)。
将3-(6-羧基苯并噁唑-2-基)-7-氟-香豆素(0.65g,2mmol)和4-(N-3-磺丙基)氨基丁酸叔丁酯(1.13g,4mmol)以及无水DMSO(15mL)在室温处搅拌几分钟,然后添加DIPEA(1.3g,10mmol)。在120℃处搅拌15小时之后,在真空下蒸馏出溶剂的一半体积。将混合物在室温处搅拌1小时,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物化合物II-11tBu分离。在蒸发溶剂之后,滤出黄色沉淀。收率:0.66g(56%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值586.16。m/z实测值:(+)587(M+1)。
将(5-羧基苯并噻唑-2-基)乙酸乙酯(0.27g,1mmol)、二乙基氨基水杨醛(0.21g,1.1mmol)、哌啶(5滴)和乙酸(5滴)添加到无水乙醇(5mL)中,并且将所得的混合物在60℃至65℃处搅拌7h,然后置于室温处过夜。通过抽滤收集所得的橙色沉淀并且用水洗涤。收率:0.28g(72%)。
将7-二乙基氨基-3-(5-羧基苯并噁唑-2-基)香豆素(0.84g,2mmol)和浓硫酸(5mL)在室温处搅拌几分钟,然后将溶液在150℃处加热2小时。将混合物在室温处搅拌1小时,然后用冰水(50g)稀释,并且将反应混合物搅拌过夜。滤出黄色沉淀。收率:0.51g(65%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值394.10。m/z实测值:(+)395(M+1)
将(5-羧基-1-苯基苯并咪唑-2-基)乙酸乙酯(0.16g,1mmol)和二乙基氨基水杨醛(0.21g,1.1mmol)溶解于无水乙醇(7mL)中。添加哌啶(5滴)和乙酸(5滴),并且将所得的混合物在80℃处搅拌5h,然后在室温处放置过夜。通过抽滤收集所得的橙色沉淀并且用水洗涤。收率:0.16g(70%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值453.17。m/z实测值:(+)454(M+1)
将3-(5-羧基苯并噁唑-2-基)-7-氟-香豆素(0.65g,2mmol)和4-氨基丁酸乙酯盐酸盐(0.5g,3mmol)添加到无水DMSO(5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加二异丙基乙胺(0.65g,5mmol)。将反应混合物在温度110℃处搅拌3小时。在室温处静置1小时之后,用水(10mL)稀释黄色半固体反应混合物,并且保持搅拌过夜。通过抽滤收集所得的沉淀。收率为0.5g(58%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值436.13。m/z实测值:(+)437(M+1)
将3-(5-羧基苯并噁唑-2-基)-7-氟-香豆素(0.32g,1mmol)和4-氨基丁酸乙酯盐酸盐(0.5g,3mmol)添加到无水DMSO(5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加二异丙基乙胺(0.39g,3mmol)。将反应混合物在温度120℃处搅拌3小时。在室温处静置1小时之后,用水(10mL)稀释黄色半固体反应混合物,用乙酸(1mL)酸化,并且保持搅拌过夜。通过抽滤收集所得的沉淀。收率为0.21g(48%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值436.13。m/z实测值:(+)437(M+1)
将3-(5-氯苯并噁唑-2-基)-7-氟-香豆素(0.32g,1mmol)和4-氨基丁酸(0.21g,2mmol)添加到圆底烧瓶中的无水DMSO(5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加二异丙基乙胺(0.52g,4mmol)。将反应混合物在温度135℃处搅拌7小时。添加附加部分的4-氨基丁酸(0.1g,1mmol)和二异丙基乙胺(0.26g,2mmol),并且在135℃处继续加热5小时。在室温处静置1小时之后,用水(15mL)稀释浅黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.12g(30%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值398.07。m/z实测值:(+)399(M+1)
将3-(苯并噁唑-2-基)-7-氟-香豆素(0.28g,1mmol)和4-氨基丁酸(0.21g,2mmol)溶解于无水DMSO(5mL)中,然后将该混合物在室温处搅拌数分钟,并且添加二异丙基乙胺(0.26g,2mmol)。将反应混合物在温度125℃处搅拌7小时。添加附加部分的4-氨基丁酸(0.1g,1mmol)和二异丙基乙胺(0.13g,1mmol),并且在125℃处继续加热3小时。用水(10mL)稀释浅黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.08g(23%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值364.11。m/z实测值:(+)365(M+1)
将3-(5-羧基苯并噁唑-2-基)-7-氟-香豆素(0.33g,1mmol)和3-氨基丙磺酸(0.42g,3mmol)添加到无水DMSO(5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加二异丙基乙胺(0.39g,3mmol)。将反应混合物在温度125℃处搅拌7小时。在真空下蒸馏出溶剂的一半体积。将混合物在室温处搅拌1小时,然后用水-乙腈的1:1混合物(10mL)稀释,并且通过制备型HPLC用乙腈-TEAB混合物作为洗脱剂,将产物分离。在蒸发溶剂之后,用乙腈(3mL)研磨黄色沉淀并滤出。收率:0.06g(14%)。通过HPLC、NMR和LCMS确认染料的纯度、结构和组成。MS(DUIS):MW计算值444.06。m/z实测值:(+)445(M+1)。
将染料溶液(EtOH-水1:1;在最大激发波长450nm处)的荧光强度与标准染料在相同光谱区进行比较。结果示于表2中,并且证明了用于基于荧光的分析应用的染料的显著优点。
将本文所公开的香豆素荧光染料与适当的氨基取代的腺嘌呤(A)核苷酸衍生物和胞嘧啶(C)核苷酸衍生物A-LN3-NH
在根据以下腺嘌呤方案用适当的试剂活化染料的羧基基团之后:
腺嘌呤偶联的一般产物如下所示:
ffA-LN3-染料是指具有LN3连接基并且用本文所公开的香豆素染料标记的完全官能化的A核苷酸。每个结构中的R基团是指缀合后的香豆素染料部分。
将染料(10μmol)置于5mL圆底烧瓶中干燥,并且溶解于无水二甲基甲酰胺(DMF,1mL)中,然后真空蒸馏出溶剂。将该规程重复两次。在室温处将干燥的染料溶解于无水N,N-二甲基乙酰胺(DMA,0.2mL)中。将N,N,N’,N’-四甲基-O-(N-琥珀酰亚胺基)脲四氟硼酸盐(TSTU,1.5当量,15μmol,4.5mg)添加到染料溶液中,然后经由微量移液管将DIPEA(3当量,30μmol,3.8mg,5.2μL)添加到该溶液中。将反应烧瓶在氮气下密封。通过TLC(洗脱剂:乙腈-水1:9)和HPLC监测反应进程。同时,将适当的氨基取代的核苷酸衍生物(A-LN3-NH
胞嘧啶偶联的一般产物如下所示,遵循上述类似的规程。
ffC-LN3-染料是指具有LN3连接基并且用本文所公开的香豆素染料标记的完全官能化的C核苷酸。每个结构中的R基团是指缀合后的香豆素染料部分。
本文所述的一些附加的具体实施涉及式(II)的化合物的酰胺衍生物及其制备方法,所述方法包括通过羧酸活化将式(IIa)的化合物转化成式(IIa′)的化合物:
以及使式(IIa′)的化合物与式(Am)的伯胺或仲胺反应,得到式(IIb)的酰胺衍生物:
其中变量X、R、R
将适当的式(IIa)染料(0.001mol)溶解于合适的无水有机溶剂(DMF,1.5mL)中。向该溶液中添加羧基活化试剂,诸如TSTU、BOP或PyBOP。将该反应混合物在室温处搅拌约20分钟,然后添加适当的胺衍生物。将反应混合物搅拌过夜,过滤,用0.1M TEAB水溶液淬灭过量的活化试剂。真空蒸发溶剂,将残余物再溶解于TEAB溶液中并且通过HPLC纯化。
例如,制备化合物II-2的伯酰胺衍生物和仲酰胺衍生物:
用本文所述的染料标记的A核苷酸在测序应用中的效率在双通道检测方法中得到证实。关于本文所述的双通道方法,可以利用在美国专利申请号2013/0079232中所述的方法和系统对核酸进行测序,该美国专利申请的公开内容全文以引用方式并入本文。
在双通道检测中,可以通过提供在第一通道中检测到的第一核苷酸类型、在第二通道中检测到的第二核苷酸类型、在第一通道和第二通道这两者中检测到的第三核苷酸类型,以及缺乏标记且在任一通道中未检测到或最低程度检测到的第四核苷酸类型,来对核酸进行测序。通过实验的RTA2.0.93分析生成散点图。下图中所展示的散点图是在26次循环运行中的每一次运行的循环5处的散点图。
测序条件:
在60C处,在CCL FC(簇化学线性化),PhiX上扫描Pol1671
绿色染料如下,不同的是组3:ffA-BL-NR550S0/ffT-AF550POPOS0
等温测序2×151c
·在60C处,在CCL FC(簇化学线性化),PhiX上扫描Pol1671
.绿色染料如下,不同的是组3:ffA-BL-NR550S0/ffT-AF550POPOS0
在一些具体实施中,仲胺取代的香豆素化合物可以特别适用于荧光检测和合成测序方法。本文所述的具体实施涉及式(III)结构的染料及其衍生物,或者它们的盐:
其中:
X为O、S、Se或NR
R和R
R
R
其中当R为-CN时,R
每个R
m为0、1、2、3或4。
在一些方面,R不是-CN,使得R为H、卤基、-CO
在另一方面,为式(IV)的化合物或其盐:
其中:
X’选自O、S和NR
R
R
R
R
R
每个R
q为0、1或2。
关于式(III)的化合物或其盐,各种取代基的特定具体实施在下文示出。除非另外指明,否则每个单一基团可以与任何其他单独的限制进行组合。
为了改善生物标志物(尤其是其在水基溶液中的生物缀合物)的荧光特性,式(III)的化合物是下述化合物,其中:
i)R
ii)R
iii)R
在一些方面,X为O或S。在一些方面,X为O。在一些方面,X为S。在一些方面,X为NR
在一些方面,R
当经由R
任选地,R
任选地,R
吲哚部分的苯环任选地在任何一个、两个、三个或四个位置被如R
在一些方面,R
在一些方面,R
在一些方面,R为H。在一些方面,R为卤基。在一些方面,R为Cl。在一些方面,R为C
在一些方面,R
在一些方面,R
式(III)的化合物的特定示例包括:其中X为O或S;R为H;R
式(III)的化合物的特定示例包括:其中X为O或S;R为H;R
式(III)的化合物的特定示例包括:其中X为O或S;R为H;R
在式(IV)的一些方面,X’为O。在一些方面,X’为S。在一些方面,X’为NR
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,R
在一些方面,每个R
在一些方面,q为0。在其他方面,q为1。在还有其他方面,q为2。
仲胺取代的香豆素染料的具体示例包括:
特别有用的化合物是用如本文所述的染料标记的核苷酸或寡核苷酸。标记的核苷酸或寡核苷酸可以具有经由烷基-羧基基团附接到香豆素分子的氮原子以形成烷基-酰胺的标记。标记的核苷酸或寡核苷酸可以具有通过连接基部分附接到嘧啶碱基的C5位置或7-脱氮嘌呤碱基的C7位置的标记。
标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的封闭基团。该封闭基团可以附接在核糖或脱氧核糖上的任何位置处。在特定具体实施中,该封闭基团位于核苷酸的核糖或脱氧核糖的3’OH位置处。
本文提供了包括两种或更多种核苷酸的试剂盒,其中至少一种核苷酸是用本公开的化合物标记的核苷酸。该试剂盒可以包括两种或更多种标记的核苷酸。这些核苷酸可以用两种或更多种荧光标记物进行标记。可以使用单个激发源来激发这些标记中的两种或更多种标记,该激发源可以是激光器。例如,这两种或更多种标记的激发带可以至少部分地重叠,使得光谱重叠区域中的激发导致这两种标记发射荧光。在特定具体实施中,来自这两种或更多种标记的发射将发生在光谱的不同区域中,使得这些标记中的至少一种标记的存在可以通过以光学方式区分发射来确定。
该试剂盒可以包含四种标记的核苷酸,其中这四种核苷酸中的第一种核苷酸用如本文所公开的化合物进行标记。在这种试剂盒中,这四种核苷酸中的每一种核苷酸可以用与其他三种核苷酸上的标记相同或不同的化合物进行标记。因此,这些化合物中的一种或多种化合物可以具有不同的吸光度最大值和/或发射最大值,使得所述化合物能够与其他化合物区分开。例如,每种化合物可以具有不同的吸光度最大值和/或发射最大值,使得这些化合物中的每一种化合物能够与其他三种化合物区分开。应当理解,吸收光谱和/或发射光谱中除最大值之外的部分可以不同,并且可以利用这些差异来区分化合物。该试剂盒可以是这样的:即,这些化合物中的两种或更多种化合物具有不同的吸光度最大值。这些化合物可以吸收低于500nm的区域中的光。
本文示出的化合物、核苷酸或试剂盒可以用于检测、测量或识别生物系统(包括例如其过程或组分)。可以采用所述化合物、核苷酸或试剂盒的一些技术包括测序、表达分析、杂交分析、遗传分析、RNA分析、细胞测定(例如,细胞结合或细胞功能分析)或者蛋白质测定(例如,蛋白质结合测定或蛋白质活性测定)。该用途可以是在用于执行特定技术的自动化仪器(诸如自动化测序仪器)上。测序仪器可以包含在不同波长下操作的两个激光器。
本文公开了合成本公开的化合物的方法。根据本公开的染料可以由多种不同的合适起始物质合成。用于制备香豆素染料的方法是本领域熟知的。
本文所述的化合物可以表示为若干内消旋形式。在绘制单一结构的情况下,预期存在任何相关的内消旋形式。本文所述的香豆素化合物由单一结构表示,但同样可以被显示为任何相关的内消旋形式。一些内消旋结构在下面针对式(III)示出:
在示出本文所述化合物的单一内消旋形式的每种情况下,同样设想了替代性的内消旋形式。
与生物分子的附接可以经由式(III)的化合物的R、R
在一些具体实施中,染料化合物可以经由核苷酸碱基共价地附接到寡核苷酸或核苷酸。例如,标记的核苷酸或寡核苷酸可以具有通过连接基部分附接到嘧啶碱基的C5位置或7-脱氮嘌呤碱基的C7位置的标记。标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的3'-OH封闭基团。
如本文所述的荧光染料的特别有用的应用是用于标记生物分子,例如,核苷酸或寡核苷酸。本申请的一些具体实施涉及用如本文所述的荧光化合物标记的核苷酸或寡核苷酸。
在以下实施例中更详细地公开了附加的具体实施,这些实施例并非旨在以任何方式限制权利要求书的范围。
在以下实施例中更详细地公开了附加的具体实施,这些实施例并非旨在以任何方式限制权利要求书的范围。表3汇总了实施例中所公开的香豆素荧光染料的光谱特性。表4汇总了用本文所公开的染料标记的各种核苷酸的结构和光谱特性。
将3-(苯并噻唑-2-基)-7-氟-香豆素衍生物(FC-1,0.4g,1.345mmol,1当量)和6-氨基己酸(AC-C5,0.25g,1.906mmol,1.417当量)添加到无水二甲基亚砜(DMSO,3mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后将N,N-二异丙基-N-乙胺(DIPEA,0.25g,2mmol,2当量)添加到该混合物中。将反应混合物在120℃处搅拌3小时。在室温处静置1小时之后,用水(5mL)稀释黄色半固体反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.36g(65.5%)。MS(DUIS):MW计算值408.47。m/z实测值:(+)409(M+1)
将3-(苯并咪唑-2-基)-7-氟-香豆素(FC-2,0.28g,1mmol,1当量)和6-氨基己酸(AC-C5,0.13g,1mmol,1当量)添加到无水二甲基亚砜(DMSO,2mL)中。将所得的混合物在室温处搅拌数分钟,然后添加DIPEA(0.25g,2mmol,2当量)。将反应混合物在温度130℃处搅拌4小时。将附加部分的6-氨基己酸(AC-1,0.13g,1mmol,1当量)和DIPEA(0.26g,2mmol,2当量)添加到反应混合物中,并且在130℃处继续加热5小时。在室温处静置1小时之后,用水(5mL)稀释浅黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.26g(68.5%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值391.15。m/z实测值:(+)392(M+1)
将3-(苯并噻唑-2-基)-7-氟-香豆素(FC-1,0.3g,1.01mmol,1当量)和3-氨基丙酸叔丁酯盐酸盐(AC-C2,0.2g,1.1mmol,1.09当量)添加到无水二甲基亚砜(DMSO,2mL)中,将所得的混合物在室温处搅拌数分钟,然后添加DIPEA(0.26g,2mmol,2当量)。将所得的混合物在100℃处搅拌2小时。在室温处静置1小时之后,用水(7mL)稀释黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.38g(69%)。MS(DUIS):MW计算值422.13。m/z实测值:(+)423(M+1)
用三氟乙酸(0.5mL)处理7-[2-(叔丁氧羰基)乙基]氨基-3-(苯并噻唑-2-基)香豆素(III-1-3tBu,0.2g,0.473mmol)在无水二氯甲烷(20mL)中的溶液,并且将所得的混合物在室温处搅拌24小时。蒸馏出溶剂,并且用水(10mL)研磨残余物。通过抽滤收集所得的沉淀。收率为0.15g(86%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值366.39。m/z实测值:(+)367(M+1)
步骤A:7-[3-(叔丁氧羰基)丙基]氨基-3-(苯并噻唑-2-基)香豆素。
将3-(苯并噻唑-2-基)-7-氟-香豆素(FC-1,0.6g,2.02mmol,1当量)和4-氨基丁酸叔丁酯盐酸盐(AC-C3,0.5g,2.56mmol,1.27当量)添加到无水二甲基亚砜(DMSO,5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加DIPEA(0.65g,5mmol,4当量)。将反应混合物在温度100℃处搅拌3小时。在室温处静置1小时之后,用水(10mL)稀释黄色半固体反应混合物,并且保持搅拌过夜。通过抽滤收集所得的沉淀。收率为0.7g(79%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值436.53。m/z实测值:(+)437(M+1)
用三氟乙酸(1mL)处理7-[3-(叔丁氧羰基)丙基]氨基-3-(苯并噻唑-2-基)香豆素(III-1-4tBu,0.7g,1.604mmol)在无水二氯甲烷(25mL)中的溶液,并且将反应混合物在室温处搅拌24小时。蒸馏出溶剂,并且用水(10mL)研磨残余物。通过抽滤收集所得的沉淀。收率为0.59g(97%)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值366.39。m/z实测值:(+)381(M+1)
将3-(5-氯-苯并噁唑-2-基)-7-氟-香豆素(FC-3,0.32g,1mmol,1当量)和6-氨基己酸(AC-C5,0.26g,2mmol,2当量)添加到圆底烧瓶中的无水二甲基亚砜(DMSO,5mL)中。添加完成之后,将混合物在室温处搅拌数分钟,然后添加DIPEA(0.52g,4mmol,2当量)。将反应混合物在温度135℃处搅拌7小时。添加附加部分的6-氨基己酸(AC-1,0.13g,1mmol,1当量)和DIPEA(0.26g,2mmol,2当量)并且在135℃处继续加热5小时。在室温处静置1小时之后,用水(15mL)稀释浅黄色反应混合物,并且搅拌过夜。通过抽滤收集所得的沉淀。收率为0.09g(21%)。通过HPLC、NMR和LCMS确认产物的纯度、结构和组成。MS(DUIS):MW计算值426.10。m/z实测值:(+)427(M+1)
伴随搅拌将化合物III-1-1(0.1g,0.245mmol)以小份添加到在干冰/丙酮浴中冷却的20%发烟硫酸(1mL)中。添加完成之后,将混合物在0℃处搅拌1小时,升温至室温,然后在室温处搅拌2小时。将溶液倾注到无水乙醚(25mL)中。在室温处静置1小时之后,通过抽滤收集所得的沉淀。收率为78mg(65%)。
实施例化合物III-2A,钠盐:将得自上文的沉淀再悬浮于水(2mL)中,并且通过添加5M NaOH溶液将悬浮液的pH调节至约5。将所得的混合物倾注到10mL甲醇中并且过滤悬浮液。将滤液蒸发至干,获得钠盐形式的染料(III-2A-Na)。通过HPLC、NMR和LCMS确认纯度、结构和组成。MS(DUIS):MW计算值488.07。m/z实测值:(+)489(M+1)
制备化合物III-2A和III-2B的三乙基铵盐:伴随搅拌将化合物III-1-1(0.41g,1mmol)以小份添加到在干冰/丙酮浴中冷却的20%发烟硫酸(5mL)中。添加完成之后,将混合物在0℃处搅拌1小时,升温至室温,然后在室温处搅拌2小时。将溶液倾注到无水乙醚(50mL)中。在室温处静置1小时之后,滗出有机溶剂层,并且将半固体底层溶解于乙腈-水(1:1,10mL)中。通过添加2M TEAB的水溶液将溶液的pH调节至约7.0。将所得的溶液通过20μm尼龙过滤器过滤,并且通过制备型HPLC分离异构体。真空浓缩异构体溶液,然后再溶解于水(20μL)中,真空除去溶剂至干,得到三乙基铵盐形式的染料。通过HPLC和LCMS确认纯度和组成。
伴随搅拌将化合物III-1-1(0.08g,0.2mmol)以小份添加到在干冰/丙酮浴中冷却的20%发烟硫酸(2mL)中。添加完成之后,将混合物在0℃处搅拌1小时,升温至室温,然后在70℃处搅拌2小时。然后将混合物在室温处搅拌过夜。将溶液倾注到无水乙醚(30mL)中。在室温处搅拌1小时之后,通过抽滤收集所得的沉淀。收率为43mg(38%)。
将沉淀重悬于水(2mL)中,并且通过添加2M TEAB的水溶液将悬浮液的pH调节至约7.5。将所得的混合物通过20μm尼龙过滤器过滤,并且通过制备型HPLC纯化。真空浓缩染料级分,然后再溶解于水(20μL)中,真空除去溶剂至干,得到双三乙基铵盐形式的染料。通过HPLC和LCMS确认纯度和组成。MS(DUIS):MW计算值568.03。m/z实测值:(+)569(M+1)
将染料溶液的荧光强度与商业染料在相同光谱区进行比较。结果示于表3中,并且证明了用于基于荧光的分析应用的染料的显著优点。
*在460nm处的荧光激发
将本文所公开的香豆素荧光染料与适当的氨基取代的腺嘌呤(A)核苷酸衍生物和胞嘧啶(C)核苷酸衍生物A-LN3-NH
在根据以下腺嘌呤方案用适当的试剂活化染料的羧基基团之后:
腺嘌呤偶联的一般产物如下所示:
ffA-LN3-染料是指具有LN3连接基并且用本文所公开的香豆素染料标记的完全官能化的A核苷酸。每个结构中的R基团是指缀合后的香豆素染料部分。
将染料(10μmol)置于5mL圆底烧瓶中干燥,并且溶解于无水二甲基甲酰胺(DMF,1mL)中,然后真空蒸馏出溶剂。将该规程重复两次。在室温处将干燥的染料溶解于无水N,N-二甲基乙酰胺(DMA,0.2mL)中。将N,N,N′,N′-四甲基-O-(N-琥珀酰亚胺基)脲四氟硼酸盐(TSTU,1.5当量,15μmol,4.5mg)添加到染料溶液中,然后经由微量移液管将DIPEA(3当量,30μmol,3.8mg,5.2μL)添加到该溶液中。将反应烧瓶在氮气下密封。通过TLC(洗脱剂:乙腈-水1:9)和HPLC监测反应进程。同时,将适当的氨基取代的核苷酸衍生物(A-LN3-NH
用本文所公开的染料标记的核苷酸的溶液中的荧光强度与用商业染料(来自AttoTec GmbH的Atto465)标记的核苷酸在相同光谱区的适当数据的比较证实了本文所述的用于标记生物分子的染料用于基于荧光的分析应用的优点。
本公开的一些方面提供了式(V)的化合物或其内消旋形式:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
p为整数1至2;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
Y为S、O或CH
Z为OH;
n为整数0至3;
X为OH或O
Ra
Rc
在一些方面,Rc
这些分子可以在位置Ra处包含一个或多个磺酰胺或SO
Ra
其中Rd可以为H、烷基、取代的烷基、芳基、取代的芳基、卤素、羧基、磺酰胺或磺酸。
因此,本公开的一些染料可以由式(VC)或(VD)或者它们的内消旋形式描述:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
p为整数1至2;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
Y为S、O或CH
Z为OH;
n为整数0至3;
X为OH或O
Ra
Rc
Rd是H、烷基、取代的烷基、芳基、取代的芳基、卤素、羧基、磺酰胺或磺酸。
在一些方面,Rd为H、烷基、取代的烷基、芳基、取代的芳基、卤素、羧基、磺酰胺或磺酸,其中Ra
在式(VC)或(VD)中,与吲哚环的相邻碳原子稠合的附加的环可以任选地被例如磺酸或磺酰胺取代。
C(=O)-X羧基基团或其衍生物通过长度为q的烷基链附接到吲哚氮原子,其中q为1至5个碳或杂原子。链可以为(CH
这些分子可以在位置Rc处包含一个或多个烷基磺酸根部分。Rc
在某些具体实施中,当Ra
以C(=O)-X示出的COOH基团可以充当用于进一步附接的连接部分或连接到另外的分子。一旦已发生缀合,COOH或COO
化合物的示例包括根据式(VI)或(VIa)的结构,或者它们的内消旋形式:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
p为整数1至2;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
Y为S、O或CH
Z为OH;
n为整数0至3;
X为OH或O
Ra
Rc
在一些方面,Rc
化合物的另外的示例包括根据式(VIIa)或(VIIb)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
p为整数1至2;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
t为整数1至6;
Y为S、O或CH
Z为OH;
n为整数0至3;
X为OH或O
Ra
Rc
在一些方面,Rc
化合物的另外的示例包括根据式(VIIIa)至(VIIId)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
Y为S、O或CH
Z为OH;
n为整数0至3;
X为OH或O
Ra
Rc
Rd是H、烷基、取代的烷基、芳基、取代的芳基、卤素、羧基、磺酰胺或磺酸。
化合物的另外的示例包括根据式(IXa)至(IXd)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且m为整数0至3;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;Y为S、O或CH
Z为OH;
n为整数0至3;并且
X为OH或O
化合物的另外的示例包括根据式(Xa)至(Xd)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
q为整数1至5;
alk为任选地含有一个或多个双键或三键的1至5个碳原子的链;
t为整数1至6;
Y为S、O或CH
Z为OH;
n为整数0至3;并且
X为OH或O
在前述具体实施中,alk为任选地含有一个或多个双键或三键的1至5个碳原子的烷基、烯基或炔基链。Alk可以是基团(CH
在以式V至XII给出的任何示例中;q可以等于5。在以式VII、式X或式XI给出的任何示例中;t可以等于4。在以式V至X给出的任何示例中;n可以等于1至3。在以式V至X给出的任何示例中;n可以等于1。在以式V至X给出的任何示例中;n可以为整数0至1。在n为1的情况下,OH基团可以在环上的任何位置处。OH基团可以在4位处。其中n为2或3,OH基团可以在苯环上的任何位置处。在以式V至X给出的任何示例中;当n为零时,Y可以等于O或S,而不是CH
化合物的另外的示例包括根据式(XIa)至(XId)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且m为整数0至3;
q为整数1至5;
r为整数1至5;
t为整数1至6;以及
X为OH或O
化合物的另外的示例包括根据式(XIIa)至(XIId)的结构:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
q为整数1至5;
r为整数1至5;以及
X为OH或O
在以式XI至XII给出的任何示例中;r可以等于3。
特别有用的化合物是用如本文所述的染料标记的核苷酸或寡核苷酸。标记的核苷酸或寡核苷酸可以具有经由烷基-羧基基团附接到吲哚的氮原子以形成酰胺的标记。标记的核苷酸或寡核苷酸可以具有通过连接基部分附接到嘧啶碱基的C5位置或7-脱氮嘌呤碱基的C7位置的标记。
标记的核苷酸或寡核苷酸还可以具有共价连接到核苷酸的核糖或脱氧核糖的封闭基团。该封闭基团可以附接在核糖或脱氧核糖上的任何位置处。在特定具体实施中,该封闭基团位于核苷酸的核糖或脱氧核糖的3’OH位置处。
本文提供了包括两种或更多种核苷酸的试剂盒,其中至少一种核苷酸是用本公开的化合物标记的核苷酸。该试剂盒可以包括两种或更多种标记的核苷酸。这些核苷酸可以用两种或更多种荧光标记物进行标记。可以使用单个激发源来激发这些标记中的两种或更多种标记,该激发源可以是激光器。例如,这两种或更多种标记的激发带可以至少部分地重叠,使得光谱重叠区域中的激发导致这两种标记发射荧光。在特定具体实施中,来自这两种或更多种标记的发射将发生在光谱的不同区域中,使得这些标记中的至少一种标记的存在可以通过以光学方式区分发射来确定。
该试剂盒可以包含四种标记的核苷酸,其中这四种核苷酸中的第一种核苷酸用如本文所公开的化合物进行标记。在这种试剂盒中,第二种、第三种和第四种核苷酸可以各自用任选地不同于第一种核苷酸上的标记并且任选地不同于彼此上的标记的化合物进行标记。因此,这些化合物中的一种或多种化合物可以具有不同的吸光度最大值和/或发射最大值,使得所述化合物能够与其他化合物区分开。例如,每种化合物可以具有不同的吸光度最大值和/或发射最大值,使得这些化合物中的每一种化合物能够与其他三种化合物区分开。应当理解,吸收光谱和/或发射光谱中除最大值之外的部分可以不同,并且可以利用这些差异来区分化合物。该试剂盒可以是这样的:即,这些化合物中的两种或更多种化合物在600nm以上具有不同的吸光度最大值。这些化合物可以吸收高于640nm的区域中的光。该试剂盒可以包括本文所述的红色波长发光化合物、绿色波长发光化合物或蓝色波长发光化合物中的任一种。
本文示出的化合物、核苷酸或试剂盒可以用于检测、测量或识别生物系统(包括例如其过程或组分)。可以采用所述化合物、核苷酸或试剂盒的一些技术包括测序、表达分析、杂交分析、遗传分析、RNA分析、细胞测定(例如细胞结合或细胞功能分析)或者蛋白质测定(例如蛋白质结合测定或蛋白质活性测定)。该用途可以是在用于执行特定技术的自动化仪器(诸如自动化测序仪器)上。测序仪器可以包含在不同波长下操作的两个激光器。
本文公开了合成本公开的化合物的方法。式(XIII)和/或(XIII-1)、(XIII-2)、(XIII-3)或(XIII-4)的化合物或其盐可以用作合成对称或非对称聚次甲基染料的起始物质:
或它们的盐,其中Ra
本文公开了合成本公开的化合物的方法。式(XIII-5)的化合物或其盐可以用作合成对称或非对称聚次甲基染料的起始物质:
本公开的另外的方面提供了式(XIV)的聚次甲基染料化合物或其内消旋形式:
其中mCat+或mAn-是有机或无机的带正/负电荷的抗衡离子,并且
m为整数0至3;
Ra
Rb为任选地取代的芳基或任选地取代的烷基;
Rc
Rb或者Rc
每个Ra
Ra
因此,本公开的染料可以由式(XIVA)、(XIVB)或(XIVC)描述:
在式(XIVA)、(XIVB)和(XIVC)中,与吲哚环的相邻碳原子稠合的一个或两个附加的环可以任选地被例如磺酸或磺酰胺取代。
该化合物可以是这样的:其中Ra基团之一为形成式(XV)结构的另外的稠环:
其中Ra
Rc
Rb可以为任选地取代的芳基或任选地取代的烷基;Rb可以为烷基。Rb可以为甲基、乙基、丙基、丁基、戊基或己基。烷基链可以进一步例如被羧基基团或磺酸基基团取代。Rb可以用于进一步缀合。例如,如果Rb含有COOH部分,则其可以与另外的分子缀合以便附接该标记。就生物分子、蛋白质、DNA标记和类似物而言,缀合可以经由Rb进行。一旦已发生缀合,Rb就可以形成酰胺或酯衍生物。该化合物可以经由Rb附接到核苷酸或寡核苷酸。
Rb可以为芳基或取代的芳基。Rb可以为苯基。
每个Rc
Rb或者Rc
化合物的示例包括:
或它们的盐。
本文公开了合成本公开的化合物的方法。式(XVI)和/或(XVI1)、(XVI2)的化合物或其盐可以用作合成对称或非对称聚次甲基染料的起始物质:
其中Ra为H、SO
Rb为任选地取代的芳基或任选地取代的烷基;并且
Rc为烷基或取代的烷基。
特定的激发波长可以为532nm、630nm至700nm,特别是660nm。
在低于5℃的温度处,将2-亚甲基-3,3-三甲基-1-苯基-2,3-二氢-1H-吲哚(1g,4.25mmol)溶解于1ml硫酸中,并且伴随搅拌添加1ml发烟硫酸(20%)。将溶液在室温处搅拌1h,然后在60℃处加热3h。用二乙醚沉淀产物,并且用丙酮和乙醇洗涤。收率为0.7g(52%)。通过NMR确认结构。
反应方案:
将2,3,3-三甲基-1-苯基-3H-吲哚鎓-5-磺酸盐(0.63g)和N-苯基甲酰亚胺乙酯(0.5g)的混合物在70℃处加热30分钟。形成了橙色熔化物。将产物用二乙醚研磨并滤出。收率为0.7g(84%)。
反应方案:
将2,3,3-三甲基-1-苯基-3H-吲哚鎓-5-磺酸盐(0.63g)、N,N’-二苯基甲脒(0.5g)、乙酸(1ml)和乙酸酐(2ml)的混合物在70℃处加热3小时,然后在50℃处加热过夜。形成了黄色溶液。滤出产物并且用二乙醚洗涤。收率为0.69g(75%)。
反应方案:
将N-(2-萘基),N-苯肼盐酸盐(19.51mmol,5.28g)、5-甲基-6-氧代庚烷磺酸(17.18mmol,3.70g)和无水ZnCl
质子NMR:(MeOH-D4):8.28(0.5H,d,J=8Hz);8.05-8.02(1H,m);7.89(0.5H,d,J=8Hz);7.75-7.66(3H,m);7.65-7.60(1H,m);1.49-1.43(1.5H,m);7.31-7.25(2H,m);7.16(.5H,d,J=9Hz);7.07(.5H,appt,J=7.4Hz);6.61(0.5H,d,J=8Hz);2.85-2.35(4H,m);1.88(3H,appd,J=9Hz);1.75-1.4(5H,m);1.35-1.25(0.5H,m);1.1-0.95(0.5H,m);0.8-0.65(0.5H,m);0.58-0.45(0.5H,m)。
反应方案:
作为先前的化合物由N-(2-萘基)-N-苯肼盐酸盐和4-甲基-5-氧代戊磺酸制备标题化合物。通过硅胶快速柱纯化产物。收率:40%。通过NMR光谱确认结构。
反应方案:
将N,N-二苯基肼盐酸盐(0.01mol,2.2g)、5-甲基-6-氧代庚烷磺酸(0.017mol,3.0g)的冰醋酸(20mL)溶液在室温(约20
化学名:2-{(5-[1-苯基-3,3-二甲基)-1,2-二氢-3H-吲哚-2-亚基]-1-丙烯-1-基}-3,3-二甲基-1-(5-羧基戊基)-吲哚鎓-5-磺酸盐。
反应方案:
将3,3-二甲基-1-(5--羧基戊基-2-(4-苯胺基乙烯基)-3H-吲哚鎓-5-磺酸盐(0.46g)和2,3,3-三甲基-1-苯基-3H-吲哚鎓高氯酸盐(0.34g)在乙酸酐(2ml)和乙酸(1ml)的混合物中的溶液在室温(约25℃)处搅拌0.5小时。然后向该溶液中添加吡啶(0.5ml)。将反应混合物在80℃处搅拌3小时。通过TLC(20%H
化学名:2-{(5-[(4-磺酸根基丁基)-1-苯基-3-甲基)-1,2-二氢-3H-吲哚-2-亚基]-1-丙烯-1-基}-3,3-二甲基-1-(5-羧基戊基)-吲哚鎓-5-磺酸三乙基铵。
反应方案:
将3,3-二甲基-1-(5-羧基戊基-2-(4-苯胺基乙烯基)-3H-吲哚鎓-5-磺酸盐(0.46g)和2,3-二甲基-3-(4-磺酸基丁基)-1-苯基-3H-吲哚鎓(0.36g)在乙酸酐(2ml)和乙酸(1ml)的混合物中的溶液在室温(约25℃)处搅拌0.5小时。然后向该溶液中添加吡啶(1ml)。将反应混合物在80℃处搅拌3小时。通过TLC(20%H
化学名:2-{(5-[(3-苯基-1,1-二甲基)-2,3-二氢-1H-苯并[e]吲哚-2-亚基]-1-丙烯-1-基}-3,3-二甲基-1-(5-羧基戊基)-吲哚鎓-5-磺酸盐。
反应方案:
将3,3-二甲基-1-(5-羧基戊基-2-(4-苯胺基乙烯基)-3H-吲哚鎓-5-磺酸盐(0.46g)和1,1,2-三甲基-3-苯基-3H-吲哚鎓高氯酸盐(0.39g)在乙酸酐(1ml)和乙酸(1ml)的混合物中的溶液在室温(约25℃)处搅拌0.5小时。然后向该溶液中添加吡啶(1ml)。将反应混合物在60℃处搅拌3h。通过TLC(20%H
反应方案:
制备:将无水DMA(5mL)和Hunig碱(0.06mL)添加到染料(化合物XXIII)的干燥样品(60mg)中。然后向其中添加TSTU(0.25g)在5mL无水DMA中的溶液。活化酯的红色显现。将反应混合物在室温下搅拌1小时。根据TLC(20%H
反应方案:
制备:将无水DMA(5mL)和Hunig碱(0.06mL)添加到染料(化合物XXIII)的干燥样品(82mg)中。然后向其中添加TSTU(0.25g)在5mL无水DMA中的溶液。活化酯的红色很快显现。将反应混合物在室温处搅拌1h。在活化完成之后(TLC:15%H
在本说明书通篇中使用的术语“基本上”和“约”用于描述和说明小的波动,诸如由于处理中的变化所引起的小的波动。例如,它们可以指小于或等于±5%,诸如小于或等于±2%,诸如小于或等于±1%,诸如小于或等于±0.5%,诸如小于或等于±0.2%,诸如小于或等于±0.1%,诸如小于或等于±0.05%。另外,当在本文中使用时,不定冠词诸如“一个”或“一种”意味着“至少一个”或“至少一种”。
应当理解,前述概念和下文更详细讨论的附加概念(假设此类概念不相互矛盾)的所有组合都被设想为是本文所公开的发明主题的一部分。具体地讲,出现在本公开末尾的要求保护的主题的所有组合都被设想为是本文所公开的发明主题的一部分。
已经描述了多个具体实施。然而,应当理解,在不脱离说明书的实质和范围的前提下,可以进行各种修改。
此外,附图中所示的逻辑流程不需要所示的特定顺序或有序顺序来实现所需的结果。此外,可以提供其他过程,或者可以从所描述的流程中消除一些过程,并且可以向所描述的系统中添加其他部件,或者从所描述的系统中移除其他部件。因此,其他具体实施也在以下权利要求书的范围内。
虽然所描述的具体实施的某些特征已经如本文所描述加以展示,但是本领域的技术人员现在将想到许多修改、替换、改变和等同形式。因此,应当理解,所附权利要求书旨在涵盖落入具体实施范围内的所有此类修改和变化。应当理解,它们仅以举例的方式而非限制的方式呈现,并且可以在形式和细节上做出各种改变。本文所述的设备和/或方法的任何部分可以以除了互相排斥的组合之外的任何组合进行组合。本文所述的具体实施可以包括所描述的不同具体实施的功能、组分和/或特征的各种组合和/或子组合。
- 分析物的多重荧光检测
- 细胞、颗粒和其它分析物的多重分析
