透明质酸的固相包被物及方法、检测试剂盒、系统及方法
文献发布时间:2023-06-19 11:40:48
技术领域
本申请涉及免疫技术领域,特别是涉及一种透明质酸的检测试剂盒、固相包被物、固相包被方法、检测方法及免疫分析系统。
背景技术
透明质酸(hyaluronic acid,简称HA)为基质成分之一,由间质细胞合成,可较准确灵敏地反映肝内已生成的纤维量及肝细胞受损状况,本指标较之肝活检更能完整反映出病肝全貌,是肝纤维化和肝硬变的敏感指标。
当前的透明质酸的检测试剂的制备工艺繁琐,且制备成本高,不能满足使用需求。
发明内容
本申请主要解决的技术问题是提供一种透明质酸的检测试剂盒、固相包被物、固相包被方法、检测方法及免疫分析系统,能够简化透明质酸检测试剂盒的制备工艺,以及降低透明质酸检测试剂盒的成本。
为解决上述技术问题,本申请采用的一个技术方案是:提供一种透明质酸的检测试剂盒,所述透明质酸的检测试剂盒包括第一试剂,所述第一试剂包括固相载体-透明质酸复合物;其中,所述固相载体-透明质酸中的固相载体表面具有氨基官能团,所述固相载体-透明质酸中的透明质酸具有羧基官能团,所述固相载体与所述透明质酸之间通过氨基官能团与羧基官能团连接在一起。
为解决上述技术问题,本申请采用的另一个技术方案是:提供一种透明质酸的固相包被物,包括互相连接的固相载体及透明质酸,其中,所述固相载体表面具有氨基官能团,所述透明质酸中具有羧基官能团,所述固相载体与所述透明质酸之间通过氨基官能团与羧基官能团连接在一起。
为解决上述技术问题,本申请采用的另一个技术方案是:提供一种免疫分析系统,所述免疫分析系统包括免疫分析设备及如上所述的透明质酸的检测试剂盒。
为解决上述技术问题,本申请采用的另一个技术方案是:提供一种透明质酸的固相包被方法,所述制备方法包括:提供固相载体、透明质酸及缓冲液,其中,所述固相载体表面具有氨基官能团,所述透明质酸具有羧基官能团;将所述固相载体、所述透明质酸以及所述缓冲液混匀,以使得所述固相载体与所述透明质酸之间通过氨基官能团与羧基官能团连接在一起,得到透明质酸包被的固相载体。
为解决上述技术问题,本申请采用的另一个技术方案是:提供一种透明质酸的检测方法,所述检测方法包括:将待测样本与固相载体-透明质酸复合物、透明质酸结合蛋白混合,进行第一孵育,以使得所述固相载体-透明质酸复合物中的透明质酸,以及所述待测样本中的透明质酸分别与所述透明质酸结合蛋白结合,从而形成固相载体-透明质酸-透明质酸结合蛋白的第一复合物,以及透明质酸-透明质酸结合蛋白的第二复合物,并在所述第一孵育完成后,去除上清液;在所述第一孵育完成并去除上清液后,加入透明质酸结合蛋白抗体,进行第二孵育,以使所述第一复合物中的所述透明质酸结合蛋白分别与所述透明质酸结合蛋白抗体结合,从而形成固相载体-透明质酸-透明质酸结合蛋白-透明质酸结合蛋白抗体的第三复合物,并在所述第二孵育完成后,去除上清液;利用荧光标记物对所述第三复合物进行荧光标记,得到待测物;对所述待测物进行荧光检测,从而得出所述待测样本中所述透明质酸的浓度;其中,所述固相载体-透明质酸中的固相载体表面具有氨基官能团,所述固相载体-透明质酸中的透明质酸具有羧基官能团,所述固相载体与所述透明质酸之间通过氨基官能团与羧基官能团连接在一起。
本申请的有益效果是:区别于现有技术的情况,本申请透明质酸的检测试剂盒中的固相载体-透明质酸复合物中的固相载体采用表面带有氨基的固相载体,从而使得固相载体与透明质酸之间能够通过固相载体表面的氨基官能团与透明质酸的羧基官能团直接连接在一起,而无需进一步对透明质酸进行生物大分子的偶联,从而能够简化透明质酸检测试剂盒的制备工艺,以及降低透明质酸检测试剂盒的成本。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。其中:
图1是本申请透明质酸的检测试剂盒一实施方式的结构示意图;
图2是本申请免疫分析系统一实施方式的结构示意图;
图3是本申请透明质酸的固相包被方法一实施方式的流程示意图;
图4是图3中步骤S12的流程示意图;
图5是本申请透明质酸的检测方法一实施方式的流程示意图。
具体实施方式
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性的劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
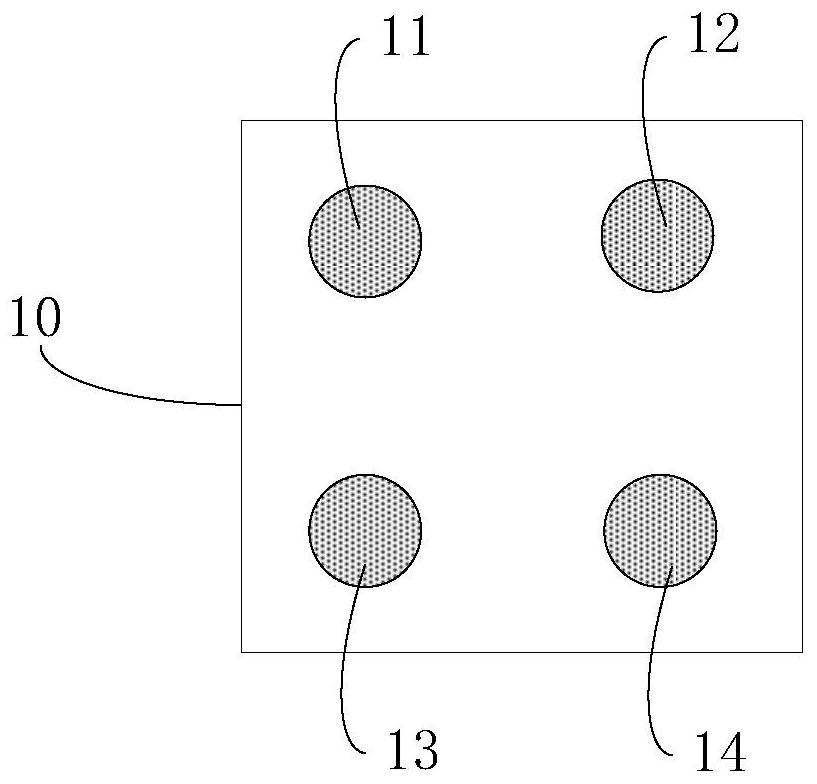
请参阅图1,图1是本申请透明质酸的检测试剂盒一实施方式的结构示意图。
本实施方式中,检测试剂盒10可包括第一容纳位11、第二容纳位12、第三容纳位13及第四容纳位14,以及第一试剂、第二试剂、第三试剂及第四试剂,其中,第一试剂、第二试剂、第三试剂及第四试剂分别容置于第一容纳位11、第二容纳位12、第三容纳位13及第四容纳位14中。
其中,第一试剂可包括固相载体-透明质酸复合物、第一保存液等,第二试剂可包括透明质酸结合蛋白(HABP)、第二保存液等,第三试剂可包括透明质酸结合蛋白抗体、第三保存液等,第四试剂可包括标记物、第四保存液等。
其中,上述第一保存液、第二保存液、第三保存液及第四保存液均可相同或者不同。在一个应用场景中,第一保存液、第二保存液、第三保存液及第四保存液均为10mM的pH为8.0的氨基丁三醇缓冲液(即Tris缓冲液),其中含有质量百分含量为0.05%的吐温-20,以及质量百分含量为0.1%的牛血清蛋白(Bovine serum albumin,BSA)。
具体地,在第一试剂中,固相载体-透明质酸复合物的浓度为0.01-1mg/mL,具体如0.01mg/mL、0.05mg/mL、0.1mg/mL、0.5mg/mL、1mg/mL等;第二试剂中,透明质酸结合蛋白的浓度为0.1-2ug/mL,具体如0.1ug/mL、0.5ug/mL、1ug/mL、1.5ug/mL、2ug/mL等,第三试剂中,透明质酸结合蛋白抗体的浓度为0.1-2ug/mL,具体如0.1ug/mL、0.5ug/mL、1ug/mL、1.5ug/mL、2ug/mL等,第四试剂中,标记物的浓度为0.1-2ug/mL,具体如0.1ug/mL、0.5ug/mL、1ug/mL、1.5ug/mL、2ug/mL等。
进一步地,本实施方式中,固相载体-透明质酸中的固相载体表面具有氨基官能团,固相载体-透明质酸中的透明质酸具有羧基官能团,固相载体与透明质酸之间通过氨基官能团与羧基官能团连接在一起。
需要指出的是,本实施方式中,固相载体采用表面带有氨基的固相载体,从而使得固相载体与透明质酸之间能够通过固相载体表面的氨基官能团直接与透明质酸的羧基官能团连接在一起,而无需进一步对透明质酸进行生物大分子的偶联,从而能够降低透明质酸检测试剂盒的制备成本。
进一步地,固相载体可以为磁性微球,其中,磁性微球的平均粒径可以为3μm-8μm,具体如3μm、4μm、5μm、6μm、8μm等。
进一步地,在一实施方式中,第三试剂中的透明质酸结合蛋白抗体经过生物素修饰,而第四试剂中的标记物则经亲和素修饰。
其中,亲和素是一种糖蛋白,可由蛋清中提取,每个亲和素分子由4个亚基组成,可以和4个生物素分子亲密结合。亲和素与生物素的结合,虽不属免疫反应,但特异性强,亲和力大,两者一经结合就极为稳定。由于1个亲和素分子有4个生物素分子的结合位置,可以连接更多的生物素化的分子,形成一种类似晶格的复合体。
因此,从而在使用该试剂盒进行检测时,标记物与透明质酸结合蛋白抗体能够通过亲和素与生物素的结合而形成稳定的复合物,从而实现标记物对透明质酸结合蛋白抗体的标记。
其中,标记物可以为荧光标记物,如藻红蛋白(P-phycoerythrin,PE)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、四甲基异硫氰酸罗丹明(Tetramethylrhodamine)、菁类染料(如Cy2、Cy3)等中的至少一种。具体地,本实施方式中的标记物可以为亲和素修饰的藻红蛋白。当然,在其它实施方式中,也可采用其它的标记物,此处不做具体限定
本申请还提供一种透明质酸的固相包被物。在一实施方式中,透明质酸的固相包被物可包括互相连接的固相载体及透明质酸。
本实施方式中的固相载体为表面具有氨基官能团的固相载体,具体可以为具有氨基官能团的微孔板、玻璃片、微流控芯片、胶乳、磁性或非磁性的高分子微球、金属合金纳米颗粒、无机微球、无机/有机杂化微球、荧光纳米颗粒、磁珠、多功能荧光磁珠等中的至少一种。
进一步地,透明质酸具有羧基官能团,上述固相载体与透明质酸之间通过氨基官能团与羧基官能团连接在一起,从而形成透明质酸的固相包被物。
需要说明的是本实施方式中关于固相载体与透明质酸的其它相关特征与本申请上述透明质酸的检测试剂盒实施方式中的相同,相关详细内容请参见上述实施方式,此处不再赘述。
请参阅图2,图2是本申请免疫分析系统一实施方式的结构示意图。本实施方式中,免疫分析系统100包括透明质酸的检测试剂盒10及免疫分析设备20。
其中,透明质酸的检测试剂盒10与本申请上述透明质酸的检测试剂盒实施方式中的相同,相关详细内容请参见上述实施方式,此处不再赘述。
请参阅图3,图3是本申请透明质酸的固相包被方法一实施方式的流程示意图。本实施方式中,该固相包被方法包括:
步骤S11:提供固相载体、透明质酸及缓冲液,其中,固相载体表面具有氨基官能团,透明质酸具有羧基官能团;
具体地,固相载体可以为氨基官能团的微孔板、玻璃片、微流控芯片、胶乳、磁性或非磁性的高分子微球、金属合金纳米颗粒、无机微球、无机/有机杂化微球、荧光纳米颗粒、磁珠、多功能荧光磁珠等中的至少一种。
缓冲液可以为3-(N-吗啉基)丙磺酸-氢氧化钠缓冲液、3-[N,N-二(羟乙基)氨基]-2-羟基丙磺酸-氢氧化钠缓冲液、4-(2-羟乙基)-1-哌嗪丙磺酸-氢氧化钠缓冲液、三羟甲基氨基甲烷-HCl缓冲液、N-(2-羟乙基)哌嗪-N'-2-乙烷磺酸-NaOH缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、咪唑缓冲液、柠檬酸缓冲液、甘氨酸-NaOH缓冲液或巴比妥缓冲液中的至少一种。
步骤S12:将固相载体、透明质酸以及缓冲液混匀,以使得固相载体与透明质酸之间通过氨基官能团与羧基官能团连接在一起,得到透明质酸包被的固相载体。
具体地,请参阅图4,步骤S12可包括:
步骤S121:利用缓冲液对固相载体进行清洗,并向清洗后的固相载体中加入缓冲液重悬,得到固相载体与缓冲液的第一混合物;
步骤S122:向所述第一混合物中加入透明质酸,并混匀,得到第二混合物;
步骤S123:依次向第二混合物中加入第一活化剂和第二活化剂,并混匀反应预设时间,以使得固相载体与透明质酸之间通过氨基官能团与羧基官能团连接在一起,得到第三混合物;
步骤S124:去除第三混合物中的上清液,并利用清洗液进行清洗,然后加入封闭液,进行封闭处理,得到第四混合物;
步骤S125:去除第四混合物中的上清液,并利用清洗液进行清洗,然后加入保存液进行保存。
其中,上述各步骤中涉及到清洗以及去除上清液的,均可采用磁分离技术进行。
具体地,上述第一活化液和第二活化液可分别为N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(N-Ethyl-N'-(3-dimethylaminopropyl)carbodiimide hydrochloride,EDC)、NHS与MES的混合液、EDC与MES的混合液中的至少一种,例如,第一活化液为NHS与MES的混合液,第二活化液为EDC与MES的混合液。
其中,上述透明质酸的固相包被方法中,其它相关内容可与本申请上述透明质酸的检测试剂盒实施方式中的相同,相关详细内容请参阅上述实施方式,此处不再赘述。
需要指出的是,上述透明质酸的固相包被方法中,采用具有氨基官能团的固相载体,可以通过透明质酸的羟基官能团与氨基官能团之间的连接而直接将透明质酸偶联到固相载体上,从而实现透明质酸的固相包被,而无需在偶联之前进一步对透明质酸进行生物大分子修饰,操作工艺简单、从而能够降低成本。
请参阅图5,图5是本申请透明质酸的检测方法一实施方式的流程示意图。本实施方式中,该检测方法包括:
步骤S21:将待测样本与固相载体-透明质酸复合物、透明质酸结合蛋白混合,进行第一孵育,以使得固相载体-透明质酸复合物中的透明质酸,以及待测样本中的透明质酸分别与透明质酸结合蛋白结合,从而形成固相载体-透明质酸-透明质酸结合蛋白的第一复合物,以及透明质酸-透明质酸结合蛋白的第二复合物,并在第一孵育完成后,去除包含第二复合物在内的上清液;
步骤S22:在第一孵育完成并去除上清液后,加入透明质酸结合蛋白抗体,进行第二孵育,以使第一复合物中的透明质酸结合蛋白分别与透明质酸结合蛋白抗体结合,从而形成固相载体-透明质酸-透明质酸结合蛋白-透明质酸结合蛋白抗体的第三复合物,并在第二孵育完成后,去除上清液;
步骤S23:利用荧光标记物对第三复合物进行荧光标记,得到待测物;
步骤S24:对待测物进行荧光检测,从而得出待测样本中透明质酸的浓度。
需要指出的是,上述步骤S21中,固相载体-透明质酸复合物与待测样本中的透明质酸在与透明质酸结合蛋白结合时,形成竞争的关系,在进行第一孵育时,待测样本中的透明质酸的浓度越高,则固相载体-透明质酸-透明质酸结合蛋白的第一复合物的量越少,在第一孵育后所去除的上清液中,包含透明质酸-透明质酸结合蛋白的第二复合物,从而使得在步骤S24中进行荧光检测时,所检测到的荧光信号的强度与待测样本中的透明质酸的浓度呈负相关的关系。
进一步地,上述透明质酸的检测方法中,其它相关内容可与本申请上述透明质酸的检测试剂盒实施方式中的相同,相关详细内容请参阅上述实施方式,此处不再赘述。
下面通过具体的实施例对本申请上述各实施方式进行说明。
实施例一
透明质酸包被的磁性微球的制备:
(1)取0.1mg平均粒径为3um的氨基磁性微球,采用浓度为50mM、pH值为5.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为50mM、pH值为5.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的透明质酸,并涡旋混匀;
(3)利用浓度为50mM、pH值为5.0的MES缓冲液溶解NHS至10mg/mL,并取5uL加入上述混匀的氨基磁性微球与透明质酸的混合物中,涡旋混匀后,并利用浓度为50mM、pH值为5.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述已加入NHS的混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭1h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
作为制备透明质酸包被磁性微球的对照,用相同的方式制备BSA包被的磁性微球:
(1)取0.1mg平均粒径为3um的氨基磁性微球,采用浓度为50mM、pH值为5.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为50mM、pH值为5.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的BSA,并涡旋混匀;
(3)利用浓度为50mM、pH值为5.0的MES缓冲液溶解NHS至10mg/mL,并取5uL加入上述混匀的氨基磁性微球与BSA的混合物中,涡旋混匀后,并利用浓度为50mM、pH值为5.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述已加入NHS的混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭1h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
实施例二
透明质酸包被的磁性微球的制备:
(1)取0.1mg平均粒径为5um的氨基磁性微球,采用浓度为50mM、pH值为5.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为50mM、pH值为5.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的透明质酸,并涡旋混匀;
(3)利用浓度为50mM、pH值为5.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述氨基磁性微球混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭1h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
作为制备透明质酸包被磁性微球的对照,用相同的方式制备BSA包被的磁性微球:
(1)取0.1mg平均粒径为5um的氨基磁性微球,采用浓度为50mM、pH值为5.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为50mM、pH值为5.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的BSA,并涡旋混匀;
(3)利用浓度为50mM、pH值为5.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述氨基磁性微球混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭1h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
实施例三
透明质酸包被的磁性微球的制备:
(1)取0.1mg平均粒径为5um的氨基磁性微球,采用浓度为10mM、pH值为6.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为10mM、pH值为6.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的透明质酸,并涡旋混匀;
(3)利用浓度为10mM、pH值为6.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述氨基磁性微球混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭1h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
作为制备透明质酸包被磁性微球的对照,用相同的方式制备BSA包被的磁性微球:
(1)取0.1mg平均粒径为5um的氨基磁性微球,采用浓度为10mM、pH值为6.0的MES缓冲液通过磁分离技术去除上清液的方式清洗两遍后,再加入80uL的浓度为10mM、pH值为6.0的MES缓冲液重悬;
(2)在重悬的氨基磁性微球中加入10uL的浓度为1mg/mL的BSA,并涡旋混匀;
(3)利用浓度为10mM、pH值为6.0的MES缓冲液溶解EDC至10mg/mL,然后取5uL加入上述氨基磁性微球混合物中,涡旋混匀,并在37℃下反应3h;
(4)反应后,通过磁分离技术去除上清液,并利用清洗液清洗1次后,加入0.1mL封闭液,在37℃下封闭3h;
(5)封闭后,利用磁分离技术去除上清液,并利用清洗液清洗1次后加入1mL保存液至浓度为0.1mg/mL,4℃保存。
需要说明的是,上述制备方法以及下述测试方法中所采用的清洗液为浓度为10mM、pH值为8.0的Tris,且包含质量百分含量为0.05%的吐温-20,封闭液为浓度为10mM、pH值为8.0的Tris,且包含质量百分含量为1%的BSA。
分别对上述三个实施例所制备的透明质酸包被的磁性微球、BSA包被的磁性微球进行偶联测试,具体方式如下:
(1)取50uL浓度为0.1mg/mL的待测物,加入25uL的浓度为1ug/mL HABP,同时设置一个空白对照,向待测物中加入等量的清洗液,并分别在37℃下孵育15min;
(2)通过磁分离技术去除上清液,然后加入100uL的浓度为0.5ug/mL的生物素标记的抗HABP抗体,并在37℃下孵育10min;
(3)通过磁分离技术去除上清液,然后加入100uL的浓度为0.2ug/mL SA-PE,并在37℃下孵育5min;
(4)通过磁分离技术去除上清液,然后加入100uL的上述清洗液,重悬后进行荧光检测,检测结果如下表1所示:
表1
从上表1能够看出,经过上述实施例一、二、三中的方法的制备,透明质酸都成功包被上氨基磁性微球,且具有较高活性。
进一步地,分别利用上述三个实施例所制备的透明质酸包被的磁性微球对HA血清样本进行检测,具体方式如下:
(1)取50uL浓度为0.1mg/mL的包被HA的氨基磁性微球,加入25uL HA血清样本,以及25uL浓度为1ug/mL的HABP,并在37℃下孵育15min;
(2)利用磁分离技术去除上清液,并加入100uL清洗液洗一次,然后加入100uL浓度为0.5ug/mL的生物素标记的抗HABP抗体,并在37℃下孵育10min;
(3)利用磁分离技术去除上清液,并加入100uL清洗液洗一次,然后加入100uL浓度为0.5ug/mL的SA-PE,并在37℃下孵育5min;
(4)利用磁分离技术去除上清液,并加入100uL清洗液洗一次,然后加入100uL的清洗液重悬后,利用新产业化学发光免疫分析仪进行检测,所得到的检测结果如下表2。
表2
从表2中可以看出,上述实施例一、二、三所制备的HA包被的磁性微球最低可以测到透明质酸浓度为2.775ng/mL的待测样本,有较高的灵敏度和较宽的检测范围(2.775-2000ng/mL)。
以上所述仅为本申请的实施方式,并非因此限制本申请的专利范围,凡是利用本申请说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本申请的专利保护范围内。
- 透明质酸的固相包被物及方法、检测试剂盒、系统及方法
- 一种透明质酸固相包被方法
