具有间充质干细胞的动员活性的肽
文献发布时间:2023-06-19 12:02:28
技术领域
本申请涉及具有间充质干细胞的动员活性的肽、间充质干细胞的动员用组合及基于间充质干细胞的动员的疾病治疗药。
背景技术
骨髓液等中含有的间充质干细胞具有能够分化为骨、软骨、脂肪、肌肉、神经、上皮等各种组织的能力(多分化能力),因此近年来,广泛进行了使用通过培养而增殖的骨髓来源间充质干细胞进行再生医疗(细胞移植治疗)的尝试。但是,含有间充质干细胞的骨髓血的采集是通过向髂骨多次刺入粗针的侵入性方法来进行的,因此对供体的负担大。另外,间充质干细胞在体外持续传代培养时会逐渐失去增殖能力、多分化能力。此外,基于保证生物体内移植的安全性的高品质管理的间充质干细胞的培养需要CPC(cell processingcenter,细胞培养设施)等特殊培养设备,因此现状是只有有限的大学或企业能实施。
现有技术文献
非专利文献
非专利文献1:PNAS 2011 Apr 19;108(16):6609-14
专利文献
专利文献1:WO2008/053892
专利文献2:WO2009/133939
专利文献3:WO2012/147470
发明内容
发明所要解决的课题
本申请的目的在于开发能够克服细胞移植治疗的问题点的新的再生医疗的技术。
用于解决课题的手段
本发明者们基于目前为止进行的独自的研究结果设计了人工序列肽,结果发现,该肽显示将间充质干细胞动员到外周血中的活性。另外发现,该人工序列肽对炎症性肠病、特应性皮炎、以及脑梗塞显示治疗效果。基于这些见解,本发明提供一种能够克服细胞移植治疗的问题点的新的再生医疗的技术。
即,本申请提供以下内容。
〔1〕
一种用于将间充质干细胞动员到外周血的组合物,其含有选自以下中的肽:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔2〕
一种用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的组合物,其含有选自以下中的肽:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔3〕
根据〔2〕所述的组合物,其中,疾病或病理状态的治疗选自炎症抑制治疗、免疫调节治疗、组织的再生诱导治疗及组织的纤维化抑制治疗。
〔4〕
根据〔2〕所述的组合物,其中,疾病或病理状态选自炎症性疾病、自身免疫疾病、伴随组织的损伤、缺血或坏死的疾病及纤维性疾病。
〔5〕
根据〔2〕所述的组合物,其中,疾病或病理状态为炎症性肠病。
〔6〕
根据〔2〕所述的组合物,其中,疾病或病理状态为溃疡性结肠炎。
〔7〕
根据〔2〕所述的组合物,其中,疾病或病理状态为特应性皮炎。
〔8〕
根据〔2〕所述的组合物,其中,疾病或病理状态为脑梗塞。
〔9〕
一种用于治疗选自炎症性肠病、特应性皮炎及脑梗塞中的疾病的组合物,其含有选自以下中的肽:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔10〕
选自以下中的肽:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔A1〕
一种将间充质干细胞动员到外周血的方法,其包含向对象给药选自以下中的肽的有效量的工序:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔A2〕
一种通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的方法,其包含向对象给药选自以下中的肽的有效量的工序:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔A3〕
根据〔A2〕所述的方法,其中,疾病或病理状态的治疗选自炎症抑制治疗、免疫调节治疗、组织的再生诱导治疗及组织的纤维化抑制治疗。
〔A4〕
根据〔A2〕所述的方法,其中,疾病或病理状态选自炎症性疾病、自身免疫疾病、伴随组织的损伤、缺血或坏死的疾病及纤维性疾病。
〔A5〕
根据〔A2〕所述的方法,其中,疾病或病理状态为炎症性肠病。
〔A6〕
根据〔A2〕所述的方法,其中,疾病或病理状态为溃疡性结肠炎。
〔A7〕
根据〔A2〕所述的方法,其中,疾病或病理状态为特应性皮炎。
〔A8〕
根据〔A2〕所述的方法,其中,疾病或病理状态为脑梗塞。
〔A9〕
一种治疗选自炎症性肠病、特应性皮炎及脑梗塞中的对象的疾病的方法,其包含向对象给药选自以下中的肽的有效量的工序:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔B1〕
一种用于将间充质干细胞动员到外周血的肽,其选自以下:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔B2〕
一种用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的肽,其选自以下:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔B3〕
根据〔B 2〕所述的肽,其中,疾病或病理状态的治疗选自炎症抑制治疗、免疫调节治疗、组织的再生诱导治疗及组织的纤维化抑制治疗。
〔B 4〕
根据〔B2〕所述的肽,其中,疾病或病理状态选自炎症性疾病、自身免疫疾病、伴随组织的损伤、缺血或坏死的疾病及纤维性疾病。
〔B5〕
根据〔B2〕所述的肽,其中,疾病或病理状态为炎症性肠病。
〔B6〕
根据〔B2〕所述的肽,其中,疾病或病理状态为溃疡性结肠炎。
〔B7〕
根据〔B2〕所述的肽,其中,疾病或病理状态为特应性皮炎。
〔B8〕
根据〔B2〕所述的肽,其中,疾病或病理状态为脑梗塞。
〔B9〕
一种用于治疗选自炎症性肠病、特应性皮炎及脑梗塞中的疾病的肽,其选自以下:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔C1〕
选自以下中的肽在制造用于将间充质干细胞动员到外周血的药物或者试剂中的用途:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔C2〕
选自以下中的肽在制造用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的药物中的用途:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
〔C3〕
根据〔C2〕所述的用途,其中,疾病或病理状态的治疗选自炎症抑制治疗、免疫调节治疗、组织的再生诱导治疗及组织的纤维化抑制治疗。
〔C4〕
根据〔C2〕所述的用途,其中,疾病或病理状态选自炎症性疾病、自身免疫疾病、伴随组织的损伤、缺血或坏死的疾病及纤维性疾病。
〔C5〕
根据〔C2〕所述的用途,其中,疾病或病理状态为炎症性肠病。
〔C6〕
根据〔C2〕所述的用途,其中,疾病或病理状态为溃疡性结肠炎。
〔C7〕
根据〔C2〕所述的用途,其中,疾病或病理状态为特应性皮炎。
〔C8〕
根据〔C2〕所述的用途,其中,疾病或病理状态为脑梗塞。
〔C9〕
选自以下中的肽在制造用于治疗选自炎症性肠病、特应性皮炎及脑梗塞中的疾病的药物中的用途:
(a)包含序列号1的氨基酸序列的肽;
(b)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或多个氨基酸而成的氨基酸序列的肽;以及
(c)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的肽。
附图说明
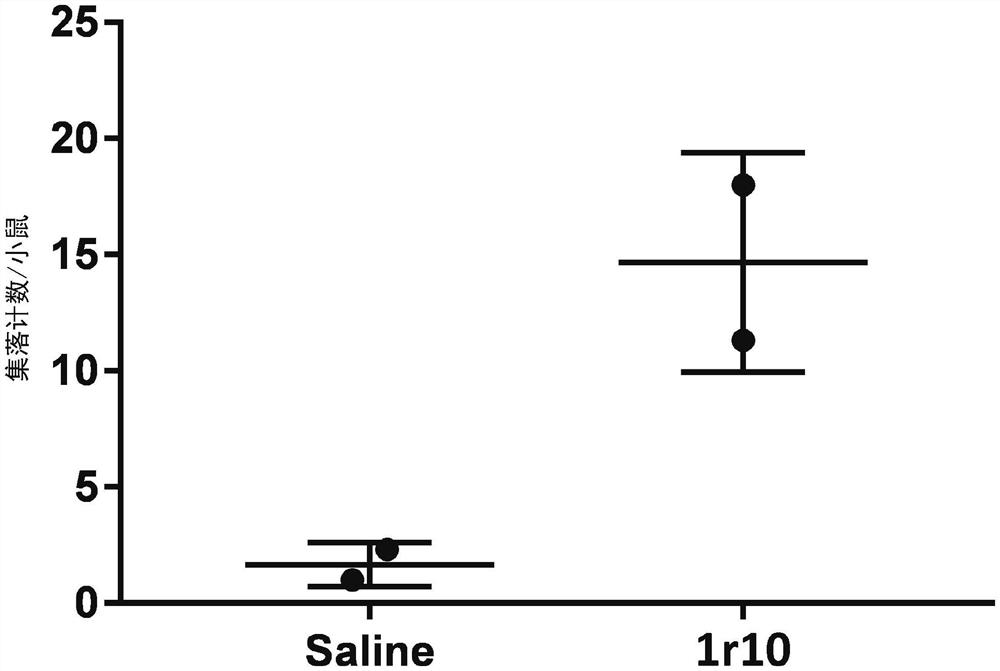
图1是对将生理盐水或肽给药14小时后的外周血进行培养而得到的集落数作图而成的图。曲线图中,“saline”表示对照组,“1r10”表示肽1r10给药组。集落数以换算成每从1只小鼠采集的外周血量(约800μL)而得到的值表示。横线的长线表示平均值,短线表示标准偏差。
图2是表示小鼠的体重变化的曲线图(平均±标准误差(SEM);*p<0.05(Student’s t test))。曲线图中,“saline”表示对照组,“1r10”表示肽1r10给药组。横轴表示葡聚糖硫酸钠(DSS)水溶液开始饮用后的天数。
图3是表示小鼠的粪便评分的曲线图(平均±标准误差(SEM))。曲线图中,“saline”表示对照组,“1r10”表示肽1r10给药组。横轴表示葡聚糖硫酸钠(DSS)水溶液开始饮用后的天数。
图4是表示小鼠的DAI评分的曲线图(平均±标准误差(SEM);*p<0.05(MannWhitney U test))。曲线图中,“saline”表示对照组,“1r10”表示肽1r10给药组。横轴表示葡聚糖硫酸钠(DSS)水溶液开始饮用后的天数。
图5是表示葡聚糖硫酸钠(DSS)水溶液饮用开始10天后的大肠长度的曲线图(平均±标准误差(SEM))。曲线图中,“saline”表示对照组,“1r10”表示肽1r10给药组。
图6是表示肽给药开始4天后的小鼠的耳廓部的照片。箭头表示容易看到落屑的耳廓边缘部。
图7是表示肽给药期间中的耳廓厚度的变化的曲线图(纵轴为将肽给药开始日设为100%时的相对值)。各点表示平均值和标准误差(*p<0.05;Repeated one way ANOVAtest;post hoc Tukey-Kramer test)。
图8是表示肽给药开始后第4天的耳廓部皮肤切片的H.E.染色图像的代表照片。照片内的箭头表示所测定的真皮厚度的例子。
图9是表示肽给药开始后第4天的各组的真皮厚度的曲线图(Box-Wh iskerplot)。中央的Box和Whisker分别表示中央值和四分位数以及最大值/最小值。Box内的Diamond表示平均值。(**p<0.01Mann Whitney U-test;每组小鼠7只×每只小鼠9个测定值。
图10是表示肽给药开始后第4天的耳廓部皮肤切片的多重荧光免疫染色图像的照片(Laminin(绿)-CD45(红)-DAPI(蓝))。Laminin用于标记组织内结构(血管、基底膜、神经),DAPI用于对各细胞的DNA进行复染(counterstain)。
图11是表示肽给药开始后第4天的耳廓部皮肤切片中的各组的高倍率视野(HPF:High power field(400×))每单位面积的CD45阳性细胞(C D45+immune cells)的数量的曲线图(Box-Whisker plot)。中央的Box和Whisker分别表示中央值和四分位数以及最大值/最小值。Box内的Diamon d表示平均值。x表示离群值(outlier)。(**p<0.01MannWhitney U-test;每组小鼠7只×每只小鼠9个测定值,其中,对照组及肽给药组中的任一个中,离群值都出现在全部7个体中的1个个体(约14%),因此对各组进行代入不具有离群值的其他6个个体的平均值的处理。
图12是表示右MCA封闭48小时后的脑梗塞灶体积率的曲线图(平均值±标准误差)。**p<0.01、Mann-Whitney的U检验。
具体实施方式
本发明者们目前为止发现了具有使生物体内的干细胞活化或经由末梢循环动员到损伤组织的作用的物质,认为该物质有望成为能够克服细胞治疗的弱点的新型的药物。具体而言,本发明者们发现,从坏死组织释放的High Mobility Group Box 1(高迁移率族蛋白,HMGB1)通过将在生物体内担负诱导组织再生的作用的platelet-derived growthfactor receptor a(血小板衍生生长因子受体a,PDGFRα)阳性细胞(考虑是间充质干细胞(Mesenchymal stem cell:MSC))经由末梢循环动员到坏死组织,可抑制坏死组织的炎症、促进组织再生。另外,本发明者们还发现,HMGB1的片段肽显示间充质干细胞的外周血动员活性及组织再生诱导活性。本次,本发明者们基于目前为止进行的独自的研究结果,设计了具有特定的氨基酸序列的人工序列肽,结果确认了该肽显示出将间充质干细胞动员到外周血中的活性。
另外,本发明者们还发现,上述人工序列肽对炎症性肠病显示治疗效果。具体而言,确认了人工序列肽在小鼠的炎症性肠病模型中改善作为疾病活动性评价的指标的DAI(disease activity index,疾病活动性指数)评分。
另外,本发明者们还发现,上述人工序列肽对特应性皮炎显示治疗效果。具体而言,确认了人工序列肽在小鼠的特应性皮炎模型中抑制落屑及水肿,抑制真皮厚度的增大,且抑制CD45阳性细胞的浸润。
另外,本发明者们还发现,上述人工序列肽对脑梗塞显示治疗效果。具体而言,确认了人工序列肽在大鼠的脑梗塞模型中使脑梗塞灶缩小。
本领域技术人员公知间充质干细胞发挥抗炎作用、免疫调节作用、抗纤维化作用。另外,间充质干细胞还具有能够分化为各种组织的多能性,因此发挥损伤组织的再生促进作用也是本领域技术人员所公知的。因此,考虑如果向对象给药具有将间充质干细胞动员到外周血中的活性的人工序列肽,则间充质干细胞被动员到外周血中,通过该间充质干细胞的抗炎作用、免疫调节作用、抗纤维化作用、组织再生促进作用(通过间充质干细胞的分化和/或炎症抑制作用进行),可对各种疾病发挥治疗效果。
在本申请中,“人工序列肽”是指具有天然不存在的氨基酸序列的肽。另外,在本申请中,也将“人工序列肽”简称为“人工肽”。
本申请提供一种用于将间充质干细胞动员到外周血的组合物,其含有特定的人工序列肽。
本申请的用于将间充质干细胞动员到外周血的组合物可以用作药物组合物或试剂组合物。在本申请中,“药物组合物”这一用语与“药物”、“药剂”或“药学组合物”互换使用,“试剂组合物”这一用语与“试剂”互换使用。
本申请的用于将间充质干细胞动员到外周血的组合物例如可用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态。
也可以利用本申请的用于将间充质干细胞动员到外周血的组合物,将被动员到外周血中的间充质干细胞回收到体外后,浓缩,用于治疗对象的疾病或病理状态。本申请还提供特定的人工序列肽在制造用于将间充质干细胞回收到体外的药物或试剂中的用途。
本申请的用于将间充质干细胞动员到外周血的组合物例如也可用于基础研究、临床研究等。作为基础研究和临床研究,例如可举出试管内的间充质干细胞的动员研究、实验动物中的间充质干细胞的动员研究等,但并不限定于这些。本申请还提供特定的人工序列肽在制造用于基础研究或临床研究的药物或试剂中的用途。
本申请的用于将间充质干细胞动员到外周血的组合物中可以包含1个或多个人工序列肽。
在本申请中,“间充质干细胞”是指从骨髓或其他组织(血液、例如脐带血及皮肤、脂肪、牙髓等)采集、能够作为附着在培养皿(塑料或玻璃制)上的附着细胞进行培养、增殖,且具有向骨、软骨、脂肪、肌肉等间充质组织分化的能力的细胞。在一个方式中,间充质干细胞还具有向上皮系组织、神经组织分化的能力。在一个方式中,间充质干细胞是具有集落形成能力的细胞。本申请的间充质干细胞不仅可以以狭义的干细胞(具有自我复制能力和分化能力的细胞)的形式存在,也可以以还包含前体细胞在内的不均匀的细胞集团的形式存在,在培养条件下,也可以包含狭义的干细胞、或在狭义的干细胞及前驱细胞基础上分化了的细胞。在一个方式中,间充质干细胞可以仅由狭义的干细胞构成。
在本申请中,前体细胞被定义为具有向除血液系统以外的特定组织细胞分化的单向分化能力的细胞,包括具有向间充质组织、上皮系组织、神经组织、实质脏器、血管内皮分化的能力的细胞。
在本申请中,作为间充质干细胞,也可举出骨髓间充质干细胞及骨髓来源间充质干细胞,但并不限定于此。“骨髓间充质干细胞”是指存在于骨髓内的细胞,其是能够从骨髓采集并作为附着在培养皿(塑料或玻璃制)上的附着细胞进行培养、增殖,且具有向骨、软骨、脂肪、肌肉等间充质组织分化的能力的特征的细胞。在一个方式中,骨髓间充质干细胞还具有向上皮系组织、神经组织分化的能力。在一个方式中,骨髓间充质干细胞是具有集落形成能力的细胞。在本申请中,“骨髓间充质干细胞”这一用语与“骨髓间充质系间质细胞”、“骨髓多能性干细胞”或“骨髓多能性间质细胞”互换使用。
另外,“骨髓来源间充质干细胞”是指被从骨髓动员到骨髓外的骨髓间充质干细胞,是能够通过外周血采血、甚至从脂肪等间充质组织、皮肤等上皮细胞、脑等神经组织的采集而获得的细胞。在本申请中,“骨髓来源间充质干细胞”这一用语与“骨髓来源间充质系间质细胞”、“骨髓来源多能性干细胞”或“骨髓来源多能性间质细胞”互换使用。
在一个方式中,骨髓间充质干细胞和骨髓来源间充质干细胞还具有如下特征:通过将采集后的细胞直接或暂且附着于培养皿的细胞向生物体的损伤部进行给药,还具有向例如构成皮肤的角质形成细胞等上皮系组织、构成脑的神经系统的组织分化的能力。
骨髓间充质干细胞及骨髓来源间充质干细胞优选具有除了向成骨细胞(可通过诱导分化和确认钙的沉积等来确定)、软骨细胞(可通过阿利新蓝染色阳性、番红-0染色阳性等来确定)、脂肪细胞(可通过苏丹III染色阳性等来确定)分化之外,还具有向例如成纤维细胞、平滑肌细胞、骨骼肌细胞、基质细胞、肌腱细胞等间充质细胞、神经细胞、色素细胞、表皮细胞、毛囊细胞(表达细胞角蛋白家族、头发角蛋白家族等)、上皮系细胞(例如表皮角化细胞、肠道上皮细胞表达细胞角蛋白家族等)、内皮细胞、甚至肝脏、肾脏、胰腺等实质脏器细胞分化的能力,但分化后的细胞并不限定于上述细胞。
作为人间充质干细胞的标记,可例示PDGFRα阳性、PDGFRβ阳性、Lin阴性、CD45阴性、CD44阳性、CD90阳性、CD29阳性、Flk-1阴性、CD105阳性、CD73阳性、CD90阳性、CD71阳性、Stro-1阳性、CD106阳性、CD166阳性、CD31阴性、CD271阳性、CD11b阴性中的全部或一部分,但并不限于这些。
作为小鼠间充质干细胞的标记,可例示CD44阳性、PDGFRα阳性、PDGFRβ阳性、CD45阴性、Lin阴性、Sca-1阳性、c-kit阴性、CD90阳性、CD105阳性、CD29阳性、Flk-1阴性、CD271阳性、CD11b阴性中的全部或一部分,但并不限于这些。
作为大鼠间充质干细胞的标记,可例示PDGFRα阳性、CD44阳性、CD54阳性、CD73阳性、CD90阳性、CD105阳性、CD29阳性、CD271阳性、CD31阴性、CD45阴性中的全部或一部分,但并不限于这些。
在本申请中,作为间充质干细胞,可例示PDGFRα阳性的间充质干细胞、PDGFRα阳性的骨髓来源间充质干细胞、PDGFRα阳性的骨髓来源细胞,其是通过骨髓采集(骨髓细胞采集)或外周血采血得到的血液中的单核细胞分级细胞培养,作为附着细胞而得到的细胞等,但并不限定于这些。作为PDGFRα阳性的间充质干细胞的例子,可举出PDGFRα及CD44阳性的细胞、PDGFRα及CD90阳性的细胞、PDGFRα及CD105阳性的细胞、PDGFRα及CD29阳性的细胞等。在一个方式中,PDGFRα阳性的间充质干细胞可以是CD44阴性的细胞。
本申请提供一种用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的组合物,其含有特定的人工序列肽。
本申请的用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的组合物可以用作药物组合物。
作为本申请中的对象,没有特别限制,可举出哺乳类、鸟类、鱼类等。作为哺乳类,可举出人或非人动物,例如可例示人、小鼠、大鼠、猴、猪、狗、兔、仓鼠、豚鼠、马、羊、鲸等,但并不限定于这些。在本申请中,“对象”这一用语与“患者”、“个体”或“动物”互换使用。
本申请的用于通过将间充质干细胞动员到外周血来治疗对象的疾病或病理状态的组合物中可以包含1个或多个人工序列肽。
在本申请中,疾病或病理状态的治疗例如选自炎症抑制治疗、免疫调节治疗、组织的再生诱导治疗及组织的纤维化抑制治疗,但并不限定于这些。
在本申请中,疾病或病理状态例如选自炎症性疾病、自身免疫疾病、伴随组织的损伤、缺血或坏死的疾病及纤维性疾病,但并不限定于这些。
在本申请中,作为炎症性疾病,例如可举出炎症性肠病及特应性皮炎,但并不限定于这些。作为自身免疫疾病,例如可举出炎症性肠病,但并不限定于此。作为纤维性疾病,例如可举出肺纤维化,但并不限定于此。作为伴随组织的损伤、缺血或坏死的疾病,例如可举出炎症性肠病及脑梗塞,但并不限定于这些。作为炎症性肠病,可举出溃疡性结肠炎和克隆氏病,但并不限定于这些。
在本申请中,“将间充质干细胞动员到外周血中的活性”这一用语与“使外周血中的间充质干细胞的存在量增加的活性”互换使用。
本申请的人工序列肽的将间充质干细胞动员到外周血中的活性可以通过如下进行评价:i)从给药了人工序列肽的个体、以及未给药人工序列肽的个体回收外周血,播种到培养皿(culture dish)中进行培养(数天~10天),对所形成的集落数进行计数;以及ii)确认所形成的集落具有对固相的附着性及增殖能力(自我复制能力),且具有向成骨细胞、软骨细胞及脂肪细胞分化的能力。在上述i)中,也可以在将所回收的外周血播种到培养皿中之前,通过所希望的方法将红细胞从该外周血中除去。
本申请的人工序列肽可以将编码其的DNA嵌入到适当的表达系统中而得到基因重组体(recombinant),或者也可以人工合成。因此,本申请的人工序列肽还包括使用细胞制造的肽、以及人工合成的肽(即所谓的synthetic peptide)。
为了通过基因工程的方法得到本申请中的人工序列肽,只要将编码该肽的DNA嵌入到适当的表达系统中使其表达即可。
作为可应用于本申请的宿主,可举出原核生物的细胞、真核生物的细胞,但并不限定于这些。另外,作为可应用于本申请的宿主,还可举出细菌(例如大肠杆菌)、酵母、动物细胞(例如HEK293细胞、CHO细胞等哺乳动物细胞、家蚕细胞等昆虫细胞)、植物细胞等,但并不限定于这些。
作为可应用于本申请的宿主/载体系统,例如可示出表达载体pGEX和大肠杆菌。pGEX可以将外源基因以与谷胱甘肽S-转移酶(GST)的融合蛋白的形式表达(Gene,67:31-40,1988),因此将嵌入有编码本申请的人工序列肽的DNA的pGEX通过热休克导入到BL21那样的大肠杆菌株中,在适当的培养时间后添加异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG)来诱导GST融合肽的表达。本申请的GST吸附于谷胱甘肽琼脂糖4B,因此表达产物能够通过亲和色谱法容易地分离、纯化。
作为用于得到本申请的人工序列肽的基因重组体的宿主/载体系统,除此之外还可以应用如下的载体。首先,在将细菌用于宿主的情况下,市售有利用了标签等的融合蛋白的表达用载体。另外,本申请的基因重组体还包含附加有标签或其一部分肽的状态的基因重组体。
作为本申请的人工序列肽所附加的标签,只要不影响本申请的人工序列肽的活性,就没有特别限制,例如可举出组氨酸标签(例如6×His、10×His)、HA标签、FLAG标签、GST标签、T7-标签、HSV-标签、E-标签、lck标签、B-标签等。
已知酵母中,Pichia属酵母对具有糖链的蛋白的表达是有效的。在糖链的附加这点上,利用了以昆虫细胞为宿主的杆状病毒载体的表达系统也是有用的(Bio/Technology,6:47-55,1988)。此外,利用哺乳动物的细胞进行利用了CMV、RSV或SV40等启动子的载体的转染,这些宿主/载体系统均可用作本申请的人工序列肽的表达系统。另外,还可以利用质粒载体、逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体、仙台病毒载体、仙台病毒包膜载体、乳头瘤病毒载体等病毒载体导入基因,但并不限定于这些。该载体中也可以包含有效地诱导基因表达的启动子DNA序列、控制基因表达的因子、维持DNA的稳定性所需要的分子。
所得到的本申请的人工序列肽可以从宿主细胞内或细胞外(培养基等)分离,以实质上纯粹且均匀的蛋白形式进行纯化。肽的分离、纯化只要使用通常的肽的纯化中使用的分离、纯化方法即可,没有任何限定。例如,可以适当选择、组合色谱柱、过滤器、超滤、盐析、溶剂沉淀、溶剂提取、蒸馏、免疫沉降、SDS-聚丙烯酰胺凝胶电泳、等电点电泳法、透析、重结晶等来将肽分离、纯化。
作为色谱法,例如可举出亲和色谱法、离子交换色谱法、疏水性色谱法、凝胶过滤、反相色谱法、吸附色谱法等(Marshak et al.,Strategies for Protein Purificationand Characterization:A Laboratory Course Manual.Ed Daniel R.Cold SpringHarbor Laboratory Press,1996)。这些色谱法中,可以使用液相色谱法、例如HPLC、FPLC等液相色谱法来进行。
另外,本申请的人工序列肽优选为实质上纯化的肽。在此,“实质上纯化”是指本申请的人工序列肽的纯化度(本申请的人工序列肽在蛋白成分整体中的比例)为50%以上、60%以上、70%以上、80%以上、90%以上、95%以上、100%或接近100%。接近100%的上限依赖于本领域技术人员的纯化技术、分析技术,例如为99.999%、99.99%、99.9%、99%等。
另外,只要具有上述的纯化度,则通过任何纯化方法纯化者均包括在实质上纯化的人工序列肽中。例如,可例示通过适当选择或组合上述色谱柱、过滤器、超滤、盐析、溶剂沉淀、溶剂提取、蒸馏、免疫沉降、SDS-聚丙烯酰胺凝胶电泳、等电点电泳法、透析、重结晶等而得到的实质上纯化的人工序列肽,但并不限定于这些。
另一方面,还可以人工合成本申请的人工序列肽。就本申请的肽合成法而言,可以通过肽液相合成法和肽固相合成法等方法来化学合成肽。肽固相合成法是在化学合成肽时通常使用的方法之一。将表面用氨基修饰了的直径为0.1mm左右的聚苯乙烯高分子凝胶的珠粒等用作固相,通过脱水反应由此每次1个地延长氨基酸链。当完成目标肽的序列后,从固相表面上切出,得到目标物质。通过固相合成法,还能够进行难以在细菌中合成的核糖体肽的合成、或D体、稳定同位素(
作为本申请的人工序列肽的氨基酸长度,例如可举出25~35个氨基酸、20~40个氨基酸、10~50个氨基酸、10~70个氨基酸、10~100个氨基酸等的范围,但并不限定于这些。
在本申请中,作为人工序列肽,例如可举出选自以下中的肽:
(i)包括序列号1的氨基酸序列的人工序列肽;
(ii)由序列号1的氨基酸序列构成的人工序列肽;
(iii)由序列号1的氨基酸序列的一部分构成的人工序列肽;
(iv)包含在序列号1的氨基酸序列中替换、缺失、插入或添加1个或数个氨基酸而成的氨基酸序列的人工序列肽;
(v)由在序列号1的氨基酸序列中替换、缺失、插入或添加1个或数个氨基酸而成的氨基酸序列构成的人工序列肽;
(vi)包含与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列的人工序列肽;
(vii)由与序列号1的氨基酸序列具有约90%以上的序列同源性的氨基酸序列构成的人工序列肽;
(viii)由序列号2的碱基序列构成的DNA编码的人工序列肽;以及(ix)由在严格条件下与由序列号2的碱基序列构成的DNA杂交的DNA编码的人工序列肽。
在本申请中,作为“数个”,例如可举出1个~5个、1个~4个、1个~3个、或者1个或2个。
在本申请中,作为“约90%以上”,例如可举出约90%以上、约91%以上、约92%以上、约93%以上、约94%以上、约95%以上、约96%以上、约97%以上、约98%以上或约99%以上。
在本申请中,“严格条件”可以表示例如6×SSC、40%甲酰胺、25℃下的杂交、和1×SSC、55℃下的清洗这样的条件。严格虽然受盐浓度、甲酰胺的浓度、或者温度这样的条件的左右,但只要是本领域技术人员,就能够设定这些条件以得到所需要的严格。
如果在严格条件下实施杂交,则选择同源性高的DNA作为碱基序列,作为其结果,在所分离的肽中包含与由序列号1的氨基酸序列构成的肽在功能上等同的肽的可能性提高。同源性高的碱基序列可以显示例如约60%以上、约70%以上、或约80%以上的同源性。在此,“功能上等同”是指与将间充质干细胞动员到外周血中的活性有关的功能上的等同。
选自上述(i)~(ix)中的人工序列肽是具有将间充质干细胞动员到外周血中的活性的人工序列肽。因此,考虑这些人工序列肽具有将间充质干细胞动员到外周血中的效果、以及炎症性疾病、自免疫疾病、伴随组织的损伤、缺血或坏死的疾病、以及纤维化疾病的治疗效果。
本申请还提供选自上述(i)~(ix)中的人工序列肽。
序列号1中记载的氨基酸序列是本申请的人工序列肽1r10的氨基酸序列。
序列号2中记载的碱基序列是编码本申请的人工序列肽1r10的DNA的碱基序列的一个例子。编码本申请的人工序列肽1r10的其他DNA序列可以使用本领域技术人员公知的密码子表,通过将人工序列肽1r10的氨基酸残基转换为对应的密码子的方法(逆向翻译)来制作。逆向翻译可以根据期望利用用于分析氨基酸和核酸序列而开发的各种软件(包括程序、算法等)来进行。
为了治疗本说明书中记载的疾病或症状,向对象给药本申请的人工序列肽或含有其的药物组合物(以下称为药物组合物等)的有效量。
本申请中的有效量是指对本说明书中记载的疾病或病理状态的治疗而言充分的量。本申请中的治疗包括减轻、延缓、阻止、改善、缓解、治愈、完全恢复等,但并不限定于这些。
本申请的药物组合物等的给药部位没有限制,向出现疾病或病理状态的症状的部位或其附近、与这些不同的部位(除这些以外的部位)、与出现疾病或病理状态的症状的部位分离的部位、位于距出现疾病或病理状态的症状的部位为远位的部位、或相对于出现疾病或病理状态的症状的部位而言为远位且为异位的部位等任何部位给药,本申请的药物组合物等均能够发挥其效果。
另外,本申请的药物组合物等向与出现疾病或病理状态的症状的组织不同的组织、与出现疾病或病理状态的症状的组织分离的组织、位于距出现疾病或病理状态的症状的组织为远位的组织、或相对于出现疾病或病理状态的症状的组织而言为远位且为异位的组织等任何组织给药,均能够发挥其效果。
作为本申请的药物组合物等的给药方法,可举出经口给药或非经口给药,作为非经口给药方法,可举出血管内给药(动脉内给药、静脉内给药等)、肌肉内给药、皮下给药、皮内给药、腹腔内给药、经鼻给药、经肺给药、经皮给药等,但并不限定于这些。另外,可以通过注射给药、例如静脉内注射、肌肉内注射、腹腔内注射、皮下注射等将本申请的药物组合物等向全身或局部(例如皮下、皮内、皮肤表面、眼球或眼睑结膜、鼻腔粘膜、口腔内和消化道粘膜、阴道-子宫内粘膜、或损伤部位等)给药。
另外,也可以代替本申请的人工序列肽,使用分泌该人工序列肽的细胞、插入有编码该人工序列肽的DNA的基因治疗用载体、以及含有它们的药物组合物。
另外,可以根据患者的年龄、症状而适当地选择给药方法。在给药本申请的药物组合物等的情况下,例如,对于一次给药,可以在每1kg体重为0.0000001mg~1000mg的范围内选择给药量。或者,例如,可以在每位患者0.00001~100000mg/body的范围内选择给药量。在给药分泌本申请的人工序列肽的细胞、插入有编码该人工序列肽的DNA的基因治疗用载体的情况下,也可以按照该人工序列肽的量在上述范围内的方式进行给药。然而,本申请中的药物组合物并不限定于这些给药量。
本申请的药物组合物可以按照常规方法制成制剂(例如Remington'sPharmaceutical Science,latest edition,Mark Publishing Company,Easton,U.S.A),可以同时含有药学上可接受的载体或添加物。例如可举出表面活性剂、赋形剂、着色料、着香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等渗剂、粘合剂、崩解剂、润滑剂、流动性促进剂、矫味剂等,但并不限定于这些,还可以适当使用其他常用的载体。具体而言,可举出轻质硅酸酐、乳糖、结晶纤维素、甘露醇、淀粉、羧甲基纤维素钙、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯醇缩醛二乙基氨基乙酸酯、聚乙烯基吡咯烷酮、明胶、中链脂肪酸甘油三酯、聚氧乙烯氢化蓖麻油60、白糖、羧甲基纤维素、玉米淀粉、无机盐类等。
需要说明的是,本说明书中引用的所有的现有技术文献作为参照纳入本说明书中。
本发明通过下述的实施例进一步进行例示,但并不限定于这些。
(1)材料和方法
i)肽的制造
化学合成由序列号1的氨基酸序列构成的人工序列肽(得到的肽是三氟乙酸(TFA)盐的形态)。以下,将该肽称为“人工序列肽1r10”或“肽1r10”。
ii)肽的给药
准备C57BL/6J小鼠(8周龄、雄性、体重为25g),分为给药人工序列肽1r10的组和对照组。肽的给药通过将以生理盐水为溶剂调整为1μg/μL的浓度的肽1r10的溶液以100μL/只的量(以肽的给药量计为4mg/kg)注入到尾静脉中进行。对照组将生理盐水以100μL/只的量注入到尾静脉。
iii)从外周血的细胞回收
从生理盐水或人工序列肽1r10的给药起14小时后,在全身麻醉下从心脏采集约800-1000μL的外周血(使用含有肝素的1mL注射器)。为了除去红细胞,加入与所采集的血液等量的Hetasep(STEMCELL Technologies公司、Cat No.ST-07906),在100G下离心2分钟,在室温下孵育15分钟,然后将上清液回收。将该上清液作为包含外周血中的有核细胞的样品供于以下的实验。
iv)集落分析
将通过上述步骤得到的上清液(含外周血来源细胞的样品)播种于经胶原I涂布的6孔板(Corning公司、Cat No.356400),利用MesenCult Expansion Kit(STEMCELLTechnologies公司、Cat No.ST-05513),使用按照该试剂盒的手册制备的在ExpansionMedium中含有1%L-glutamine(Nacalai Tesque公司)、10μM ROCK inhibitor(Y27632、Tocris Bioscience公司)和1%青霉素/链霉素(Nacalai Tesque公司)的培养基(数值均为终浓度),在37℃、5%CO
本发明者们在到目前为止进行的实验中,将外周血在平皿或平板等固相上培养,结果得到的集落全部具有对固相的附着性和自我复制能力,除此以外,能够确认为PDGFRα阳性且具有向骨、软骨、脂肪、上皮等分化的能力。
另外,将由具有将间充质干细胞动员到外周血中的活性的人HMGB1蛋白的氨基酸残基1-44构成的肽(以下称为HMGB1肽1-44)给药后的外周血在固相上培养,结果能够确认得到的集落也全部具有对固相的附着性和自我复制能力且为PDGFRα阳性,并且对转录组分析的数据进行聚类,进行gene ontology分析,由其结果能够确认具有间充质干细胞特征性的基因表达谱。
此外,也确认到与生理盐水给药后的外周血相比,给药HMGB1肽1-44后的外周血的通过固相培养得到的集落数更多。
因此,认为将外周血在固相上培养,结果得到的集落为间充质干细胞,在外周血的固相培养中检测出的集落数的增加表示外周血中的间充质干细胞数的增加。
另外,通常间充质干细胞几乎不存在于外周血中,因此认为增加部分的间充质干细胞是被从外周血以外的组织(例如骨髓)动员到外周血中的细胞。
根据以上情况,在受试物质给药后的外周血的固相培养中检测出的集落数可以用作该受试物质的将间充质干细胞动员到外周血中的活性的指标。
(2)结果
给药了人工序列肽1r10的小鼠与给药了生理盐水的小鼠相比,通过外周血来源细胞的培养,在平板上得到的集落数更多(图1)。
如上所述,本说明书中记载的通过集落分析检测出的集落数的增加表示外周血中的间充质干细胞数的增加,因此这些结果证实了肽1r10具有将间充质干细胞动员到外周血中的活性。
(1)材料和方法
i)药剂
将葡聚糖硫酸钠(DSS)(分子量为36,000至50,000,MP Biomedicals公司制,产品编号为160110)溶解于纯化水中,制备2.5%(w/v)的DSS水溶液。另外,将实施例1中记载的肽1r10(TFA盐)用作受试物质。
ii)炎症性肠病(IBD)模型小鼠的制作
使BALB/c小鼠(9周龄、雄性)自由饮用2.5%DSS水溶液7天,诱发结肠炎。之后,从DSS变更为饮用自来水,3天后(DSS水溶液饮用开始10天后)进行结肠采集。
iii)肽的给药
将如上所述制成的IBD模型小鼠分成肽1r10给药组(n=8)和对照组(n=8)。肽的给药如下进行:在DSS水溶液饮用开始后第1、4、7、8和9天,将以生理盐水为溶剂调整为0.5mg/mL的浓度的肽1r10溶液以10mL/kg的量(以肽的给药量计为5mg/kg)注入到尾静脉。对照组在DSS水溶液饮用开始后第1、4、7、8和9天,以10mL/kg的量将生理盐水注入到尾静脉。
iv)肽的给药效果的评价
从DSS水溶液饮用开始起的10天、除去星期六、星期日、节日,每天进行小鼠的体重测定和症状(粪便的状态、以及出血)的观察,算出DAI(disease activity index,疾病活动指数)评分来评价症状的程度。DAI评分如下述表所示对体重减少率、粪便的状态以及粪便出血进行评分,并对这3个项目的评分进行合计来算出。评分的基准将Li等的方法(PLoSOne.2015Dec 7;10(12):e0144101)作为一部分参考。
表1
DAI(疾病活动指数)的评分
另外,使用数字游标卡尺测定在DSS的饮用开始10天后采集的大肠(从结肠到直肠)的长度。
(2)结果
将试验期间中的小鼠的体重变化示于图2(对照组参见“saline”、肽给药组参见“1r10”)。对照组及肽给药组均在DSS饮用开始后经时地体重减少,但其减少程度与对照组相比,肽给药组更缓慢,在DSS水溶液饮用开始10天后,肽给药组的体重显示恢复倾向。
将DSS水溶液饮用开始8~10天后的粪便评分(如上述表1记载地进行了评分的“粪便的状态”评分和“出血”的评分的合计)和DAI评分分别示于图3和4(对照组参见“saline”、肽给药组参见“1r10”)。粪便评分及DAI评分均显示与对照组相比,肽给药群为更低的值。
在DSS水溶液饮用开始10天后,肽给药组的大肠长度比对照组长(参见图5;对照组参见“saline”、肽给药组参见“1r10”)。
在IBD中,在肠道的粘膜中发生炎症,除了形成糜烂或溃疡以外,还会产生肠道的狭小、缩短等症状。另外,作为IBD的其他症状,已知发生体重的减少,认为其原因在于在肠道的粘膜中发生的炎症、组织损伤(溃疡等)所致的营养状态的恶化。另外,已知当向动物的IBD模型静注间充质干细胞时,包括体重减少以及肠道中的上皮的损伤以及炎症细胞的浸润等在内的各种症状得到改善。该症状的改善是由于间充质干细胞的抗炎作用,肠道粘膜的炎症得到抑制,以及作为其结果粘膜组织的再生得到促进等而带来的。
此次,通过向IBD模型小鼠给药本申请的人工序列肽,体重的减少得到抑制,大肠长度的缩短得到抑制,DAI评分得到改善。认为这是由于本申请的人工序列肽的作用,间充质干细胞被动员到外周血,由该细胞发挥炎症抑制效果和组织再生效果的结果。
(1)材料和方法
i)药剂
为了诱导小鼠发生特应性皮炎(Atopic Dermatitis;以下也称为“AD”),使用MC903(通用名:Calcipotriol)。另外,将实施例1中记载的肽1r10(TFA盐)用作受试物质。
ii)特应性皮炎模型小鼠的制作
从日本Claire株式会社购入C57BL/6小鼠(C57BL/6JJcl、7-8周龄、雄性、微生物等级SPF),在动物饲养室内驯化5天以上后,供于以下的实验。在该小鼠的耳廓部皮肤上,在2周内以2.25nmol MC903/耳/1次/1天的量涂布(合计涂布10次)用乙醇制备过的MC903溶液,诱导特应性皮炎(AD)。该MC903诱导性的AD模型是通过人工诱导在AD患者实际可见的由上皮细胞分泌TSLP而引起一系列的2型免疫反应级联,能够在短期内(1-2周)再现AD样病理状态的模型(Li M et al.,Proc Natl Acad Sci U S A.2006;103:11736-41.)。另外,作为预备试验,观察正常小鼠和利用MC903制作的AD诱导小鼠(诱导开始14天后)的耳廓部的外观和组织,结果也能够确认:在AD诱导小鼠中产生由炎症引起的红斑、边缘区域处的落屑、角质的苔藓化、表皮的Acanthosis(由棘细胞增殖引起的表皮肥厚)、局部的阻隔的破坏、免疫细胞向真皮的浸润、真皮厚度的增大、以及表皮的一部分中的Spongiosis(海绵状变化)。
iii)肽的给药
从MC903涂布开始(记为Day1)到2周后(Day 15),根据落屑(Scaling)、红斑(Erythema)、水肿(Edema)的主症状进行判断,仅筛选出明显被诱导了AD的个体,然后考虑个体间的炎症的重症度的差异,基于耳廓厚度在组间进行平均化处置,分成对照组及肽给药组(各组n=7)。肽的给药如下进行:在分组日(Day 15)1次和其后的4天(从Day 16到Day19)之间1次合计2次、将使用生理盐水调整为0.3mg/mL的肽1r10的溶液以5mL/kg的容量(以肽的给药量计为1.5mg/kg)注入到尾静脉。对于对照组,在分组日(Day 15)1次和在其后的4天(从Day 16到Day 19)之间1次合计2次,将使用生理盐水调整为0.3mg/mL的牛血清白蛋白(BSA)的溶液以5mL/kg的容量(以BSA的给药量计为1.5mg/kg)注入到尾静脉。
iv)肽的给药效果的评价
水肿及落屑的评价
肽给药期间中(Day 15~Day 19)为了水肿(Edema)的判定每天实施耳廓厚度(EarSwellings)的测定,对于作为AD的主特征的落屑(Scaling),使用数码照相机(E-M1 II;Olympus公司)从距耳廓部13-14cm的高度的固定台进行照片拍摄(1周3次)进行判定。
病理分析
在肽给药开始后第4天(Day 19),将小鼠置于异氟烷麻醉影响下,进行颈椎脱臼使其安乐死,在冰上防止样品的蛋白变性,立即切取耳廓的炎症部位及其周边区域的皮肤并回收。所采集的耳廓部皮肤用镊子除去多余的毛发、皮肤后,浸渍于10%Formalin,使用shaker在冰上使其振荡,同时在4℃下固定一晚。将固定后的皮肤用磷酸缓冲盐水(PBS)充分洗涤、修整后,注意皮肤固有的背腹轴/左右轴的组织的极性,同时用自动包埋器(Excelsior ES;Thermo Scientific公司)制成石蜡块。然后,用旋转式切片机(HM325;Thermo Sceintific公司)薄切(5μm厚)后,固定在载玻片上,供于各种染色。作为病理学分析,通过组织化学染色和荧光免疫染色法分别对皮肤厚度和免疫细胞的浸润进行评价。
真皮厚度的测定
为了对炎症部位的治愈状态进行定量评价,对如上所述制成的皮肤组织的石蜡薄切(5μm厚)进行苏木精-伊红(H.E.)染色,测定真皮厚度。其详细内容如下:对每1个个体准备3片切片,对各切片1个个部位地用显微镜(Keyence BZ-X710)对炎症中心部位(center)、头侧(Head)以及尾侧(Tail)进行拍摄(即对每1个个体拍摄9个部位)。接着,对所拍摄的图像,从表皮真皮接合部(Epidermis-Dermis junction)画到皮下脂肪-软骨接合部(Subcutaneous Fat-Cartilage junction)的垂线,仅选择视野中最长的垂线用作真皮厚度的测定值。
免疫细胞的定量
为了对炎症部位的免疫细胞数进行定量评价,对于如上所述制成的石蜡薄切(5μm厚),使用抗Laminin抗体和抗CD45抗体进行荧光免疫染色(在Laminin的检测中,作为1次抗体,使用Anti-Laminin(Sigma Aldrich公司;目录号为L9393);作为2次抗体,使用Donkeyanti-Rabbit IgG(H+L)、Alexa Fluor 488(Thermo Fisher Scientific公司;目录号为A-21206)。在CD45的检测中,作为1次抗体,使用Goat Anti-mouse CD45(R&D Systems公司;目录号为AF114);作为2次抗体,使用Cy3 AffiniPure Bovine Anti-Goat IgG(H+L)(JacksonImmunoReseach公司;目录号为805-165-180))。作为定量的详细情况,对每1个个体准备3片切片,对各切片中的炎症中心部位(center)、头侧(Head)以及尾侧(Tail),1个个部位地用显微镜(Keyence BZ-X710)拍摄高倍率视野(HPF:400×)(即对1个个体拍摄9个部位)。接着,对于所拍摄的图像,对视野中的CD45阳性细胞(用Cy3的荧光进行检测)进行计数,用作测定值。
统计处理
对于通过上述分析得到的测定值或修正后的计算值,使用统计分析软件(statcel-3(OMS出版)和Excel统计(BellCurve))计算各统计值后进行分析/判定,具体而言,作为事先检验,进行(1)正态性的检验(使用偏度/峰度系数的D’Agostino检验;P>0.05视为正态分布);(2)舍弃检验(Grubbs检验;P<0.05时视为离群值(outlier));在(1)中得到的结果显示正态分布时,在组间进行t-test;在不显示正态分布时,作为基于组间的位次的非参数检验,进行Mann-Whitney U-test,p<0.05时判定为有统计学显著性差异;另外,对于以时间序列的反复测定为主的体重变化和耳廓厚变化,实施Repeated one way ANOVAtest,进而作为post hoc test,进行Tukey-Kramer test;关于离群值的处理,采用了如下方法:(a)在Grubbs检验中,P<0.05的组内的个体数相对于该组的总个体数(n数)为10%以下时,将该离群值作为缺损值进行处理;(b)在P<0.05的个体数相对于n数超过10%时,将不具有离群值的其他个体的平均值补充地代入(imputation)(所谓的Meansubstitution)。
(2)结果
落屑
在AD模型诱导后的对照组小鼠的耳廓部中,在边缘部高频率地发生典型的AD图像即由湿疹和干燥引起的剥离表皮所形成的落屑(图6,左照片的箭头部分)。另一方面,在肽给药组中,可见耳廓部的落屑减轻(图6,右照片的箭头部分)。
耳廓厚度(水肿)
将肽给药期间中的耳廓厚度(水肿)的变化示于图7(对照组参见“Control”、肽给药组参见“1r10”)。肽给药组与对照组相比,可见统计学上显著的耳廓厚度的减少。
真皮厚度
对皮肤组织切片进行H.E.染色,结果在对照组中观察到在AD非诱导小鼠中未见的真皮厚度的增大(考虑是由AD引起的伴随着免疫反应的细胞浸润和血管透过性的亢进)(参见图8;对照组参见“Control”、肽给药组参见“1r10”)。另一方面,肽给药组与对照组相比,可见统计学上显著的真皮厚度的减少(参见图9;对照组参见“Control”、肽给药组参见“1r10”)。另外,即使在以0.5mg/kg的用量给药肽1r10的情况下,与对照组相比也可见统计学上显著的真皮厚度的减少(未示出数据)。
免疫细胞的浸润
对皮肤组织切片进行荧光免疫染色,结果在对照组中在以血管周围(用Laminin标记)为代表的皮肤整体上观察到由AD引起的伴随免疫反应的CD45阳性免疫细胞的组织内浸润(参见图10的箭头部分;对照组参见“Control”、肽给药组参见“1r10”)。另一方面,肽给药组与对照组相比,可见统计学上显著的CD45阳性细胞数的减少(参见图11;对照组参见“Control”、肽给药组参见“1r10”)。
需要说明的是,本试验的实施期间(给药开始(Day 15)~皮肤回收时(Day 19))中的小鼠的体重变化在任意的组中都没有明显的差异,在组间未见统计学上显著的变化(p>0.05,Repeated one-way ANOVA)。
在本实施例中,通过向特应性皮炎模型小鼠给药本申请的人工序列肽,落屑及水肿得到抑制,真皮厚度的增大得到抑制,且CD45阳性细胞的浸润得到抑制。认为这是由于本申请的人工序列肽的作用,间充质干细胞被动员到外周血,由该细胞发挥炎症抑制效果的结果。
(1)材料和方法
i)药剂
将实施例1中记载的肽1r10(TFA盐)用作受试物质。
ii)脑梗塞模型大鼠的制作
从日本Charles River获得Crl:CD(SD)大鼠(7周龄、雄性),在6天的驯化后,分为对照组(n=8)和肽给药组(n=8)。分组第二天,将大鼠在2%异氟烷吸入麻醉下(麻醉背景为笑气:氧=7:3)固定在仰卧位。为了进行手术中的体温调节,将与数字温度计连接的体温计用探针插入直肠内,监测手术前后的直肠温度的变化。其结果,未见任何大鼠直肠温度的降低,因此未实施加温。使右总颈动脉、右外颈动脉以及右内颈动脉露出,用缝合线将右总颈动脉及右外颈动脉结扎。将预先用硅涂布并切断为19mm的长度的4号尼龙线(塞子)从右外颈动脉和右内颈动脉的分支部插入,将右中大脑动脉(MCA)闭塞。右MCA闭塞后,进行颈部皮肤的缝合,从麻醉中释放。在右MCA闭塞后30分钟确认闭塞侧的对侧前肢的弯曲。2%异氟烷吸入麻醉下,再次使右总颈动脉、右外颈动脉以及右内颈动脉露出,在右MCA闭塞后90分钟拔出塞子,使右MCA的血流重新打开。在右MCA的血流重新打开后,进行右内颈动脉的结扎和颈部皮肤的缝合,从麻醉中释放。其中,在右MCA闭塞手术前,以20000units/kg的用量肌肉内给药苄青霉素钾。
iii)肽的给药
肽的给药如下进行:在右MCA闭塞后105分钟及24小时的时间点,将以生理盐水为溶剂调整为1mg/mL的浓度的肽1r10的溶液以2mL/kg的容量(以肽的给药量计为2mg/kg)注入到尾静脉。对于对照组,在右MCA闭塞后105分钟及24小时的时间点,以2mL/kg的容量将生理盐水注入到尾静脉。
iv)肽的给药效果的评价
脑梗塞灶体积率的计算
在右MCA闭塞后48小时,在利用戊巴比妥钠(50mg/kg,腹腔内给药)的麻醉下将动物断头,摘出全脑,制作厚度为2mm的脑切片。脑切片是以Paxinos and Watson脑图谱(Paxinos G.and Watson C.,The rat brain in stereotaxic coordinates,secondedition.Academic Press Inc.;1986)为参考,选择获得Bregma前方4mm、Bregma前方2mm、Bregma上、Bregma后方2mm、Bregma后方4mm及Bregma后方6mm的冠状面的位置。将脑切片在室温下浸渍于1w/v%的2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetr azoliumchloride,TTC)溶液中并染色,进行照片拍摄。对得到的照片进行图像分析,用实测值求出脑梗塞灶面积及脑的截面积,通过下述计算式算出Bregma前方4mm~Bregma后方6mm的脑梗塞灶体积及脑的总体积。另外,由脑梗塞灶体积及脑的总体积算出脑梗塞灶体积率(脑梗塞灶体积率(%)=脑梗塞灶体积/脑部的总体积×100)。
V:脑梗塞灶体积或脑的总体积(mm
a:Bregma前方4mm截面上的脑梗塞灶面积或脑的截面积(mm
b:Bregma前方2mm截面上的脑梗塞灶面积或脑的截面积(mm
c:Bregma截面上的脑梗塞灶面积或脑的截面积(mm
d:Bregma后方2mm截面上的脑梗塞灶面积或脑的截面积(mm
e:Bregma后方4mm截面上的脑梗塞灶面积或脑的截面积(mm
f:Bregma后方6mm截面上的脑梗塞灶面积或脑的截面积(mm
(2)结果
对照组和肽给药组的脑梗塞灶体积率分别为34.1±1.1%和27.2±1.2%(平均值±标准误差)(参见图12;对照组参见“Control”、肽给药组参见“1r10”)。与对照组相比,肽给药组的脑梗塞灶体积率显示出低值,可见有统计学上显著性差异(Mann-Whitney的U检验,p<0.01)。
在本实施例中,通过向脑梗塞模型大鼠给药本申请的人工序列肽,可得到缩小脑梗塞灶的效果。认为这是由于本申请的人工序列肽的作用,间充质干细胞被动员到外周血中,由该细胞发挥炎症抑制效果、trophic效果(营养因子的分泌)、组织再生效果等的结果。
产业上的可利用性
本申请的人工序列肽可以用作炎症性疾病、自身免疫疾病、纤维性疾病、以及伴有组织的损伤/缺血/坏死的疾病的治疗药物。
序 列 表
<110> 斯特姆里姆有限公司
国立大学法人大阪大学
<120> 具有间充质干细胞的动员活性的肽
<130> G6-A1805P
<150> JP 2018-190090
<151> 2018-10-05
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> 人工合成的肽序列
<400> 1
Ile Met Trp Leu Cys Gln Tyr Phe Phe Gln Cys His Lys Cys Ala Val
1 5 10 15
Lys Lys Lys Thr Trp Lys Glu Lys Lys Asp Arg Arg His Pro
20 25 30
<210> 2
<211> 90
<212> DNA
<213> 人工序列
<220>
<223> 人工合成的核苷酸序列
<400> 2
atcatgtggc tgtgccagta cttcttccag tgccacaagt gcgccgtgaa gaagaagacc 60
tggaaggaga agaaggacag gaggcacccc 90
- 具有间充质干细胞的动员活性的肽
- 脐带间充质干细胞活性肽分泌物、制备方法、应用及皮肤微生态调节剂
