粘膜粘附脂质递送系统
文献发布时间:2023-06-19 12:14:58
技术领域
本发明总体上涉及用于增强对抗原的免疫应答的组合物。具体地,本发明涉及使用粘膜粘附阳离子脂质载体递送的组合佐剂组合物,用作疫苗佐剂来刺激粘膜免疫。
背景技术
杀死的疫苗或亚单位疫苗通常免疫原性较差,并且可能导致弱和短暂的T细胞应答,因此需要佐剂来增强免疫应答。因此,佐剂是许多疫苗的关键组分。它们用于改善疫苗的免疫原性,目的是赋予长期保护,增强疫苗在新生儿、老年人或免疫功能低下者中的功效,并且减少抗原的量或引起有效免疫所需的剂量。
然而,许多目前可获得的疫苗包括佐剂,这些佐剂在诱导免疫反应的质量和程度上都不理想。例如,明矾是美国少数批准用于人体的佐剂之一,诱导良好的Th2型免疫应答,但不是用于Th1型免疫应答的有效佐剂(HogenEsch et al.,Vaccine(2002)20Suppl 3:S34-39)。因此,需要另外的有效且更安全的佐剂。
现在广泛认识到,尤其是对于呼吸道疾病,诱导局部和全身免疫两者可以显著提高保护水平。粘膜给药(诸如,鼻内递送)的优点在于能诱导局部和全身免疫,而肌内免疫仅诱导全身免疫。事实上,现在在人类和动物两者中通过粘膜给药越来越多的疫苗被。为了使鼻内疫苗有效,必须将疫苗以粘附于鼻粘膜并且可以渗透到粘膜本身的载体中递送,并且此外,要使佐剂的免疫刺激作用最大化。
最近,开发了一种包含三种组分的组合佐剂平台:(1)免疫刺激分子,诸如,CpG或聚(I:C)(聚肌苷酸-聚胞苷酸);(2)聚磷腈,诸如,聚[二(羧酰苯氧基钠)磷腈](PCPP)或聚(二-4-氧基苯基丙酸酯)磷腈(PCEP)(作为钠盐或呈酸性形式);以及(3)能够杀死广谱微生物的抗微生物分子,称为“宿主防御肽”。例如,参见美国专利第9,408,908和9,061,001号,通过引用以其全文结合在此。三重佐剂形成稳定的复合物,并且已证实在肌内或皮下给药后,在广泛的人类和动物疫苗中被证明是高度有效的。参见,例如,Garg等,J.Gen.Virol.(2014)95:301-306。当与各种疫苗抗原一起使用时,这种三重佐剂组合物诱导有效的长期体液和细胞免疫。此外,佐剂平台适合于母体免疫,并且甚至在母体抗体的存在下,在新生儿中也是高度有效的。然而,通过鼻途径最大化粘膜免疫的功效仍然需要增强。
尽管佐剂技术取得了各种进展,但是仍然需要安全和有效的方法来预防感染性疾病。因此,非常需要用于粘膜免疫的新的佐剂递送方法的广泛可用性。
发明内容
本发明部分地基于以下发现:组合佐剂的使用,包括用粘膜粘附阳离子脂质载体配制的宿主防御肽、聚阴离子聚合物(诸如,聚磷腈)、具有免疫刺激特性(ISS)的核酸序列(诸如,聚(I:C)),当肌内或粘膜递送时,与未观察到的那些组分相比,对共同给药抗原提供了显著更高的抗体滴度。佐剂组合物提供了一种安全且有效的方法,该方法用于增强用于预防性和治疗性组合物两者的多种疫苗抗原的免疫原性。
因此,在一个实施方式中,提供了一种粘膜粘附脂质载体系统。粘膜粘着剂脂质载体系统包含三重佐剂组合物,该三重佐剂组合物包含用粘膜粘附脂质载体配制的宿主防御肽、免疫刺激序列和聚阴离子聚合物。粘膜粘附脂质载体系统能够增强对所选择的抗原的免疫应答。在某些实施方式中,当粘膜给药时,粘膜粘附剂脂质载体系统能够增强免疫应答。在一些实施方式中,当肌内给药时,粘膜粘附剂脂质载体系统能够增强免疫应答。在某些实施方式中,系统的粘膜粘附脂质载体包括阳离子脂质体,诸如,但不限于粘膜粘附阳离子脂质载体,该粘膜粘附阳离子脂质载体包括选自以下的一种或多种阳离子脂质:1,2-二油酰基-3-三甲基铵-丙烷(DOTAP);3β-[N-(N’,N’-二甲基氨基乙烷)-氨甲酰基](DC);二甲基双十八烷基铵(DDA);十八烷基胺(SA);二甲基双十八烷基溴化铵(DDAB);1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE);卵L-α-磷脂酰胆碱(EPC);胆固醇(Chol);二硬脂酰磷脂酰胆碱(DSPC);1,2-二肉豆蔻酰基-3-三甲基铵-丙烷(DMTAP);二肉豆蔻酰磷脂酰胆碱(DMPC);或神经酰胺氨基甲酰基-精胺(CCS)。
在另外实施方式中,系统的粘膜粘附脂质体由DDAB和DOPE;DDAB、EPC和DOPE;SA和Chol;EPC和Chol;或SA/EPC和Chol组成。
在另外实施方式中,粘膜粘附脂质载体系统的宿主防御肽是IDR-1002(SEQ IDNO:19)。
在另外实施方式中,粘膜粘附脂质载体系统的免疫刺激序列是聚肌苷酸-聚胞苷酸(聚(I:C))或CpG。
在另外实施方式中,粘膜粘附脂质载体系统的聚磷腈是聚(二-4-氧基苯基丙酸酯)磷腈(PCEP),诸如,PCEP的钠盐。
在另外实施方式中,粘膜粘附脂质载体系统包含来自侵入粘膜组织的病原体的抗原,诸如,抗原来自病毒、细菌、寄生虫或真菌。
在又一另外实施方式中,提供了一种粘膜粘附阳离子脂质载体系统。阳离子脂质载体系统包含(a)DDAB和DOPE;DDAB、EPC和DOPE;SA和Chol;EPC和Chol;或SA/EPC和Chol;(b)IDR-1002(SEQ ID NO:19);(c)聚(I:C);(d)PCEP(诸如,PCEP的钠盐);以及(e)抗原,该抗原来自侵袭粘膜组织的病原体。在某些实施方式中,抗原来自病毒、细菌、寄生虫或真菌。
在另外实施方式中,提供了一种组合物,该组合物包括如在此所描述的粘膜粘附脂质载体系统;以及药学上可接受的赋形剂。在某些实施方式中,组合物中的粘膜粘附脂质载体系统的平均直径小于200纳米。
在另外实施方式中,提供了一种增强对所选择的抗原的免疫应答的方法。方法包括向受试者给药组合物;以及所选择的抗原。在某些实施方式中,给药通过粘膜进行。在某些实施方式中,给药通过鼻内进行。在某些实施方式中,给药通过肌内进行。
结合在本文的公开内容,本领域的普通技术人员将容易地想到本发明的这些和其他实施方式。
附图说明
图1示出通过ζ电位评估的脂质三重佐剂颗粒(L-TriAdj)在24小时内的稳定性。数据表示平均值+/-SD(n=3)。
图2示出使用DDAB/DOPE 50:50和各种组合物的粘蛋白结合研究的结果,如实施例中所描述。
图3示出使用DDAB/DOPE 75:25和各种组合物的粘蛋白结合研究的结果,如实施例中所描述。
图4示出使用DDAB/EggPC/DOPE 40:50:10和各种组合物的粘蛋白结合研究的结果,如实施例中所描述。
图5示出使用EggPC/Chol 90:10和各种组合物的粘蛋白结合研究的结果,如实施例中所描述。
图6示出MTS细胞毒性测定的结果,其中TriAdj含量恒定在0.5:1:0.5(μg:μg:μg)/孔,如实施例中所描述。
图7示出MTS细胞毒性测定的结果,其中TriAdj含量恒定在0.25:0.5:0.25μg:μg:μg/孔,如实施例中所描述。
图8A至图8J示出鼻内给药后在动物中获得的免疫应答,如实施例中所描述。图8A和图8F示出在鼻疫苗给药TriAdj(以卵清蛋白(Ova)为抗原以及每剂量为1:2:1或5:10:5μg体重比)之后,小鼠中IgG2a(8A)和IgG1(8F)应答的ELISA结果。L-TriAdj用DDAB/DOPE(50:50mol/mol)或DDAB/EPC/DOPE(40/50/10mol/mol/mol)配制。对于所有其他图(8B、8C、8D、8E、8G、8H、8I、8J),TriAdj的剂量是5:10:5μg,除了8B和8G(PBS对照免疫)。图8B、图8C、图8D、图8E、图8G、图8H、图8I和图8J中的数据表示从接种疫苗的小鼠收获的脾淋巴细胞的ELISpot结果,分别示出Ova抗原刺激的IFN-γ(图的左侧)或IL-5(右侧)的分泌。数据表示来自个体小鼠的一式三份样品的反应,并且横线表示中值(n=8)。●盐水对照;■仅抗原;▲TriAdj;▼L-TriAdj DDAB/DOPE(2μg肽);◆L-TriAdj DDAB/DOPE(10μg肽);
图9示出TriAdj剂量对小鼠中含佐剂卵清蛋白疫苗的免疫应答的影响。数据表示来自每个治疗组的IFN-γ应答的第四四分位数(n=8/组)。
图10示出用三重佐剂组合物(TriAdj)或包含卵清蛋白抗原(Ova)的脂质体三重佐剂颗粒(L-TriAdj+Ova)疫苗接种的每只小鼠的干扰素-γ(INF)和白细胞介素-5(IL-5)的ELISpot值的比率,如实施例中所描述。结果表示为平均值+SD(n=7)。1:2:1或5:10:5μg的TriAdj和脂质体组合物的剂量如图8所示。将来自接种疫苗的小鼠的脾淋巴细胞一式三份地暴露于离体的5或10μg卵清蛋白并且测量IL5和IFN的分泌。这些值的比率反映了细胞(Th1)与体液(Th2)类型应答的平衡。*与具有5:10:5μg的TriAdj并且用5μg Ova刺激的L-TriAdj DDAB/DOPE显著不同(p=0.05)。2或10μg的TriAdj和脂质体组合物内的肽剂量如图8所示。
图11A至图11J示出的鼻内给药之后在动物中获得的免疫应答,如实施例中所描述。图11A和图11B示出在鼻内疫苗给药TriAdj(以卵清蛋白(Ova)作为抗原以及1μg或10μgOva/剂量)和TriAdj(由每剂量5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐组成)后,小鼠中IgG2a(11A)和IgG1(11B)应答的ELISA结果。在0、4和10周时,用DDAB/DOPE(50:50mol/mol)配制L-TriAdj。图11C、图11D、图11E、图11F、图11G、图11H、图11I和图11J中的数据表示从接种疫苗的小鼠收获的脾淋巴细胞的ELISpot结果,分别示出离体Ova抗原刺激的IFN-γ(图的左侧)或IL5(右侧)的分泌。数据表示来自个体小鼠的一式三份样品的反应,并且横线表示中值(n=8)。●:仅Ova 1μg;■:仅Ova 10μg;▲:Ova 1μg+TriAdj MP;▼:Ova 10μg+TriAdj MP;◆:Ova 1μg+L-TriAdj;
图12示出基于IgG2a血清水平,在接种Ova+L-TriAdj疫苗的小鼠中,接种后4周的佐剂活性更高。数据表示对数(n=8);X表示中值。
图13示出在给药每剂量1μg(图13A)或10μg(图13B)μg的Ova和由5μg聚(I:C):10μgIDR-1002:5μg PCEP钠盐组成的TriAdj(用DDAB/DOPE(50:50mol/mol,标记为L-TriAdj)、微粒(标记为TriAdj MP)或溶液(标记为TriAdj)配制)的小鼠中血清IgA应答的ELISA结果。
图14示出在免疫之前(图14A)、在4周(图14B)、6周(图14C)以及10周(图14D),在鼻内或肌内疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐的TriAdj配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐)之后,小鼠中血清IgG1应答的ELISA结果,如实施例中所描述。●:Ova 10μg+L-TriAdj,鼻内递送;■:Ova 10μg+L-TriAdj,肌内递送;▲:Ova10μg+TriAdj MP(5:10:5),鼻内递送;▼:Ova 10μg+TriAdj MP(5:10:5),肌内递送;+:Ova10μg,肌内递送。数据表示来自个体小鼠的样品的反应,并且横线表示中值(n=8)。
图15示出在免疫之前(图15A)、在4周(图15B)、6周(图15C)以及10周(图15D),在鼻内或肌内疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐的TriAdj配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐)之后,小鼠中血清IgG2a应答的ELISA结果,如实施例中所描述。●:Ova 10μg+L-TriAdj,鼻内递送;■:Ova 10μg+L-TriAdj,肌内递送;▲:Ova10μg+TriAdj MP(5:10:5),鼻内递送;▼:Ova 10μg+TriAdj MP(5:10:5),肌内递送;+:Ova10μg,肌内递送。数据表示来自个体小鼠的样品的反应,并且横线表示中值(n=8)。
图16示出在免疫之前(图16A)、在4周(图16B)、6周(图16C)以及10周(图16D),在鼻内或肌内疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐的TriAdj配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP钠盐)之后,小鼠中血清IgG2a应答的ELISA结果,如实施例中所描述。●:Ova 10μg+L-TriAdj,鼻内递送;■:Ova 10μg+L-TriAdj,肌内递送;▲:Ova10μg+TriAdj MP(5:10:5),鼻内递送;▼:Ova 10μg+TriAdj MP(5:10:5),肌内递送;+:Ova10μg,肌内递送。数据表示来自个体小鼠的样品的反应,并且横线表示中值(n=8)。
图17示出在第一次免疫之后10周鼻内或肌内疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):10μg IDR-1002:5μgPCEP的TriAdj配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP)之后,在小鼠的鼻内(IN)洗涤中的IgG1、IgG2a和IgA应答的ELISA结果。在图17A中呈现IN洗涤IgG1应答,在图17B中呈现IN洗涤IgG2a应答,并且在图17C中呈现IN洗涤IgA应答。●:Ova 10μg+L-TriAdj,鼻内递送;■:Ova 10μg+L-TriAdj,肌内递送;▲:Ova 10μg+TriAdj MP(5:10:5),鼻内递送;▼:Ova 10μg+TriAdj MP(5:10:5),肌内递送;+:Ova 10μg,肌内递送。数据表示来自个体小鼠的样品的反应,并且横线表示中值(n=8)。
图18示出在第一次免疫之后10周鼻内或肌内疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):10μg IDR-1002:5μgPCEP的TriAdj配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP)之后,在小鼠的鼻内(BAL)洗涤中的IgG1、IgG2a和IgA应答的ELISA结果。在图18A中呈现BAL IgG1应答,在图18B中呈现BAL IgG2a应答,并且在图18C中呈现BAL IgA应答。数据表示来自个体小鼠的样品的反应,并且横线表示中值(n=8)。
图19表示来自在10周时从接种疫苗的小鼠收获的脾淋巴细胞的ELISpot结果,示出离体Ova抗原刺激的IFN-γ分泌。通过鼻内(IN)或肌内(IM)疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):0μg IDR-1002:5μg PCEP配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP)对小鼠进行疫苗接种。ELISpot刺激剂是:●:介质(阴性对照);■:Ova 5μg/mL;▲:Ova 10μg/mL。数据表示来自个体小鼠的一式三份样品的反应,并且横线表示中值(n=8)。
图20表示在10周时从接种疫苗的小鼠收获的脾淋巴细胞的ELISpot结果,示出离体Ova抗原刺激的IL5分泌。通过鼻内(IN)或肌内(IM)疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):0μg IDR-1002:5μgPCEP配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP)对小鼠进行疫苗接种。ELISpot刺激剂是:●:介质(阴性对照);■:Ova 5μg/mL;▲:Ova10μg/mL。数据表示来自个体小鼠的一式三份样品的反应,并且横线表示中值(n=8)。
图21表示在10周时从接种疫苗的小鼠收获的脾淋巴细胞的离体Ova抗原刺激的分泌后的IFNγ和IL5 ELISpot结果的比率。通过鼻内(IN)或肌内(IM)疫苗给药作为抗原的10μg卵清蛋白(Ova)以及L-TriAdj(用DDAB/DOPE(50:50mol/mol)和作为5μg聚(I:C):0μgIDR-1002:5μg PCEP配制)或TriAdj微粒(5μg聚(I:C):10μg IDR-1002:5μg PCEP)对小鼠进行疫苗接种。ELISpot刺激剂是:●:介质(阴性对照);■:Ova 5μg/mL;▲:Ova 10μg/mL。数据表示来自个体小鼠的一式三份样品的反应,并且横线表示中值(n=8)。
图22示出用于本发明制剂中的代表性聚磷腈化合物。
具体实施方式
除非另有说明,否则本发明的实施将采用将在本领域技术范围内采用微生物学、化学、生物化学、重组DNA技术和免疫学的常规方法。这些技术在文献中得到充分解释。参见,例如,Handbook of Experimental Immunology,Vols.I-IV(D.M.Weir andC.C.Blackwell eds.,Blackwell Scientific Publications);T.E.Creighton,Proteins:Structures and Molecular Properties(W.H.Freeman and Company,current Edition);A.L.Lehninger,Biochemistry(Worth Publishers,Inc.,现行添加);Sambrook等人,Molecular Cloning:A Laboratory Manual(现行添加);Methods In Enzymology(S.Colowick and N.Kaplan eds.,Academic Press,Inc.).
在此引用的所有出版物、专利和专利申请,无论是在上文还是在下文,都通过引用以其全文结合在此。
贯穿本文使用以下氨基酸缩写:
丙氨酸:Ala(A) 精氨酸:Arg(R)
天冬酰胺:Asn(N) 天冬氨酸:Asp(D)
半胱氨酸:Cys(C) 谷氨酰胺:Gln(Q)
谷氨酸:Glu(E) 甘氨酸:Gly(G)
组氨酸:His(H) 异亮氨酸:Ile(I)
亮氨酸:Leu(L) 赖氨酸:Lys(K)
甲硫氨酸:Met(M) 苯丙氨酸:Phe(F)
脯氨酸:Pro(P) 丝氨酸:Ser(S)
苏氨酸:Thr(T) 色氨酸:Trp(W)
脱氢丙氨酸(Dha) 溴丁比林(Dhb)
表1.在本文呈现的序列:
I.定义
在描述本发明时,将采用以下术语,并且旨在如下所示进行定义。
应该注意,除非上下文另外明确清楚地规定,否则如说明书和所附的权利要求中使用的,“一个”、“一种”和“该”包括复数指示物。因此,例如,提及“宿主防御肽”包括两种或更多种宿主防御肽的混合物等。
“宿主防御肽”或“HDP”意指具有增强对共给药的抗原的免疫应答的能力的各种宿主防御肽中的任一种。各种宿主防御肽的DNA和相应的氨基酸序列是已知的并且在下文详细描述。用于本发明方法的宿主防御肽包括全长(即,前原序列,如果存在的话,整个前原分子)或基本上全长的蛋白质,以及蛋白质的生物活性片段、融合物或突变体。术语还包括多肽的表达后修饰,例如糖基化、乙酰化、磷酸化等。此外,出于本发明的目的,“宿主防御肽”是指包括对天然序列的修饰,诸如,缺失、添加和取代(通常在自然界中是保守的)的蛋白质,只要蛋白质维持所期望的活性。这些修饰可以是有意的,如通过定点诱变,或者可以是意外的,诸如,通过由于PCR扩增而产生蛋白质或错误的宿主的突变。很明显,宿主防御肽因此可以包含完整的前导序列、成熟序列、片段、截短和部分序列、以及分子的类似物、突变蛋白和前体形式。术语还旨在缺失、添加和取代参考序列,只要分子保留所期望的生物活性。
“聚(I:C)核苷酸”或“聚(I:C)”意指合成的病毒样错配的双链免疫刺激核糖核酸,该双链免疫刺激核糖核酸含有通过链中的嘌呤碱基与嘧啶碱基之间的氢键结合在一起的多核糖肌苷酸和多核糖胞苷酸的链。已经发现聚(I:C)在体外具有强的干扰素诱导作用并且因此在传染性疾病研究中具有重要意义。
“CpG寡核苷酸”、“CpG”、或“CpG ODN”意指含有至少一个胞嘧啶-鸟嘌呤二核苷酸序列(即,5’胞苷,随后是3’鸟苷并且通过磷酸键连接)并且激活免疫系统的免疫刺激核酸。“未甲基化的CpG寡核苷酸”是包含未甲基化的胞嘧啶-鸟嘌呤二核苷酸序列(即,未甲基化的5’胞苷,随后是3’鸟苷并且通过磷酸键连接)并且激活免疫系统的核酸分子。“甲基化的CpG寡核苷酸”是包含甲基化胞嘧啶-鸟嘌呤二核苷酸序列(即,甲基化5’胞苷,随后是3’鸟苷并且通过磷酸键连接)并且激活免疫系统的核酸。CpG寡核苷酸是本领域熟知的并且描述于例如美国专利号6,194,388;6,207,646;6,214,806;6,218,371;6,239,116;以及6,339,068;PCT公开号WO 0122990;PCT公开号WO 03015711;美国公开号20030139364,这些专利和出版物通过引用以其全文结合在此。
“聚磷腈”是指高分子量的水溶性聚合物,该聚合物含有交替的磷和氮原子的主链以及在每个磷原子处附接的有机侧基。参见,例如,Payne等人,Vaccine(1998)16:92-98;Payne等人,Adv.Drug.Deliv.Rev.(1998)31:185-196。许多聚磷腈是已知的并且在下文中更详细地描述。
“粘液膜”或“粘膜”是指各种体腔壁(诸如,但不限于呼吸道,即肺和鼻腔;胃肠道(GI),包括口、食道、胃、小肠、大肠、直肠和肛门;阴道;以及角膜)的任何湿润表面。粘膜由结缔组织层、固有层(位于上皮层下方)组成,其表面通常通过粘液层的存在而变得湿润。上皮可以是单层的(诸如,在胃、小肠和大肠和支气管中发现的)或多层的/分层的(诸如,在食道、阴道和眼睛中存在的)。前者包含杯状细胞,其直接将粘液分泌到上皮表面上,而后者包含组织或与邻近组织,其包括分泌粘液到上皮表面上的专门化腺体,诸如,液腺。粘液以粘附于粘膜表面的凝胶层或以腔可溶或悬浮形式存在。所有粘液凝胶的主要组分是粘蛋白糖蛋白、脂质、无机盐和水。粘膜是大多数病原体侵入的表面。
“粘膜粘附”是指将物质与粘膜缔合的过程。粘膜粘附的机制通常分为两个步骤:接触阶段和固结阶段。第一步的特征在于,随着制剂扩散和溶胀,使粘膜粘附物质(在该情况下为包含包封的三重佐剂组合物的粘膜粘附脂质载体系统)和粘膜接触。这引发与粘液层的深度接触。在固结步骤中,通过水分的存在活化粘膜粘附材料。水分允许粘膜粘附分子通过弱的范德华力和氢键断裂和连接。
“粘膜粘附脂质载体”意指由脂质(典型地阳离子脂质,诸如,阳离子脂质体)组成的微粒载体,其中,当存在所选择的共给药的抗原时,载体具有通过粘膜粘附与粘膜缔合以刺激局部免疫应答并且在一些情况下刺激全身免疫应答的能力。
通常称为“MALT”的“粘膜免疫系统”是位于粘膜附近的适应性免疫系统。粘膜免疫系统的显性抗体同种型是IgA。这类抗体以两种同种型IgA1和IgA2在一些哺乳动物中发现。IgA的表达在血液和粘膜分泌物(在其中发现它的两个主要区室)之间不同。在血液中,主要发现IgA为单体并且IgA1与IgA2的比率为约4:1。在粘膜分泌物中,IgA几乎唯一地作为二聚体产生,并且IgA1与IgA2的比率是约3:2。许多常见的肠病原体具有可消化IgA1的蛋白水解酶,而IgA2对消化更有抗性。
“肌内”是指将所期望的组合物(诸如,粘膜粘附脂质载体系统或阳离子粘膜粘附脂质载体系统)注射或递送至患者的肌肉组织中的方法。例如,可以将组合物注射到患者手臂的三角肌中。
“抗原”或“免疫原”是指包含一个或多个表位(以下定义)的分子,当抗原被呈递时,这些表位将刺激宿主免疫系统以产生细胞抗原特异性免疫应答和/或体液抗体应答。术语表示亚基抗原,即,与抗原自然相关的完整生物体分离并分离的蛋白质,以及杀死的、减毒的或灭活的细菌、病毒、寄生虫或其他微生物。抗体(诸如,抗独特型抗体)、或其片段、以及可以模拟抗原或抗原决定簇的合成肽模拟表位,也在如本文所用的抗原的定义下被捕获。类似地,在体内(诸如,在基因疗法和核酸免疫应用中)表达治疗性或免疫原性蛋白质或抗原决定簇的寡核苷酸或多核苷酸也包括在本文抗原的定义中。此外,出于本发明的目的,抗原可以衍生自数种已知病毒、细菌、寄生虫和真菌中的任一种,以及各种肿瘤抗原中的任一种。
术语“衍生自”用于鉴定分子(例如,牛或人)的原始来源,但不意在限制制备分子的方法,该方法可以例如通过化学合成或重组手段进行。
术语“类似物”和“突变蛋白”是指保留如在本文所描述的所期望的活性的参比分子的生物活性衍生物。总体上,术语“类似物”是指相对于天然分子,具有天然多肽序列和具有一个或多个氨基酸添加、取代(总体上在自然界中是保守的)和/或缺失的结构的化合物,只要这些修饰不破坏活性并且它们与如以下定义的参考分子“基本上同源”。术语“突变蛋白”是指具有一种或多种肽模拟物的肽(“类肽”),如在国际公开号WO 9104282。优选地,类似物或突变蛋白至少具有与天然分子相同的所需活性。制备多肽类似物和突变蛋白的方法是本领域已知的,并在下文进一步描述。
术语还涵盖对参考分子进行的有目的突变。特别优选的类似物包括本质上保守的取代,即在其侧链中相关的氨基酸家族内发生的那些取代。具体地,氨基酸一般分为四个家族:(1)酸性的天冬氨酸和谷氨酸;(2)碱性的赖氨酸、精氨酸、组氨酸;(3)非极性的丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸;以及(4)不带电的极性氨基酸(甘氨酸、天门冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸)。有时将苯丙氨酸、色氨酸和酪氨酸分类为芳香族氨基酸。例如,将亮氨酸分离置换为异亮氨酸或缬氨酸,将天冬氨酸分离置换为谷氨酸,将苏氨酸分离置换为丝氨酸,或将氨基酸类似的保守置换为结构相关的氨基酸,对生物活性没有重大影响是可以合理预见的。例如,感兴趣的分子可以包括高达约510个保守或非保守氨基酸取代、或甚至高达约1520个保守或非保守氨基酸取代、或5-20之间的任何整数个,只要分子的所期望的功能保持完整。通过参考本领域公知的Hopp/Woods和Kyte Doolitt1e图,本领域技术人员可以容易地确定感兴趣的分子的可以耐受变化的区域。
“片段”是指仅由完整全长多肽序列和结构的一部分组成的分子。片段可以包括天然多肽的C末端缺失、N末端缺失和/或内部缺失。片段通常将包括全长分子的至少约510个连续氨基酸残基,优选全长分子的至少约1525个连续氨基酸残基,最优选全长分子的至少约2050个或更多个连续氨基酸残基,或5个氨基酸与全长序列之间的任何整数个,条件是所讨论的片段保留引发所期望的生物应答的能力。
“免疫原性片段”意指亲本分子的片段,该片段包括一个或多个表位并且因此可以调节免疫应答或可以充当共给药的抗原的佐剂和/或能够诱导适应性免疫应答。可以使用本领域公知的任何数量的表位作图技术来鉴定此类片段。参见,例如,Epitope MappingProtocols in Methods in Molecular Biology,Vol.66(Glenn E.Morris,Ed.,1996)Humana Press,Totowa,New Jersey。例如,线性表位可以通过例如在固体支持物上同时合成大量肽(该肽对应于蛋白质分子的部分)并且在肽仍附着于支持物时使肽与抗体反应来确定。此类技术是本领域公知的并且描述于美国专利号4,708,871;Geysen et al.,(1984)Proc.Natl.Acad.Sci.USA 81:3998-4002;Geysen et al.,(1986)Molec.Immunol.23:709-715,其全部内容通过引用并入本文。类似地,通过确定氨基酸的空间构象,例如通过例如X射线晶体学和二维核磁共振,容易地鉴定构象表位。参见,例如,Epitope MappingProtocols,supra.也可以使用标准抗原性和亲水性图来鉴定蛋白质的抗原区域,例如使用例如可从牛津分子集团获得的Omiga 1.0版软件程序计算的那些。这个计算机程序采用用于确定抗原性谱的Hopp/Woods方法(Hopp等人,Proc.Natl.Acad.Sci USA(1981)78:3824-3828)和用于亲水性图的Kyte-Doolitt1e技术(Kyte et al.,J.Mol.Biol.(1982)157:105-132)。
出于本发明的目的,免疫原性片段的长度通常是至少约2个氨基酸,更优选约5个氨基酸,最优选至少约10至15个氨基酸。片段的长度没有关键的上限,其可以几乎包含蛋白质序列的全长,或甚至包含所讨论的蛋白质的两个或更多个表位的融合蛋白。
术语“表位”是指特异性B细胞和T细胞应答的抗原或半抗原上的位点。术语还与“抗原决定簇”或“抗原决定簇位点”可互换使用。可以在简单的免疫测定法中鉴定识别相同表位的抗体,免疫测定法显示抗体阻断另一抗体与靶抗原结合的能力。
对组合物的“免疫应答”是在宿主中发展对感兴趣的组合物或疫苗的细胞和/或抗体介导的免疫应答。通常,“免疫应答”包括但不限于以下作用中的一种或多种:特异性针对包括在感兴趣的组合物或疫苗中的一种或多种抗原的抗体、B细胞、辅助T细胞、抑制T细胞、和/或细胞毒性T细胞和/或γδT细胞的产生。优选地,宿主将对所讨论的微生物显示保护性免疫应答,例如,将宿主保护免受病原体的后续感染,并且这种保护将通过由感染的宿主正常显示的症状的减少或缺乏或更快的恢复时间来证明。
术语“免疫原性”分子是指引起如上所描述的免疫应答的分子。如在本文使用的,“免疫原性”蛋白或多肽包括所讨论的蛋白的全长序列,包括前体和成熟形式、其类似物、或其免疫原性片段。
包含宿主防御肽、聚磷腈和免疫刺激序列的佐剂组合物“增强”或“增加”免疫应答,或当所选择的抗原具有比在不含佐剂组合物的情况下递送等量抗原所诱导的免疫应答更大的诱导免疫应答的能力时,相对于所选抗原显示“增强的”或“增加的”免疫原性。可以通过向动物给药抗原和佐剂组合物和抗原对照并且使用本领域公知的标准测定(诸如,放射免疫测定和ELISA)比较针对两者的抗体滴度来确定此类增强的免疫原性。
“基本上纯化的”通常是指物质(化合物、多核苷酸、蛋白质、多肽、多肽组合物)的分离,这样使得该物质包含其所在样品的大部分。通常,在样品中,基本上纯化的组分占样品的50%,优选80%-85%,更优选90%-95%。用于纯化感兴趣的多核苷酸和多肽的技术是本领域公知的,并且包括例如离子交换色谱法、亲和色谱法、金属螯合色谱法、反相色谱法、疏水相互作用色谱法、以及根据密度的沉降。
“分离的”是指所指出的分子是与在自然界中发现该分子的整个生物体分开和离散的,或者在基本上不存在相同类型的其他生物大分子的情况下存在。关于多核苷酸的术语“分离的”是缺乏(全部或部分)在自然界中通常与其相关联的序列的核酸分子;或序列,如其在自然界中存在的,但具有与其相关联的异源序列;或从染色体分离的分子。
“同源性”是指两个多核苷酸或两个多肽部分之间的百分比同一性。当两个核酸或两个多肽序列在分子的限定长度上显示至少约50%、优选至少约75%、更优选至少约80%-85%、优选至少约90%、并且最优选至少约95%-98%的序列同一性时,这些序列彼此“基本上同源”。如本文所使用的,基本上同源也指显示与指定序列完全同一性的序列。
通常,“同一性”分别是指两个多核苷酸或多肽序列的确切核苷酸与核苷酸或氨基酸与氨基酸的对应性。百分比同一性可以通过直接比较两个分子(参考序列和与参考序列具有未知百分比同一性的序列)之间的序列信息来确定,通过比对序列、计算两个比对序列之间的确切数目、除以参考序列的长度、并且将结果乘以100。容易获得的计算机程序可以用于帮助分析,诸如,ALIGN,Dayhoff,M.O.in Atlas of Protein Sequence andStructure M.O.Dayhoff ed.,5Suppl.3:353-358,National biomedical ResearchFoundation,Washington,DC,其改编了用于肽分析的Smith和Waterman Advances inAppl.Math.2:482-489,1981的局部同源性算法。用于确定核苷酸序列同一性的程序可获得于Wisconsin Sequence Analysis Package,第8版(从Genetics Computer Group,Madison,WI可获得)例如,BESTFIT、FASTA和GAP程序,该程序还依赖于Smith和Waterman算法。这些程序易于与制造商推荐的默认参数一起使用,并且描述于以上提及的Wisconsin序列分析包中。例如,可以使用具有默认评分表和六个核苷酸位置的空位罚分的Smith和Waterman的同源性算法来确定特定核苷酸序列与参考序列的百分比同一性。
在本发明的上下文中建立百分比同一性的另一方法是使用ohn F.Collins和Shane S.Sturrok开发并且由由IntelliGenetics,Inc.(Mountain View,CA)发行的Edinburgh大学版权保护的程序的MPSRCH包。从这套包中可以采用Smith Waterman算法,其中默认参数用于评分表(例如,空位开放罚分12,空位延伸罚分1,并且空位6)。从生成的数据中,“Match”值反映了“序列同一性”。用于计算序列之间的百分比同一性或相似性的其他适合的程序在本领域中通常是已知的,例如,另一比对程序是BLAST,与默认参数一起使用。例如,BLASTN和BLASTP可以使用以下默认参数:遗传密码=标准;过滤=无;链=两个;截止=60;预期值=10;矩阵=BLOSUM62;描述=50个序列;排序=高分数;数据库=非冗余(non-redundant),GenBank+EMBL+DDBJ+PDB+GenBankCDS翻译+Swiss蛋白+Spupdate+PIR。这些程序的细节是容易获得的。
替代性地,同源性可以通过多核苷酸在同源区之间形成稳定双链体的条件下的杂交,随后用一种或多种单链特异性核酸酶消化,并且大小确定消化的片段来确定。例如,基本上同源的DNA序列可以在Southern杂交实验中在如对于该特定系统定义的严格条件下鉴定。定义适当的杂交条件是在本领域的技术范围内。参见,例如,Sambrook et al.,supra;DNA Cloning,supra;Nucleic Acid Hybridization,supra。
如本文中用于描述核酸分子的“重组”意指基因组、cDNA、病毒、半合成、或合成来源的多核苷酸,该多核苷酸凭借其来源或操作不与在自然界中与其相关联的多核苷酸的全部或部分相关联。如关于蛋白质或多肽使用的术语“重组”意指通过重组多核苷酸的表达产生的多肽。一般地,克隆目的基因,然后在转化的生物体中表达,如下文进一步描述的。宿主生物体在表达条件下表达外源基因以产生蛋白质。
术语组合物或组合物的组分的“有效量”或“药学有效量”是指无毒但足够量的组合物或组分以提供所期望的应答(诸如,增强的免疫原性,以及任选地相应的治疗效果)。所需的确切量将随受试者而变化,这取决于受试者的物种、年龄、和一般状况、所治疗状况的严重程度、以及感兴趣的具体组分、给药模式等。在任何个案中的合适的“有效”量可以由本领域的技术人员使用常规实验决定。
“脊椎动物受试者”意指绒毛膜下层的任何成员,包括但不限于人类和其他灵长类,包括非人类灵长类如黑猩猩和其他猿和猴物种;家畜,诸如,牛、绵羊、猪、山羊和马;家养哺乳动物,诸如,狗和猫;实验室动物,包括啮齿类动物如小鼠、大鼠和豚鼠;鸟类,包括家养、野生和猎鸟,诸如,鸡、火鸡和其他鸡鸟、鸭、鹅等。术语不表示特定年龄。因此,旨在涵盖成人个体和新生个体两者。在此描述的本发明旨在用于以上脊椎动物物种中的任一种,因为所有这些脊椎动物的免疫系统类似地操作。
如在此使用的术语“治疗”是指(1)预防感染或重新感染(预防)、或(2)减少或消除感兴趣的疾病的症状(治疗)。
II.实施本发明的方式
在详细描述本发明之前,应当理解,本发明不限于特定的配方或工艺参数,因为这些当然可以变化。还要理解的是,这里使用的术语仅仅是为了描述发明的特定实施方式,而并不是用来限制。
虽然在本发明的实践中可以使用许多与本文描述的那些相似的或等价的方法和材料,但是本文描述了优选的材料和方法。
本发明是基于以下发现:包含免疫刺激序列(例如CpG或非CpG寡核苷酸(例如,聚(I:C)))、聚阴离子聚合物(诸如,聚磷腈)和宿主防御肽,当使用粘膜粘附脂质载体给药时,例如阳离子脂质体可用于粘膜或肌内给药以增强对共给药的抗原的免疫应答。因此,例如,这些系统可以用来在粘膜或肌内递送至呼吸系统、胃肠道、泌尿生殖道、眼睛等的膜时,赋予针对感染的保护。
含有这些三重佐剂组合物的粘膜粘附脂质载体系统可用于预防和治疗人类和其他动物中由侵入粘膜的多种病原体引起的感染性疾病,包括细菌、分枝杆菌、病毒、真菌、寄生虫等引起的疾病(当与共给药的抗原一起使用时)。
本发明的粘膜粘附脂质载体系统可以使用多种粘膜或肌内递送技术中的任一种引入到受试者中,下文更全面地描述。系统可以与一种或多种抗原或免疫原(包括多肽、多核苷酸、多糖或脂质抗原或免疫原)以及与灭活的或减毒的病原体一起使用,以在递送系统的受试者中产生免疫应答,诸如,粘膜免疫应答。免疫应答可以用于保护免受未来的感染或减轻或改善感染的作用。
为了进一步理解本发明,下文提供了关于用于主题组合物和方法的宿主防御肽、免疫刺激序列、聚阴离子聚合物、粘膜粘附脂质载体和抗原的更详细讨论。
宿主防御肽
如上所描述,本发明的方法和组合物包括宿主防御肽。在植物、昆虫和动物中已经鉴定出超过400种这些抗微生物蛋白。参见,例如,Boman,H.G.,Annu.Rev.Immunol.(1995)13:61-92;Boman,H.G.,Scand.J.Immunol.(1998)48:15-25;Broekaert等人,Plant.Physiol.(1995)108:1353-1358;Steiner等人,Nature(1981)292:246-248;Ganz等人,Curr.Opin.Immunol.(1994)4:584-589;Lehrer等人,Curr.Opin.Immunol.(1999)11:23-27。哺乳动物宿主防御肽的两个主要家族是防御素和儿茶素。参见,例如,Ganz等人,Curr.Opin.Immunol.(1994)4:584-589;Lehrer等人,Curr.Opin.Immunol.(1999)11:23-27;Ouellette等人,FASEB J(1996)10:1280-1289;Zanetti等人,FEBS Lett(1995)374:1-5。
哺乳动物防御素是阳离子蛋白质家族,其含有六个高度保守的半胱氨酸残基,这些残基形成三对链内-二硫键。哺乳动物防御素基于它们的链内-二硫桥键的模式被分类为三个亚家族,α-、β-、和θ-防御素,(Ganz等人,Curr.Opin.1mmunol.(1994)4:584-589;Lehrer等人,Curr.Opin.1mmunol.(1999)11:23-27;Tang等人,Science(1999)286:498-502)。θ-防卫素亚家族包括其六个半胱氨酸残基连接C1至C6、C2至C5和C3至C4的环状分子(Tang等人,Science(1999)286:498-502)。α-防卫素的三个二硫键是成对的C1至C6、C2至C4、和C3至C5(Ganz等人,Curr.Opin.Immunol.(1994)4:584-589;Ouellette等人,FASEB J(1996)10:1280-1289;Zhang等人,Biochemistry(1992)31:11348-11356)。β-防卫素的二硫键是C1至C5、C2至C4以及C3至C6(Ganz等人,Curr.Opin.Immunol.(1994)4:584-589;Tang等人,J.Biol.Chem.(1993)268:6649-6653)。
在哺乳动物物种中已鉴定出超过50个防卫素家族成员。在人类中,已经鉴定了至少六种α-防卫素和三种β-防卫素(Ganz等人,Curr.Opin.Immunol.(1994)4:584-589;Lehrer等人,Curr.Opin.Immunol.(1999)11:23-27;Ouellette等人,FASEB J(1996)10:1280-1289;Ganz等人,J.Clin.Invest.(1985)76:1427-1435;Wilde等人,J.Biol.Chem.(1989)264:11200-11203;Mallow等人,J.Biol.Chem.(1996)271:4038-4045;Bensch等人,FEBS Lett(1995)368:331-335;Larrick等人,Infect.Immun.(1995)63:1291-1297)。人防卫素的非限制性实施例包括人α-防卫素1、2、3和4,也称为人嗜中性粒细胞肽(HNP)1、2、3和4;人α-防御素5和6(HD5和6);以及人β-防御素(HBD)1、2和3。
过氧化氢酶是抗微生物蛋白的家族,其具有推定的N-末端信号肽、在中间的高度保守的儿茶素(组织蛋白酶L抑制剂)样结构域和较不保守的C-末端抗微生物结构域(Lehrer等人,Curr.Opin.Immunol.(1999)11:23-27;Zanetti等人,FEBS Lett.(1995)374:1-5。在哺乳动物中已经鉴定了约20个cathelicidin成员,具有来自人类的至少一种cathelicidin(Zanetti等人,FEBS Lett.(1995)374:1-5;Larrick等人,Infect.Immun.(1995)63:1291-1297;Cowland等人,FEBS Lett.(1995)368:173-176;Agerberth等人,Proc.Nat1.Acad.Sci.USA(1995)92:195-199)。人导管肽(hCAP18)的切割释放其C末端抗微生物结构域,称为LL-37的肽,具有两个N-末端亮氨酸残基。LL-37是37个氨基酸残基长度(Zanetti等人,FEBS Lett.(1995)374:1-5;Gudmundsson等人,Eur.J.Biochem.(1996)238:325-332)。
另一组宿主防御肽含有高百分比的特定氨基酸(诸如,富含脯氨酸-/精氨酸的牛肽、Bac2a、Bac5和Bac7)(Gennaro等人,Infect.Immun.(1989)57:3142-3146)和猪肽PR-39(Agerberth等人,Eur.J.Biochem.(1991)202:849-854);和吲哚啶,其是具有序列ILPWKWPWWPWRR(SEQ ID NO:1)的13-氨基酸宿主防御肽。
其他代表性宿主防御肽呈现在表1和实施例中,诸如,肽IDR-1002。
用于在此使用的宿主防御肽可以包括前原序列、无前序列的前蛋白、或无前原序列的成熟蛋白。如果存在信号序列,则分子可以包括例如天然信号序列,以及原序列或成熟序列。或者,用于本文的宿主防御肽可以包括具有异源信号序列的原序列或成熟序列。或者,本文使用的宿主防御肽可以仅包括成熟蛋白的序列,只要分子保留生物活性。此外,用于本文的宿主防御肽可以是显示与亲本分子基本上同源的生物活性分子,如上文所定义的。
因此,用于本发明的宿主防御肽可以包括,例如,整个亲本分子或其生物活性片段,诸如,包含连续氨基酸序列的片段,该连续氨基酸序列包含至少约5-10个至多约50个或其间的任何整数所讨论的分子的全长。分子将典型地包括一个或多个表位。使用本领域公知的技术,例如使用标准抗原性和亲水性图,例如使用例如可从牛津分子集团(OxfordMolecular Group)获得的Omiga版本1.0软件程序计算的那些,可以容易地鉴定此类表位。这个计算机程序采用用于确定抗原性谱的Hopp/Woods方法(Hopp等人,Proc.Nat1.Acad.Sci USA(1981)78:3824-3828)以及用于亲水性图的Kyte-Doolitt1e技术(Kyte等人,J.Mol.Biol.(1982)157:105-132)。程序可以与以下参数一起使用:对窗口7上的结果求平均;根据Emini确定表面概率;根据Karplus-Schulz的链柔性;根据Jameson-Wolf的抗原性指数;根据Garnier-Osguthorpe-Robson的二级结构;根据Chou-Fasman的二级结构;以及鉴定预测的糖基化位点。本领域技术人员可以容易地使用与本说明书的教导组合获得的信息来鉴定应当包括在用于本发明的分子中的抗原区域。
显示出适当生物活性(诸如,调节免疫应答的能力)的任何以上肽、以及其片段和类似物,如当经由还含有如本文所描述的三重佐剂的其他组分的粘膜粘附脂质载体系统递送时,增强对共递送的抗原的免疫应答的能力,将在本方法中找到用途。通过使用粘膜粘附脂质载体系统进行递送而显示的增强的佐剂活性可以通过确定感兴趣的组合物是否与载体系统一起递送并且当与感兴趣的抗原共递送时来阐明,与由等量的不用粘膜粘附脂质载体系统递送的相同组合物引起的免疫应答相比,具有更大的引发免疫应答的能力。这种增强的免疫原性可以通过比较抗体滴度或使用本领域公知的标准测定(诸如,放射免疫测定、ELISA、淋巴增殖测定等)产生的细胞免疫应答来确定。
用于本发明的宿主防御肽可以使用标准技术获得。例如,由于宿主防御肽通常较小,因此它们可以通过肽领域技术人员已知的几种技术中的任一种方便地化学合成。通常,这些方法采用向生长的肽链顺序添加一个或多个氨基酸。通常,第一氨基酸的氨基或羧基受到合适的保护基团的保护。然后可以在允许形成酰胺键的条件下通过在具有适当保护的互补(氨基或羧基)基团的序列中添加下一氨基酸将受保护的或衍生的氨基酸附接到惰性固体载体上或在溶液中利用。然后从新添加的氨基酸残基去除保护基团,然后添加下一氨基酸(适当保护的)等等。在所期望的氨基酸已经以适当的序列连接之后,依次或同时地去除任何剩余的保护基团(和任何固体支持物,如果使用固相合成技术),以产生最终的多肽。通过简单修饰这一通用程序,有可能一次将多于一个氨基酸添加到增长的链中,例如通过偶联(在不外消旋化手性中心的条件下)受保护的三肽与适当保护的二肽,以在脱保护之后形成五肽。参见,例如,用于固相肽合成技术的J.M.Stewart和J.D.Young,Solid PhasePeptide Synthesis(Pierce Chemical Co.,Rockford,IL 1984)和G.Barany和R.B.Merrifield,The Peptides:Analysis,Synthesis,Biology,editors E.Gross和J.Meienhofer,Vol.2,(Academic Press,New York,1980,pp.3-254);以及用于经典的溶液合成的M.Bodansky,Principles of Peptide Synthesis,(Springer-Verlag,Berlin1984)和E.Gross and J.Meienhofer,Eds.,The Peptides:Analysis,Synthesis,Biology,Vol.1。
典型的保护基团包括叔丁氧羰基(Boc)、9-芴基甲氧羰基(Fmoc)、苄氧羰基(Cbz);对甲苯磺酰基(Tx);2,4-二硝基苯基;苄基(Bzl);联苯基异丙氧基羰基、叔戊氧基羰基、异冰片基氧基羰基、邻溴苄氧基羰基、环己基、异丙基、乙酰基、邻硝基苯基磺酰基等。典型的固体载体是交联的聚合物载体。这些可以包括二乙烯基苯交联的苯乙烯基聚合物,例如,二乙烯基苯-羟甲基苯乙烯共聚物、二乙烯基苯-氯甲基苯乙烯共聚物和二乙烯基苯-二苯甲基氨基聚苯乙烯共聚物。
本发明的宿主防御肽还可以通过其他方法化学制备,例如,通过同时多肽合成的方法。参见,例如,Houghten Proc.Natl.Acad.Sci.USA(1985)82:5131-5135;美国专利号4,631,211。
或者,可以通过重组技术产生宿主防御肽。参见,例如,Zhang等人,FEBS Lett.(1998)424:37-40;Zhang等人,J.Biol.Chem.(1999)274:24031-24037;Shi等人,Infect.Immun.(1999)67:3121-3127。宿主防御肽可以重组产生,例如通过从cDNA文库或包括该cDNA文库的载体获得DNA分子、或使用酚提取从宿主组织获得DNA分子。或者,可以合成编码所期望的宿主防御肽的DNA和ATG起始密码子。核苷酸序列可以设计有用于所期望的具体氨基酸序列的适当密码子。通常,选择表达序列的预期宿主的优选密码子。完整序列通常由通过标准方法制备的重叠寡核苷酸组装并组装成完整编码序列。参见,例如,EdgeNature(1981)292:756;Nambair等人Science(1984)223:1299;Jay等人J.Biol.Chem.(1984)259:6311。自动化合成技术(诸如,磷酰胺固相合成)可以用于产生核苷酸序列。参见,例如,Beaucage,S.L.等人Tet.Lett.(1981)22:1859-1862;Matteucci,M.D.等人,J.Am.Chem.Soc.(1981)103:3185-3191。接下来,使用常规方法将DNA克隆到适当的载体、原核或真核中。许多克隆载体是本领域技术人员公知的,并且适当的克隆载体的选择是选择的问题。合适的载体包括但不限于质粒、噬菌体、转座子、粘粒、染色体或病毒,其在与适当的控制元件结合时能够复制。然后将编码序列置于合适的控制元件的控制下,这取决于用于表达的系统。因此,编码序列可以置于启动子、核糖体结合位点(用于细菌表达)和任选地操纵子的控制下,使得目的DNA序列通过合适的转化体转录成RNA。编码序列可以或可以不包含信号肽或前导序列,该信号肽或前导序列可以稍后在翻译后加工中被宿主去除。参见,例如,美国专利号4,431,739;4,425,437;4,338,397。如果存在,信号序列可以是与目的肽联合发现的天然前导序列。
除了控制序列之外,可能期望添加调节序列,这些调节序列允许相对于宿主细胞的生长来调节这些序列的表达。调节序列是本领域技术人员已知的,并且实施例包括引起基因表达应答于化学或物理刺激(包括调节化合物的存在)而开启或关闭的那些。其他类型的调节元件也可以存在于载体中。例如,增强子元件可以在本文中用于增加构建体的表达水平。实施例包括SV40早期基因增强子(Dijkema等人(1985)EMBO J.4:761),来源于劳斯肉瘤病毒的长末端重复(LTR)的增强子/启动子(Gorman等人(1982)Proc.Nat1.Acad.Sci.USA79:6777)和源自人CMV的元件(Boshart等人.(1985)Cell 41:521),诸如,包括在CMV内含子A序列(U.S.美国专利号5,688,688)。表达盒还可以包括在适合的宿主细胞中用于自主复制的复制起点、一个或多个选择性标记、一个或多个限制性位点、高拷贝数的潜力和强启动子。
构建表达载体,使得特定编码序列与适当的调节序列一起位于载体中,编码序列相对于控制序列的定位和取向是使得编码序列在控制序列的“控制”下转录(即,在控制序列处结合至DNA分子的RNA聚合酶转录编码序列)。为了达到这个目的,可能期望对编码感兴趣的分子的序列进行修饰。例如,在一些情况下,可能需要修饰序列,使得其可以以适当的取向附接至控制序列;即,保持读取框。控制序列和其他调节序列可以在插入载体之前连接至编码序列。或者,可以将编码序列直接克隆到已经含有控制序列和合适的限制性位点的表达载体中。
如以上所解释的,还可能令人期望的是产生感兴趣的肽的突变体或类似物。用于主题组合物的宿主防御肽的突变体或类似物可以通过缺失编码感兴趣分子的序列的一部分、通过插入序列和/或通过在序列内取代一个或多个核苷酸来制备。修饰核苷酸序列的技术,例如定点诱变等是本领域技术人员公知的。参见,例如,Sambrook等人,同上;Kunkel,T.A.(1985)Proc.Nat1.Acad.Sci.USA(1985)82:448;Geisseloder等人(1987)BioTechniques 5:786;Zoller和Smith(1983)Methods Enzymol.100:468;DalbieMcFarland等人(1982)Proc.Nat1.Acad.Sci USA 79:6409。
这些分子可以在多种多样的系统中表达,包括昆虫、哺乳动物、细菌、病毒和酵母表达系统,所有这些在本领域都是公知的。例如,昆虫细胞表达系统(诸如,杆状病毒系统)是本领域技术人员公知的,并且描述于例如Summers和Smith,Texas AgriculturalExperiment Station Bulletin No.1555(1987)。用于杆状病毒/昆虫细胞表达系统的材料和方法以试剂盒形式尤其从Invitrogen,San Diego CA(“MaxBac”试剂盒)可商购。类似地,细菌和哺乳动物细胞表达系统在本领域中是公知的并且描述于例如Sambrook等人,同上。酵母表达系统在本领域中也是已知的并且描述于例如Yeast Genetic Engineering(Barr等人,eds.,1989)Butterworths,London。
用于与以上系统一起使用的许多适当的宿主细胞也是已知的。例如,哺乳动物细胞系是本领域已知的,并且包括可从美国典型培养物保藏中心(ATCC)获得的永生细胞系,例如但不限于中国仓鼠卵巢(CHO)细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人类胚胎肾细胞、人类肝细胞癌细胞(例如Hep G2)、Madin-Darby牛肾(“MDBK”)细胞以及其他细胞。类似地,细菌宿主(诸如,大肠杆菌、枯草芽孢杆菌和链球菌属物种)将与本发明的表达构建体一起使用。在本发明中有用的酵母宿主尤其包括:酿酒酵母(inter alia)、白色念珠菌(Saccharomyces cerevisiae)、麦芽假丝酵母(Candida albicans)、多形汉逊酵母(Candida maltosa)、脆壁克鲁维酵母(Hansenula polymorpha)、乳酸克鲁维酵母(Kluyveromyces fragilis)、吉氏毕赤酵母(Kluyveromyces lactis)、巴斯德毕赤酵母(Pichia guillerimondii)、毕赤酵母(Pichia pastoris)、粟酒裂殖酵母(Schizosaccharomyces pombe)以及解脂耶氏酵母(Yarrowia lipolytica)。与杆状病毒表达载体一起使用的昆虫细胞尤其包括埃及伊蚊(埃及伊蚊)、苜蓿银纹夜蛾(Autographacalifornica)、家蚕、果蝇、草地贪夜蛾(Spodoptera frugiperda)和粉纹夜蛾(Trichoplusia ni)。
可以使用本领域公知的各种基因递送技术将包含感兴趣的核苷酸序列的核酸分子稳定地整合到宿主细胞基因组中或维持在适合的宿主细胞中的稳定的附加体元件上。参见,例如,美国专利号5,399,346。
取决于所选择的表达系统和宿主,通过在表达蛋白质的条件下培养由上述表达载体转化的宿主细胞来产生分子。然后将表达的蛋白质从宿主细胞中分离并纯化。如果表达系统将蛋白质分泌到生长培养基中,则可以直接从培养基中纯化产物。如果它不是分泌的,那么它可以从细胞裂解物中分离。合适的生长条件和回收方法的选择在本领域的技术范围内。
将宿主防御肽,无论是重组产生还是合成产生,配制成组合物并用于本文详述的方法。待在佐剂组合物中给药的宿主防御肽的典型量是约0.01至约8000μg/kg,典型地约0.05至约500μg/kg(诸如,1至100μg/kg或5至50μg/kg、或这些值之间的任何整数)。
免疫刺激序列
已知细菌DNA刺激哺乳动物免疫应答。参见例如Krieg等人,Nature(1995)374:546-549。这种免疫刺激能力归因于高频率的免疫刺激核酸分子(ISS),诸如,细菌DNA中存在的未甲基化CpG二核苷酸。含有未甲基化CpG基序的寡核苷酸已显示诱导B细胞、NK细胞和抗原呈递细胞(APC)(诸如,单核细胞和巨噬细胞)的活化。参见,例如,美国专利号6,207,646,通过引用将其全部内容结合于此。
本发明使用包括源自ISS的组分的佐剂。ISS包括可以是较大核苷酸构建体(诸如,质粒或细菌DNA)的一部分的寡核苷酸。寡核苷酸可以是线性或环状配置的,或者可以包含线性和环状区段。寡核苷酸可以包括修饰,例如但不限于3’OH或5’OH基团的修饰、核苷酸碱基的修饰、糖组分的修饰、以及磷酸酯基团的修饰。ISS可以包含核糖核苷酸(含有核糖作为主要或主要糖组分)或脱氧核糖核苷酸(含有脱氧核糖作为主要糖组分)。修饰的糖或糖类似物也可以掺入寡核苷酸中。可以使用的糖部分的实例施包括核糖、脱氧核糖、戊糖、脱氧戊糖、己糖、脱氧己糖、葡萄糖、阿拉伯糖、木糖、来苏糖、以及糖类似物环戊基基团。糖可以是吡喃糖基或呋喃糖基形式。可以使用磷衍生物(或修饰的磷酸酯基团)并且可以是一磷酸酯、二磷酸酯、三磷酸酯、烷基磷酸酯、烷磷酸酯、硫代磷酸酯、二硫代磷酸酯等。掺入ISS的寡核苷酸碱基中的核酸碱基可以是天然存在的嘌呤和嘧啶碱基,即,尿嘧啶或胸腺嘧啶、胞嘧啶、肌苷、腺嘌呤和鸟嘌呤、以及这些碱基的天然存在的和合成的修饰。此外,包含各种杂环碱基和各种糖部分(和糖类似物)的大量非天然核苷是可获得的,并且是本领域技术人员已知的。
在结构上,ISS的根寡核苷酸可以是含有CG的核苷酸序列,其可以是回文的。胞嘧啶可以是甲基化的或未甲基化的。用于本发明的特定ISS分子的实施例包括本领域已知的CpG、CpY和CpR分子等。
此类ISS分子可以衍生自CpG分子家族,诸如,CpG二核苷酸和包含CpG基序的合成寡核苷酸(参见,例如,Krieg等人,Nature(1995)374:546和Davis等人,J.Immunol.(1998)160:870-876),美国专利号6,194,388;6,207,646;6,214,806;6,218,371;6,239,116;6,339,068,美国公开号20030139364;PCT公开号.WO 0122990;PCT公开号;以及WO03015711中公开的各种免疫刺激性CpG寡核苷酸中的任一种,所有这些文献通过引用以其全文结合在此。此类CpG寡核苷酸通常包含至少8个至多约100个核苷酸,优选8至40个核苷酸,更优选15-35个核苷酸,优选15-25个核苷酸,以及这些值之间的任意数目的核苷酸。例如,包含由式5’-X1CGX2-3’表示的共有CpG基序的寡核苷酸(其中X1和X2是核苷酸并且C是未甲基化的)将用作免疫刺激性CpG分子。通常X1是A、G或T,X2是C或T。其他有用的CpG分子包括通过式5’-X1X2CGX3X4,其中X1和X2是诸如,GpT、GpG、GpA、ApA、ApT、ApG、CpT、CpA、CpG、TpA、TpT或TpG的序列,并且X3和X4是TpT、CpT、ApT、ApG、CpG、TpC、ApC、CpC、TpA、ApA、GpT、CpA、或TpG,其中,“p”表示磷酸键。典型地,这些寡核苷酸不包括在5’-和/或3’末端或其附近的GCG序列。此外,CpG通常在其5’-端侧翼有两个嘌呤(优选GpA二核苷酸)或嘌呤和嘧啶(优选GpT),并且在其3’-端侧翼有两个嘧啶,例如TpT或TpC二核苷酸。因此,分子可以包括序列GACGTT、GACGTC、GTCGTT或GTCGCT,并且这些序列的侧翼可以是若干另外的核苷酸,例如具有1-20个或更多个核苷酸,优选2至10个核苷酸并且更优选3至5个核苷酸,或这些规定范围之间的任何整数。在中心核心区域之外的核苷酸似乎非常易于改变。
此外,本文使用的ISS寡核苷酸可以是双链或单链的。双链分子在体内更稳定,而单链分子显示增强的免疫活性。此外,可以修饰磷酸酯骨架,例如二硫代磷酸酯修饰,以增强ISS分子的免疫刺激活性。如在美国专利号6,207,646中,具有硫代磷酸酯骨架的CpG分子优先活化B细胞,而具有磷酸二酯骨架的那些优先活化单核细胞(巨噬细胞、树突细胞和单核细胞)和NK细胞。
已经描述了不同类别的CpG核酸。一类对于活化B细胞是有效的,但是在诱导IFN-α和NK细胞活化方面是相对弱的。该类别称为B类。B类CpG核酸是完全稳定的并且在某些优选的碱基背景中包括未甲基化的CpG二核苷酸。参见,例如,美国专利号6,194,388;6,207,646;6,214,806;6,218,371;6,239,116;以及6,339,068,通过引用以其全文结合在此。另一类对于诱导IFN-α和NK细胞活化是有效的,但是在刺激B细胞时是相对弱的;该类别称为A类。A类CpG核酸典型地在5’和3’端具有稳定的聚G序列,并且具有至少6个核苷酸的含回文磷酸二酯CpG二核苷酸的序列。参见,例如,PCT公开号WO 0122990,通过引用将其全部内容结合于此。另一类CpG核酸激活B细胞和NK细胞并诱导IFN-α;该类别称为C类。C类CpG核酸通常是完全稳定的,包括B类型序列和富含GC的回文或近回文序列。这类描述于PCT公开号WO03/015711中,其全部内容通过引用结合在此。
可以使用本领域公知的标准技术容易地测试ISS分子刺激免疫应答的能力。例如,使用在此描述的免疫测定容易地确定分子刺激体液和/或细胞免疫应答的能力。此外,佐剂组合物和抗原可以与ISS一起给药或不与ISS一起给药以确定免疫应答是否增强。
用于在本发明的组合物中使用的CpG寡核苷酸的示例性非限制性实例包括那些寡核苷酸5’TCCATGACGTTCCTGACGTT3’(SEQ ID NO:8),称为CpG ODN 1826,B类CpG;5’TCGTCGTTGTCGTTTTGTCGTT3’(SEQ ID NO:9),称为CpG ODN 2007,B类CpG;5’TCGTCGTTTTGTCGTTTTGTCGTT3’(SEQ ID NO:10),也称为CPG7909或10103,B类CpG;5’GGGGACGACGTCGTGGGGGGGGG3’(SEQ ID NO:11),称为CpG 8954,A类CpG;以及5’TCGTCGTTTTCGGCGCGCGCCG3’(SEQ ID NO:12),也称为CpG 2395或CpG 10101,C类CpG。所有上述B和C类分子是完全硫代磷酸酯化的。
用于本发明组合物的非CpG寡核苷酸包括双链聚核糖肌苷酸:聚核糖胞苷酸,也称为聚(I:C);以及非CpG寡核苷酸5’AAAAAAGGTACCTAAATAGTATGTTTCTGAAA3’(SEQ ID NO:13)。
通常,三重佐剂组合物中存在的ISS将代表每剂约0.01至约1000μg/kg,典型地从约0.05至约500μg/kg,如从1至100μg/kg、或5至50μg/kg,或这些范围内的任何量的ISS。本领域技术人员可以确定ISS的量以及ISS与三重佐剂组合物中其他组分的比率。
聚阴离子聚合物
本发明的聚阴离子聚合物是当存在于三重佐剂组合物中时由于阴离子组成重复单元(例如,含有硫酸根、Y磺酸根、羧酸根、磷酸根和硼酸根基团的单元)的存在而带负电荷的聚合物。组成重复单元或I单体是指聚合物的最小结构单元。聚阴离子聚合物可以是包含两种或更多种不同阴离子组成重复单元的聚阴离子杂聚物,或者可以是由单个阴离子组成重复单元组成的聚阴离子均聚物。不是每个单体/重复单元都需要带负电。
用于这些佐剂组合物中的聚阴离子聚合物可以是化学聚合物并且可以包含从获得来自下组的阴离子组成重复单元,该组例如但不限于丙烯酸、甲基丙烯酸、马来酸、富马酸、乙基磺酸、乙烯基硫酸、乙烯基磺酸、苯乙烯磺酸、乙烯基苯基硫酸、2-甲基丙烯酰氧基乙烷磺酸、3-甲基丙烯酰氧基-2羟基丙磺酸、3-甲基丙烯酰氨基-3-甲基丁酸、丙烯酰胺甲基丙磺酸、乙烯基磷酸、4-乙烯基苯甲酸、3-乙烯基氧基丙烷-1-磺酸、N-乙烯基琥珀酰亚胺酸、以及上述的盐。
替代性地,本发明所用的聚阴离子聚合物可以是寡糖或多糖,例如葡聚糖。
此外,聚阴离子聚合物可以是寡肽或多肽。此类肽可以是D-或L-肽,并且可以包括阴离子的构成重复单元(或单体),诸如,L-天冬氨酸、D-天冬氨酸、L-谷氨酸、D-谷氨酸、非天然阴离子氨基酸(或其盐或阴离子化学衍生物)。
在某些实施方式中,聚阴离子聚合物可以是聚甲基丙烯酸甲酯聚合物以及衍生自聚(丙交酯)和聚(丙交酯-共-乙交酯)(被称为PLG)的聚合物。参见,例如,Jeffery等人,Pharm.Res.(1993)10:362-368;以及McGee等人,J.Microencap.(1996)。
在一些实施方式中,聚阴离子聚合物是聚磷腈。聚磷腈是高分子量的水溶性聚合物,其含有交替的磷和氮原子的主链以及在每个磷原子处连接的有机侧基。参见,例如,Payne等人,Vaccine(1998)16:92-98;Payne等人,Adv.Drug.Deliv.Rev.(1998)31:185-196。当与目的化合物如抗原和其他佐剂混合时,聚磷腈可以形成非共价复合物,增加其稳定性并允许多聚体呈递。已知多于700种具有不同化学和物理性质的聚磷腈。关于综述,参见,Mark等人,“Inorganic Polymers,2nd Edition”,牛津大学出版社(Oxford UniversityPress),2005。典型地,与本发明的三重佐剂组合物一起使用的聚磷腈将采取水溶液中的聚合物或聚合物微粒的形式,具有或不具有包封的或吸附的物质(诸如,抗原或其他佐剂)。
例如,佐剂组合物的聚磷腈组分可以为可溶性聚磷腈,例如具有含有例如羧酸、磺酸或羟基结构部分的离子化或可离子化侧基和在使用条件下易于水解以向聚合物赋予可生物降解性质的侧基的聚磷腈聚电解质。此类聚磷腈聚电解质是众所周知的并且描述于例如美国专利号5,494,673;5,562,909;5,855,895;6,015,563;以及6,261,573,通过引用以其全文结合在此。
或者,交联微粒形式的聚磷腈聚合物也可用于本发明佐剂组合物中。此类交联的聚磷腈聚合物微粒是本领域熟知的并且描述于例如美国专利号5,053,451;5,149,543;5,308,701;5,494,682;5,529,777;5,807,757;5,985,354;以及6,207,171,通过引用以其全文结合在此。
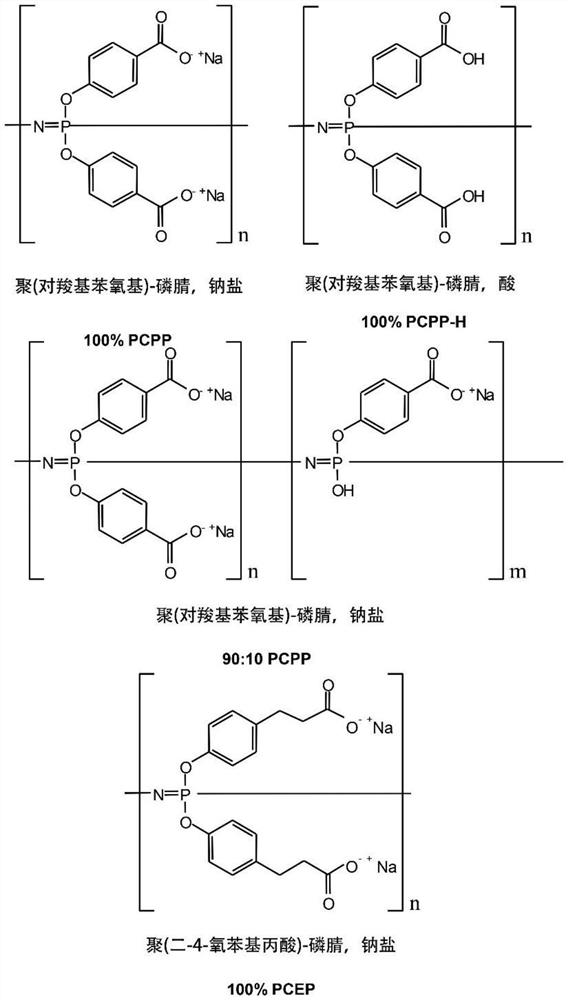
用于本发明方法的示例性聚磷腈聚合物和三重佐剂组合物示于图13中并且以各种形式(诸如,钠盐或酸性形式)包括聚[二(羧酰苯氧基钠)磷腈](PCPP)和聚(二-4-氧基苯基丙酸酯)磷腈(PCEP),以及由不同百分比的具有羟基的PCPP或PCEP共聚物组成的聚合物,诸如,90:10PCPP/OH。用于合成这些化合物的方法是已知的并且描述于以上提及的专利中,以及Andrianov等人,Biomacromolecules(2004)5:1999;Andrianov等人,Macromolecules(2004)37:414;Mutwiri等人,Vaccine(2007)25:1204;以及在美国专利号9,408,908和9,061,001中,其各自通过引用以其全文结合在此。
存在于三重佐剂组合物中的聚磷腈的典型量将表示从约0.01至约2500μg/kg,典型地从约0.05至约500μg/kg(诸如,从0.5至100μg/kg、或1至50μg/kg或这些值内的任何量)。本领域技术人员可以确定三重佐剂组合物中聚磷腈的量以及聚磷腈与其他组分的比率。
粘膜粘附脂质载体
然后将所选择的HDR、ISS和聚磷腈组合以产生如在本文实施例和美国专利号9,408,908和9,061,001中描述的三重佐剂组合物,各自通过引用以其全文结合在此。本领域的技术人员可以确定存在的ISS:HDR:聚磷腈的比率,这将取决于所使用的具体组分。例如,在聚(I:C)/IDR-1002/PCEP的情况下,组分可以1:2:1(w/w/w)的比率存在。然而,应当理解,这仅是示例性的,其他比例将用于本发明组合物中。然后将这种三重佐剂组合物与如在本文所描述的脂质组合物组合,以形成带正电的粘膜粘附脂质载体系统,诸如,包封佐剂组合物的阳离子脂质体。术语“脂质体”是指由一个或多个同心有序的脂双层组成的包封水相的囊泡。水相可以含有三重佐剂组合物和任选的待递送至受试者的抗原。脂质体最终变得可渗透并且粘膜地释放包封的组分。这可以例如以被动的方式完成,其中,脂质体双层通过体内各种试剂的作用随时间降解。替代性地,可以使用诱导脂质体囊泡中的渗透性变化的试剂来实现活性剂释放。例如,当脂质体被靶细胞内吞时,它们改变内体膜并且由此引起从内体释放。这种去稳定化被称为融合发生(fusogenesis)。1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)是许多融合系统的基础。
在其他实施方式中,这些阳离子脂质体借助于聚电解质非共价吸引与三重佐剂组合物相互作用,导致产生纳米颗粒的缩合反应。参见,例如,Bloomfield,V.A.,Biopolymers(1991)31:1471-1481;Bloomfield,V.A.,Biopolymers(1997)44:269-282;Morris等人,Curr.Opin.Biotechnol.(2000)11:461-466;以及Wadhwa等人,Bioconjug.Chem.(1997)8:81-88。本领域的技术人员可以确定三重佐剂ISS:HDR:聚磷腈与阳离子脂质体的比率,这将取决于所使用的具体组分。这些组分的比率将确定是否形成了阴离子、中性或阳离子脂质纳米颗粒缩合物,其中阳离子脂质体纳米颗粒是优选的并且在实施例中示出。本领域技术人员可以确定三重佐剂ISS:HDR:聚磷腈与阳离子脂质体的比率,这将影响缩合的脂质纳米颗粒的粒度。还有可能使用处于以下形式的脂质:胶束、多层囊泡、小的单层囊泡、大的单层囊泡、外来体或在有机溶剂(例如乙醇、甲醇、氯仿等)中的溶液。
用于本发明的脂质体可以是单层囊泡(具有单膜双层)或多泡囊泡(洋葱样结构,其特征在于多个膜双层,每个膜双层通过水层与下一膜双层分开)。双层由具有疏水“尾部”区域和亲水“头部”区域的两个脂质单层组成。膜双层的结构是这样的:脂质单分子层的疏水性(非极性)“尾部”朝向双层的中心,而亲水性“头部”朝向水相。
存在许多用于制备脂质体并用治疗性化合物装载脂质体的方法。最简单的装载方法是通过被动捕获,其中,将干燥的脂质膜与包含水溶性试剂的水溶液水合以形成脂质体。其他被动截留方法涉及脱水-再水化方法,其中将预先形成的脂质体添加到药物的水溶液中,并且通过冻干、蒸发或通过冻融处理使混合物脱水,该冻融处理使用多层囊泡的重复冷冻和融化以改善水化并因此增加负载。为了提高截留效率,可以使用高脂质浓度或脂质组分的特定组合。
因此,有多种方法可以用于制备脂质体,例如但不限于超声处理、挤出、高压/均化、微流化、去污剂透析、钙诱导的小脂质体囊泡融合和醚融合方法,所有这些都是本领域技术人员已知的。用于制备脂质体的方法描述于例如Szoka等人,Ann.Rev.Biophys.Bioeng(1980)9:467;美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028、4,946,787,其各自通过引用以其全文结合在此;PCT公开号WO9117424,通过引用将其全部并入本文中;Deamer等人,Biochim.Biophys.Acta(1976)443:629-634;Fraley等人,Proc.Nat1.Acad.Sci.USA(1979)76:3348-3352;Hope等人,Biochim.Biophys.Acta(1985)812:55-65;Mayer等人,Biochim.Biophys.Acta(1986)858:161-168;Williams等人,Proc.Nat1.Acad.Sci.USA(1988)85:242-246;脂质体(Ostro(ed.),Current Edition,第1章);Hope等人,Chem.Phys.Lip.(1986)40:89(1986);Gregoriadis,脂质体技术;以及Lasic,脂质体:从物理到应用。
总体上,颗粒是从非反应性的、生物相容的并且以药物级纯度可获得的材料生产的。这种或这些活性剂将通过颗粒降解、侵蚀、溶胀、或扩散出基质而在体内释放。因此,颗粒材料及其降解产物都应当是生物相容的。此外,颗粒材料应该是稳定的,能够有效地包封最佳量的活性剂,并且重要的是,具有接触覆盖粘膜上皮表面的粘液层的能力。
可以使用各种材料来产生阳离子粘膜粘附颗粒载体系统,包括阳离子脂质,例如但不限于1,2-二油酰基-3-三甲基铵-丙烷(DOTAP);1,2-二-O-十八烯基-3-三甲基铵丙烷(氯化物盐)(DOTAP);3β-[N-(N’,N’-二甲基氨基乙烷)-氨甲酰基](DC);3β-[N-(N’,N’-二甲基氨基乙烷)-氨基甲酰基]胆固醇盐酸盐(DC-Chol);二甲基双十八烷基铵(DDA);十八烷基胺(SA);二甲基双十八烷基溴化铵(DDAB);1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE);蛋或大豆L-α-磷脂酰胆碱(EPC);胆固醇(Chol);二硬脂酰磷脂酰胆碱(DSPC);1,2-二肉豆蔻酰基-3-三甲基铵-丙烷(DMTAP);二肉豆蔻酰磷脂酰胆碱(DMPC);神经酰胺氨基甲酰基-精胺(CCS);N4-胆固醇-精胺HCL盐;以及一种、两种、三种或更多种阳离子脂质,诸如,超过一种以上列出的阳离子脂质的各种组合;或阳离子或磷脂的溶血脂质衍生物。脂质体还可以包括不同糖(诸如,海藻糖,例如,海藻糖6,6,9-二山嵛酸酯(TDB)、蔗糖、乳糖、甘露醇)或其他本领域已知的常见冷冻保护剂和冻干保护剂。
因此,例如,阳离子脂质体可以包括DDAB和DOPE(DDAB/DOPE);DDAB、EPC和DOPE(DDAB/EPC/DOPE);SA和Chol(SA/Chol);EPC和Chol(EPC/Chol);SA、EPC和Chol(SA/EPC/Chol);DOTAP/DC/Chol;DDA和TDB(DDA/TDB);DSPC、TDB和DDA(DSPC/TBD/DDA);DMTAP和DMPC(DMTAP/DMPC),或阳离子脂质的任何组合,只要脂质体保留接触粘液层的能力。上述组合仅是示例性的,本领域技术人员可以确定其他组合。
当使用多于一种阳离子脂质时,组分将以允许与粘液层接触并随后释放脂质体内容物的摩尔比存在。此类比率的非限制性实施例是例如50:50、60:40、75:25、或在DDAB:DOPE的这些范围内的任何整数;90:10;80:20;75:25、70:30、或这些范围内的任何整数SA:Chol;90:10;80:20;75:25、70:30、或这些范围内的任何整数EPC:Chol;40:50:10DDAB:EPC:DOPE;和40:50:10SA/EPC/Chol。应当理解,这些比率可以变化并且上述量仅是示例性的。本领域技术人员将能够确定与特定组合一起使用的可接受的摩尔比。
典型地,为了在本发明中使用,粘膜粘附颗粒的平均直径将在纳米范围内,诸如,从1nm至1000nm,例如10nm至500nm,20nm至250nm,诸如,在300…250…200…150…100…50nm以下,等等。可以使用各种技术中的任一种来测量粒度,诸如实施例中所描述的动态光散射。
关于阳离子脂质体产生和用于粘膜免疫的用途的综述,参见例如Chadwick等人,Advanced Drug Delivery Reviews(2010)62:394-407;以及Boddupalli等人,J.Adv.Pharm.Technol.Res(2010)1:381–387。
疫苗抗原
如上所描述,粘膜粘附载体系统能够递送至粘膜以增强对共递送的疫苗抗原的局部免疫应答,并且在一些情况下系统免疫。当佐剂组合物具有比当量的抗原而不通过粘膜粘附性脂质载体系统递送时引起的免疫应答更大的能力时,当通过如本文所述的粘膜粘附脂质载体系统递送时,包含宿主防御肽、聚磷腈和免疫刺激序列的佐剂组合物相对于选择的抗原增强免疫应答。可以通过向动物给药抗原和粘膜粘附脂质载体系统和抗原对照并且使用本领域公知的标准测定(诸如,放射免疫测定和ELISA)比较针对两者的抗体滴度来确定这种增强的免疫原性。
与佐剂组合物一起使用的抗原包括但不限于病毒、细菌、分枝杆菌、真菌或寄生虫来源的抗原。
例如,本发明的佐剂组合物可以与抗原组合使用以治疗或预防由细菌(包括革兰氏阴性细菌和革兰氏阳性细菌)引起的多种感染。用于刺激粘膜免疫的特别有用的抗原将衍生自侵入粘膜的病原体,例如但不限于侵入呼吸道、GI道、泌尿生殖道和眼睛的病原体。
抗原可以衍生自的细菌病原体的非限制性实施例包括革兰氏阴性细菌和革兰氏阳性细菌。革兰氏阳性细菌包括但不限于巴斯德氏菌属物种、葡萄球菌属物种和链球菌属物种。革兰氏阴性细菌包括但不限于大肠杆菌、细胞内劳氏菌、假单胞菌属物种、以及沙门氏菌物种。传染性细菌的具体实施例包括但不限于:幽门螺杆菌、伯格氏螺杆菌、嗜肺军团菌、分枝杆菌属物种(例如,结核分枝杆菌、鸟分枝杆菌、胞内分枝杆菌、卡那西分枝杆菌、戈氏分枝杆菌)、金黄色葡萄球菌、淋病奈瑟球菌、脑膜炎奈瑟球菌、单核细胞增生李斯特菌、酿脓链球菌(A组链球菌)、无乳链球菌(B组链球菌)、链球菌(病毒组)、粪链球菌、牛链球菌、链球菌(厌氧菌属)、肺炎链球菌、致病性弯曲杆菌属、肠球菌属、流感嗜血杆菌、拮抗芽孢杆菌、白喉棒状杆菌、棒状杆菌属、丹毒丝菌、产气荚膜梭菌、破伤风梭菌、产气肠杆菌、肺炎克雷伯菌、多杀巴斯德氏菌、拟杆菌属、核梭菌、串珠状链球菌、苍白密螺旋体、百日咳密螺旋体、钩端螺旋体、立克次氏体、以及以色列放线菌。
例如,本发明的佐剂组合物可与包括百日咳杆菌、副百日咳杆菌、抗支气管炎杆菌等的各种博尔德杆菌属中的任何一种;包括脑膜炎奈瑟菌、淋病奈瑟菌等的各种奈瑟菌属;包括但不限于沙门氏菌的各种肠杆菌科,诸如,鼠伤寒沙门氏菌、肠炎沙门氏菌、志贺氏菌、福氏沙门氏菌、大肠埃希菌、大肠杆菌0157:H7、克雷伯菌、肠杆菌、沙雷氏菌、变形杆菌、摩根杆菌、普罗维登氏菌、耶尔森菌、小肠结肠炎耶尔森菌、李斯特菌、单核细胞增生性李斯特菌、金黄色葡萄球菌等;各种假单胞菌,诸如,铜绿假单胞菌;担状种,诸如,猪链球菌、结核链球菌、无乳链球菌、失乳链球菌、肺炎链球菌、化脓链球菌等;各种放线杆菌种,包括但不限于胸膜肺炎链球菌、猪链球菌、化脓链球菌等。
这些佐剂化合物可以与抗原组合使用以治疗或预防由不适当的食物处理引起的疾病以及由食物传播的病原体引起的疾病,诸如但不限于肠炎沙门氏菌、鼠伤寒沙门氏菌、大肠杆菌O157:H7、小肠结肠炎耶尔森氏菌、弗氏志贺氏菌、单核细胞增多性李斯特菌、以及金黄色葡萄球菌。另外,这些佐剂组合物还可用于与来自引起医院感染的病原体的抗原组合,这些病原体例如但不限于产生广谱β-内酰胺酶(ESBL)并且因此具有使β-内酰胺抗生素失活的能力的病原体。这些酶由各种细菌产生,包括肺炎克雷伯氏菌、大肠杆菌和奇异变形杆菌。另外,这些佐剂组合物可以与抗原组合使用以治疗或预防由病原微生物(诸如,金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、不动杆菌、肺炎克雷伯菌、阴沟肠杆菌、大肠杆菌、变形杆菌和白色念珠菌等真菌)对皮肤的生物污染引起的疾病。
这些佐剂组合物还可以与抗原组合使用以治疗或预防呼吸道病症(诸如,由肺炎链球菌、流感嗜血杆菌和铜绿假单胞菌引起的呼吸道病症)以及性传播疾病,包括但不限于衣原体感染(诸如,由沙眼衣原体引起的衣原体感染)和淋球菌感染(诸如,由淋病奈瑟球菌引起的淋球菌感染)。
此外,佐剂组合物可以与抗原一起使用以治疗或预防多种病毒性疾病,诸如但不限于由小核糖核酸病毒科(Picornaviridae)(例如,髓灰质炎病毒等);杯状病毒科;披膜病毒科(例如,风疹病毒、登革热病毒等);黄病毒科;冠状病毒科;呼肠孤病毒科;双RNA病毒科;弹道病毒科(例如,狂犬病病毒等);丝状病毒科;副粘病毒科(例如,腮腺炎病毒、麻疹病毒、呼吸道合胞病毒等);正粘病毒科(例如,甲型、乙型和丙型流感病毒等);布尼亚病毒科(Bunyaviridae);沙粒病毒科(Arenaviridae);成员引起的那些疾病;参见,例如Virology,第3版(W.K.Joklik ed.1988);Fundamental Virology,第2版B.N.Fields和D.M.Knipeeds.,1991),关于这些和其他病毒的描述。病毒的其他具体实施例包括疱疹病毒科病毒,例如,牛疱疹病毒(BHV)和1型和2型人单纯疱疹病毒(HSV)(诸如,BHV-1、BHV-2、HSV-1和HSV-2)、水痘带状疱疹病毒(VZV)、EB病毒(EBV)、巨细胞病毒(CMV)、HHV6和HHV7;各种肝炎病毒引起的疾病,诸如,HAV、HBV和HCV;乳头瘤病毒和轮状病毒等引起的疾病。
影响可衍生抗原或以减毒或灭活形式提供抗原的人类和/或非人类脊椎动物的病毒病原体的非限制性实施例包括逆转录病毒、RNA病毒和DNA病毒。逆转录病毒的组包括简单逆转录病毒和复杂逆转录病毒。简单逆转录病毒包括B型逆转录病毒、C型逆转录病毒和D型逆转录病毒的亚组。B型逆转录病毒的实施例是小鼠乳腺肿瘤病毒(MMTV)。C型逆转录病毒包括亚组C型组A(包括劳氏肉瘤病毒、禽类白血病病毒(ALV)和禽类成髓细胞增多症病毒(AMV))和C型组B(包括鼠类白血病病毒(MLV)、猫类白血病病毒(FeLV)、鼠类肉瘤病毒(MSV)、长臂猿白血病病毒(GALV)、脾坏死病毒(SNV)、网状内皮细胞增多症病毒(RV)和猿类肉瘤病毒(SSV))。D-型逆转录病毒包括Mason-Pfizer猴病毒(MPMV)和1型猿猴逆转录病毒(SRV-1)。复杂逆转录病毒包括慢病毒、T细胞白血病病毒和泡沫病毒的亚组。慢病毒包括HIV-1、HIV-2、SIV、Visna病毒、猫免疫缺陷病毒(FIV)和马感染性贫血病毒(EIAV)。T细胞白血病病毒包括HTLV-1、HTLV-II、猿T细胞白血病病毒(STLV)和牛白血病病毒(BLV)。泡沫病毒包括人泡沫病毒(HFV)、猿泡沫病毒(SFV)和牛泡沫病毒(BFV)。
可以衍生抗原的其他RNA病毒的实施例包括但不限于以下:呼肠孤病毒科的成员,包括正呼肠孤病毒属(哺乳动物和禽类逆转录病毒的多种血清型)、狂犬病病毒(蓝舌象病毒、美洲绿蝽病毒、Kemerovo病毒、非洲马病病毒和科罗拉多蜱热病毒)属、轮状病毒属(人轮状病毒、内布拉斯卡小牛腹泻病毒、鼠轮状病毒、猿轮状病毒、牛或绵羊轮状病毒、禽轮状病毒);小核糖核酸病毒科,包括肠道病毒属(脊髓灰质炎病毒、柯萨奇病毒A和B、肠道细胞病变人类孤病毒(ECHO)、甲型肝炎病毒、猿猴肠道病毒、鼠脑脊髓炎(ME)病毒、脊髓灰质炎病毒、牛肠道病毒、猪肠道病毒、心脏病毒属(脑心肌炎病毒(EMC)、门戈病毒)、鼻病毒属(人类鼻病毒,包括至少113种亚型;其他鼻病毒)、口蹄疫病毒属(口蹄疫病(FMDV);杯状病毒科,包括猪病毒的水疱性黄斑狼疮、圣米古尔海蠹病毒、猫小核糖核酸病毒和诺沃克病毒;披膜病毒科,包括甲病毒属(东方马脑炎病毒、塞姆利基森林病毒、辛德毕斯病毒、基孔肯雅病毒、奥尼奥-尼奥格病毒、罗斯河病毒、委内瑞拉马脑炎病毒、西方马脑炎病毒)、黄病毒属(蚊传黄热病毒、登革热病毒、日本脑炎病毒、圣路易斯脑炎病毒、墨雷谷脑炎病毒、西尼罗河病毒、昆金病毒、欧洲中枢蜱传病毒、东部蜱传病毒、柯萨诺森林病毒、路易斯III病毒、波瓦桑病毒、奥姆斯克出血热病毒)、风疹病毒属(风疹病毒)、瘟病毒属(粘膜病病毒、BVDV、霍霍乱病毒、边界病病毒);布尼亚病毒科,包括布尼病毒属(Bunyamwera和相关病毒,加利福尼亚脑炎组病毒)、Phlebo病毒属(桑德菲西利亚病毒、裂谷热病毒)、Nairovirus属(克里米亚-刚果出血热病毒、Nairobi绵羊病病毒)和Uuku病毒属(Uukuniemi和相关病毒);正粘病毒科,包括流感病毒属(甲型流感病毒,许多人亚型);猪流感病毒和禽流感病毒和马流感病毒;乙型流感(许多人亚型)和C型流感(可能的单独属);副粘病毒科,包括副粘病毒属(1型副流感病毒、仙台病毒、血吸着病毒、2型至5型副流感病毒、新城疫病毒、腮腺炎病毒)、麻疹病毒属(麻疹病毒、亚急性硬化性全脑炎病毒、瘟热病毒、林德尔害虫病毒)、肺炎病毒属(小鼠的呼吸道合胞病毒(RSV)、牛呼吸道合胞病毒(BRSV)和肺炎病毒);森林病毒;弹状病毒科,包括水泡病毒(VSV)属、Chandipura病毒、Flanders-Hart Park病毒)、Lyssavirus(狂犬病病毒)、鱼弹状病毒和两种可能的弹状病毒(马尔堡病毒和埃博拉病毒);沙粒病毒科,包括淋巴细胞性脉络丛脑膜炎病毒(LCM)、Tacaribe病毒复合物和Lassa病毒;冠状病毒科,包括SARS病毒、传染性支气管炎病毒(IBV)、小鼠肝炎病毒、人肠道冠状病毒、猪流行性腹泻病毒(PEDV)和猫传染性腹膜炎(猫冠状病毒)。例如,对于RSV疫苗,有用的抗原包括衍生自融合(F)蛋白、附着(G)蛋白、和/或基质(M)蛋白、或其组合的那些。这些蛋白质是众所周知的并且可以如美国专利号7,169,395中所描获得,通过引用以其全文结合在此。
抗原可以衍生自的示例性DNA病毒包括但不限于:痘病毒科,包括正痘病毒属(重型天花、轻型天花、猴痘、牛痘、水牛痘、兔痘、埃奇罗米利亚)、麻风痘病毒属(粘液瘤、纤维瘤)、禽痘病毒属(鸡痘、其他禽痘病毒)、羊痘病毒属(羊痘、山羊痘)、猪痘病毒属(猪痘)、副痘病毒属(传染性脓疱性皮炎病毒、假牛痘、牛丘脑口炎病毒);虹膜病毒属(非洲猪热病毒、青蛙病毒2和3、鱼的淋巴细胞病毒);疱疹病毒属,包括α-疱疹病毒(1型和2型单纯疱疹病毒、水痘-带状疱疹病毒、雌性流产病毒、雌性疱疹病毒2和3型、伪狂犬病病毒、传染性牛角膜结膜炎病毒、传染性牛鼻气管炎病毒、猫鼻气管炎病毒、传染性喉气管炎病毒)、β-疱疹病毒(人巨细胞病毒和猪、猴和啮齿动物的巨细胞病毒);γ-疱疹病毒(EB病毒(EBV)、马立克氏病病毒、风疹疱疹、麻疹病毒、疱疹病毒、豚鼠疱疹病毒、卢卡肿瘤病毒);腺病毒鼠,包括马斯塔登病毒属(人亚组A、B、C、D、E和未分组的);猿腺病毒(至少23种血清型)、传染性犬肝炎和牛、猪、绵羊、蛙和许多其他物种的腺病毒、Avi腺病毒属(Avian腺病毒);和不可培养的腺病毒;乳头状病毒属,包括乳头瘤病毒属(人乳头瘤病毒、牛乳头瘤病毒、牛兔乳头瘤病毒、以及其他种类的不同病原性乳头瘤病毒)、多瘤病毒属(多瘤病毒、猴空泡化剂(SV-40)、兔空泡化剂(RKV)、K病毒、BK病毒、JC病毒、以及其他灵长类多瘤病毒,例如淋巴营养乳头瘤病毒);细小病毒属,包括腺相关病毒属、细小病毒属(猫全白细胞减少症病毒、牛细小病毒、犬细小病毒、猪细小病毒、亚历山金病病毒等)。最后,DNA病毒可以包括不适合于以上属的病毒,例如库鲁和克罗茨费尔特-雅各布病(Creutzfeldt-Jacob disease)病毒以及慢性感染性神经病性试剂(Chronic Infectious Neuropathic Agents)。
类似地,本发明的佐剂组合物可用于针对多种寄生虫,诸如但不限于疟原虫,例如,疟疾疟原虫、约氏疟原虫、恶性疟原虫、卵形疟原虫和间日疟原虫、弓形虫、日本血吸虫、大利什曼原虫、克鲁斯锥虫等。
此外,这些佐剂组合物可用于增强针对多种真菌病原体的免疫应答,这些真菌病原体诸如但不限于引起念珠菌病、隐球菌病、曲霉病、接合菌病、芽生菌病、球孢子菌病、组织胞浆菌病、副球孢子菌病、孢子丝菌病的那些真菌。抗原可以衍生自的传染性真菌的具体非限制性实施例包括:新型隐球菌、荚膜组织胞浆菌、粗球孢子菌、皮炎芽生菌、沙眼衣原体、白色念珠菌。
其他医学相关微生物已在文献中广泛描述。参见,例如,C.G.A Thomas,MedicalMicrobiology,Bailliere Tindall,Great Britain 1983,其全部内容通过引用结合在此。
因此,很明显,这些粘膜粘附脂质载体可以与多种抗原组合使用以增强免疫应答,从而预防或治疗疾病(诸如,人类中的感染性疾病以及非人类动物中的疾病)。
这些抗原可以作为减毒、灭活或亚基疫苗组合物提供。此外,可以在核酸构建体中提供抗原用于DNA免疫。用于制备DNA抗原的技术是本领域公知的,并且描述于例如美国专利号5,399,346、5,580,859、5,589,466,通过引用以其全文结合在此。
脂质包封的三重佐剂组合物还可与多种商业疫苗组合使用,以便增强对共递送抗原的粘膜免疫应答。例如,这些佐剂组合物可以与可商购的人和动物疫苗(包括但不限于百日咳疫苗和组合疫苗(诸如,各种全细胞(wP)和无细胞疫苗(aP))共给药。此类疫苗的非限制性实施例包括称为TRIPEDIA、TRIPACEL、QUADRACEL、TETRAVAL、TETRACT-Hib、PENTACT-Hib、PENTACEL、PENTAVAC和HEXAVAC(Aventis,Bridgewater,NJ);INFANRIX和PEDIARIX(GlaxoSmithKline,Research Triangle Park,NC);CERTIVA(North American Vaccine,Beltsville,MD);Biothrax;TICE BCG;Mycobax;HiBTITER;Pedvax HIB;ActHIB;Comvax;Havrix;VAQTA;Twinrix;Recombivax HB;Engerix-B;流感疫苗;氟维菌素;Fluzone;JE-Vax;Attenuvax;M-M-Vax;M-M-R II;Menumone-A/C/Y/W-135;Mumpsvax;Pneumovax 23;Prevnar;Poliovax;IPOL;Imovax;RabAvert;Meruvax II;Dryvax;TYPHIM Vi;VIVOTIF;Varivax;YF-Vax。
可以在脂质包封的三重佐剂组合物之前、同时或之后给药抗原/疫苗。如果同时给药,这些抗原可以被封装或以其他方式与粘膜粘附脂质载体缔合或在分开的制剂中同时递送。如果在用抗原免疫之前给药脂质包封的三重佐剂组合物,则可以早在免疫之前5-10天、优选在免疫之前3-5天并且最优选在免疫之前1-3或2天给药它。
本发明所用的抗原可用本领域熟知的标准技术制备。例如,抗原可以直接从目的生物体分离,或可以使用上述技术重组或合成产生。
制剂和给药
配制脂质包封的三重佐剂组合物和抗原的一些实施例用于递送至粘膜,例如递送至口腔、舌下、鼻道、肺、胃肠道、眼、泌尿生殖道等。因此,制剂包括栓剂、气雾剂、鼻内、口服制剂和持续释放制剂。制备此类制剂的方法是本领域已知的并且描述于例如Remington’sPharmaceutical Sciences,Mack Publishing Company,Easton,Pennsylvania,最新版本中。
鼻内制剂通常将包括药学上可接受的赋形剂,这些赋形剂既不引起对鼻粘膜的主要刺激也不显著干扰睫毛功能。稀释剂(诸如,水、盐水或其他已知物质)可以与本发明一起使用。鼻制剂还可以包含防腐剂,例如但不限于氯丁醇和苯扎氯铵。可以存在表面活性剂以增强这些主题蛋白被鼻粘膜吸收。可以使用滴鼻剂、喷雾剂、凝胶、悬浮液和乳液、吸入器和/或雾化器鼻内递送试剂。因此,鼻内制剂可以通过诸如吸入、喷雾、液体流灌洗、雾化或鼻灌洗的方法给药。给药可以是对窦腔或肺。
对于栓剂,赋形剂将包括传统的粘合剂和载体,诸如,聚链烷二醇或甘油三酯。此类栓剂可以由包含约0.5%至约10%(w/w),优选约1%至约2%的活性成分的混合物形成。
口服载体包括通常采用的赋形剂,例如药物级甘露醇、乳糖、淀粉、硬脂酸镁、硬脂酸镁、糖精钠纤维素、碳酸镁等。这些口服疫苗组合物可以采用溶液、悬浮液、片剂、丸剂、胶囊、缓释制剂或粉末的形式,并且包含约10%至约95%,优选约25%至约70%的活性成分。
气雾剂递送系统典型地使用喷雾器和其他吸入器装置和系统。通过吸入给药需要能够成功雾化的制剂和能够产生有用的药物气溶胶的给药系统。这些颗粒或小滴应该具有足够的尺寸和质量以便被携带至远端肺部或沉积在近端气道上以便产生治疗效果。
配制脂质包封的三重佐剂组合物和抗原的一些实施例用于通过注射递送至肌肉组织。此类实施方式可以包括药学上适合的赋形剂、稀释剂、以及载体。此类药学上可接受的赋形剂、稀释剂和载体的实施例可以在Remington:The Science and Practice ofPharmacy(2006)中找到。同样,药学上可接受的载体、稀释剂和赋形剂的实施例可以在例如1999年出版的Remington’s Pharmaceutical Sciences(2000-第20版)和美国药典:国家处方集(USP 24NF19)中找到,这些文献各自通过引用以其全文结合在此。
疫苗接种以单剂量实现或根据需要间隔重复,如本领域技术人员可以容易地确定的。例如,初次剂量可以在每周、每月、或更长的间隔后跟随一个或多个加强剂量。适当的剂量取决于不同的参数,包括受体(例如,成人或婴儿)、具体的疫苗抗原、给药途径和频率、以及所期望的作用(例如,保护和/或治疗),如本领域的普通技术人员可以确定的。通常,通过粘膜途径以1至25μg/kg的量给药含有三重佐剂组合物和任选地疫苗抗原的粘膜粘附脂质载体系统。
试剂盒
本发明还提供了试剂盒。在某些实施方式中,本发明的试剂盒包括一个或多个容器,这些容器包括粘膜粘附脂质载体,该粘膜粘附脂质载体包括三重佐剂组合物和任选地感兴趣的抗原,或者用三重佐剂组合物包封,或者包封在单独的容器中。容器可以是单位剂量、散装包装(例如,多剂量包装)或子单位剂量。
在实施方式中,这些试剂盒包含粘膜可接受的赋形剂。试剂盒可以包含任何方便的适当包装中的组分。例如,如果粘膜粘附脂质载体系统作为干燥制剂(例如,冷冻干燥或干燥粉末)提供,那么可以使用具有弹性塞子的小瓶,使得可以通过经由弹性塞子注射流体来再悬浮载体。具有非弹性的可移除封闭物(例如,密封玻璃)或弹性塞子的安瓿可以用于液体制剂。还考虑了用于与特定装置(例如,喷雾器)组合使用的包装。
这些试剂盒还可以包括适合于粘膜递送的递送装置(诸如,输注装置(诸如,微型泵、吸入器))、以及鼻给药装置(例如,雾化器)。
试剂盒还可以包括适当的一组说明书。说明书通常包括关于预期使用方法的剂量、给药方案和给药途径的信息。本发明的试剂盒中提供的说明通常是在标签或包装插页(例如,试剂盒中包括的纸张)上的书面说明,但是机器可读的说明(例如,在磁或光存储盘上携带的说明)也是预期的。
III.实验
以下是用于实施本发明的具体实施方式的实施例。提供实施例仅用于说明目的,并且不旨在以任何方式限制本发明的范围。
已经做出努力以确保关于所使用的数字(例如,量、温度等)的准确性,但是当然应该允许有一些实验误差和偏差。
实施例中使用的材料:
聚肌苷酸-聚胞苷酸(聚(I:C))A佐剂(99%纯度)获自Sigma Aldrich(加拿大)。在制剂中使用IDR-1002阳离子肽佐剂和聚(二-4-氧基苯基丙酸酯)磷腈(称为PCEP的聚磷腈)、钠盐(平均分子量大约1800X 10
IDR-1002获自Genscript(Piscataway Township,NJ)。IDR-1002的序列是Val-Gln-Arg-Trp-Leu-Ile-Val-Trp-Arg-Ile-Arg-Lys-NH2(SEQ ID NO:19)。
罗丹明标记的聚聚(I:C)来自InvivoGen(San Diego,CA USA);琼脂糖来自Invitrogen(Carlsbad,CA USA);凝胶加载染料6x来自新英格兰NBiolabs Inc.(Ipswich,MA,USA);并且无菌注射器0.2μm过滤器来自Millipore。
二甲基二十八烷基溴化铵(DDAB)来自Sigma Aldrich(St.Louis,MO,USA。脂质1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和卵L-αa-磷脂酰胆碱(EPC)来自Avanti PolarLipids(Alabaster,USA),胆固醇来自J.T Baker(Center Valley,PA USA)。
细胞系RAW 264.7获自美国典型培养物保藏中心(ATCC TIB-71
通过在1mL的体积中以1:2:1(w/w/w)比率混合150μg的聚(I:C)、300μg的IDR-1002肽和150μg PCEP来制备三重佐剂组合物(参见,Garg等人,J.Gen.Virol.(2014)95:301-306)。将稀释剂无菌过滤(0.2μm)右旋糖(5%(w/v)(D5W)并且在冰上进行制备并且在4℃下储存以在3天之内使用(参见,Garg等人,Hum.Vaccin.Immunother.(2017)13:2894-2901。通过琼脂糖凝胶电泳和在组分相互作用时发生的荧光淬灭来确认不可解离复合物的形成。
为了在三重佐剂组合物所需的水性环境中容易控制脂质组分的比例以及脂质混合物的均匀性,使用预制的脂质体制备具有三重佐剂组合物的脂质复合物。通过薄膜挤出方法制备脂质体。适当摩尔比的脂质,诸如,DDAB/DOPE 75:25;DDAB/DOPE 50:50;并且将DDAB/EPC/DOPE40:50:10溶解于氯仿中。将各种制剂在过滤空气流下干燥以在玻璃管中形成薄膜。将薄膜在冻干机中在真空下干燥4-6小时以去除有机溶剂。使用D5W将干燥的脂质膜再水化。在脂质膜水合之后,使脂质悬浮液经受冷冻-解冻10次,导致形成多层囊泡(MLV)。将所得的制剂在55-60℃下通过具有挤出机装置(Lipex挤出机)的聚碳酸酯过滤器(0.1μm Whatman,Sigma Aldrich,St.Louis,USA)挤出10次。
脂质体的平均直径通过动态光散射测定并且ζ电位在D5W稀释剂中在23℃下测量(Nano ZS,Malvern Panalytical,Westborough,MA)。通过以下所描述的磷测定对脂质体脂质浓度进行定量。
测定各种脂质体制剂和具有不同IDR-1002肽比率的三重佐剂组合物的总磷(P)含量。为此,使用Fiske和Subbarow磷测定法的修改版本。参见,例如,Chen等人,Anal.Chem.(1956)28:1756-1758;Fiske)等人,J.Biol.Chem.(1925)66:374-389;以及avantilids.com/tech-support/analytical procedures/determination-of-total-phosphorus。简言之,从磷标准溶液(0.65mM,Sigma Aldrich,St.Louis,MO,USA)一式三份制备六种标准溶液(含有0至0.23μmol的磷),然后加入0.45mL的H
在添加每种溶液之前,将每个管涡旋5分钟。将所有管再次加热至100℃持续7分钟,然后冷却至环境温度。在分光光度计中在820nm处一式三份测量吸光度,并且从标准品的线性回归曲线计算磷浓度(r
如上所描述测定磷(P)浓度。将来自脂质体的P与来自三重佐剂组合物的P的摩尔比设定为0.5:1、1:1、2:1和3:1,以覆盖一定范围的电荷摩尔比(负与正),以便凭经验确定实现阳离子超分子组装所必需的组合物,即,带正电的脂质纳米颗粒。目标是建立组分比率,这些组分比率将促进阳离子脂质体与阴离子三重佐剂组合物之间的有利的多价聚合物相互作用,从而导致缩合(参见,Bloomfield,V.A.,Biopolymers(1997)44:3)而不是总体聚集。在D5W中分别稀释脂质体和三重佐剂,并且随后混合两种组分的一致的体积比以实现不同的P摩尔比。通过涡旋混合2分钟接着在环境温度下孵育30分钟进行脂质体和三重佐剂的组合以形成脂质三重佐剂复合物。测定各种脂质体制剂和三重佐剂组合物的总P含量。使用此信息来设计所需的摩尔比以接近脂质体的脂质复合物加上三重佐剂组合物(L-TriAdj)的所期望的电荷比。将来自脂质体的P与来自TriAdj的P的摩尔比设定为0.5:1、1:1、2:1和3:1(比率分别为1、2、3和4)。
作为比较点,如先前描述的将三重佐剂制备为微粒(MP)(参见,Polewicz等人,Vaccine(2013)31:3148-3155;Garlapati等人,Vaccine(2011)29:6540-6548;Garlapati等人,Vaccine(2012)30:5206-5214),没有进一步表征。通过凝聚方法制备微粒,首先将聚(I:C)与IDR-1002肽在37℃下混合30分钟,并且分别组合PCEP和卵清蛋白抗原。然后将聚(I:C)-肽混合物与PCEP和抗原混合物合并,随后以1.95mL的NaCl比1mL的0.2%PCEP的比率逐滴添加6.2%NaCl。聚(I:C)、IDR-1002肽和PECP的重量比是10:20:10μg。在室温下20分钟后,加入8%的CaCl
脂质体、三重佐剂组合物(TriAdj)和阳离子脂质-三重佐剂纳米颗粒(L-TriAdj)的平均粒度(nm)和多分散性指数(PDI)通过动态光散射测定。通过在D5W中在23℃下的ζ电位测量(Nano ZS,Malvern Panalytical,Westborough,MA)估计表面电荷。一式三份测量样品。通过扫描电子显微镜确认粒度和特征。
发现所有脂质体制剂的平均直径<200nm,并且对于含有DDAB的那些,ζ电位是高度阳性的。过量的正电荷通过静电排斥防止颗粒聚集。0.5:1和1:1的P比率一致地导致总体可见的聚集并且不被进一步使用,可能表示有净中性表面电荷的样品。对于以3:1的P比率(比率4)含有DDAB/DOPE(75/25)的L-TriAdj,也观察到聚集并且还消除了这种组成。以下描述的体内研究使用以如上所描述的磷(脂质体:TriAdj)(比率3)的2:1摩尔比制备的L-TriAdj。L-TriAdj,DDAB/DOPE(50/50)产生了比DDAB/DOPE(75/25)更小并且更均匀的颗粒(参见表2和表3)。出于这个原因,L-TriAdj的DDAB/DOPE(50/50)组合物用于以下描述的体内研究中。DDAB/DOPE 50/50(mol/mol)、DDAB/DOPE 75/25和EggPC/chol90/10脂质体的ζ电位分别是62.5、78.6和-5.89mV。对于L-TriAdj,将对应的ζ电位值分别降低至49.7、56.4和-18mV,这些值在24小时内是稳定的(图1)。使用重量比为5:10:5、6:25:12.5:6.25或12.5:25:12.5(μg:μg:μg)的聚(I:C):IDR-1002肽:聚磷腈的TriAdj含量不显著影响使用这些脂质制剂TriAdj的粒度或ζ电位。在24小时内评估L-TriAdj的大小分析和ζ电位并且发现是稳定的。对于向小鼠给药用于功效测试的L-TriAdj和卵清蛋白的完整疫苗,发现在1μg的与L-TriAdj混合的Ova下ζ电位稳定24小时,但是当存在10μg卵清蛋白时在24小时注意到一些多分散性。
表2.脂质体的大小分析和ζ电位
表3.具有平均直径的多模态分布分析的脂质三重佐剂颗粒的粒度分析
在每个实验前新鲜制备去离子水中的粘蛋白(5mg/mL)。将L-TriAdj或脂质体与粘蛋白的混合物在环境温度下孵育30分钟,并且在23℃下进行颗粒分级和ζ电位分析(NanoZS,Malvern Panalytical,Westborough,MA)之前立即通过涡旋进行混合。一式三份测量样品。将具有数字加权的多峰分析用于颗粒分级。
为了评估粘膜粘附的潜力,在添加粘蛋白(5mg/mL)之前和之后测量脂质体、TriAdj和L-TriAdj的ζ电位。ζ电位是颗粒表面与本体液相之间的电位差的测量。在此,使用ζ电位的变化作为粘蛋白结合的替代量度,因为如果粘蛋白吸附或结合至颗粒表面,ζ电位值将变化。它不反映结合的亲和力或特异性。图2至图4显示单独的阳离子脂质体以及与三重佐剂组合物联合的阳离子脂质体与粘蛋白结合。单独构成DDAB/DOPE 50/50(图2)、DDAB/DOPE 75/25(图3)和DDAB/EPC/DOPE 40/50/10(图4)的阳离子脂质体分别显示62.5、78.6和31mV的初始ζ电位值,其在添加TriAdj(形成L-TriAdj)后显著降低。这表明脂质体与三重佐剂组合物形成复合物。三重佐剂组合物单独具有负ζ电位(-45mV)。当将粘蛋白添加至L-TriAdj时,ζ电位进一步降低,与相互作用一致。EPC/Chol 90/10(图5)用作阴性对照,并且当与TriAdj和粘蛋白混合时显示脂质体的ζ电位的轻微变化(-33mV),表明非特异性相互作用。
在小鼠巨噬细胞系RAW 267.4中通过MTS测定评估了三重佐剂组合物与L-TriAdj的细胞毒性。在37℃和5%的CO
在MTS测定中,TriAdj含量恒定在0.5:1:0.5(μg:μg:μg)/孔(图6)和0.25:0.5:0.25μg:μg:μg/孔(图7)。与DDAB/DOPE组成的脂质体(50:50)相比,单独使用三重佐剂组分的毒性更大(p<0.01)mol:mol)EPC/Chol(90:10);DDAB/EPC/DOPE(40:50:10)或L-TriAdj脂质复合物(LC)(比率3)。
为了评估脂类三重佐剂颗粒的佐剂活性,在小鼠中用卵清蛋白(Ova)疫苗的鼻内给药进行了三次体内研究。第一项研究比较了具有聚磷腈:肽:聚(I:C)的恒定重量比的L-TriAdj的两种不同的脂质组合物以及2种不同剂量的TriAdj,即,1:2:1或1:2:1(μg:μg:μg)。将Balb/c小鼠随机分成7个佐剂组(n=8/组)。小鼠也被随机分到笼子里,这样不同的治疗组就不在同一个笼子里了。除了PBS对照和Ova对照之外,所有组就在鼻内给药之前接受与佐剂混合的1μg Ova抗原(20μL;10μL/鼻孔)。治疗组:A:PBS对照(无疫苗);B:Ova对照(1μg)(仅抗原,无佐剂);组C-G接受Ova抗原和所示佐剂:C:TriAdj(5:10:5);D:L-TriAdj为DDAB/DOPE 60/40(mol/mol)(TriAdj 1:2:1);E:L-TriAdj为DDAB/DOPE60/40(TriAdj 5:10:5);F:L-TriAdj为DDAB/EPC/DOPE 45/45/10(TriAdj1:2:1);G:L TriAdj为DDAB/EPC/DOPE 45/45/10(TriAdj 5:10:5)。
在第二研究中,以与上述类似的方式进行与卵清蛋白抗原共配制的L-TriAdj与TriAdj(MP,参见上文)的钙微粒制剂的比较。在第二研究中,抗原的剂量变化为1μg或10μg,没有佐剂、与抗原混合的TriAdj、与氯化钙微粒中的抗原共配制的TriAdj、或与抗原混合的L-TriAdj。如在第一研究中,所有小鼠鼻内接受20μL。处理组(n=8只小鼠/组)为:A:Ova对照(1μg)(仅抗原,无佐剂);B:Ova对照(10μg)(仅抗原,无佐剂);组C-G全部接受作为5:10:5比率的聚(I:C):IDR-1002肽:聚磷腈的三重佐剂,但是作为以下制剂:C:在微粒佐剂中共配制的Ova 1μg;D:在微粒佐剂中共配制的Ova 10μg;E:Ova 1μg+L-TriAdj DDAB/DOPE(50/50mol/mol);F:Ova 10μg+L-TriAdj DDAB/DOPE(50/50mol/mol);G:Ova 1μg+TriAdj;H:Ova10μg+TriAdj。
在第三研究中,以与上述类似的方式进行与卵清蛋白抗原共配制的L-TriAdj和TriAdj(MP,参见上文)的钙微粒制剂两者的鼻内和肌内给药途径的比较。在第三研究中,抗原的剂量是10μg,没有佐剂或与在氯化钙微粒中与抗原共配制的TriAdj或与L-TriAdj混合。鼻内给药的小鼠接受20μL,如在第一和第二研究中;肌内给药的小鼠接受50μL(25μL/腿)。处理组(n=8只小鼠/组)是:A:在20μL中鼻内递送的Ova 10μg+L-TriAdj DDAB/DOPE(50/50mol/mol);B:以50μL肌内递送的Ova 10μg+L-TriAdj DDAB/DOPE(50/50mol/mol);C:在微粒佐剂中共配制的Ova 10μg,以20μL鼻内递送;D:在微粒佐剂中共配制的Ova 10μg,以50μL肌内递送;E:以50μL肌内递送Ova对照(10μg)(仅抗原,无佐剂)。组A-D全部以聚(I:C):IDR-1002肽:聚磷腈的5:0:5比率接受TriAdj。
在所有三个研究中,小鼠在第0天和第28天以相同剂量接种疫苗。对于第二研究(仅第10周)和第三研究,在第0、14、28、42、56和70天收集IgG1和IgG2a ELISA以及IgAELISA的血清。在第70天和第72天对小鼠实施安乐死并且收集脾(注意第三项研究:每组的两只小鼠在第70天实施安乐死,在第72天实施三只并且在第73天实施最后三只;结果没有显示安乐死当天的效果)。每个脾用于通过ELISApot测定的淋巴细胞活化测定,如下所描述。在ELISA和ELISpot测定期间,分析者对治疗组不知情。
为了测量疫苗接种后抗原特异性IgG1、IgG2a和IgA血清水平,在0、2、4、6、8和10周从小鼠收集血清。如前所描述,在收集的血清上进行ELISA。参见,Garg等人,Vaccine(2015)33:1338-1344。将板在4℃下用卵清蛋白包被过夜并且用稀释100:800的血清孵育。为了检测IgG1、IgG2a和IgA,添加生物素标记的山羊抗小鼠IgG1、IgG2a或IgA(Cat.No.A10519;IgG2a:Invitrogen Cat.No.M32315;IgA:Invitrogen Cat.No.M31115),随后是链霉亲和素-碱性磷酸酶(AP)(016–050–084,Jackson ImmunoResearch Laboratories Inc.,WestGrove,PA)。使用磷酸对硝基苯酯(Sigma-Aldrich,St.Louis,MO)作为AP底物显现比色反应。用Biorad iMark ReaderTM读取板。数据表示为效价,其代表示产生超过阴性对照平均值三个标准偏差的吸光度读数所需的稀释因子,例如,来自未接受疫苗接种的对照小鼠的血清。
为了测量来自支气管肺泡灌洗(BAL)和鼻内洗涤的抗原特异性IgG1、IgG2a和IgA水平,在安乐死时第10周在小鼠上收集这些样品。
为了从支气管肺泡灌洗(BAL1s)和鼻内清洗中测量抗原特异性IgG1,IgG2a和IgA的水平,在安乐死时第10周将这些样品收集在小鼠上。将脾通过40μm滤网(BD Falcon)筛分并且将细胞在4℃下以1000rpm沉淀10分钟。将细胞沉淀重悬于5mL Gey溶液中并且在室温下孵育10分钟。向溶液中加入9mL MEM,然后如上所描述离心两次。将最终沉淀重悬于2mLAIM V培养基(Gibco)中,并使用Millipore Scepter手持自动细胞计数器计数细胞。如先前所描述进行ELISApot测定。参见,Garlapati等人,Vaccine(2011)29:6540-6548;Garg等人,Vaccine(2015)33:1338-1344;Garg等人,Virology(2016)499:288-297。简言之,将ELISpot板(Millipore,Billerica,MA,USA)用2μg/mL的IL5或IFN-γ(BD生物科学目录(BDBiosciences Cat.NO.551216和554393))包被过夜。然后以1x 107个细胞/mL的浓度一式三份添加脾样品,并孵育过夜。用两种不同浓度的卵清蛋白刺激脾细胞:5μg/mL和10μg/mL。使用生物素酰化的IFN-γ-或IL-5-特异性山羊抗小鼠IgG(BD Biosciences),554410,554397),随后是AP-轭合的链霉亲和素和BCIP/NBT(Sigma-Aldrich,B5655)作为底物来开发代表IFN-γ-或IL-5-分泌细胞的斑点。用AID ELISpot Reader(Autoimmun DiagnostikaGmbH,Germany)计数斑点。
从小鼠中的第一体内研究获得的结果示于图8A-8J中,并且显示与单独的三重佐剂组合物(TriAdj)相比,在用较低剂量的卵清蛋白抗原(Ova)鼻内给药后,对基于脂质的复合物的显著更大的应答。在更高剂量的Ova下,两组表现同样良好。如以上所解释的,为了评估针对疫苗接种的体液(Th2型)免疫应答与细胞(Th1型)免疫应答,通过ELISA在0、4和10周测量IgG1和IgG2a的血清水平(图8A和8F)。与单独的TriAdj(p<0.01)相比,L-TriAdj(包含DDAB/DOPE与处于5:10:5重量比的聚(I:C):IDR-1002肽:聚磷腈(μg:μg:μg))的TriAdj)产生显著更高的IgG1水平,但是对于处于任一量的TriAdj的DDAB/EPC/DOPE而言情况并非如此。IgG1滴度值的秩序转化揭示,以两种剂量的TriAdj(1:2:1和5:10:5)或以5:10:5重量比配制的DDAB/EPC/DOPE接受基于DDAB/DOPE的L-TriAdj的组比以5:10:5重量比接受TriAdj的组统计学上显著更高(p<0.01)。等级数据的比较进一步显示,在按1:2:1的L-TriAdj重量比与TriAdj的5:10:5重量比接受L-TriAdj的小鼠之间,IgG1应答存在显着差异(p<0.05)。此外,在接受脂质制剂的组中,小鼠的IgG2a应答中值显著高于仅接受TriAdj作为佐剂的那些,如图8F中所示。对于DDAB/DOPE和DDAB/EPC/DOPE基L-TriAdj,来自接受1:2:1剂量的TriAdj的组的秩序转化的IgG2a值与5:10:5比率之间存在显著差异(p<0.01)。然而,与在第10周时5:10:5比率的两种基于脂质的佐剂相比,IgG2a应答没有统计学显著性差异。
从接种疫苗的小鼠的脾中分离淋巴细胞,并且通过测量分泌的IFN-γ和IL-5(ELISPOT测定)离体评估它们对卵清蛋白抗原的应答。图8被组织成左侧代表细胞(Th1)应答(IgG2a和IFN-γ)并且右侧代表体液(Th2)应答(IgG1和IL-5)。平衡的Th1/Th2应答是令人期望的,并且Th1类型应答对于旨在用于病毒感染的疫苗是必需的,以便促进感染细胞的细胞毒性杀伤。从获自接种疫苗的小鼠的淋巴细胞分泌IL-5在各种治疗组之间没有显著不同(图8G、图8H、图8I和图8J)。然而,针对IFN-γ从卵巢刺激的脾细胞分泌的ELISpot结果(图8B、图8C、图8D、图8E)显示,与作为佐剂的单独的TriAdj相比,在用L-TriAdj以5:10:5的重量比疫苗接种的组中,强反应者比例更大。对L-TriAdj内的三重佐剂含量的这种剂量-应答示于图9中,其中来自用5或10μg/mL Ova的回忆剂量刺激的经疫苗接种的小鼠的淋巴细胞对于以5:10:5的佐剂重量比接受L-TriAdj的那些组显示出更高水平的IFN-γ释放。图10表示相对于脂质组合物、佐剂剂量和Ova抗原剂量的T细胞应答的极化的分析。值<1意味着相对较大的Th1类型应答。值>1意味着更强的Th2应答。使用TriAdj和L-TriAdj两者,注意到所期望的平衡应答。
图11A至图11J显示了在小鼠中第二体内研究的结果,比较了配制为钙微粒的TriAdj对比L-TriAdj或单独的TriAdj的佐剂能力。图11A表示0、4和10周时来自接受含TriAdj、TriAdj微粒或L-TriAdj的鼻内Ova疫苗的小鼠的血清IgG2a水平,如通过ELISA测定所测量的。PBS和不含佐剂的Ova用作对照。对于所有佐剂和对照组,Ova抗原剂量变化为1或10μg/剂量。在第4周鼻内给药加强剂量。
图11B表示来自相同动物的相应IgG1血清水平。在4周,对于TriAdj的微粒和脂质制剂,对于用1μg Ova对比10μg Ova接种的小鼠,IgG1滴度是类似的,并且用IgG2a滴度观察到类似的趋势。然而,可溶性TriAdj需要10μg Ova以产生IgG1和IgG2a滴度,与用L-TriAdj作为佐剂的1μgOva所达到的滴度相当。在4周,与具有1μg Ova的L-TriAdj相比,具有1μgOva的TriAdj的微粒制剂产生更低的IgG2a滴度,而对于相同的抗原剂量(1或10μg Ova),IgG1滴度是相似的。来自接种疫苗的小鼠的10周时的滴度高于4周时的滴度。在高剂量的抗原(10μg Ova)下,在接受添加有TriAdj、微粒TriAdj或L-TriAdj的疫苗的组之间的IgG1滴度中没有显著的差异,然而在观察IgG2a滴度时,可以看出微粒制剂在10μg Ova/剂量下比其他两个佐剂组诱导更低的滴度。此外,就IgG2a应答而言,L-TriAdj在1μg的Ova剂量下胜过其他佐剂,证明了其抗原剂量节约作用的潜力。
图11C-11J表示在用5或10μg/mL的Ova抗原离体刺激之后,来自从接种疫苗的小鼠的脾获得的淋巴细胞的IFN-γ(左侧)和IL-5应答(右侧),如通过ELISpot测定所测量的。因此,不仅比较了佐剂制剂类型和抗原剂量的效果,而且比较了在两个剂量下对抗原回忆的响应的范围。图11C和11D分别说明了来自用1或10μg/剂量的Ova单独(无佐剂)疫苗接种的小鼠的淋巴细胞的反应。在每个制剂组和抗原剂量内,对于IFN-γ和IL-5ELISpot结果以及对于L-TriAdj和微粒佐剂组,淋巴细胞对Ova回忆的中值应答在5μg/mL Ova下是相似的,然而,与1μg Ova(图11E、图11G、图11I)相比,当疫苗中包括10μg Ova抗原时(图11F、图11H、图11J),在IL-5和IFN-γ值中注意到更大的应答。与接受作为佐剂的L-TriAdj和1μg Ova的组相比,在接受疫苗中L-TriAdj和10μg Ova的组中测量类似的IL-5和IFN-γ值。
根据这些结果,至少三个关键特征是值得注意的:在10周时观察到的具有L-TriAdj(DDAB/DOPE 50:50)的潜在降低的抗原剂量要求(抗原节约);接受L-TriAdj(10μgOva)的小鼠的较早免疫应答;以及维持平衡的Th1/Th2免疫性。制剂之间的这种差异在较高剂量的抗原下较不明显,这产生了可测量的IgG1和IgG2a应答,甚至没有佐剂,如图11A和11B所示。比较4周时的免疫应答,在加强剂量之前,L-TriAdj的中值IgG2a应答显著大于微粒TriAdj制剂或10μg剂量的Ova抗原的TriAdj的中值IgG2a应答。图12示出这些组在4周时的中值IgG2a滴度。与使用TriAdj的脂质制剂的第一体内研究一致,IgG2a抗体滴度和来自接种疫苗的小鼠的淋巴细胞的INF-γ分泌指示对于脂质和微粒制剂两者的强的细胞介导的应答。
仍在这个第二小鼠研究中,在10周时测量IgA(粘膜免疫的标志物)的血清水平(图13)。与单独给药卵清蛋白相比,10μg Ova的所有佐剂化给药诱导显著更高水平的IgA,其中L-TriAdj制剂显示最高水平(图13B)。
图14至图18示出在小鼠中第三体内研究的结果,比较了鼻内和肌内途径对由L-TriAdj(报告为以上DDAB/DOPE 50:50)或制剂为钙微颗粒的TriAdj诱导的免疫应答的影响。无佐剂的Ova作为对照。对于所有佐剂组和对照组,Ova抗原剂量是10μg。在第4周鼻内给药加强剂量。在10周时进行安乐死。
图14代表来自接受用TriAdj微粒(标记为TriAdj)或L-TriAdj DDAB/DOPE 50:50(标记为L-TriAdj)佐剂化的鼻内或肌内Ova疫苗的小鼠的0周(图14A)、4周(图14B)、6周(图14C)和10周(图14D)的血清IgG1水平,如通过ELISA所测量的。
图15表示在相同时间点(图15A至图15D分别持续0、4、6和10周)来自与图14中相同的动物的相应IgG2a血清水平,如通过ELISA测量的。
图16表示在相同的时间点(图16A至图16D分别持续0、4、6和10周)来自与图14中相同的动物的相应的IgA血清水平,如通过ELISA测量的。
相对于所有其他制剂和途径,在用肌内递送的用脂质三重佐剂配制的10μg Ova进行第一次免疫之后四周IgG1和IgG2a滴度升高(图14B和15B)。在第二次免疫后两周,即在6周,与其他制剂和途径相比,肌内递送的L-TriAdj制剂仍诱导更高滴度的IgG1(图14C)和更高滴度的Ig2a(图15C)。在6周,L-TriAdj制剂的IM免疫后的Ig2a滴度高于TriAdj微粒制剂的IN和IM免疫后的Ig2a滴度(对于Ova+L-TriAdj IM对比而言,p<0.0001)。TriAdj IM或IN和单独的Ova。
在第一次免疫后4周未检测到血清IgA滴度,除了在用L-TriAdj鼻内疫苗接种的组中(图16B)。在6周,即在第二次免疫后2周,在用L-TriAdj鼻内接种的组中血清IgA滴度进一步升高,并且比在任何其他组中显著更高(p<0.0001)(图16C)。在10周,鼻内递送的L-TriAdj制剂再次胜过所有组,包括肌内递送的L-TriAdj制剂(图16D,p<0.01)。
图17表示在安乐死时(第10周)从鼻内或肌内给药含有TriAdj微粒(标记为TriAdj)或DDAB/DOPE 50:50(标记为L-TriAdj)佐剂的Ova疫苗的小鼠收集的鼻内(IN)洗涤样品中检测的抗体滴度,如通过ELISA测量的。发现IgG1的IN洗涤滴度(图17A)在用含有TriAdj的所有制剂免疫后相对于用单独的Ova免疫稍微升高,其中在用L-TriAdj制剂IM免疫后观察到最高滴度。仅在鼻内或肌内递送的L-TriAdj制剂免疫后检测到IgG2a的IN洗涤滴度(图17B)。发现在用鼻内递送的L-TriAdj制剂免疫后,IgA的IN洗涤滴度(图17C)升高(p<0.0001相对于所有其他条件)。
图18表示在安乐死时(第10周)从小鼠收集的支气管肺泡灌洗(BAL)样品中检测的抗体滴度,小鼠鼻内或肌内给药佐剂有TriAdj微粒(标记为TriAdj)或DDAB/DOPE 50:50(标记为L-TriAdj)的Ova疫苗,如通过ELISA所测量的。发现IgG1的BAL滴度(图18A)在用含有TriAdj的所有制剂免疫之后相对于用单独的Ova免疫是升高的。相对于TriAdj微粒制剂,在用L-TriAdj制剂鼻内或肌内免疫后,IgG2a的BAL滴度(图18B)示出更高的水平。发现IgA的BAL滴度(图18C)在用鼻内递送的制剂(尤其用L-TriAdj)免疫后升高。
在第一次免疫后测试的所有时间点,在用L-TriAdj制剂鼻内免疫的小鼠的血清中,以及在10周时收集的IN洗涤和BAL样品中检测到升高的IgA滴度,总体上证明粘膜免疫的快速且持续的诱导。
图19和图20表示ELISpot结果。将来自接种疫苗的小鼠的脾淋巴细胞一式三份暴露于离体的5或10μg/mL卵清蛋白并且测量IFN-γ(图19)和IL5(图20)的分泌。这些值的比率反映了细胞(Th1)与体液(Th2)类型应答的平衡。来自10μg/mL Ova刺激的脾细胞的IFN-γ的分泌的ELISpot结果(图19)显示在用佐剂化制剂疫苗接种的组中比在仅用卵清蛋白肌肉内疫苗接种的组中应答者更多(图19E),以及用L-TriAdj以鼻内途径(图19A)或肌内途径(图19C)疫苗接种的组中的强反应者比例更高,证实L-TriAdj诱导Th1应答的能力。来自10μg/mL Ova刺激的脾细胞的IL-5的分泌的ELISpot结果(图20)在所有组中显示出类似的应答者,除了用配制在TriAdj微粒中的10μg Ova肌内接种疫苗的组,该组显示出更高的应答(图20D)。
图21表示如由IFN-γ/IL5比率表示的细胞对体液应答的平衡。用10μg/mL卵清蛋白(图21C)的刺激诱导了相对于IL5,在已经用L-TriAdj(鼻内或肌内)疫苗接种的小鼠的脾细胞中比在用TriAdj微粒或无佐剂疫苗接种的小鼠的脾细胞中分泌更多的IFN-γ。这些结果证实了L-TriAdj诱导更平衡的Th1/Th2应答的能力。
总之,脂质纳米载体与三重佐剂组合物的组合经历超分子自组装过程,这导致具有理想直径和电荷的脂质纳米颗粒。组合物有助于粘蛋白的粘附并且可以允许其渗透。脂质组合物包含用于免疫刺激和粘蛋白结合的阳离子脂质(如DDAD)以及辅助脂质(诸如,DOPE)以帮助内体逃逸。脂质体表面电荷密度和理论上脂质体膜流动性的调节通过包含磷脂酰胆碱(EPC)来实现。阳离子脂质体和三重佐剂组合物的组装过程可重复并且产生稳定的、浓缩的L-TriAdj颗粒,这些颗粒具有超过通过单独的三重佐剂组合物实现的佐剂活性的佐剂活性。
结合到脂类佐剂中的带电的聚合物电解质组分的平衡促进了自组装和缩合,并且总的阳离子电荷抑制了总体聚集并且促进了粘蛋白相互作用,如由ζ电位改变所指示的。组分的缩合还产生了相对小的颗粒(<200nm),这些颗粒将具有适合于细胞吸收的直径。全疫苗(抗原+佐剂)的大小分析和24小时稳定性也表明了亚微米颗粒。理想地,抗原和佐剂被相同的APC吸收,因此抗原与脂质佐剂的结合是有利的。
混合佐剂通过激活免疫应答的不同方面并降低抗原剂量或产生足够强度的应答所需的剂量数目来提供明显的优势,以保护感染因子攻击后的宿主。聚(I:C)是双链RNA的合成版本,其通过其病原体相关分子模式(PAMP)的性质警告免疫系统,经由Toll样受体3(TLR3)激活免疫应答。它不仅驱动细胞毒性/Th1应答和促炎性细胞因子的产生,而且还调节应答的持续时间,从而促进树突细胞的凋亡(Fuertes等人,PLoS One(2011)6:e20189),这对免疫应答消退是重要的。PCEP是具有免疫刺激特性的合成阴离子聚合物,该合成阴离子聚合物还充当高分子电解质结合剂(Garlapati等人,Vaccine(2011)29:6540-6548;Mutwiri等人,Vaccine(2007)25:1204)。该三重佐剂组合物的另一关键组分是阳离子先天防御调节(IDR)肽1002,该肽具有多种免疫调节作用,包括嗜中性细胞和树突细胞的募集和选择性活化(Garlapati等人,Vaccine(2011)29:6540-6548;Nijnik等人,J.Immunol.(2010)184:2539-2550;Garg等人,J.Gen.Virol.(2014)95:301-306;Hancock等人,Nat.Rev.Immunol.(2016)16:321-334)。通过使用合理比例的阳离子脂质和辅助脂质(其使得能够形成粘膜粘附颗粒),建立的佐剂可以通过鼻给药途径增强,从而导致体内平衡的Th1/Th2免疫应答。颗粒制剂也可以具有长效作用,在鼻组织中停留持续延长的时间进行暴露。
这种通用鼻佐剂平台可以用于广范围的疫苗,这些疫苗通过有利地产生粘膜免疫而产生局部和全身免疫两者,粘膜免疫是完全保护免受呼吸道感染的关键。
因此,公开了用于治疗和预防感染性疾病的新型的佐剂组合物和方法。尽管已经详细描述了本发明的优选实施方式,但是应当理解,在不背离由权利要求限定的本发明的精神和范围的情况下,可以做出明显的变化。
- 粘膜粘附脂质递送系统
- 叔胺类阳离子脂质衍生物及其在RNA药物递送系统的应用
