艾叶在治疗和预防由幽门螺旋杆菌引起的胃部疾病中的应用
文献发布时间:2023-06-19 13:51:08
技术领域
本发明属医药技术领域,具体涉及一种艾叶在制备治疗和预防由幽门螺旋杆菌引起的胃部疾病药物中的应用。
背景技术
导致胃粘膜损伤、胃溃疡的因素主要有几个方面:酒精、幽门螺杆菌的感染、药物、应激反应、疾病如肝硬化等、其他如胃食管反流、化学因素、年龄等。其中,酒精、幽门螺杆菌的感染和药物是最主要的因素。
乙醇引起的胃粘膜损伤机制包括直接损伤和间接损伤。直接损伤包括物理化学损伤,即作为一种有机溶剂,乙醇具脱水作用,能凝固组织蛋白,进入胃内后可腐蚀胃粘膜,破坏表面黏液层和粘液细胞,进而破坏胃粘膜的正常代谢所需的生理环境,导致胃粘膜细胞膜的损坏。间接损伤即生物损伤,乙醇能对胃粘膜及其生理代谢环境产生一系列的影响,包括改变胃粘膜屏障的平衡、影响胃酸分泌、刺激炎症细胞及炎症因子的浸润和释放、改变胃粘膜微循环状态及影响胃肠激素如一氧化氮(NO)与前列腺素(PGE2)的释放等,从而引起一系列胃粘膜的损害,从而促炎性细胞因子释放、诱导氧化应激及介导细胞调亡,最终引起胃粘膜生物性损伤。
幽门螺旋杆菌(Helicobacter pylori,Hp)感染是目前全球流行的人类发生率最高的慢性细菌感染之一。Hp主要寄生在胃幽门、胃窦等附近的黏膜上,与胃部多种疾病的发生息息相关。其导致的胃部疾病的机制非常复杂,并且是一个多因素、多阶段、多基因变异参与的过程。目前研究发现幽门螺旋杆菌的致病因子根据其性质可分为定植因子(鞭毛、脲酶(Urease))和毒力因子(丝氨酸蛋白酶(HtrA)、空泡细胞毒素A(VacA)、细胞毒素相关蛋白基因A(CagA))等。定植因子有强力附着能力,在Hp进入胃后,鞭毛及其菌体组成的特殊螺旋结构为其穿梭胃黏液层并定植于胃黏膜提供了便利条件。当Hp到达上皮表面后,通过粘附素,牢牢地与上皮细胞连接在一起并且利用其富含的脲酶(Urease),水解尿素产生氨,在菌体周围形成“氨云”保护层,以抵抗胃酸的杀灭作用。之后,Hp分泌一种高度进化的保守热休克诱导的丝氨酸蛋白酶(HtrA)。Hp分泌的HtrA会活跃分泌至细胞外环境中,并与细胞粘附分子成员之一E-钙黏蛋白(E-cadherin)发生作用,打开细胞间连接,向细胞内分泌多种毒性致病因子,如细胞空泡毒素A(VacA)、细胞毒素相关蛋白A(CagA)、胃上皮接触后诱导表达因子(IceA)、血型抗原结合黏附素(BabA)、编码前炎症性外膜蛋白(OipA)、十二指肠球溃疡启动因子(DupA)等,最终导致胃粘膜损伤等消化性溃疡疾病,并进一步随着疾病的发展进程,急性、慢性胃炎以及胃癌等疾病。因此,幽门螺旋杆菌在酸性条件下存活的关键特征之一是产生大量的脲酶(Urease),其释放毒性因子的关键蛋白是丝氨酸蛋白酶(HtrA)。而VacA和CagA作为幽门螺杆菌大量分泌的毒性因子,在幽门螺杆菌诱发胃溃疡的过程中发挥重要作用。前者促进细胞空泡化并通过线粒体途径诱导细胞凋亡;后者与多种炎性因子的产生有关,并且参与多种致癌机制。因此,通过双重抑制Urease和HtrA,从而抑制Hp的定植和VacA或CagA的释放和侵入细胞成为治疗Hp诱发的胃溃疡的一个重要策略。
艾叶,来源于菊科植物艾(Artemisia argyi Levl.et Vant.),有温经止血,散寒止痛,暖胃祛湿的功效,归肝、脾、肾经。主要用于吐血,衄血,崩漏,月经过多,胎漏下血,少腹冷痛,经寒不调,宫冷不孕的治疗;外治皮肤瘙痒。醋艾炭温经止血,用于虚寒性出血。现代药理学研究证明,艾叶具有广谱抗菌抗病毒和止血凝血功效。尽管艾叶具有极大的药用价值,但时至今日国内外很少有关于其抑制幽门螺旋杆菌方面的物质基础研究,极大的限制了其临床应用。
发明内容
本发明的目的是基于现有技术的现状和基础,提供一种艾叶活性提取物、艾叶总黄酮、艾叶中黄酮类单体化合物及其在制备幽门螺旋杆菌引起的胃部疾病的药物中的应用。
为实现上述目的,本发明采用技术方案为:
一种艾叶在治疗和预防由幽门螺旋杆菌引起的胃部疾病中的应用,艾叶在制备治疗和预防由幽门螺旋杆菌引起的胃部疾病药物中的应用。
所述艾叶为菊科植物艾Artemisia argyi Levl.et Vant.。
所述艾叶为艾叶的提取物,提取物纯化后的艾叶总黄酮或化学合成的艾叶总黄酮。
所述提取物纯化后的艾叶总黄酮为黄酮类化合物中的一种或几种。黄酮类(包括黄酮(醇)、二氢黄酮(醇)、异黄酮、黄烷等)化合物组成。
所述提取物纯化后的艾叶总黄酮为5,7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)、5,7,3',4'-四羟基-6,5'-二甲氧基黄酮和5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)的一种或几种。
所述艾叶的提取物,提取物纯化后的艾叶总黄酮、提取纯化或化学合成的7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)、提取纯化或化学合成的5,7,3',4'-四羟基-6,5'-二甲氧基黄酮、提取纯化或化学合成的5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)等艾叶黄酮类成分在制备治疗和预防由幽门螺旋杆菌引起的胃炎、胃癌及胃溃疡药物中的应用。
所述所述艾叶的提取物,提取物纯化后的艾叶总黄酮、提取纯化或化学合成的7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)、提取纯化或化学合成的5,7,3',4'-四羟基-6,5'-二甲氧基黄酮、提取纯化或化学合成的5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)等艾叶黄酮类成分与药学、功能食品、保健品或食品中可接受的赋形剂混合制备治疗和预防由幽门螺旋杆菌引起的胃炎、胃癌及胃溃疡药物。
所述艾叶的提取物为菊科植物艾Artemisia argyi Levl.et Vant.的干燥叶、茎、或整个地上部分经醇提取获得。
上述艾叶的提取物获得为取干燥艾叶(Artemisia argyi Levl.et Vant.)药材,经醇提取,将提取液浓缩,回收溶剂,干燥,得艾叶提取物。
所述提取的醇为60-95%的醇水溶液,优选为75-95%醇水溶液,提取方式为浸渍、渗漉、加热回流、连续加热回流(沙氏提取法)、超声提取。
所述的醇为甲醇或乙醇等醇类溶剂;提取次数为2-4次;溶剂用量与药材质量的比例为1:4-1:12,其中浸渍或渗漉提取每次溶剂用量与药材质量的比例为1:4-1:30;浸渍提取的时间为每次4-20小时,加热回流、或连续加热回流(沙氏提取法)、或超声提取方法每次提取时间为0.5-4小时。
所述浓缩方式为常压蒸馏或减压蒸馏,干燥方式为常温加热干燥、减压干燥、冷冻干燥或喷雾干燥等。
所述艾叶的提取物纯化后的艾叶总黄酮为上述艾叶总提取物通过四种方法进一步分离纯化,得到艾叶总黄酮,分别为大孔树脂法、聚酰胺柱色谱法、硅胶柱色谱法或碱酸法。
所述大孔吸附树脂法,为依次用水,体积比例为40-60%乙醇-水、70-95%的乙醇-水洗脱,富集70-95%的乙醇-水洗脱液。所述的大孔树脂为非极性树脂、弱极性树脂或中等极性树脂,所述的非极性树脂选自XAD-4,Diaion HP-20,D101、D102、D401、D1、D2、D3、D4、HPD-100或X-5,所述的弱极性树脂选自D-201、HPD-300或AB-8,所述的中等极性树脂选自XAD-6、XAD-7或XAD-8。
所述的聚酰胺柱色谱法,为依次用水,体积比例为40%、60%、80%的乙醇-水洗脱,富集60-80%的乙醇-水洗脱液。所述的聚酰胺树脂为30-60目。
所述硅胶柱色谱分离,采用溶剂梯度洗脱的方法为:用体积比50:1-10:1的二氯甲烷(或氯仿)-甲醇系统梯度洗脱;或采用体积比为12:1-3:1的石油醚(或正己烷)-丙酮系统梯度洗脱。
所述碱酸法,将艾叶总提取物溶解于体积比20:1的二氯甲烷-甲醇溶液中,加等体积5%碳酸钠溶液,萃取3-4次,取碱水层用盐酸酸化至pH 4-5,用乙酸乙酯萃取3-4次,减压浓缩回收浸膏,将浓缩物用甲醇溶解,聚酰胺拌样,二氯甲烷-甲醇20:1洗脱,得艾叶总黄酮。
本发明所述的已知黄酮类单体化合物通过下述方法制得:
上述艾叶总黄酮,采用溶剂梯度洗脱,以二氯甲醇(氯仿)-甲醇体系进行梯度洗脱,然后经Sephadex LH-20凝胶柱色谱、ODS反相硅胶柱色谱及高效液相制备得到化合物(I)、(II)和(III);用波谱方法鉴定化合物(I)的结构为5,7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)、化合物(II)的结构为5,7,3',4'-四羟基-6,5'-二甲氧基黄酮、化合物(III)的结构为5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)。
(I)5,7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)
(II)5,7,3',4'-四羟基-6,5'-二甲氧基黄酮
(III)5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)
所述的二氯甲醇(氯仿)-甲醇的梯度:100:0-100:100。
所述Sephadex LH-20凝胶柱色谱,洗脱溶剂为甲醇或丙酮。
所述ODS反相硅胶柱色谱,采用的洗脱液为50:50-100:0的甲醇-水。
所述高效液相色谱为SHIMADZU LC-6AD(日本岛津);色谱柱为YMC-Pack ODS-A(日本YMC公司);洗脱剂为甲醇-水。
本发明所具有的优点:
本发明提供所述化合物的药用用途;所述物质为艾叶总提取物、并由艾叶总提取物中进一步纯化获得的艾叶总黄酮及艾叶中黄酮类单体化合物,或是化学合成的艾叶总黄酮及艾叶中黄酮类单体化合物,所得物质均对幽门螺旋杆菌的最小抑菌浓度(MIC)的测定以及对幽门螺旋杆菌导致的大鼠胃溃疡的治疗活性评价。以及通过建立体外幽门螺杆菌共孵育的AGS胃癌细胞模型,进行体外抗胃黏膜损伤活性评价。以VacA和CagA释放量为指标,对艾叶中所述单体化合物幽门螺杆菌诱导AGS过程中毒性因子的抑制活性测试。结果表明,艾叶总提取物、艾叶总黄酮及艾叶中黄酮类单体化合物对幽门螺旋杆菌所致大鼠胃溃疡具有显著的治疗作用,所述式(I)、式(II)和式(III)化合物具有显著的幽门螺杆菌诱导AGS过程中毒性因子的抑制活性,可用于制备幽门螺旋杆菌引起的胃部疾病的药物或先导化合物。
本发明提供的具有对幽门螺旋杆菌所致大鼠胃溃疡具有显著的治疗作用的艾叶提取物、艾叶总黄酮及黄酮类单体化合物,以及对幽门螺杆菌诱导AGS过程中毒性因子的抑制活性的黄酮类化合物,所述的艾叶提取物、艾叶总黄酮及化合物可用于制备幽门螺旋杆菌引起的胃溃疡的药物或先导化合物。
附图说明
图1为实施例3中本发明艾叶提取物、艾叶总黄酮、化合物(I)对大鼠胃组织匀浆液TNF-α(图1A)、IL-1β(图1B)、IL-10(图1C)含量的影响图;*P<0.05,**P<0.01,***P<0.001。
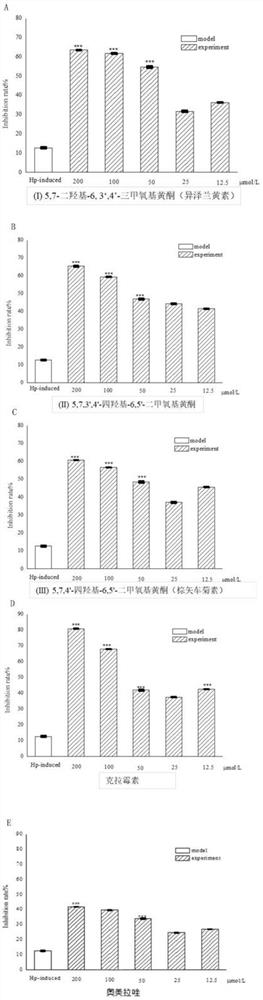
图2为实施例4中本发明化合物(I)(图2A)、(II)(图2B)和(III)(图2C)对Hp诱导的AGS细胞抑制率的影响图;其中,*P<0.05,**P<0.01,***P<0.001。
图3为实施例5中本发明化合物(I)(图3A)、(II)(图3B)和(III)(图3C)对毒性因子VacA和CagA释放量的影响图;其中,*P<0.05,**P<0.01,***P<0.001。
具体实施方式
以下结合实例对本发明的具体实施方式做进一步说明,应当指出的是,此处所描述的具体实施方式只是为了说明和解释本发明,并不局限于本发明。
本发明通过艾叶,对其进行提取获得艾叶提取物、艾叶总黄酮、艾叶中分离得到的天然黄酮类单体化合物,包括但不限于5,7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素)、5,7,3',4'-四羟基-6,5'-二甲氧基黄酮或5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素)等;提取获得各物质经试验表明,艾叶提取物、总黄酮及化合物(I)对幽门螺旋杆菌所致胃溃疡具有较好的的防治作用,所述3个化合物具有显著的Hp诱导AGS过程中毒性因子的抑制活性,可用于制备幽门螺旋杆菌引起的胃部疾病的药物或先导化合物。
实施例1艾叶总提取物的制备
取干燥艾叶(Artemisia argyi Levl.et Vant.)药材,干燥后取24kg艾叶用体积分数为95%的乙醇室温下浸渍提取2次,每次浸提20小时,而后减压回收溶剂,浓缩得艾叶总提取物浸膏(1458g)。
其中,所述的艾叶药材包括菊科植物艾Artemisia argyi Levl.et Vant.的干燥叶、茎、或整个地上部分。
艾叶与乙醇质量比为1:10。
实施例2艾叶总黄酮的制备
取部分实施例1的艾叶总提取物,经HPD100型大孔吸附树脂色,依次用水,体积比例为60%乙醇-水、95%的乙醇-水洗脱,95%的乙醇/水洗脱液浓缩干燥,得到艾叶总黄酮。
实施例3艾叶黄酮类单体化合物的分离
取部分实施例1中的艾叶总提取物分散于水中,依次用石油醚、二氯甲烷、乙酸乙酯和正丁醇萃取,减压浓缩。乙酸乙酯层萃取部位经反复硅胶柱色谱,以二氯甲烷-甲醇系统(100:0→100:5→100:10→100:20→100:33→100:100)进行梯度洗脱,每个梯度用量5升,收集流份,合并二氯甲烷-甲醇(100:5)及二氯甲烷-甲醇(100:10)流份,经硅胶柱色谱,以石油醚-丙酮体系(9:1→7:1→3:1→1:1)梯度洗脱,每个梯度用量2升,收集流份;其中石油醚-丙酮(9:1)流份经过Sephadex LH-20凝胶柱色谱,以甲醇洗脱,流速为0.8-1.5ml/min,每5毫升为一流份,根据TLC显色合并相似流份,得到3个组分,组分2经半制备HPLC纯化得到化合物(I)5,7-二羟基-6,3',4'-三甲氧基黄酮(异泽兰黄素),洗脱剂为甲醇-水(55:100);组分3经半制备HPLC纯化得到化合物(II)5,7,3',4'-四羟基-6,5'-二甲氧基黄酮,洗脱剂为甲醇-水(60:100);石油醚-丙酮(7:1)流份经半制备HPLC纯化得到化合物(III)5,7,4'-四羟基-6,5'-二甲氧基黄酮(棕矢车菊素),洗脱剂为甲醇-水(58:100)。柱层析硅胶(200-300目,青岛海洋化工厂);Sephadex LH-20(瑞典GE Healthcare公司);高效液相色谱为SHIMADZU LC-6AD(日本岛津);色谱柱为YMC-Pack ODS-A(日本YMC公司)。
式(I)化合物的理化性质及光谱数据如下:黄色粉末(甲醇),254nm下有暗斑,三氯化铁-铁氰化钾反应阳性,核磁共振氢谱数据如表1所示。
式(II)化合物的理化性质及光谱数据如下:黄色粉末(甲醇),254nm下有暗斑,365nm下有荧光,体积分数为10%硫酸-乙醇显黄色,三氯化铁阳性,示有酚羟基的存在。核磁共振氢谱数据如表1所示。
式(III)化合物的理化性质如下:黄色粉末(甲醇)。三氯化铁-铁氰化钾反应阳性,提示存在酚羟基,可能为黄酮类化合物。核磁共振氢谱数据如表1所示。
表1式(I)、式(II)和式(III)化合物的核磁共振氢谱(600MHz,DMSO-d
实验例4最小抑菌浓度(MIC)的测定
采用96孔板微量稀释法测定艾叶提取物、艾叶总黄酮及黄酮类单体化合物对幽门螺旋杆菌的最小抑菌浓度。
将幽门螺杆菌液用布鲁氏菌肉汤培养基稀释,每孔100μL,最终浓度为每孔1×10
实验结果如表2所示,化合物(I)(II)(III)显示了较好的抗幽门螺杆菌活性均表现出抑菌活性,MIC分别为16、37、29μg/ml。
表2艾叶提取物、总黄酮及化合物(I)(II)(III)抗幽门螺旋杆菌的MIC值
实验例5艾叶提取物的体内胃溃疡抑制实验
随机选取10只大鼠作为正常对照组,其余大鼠进行造模:先禁食12h,再灌胃给予2ml 5%NaNO
选择造模成功的大鼠100只,随机分为10组,分别为模型对照组、艾叶提取物高、中、低剂量组,艾叶总黄酮高、中、低剂量组,异泽兰黄素(I)高、中、低剂量组,模型对照组以1.0ml/100g灌胃给予蒸馏水,治疗组分别给予艾叶提取物3.0g/kg(高剂量组)、1.0g/kg(中剂量组)、0.33g/kg(低剂量组),艾叶总黄酮3.0g/kg、1.0g/kg、0.33g/kg,异泽兰黄素200mg/kg、100mg/kg、50mg/kg配成相应浓度药液,均以1.0ml/100g灌胃给药,每日1次,连续给药15日。末次给药后1h,将大鼠断颈处死,打开腹腔,结扎贲门和幽门后将胃取出,沿胃大弯剪开,用冷0.9%氯化钠溶液冲洗胃内残留物,测量溃疡的横径和竖径,以二者乘积(mm
1分:指溃疡面积为1~12mm
2分:指溃疡面积为13~25mm
3分:指溃疡面积为26~37mm
4分:指溃疡面积为38~50mm
5分:指溃疡面积≥50mm
对于面积≤1mm
胃组织匀浆液的处理:准确称取组织重量,按重量体积比加入9倍的生理盐水制成10%的组织匀浆,2500r/min离心10min,取上清液,EP管分装,-20℃保存备用待测。
TNF-α、IL-1β、IL-10含量测定:大鼠TNF-α、IL-1β、IL-10测定采用酶联免疫法(Elisa)检测,操作按照试剂盒说明书要求进行。
实验结果如图1、表3所示,与模型对照组相比,艾叶提取物,艾叶总黄酮及化合物(I)的高、中剂量组对幽门螺旋杆菌所致大鼠胃溃疡具有显著的防治作用,且呈剂量依赖关系。
表3艾叶提取物、总黄酮及化合物(I)对幽门螺旋杆菌所致大鼠胃溃疡的影响
注:与模型对照组比较*P<0.05,**P<0.01
实施例6艾叶中黄酮类单体化合物体外对Hp诱导的AGS细胞抑制实验
取对数生长期培养的AGS胃癌细胞,用含5%胎牛血清的新鲜RPMI1640培养基将细胞密度调至3×10
细胞抑制率%=(空白样本吸光度-待测样品的吸光度)/空白样本吸光度×100%
表3式(I)、式(II)和式(III)化合物体外对Hp诱导的AGS细胞的抑制率
实验结果如图2、表3所示,结果表明(II)的IC50值低于同组阳性药数据,表明其在抑制Hp诱导的AGS细胞增殖过程中具有优于阳性药的表现。且(I)和(III)的IC50值仅略高于阳性药数据,说明其在抑制Hp诱导的AGS细胞增殖过程中也发挥出良好作用。而质子泵抑制剂奥美拉唑作为胃溃疡的临床用药,对于Hp诱导的AGS细胞增殖则无明显的抑制作用。
实施例7艾叶中单体化合物对毒性因子VacA和CagA释放量的影响
将AGS细胞置于96孔板中,密度为每毫升4×10
(1)准备试剂,样品和标准品。
(2)加入准备好的样品和标准品,37℃反应30min。
(3)洗板5次,加入酶标试剂,37℃反应30min。
(4)洗板5次,加入显色液A、B,37℃显色10min。
(5)加入终止液。
(6)15min之内450nm下酶标仪检测并读取OD值。
(7)以标准物浓度为横坐标,OD值为纵坐标绘制标准曲线,根据样品OD值计算其相应浓度。
结果如图3所示,式(I)和式(III)化合物在VacA释放过程中具有优于阳性药抑制效果,分别约为阳性药的1.6倍和1.5倍。式(I)、式(II)和式(III)化合物在CagA释放过程中具有优于阳性药抑制效果,作用效果均约为阳性药的1.4倍。而奥美拉唑则对毒性因子VacA和CagA的释放无明显影响。
实验结果表明,本发明的艾叶提取物、艾叶总黄酮、化合物(I)对幽门螺旋杆菌导致的胃溃疡具有显著的防治作用。化合物(I)、(II)和(III)具有显著的抑制幽门螺杆菌诱导AGS过程中毒性因子作用,可用于制备幽门螺旋杆菌引起的胃溃疡的药物或先导化合物。
- 艾叶在治疗和预防由幽门螺旋杆菌引起的胃部疾病中的应用
- 一种微囊及其制备方法和在预防和/或治疗放射治疗引起的唾液腺损伤中的应用
