一种高活性淀粉酶抑制活性肽及其制备方法和应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及一种活性肽,尤其涉及一种高活性淀粉酶抑制活性肽及其制备方法和应用。
背景技术
碳水化合物是人体中主要的能量来源,血液中葡萄糖含量过高会导致一系列的代谢相关疾病发生。淀粉首先经过淀粉酶的水解作用成为小分子多糖进入到消化道中,其次在葡萄糖苷酶的作用下水解为单糖进入血液。代谢综合征如Ⅱ型糖尿病和肥胖症等可以通过抑制淀粉酶活性从而来控制或缓解症状。此外淀粉酶抑制剂在农业上也被用作杀虫剂,通过抑制昆虫淀粉酶活性使得昆虫体内淀粉无法消化吸收,从而杀灭昆虫幼虫。
藜麦(Chenopodium quinoa willd)是一种原产于南美洲安第斯山脉地区的农作物,属苋科藜属的一年生双子叶植物。根据放射性碳年代测定技术,藜麦的历史可追溯到8000年前,最早发现于玻利维亚和秘鲁交界的Titicaca湖附近。近年来随着藜麦在我国多个省份的引进,初步形成了适合不同区域的栽培方法,藜麦中蛋白质含量丰富,大约在9.1-15.7%,高于水稻和玉米等农作物,与小麦含量相当。藜麦中氨基酸组成比例与联合国粮农组织(FAO)推荐的理想蛋白质相似。由于其营养价值较高,受到了消费者的热爱,市场上出现了大量的藜麦产品,其功能性成分也逐渐成为研究的热点。国内外的学者研究发现藜麦蛋白提取物具有抗氧化、降血糖、免疫调节活性、降低高血压和益生元活性等一系列的生物活性。
目前对于藜麦的研究主要是以藜麦籽粒或藜麦中酚酸等为研究对象,没有单纯分析藜麦蛋白及蛋白水解成分多肽的生物活性,例如已有研究表明通过在单一碳水膳食中增加藜麦的摄入可以降低食物的GI值。但是其降低GI值的机理尚未进行透彻研究。因此基于藜麦蛋白具有多种生物活性的特点,开发一种结构明确且具有淀粉酶抑制活性的藜麦多肽具有较大的实际应用价值。
发明内容
为了克服现有技术的不足,本发明的目的之一在于提供一种高活性淀粉酶抑制活性肽,可以有效抑制淀粉酶的活性,延长淀粉的水解时间。
本发明的目的之二在于提供一种高活性淀粉酶抑制活性肽的制备方法。
本发明的目的之三在于提供一种高活性淀粉酶抑制活性肽的应用。
本发明的目的之一采用如下技术方案实现:
一种高活性淀粉酶抑制活性肽,所述活性肽的序列如SEQIDNO.1所示:Met-Met-Phe-Pro-His。
优选的,所述活性肽中组氨酸、色氨酸、脯氨酸和含硫氨基酸对淀粉酶抑制起重要作用。活性肽的C末端前一位为脯氨酸。
优选的,所述活性肽分子量为679.87Da。
本发明的目的之二采用如下技术方案实现:
上述高活性淀粉酶抑制活性肽的制备方法,包括以下步骤:
(1)取藜麦清洗烘干后粉碎过筛得到藜麦粉;
(2)采用碱提酸沉法提取藜麦粉中的藜麦蛋白;
(3)将步骤(2)提取的藜麦蛋白用胃蛋白酶进行酶解,酶解结束后灭酶,冷却至室温后离心,取上清液冷冻干燥得到藜麦蛋白酶解产物;
(4)采用不同分子量的超滤膜对步骤(3)中的藜麦蛋白酶解产物进行分离,收集分离的各组分后分别测定对淀粉酶的抑制活性;
(5)取步骤(4)中对淀粉酶抑制活性最高的组分经液相色谱分离后测定各组分对淀粉酶的抑制活性,取对淀粉酶抑制活性最好的组分进行氨基酸序列分析,得到氨基酸序列为Met-Met-Phe-Pro-His的活性肽。
优选的,步骤(1)中过180目筛得到藜麦粉。
优选的,步骤(3)中胃蛋白酶的浓度为45000U/g,酶解时间为180min,酶解温度为37℃、pH 2.0,酶解结束后在85℃水浴20min灭酶。
优选的,步骤(3)中依次使用1kDa、3kDa、10kDa超滤膜进行过滤,根据分子量藜麦蛋白酶解产物被分离为<1kDa、1-3kDa、3-10kDa、>10kDa的各组分。
本发明的目的之三采用如下技术方案实现:
上述高活性淀粉酶抑制活性肽的应用,所述活性肽在制备淀粉酶活性抑制剂中的应用。
优选的,所述活性肽在制备与淀粉酶相互作用位点残基为His305、Ala307、Ile235、His201、His299、Glu233、Ala198、Tyr62和Gln63的抑制剂中的应用。
所述活性肽能够与淀粉酶活性位点氨基酸结合表现出竞争性抑制,也能够与非活性位点氨基酸结合改变淀粉酶结构表现为不可逆抑制。与淀粉酶结合模式为快结合慢解离的模式。
优选的,所述活性肽在制备保健品、食品或者药品中的应用。
优选的,所述活性肽在食品、保健品或药品中的添加量为0.5-2mg/mL。
优选的,所述活性肽在制备调控血糖的保健品、食品或者药品中的应用。
相比现有技术,本发明的有益效果在于:本发明提供一种高活性淀粉酶抑制活性肽,具有良好的淀粉酶抑制活性。本发明的活性肽通过合适的取向和淀粉酶上氨基酸残基相互结合,与淀粉酶上的结合位点包括活性位点以及活性位点附近的氨基酸残基同时结合;活性肽与淀粉酶相互结合的结合模式表现为快速结合但缓慢解离。这种同时结合的作用方式,使淀粉酶活性受到抑制,延长淀粉的水解时间。
本发明还提供了一种高活性淀粉酶抑制活性肽的制备方法,先自藜麦中提取藜麦蛋白,再将藜麦蛋白经水解、超滤、以及液相色谱分离纯化等过程后制备得到,原料来源广泛,制备过程易于操作实现。
本发明还提供了一种高活性淀粉酶抑制活性肽的应用,可将其作为淀粉酶活性抑制剂,用于保健品、食品或者药品中,通过抑制淀粉酶的活性发挥降血糖等作用。
附图说明
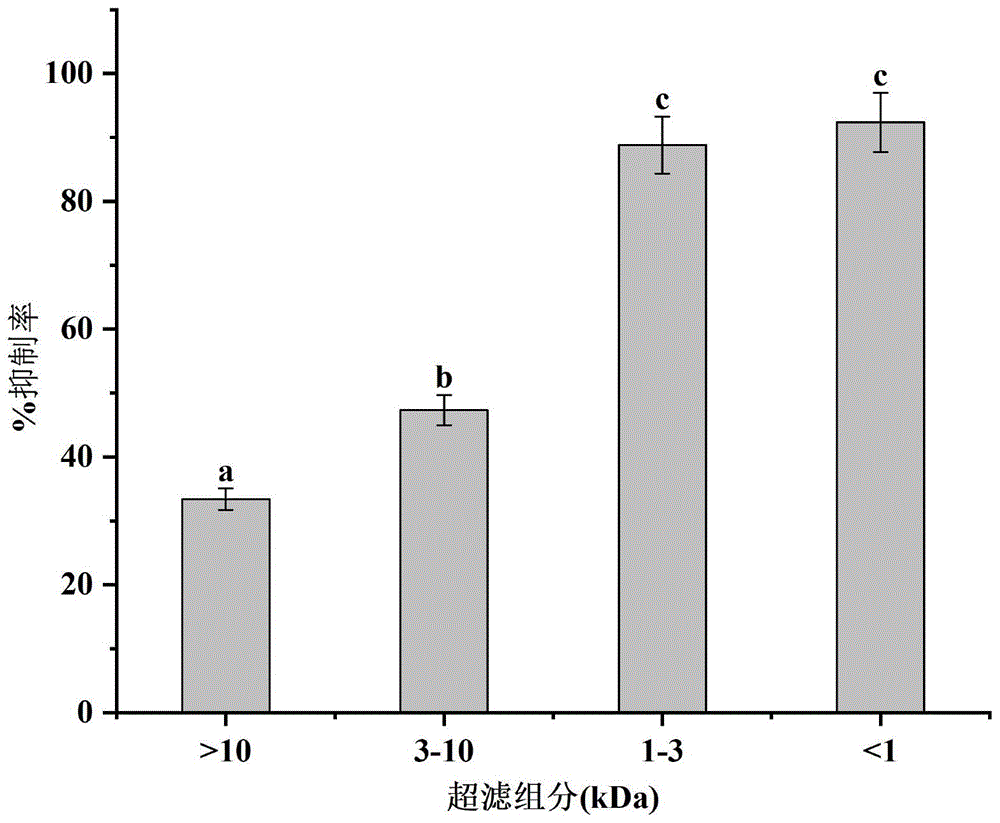
图1为不同超滤组分α-淀粉酶抑制活性图;
图2蛋白纯化系统分离纯化色谱图;
图3为蛋白纯化分离各组分的α-淀粉酶抑制活性图;
图4为α-淀粉酶抑制活性肽的二级质谱图;
图5为F5组分及肽段1至6的α-淀粉酶抑制活性图;
图6为藜麦分离蛋白、胃蛋白酶酶解成分、胰蛋白酶酶解成分、风味蛋白酶解成分以及中性蛋白酶解成分的α-淀粉酶抑制活性图;
图7为MMFPH与α-淀粉酶酶促反应动力学图;
图8为MMFPH与α-淀粉酶分子互作图;
图9为MMFPH与α-淀粉酶结合模式。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
本发明实施例以及实验例中所用淀粉酶均为α-淀粉酶,抑制活性按照如下过程测定得到:
采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)显色法测定待测样品的α-淀粉酶抑制活性。α-淀粉酶溶于pH 7.0的PBS中,浓度为1U/mL,首先将250μL淀粉酶和250μL待测样品加入到500μL PBS缓冲液中,于37℃反应10min,再加入250μL 1%(w/v)可溶性淀粉于37℃精确控制反应5min。随后加入500μL DNS,100℃水浴10min,待冷却后加入5mL去离子水,于540nm下检测吸光度。样品对照组将淀粉酶替换为250μL PBS。空白组将待测样品替换为250μLPBS,空白对照组将淀粉酶和待测样品均替换为250μLPBS。
注:A
实施例1
一种高活性淀粉酶抑制活性肽,活性肽的序列如SEQIDNO.1所示:Met-Met-Phe-Pro-His,活性肽分子量为679.87Da。
上述高活性淀粉酶抑制活性肽的制备过程如下:
(1)取藜麦清洗烘干后利用超微粉碎机粉碎并过180目筛得到藜麦粉;
(2)藜麦粉用无水乙醇以质量体积比(M:V)1:5混合均匀,脱脂6h,脱脂结束后在通风橱挥发12h,得到脱脂藜麦粉。将脱脂藜麦粉用纯水复溶,藜麦粉与纯水的比例为1:20,用1M NaOH调节pH至9.5,50℃搅拌提取2h后,在4℃下,4500r/min离心30min,收集上清。将离心后的沉淀进行二次浸提,步骤与一次浸提相同,提取1h后离心,将两次上清液合并。调节上清液pH至4.8(藜麦蛋白的等电点),随后在4℃下,4500r/min离心30min,收集沉淀,并用纯水复溶,再用1M HCl和1M NaOH调节pH至中性并透析过夜。将透析后样品冷冻干燥48h,冻干粉-20℃保存备用。得到藜麦蛋白;
(3)将步骤(2)提取的藜麦蛋白用胃蛋白酶进行酶解,胃蛋白酶浓度为45000U/g蛋白,酶解时间均为180min,酶解条件为:酶解温度为37℃、pH 2.0;酶解结束后在85℃水浴20min灭酶。待酶解液冷却至室温后,在4℃,4500r/min离心30min,取上清液冷冻干燥,得到藜麦蛋白酶解物,-20℃保存备用。
(4)依次使用1kDa、3kDa、10kDa超滤膜将步骤(3)的胃蛋白酶酶解产物进行分离,酶解产物根据分子量分成<1kDa、1-3kDa、3-10kDa、>10kDa的组分,各超滤组分冻干后测定α-淀粉酶抑制活性,收集分离的各组分后分别测定对α-淀粉酶的抑制活性,结果如图1所示,取抑制活性最高的组分即分子量<1kDa的酶解产物;
(5)取步骤(4)中分子量<1kDa的酶解产物经0.22μm滤膜过滤后,用AKTAPure蛋白纯化系统进一步分离纯化,采用1mL注射器通过上样环进行上样,凝胶色谱柱为SuperdexPeptide10/300GL,流动相为pH 7.2-7.4,0.05mol/L磷酸盐缓冲液(含0.15mol/LNaCl),洗脱方式为等度洗脱,流速为0.5mL/min,检测波长为220nm,超滤组分样品浓度为10mg/mL,进样量为500μL,样品主要分为7个组分,对每个组分进行收集并冷冻干燥,最后测定各组分的α-淀粉酶抑制活性。
凝胶色谱分离色谱图如图2,在检测波长220nm下,根据出峰时间及峰形,共分离得到7个色谱峰。将这7个组分(F1-F7,按收集时间排序)分别收集,冷冻干燥后测定各组分的淀粉酶抑制活性如图3所示,样品浓度为0.5mg/mL时,F1-F7对淀粉酶抑制率分别为F1:17.86±1.90%,F2未检测到活性,F3:2.813±0.45%,F4:26.05±1.90%,F5:30.11±1.90%,F6:14.35±0.99%,F7:2.54±1.00%,其中F5组分的淀粉酶抑制活性最高,除F4外与其他组分均有显著性差异(p<0.05),根据分离色谱图来看,F5组分的出峰时间晚于F4组分说明F5组分的分子量相对较小,并且F5组分的峰形更加完整且收集时间较短,在凝胶排阻色谱中成分更具有一致性。
F5组分氨基酸序列分析:将凝胶分离组分F5溶于超纯水,于适量样品中加入二硫苏糖醇(Dithiothreitol,DTT)溶液使其终浓度为10mmol/L,56℃水浴还原1h,加入碘乙酰胺(2-Iodoacetamide IAA)溶液使其终浓度为50mmol/L,避光反应40min。最后使用脱盐柱进行脱盐,于45℃真空离心浓缩仪上挥干溶剂。
毛细管液相色谱条件:预柱:(Acclaim PepMap RPLC C18,300μmⅹ5mm,5μm),分析柱:(Acclaim PepMap RPLC C18,150μmⅹ150mm,1.9μm);流动相A:0.1%甲酸,2%乙腈(Acetonitrile,CAN);流动相B:0.1%甲酸,80%ACN;流速600nL/min;分析时间:66min;分离程序:0-2min B:4-8%,2-45min B:8-28%,45-55min B:28-40%,55-56min B:40-95%,56-66min B:95%。质谱条件:一级质谱的分辨率:70000;自动增益控制目标(AGCtarget):3e6;最大IT:40ms;扫描范围:350-1800m/z;二级质谱的分辨率:17500;自动增益控制目标(AGCtarget):1e5;最大IT:60ms;TopN:20;NCE/steppedNCE:27采用De Novo的方法对质谱结果进行分析,将质谱结果在PEAKS Studio 8.5软件进行分析,参数设置如下:蛋白修饰为氨基甲基化(C)(固定)、氧化(M)(可变)、乙酰化(蛋白N端)(可变);酶切位点设置为非特异性;遗漏酶切位点限制为2;质谱误差设置为±20ppm。选择置信度高的肽段进行肽段鉴定。
高活性组分F5种共鉴定得到64条肽段,如表1所示为评分较高的肽段的序列信息,图4为序列MMFPH的二级质谱图。图5为表1中各肽段的α-淀粉酶抑制活性。
表1藜麦淀粉酶抑制活性肽段
由图6可以看出肽段1也即序列为MMFPH(Met-Met-Phe-Pro-His)的肽段α-淀粉酶的抑制活性最好,也即为本发明要求保护的活性肽。
实验例1
将实施例1步骤(2)提取的藜麦蛋白分别用胃蛋白酶、胰蛋白酶、风味蛋白酶和中性蛋白酶进行酶解,其中各酶的浓度均为45000U/g蛋白,酶解时间均为180min,酶解条件分别为:胃蛋白酶酶解温度为37℃、pH 2.0;胰蛋白酶酶解温度为37℃、pH 8.5;风味蛋白酶酶解温度为50℃、pH 7.5;中性蛋白酶酶解温度为50℃、pH 7.0。酶解结束后在85℃水浴20min灭酶。待酶解液冷却至室温后,在4℃,4500r/min离心30min,取上清液冷冻干燥,得到藜麦蛋白酶解物,-20℃保存备用。对各酶的酶解产物分别测定淀粉酶抑制活性,结果如图6所示,相同浓度下2mg/mL胃蛋白酶酶解产物的淀粉酶抑制活性为48.74±1.23%,显著高于藜麦蛋白和其他蛋白酶酶解组分(p<0.05)。
实验例2
淀粉酶酶促反应动力学实验:将α-淀粉酶溶于pH 7.0的磷酸盐缓冲液中,浓度为1U/mL。反应管中加入0.5mL磷酸盐缓冲液,0.25mLα-淀粉酶溶液和相同体积肽段MMFPH,肽段的浓度为2mg/mL,于37℃反应10min,加入不同质量浓度淀粉溶液(0mg/mL,0.5mg/mL,1.0mg/mL,1.5mg/mL,2.5mg/mL)于37℃精确控制反应5min,加入500μL DNS,100℃水浴10min,停止反应,冷却后加入5mL去离子水,于540nm下检测吸光度。利用Lineweaver-Burk曲线的双倒数计算米氏方程常数(Km),如图7所示,最大酶促反应速率V
其中V
表2肽段MMFPH对α-淀粉酶促反应动力学参数
K
实验例3
淀粉酶与肽段分子互作实验测试:利用Reichert 2SPR仪器进行表面等离子体共振实验,选择蛋白质通用的Dextrn羟甲基葡聚糖涂层芯片,流动相为1×PBST(136mM NaCl,268mM KCl,6mM NaH
动力学实验中将肽段MMFPH用1×PBST溶解至不同浓度0.75mmol/L、1.51mmol/L、3.03mmol/L、6.05mmol/L、12.0mmol/L。用缓冲液将基线冲至水平后,在室温下,用25μL/min流速持续结合2.5min,然后解离5min,每个样品结合-解离结束后测试空白样品,待所有实验结束后使用SDS-Gly清洗芯片表面。使用TraceDrawer软件对肽段MMFPH在不同浓度下产生的结合解离曲线进行全局拟合,并计算结合(Ka)和解离(Kd)速率常数,结合亲和力通过KD=Kd/Ka公式进行计算。
实验结果如图8所示,不同浓度的肽段MMFPH对α-淀粉酶结合的SPR测量值,肽段MMFPH与α-淀粉酶结合速率常数为1.08e4 M
实验例4
基于分子对接技术研究高活性淀粉酶抑制活性肽的作用机理:α-淀粉酶的晶体结构(PDB ID:1PIF),多肽的结构通过PEP-FOLD3进行在线结构模拟,根据网站内部打分值选取能量最低的结构进行对接,对接前使用AutoDock Tools将淀粉酶上的水分子删掉并添加上电荷和氢原子,在X,Y,Z三个尺寸上设置的对接盒子大小为
本实验例通过非分子对接研究α-淀粉酶抑制活性肽MMFPH对α-淀粉酶相互作用的影响,从分子水平阐明该α-淀粉酶抑制活性肽的作用机理,结果如图9A所示,肽段MMFPH与α-淀粉酶的对接结果显示它们之间对接的结合能为-7.2kcal/mol,表明肽段与淀粉酶之间的结合是自发的。主要结合在淀粉酶的结构域A上Ca
根据文献记载:在菊苣叶水体物中鉴定出多种与淀粉酶具有抑制作用的化合物,部分化合物与淀粉酶的活性位点关键氨基酸具有结合作用,然而这些化合物中环十六烯并没有与关键氨基酸有任何结合却表现出了显著的抑制作用,通过与阿卡波糖的对比,研究人员得出结论,即环十六烯与淀粉酶之间的抑制作用并不是竞争性抑制(Anigboro AA,Avwioroko O J,Ohwokevwo O A,et al.Phytochemical profile,antioxidant,alpha-amylase inhibition,binding interaction and docking studies of Justicia carneabioactive compounds with alpha-amylase[J].Biophysical Chemistry,2021,269:106529)。因此推测在藜麦鉴定得到的多肽中肽段MMFPH上其他残基与淀粉酶之间的结合导致肽段MMFPH对α-淀粉酶抑制作用类型为不可逆型抑制作用。分子对接的结果对荧光光谱和酶促反应动力学的实验结果进行了验证,表明肽段MMFPH不仅与α-淀粉酶上活性位点残基产生相互作用,同时也与α-淀粉酶上其他位点残基相结合,其中包括具有荧光特性的酪氨酸,因此导致了α-淀粉酶荧光光谱的变化。
藜麦作为一种营养全面的谷物正逐渐走进人们的生活中,本发明通过蛋白酶解纯化的方法制备得到α-淀粉酶抑制活性肽MMFPH,发现其对α-淀粉酶的作用机理,通过和α-淀粉酶活性位点及非活性位点结合表现出两种不同的抑制方式。分子互作结果显示肽段MMFPH与淀粉酶结合模式为快结合慢解离的模式。分子对接结果显示肽段与淀粉酶上的残基His305、Ala307、Ile235、His201、His299、Glu233、Ala198、Tyr62和Gln63相互结合。为藜麦高活性淀粉酶抑制活性肽在相关食品、保健品和药品中的使用提供理论支持。
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
