一种肿瘤联合治疗疗法
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及生物医药领域。具体地说,本发明涉及一种肿瘤联合治疗疗法。
背景技术
近年来出现的肿瘤免疫治疗,尤其是靶向T/B免疫细胞表达的PD-1或肿瘤及其他细胞表达PD-L1的免疫检查点阻断(ICB)疗法,在包括肺癌等实体肿瘤中取得一些令人鼓舞的疗效,但同时更多的肿瘤对ICB疗法表现出抵抗或者应答率很低。例如,在部分肺癌中ICB疗法有较好的客观应答率,提升无进展生存期和总生存率;其中,ICB对非同义突变负担高的非小细胞肺癌更加有效。但是,大部分肺癌,尤其是PD-L1表达较低或者携有EGFR突变的肿瘤对ICB的应答不佳。EGFR突变是肺癌中常见的基因突变,而也有大量肿瘤中PD-L1表达较低。因此,探索肿瘤中PD-L1的表达是怎样被调控的,并寻找能够克服ICB应答不佳的方法对临床治疗非常重要。尤其是找到在现有ICB疗法的基础上的新的联合治疗方法,有可能改变目前ICB治疗的现状,扩大ICB疗法的受益人群。
因此,本领域需要开发一种适用于对ICB疗法不敏感的肿瘤的治疗疗法。
发明内容
本发明的目的就是提供一种适用于对ICB疗法不敏感的肿瘤的治疗疗法。
在本发明的第一方面,提供了一种活性成分组合,所述活性成分组合包含:
作为第一活性成分的AIP4/MTSS1复合物抑制剂;和
作为第二活性成分的免疫检查点抑制剂。
在另一优选例中,所述的AIP4/MTSS1复合物抑制剂选自:AIP4抑制剂、MTSS1抑制剂、AIP4/MTSS1结合阻断剂、或其组合。
在另一优选例中,所述的AIP4抑制包括:减少AIP4表达、促进AIP4降解、抑制AIP4活性、阻止AIP4与PD-L1结合、或其组合。
在另一优选例中,所述的AIP4抑制剂选自下组:小分子化合物、抗体、核酸药物、基因编辑药物,或其组合。
在另一优选例中,所述的AIP4抑制剂为三环类抗抑郁药物。
在另一优选例中,所述的AIP4抑制剂选自:氯米帕明及其活性代谢物、地昔帕明、泰尔登、氯丙嗪、丙咪嗪、曲米帕明、环苯扎林、马普替林、帕罗西汀、氟西汀、普罗替林、去甲替林、阿米替林、异丙嗪、多虑平、或其药学上可接受的盐。
在另一优选例中,所述的AIP4抑制剂为氯米帕明、或其药学上可接受的盐。
在另一优选例中,所述的MTSS1抑制包括:减少MTSS1表达、促进MTSS1降解、抑制MTSS1活性、或其组合。
在另一优选例中,所述的MTSS1抑制剂选自下组:小分子化合物、抗体、核酸药物、基因编辑药物,或其组合。
在另一优选例中,所述的MTSS1抑制剂为EGFR激活剂。
在另一优选例中,所述的AIP4/MTSS1结合阻断剂为阻断AIP4/MTSS1结合的抗体。
在另一优选例中,所述的免疫检查点抑制剂为免疫检查点抗体,优选地为抗PD-L1抗体。
在另一优选例中,所述的免疫检查点抑制剂选自下组:阿替利珠单抗、度伐利尤单抗、帕博利珠单抗、信迪利单抗等、阿维鲁单抗、纳武利尤单抗、卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗、西米普利单抗、或其组合。
在另一优选例中,所述的活性成分组合中,AIP4/MTSS1复合物抑制剂和免疫检查点抑制剂的质量比为10:1至1:1,较佳地5:1至1.5:1,更佳地为3.125:1-2:1,最佳地为2:1。
在另一优选例中,所述活性成分组合进一步包括第三活性成分,所述第三活性成分包括其他抗肿瘤药物(如化疗剂)。
在本发明的第二方面,提供了如本发明第一方面所述的活性成分组合的用途,用于制备治疗肿瘤的药物组合物或药盒。
在另一优选例中,所述的治疗肿瘤包括:抑制肿瘤细胞增殖;抑制肿瘤组织生长;和促进对肿瘤细胞的免疫杀伤。
在另一优选例中,所述的肿瘤为对免疫阻断治疗不敏感的肿瘤。
在另一优选例中,所述的免疫阻断治疗为抗PD-L1/PD-1治疗。
在另一优选例中,所述的肿瘤为:MTSS1高表达的肿瘤、PD-L1低表达的肿瘤、EGFR突变的肿瘤、或其组合。
在另一优选例中,所述的EGFR突变为EGFR
在另一优选例中,所述的MTSS1高表达是指与正常对照细胞或组织相比,MTSS1的表达和/或活性显著上调。
在另一优选例中,所述的显著上调指,在肿瘤细胞或组织中MTSS1表达量E1与正常细胞或组织中的MTSS1表达量E0之比(即E1/E0)≥1.5,较佳地≥2.0,更佳地≥2.5;和/或肿瘤细胞或组织中MTSS1的活性A1与正常细胞或组织中的MTSS1活性A0之比(即A1/A0)≥1.5,较佳地≥2.0,更佳地≥2.5。
在另一优选例中,所述的PD-L1低表达是指在肿瘤细胞或组织中PD-L1表达量E1与正常细胞或组织中的PD-L1表达量E0之比(即E1/E0)≤0.8,较佳地≤0.7,更佳地≤0.5。
在另一优选例中,所述的MTSS1高表达指其mRNA的CT值低于23cycle,PD-L1低表达指其mRNA的CT值高于28cycle。
在另一优选例中,所述的活性成分组合用于制备治疗肿瘤的药物组合物或药盒。
在另一优选例中,所述的肿瘤选自:肺癌、胃癌、肝癌、肾脏肿瘤、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、卵巢癌、淋巴癌、鼻咽癌、肾上腺肿瘤、膀胱肿瘤、脑癌、子宫内膜癌、睾丸癌、甲状腺癌、或其组合。
在另一优选例中,所述的肿瘤为肺癌,优选地为肺腺癌。
在另一优选例中,所述的肿瘤细胞为H1975肺癌细胞、LLC肺癌细胞、或其组合。
在另一优选例中,所述的药物组合物或药盒用于治疗哺乳动物或施用于哺乳动物,更佳地所述哺乳动物为啮齿类动物(如小鼠、大鼠)或人。
在本发明的第三方面,提供了一种药物组合物,所述药物组合物包含:
(A1)治疗有效量的第一活性成分,所述第一活性成分为AIP4/MTSS1复合物抑制剂;
(A2)治疗有效量的第二活性成分,所述第二活性成分为免疫检查点抑制剂;和
(B)药学上可接受的载体或赋形剂。
在另一优选例中,所述的免疫检查点为PD-1/PD-L1。
在另一优选例中,所述药物组合物中,所述(A1)、(A2)占所述药盒总重的0.01-99.99wt%,较佳地0.1-90wt%,更佳地1-80wt%。
在另一优选例中,所述的药物组合物还含有其他治疗肿瘤的药物。
在本发明的第四方面,提供了一种药盒,所述药盒包括:
(a)第一制剂,所述第一制剂含有AIP4/MTSS1复合物抑制剂、及药学上可接受的载体;
(b)第二制剂,所述第二制剂含有免疫检查点抑制剂、及药学上可接受的载体;
(c)说明书,所述说明书描述了将第一制剂和第二制剂联用以治疗肿瘤的方法。
在本发明的第五方面,提供了一种MTSS1基因、mRNA、cDNA、蛋白、或其检测试剂、或其组合的用途,用于制备一试剂盒,所述试剂盒用于选自下组的一种或多种用途:
(i)评估肿瘤对免疫细胞杀伤的敏感性;
(ii)评估肿瘤对免疫检查点阻断(ICB)疗法的敏感性;
(iii)评估肿瘤患者是否适合使用AIP4/MTSS1复合物抑制剂及免疫检查点抑制剂进行协同治疗。
在另一优选例中,所述的试剂盒内包含一说明书,所述说明书记载有:
如检测到肿瘤组织中MTSS1高表达,则可预测所述肿瘤对免疫细胞杀伤的敏感性高,且对ICB疗法敏感性低;
如检测到肿瘤组织中MTSS1低表达,则可预测所述肿瘤对免疫细胞杀伤的敏感性低,且对ICB疗法敏感性高。
在另一优选例中,所述的试剂盒中含有MTSS1基因、mRNA、cDNA或蛋白作为对照品或质控品。
在本发明的第六方面,提供了一种产品组合,所述的产品组合包含:
(A1)如本发明第三方面所述的药物组合物,或如本发明第四方面所述的药盒;
(A2)检测试剂,所述检测试剂选自下组:
(a1)检测MTSS1基因、mRNA、cDNA、蛋白,或其组合的试剂;
(a2)检测PD-L1基因、mRNA、cDNA、蛋白,或其组合的试剂;
(a3)检测EGFR突变的试剂;
(a4)所述(a1)-(a3)的任意组合。
在另一优选例中,所述的产品组合含有一容器,所述容器中含有所述检测试剂(A2);以及标签或说明书,所述标签或说明书注明所述试剂盒用于评估肿瘤患者是否适合使用AIP4/MTSS1复合物抑制剂及免疫检查点抑制剂进行协同治疗。
优选地,所述标签或说明书注明:
如在肿瘤患者中检测到MTSS1高表达、或检测到PD-L1低表达,或检测到EGFR突变,则所述患者适合使用AIP4/MTSS1复合物抑制剂及免疫检查点抑制剂进行协同治疗。
在本发明的第七方面,提供了本发明第六方面所述产品的用途,用于制备治疗肿瘤的医疗产品。
在另一优选例中,所述的肿瘤为对免疫阻断治疗不敏感的肿瘤。
在另一优选例中,所述的肿瘤为:MTSS1高表达的肿瘤、PD-L1低表达的肿瘤、EGFR突变的肿瘤、或其组合。
在另一优选例中,所述的肿瘤为肺癌。
在本发明的第八方面,提供了一种体外非治疗性的协同抑制肿瘤细胞生长的方法,包括步骤:在如本发明第一方面所述的活性成分组合存在的条件下,培养肿瘤细胞,从而协同抑制所述肿瘤细胞的生长。
在本发明的第九方面,提供了一种在有需要的对象中治疗肿瘤的联合疗法,包括步骤:
给有需要的对象施用如本发明第一方面所述的活性成分,或如本发明第三方面所述的药物组合物。
在另一优选例中,所述的对象患有MTSS1高表达、或PD-L1低表达,或EGFR突变的肿瘤。
在另一优选例中,所述的对象为哺乳动物,更优选地为啮齿类动物(如小鼠、大鼠)或人。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
下列附图用于说明本发明的具体实施方案,而不用于限定由权利要求书所界定的本发明范围。
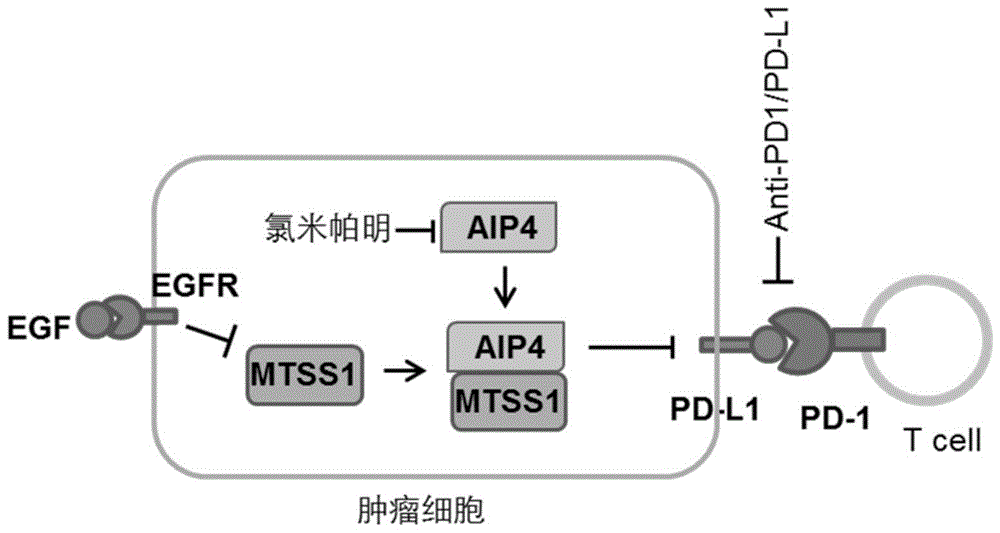
图1显示了EGFR-MTSS1-AIP4调控PD-L1表达的作用机制以及药物联用模式图。
图2显示了EGFR-MTSS1-AIP4对PD-L1表达的调控。(a,b)免疫印迹分析在人源(H1975)及鼠源(LLC)肺腺癌细胞中过表达AIP4(a)或MTSS1(b)后对PD-L1蛋白表达的影响。(c)用氯米帕明处理H1975细胞后,免疫印迹分析AIP4及PD-L1蛋白表达的变化。(d)用EGF处理肺上皮细胞激活EGFR后,免疫印迹分析MTSS1及PD-L1蛋白表达的变化。(e)蛋白泛素化实验分析在HeLa细胞中敲低AIP4(siAIP4)及过表达MTSS1后对PD-L1单泛素化水平的影响。箭头所指为单泛素化的PD-L1。(f)免疫共沉淀分析MTSS1过表达前后对AIP4蛋白与PD-L1蛋白相互作用的影响。
图3显示了MTSS1抑制的肺癌发生发展。(a)肺腺癌病人原位肿瘤和对应的癌旁组织中MTSS1的表达值(每组n=36)。(b)MTSS1高表达值组与低表达值组病人的生存曲线。(c,d)免疫正常C57小鼠皮下注射MTSS1过表达的LLC肺癌细胞系后形成的肿瘤生长曲线(c)及小鼠生存曲线(d);每组n=7或10只小鼠。(e,f)PBMC人源化小鼠皮下注射MTSS1敲低(shMTSS1)的H1975肺癌细胞后形成的肿瘤生长曲线(e)及终点肿瘤大小展示图(f)(每组n=5)。
图4显示了MTSS1表达与肿瘤中PD-L1的蛋白表达及ICB响应度的关联。(a)PBMC人源化小鼠皮下注射MTSS1敲低的H1975细胞后形成肿瘤,然后通过免疫组化定量分析肿瘤中CD8
图5显示了氯米帕明单药对肿瘤的作用。(a)不同浓度的氯米帕明处理H1975肺癌细胞后细胞的生存率。(b)25uM氯米帕明处理H1975肺癌细胞后肿瘤微球体的形成能力。(c,d)LLC细胞抑制到免疫缺陷裸鼠(c)或免疫正常的C57小鼠(d)后,用400μg氯米帕明(CMI)治疗小鼠后肿瘤的生长曲线。生理盐水(Saline)用作药物对照。(e,f)上述小鼠经氯米帕明治疗的体重情况。
图6显示了氯米帕明和PD-1/PD-L1单抗ICB疗法的联用对肺癌的疗效。(a,b)免疫正常C57小鼠体内移植LLC肺癌细胞,用400μg氯米帕明(CMI)和125μg PD-1单抗RMP1-14(anti-PD-1)单药或联用治疗后肿瘤生长曲线(a)及小鼠生存曲线(b);每组n=7,7,6,7只小鼠。生理盐水(Saline)和相同亚型的对照抗体(Iso)用作两种药物的对照。(c-f)PBMC人源化小鼠皮下移植人源H1975肺癌细胞,用400μg氯米帕明(CMI)和200μg PD-L1单抗Atezolizumab(anti-PD-L1)处理后肿瘤生长曲线(c),终点肿瘤大小展示图(d),以及免疫组化定量分析肿瘤中CD8
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一种肿瘤联合治疗疗法。本发明发现了肿瘤细胞EGFR-MTSS1-AIP4信号通路调控PD-L1表达的新机制。基于此,开发了使用AIP4/MTSS1抑制剂及ICB的联合疗法。本发明的联合疗法能产生协同作用,对肿瘤(尤其是肺癌)具有优秀的治疗效果。对于单用ICB疗法不敏感的MTSS1高表达、PD-L1低表达,以及携有EGFR突变的肿瘤也具有显著疗效,尤其对EGFR突变的肺腺癌也有效果。在此基础上,完成了本发明。
本发明通过实验发现,MTSS1介导AIP4与PD-L1蛋白的相互作用促进PD-L1的单泛素化降解,从而抑制PD-L1的表达,进而增强T细胞对肿瘤的免疫杀伤。而EGFR激活突变或者被EGF配体激活后抑制MTSS1蛋白表达,从而导致PD-L1表达上升,肿瘤发生免疫逃逸。氯米帕明(clomipramine)等AIP4抑制药物与PD-1/PD-L1单抗药物联用,能有效组合AIP4抑制药物对肿瘤细胞的杀伤作用,以及ICB疗法对免疫逃逸的阻断作用,从而提高肿瘤治疗效果。
术语
为了更容易理解本发明,以下具体定义了某些技术和科学术语。除非在本文中另有明确定义,本文使用的所有其它技术和科学术语都具有本发明所属领域的一般技术人员通常理解的含义。在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
如本文所用,术语“包含”、“包括”、“含有”可互换使用,不仅包括封闭式定义,还包括半封闭、和开放式的定义。换言之,所述术语包括了“由……构成”、“基本上由……构成”。
如本文所用,术语“药学上可接受的载体”的成分是指适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。
如本文所用,术语“治疗有效量”,是指对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。本领域的普通技术人员应该理解,所述的“治疗有效量”可随着药物组合物的形式、给药途径、所用药物的辅料、疾病的严重程度以及与其他药物联合用药等情况的不同而有所不同。
氯米帕明
氯米帕明(Clomipramine),是一种FDA批准用于临床治疗抑郁症的三环类药品。既往研究中,在细胞系等肿瘤模型中的实验发现氯米帕明及其三环类衍生物同时还可能具有抑制肿瘤的效果,例如三环类抗抑郁药可促进小细胞肺癌的凋亡,从而抑制肿瘤。不仅如此,氯米帕明还可抑制肺癌细胞增殖和干性。因此,有临床研究测试三环类抗抑郁药治疗肿瘤的疗效。但是,这些三环类药物单用抗肿瘤的临床研究疗效并不理想。
近期研究表明,氯米帕明等三环类药物同时还具有抑制E3酶AIP4的作用;在机制上,这些抑制剂通过不可逆的方式干扰E3酶AIP4的转硫醇作用,从而抑制AIP4蛋白泛素化的催化活性。
AIP4和MTSS1
本申请的研究表明,在肺癌细胞中AIP4可通过单泛素化PD-L1,使细胞膜上的PD-L1发生内吞,最终被溶酶体降解,导致肿瘤细胞PD-L1的表达降低。而骨架蛋白MTSS1促进AIP4对PD-L1的相互作用,从而抑制PD-L1的表达。在肺癌中MTSS1表达降低,导致PD-L1表达上升,使得PD-L1发挥免疫抑制作用,免疫细胞抗肿瘤效应降低,从而促进了肿瘤发生发展,但同时PD-L1表达的上升也使得肿瘤对ICB疗法的应答上升。
本申请涉及检测MTSS1表达和PD-L1表达,以评估肿瘤是否适宜使用AIP4/MTSS1抑制剂及ICB的联合疗法进行治疗的方法。如本文所用,术语“表达”包括mRNA从基因或基因部分的产生,并且包括由RNA或基因或基因部分所编码的蛋白质的产生,还包括与表达相关的检测物质的出现。例如,cDNA,结合配体(如抗体)与基因或其它寡核苷酸、蛋白质或蛋白质片段的结合以及结合配体的显色部分都包括在术语“表达”的范围内。因此,在免疫印迹如western印迹上半点密度的增加也处于以生物学分子为基础的术语“表达”的范围内。
药物组合物
本发明提供了一种药物组合物,其特征在于,所述药物组合物包含:
(A1)治疗有效量的第一活性成分,所述第一活性成分为AIP4/MTSS1复合物抑制剂;
(A2)治疗有效量的第二活性成分,所述第二活性成分为免疫检查点抑制剂;和
(B)药学上可接受的载体或赋形剂。
本发明所提供的药物组合物优选含有重量比为0.1-99wt%的第一活性成份,重量比为0.1-99wt%第二活性成分、其余部分为药学可接受的载体、稀释液或溶液或盐溶液。
相对于分别单独使用,本发明的第一活性成分、第二活性成分联合使用时能够产生对肿瘤的协同杀伤效果。
本发明的药物组合物还可以和其他有效成分联用,所述有效成分可以是任何能够预防和/或治疗癌症或癌症转移的药物成分,包括但不限于化疗剂、内分泌治疗剂、靶向治疗剂等。
需要的时候,在本发明药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
本发明所提供的化合物和药物组合物可以是多种形式,如片剂、注射剂、胶囊、粉剂、糖浆、溶液状、悬浮液和气雾剂等,并可以存在于适宜的固体或液体的载体或稀释液中和适宜的用于注射或滴注的消毒器具中。
本发明的药物组合物的各种剂型可按照药学领域的常规制备方法制备。其制剂配方的单位计量中通常包含0.05-1000mg本发明的活性化合物,优选地,制剂配方的单位计量中包含1mg-500mg本发明的活性化合物。
本发明的药物组合物可对哺乳动物临床使用,包括人和动物,可以通过口、鼻、皮肤、肺或者胃肠道等的给药途径。最优选为口服。最优选日剂量为0.01-400mg/kg体重,一次性服用,或0.01-200mg/kg体重分次服用。不管用何种服用方法,个人的最佳剂量应依据具体的治疗而定。通常情况下是从小剂量开始,逐渐增加剂量一直到找到最适合的剂量。
本发明的药物或抑制剂可通过各种不同方式施用,例如可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹导入机体。从易于给药的立场看,优选的药物组合物是液态组合物,尤其是注射剂。
典型地,本发明活性成分或含有它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔粘膜、眼、肺和呼吸道、皮肤、阴道、直肠等。
给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括O/W型、W/O型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等;固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。
本发明活性成分可以被制成普通制剂、也可以制成缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将本发明活性成分被制成片剂,可以广泛使用本领域公知的各种赋形剂,包括稀释剂、黏合剂、润湿剂、崩解剂、润滑剂、助流剂。稀释剂可以是淀粉、糊精、蔗糖、葡萄糖、乳糖、甘露醇、山梨醇、木糖醇、微晶纤维素、硫酸钙、磷酸氢钙、碳酸钙等;润湿剂可以是水、乙醇、异丙醇等;黏合剂可以是淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、微晶纤维素、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、丙烯酸树脂、卡波姆、聚乙烯吡咯烷酮、聚乙二醇等;崩解剂可以是干淀粉、微晶纤维素、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠、羧甲基淀粉钠、碳酸氢钠与枸橼酸、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠等;润滑剂和助流剂可以是滑石粉、二氧化硅、硬脂酸盐、酒石酸、液体石蜡、聚乙二醇等。
还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将给药单元制成胶囊剂,可以将有效成分本发明活性成分与稀释剂、助流剂混合,将混合物直接置于硬胶囊或软胶囊中。也可将有效成分先与稀释剂、黏合剂、崩解剂制成颗粒或微丸,再置于硬胶囊或软胶囊中。用于制备本发明片剂的各稀释剂、黏合剂、润湿剂、崩解剂、助流剂品种也可用于制备本发明的胶囊剂。
为将本发明活性成分制成注射剂,可以用水、乙醇、异丙醇、丙二醇或它们的混合物作溶剂并加入适量本领域常用的增溶剂、助溶剂、PH调剂剂、渗透压调节剂。增溶剂或助溶剂可以是泊洛沙姆、卵磷脂、羟丙基-β-环糊精等;PH调剂剂可以是磷酸盐、醋酸盐、盐酸、氢氧化钠等;渗透压调节剂可以是氯化钠、甘露醇、葡萄糖、磷酸盐、醋酸盐等。如制备冻干粉针剂,还可加入甘露醇、葡萄糖等作为支撑剂。
此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂或其他添加剂。
本发明的活性成分或组合物可单独服用,或与其他治疗药物或对症药物合并使用。
当本发明的活性成分与其他治疗药物存在协同作用时,应根据实际情况调整它的剂量。
本发明的主要优点包括:
1)本发明的研究揭示了肿瘤细胞EGFR-MTSS1-AIP4信号通路调控PD-L1表达的新机制,发现MTSS1的表达与肺癌病人对ICB疗法响应度的相关性。
2)本发明提供了AIP4/MTSS1抑制剂(尤其是三环类抗抑郁药物)与ICB疗法联合使用治疗肿瘤的新疗法,该疗法具有显著的协同效果。
3)本发明的疗法对于MTSS1高表达、PD-L1低表达,以及携有EGFR突变的肿瘤均有显著疗效,为ICB疗法不敏感的肿瘤提供了新治疗方案。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring HarborLaboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实验方法
1.免疫沉淀
293T细胞转染目的质粒48-60小时,收取细胞。细胞被IP裂解液(150mM NaCl,20mMHEPES pH 7.4,1%Triton X-100,1.5mM MgCl2,12.5mMβ-glycerophosphate,2mM EGTA,10mM NaF,1mM PMSF,1mM Na3VO4和蛋白酶抑制剂)在4℃摩天轮旋转裂解45分钟,12500rpm,4℃离心15分钟,并收取上清。取相同的蛋白,等量加入已经洗过的Flag beads,室温摩天轮旋转孵育2小时。弃掉蛋白裂解液,用IP裂解液洗3次,每次摩天轮室温旋转5分钟。最后将离心管中的液体弃干净,加入Flag beads 5倍体积的3×Flag短肽洗脱液,4℃摩天轮旋转孵育45分钟,收集上清,加入适量的6×上样缓冲液,95℃加热变性10分钟,最后免疫印迹分析。
2.T细胞介导的肿瘤杀伤
人源的PBMC细胞(PCS-800-011,ATCC)被培养在含有CD3/CD28和IL-2(10ng/mL,78036,Stemcell)的T细胞扩增培养基中一周来激活T细胞。1x 10
3.临床样本和免疫组化
PD-1/PD-L1免疫治疗前的肺腺癌样本来源于上海胸腔医院,其它的肺腺癌样本来源于上海第十人民医院。样本获取均在获得患者知情同意和医院研究审查委员会批准的情况下进行。
肺腺癌样本是石蜡切片。首先,将肺腺癌石蜡切片在65℃烘箱中放置30分钟,并依次浸入100%二甲苯中10分钟,共2次;100%二甲苯和100%乙醇1:1混合液中10分钟;100%乙醇中5分钟,共2次;95%乙醇中5分钟;85%乙醇中5分钟;75%乙醇中5分钟;50%乙醇中5分钟;蒸馏水中5分钟,共2次;PBST洗涤切片5分钟,共3次。室温将切片浸入3%的双氧水中20分钟,PBST洗涤切片5分钟,共3次。然后将切片缓慢放入沸腾的柠檬酸抗原修复液中,并且低温加热煮15分钟,冷却至室温。随后,PBST洗涤5分钟,共3次,用3%BSA封闭液室温封闭1小时,一抗4℃孵育过夜。第二天,片子用PBST洗涤5分钟,共3次,之后室温孵育二抗1小时,PBST洗涤5分钟,共3次。然后用ABC法增强信号,DAB法显色。显色后进行苏木素复染,并在1%盐酸溶液中分化数秒,在0.1%氨水中水洗数秒。随后,切片脱水和透明。具体如下:将切片依次浸入50%乙醇中5分钟;75%乙醇中5分钟;95%乙醇中5分钟;100%乙醇中5分钟,共2次;100%二甲苯和100%乙醇1:1混合液中10分钟;100%二甲苯中10分钟,共两次;最后取出切片通风橱室温风干,并且用中性树脂封片,显微镜拍照统计。
统计时,肺腺癌肿瘤样本中MTSS1和PD-L1的蛋白水平根据其免疫组化染色的强度被划分为高表达组和低表达组。对于T细胞的计数,利用显微镜200×的放大倍数,3个独立且免疫细胞浸润最丰富的区域被选择和拍照,数上皮中CD8
4.肿瘤皮下移植实验
1.25×106个Mtss1基因过表达或其对照的LLC细胞皮下移植到6-8周、雌性C57BL/6J小鼠或者BALB/c裸鼠的右侧皮下,观察小鼠肿瘤的生长状况,并在指定时间检测小鼠肿瘤大小。对于anti-PD1中和抗体和Clomipramine联合治疗,将LLC细胞移植到6-8周、雌性C57BL/6J小鼠的右侧皮下,当肿瘤体积到达50-100mm3时,腹腔注射125μg anti-PD1中和抗体或对应的IgG2a对照抗体,同时腹腔注射400μg Clomipramine或等体积的生理盐水,观察小鼠肿瘤的生长状况,并且在指定时间检测小鼠肿瘤大小。小鼠肿瘤体积计算公式:体积=0.5x长x宽
5.PBMC人源化小鼠
首先,从ALLCELLS公司购买已经验证可人源化的PBMC,将8×10
实施例1EGFR-MTSS1-AIP4对PD-L1表达的调控
在人源肺癌细胞H1975以及鼠源肺腺癌细胞系LLC中表达AIP4或MTSS1都可以降低PD-L1的表达(图2a和b)。通过氯米帕明抑制AIP4可明显上调PD-L1蛋白水平(图2c)。在肺上皮细胞中EGF处理激活EGF通路后能下调MTSS1,从而增强PD-L1表达(图2d)。蛋白泛素化分析发现通过siRNA抑制AIP4表达后PD-L1单泛素化消失,说明AIP4可导致PD-L1单泛素化,而MTSS1可进一步加强此效果。通过siRNA抑制AIP4表达后PD-L1单泛素化消失(图2e)。进一步的免疫共沉淀实验证明AIP4能与PD-L1相互作用,在过表达MTSS1蛋白的情况下,AIP4蛋白与PD-L1蛋白相互结合的能力增加(图2f)。
实施例2MTSS1对肿瘤的抑制作用
在肺腺癌病人中,与癌旁组织相比,MTSS1表达水平在其对应肺腺癌组织中显著下调(图3a),且高表达MTSS1的肺腺癌病人拥有更高的存活率(图3b)。在肺腺癌细胞系LLC中过表达鼠源MTSS1基因,然后将过表达稳转系通过皮下注射的方式注入免疫健全的C57BL/6J小鼠。体内实验显示MTSS1过表达明显抑制肿瘤生长(图3c),并显著地延长小鼠的生存期(图3d)。同时,为了进一步验证人肺腺癌细胞中MTSS1对人免疫微环境的影响,本发明人通过人外周血单核细胞(PBMC)移植在NOG免疫缺陷小鼠里重建人免疫系统,建立免疫系统人源化小鼠。在人源化小鼠皮下移植MTSS1表达被敲低的人肺癌H1975细胞,实验结果表明肿瘤细胞中敲低MTSS1表达后,会明显促进肿瘤在人源免疫系统环境中的生长(图3e和f)。
实施例3MTSS1与肿瘤中PD-L1的蛋白表达及ICB响应度的关联
在本实施例中,进一步用免疫组化的方法研究表明,肿瘤中MTSS1的表达被敲低后,CD8阳性(CD8
实施例4氯米帕明单药对肿瘤的作用
在体外细胞实验中,氯米帕明抑制AIP4可明显降低人源肺癌细胞H1975的存活率(图5a),并抑制肿瘤微球体的形成(图5b)。在免疫缺陷小鼠体内实验表明,氯米帕明治疗能有效抑制肺腺癌的生长(图5c),但是在免疫正常小鼠体内氯米帕明治疗的效果不佳,不能有效抑制肺腺癌的生长(图5d)。这些数据解释了为什么此前的研究表明氯米帕明在体外具有明显的抗癌作用,但是临床研究中的效果却存在争议,即氯米帕明虽然对肿瘤细胞有抑制作用,但在体内具有免疫系统的环境下,由于其能提高PD-L1的表达,可导致免疫系统对肿瘤的杀伤作用降低,从而使单用氯米帕明的综合效果不佳。但是,氯米帕明治疗在小鼠体内没有其他明显的副作用,不会影响小鼠的体重(图5e,f)。
实施例5氯米帕明联合ICB疗法的肿瘤治疗效果
5.1氯米帕明联合ICB疗法对PD-L1低表达肿瘤的治疗效果
本发明人验证了氯米帕明与使用PD-1/PD-L1中和抗体的ICB疗法的联合治疗策略。小鼠体内实验结果表明,在免疫正常的小鼠体内,PD-L1表达较低的鼠源LLC肺癌细胞对400μg氯米帕明或125μg PD-1中和抗体的单独治疗的响应率不佳,治疗不能有效抑制肿瘤生长(图6a)。但联合使用氯米帕明和PD-1中和抗体明显抑制移植的LLC肿瘤在小鼠体内生长(图6a及表1),延长小鼠生存期(图6b及表2)。
表1:联合治疗或者单药治疗时LLC肿瘤在免疫正常C57小鼠中的体积(mm
表2:联合治疗或者单药治疗时携有LLC肿瘤的小鼠存活时间(天).
表1的数据表明,氯米帕明+抗PD-1抗体组相对对照组的肿瘤体积下降值>氯米帕明单用的下降值+抗PD-1抗体单用的下降值。表2的数据表明氯米帕明+抗PD-1抗体组相对对照组延长的存活时间>氯米帕明单用的延长存活时间+抗PD-1抗体单用的延长存活时间。证明对于PD-L1低表达的LLC肿瘤,氯米帕明+抗PD-1抗体的联合使用相对于单独用药有显著的协同效果。
5.2氯米帕明联合ICB疗法对EGFR突变肿瘤的治疗效果
已知EGFR突变的肺癌病人对ICB治疗响应不佳。本发明人通过人外周血单核细胞(PBMC)移植在NSG免疫缺陷小鼠里重建人免疫系统,然后将携有EGFR突变的H1975人肺癌细胞移植到人源化小鼠体内,并加以400μg氯米帕明以及抗200μg PD-L1中和抗体的药物(阿替利珠单抗)单独或联合治疗。数据表明,单用氯米帕明或阿替利珠单抗都不能有效抑制肿瘤的生长,而两种药物联用则明显遏制肿瘤生长(图6c及表3),并且抑制最终肿瘤的大小(图6d)。
表3:联合治疗或者单药治疗时H1975肿瘤在人源化小鼠中的体积(mm
表3的数据表明,氯米帕明+抗PD-1抗体组相对对照组的肿瘤体积下降值>氯米帕明单用的下降值+抗PD-1抗体单用的下降值。证明对于EGFR突变的肿瘤,氯米帕明+抗PD-1抗体的联合使用相对于单独用药有显著的协同效果。
5.3氯米帕明联合ICB疗法对CD8
用免疫组化的方法对肿瘤组织中浸润的CD8
表4:联合治疗或者单药治疗时H1975肿瘤中CD8
表5:联合治疗或者单药治疗时H1975肿瘤中CD8
表4的数据表明,氯米帕明+抗PD-1抗体组相对对照组的肿瘤组织T细胞增加数目>氯米帕明单用的增加数目+抗PD-1抗体单用的增加数目。表5的数据表明,氯米帕明+抗PD-1抗体组相对对照组的T细胞激活比例上升幅度>氯米帕明单用的上升幅度+抗PD-1抗体单用的上升幅度。证明在促进肿瘤组织中的CD8
综上,本发明人的研究结果发现氯米帕明和PD-1/PD-L1中和抗体联合使用明显抑制肺腺癌的生长,对那些因PD-L1低表达和EGFR突变而导致ICB治疗效果不佳的肿瘤也有显著疗效。
讨论
本发明的研究揭示了肿瘤细胞EGFR-MTSS1-AIP4信号通路调控PD-L1表达的新机制,发现了MTSS1的表达与肿瘤病人(尤其是肺癌病人)对ICB疗法响应度的相关性。同时发现AIP4抑制剂药物氯米帕明与ICB药物联用能够起到协同作用,能改善对原来对两种单药都不敏感的肿瘤的治疗效果。
本发明的实验验证了氯米帕明与ICB药物联合使用治疗肿瘤的协同效果。其中氯米帕明作为AIP4的抑制剂发挥作用。由于本申请已验证MTSS1能够结合AIP4,加强AIP4导致PD-L1泛素化的效果,因此,本领域技术人员能够理解,MTSS1也可作为潜在的治疗靶点,故而本申请人也提供了使用MTSS1抑制剂或AIP4/MTSS1结合阻断剂的联合疗法。
综上,本研究为提高ICB疗法疗效提供了一种新的联合治疗方法:通过联用AIP4/MTSS1类抑制剂(如三环类抗抑郁药物)以及免疫检查点阻断(ICB)疗法来治疗肿瘤,包括MTSS1高表达而PD-L1低表达,以及携有EGFR突变的肿瘤,为多种肿瘤(尤其是肺癌)的治疗提供了新方案。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 在低温下具有增强性能的电池
- 在低温下具有优异的物理性能的二次电池用电解铜箔、及其生产方法
