基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统及其制备方法和应用
文献发布时间:2023-06-19 19:18:24
技术领域
本发明属于纳米生物医药技术领域,具体涉及一种基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统及其制备方法和应用。
背景技术
血脑屏障(Blood-brain barrier,BBB)是由致密连接的脑微血管内皮细胞、周细胞、星形胶质细胞和基底膜组成的血浆与脑细胞之间的屏障,主要由胶原蛋白和层粘连蛋白组成的细胞外间质包围。血管内皮细胞之间存在紧密连接,限制着许多物质从细胞间隙(细胞旁路)进入脑部。这些组成成分有助于维持血脑屏障的特殊性质,提供内皮细胞所需的各种生长和分化因子。血脑屏障的主要功能是选择性地通透物质,防止潜在的有害物质进入大脑,同时使营养物质和信号因子正常通过,从而维持脑部稳态环境。若不能维持血脑屏障的完整性会导致身体异常反应甚至严重的病理现象,例如脑膜炎,多发性硬化症,神经退行性疾病等。血脑屏障阻挡了血源性神经毒素和外源性有毒物质从而保护中枢神经系统(Central nervous system,CNS),但也限制了药物到达CNS发挥治疗作用,在治疗上增添了不小难度。到目前为止,已有许多脑靶向的新型纳米材料递送的研究报道。但是大多数的工程化纳米粒在大脑中的蓄积还是不超过1%,这说明递送系统仍有待进一步提高。有大量文献表明,革兰氏阴性菌大肠杆菌K1可穿过BBB并定植于大脑,从而诱发细菌性脑膜炎。因此,借助脑膜炎细菌对大脑的侵袭性提取细菌的外膜蛋白穿透血脑屏障,去建立高效的纳米递药系统是现在的研究方向,在这个研究方向中,如何安全地运用引起脑膜炎的细菌外膜囊泡和转化是需要解决的问题。
发明内容
本发明目的是提供基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统及其制备方法和应用。
本发明的技术方案是:
基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统,利用生物可降解的高分子材料制备装载药物的纳米粒作为基础载体,所述基础载体表面包裹大肠杆菌DH5ɑ改装外膜,所述生物可降解的高分子材料为聚乳酸-羟基乙酸。
本发明的另一技术方案是:
基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的制备方法,该方法包括:
(1)大肠杆菌DH5ɑ改装外膜的提取:在培养基中过夜培养大肠杆菌DH5ɑ,使其OD600值达到1.5,离心收集大肠杆菌DH5ɑ菌体沉淀;将所述菌体沉淀重悬于磷酸盐缓冲液,超声破碎,获得破碎菌液;将所述破碎菌液离心,获得沉淀;在所述沉淀中加入Tris缓冲液,高速离心,收集上清液;将所述上清液再次高速离心,获得去除脂多糖的大肠杆菌DH5ɑ改装外膜;将所述大肠杆菌DH5ɑ改装外膜分散于超纯水中,储存备用;
(2)纳米载体的制备:称取高分子材料,溶于有机溶剂中,形成油相;将药物溶解在所述油相中,成为油相的一部分,水相为水本身,或者,将药物溶解于水中,形成水相;将所述水相逐滴加入涡旋的油相中,超声乳化形成油包水的乳剂;将所述乳剂逐滴加入涡旋的外水相中,超声乳化形成水包油包水型的复乳;迅速将所述复乳倒入挥发水相中,搅拌过夜挥发,形成纳米载体混悬液;所述纳米载体混悬液通过高速离心提纯,获得纳米载体沉淀;将所述纳米载体沉淀超声分散于水中,高速离心,获得最终沉淀的纳米载体;将所述最终沉淀的纳米载体分散于超纯水中;
(3)大肠杆菌DH5ɑ外膜包裹纳米载体的制备:将所述大肠杆菌DH5ɑ改装外膜超声后,与所述最终沉淀的纳米载体混合并超声,使用聚碳酸酯膜多次挤出,获得基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统。
进一步的,在步骤(1)中,所述培养基为pH 7.4LB培养基,所述菌体沉淀与所述磷酸盐缓冲液的体积比为1:4,所述磷酸盐缓冲液的pH值为7.4。
进一步的,在步骤(1)中,所述离心收集大肠杆菌DH5ɑ菌体沉淀的离心的温度为4℃,离心力为5000g,时间为10min;所述超声破碎的功率为300w,时间为30min;所述破碎菌液离心的温度为4℃离心力为2900g,时间为1h;所述在所述沉淀中加入Tris缓冲液,高速离心的离心温度为4℃,离心力为20000g,时间为1h;所述将所述上清液再次高速离心的离心温度为4℃,离心力为125000-150000g,时间为2h。
进一步的,在步骤(1)中,所述在所述沉淀中加入Tris缓冲液具体为:在所述沉淀中加入7.5倍体积于沉淀湿重的0.1M Tris缓冲液,所述Tris缓冲液中含有10mM EDTA和5mg/ml脱氧胆酸钠。
进一步的,在步骤(2)中,所述高分子材料为聚乳酸-羟基乙酸,所述有机溶剂为乙酸乙酯;所述药物为成像剂,所述成像剂与所述高分子材料的质量比为0.02:1-0.2:1,溶于油相的成像剂为DiR、IR780、SPIO中的任意一种,溶于水相的成像剂为阿霉素。
进一步的,在步骤(2)中,所述外水相为2.5%聚乙烯醇或维生素聚乙二醇琥珀酸酯溶液;所述挥发水相为0.3%聚乙烯醇或维生素聚乙二醇琥珀酸酯溶液。
进一步的,在步骤(2)中,所述离心的温度为4℃,速度为30000-35000rpm,时间为20min。
进一步的,在步骤(3)中,所述大肠杆菌DH5ɑ改装外膜与所述最终沉淀的纳米载体的质量比为1:5,超声时间为3min,挤出次数为11次。
本发明的第三个技术方案是:
基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统在制备靶向脑内皮细胞的药物制剂中的应用。
本发明提供了基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统及其制备方法和应用,有益效果为:本发明方法简单,原材料易得,适于研究与应用转化,脑靶向递药系统可通过穿透血脑屏障,设计新颖,且成本低、效率高,可以发挥很好的脑靶向作用,具有极高的操作性,新颖性和经济效益。
附图说明
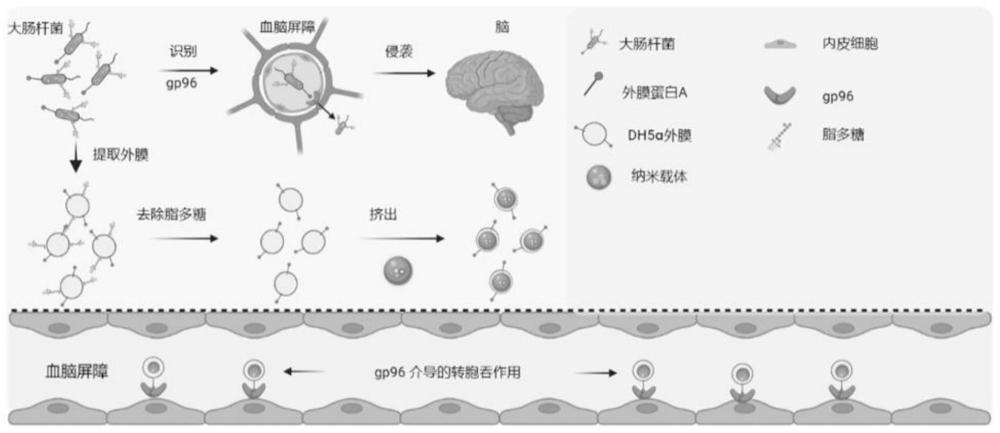
图1为本发明所述的基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的构建及其体内行为示意图;
图2为透射电镜对有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜结构的表征图;
图3为通过SDS-PAGE表征有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜的全蛋白分布图;
图4为通过western blot表征有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜的外膜蛋白A表达图;
图5为通过溶血性实验检测有脂多糖的大肠杆菌DH5ɑ外膜、大肠杆菌DH5ɑ外膜、红细胞膜、脂多糖的溶血水平图;
图6为透射电镜对大肠杆菌DH5ɑ外膜纳米载体结构的表征图;
图7为通过动态光散射法表征大肠杆菌DH5ɑ外膜纳米载体的粒径图;
图8为通过western blot表征大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜载药系统、空白纳米载体的外膜蛋白A表达图;
图9为通过溶血性实验检测有脂多糖的大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜纳米载体、红细胞膜、脂多糖的溶血水平图;
图10为定量表征的载阿霉素的多种纳米载体(阿霉素的浓度为5μg/mL,给药时间为3h)在脑微血管内皮细胞上的摄取图;
图11为定量表征的经由不同含量外源外膜蛋白A蛋白处理后载阿霉素的大肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图;
图12为定量表征的经由不同含量gp96抗体处理后载阿霉素的大肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图;
图13为通过western blot表征大肠杆菌DH5ɑ外膜、大肠杆菌外膜DH5ɑ纳米载体、大肠杆菌外膜DH5ɑ载药系统上调内皮细胞bEnd.3上gp96的表达图;
图14为定量表征的经由不同内吞抑制剂处理后载阿霉素的肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图;
图15为定量表征的不同时间IR780在载IR780大肠杆菌DH5ɑ外膜纳米载体的处理的正常鼠脑上的蓄积图,其中,IR780的剂量为2.5μg每只小鼠,给药时间为4h,12h和24h;
图16为电感耦合等离子体-质谱法定量表征的铁元素在载SPIO的多种种膜纳米载体系统处理的正常鼠脑上的蓄积图,其中,SPIO的剂量为5mg/kg小鼠,给药时间为8h;
图17为小动物成像法定性表征的不同时间IR780在载IR780的多种纳米载体系统处理的正常鼠脑上的蓄积图,其中,IR780的剂量为2.5μg每只小鼠,给药时间为2h、4h和8h;
图18为共聚焦显微镜表征的载阿霉素的红细胞膜纳米载体、Angiopep 2修饰纳米粒与大肠杆菌DH5ɑ外膜纳米载体在正常鼠脑内不同脑区的分布图,其中,阿霉素的剂量为5mg/kg小鼠,共注射两次,间隔12h,第二次注射12h后灌流。
图19为实时荧光定量PCR法定量表征的促炎因子TNF-α,IL-6,与IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统处理的正常小鼠脑上的mRNA相对表达水平图;
图20为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠脑上的浓度图;
图21为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠血清中的浓度图;
图22为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠肝脏中的浓度图;
图23为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠脾脏中的浓度图;
图24为试剂盒法定量表征的肝功能指标谷丙转氨酶、谷草转氨酶与肾功能指标尿素氮、肌酐在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统正常小鼠血清中的浓度图;
图25为苏木精—伊红染色法表征在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理后对器官组织学和形态学的观察图,图中标尺为100μm。
具体实施方式
受细菌外膜因为携带外膜蛋白可以特异性结合和侵袭BBB内皮细胞的启发,本发明利用大肠杆菌DH5ɑ外膜具有BBB侵袭能力,应用到脑靶向药物递送中,并构建出一种基于可穿透血脑屏障的大肠杆菌DH5ɑ改装外膜的脑靶向递药系统。
本发明提供一种基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统,选用生物可降解的高分子材料作为基础载体,超声乳化-溶剂挥发法制备内部装载药物的纳米载体,纳米载体表面包裹具有脑靶向入侵能力去除脂多糖的大肠杆菌DH5ɑ改装外膜,从而构建出一种基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统,该途径主要依赖于外膜蛋白A和BBB内皮细胞上可上调的gp96之间的相互作用介导的跨细胞作用,这种仿生纳米工程策略在保证低毒性和生物相容性的同时大大提高了以仿生系统为基础的药物递送系统的脑靶向效率。
上述基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的制备方法如下:
步骤一,大肠杆菌DH5ɑ改装外膜的提取;
步骤二,纳米载体的制备;
步骤三,大肠杆菌DH5ɑ改装外膜纳米载体的制备。
上述制备好的基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的制备方法可用于制备靶向脑内皮细胞的药物制剂。
上述制备好的基于可穿透血脑屏障的大肠杆菌DH5ɑ改装外膜的脑靶向递药系统请参阅图1,图1为本发明所述的基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的构建及其体内行为示意图,如图1所示,本发明所述的基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统利用DH5ɑ的去除脂多糖的外膜靶向大脑微血管内皮细胞,在大脑的血管中,该系统通过外膜蛋白A和gp96之间的特异性识别和结合,从而介导穿透BBB,并进一步分布在颅内间质间隙。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合实施例进一步说明本发明的技术方案。但是本发明不限于所列出的实施例,还应包括在本发明所要求的权利范围内其他任何公知的改变。
此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
实施例1
本实施案例按如下步骤展示一种基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统的制备方法:
1、提取大肠杆菌DH5ɑ改装外膜:在pH 7.4LB培养基中过夜培养大肠杆菌DH5ɑ,使其OD 600值达到1.5,离心收集大肠杆菌沉淀,离心参数为4℃,5000g,10min;将沉淀重悬于四倍体积的pH 7.4磷酸盐缓冲液,300W超声破碎30min;将破碎菌液以4℃,2900g离心1h;向沉淀加入7.5倍体积于细菌湿重的0.1M Tris缓冲液(含10mM EDTA和5mg/ml脱氧胆酸钠),4℃,20000g,1h高速离心;收集上清,4℃,125000-150000g,2h高速离心两次;将上述的最终大肠杆菌DH5ɑ改装外膜沉淀分散于水中,储存于-20℃待以后使用。
2、制备纳米载体:称取30mg聚乳酸-羟基乙酸于1mL乙酸乙酯中作为油相,将100μl水逐滴加入涡旋的油相中,超声乳化形成油包水乳剂;再将所述乳剂逐滴加入涡旋的2mL2.5%聚乙烯醇溶液中,超声乳化形成水包油包水型复乳;迅速将此复乳倒入50mL 0.3%聚乙烯醇溶液,搅拌过夜挥发除去乙酸乙酯;将所得纳米载体混悬液经过3000-35000rpm的高速离心20min提纯;将所述的提纯的未包裹纳米载体超声分散于适量超纯水中,高速离心水洗两次;再将所述的最终沉淀纳米载体分散于超纯水中。
3、将所得的大肠杆菌DH5ɑ改装外膜超声30s后,与最终的纳米载体按照质量比1:5混合并超声,使用200nm聚碳酸酯膜挤出11次,得到基于大肠杆菌DH5ɑ改装外膜的脑靶向递药系统,新鲜制备使用。
实施例2
为了考察本方案所提取的大肠杆菌DH5ɑ外膜,通过透射电镜考察外膜结构。请参阅图2,图2为透射电镜对有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜结构的表征图。如图2所示,透射电镜结果显示本方案成功提取了有脂多糖大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜。
实施例3
为了考察本方案所提取的大肠杆菌外膜的蛋白表达,制得有脂多糖大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜,通过SDS-PAGE考察所述外膜蛋白表达。请参阅图3,图3为通过SDS-PAGE表征有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜的全蛋白分布图。如图3所示,SDS-PAGE结果显示了有脂多糖大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜由于提取方法不同造成的蛋白差异。
实施例4
为了考察本方案所构建的纳米系统外膜蛋白A的表达,制得带有MBP标签的外膜蛋白A、有脂多糖大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜通过western blot考察所述外膜是否有可以入脑特征的外膜蛋白。请参阅图4,图4为通过western blot表征有脂多糖的大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜的外膜蛋白A表达图。如图4所示,western blot结果显示有脂多糖大肠杆菌DH5ɑ外膜和大肠杆菌DH5ɑ外膜上都有具有穿过血脑屏障的外膜蛋白A。
实施例5
为了考察大肠杆菌外膜的溶血现象,将有脂多糖大肠杆菌DH5ɑ外膜、大肠杆菌DH5ɑ外膜与红细胞膜通过溶血实验检测上述蛋白的溶血水平。请参阅图5,图5为通过溶血性实验检测有脂多糖的大肠杆菌DH5ɑ外膜、大肠杆菌DH5ɑ外膜、红细胞膜、脂多糖的溶血水平图。如图5所示,结果显示脂多糖和有脂多糖大肠杆菌DH5ɑ外膜会引起溶血反应,然而大肠杆菌DH5ɑ外膜和红细胞膜检测不到明显的溶血现象。
实施例6
为了考察本方案所构建的纳米载体系统结构,制得大肠杆菌DH5ɑ外膜纳米载体,通过透射电镜考察该载体系统结构。请参阅图6,图6为透射电镜对大肠杆菌DH5ɑ外膜纳米载体结构的表征图。如图6所示,透射电镜结果显示本方案成功构建了具有壳核结构的纳米载体系统。
实施例7
为了考察本方案所构建的纳米载体系统的粒径大小与均一程度。请参阅图7,图7为通过动态光散射法表征大肠杆菌DH5ɑ外膜纳米载体的粒径图。如图7所示,大肠杆菌DH5ɑ外膜纳米载体粒径115nm,并且多分散系数(PDI)为0.241,说明所构建的纳米载体系统均一且稳定。
实施例8
为了考察本方案所构建的纳米载体系统是否有外膜蛋白A的表达,制得大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜载药系统、空白纳米载体,通过western blot考察所述外膜蛋白A通过挤出包裹(实施例1所提及)的手段,大肠杆菌DH5ɑ外膜将外膜蛋白A转移到了所述纳米载体系统中。请参阅图8,图8为通过western blot表征大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜载药系统、空白纳米载体的外膜蛋白A表达图。如图8所示,western blot结果显示大肠杆菌DH5ɑ外膜纳米载体系统具有可介导穿过血脑屏障的外膜蛋白A。
实施例9
为了考察大肠杆菌DH5ɑ外膜纳米载体系统的溶血现象,将有脂多糖大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜纳米载体与红细胞膜纳米载体通过溶血实验检测上述纳米系统的溶血水平。请参阅图9,图9为通过溶血性实验检测有脂多糖的大肠杆菌DH5ɑ外膜纳米载体、大肠杆菌DH5ɑ外膜纳米载体、红细胞膜、脂多糖的溶血水平图。如图9所示,结果显示脂多糖和有脂多糖大肠杆菌DH5ɑ外膜纳米载体会引起溶血反应,然而大肠杆菌DH5ɑ外膜纳米载体与红细胞膜纳米载体检测不到明显的溶血现象。
实施例10
为了考察载阿霉素的多种纳米递药系统在脑微血管内皮细胞上的摄取,将小鼠脑内皮细胞(bEND.3)接种于6孔板中,分别加入未修饰纳米载体、红细胞膜纳米载体、大肠杆菌DH5ɑ外膜纳米载体孵育3h,阿霉素的浓度为5μg/mL,通过流式细胞仪FL2通道检测细胞摄取情况。该实施例的结论请参阅图10,图10为定量表征的载阿霉素的多种纳米载体(阿霉素的浓度为5μg/mL,给药时间为3h)在脑微血管内皮细胞上的摄取图。如图10所示,相比于未修饰纳米载体、红细胞膜纳米载体,大肠杆菌DH5ɑ外膜纳米载体被bEND.3细胞摄取更多,说明其更易富集于内皮细胞。
实施例11
为了考察外源外膜蛋白A处理后大肠杆菌DH5ɑ外膜纳米载体在脑微血管内皮细胞上的摄取,将小鼠脑内皮细胞(bEND.3)接种于6孔板中,分别先加入无外源外膜蛋白A、10μg外源外膜蛋白A、20μg外源外膜蛋白A和50μg外源外膜蛋白A预处理1.5h,再分别同时加入载阿霉素的DH5ɑ外膜纳米载体系统与上述不同剂量的外源外膜蛋白共孵育1.5h,阿霉素的浓度为5μg/mL,通过流式细胞仪FL2通道检测细胞摄取情况。该实施例的结论请参阅图11,图11为定量表征的经由不同含量外源外膜蛋白A蛋白处理后载阿霉素的大肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图。如图11所示,外源蛋白A能抑制内皮细胞摄取DH5ɑ外膜纳米载体系统,最多可抑制18%,证实了外膜蛋白A参与了去毒细菌外膜包裹纳米载体的脑内皮细胞摄取,结合案例11,说明外膜蛋白A和gp96之间的特异性识别密切参与血脑屏障内皮细胞摄取DH5ɑ外膜纳米载体系统。
实施例12
为了考察gp96抗体处理后DH5ɑ外膜纳米载体系统在脑微血管内皮细胞上的摄取,将小鼠脑内皮细胞(bEND.3)接种于6孔板中,分别先加入无gp96抗体、0.24μg gp96抗体、1.2μg gp96抗体预处理1.5h,再分别同时加入载阿霉素的DH5ɑ外膜纳米载体系统与上述不同剂量的抗体共孵育1.5h,阿霉素的浓度为5μg/mL,通过流式细胞仪FL2通道检测细胞摄取情况。该实施例的结论请参阅图12,图12为定量表征的经由不同含量gp96抗体处理后载阿霉素的大肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图。如图12所示,gp96抗体能抑制内皮细胞摄取DH5ɑ外膜纳米载体系统,最多可抑制20%,证实了gp96抗体参与了DH5ɑ外膜纳米载体系统的脑内皮细胞摄取,结合本实施例,说明大肠杆菌DH5ɑ外膜纳米载体系统通过外膜蛋白A和gp96之间的特异性识别来跨越血脑屏障。
实施例13
为了考察大肠杆菌DH5ɑ外膜、DH5ɑ外膜纳米载体与DH5ɑ外膜纳米载药系统引起脑微血管内皮细胞上gp96的上调,将小鼠脑内皮细胞(bEND.3)接种于T25培养瓶中,分别加入DH5ɑ外膜、DH5ɑ外膜纳米载体与DH5ɑ外膜载药系统,给药蛋白浓度为50μg/ml,处理24h。得到细胞样品后,变性定量通过western blot手段考察内皮细胞上gp96的表达。该实施例的结论请参阅图13,图13为通过western blot表征大肠杆菌DH5ɑ外膜、大肠杆菌外膜DH5ɑ纳米载体、大肠杆菌外膜DH5ɑ载药系统上调内皮细胞bEnd.3上gp96的表达图。如图13所示,western blot结果显示DH5ɑ外膜、DH5ɑ外膜纳米载体与DH5ɑ外膜载药系统会上调bEnd.3上gp96蛋白,结合案例13,说明大肠杆菌DH5ɑ外膜纳米载体系统通过外膜蛋白A和gp96之间的相互作用来跨越血脑屏障。
实施例14
为了考察大肠杆菌DH5ɑ外膜纳米载体系统在脑微血管内皮细胞上的内吞途径,将小鼠脑内皮细胞(bEND.3)接种于6孔板中,分别先加入无内吞途经抑制剂、网格蛋白途经抑制剂(氯丙嗪10μg/ml)、小窝蛋白途经抑制剂(制霉菌素25μg/ml)、脂筏途经抑制剂(甲基-β-环糊精6.5mg/ml)、巨胞饮途经抑制剂(阿米洛利100μg/ml)预处理1.5h,再分别同时加入载阿霉素的大肠杆菌DH5ɑ外膜纳米载体系统与上述抑制剂共同孵育1.5h,阿霉素的浓度为5μg/mL,通过流式细胞仪FL2通道检测细胞摄取情况。该实施例的结论请参阅图14,图14为定量表征的经由不同内吞抑制剂处理后载阿霉素的肠杆菌DH5ɑ外膜纳米载体(阿霉素的浓度为5μg/mL,给药时间为1.5h)在脑微血管内皮细胞上的摄取图。如图14所示,网格蛋白、小窝蛋白、脂筏与巨胞饮四种途经抑制剂都会内皮细胞摄取去毒大肠杆菌外膜纳米载体系统,最多被受到抑制的是脂筏途经,可抑制31%,证实了大肠杆菌DH5ɑ外膜纳米载体系统的脑内皮细胞摄取是通过以上四种内吞途经介导。
实施例15
为了定量考察不同时间IR780在载IR780的多种纳米递药系统处理的正常鼠脑上的蓄积,给正常小鼠尾静脉注射载IR780大肠杆菌DH5ɑ外膜纳米载体系统,注射4h、12h和24h后灌流固定,取小鼠脑组织,用酶标仪去定量正常脑组织的蓄积。IR780的剂量为2.5μg每只小鼠。该实施例的结论请参阅图15,图15为定量表征的不同时间IR780在载IR780大肠杆菌DH5ɑ外膜纳米载体的处理的正常鼠脑上的蓄积图。如图15所示,在4h、12h和24h,大肠杆菌DH5ɑ外膜纳米载体系统在小鼠的脑组织中均有优越的蓄积,分别为1.04%剂量/g-brain、0.97%剂量/g-brain和1.23%剂量/g-brain,表明上述纳米载体系统有出色的血脑屏障渗透能力。
大多数纳米载体,即使是那些设计用于增强BBB渗透的载体,在静脉给药后,其脑累积率较低(<1%剂量/g-brain)。因此在给药后能达到的1.23%剂量/g-brain的累积率很有吸引力,因为它明显高于大部分迄今为止报道的使用受体介导的细胞转运策略的其他载体系统的累积率。
实施例16
为了定量考察不同时间SPIO中铁元素在载SPIO的各种纳米递药系统处理的正常鼠脑上的蓄积,给正常小鼠分别尾静脉注射生理盐水、红细胞膜纳米载体、Angiopep 2修饰纳米载体、DH5ɑ外膜纳米载体系统(未预给gp96抗体)、DH5ɑ外膜纳米载体系统(预给gp96抗体),注射8h后灌流,取小鼠脑组织,用电感耦合等离子体-质谱法定量观察纳米载体中铁元素在正常脑组织的蓄积。SPIO的剂量为5mg/kg小鼠。该实施例的结论请参阅图16,图16为电感耦合等离子体-质谱法定量表征的铁元素在载SPIO的多种种膜纳米载体系统处理的正常鼠脑上的蓄积图。如图16所示,大肠杆菌DH5ɑ外膜纳米载体系统在小鼠的脑组织中纳米载体蓄积最多,且gp96抗体的预处理使大肠杆菌DH5ɑ外膜纳米载体系统在小鼠的脑组织中纳米载体蓄积显著降低,进一步证明了gp96介导的跨细胞转运在该纳米载体系统跨越血脑屏障行为中的作用。
实施例17
为了定性考察不同时间载IR780的各种纳米递药系统所处理的正常鼠脑上的药物蓄积,给正常小鼠分别尾静脉载IR780注射红细胞膜纳米载体、和大肠杆菌DH5ɑ外膜纳米载体系统,在2h、4h、8h用小动物成像系统观察活体小鼠脑部的纳米粒蓄积。IR780的剂量为2.5μg每只小鼠。该实施例的结论请参阅图17,图17为小动物成像法定性表征的不同时间IR780在载IR780的多种纳米载体系统处理的正常鼠脑上的蓄积图。如图17所示,红细胞膜纳米载体在小鼠体内没有明显的蓄积。大肠杆菌DH5ɑ外膜纳米载体系统在小鼠的脑组织中纳米粒蓄积最多,表明它有最佳的血脑屏障渗透能力。
实施例18
为了考察载阿霉素的各种纳米递药系统在正常鼠脑内不同脑区的分布,给正常小鼠分别尾静脉注射红细胞膜纳米载体、Angiopep 2修饰纳米粒和大肠杆菌DH5ɑ外膜纳米载体系统,共注射两次,间隔12h,第二次注射12h后灌流,取小鼠脑组织,蔗糖脱水,冰冻切片,用共聚焦显微镜观察纳米载体系统在正常脑组织不同脑区的分布。每次注射阿霉素的剂量为5mg/kg小鼠。该实施例的结论请参阅图18,图18为共聚焦显微镜表征的载阿霉素的红细胞膜纳米载体、Angiopep 2修饰纳米粒与大肠杆菌DH5ɑ外膜纳米载体在正常鼠脑内不同脑区的分布图。如图18所示,与Angiopep 2修饰纳米载体和红细胞膜纳米载体相比,大肠杆菌DH5ɑ外膜纳米载体系统在各个脑区的摄取更多。
实施例19
为了定量考察促炎因子TNF-α、IL-6和IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统处理的正常鼠脑上的mRNA相对表达水平,给正常小鼠尾静脉注射上述纳米载体系统,注射24h后灌流,取小鼠脑组织,用实时荧光定量PCR法定量检测促炎因子TNF-α、IL-6和IL-1β的表达。蛋白的剂量为6.86mg/kg。该实施例的结论请参阅图19,图19为实时荧光定量PCR法定量表征的促炎因子TNF-α,IL-6,与IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统处理的正常小鼠脑上的mRNA相对表达水平图。如图19所示,在mRNA水平上有脂多糖大肠杆菌DH5ɑ外膜载药系统显著增加颅内TNF-α、IL-1β和IL-6的产生,而大肠杆菌DH5ɑ外膜载药系统没有引起任何明显的炎症变化,这表明该纳米递药系统具有良好的生物安全性。
实施例20
为了定量考察促炎因子TNF-α、IL-6和IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统、脂多糖处理的正常鼠脑上的蛋白水平,给正常小鼠尾静脉注射上述各种纳米载体系统,注射24h后灌流,取小鼠脑组织,用酶联免疫吸附测定法定量检测脑组织和血清中促炎因子TNF-α、IL-6和IL-1β的蛋白表达水平。蛋白给药剂量为6.86mg/kg,脂多糖给药剂量为0.823μg/kg小鼠。该实施例的结论请参阅图20-23,图20为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠脑上的浓度图;图21为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠血清中的浓度图;图22为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠肝脏中的浓度图;图23为酶联免疫吸附测定法定量表征的促炎因子TNF-α,IL-6,IL-1β在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理的正常小鼠脾脏中的浓度图。如图20-23所示,在蛋白水平上脂多糖有脂多糖大肠杆菌DH5ɑ外膜载药系统显著增加颅内TNF-α和IL-6的产生,而大肠杆菌DH5ɑ外膜载药系统没有引起任何明显的炎症变化,这表明改纳米载体系统具有良好的生物安全性。
实施例21
为了定量考察肝功能指标谷丙转氨酶、谷草转氨酶与肾功能指标尿素氮、肌酐在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统处理的正常鼠血清中的浓度,给正常小鼠尾静脉注射上述纳米载体系统,注射24h后灌流,取小鼠血清,用试剂盒法定量检测肝功能指标谷丙转氨酶、谷草转氨酶与肾功能指标尿素氮、肌酐在正常小鼠血清中的浓度。IR780的剂量为2.5μg每只小鼠。该实施例的结论请参阅图24,图24为试剂盒法定量表征的肝功能指标谷丙转氨酶、谷草转氨酶与肾功能指标尿素氮、肌酐在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统正常小鼠血清中的浓度图。如图24所示,有脂多糖大肠杆菌DH5ɑ外膜载药系统显著增加肾功能指标的产生,而大肠杆菌DH5ɑ外膜载药系统没有引起任何明显的变化,说明它并未造成肝肾功能损伤,这表明改纳米载体系统具有良好的生物安全性。
实施例22
为了考察组织器官在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖给药后是否会有改变,给正常小鼠尾静脉注射上述纳米载体系统,蛋白给药剂量为6.86mg/kg,脂多糖给药剂量为0.823μg/kg小鼠。一周给三次药,分别在第一、四、六天。在最后一次给药的24小时后,灌流小鼠,取出小鼠器官,再将小鼠器官进行包埋切片以及苏木精—伊红染色。该实施例的结论请参阅图25,图中标尺为100μm。图25为苏木精—伊红染色法表征在生理盐水、大肠杆菌DH5ɑ外膜载药系统、有脂多糖大肠杆菌DH5ɑ外膜载药系统与脂多糖处理后对器官组织学和形态学的观察图。如图25所示,有脂多糖大肠杆菌DH5ɑ外膜载药系统和脂多糖会引起肺、肝脏与肾脏的形态上的细小改变,说明会引起一定程度的炎症反应,而大肠杆菌DH5ɑ外膜载药系统没有引起任何明显的变化,这表明改纳米载体系统具有良好的生物安全性。
与现有技术相比,本发明的有益效果是:本发明所述的基于改造大肠杆菌DH5ɑ外膜所建立的脑靶向递药系统及其制备方法和应用,以生物可降解的高分子材料为基础载体,表面包裹功能化改装后去除脂多糖的大肠杆菌DH5ɑ外膜,该递药系统基于大肠杆菌DH5ɑ外膜的外膜蛋白A和血脑屏障内皮细胞上的gp96之间的相互作用,介导血液循环中的递药系统跨过该屏障并最终进入颅内间质。该方法简单,兼具良好的生物安全性和优越的递送效率,具有可操作性和可观的经济效益。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
