一种弓形虫弱毒株及其构建方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医药技术领域,特别涉及一种弓形虫弱毒株及其构建方法和应用。
背景技术
刚地弓形虫(Toxoplasmagondii)是一种专性细胞内寄生的机会性致病原虫,可感染包括人在内的几乎所有的温血动物,在世界范围内广泛分布。弓形虫属于机会致病性病原,当人摄取含有弓形虫组织包囊的生肉或被猫粪便中卵囊污染的水之后,卵囊或组织包囊破裂,虫体入侵到肠粘膜细胞,卵囊释放的子孢子或组织包囊释放的缓殖子会转化成速殖子,最终分布到机体的各个部分,造成宿主弓形虫感染。免疫力正常的人感染弓形虫后,在机体免疫系统的作用下,宿主不表现明显的临床症状,但是对于免疫功能低下的病人,比如器官移植病人,艾滋病患者等,弓形虫感染具有很高的风险,甚至导致宿主死亡。现有药物的治疗仅对虫体的速殖子时期起作用,对于包囊内的缓殖子收效甚微,且药物的使用存在一定的毒副作用。
近年来,国内外学者认为开发疫苗免疫宿主可能是防控弓形虫病有效措施。目前,弓形虫病疫苗的研发主要集中在灭活疫苗、亚单位疫苗、核酸疫苗等,但此类疫苗仅能为免疫机体提供部分免疫保护力,而无法达到完全保护,免疫保护效果并不理想。弱毒疫苗具有免疫原性好、免疫期长等优点,成为弓形虫病防控的最佳选择之一,但目前仅有一株S48弓形虫弱毒活疫苗被允许在预防山羊和绵羊的流产中应用,但此疫苗仅局限新西兰等国家使用,且遗传背景不清楚。因此,寻找新型有效的疫苗候选抗原进行抗弓形虫病疫苗研发成为防护人类健康的重要任务。
发明内容
有鉴于此,本发明目的在于提供一种弓形虫弱毒株及其构建方法和应用,本发明通过敲除弓形虫中的TgPP6C基因,最终获得TgPP6C基因缺失的弓形虫弱毒株,发现低剂量的弓形虫弱毒株即可对弓形虫的急性感染和慢性感染具有免疫保护力。
为了实现上述目的,本发明提供以下技术方案:
一种弓形虫弱毒株的构建方法,通过敲除TgPP6C基因来影响弓形虫的胞内增殖及致病力来构建弓形虫弱毒株;所述TgPP6C基因的核苷酸序列如SEQ ID NO.1所示。
优选地,所述TgPP6C基因的敲除是利用CRISPR-Cas9技术来敲除。
优选地,所述CRISPR/Cas9系统的sgRNA的核苷酸序列如SEQ ID NO.2所示。
本发明还提供一种弓形虫弱毒株,由上述弓形虫弱毒株的构建方法构建。
本发明还提供一种上述弓形虫弱毒株在预防或治疗弓形虫感染的药物中的应用。
本发明还提供一种弓形虫弱毒活疫苗,包括上述弓形虫弱毒株。
有益技术效果:本发明提供了一种弓形虫弱毒株及其构建方法和应用,通过敲除弓形虫中的TgPP6C基因,最终获得TgPP6C基因缺失的弓形虫弱毒株,与野生株相比,TgPP6C基因缺失的弓形虫弱毒株的体外增殖速度显著下降,致病性显著降低,感染小鼠表现出不发病且不死亡现象,对宿主具有较高的安全性。同时,TgPP6C基因缺失的弓形虫弱毒株免疫小鼠后,产生高IgG抗体水平,对高剂量的弓形虫RH、PYS速殖子及Pru包囊再次感染均能够提供显著免疫保护效力,可用于预防弓形虫的再感染,是具有巨大应用价值的弱毒活疫苗。
附图说明
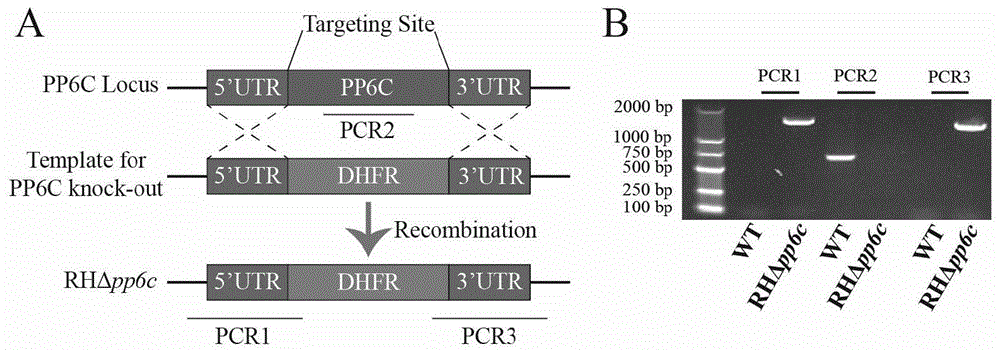
图1为弓形虫弱毒株RHΔpp6c的构建示意图,其中A为TgPP6C基因的敲除示意图;B为RHΔpp6c虫株的PCR鉴定结果图,其中PCR1、PCR3分别代表同源片段的5'和3'整合,PCR2代表TgPP6C基因是否被成功替换。
图2为弓形虫弱毒株RHΔpp6c的基本表型分析。其中,A为野生株WT和RHΔpp6c的噬斑图;B为野生株WT和RHΔpp6c胞内增殖实验及不规则纳虫泡统计,“*”代表p<0.05,差异显著;“***”代表p<0.001,差异极显著;标尺:2μm;C为TgPP6C的缺失后的胞内速殖子增殖。
图3为小鼠感染不同毒株后的抗体水平和生存曲线,其中A为不同鼠血清中IgG、IgG1及IgG2a的抗体水平;B为小鼠感染WT和RHΔpp6c弱毒株的存活率;C为接种免疫后小鼠感染不同弓形虫的存活率;D为小鼠口服灌胃包囊后的存活率;E为包囊感染小鼠30天后的脑包囊数,“n.s.”代表不显著,“***”代表p<0.001,差异极显著。
具体实施方式
本发明提供了一种弓形虫弱毒株的构建方法,通过敲除TgPP6C基因来影响弓形虫的胞内增殖及致病力来构建弓形虫弱毒株;所述TgPP6C基因的核苷酸序列如SEQ ID NO.1所示。
在本发明中,所述弓形虫弱毒株的构建方法包括如下步骤:
(1)敲除质粒的构建:将pSAG1-Cas9-SgUPRT中的UPRT替换成TgPP6C,即构建质粒pSAG1-Cas9-SgTgPP6C;构建含有TgPP6C的同源片段DHFR,在TgPP6C基因的起始密码子往前和终止密码子往后设计5'端同源臂和3'端同源臂引物,同时设计pUPRT-DHFR-D的通用扩增引物和pUC19,进行连接;最后对测序成功的DHFR质粒进行扩增。
(2)弓形虫弱毒株的构建:将上述pSAG1-Cas9-SgTgPP6C敲除质粒及含有PP6C同源臂的抗性片段电转到弓形虫中,经筛选和鉴定获得弓形虫弱毒株,记为RHΔpp6c。
在本发明中,所述TgPP6C基因的敲除优选利用CRISPR-Cas9技术来敲除。
在本发明中,所述CRISPR/Cas9系统的sgRNA的核苷酸序列如SEQ ID NO.2所示。
本发明还提供一种弓形虫弱毒株,由上述弓形虫弱毒株的构建方法构建。
本发明还提供一种上述弓形虫弱毒株在预防或治疗弓形虫感染的药物中的应用。
本发明对所述药物的剂型没有特殊限定,采用弓形虫弱毒株在医学上可接受的剂型即可。本发明对所述药物的制备方法没有特殊限定,采用相应剂型的制备方法即可。
本发明还提供一种弓形虫弱毒活疫苗,包括上述弓形虫弱毒株。
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。以下实施例中所使用的实验方法如无特殊说明,均为常规方法。以下实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。弓形虫Ⅰ型RH虫株购自美国模式培养物集存库(Americantype culture collection,ATCC),购买货号为50174。
实施例1
(1)敲除质粒的构建:
根据弓形虫基因组网站ToxoDB中的TgPP6C基因(TGGT1_301010)设计sgRNA,其核苷酸序列如SEQ ID NO.2所示。利用Q5定点突变试剂盒将pSAG1-Cas9-SgUPRT中的UPRT替换成TgPP6C,即构建质粒pSAG1::Cas9::SgTgPP6C。TgPP6C同源片段DHFR的构建,在TgPP6C基因的起始密码子往前和终止密码子往后设计5’端同源臂和3’端同源臂引物,其中5’端同源臂引物上游引物的核苷酸序列如SEQ ID NO.3所示,下游引物的核苷酸序列如SEQ ID NO.4所示;3’端同源臂引物上游引物的核苷酸序列如SEQ ID NO.5所示,下游引物的核苷酸序列如SEQ ID NO.6所示。
设计DHFR的扩增引物和pUC19扩增引物,其中从pUPRT-DHFR-D载体中扩增DHFR通用扩增引物的上游引物的核苷酸序列如SEQ ID NO.7所示,下游引物的核苷酸序列如SEQID NO.8所示;pUC19上游引物的核苷酸序列如SEQ ID NO.9所示,下游引物的核苷酸序列如SEQ ID NO.10所示
根据
然后将连接产物转化到DH5α感受态中,最后对测序成功的DHFR质粒PUC19-TgPP6C-DHFR进行扩增,即同源片段DHFR扩增,扩增引物上游引物的核苷酸序列如上SEQ IDNO.11所示,下游引物的核苷酸序列如SEQ ID NO.12所示。
其中,扩增的反应体系为:
反应条件为:94℃预变性5min;94℃变性1min,56℃退火1min,72℃延伸4min,共进行30个循环;最后72℃延伸5min。
SEQ ID NO.2:GGAGTGAGAAGAGCTGTCTC;
SEQ ID NO.3:CTTCTTCCGTCTGCTTCG;
SEQ ID NO.4:GCCTTCTTGTCGAGAGTG;
SEQ ID NO.5:TGGAGACAAAGTGGTGAAG;
SEQ ID NO.6:CCAGCATTGACTCATAGAAC;
SEQ ID NO.7:AAGCTTCGCCAGGCTGTAAATCC
SEQ ID NO.8:GAATTCATCCTGCAAGTGCATAG;
SEQ ID NO.9:TGTGAAATTGTTATCCGCTC;
SEQ ID NO.10:AACGTCGTGACTGGGAAAACC;
SEQ ID NO.11:CTTCTTCCGTCTGCTTCG;
SEQ ID NO.12:CCAGCATTGACTCATAGAAC。
(2)RHΔpp6c虫株的构建:
将HFF细胞接种于25T的细胞培养瓶中,加入8mL 10%FBS的DMEM培养基,在37℃的CO
反应条件:94℃预变性5min;94℃变性1min,56℃退火1min,72℃延伸2min,共进行30个循环;最后72℃延伸5min。
SEQ ID NO.15~SEQ ID NO.16分别为扩增3’同源臂的上游引物和下游引物;其中扩增反应体系为:
/>
反应条件:94℃预变性5min;94℃变性1min,56℃退火1min,72℃延伸2min,共进行30个循环;最后72℃延伸5min。
SEQ ID NO.17~SEQ ID NO.18分别为扩增DHFR开放阅读框的上游引物和下游引物。其中,反应体系为:
反应条件:94℃预变性5min;94℃变性1min,56℃退火1min,72℃延伸30s,共进行30个循环;最后72℃延伸5min。
SEQ ID NO.13:TCTGTTCCATCTCTTCTGCATCT;
SEQ ID NO.14:ATGCTAATTCCTTTCTACTTTGGC;
SEQ ID NO.15:ACATGACACATTCCAAGTTC;
SEQ ID NO.16:CTTCAGCAGCATCAAGTAC;
SEQ ID NO.17:TGACGCAGATGTGCGTGTATCCAC;
SEQ ID NO.18:CTTGATTGGAACCACGAAGCAC;
经PCR扩增结果可以看出,PCR1和PCR3有特异性条带,PCR2无特异性条带,确认TgPP6C已经敲除。
试验例1:
(1)基本表型分析:
间接免疫荧光:从25T细胞瓶中接出少量已完全逸出的野生株(WT)和RHΔpp6c虫株,通过血球计数板计数,使终浓度稀释到10
噬斑:从25T细胞瓶中接出少量已完全逸出的野生株(WT)和RHΔpp6c虫株,计数后使其终浓度达到10
胞内增殖:从25T细胞瓶中接出少量已完全逸出的野生株(WT)和RHΔpp6c虫株,计数后稀释终浓度至1×10
(4)减毒活疫苗的制备:
将HFF细胞接种于25T的细胞培养瓶中,加入8mL 10%FBS的DMEM培养基,在37℃的CO
(5)免疫接种小鼠:
免疫前,将购买回来的昆明雌性小鼠先饲养一周的时间以减少应激反应。将小鼠分为两大组,一组为免疫组:每只小鼠腹腔注射免疫200μL(100个)RHΔpp6c速殖子;另一组为对照组:每只小鼠腹腔注射200μL(100个)野生株WT速殖子以评价毒力作用。随后再将小鼠分为两大组,一组为免疫组:每只小鼠腹腔注射免疫200μL(200个)RHΔpp6c速殖子;另一组为对照组:每只小鼠腹腔注射200μL无菌PBS。
(6)免疫效果评价:
急性弓形虫感染组:在免疫后第60天,各取12只RHΔpp6c免疫组及空白对照组昆明鼠,从25T细胞瓶中接出少量已完全逸出的野生株RH和PYS速殖子,血球计数板计数,使终浓度稀释到5×10
慢性弓形虫感染组:在免疫后第60天,各取12只RHΔpp6c免疫组及空白对照组昆明鼠,经口感染20个II型PRU包囊,并于攻虫后每天观察小鼠健康状态,记录其存活时间;在感染PRU包囊后第30天,将存活小鼠安乐致死,并检测其脑组织中的包囊数。
(7)免疫接种小鼠:
不同组间抗体监测:免疫后于第30天采集6只免疫小鼠的血清用于检测IgG抗体以及IgG1和IgG2a抗体亚类水平。
结果:
(1)基本表型试验:
噬斑试验显示,相比于WT,RHΔpp6c表现出所形成的噬斑无论在大小及数量上都极显著降低(p<0.001),并几乎无法形成噬斑,详见图2A。我们观察到TgPP6C的缺失会导致弓形虫胞内增殖的紊乱。主要表现为,当胞内速殖子的数量达到“2”时,再进一步向“4”分裂时将出现分裂不同步,以此类推(分裂为4-8、8-16以及16-32等),不能形成我们常见的“玫瑰花环”样状,详见图2C。因此,推断TgPP6C的缺失主要影响速殖子胞内增殖阶段。由图2B可以看出,RHΔpp6c形成不规则样状的纳虫泡显著高于WT(p<0.001)。
(2)弓形虫毒力试验:
分别各取6只小鼠腹腔注射弓形虫野生株(WT)RH株和RHΔpp6c株速殖子约100个/只。由图3B可以看出:感染野生株速殖子的小鼠在8-10天内均发生死亡,而感染RHΔpp6c速殖子小鼠无死亡(p<0.001)。
(3)弓形虫RH和PYS株急性感染试验:
分别取6只各试验组小鼠用于腹腔接种弓形虫RH、PYS株速殖子约10
(4)弓形虫Pru包囊慢性感染试验:
待免疫30天后,我们将提前准备活性好的Ⅱ型虫株Pru包囊以20个的剂量对每只小鼠进行灌胃感染。对照组在感染的第10天后小鼠开始发病并部分发生死亡,而RHΔpp6c免疫鼠无发病死亡,由图3D可以看出。待包囊感染30天后,我们取存活小鼠脑组织并计数脑包囊数量。结果显示:对照组包囊数为3290±100,免疫组为35±14(p<0.001),详见图3E。
(5)评价RHΔpp6c引起的免疫反应:
在免疫后第30天时采集免疫小鼠的血清,用于检测抗弓形虫IgG、IgG1、IgG2a抗体水平。由图3A可以看出:RHΔpp6c免疫组小鼠的IgG和IgG1、IgG2a的含量显著高于对照组(p<0.001)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 鸭疫里默氏杆菌CH-1株fur基因缺失弱毒疫苗候选株、构建方法与应用
- 一株鸭疫里默氏杆菌基因缺失弱毒株及其构建方法与应用
