微藻自供氧导电抗菌多功能水凝胶的制备方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物材料技术领域,具体涉及微藻自供氧导电抗菌多功能水凝胶的制备方法。
背景技术
慢性糖尿病伤口的愈合过程缓慢,且创面深浅不一,极度不规则。伤口敷料可以保护伤口不受外部环境影响,并通过在伤口部位创造更好的愈合条件来加速伤口愈合的各个阶段。然而,传统的伤口敷料可能与创面粘连,在剥离时会对创面造成二次伤害,或者粘附性不够,容易脱落,造成伤口感染,或者只具备被动保护伤口的功效,不能与创面相互作用以加速愈合。这些因素给慢性伤口敷料的设计带来了巨大挑战。
氧含量是影响伤口愈合的一个关键参数,它涉及能量代谢的调节、伤口愈合各个阶段的氧化应激,甚至细菌的耐药性。虽然高压氧吸入在恢复特定组织方面的效果已被证实,但它依赖气态氧作为氧源,因此不容易维持足够的氧或将足够的氧输送到伤口。由于长期慢性炎症和缺氧引起的高度恶劣的微环境特征,全氟化碳、血红蛋白、工程红细胞和纳米酶催化的内源性氧气产生系统等氧供应策略在糖尿病创面愈合中效率低下。
藻类氧气生产系统如螺旋藻和蓝藻具有在自然光下持续产生氧气的特点,这些特点使其在伤口缺氧方面具有巨大的潜力。小球藻(Chlorella sp.)由于其快速增殖的特点,是目前培养最广泛的微藻之一。小球藻具有丰富的蛋白质、脂类、核酸和维生素等营养成分,被联合国粮农组织命名为“绿色健康食品”。小球藻可以通过光合作用不断产生氧气,被认为是地球上氧气的起源。近年来,活藻(聚球藻)已被证明可以改善糖尿病创面的缺氧状况,与通常使用的基于氧气的治疗方法相比,这种方法获得了更好的氧气转移效果。
水凝胶以其独特的三维多孔网络结构和亲水特性,目前已经成为一种具有多种生物医学功能的平台,在营养转移、细胞生长和传感等领域,被广泛认为是包裹活细胞的理想材料。
在伤口缺氧方面,藻类氧气生产系统如螺旋藻和绿藻在自然光下持续产生氧气的特点使其具有巨大的潜力,然而藻类单独应用于伤口表面易发生生物降解,无法通过光合作用持续产氧,基于小球藻制备生物敷料并赋予其抗菌、导电、抗氧化能力在慢性创面敷料的设计具有重大意义。
发明内容
本发明所要解决的技术问题在于针对上述现有技术的不足,提供微藻自供氧导电抗菌多功能水凝胶的制备方法。本发明的微藻自供氧导电抗菌多功能水凝胶通过将小球藻、季铵化壳聚糖、氧化普鲁兰多糖、重组胶原蛋白和聚吡咯掺杂聚多巴胺纳米材料交联,以实现水凝胶的构建。
为解决上述技术问题,本发明采用的技术方案是:一种微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,包括:
提供季铵化壳聚糖;
提供氧化普鲁兰多糖;
提供聚吡咯掺杂聚多巴胺纳米材料;
将小球藻、季铵化壳聚糖、氧化普鲁兰多糖和聚吡咯掺杂聚多巴胺纳米材料交联,得到微藻自供氧导电抗菌多功能水凝胶。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,所述微藻自供氧导电抗菌多功能水凝胶中,季铵化壳聚糖的质量百分含量为1.25wt%~2wt%,氧化普鲁兰多糖的质量百分含量为2.5wt%~10wt%,小球藻的浓度为1×10
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,所述小球藻为培养扩增后小球藻,培养扩增小球藻的方法包括:将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述接种培养并传代的光照强度为4000lx~6500lx;所述离心分离的离心速率为4000rpm~8000rpm。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,提供季铵化壳聚糖,具体包括:
步骤201、将壳聚糖溶解于醋酸溶液中,得到体系A;所述壳聚糖分子量为30000~100000;所述醋酸溶液的体积为壳聚糖质量的50~200倍,所述醋酸溶液体积的单位为mL,壳聚糖质量的单位为g;所述醋酸溶液的质量百分含量为0.5wt%~2wt%;
步骤202、向所述体系A中加入环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃~65℃条件下反应18h~36h,得到体系B;所述环氧丙基三甲基氯化铵的质量为壳聚糖质量的1倍~3倍;
步骤203、将所述体系B透析冻干,得到季铵化壳聚糖。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,提供氧化普鲁兰多糖,具体包括:
步骤301、将普鲁兰多糖溶于去离子水中,得到体系C;所述去离子水的体积为普鲁兰多糖质量的50~100倍,所述去离子水体积单位为mL,普鲁兰多糖质量单位为g;所述普鲁兰多糖分子量为200000;
步骤302、将高碘酸钠加入所述体系C中,避光搅拌10h~30h,得到体系D;所述高碘酸钠质量为普鲁兰多糖质量的0.66~3.5倍;
步骤303、向所述体系D中加入乙二醇以终止反应,得到体系E;所述乙二醇质量为普鲁兰多糖质量的1.32~3.96倍;
步骤304、将所述体系E透析冻干,得到氧化普鲁兰多糖。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,提供聚吡咯掺杂聚多巴胺纳米材料,具体包括:
步骤401、冰水浴条件下,将单体吡咯和盐酸多巴胺溶解在Tris溶液中,得到体系F;
步骤402、取过硫酸铵溶解于Tris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液转移到体系F中,4℃~8℃搅拌18~24h,得到体系G;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,步骤401中,所述单体吡咯的物质的量为盐酸多巴胺物质的量的2~6倍,所述Tris溶液的体积为单体吡咯体积的130~250倍;步骤402中,所述过硫酸铵质量为盐酸多巴胺质量的3~16倍,所述Tris缓冲液体积为过硫酸铵质量的10~12倍,所述Tris缓冲液体积单位为mL,过硫酸铵质量单位为g。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,以小球藻、季铵化壳聚糖、氧化普鲁兰多糖和聚吡咯掺杂聚多巴胺纳米材料为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖溶解于蒸馏水中,得到季铵化壳聚糖溶液;所述季铵化壳聚糖溶液中季铵化壳聚糖质量浓度为5wt%~8wt%;
步骤502、将氧化普鲁兰多糖溶解于蒸馏水中,得到氧化普鲁兰多糖溶液;所述氧化普鲁兰多糖溶液中氧化普鲁兰多糖浓度为5wt%~20wt%;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料分散于分散剂中,得到聚吡咯掺杂聚多巴胺纳米材料分散液;聚吡咯掺杂聚多巴胺纳米材料分散液中聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL~10mg/mL;
步骤504、按照体积比为1:1,将步骤501所述季铵化壳聚糖溶液与步骤503所述聚吡咯掺杂聚多巴胺纳米材料分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述氧化普鲁兰多糖溶液中,得到混合体系B;所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B混合,得到微藻自供氧导电抗菌多功能水凝胶。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,步骤503中,所述分散剂为去离子水或重组胶原蛋白溶液;所述重组胶原蛋白溶液中重组胶原蛋白的质量百分含量≤1wt%。
上述的微藻自供氧导电抗菌多功能水凝胶的制备方法,其特征在于,所述重组胶原蛋白为重组Ⅰ型胶原蛋白、重组Ⅲ型胶原蛋白或重组类人胶原蛋白。
本发明与现有技术相比具有以下优点:
1、本发明的微藻自供氧导电抗菌多功能水凝胶的制备方法,通过将小球藻、季铵化壳聚糖、重组胶原蛋白、氧化普鲁兰多糖和聚吡咯掺杂聚多巴胺纳米材料交联,以实现水凝胶的构建,该水凝胶具有可自供氧、导电和抗菌性能,可有效针对当前慢性糖尿病伤口所具有的长期炎症、强氧化应激性、高糖以及创面微环境已发生变化等独特的创面环境,其慢性糖尿病伤口修复闭合率达到99.6%,伤口附近有新生的毛囊和血管等皮肤附属物,具有良好的伤口愈合效果。
2、本发明的微藻自供氧导电抗菌多功能水凝胶的制备方法,包括向水凝胶中引入聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,通过多巴胺掺杂改性聚吡咯,赋予其更多高反应性结合位点,可有效避免因聚吡咯疏水性导致的在水凝胶中分散不足的缺陷,实现其生物相容性与导电性的发挥,实现微藻自供氧导电抗菌多功能水凝胶的长时间、可重复、高效清除活性氧。
3、采用本发明方法制备得到的微藻自供氧导电抗菌多功能水凝胶,可在4℃条件下保存9天,且可在温度恢复至室温时很快恢复活性,具有储存稳定高的特点,具有现有药物无法比拟的优势,可为针对糖尿病皮肤缺损设计新型生物材料提供实验依据和理论基础。
4、本发明方法中向水凝胶体系中引入重组胶原蛋白,与其他动物来源的胶原蛋白相比,重组胶原蛋白具有优异的生物相容性和低免疫原性,胶原蛋白是细胞外基质的主要成分,重组胶原蛋白可以为细胞提供营养,促进细胞增殖,胶原蛋白表达,以及促进伤口愈合。
5、优选的,本发明的方法中,分散剂为重组胶原蛋白,可极大提升聚多巴胺纳米材料的溶解度。
6、本发明的微藻自供氧导电抗菌多功能水凝胶的制备方法原料成本低、工艺简单可控,具有广泛的应用场景和商业价值。
下面结合附图和实施例,对本发明的技术方案做进一步的详细描述。
说明书附图
图1为实施例1、实施例6和实施例7水凝胶的流变学测试;
图2为实施例1步骤四所述聚吡咯掺杂聚多巴胺纳米材料PPY@PDA在500nm标尺下的TEM图像;
图3为实施例1、实施例10~实施例12的微藻自供氧导电抗菌多功能水凝胶QPMP1的产氧和降糖能力示意图;
图4为实施例1~7水凝胶的电导率;
图5为实施例1~7水凝胶的DPPH自由基清除效率示意图;
图6为实施例1~7水凝胶的体外溶血实验结果示意图;
图7为实施例1~7水凝胶的体外细胞相容性测试结果示意图;
图8为实施例1、实施例6和实施例7水凝胶的体外抗菌性能测试结果示意图;
图9为实施例1的微藻自供氧导电抗菌多功能水凝胶QPMP1压力响应性能示意图;
图10为实施例1的微藻自供氧导电抗菌多功能水凝胶QPMP1渗出物反应性能示意图;
图11为实施例1~7水凝胶对慢性糖尿病伤口修复闭合率测试中的统计结果;
图12为实施例13~15的水凝胶体外细胞相容性测试结果示意图。
具体实施方式
本发明提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法。该微藻自供氧导电抗菌多功能水凝胶通过将小球藻、季铵化壳聚糖、氧化普鲁兰多糖、重组胶原蛋白和聚吡咯掺杂聚多巴胺纳米材料交联,以实现水凝胶的构建。
本发明提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述接种培养并传代的培养温度为25℃,光照强度为4000lx~6500lx;所述离心分离的离心速率为4000rpm~8000rpm,所述洗涤的次数为3次~9次;所述光照强度比如可以为4000lx、5000lx或6500lx;所述离心分离的离心速率比如可以为4000rpm、6000rpm或8000rpm,所述洗涤的次数比如可以为3次、6次或9次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶解于50mL~200mL质量百分含量为0.5wt%~2wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为30000~100000;所述醋酸溶液的体积为壳聚糖质量的50~200倍,所述醋酸溶液体积的单位为mL,壳聚糖质量的单位为g;所述醋酸溶液的体积比如可以为50mL、100mL或200mL,所述醋酸溶液的质量百分含量比如可以为0.5wt%、1wt%或2wt%;
步骤202、向所述体系A中加入环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃~65℃条件下反应18h~36h,得到体系B;所述环氧丙基三甲基氯化铵的质量为壳聚糖质量的1倍~3倍;所述环氧丙基三甲基氯化铵的质量为壳聚糖质量的倍数比如可以为1倍、2倍或3倍;所述反应温度比如可以为55℃、60℃或65℃,所述反应时间比如可以为18h、24h或36h;
步骤203、将所述体系B在去离子水中透析72h~144h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;所述透析时间比如可以为72h、96h或144h;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于50mL~100mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述去离子水的体积为普鲁兰多糖质量的50~100倍,所述去离子水体积单位为mL,普鲁兰多糖质量单位为g;所述普鲁兰多糖分子量为200000;所述搅拌速率为5000~12000rpm/min;所述去离子水的体积比如可以为50mL、80mL或100mL;所述搅拌速率比如可以为5000rpm/min、10000rpm/min或12000rpm/min;
步骤302、将0.66g~3.5g高碘酸钠加入所述体系C中,避光搅拌10h~30h,得到体系D;所述高碘酸钠质量为普鲁兰多糖质量的0.66~3.5倍;所述高碘酸钠质量比如可以为0.66g、2.5g或3.5g,所述搅拌的时间比如可以为10h、20h或30h;
步骤303、向所述体系D中加入1.32g~3.96g乙二醇,以进行1h~4h的终止反应,得到体系E;所述乙二醇质量为普鲁兰多糖质量的1.32~3.96倍;所述乙二醇的质量比如可以为1.32g、2.32g或3.96g,所述终止反应的时间比如可以为1h、2h或4h;
步骤304、将所述体系E在去离子水中透析72h~144h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;所述透析的时间比如可以为72h、96h或144h;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将0.48mL~1.44mL单体吡咯和0.2g~1.8g盐酸多巴胺溶解在100mL~300mL Tris溶液中,得到体系F;所述单体吡咯的物质的量为盐酸多巴胺物质的量的2~6倍;所述Tris溶液的体积为单体吡咯体积的130~250倍;所述单体吡咯的体积比如可以为0.48mL、1.2mL或1.44mL,所述盐酸多巴胺质量比如可以为0.2g、0.4g或1.8g,所述Tris溶液体积比如可以为100mL、200mL或300mL;
步骤402、取2g~10g过硫酸铵溶解于20mL~100mL Tris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液转移到体系F中,4℃~8℃搅拌18~24h,得到体系G;所述过硫酸铵质量为盐酸多巴胺质量的3~16倍;所述Tris缓冲液体积为过硫酸铵质量的10~12倍,所述Tris缓冲液体积单位为mL,过硫酸铵质量单位为g;所述过硫酸铵质量比如可以为2g、5g或10g,所述Tris缓冲液体积比如可以为20mL、60mL或100mL,所述搅拌温度比如可以为4℃、6℃或8℃,所述搅拌时间比如可以为18h、20h或24h;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤3次~9次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;所述洗涤次数比如可以为3次、6次或9次;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为5wt%~8wt%的QCS溶液;所述季铵化壳聚糖质量浓度比如可以为5wt%、6wt%或8wt%;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为5wt%~20wt%的OP溶液;氧化普鲁兰多糖浓度比如可以为5wt%、10wt%或20wt%;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于分散剂中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL~10mg/mL的PPY@PDA分散液;所述PPY@PDA分散液中聚吡咯掺杂聚多巴胺纳米材料浓度比如可以为2mg/mL、4mg/mL、6mg/mL、8mg/mL或10mg/mL;所述分散剂为去离子水或重组胶原蛋白溶液,所述重组胶原蛋白溶液中重组胶原蛋白的质量百分含量≤1wt%;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B混合,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为1.25wt%~2wt%、2.5wt%~10wt%、1×10
以下结合实施例具体说明本发明的内容,下列说明并非对本发明的限制。
按本发明的方法制备得到一系列微藻自供氧导电抗菌多功能水凝胶,具体如下。
实施例1
本实施例提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为4000lx;所述离心分离的离心速率为4000rpm,所述洗涤的次数为3次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶于100mL质量百分含量为1wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为100000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃条件下继续搅拌以进行18h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析72h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于50mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为10000rpm/min;
步骤302、将0.66g高碘酸钠加入所述体系C中,避光搅拌10h,得到体系D;
步骤303、向所述体系D中加入1.32g乙二醇,以进行1h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析72h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将0.48mL单体吡咯和0.2g盐酸多巴胺溶解在100mL Tris溶液中,得到体系F;所述单体吡咯购买于上海麦克林生化科技有限公司;所述盐酸多巴胺购买自上海阿拉丁生化科技股份有限公司;所述Tris溶液的pH为8.5,浓度为0.01M;
步骤402、取2g过硫酸铵溶解于20mLTris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液缓慢转移到体系F中,8℃剧烈搅拌18h,得到体系G;所述Tris缓冲液的pH为8.5,浓度为0.01M;所述剧烈搅拌的速率为1200rpm/min;所述缓慢转移的加液速率为0.5mL/min;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤3次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为5wt%的QCS溶液;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为5wt%的OP溶液;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于重组胶原蛋白溶液中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液;所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为1wt%;所述重组胶原蛋白为大分子I型重组胶原蛋白,所述重组胶原蛋白由来自天然人I型胶原蛋白的短氨基酸序列作为重复单元进行多次重复而构成,其中,所述短氨基酸序列如SEQ ID No.:1(G A P G A P G S Q G AP G L)所示,重复次数为52次,该胶原蛋白具有良好水溶性,分子量为78862Da,购买于西安巨子生物基因技术股份有限公司;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B搅拌混合30s,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为1.25wt%、2.5wt%、1×10
实施例2
本实施例与实施例1相同,其中不同的为,步骤503中聚吡咯掺杂聚多巴胺纳米材料浓度为4mg/mL,命名为QPMP2。
实施例3
本实施例与实施例1相同,其中不同的为,步骤503中聚吡咯掺杂聚多巴胺纳米材料浓度为6mg/mL,命名为QPMP3。
实施例4
本实施例与实施例1相同,其中不同的为,步骤503中聚吡咯掺杂聚多巴胺纳米材料浓度为8mg/mL,命名为QPMP4。
实施例5
本实施例与实施例1相同,其中不同的为,步骤503中聚吡咯掺杂聚多巴胺纳米材料浓度为10mg/mL,命名为QPMP5。
实施例6
本实施例提供一种水凝胶QP的制备方法,包括:
步骤一、制备季铵化壳聚糖QCS,具体步骤包括:
步骤101、将1g壳聚糖溶于100mL质量百分含量为1wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为100000;
步骤102、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃条件下继续搅拌以进行18h的反应,得到体系B;
步骤103、将所述体系B在去离子水中透析72h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤二、制备氧化普鲁兰多糖OP,具体步骤包括:
步骤201、将1g普鲁兰多糖溶于100mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为5000~12000rpm/min;
步骤202、将0.66g高碘酸钠加入所述体系C中,避光搅拌10h,得到体系D;
步骤203、向所述体系D中加入1.32g乙二醇,以进行1h的终止反应,得到体系E;
步骤204、将所述体系E在去离子水中透析72h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤三、以季铵化壳聚糖QCS和氧化普鲁兰多糖OP为原料,制备多糖基质水凝胶,具体步骤包括:
步骤301、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖浓度为2.5Wt%的QCS溶液;
步骤302、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为5Wt%的OP溶液;
步骤303、按照体积比为1:1,将QCS溶液和OP溶液混合,得到由QCS和OP的席夫碱水凝胶,即水凝胶QP;所述水凝胶QP中,QCS和OP的浓度分别为1.25Wt%和2.5Wt%。
实施例7
本实施例提供一种水凝胶QPM的制备方法,包括:
步骤一、培养扩增小球藻,具体步骤包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为4000lx;所述离心分离的离心速率为4000rpm,所述洗涤的次数为3次;
步骤二、制备季铵化壳聚糖QCS,具体步骤包括:
步骤201、将1g壳聚糖溶于100mL质量百分含量为1wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为100000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃条件下继续搅拌以进行18h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析72h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、制备氧化普鲁兰多糖OP,具体步骤包括:
步骤301、将1g普鲁兰多糖溶于50mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为5000rpm/min;
步骤302、将0.66g高碘酸钠加入所述体系C中,避光搅拌10h,得到体系D;
步骤303、向所述体系D中加入1.32g乙二醇,以进行1h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析72h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、以扩增所得小球藻、季铵化壳聚糖QCS和氧化普鲁兰多糖OP为原料,制备由QCS和OP交联的包载小球藻的席夫碱水凝胶;
步骤401、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为2.5wt%的QCS溶液;
步骤402、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖质量浓度为5wt%的OP溶液;
步骤403、将扩增后小球藻离心洗涤后,分散于OP溶液中,得到混合体系F;所述混合体系F中小球藻浓度为2×10
步骤404、按照体积比为1:1,将QCS溶液和混合体系F混匀,得到由QCS和OP交联的包载小球藻的席夫碱水凝胶,即水凝胶QPM;所述水凝胶QPM中,QCS、OP和小球藻的浓度分别为1.25Wt%、2.5Wt%和1×10
实施例8
本实施例与实施例1相同,其中不同之处在于,步骤202中环氧丙基三甲基氯化铵的质量为3g。
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例9
本实施例与实施例1相同,其中不同之处在于,步骤202中环氧丙基三甲基氯化铵的质量为1g。
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例10
本实施例与实施例1相同,其中不同之处在于,步骤505中混合体系B中小球藻浓度为2×10
实施例11
本实施例与实施例1相同,其中不同之处在于,步骤505中混合体系B中小球藻浓度为2×10
实施例12
本实施例与实施例1相同,其中不同之处在于,步骤505中混合体系B中小球藻浓度为10×10
实施例13
本实施例与实施例1相同,其中不同之处在于,步骤503中,所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为0.5wt%。
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例14
本实施例与实施例1相同,其中不同之处在于,步骤503中,所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为0.25wt%。
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例15
本实施例与实施例1相同,其中不同之处在于,步骤503为,将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于去离子水中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液。
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致,本实施例的水凝胶细胞相容性性能测试结果如图12所示。
实施例16
本实施例提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为5000lx;所述离心分离的离心速率为6000rpm,所述洗涤的次数为6次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶于50mL质量百分含量为2wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为30000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在65℃条件下继续搅拌以进行24h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析96h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于80mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为5000rpm/min;
步骤302、将3.5g高碘酸钠加入所述体系C中,避光搅拌20h,得到体系D;
步骤303、向所述体系D中加入2.32g乙二醇,以进行2h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析96h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将1.44mL单体吡咯和1.8g盐酸多巴胺溶解在200mL Tris溶液中,得到体系F;所述单体吡咯购买于上海麦克林生化科技有限公司;所述盐酸多巴胺购买自上海阿拉丁生化科技股份有限公司;所述Tris溶液的pH为8.5,浓度为0.01M;
步骤402、取5g过硫酸铵溶解于60mLTris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液缓慢转移到体系F中,4℃剧烈搅拌20h,得到体系G;所述Tris缓冲液的pH为8.5,浓度为0.01M;所述剧烈搅拌的速率为1200rpm/min;所述缓慢转移的加液速率为0.5mL/min;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤6次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为6wt%的QCS溶液;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为10wt%的OP溶液;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于重组胶原蛋白溶液中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液;所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为1wt%;所述重组胶原蛋白为大分子I型重组胶原蛋白,所述重组胶原蛋白由来自天然人I型胶原蛋白的短氨基酸序列作为重复单元进行多次重复而构成,其中,所述短氨基酸序列如SEQ ID No.:1(G A P G A P G S Q G AP G L)所示,重复次数为52次,该胶原蛋白具有良好水溶性,分子量为78862Da,购买于西安巨子生物基因技术股份有限公司;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B搅拌混合30s,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为1.5wt%、5wt%、1×10
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例17
本实施例提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为6500lx;所述离心分离的离心速率为8000rpm,所述洗涤的次数为9次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶于200mL质量百分含量为0.5wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为80000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在60℃条件下继续搅拌以进行36h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析144h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于100mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为12000rpm/min;
步骤302、将2.5g高碘酸钠加入所述体系C中,避光搅拌30h,得到体系D;
步骤303、向所述体系D中加入3.96g乙二醇,以进行4h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析144h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将1.2mL单体吡咯和0.6g盐酸多巴胺溶解在300mL Tris溶液中,得到体系F;所述单体吡咯购买于上海麦克林生化科技有限公司;所述盐酸多巴胺购买自上海阿拉丁生化科技股份有限公司;所述Tris溶液的pH为8.5,浓度为0.01M;
步骤402、取10g过硫酸铵溶解于100mLTris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液缓慢转移到体系F中,6℃剧烈搅拌24h,得到体系G;所述Tris缓冲液的pH为8.5,浓度为0.01M;所述剧烈搅拌的速率为1200rpm/min;所述缓慢转移的加液速率为0.5mL/min;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤9次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为8wt%的QCS溶液;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为20wt%的OP溶液;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于重组胶原蛋白溶液中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液;所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为1wt%;所述重组胶原蛋白为大分子I型重组胶原蛋白,所述重组胶原蛋白由来自天然人I型胶原蛋白的短氨基酸序列作为重复单元进行多次重复而构成,其中,所述短氨基酸序列如SEQ ID No.:1(G A P G A P G S Q G AP G L)所示,重复次数为52次,该胶原蛋白具有良好水溶性,分子量为78862Da,购买于西安巨子生物基因技术股份有限公司;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B搅拌混合30s,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为2wt%、10wt%、1×10
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例18
本实施例提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为4000lx;所述离心分离的离心速率为4000rpm,所述洗涤的次数为3次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶于100mL质量百分含量为1wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为100000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃条件下继续搅拌以进行18h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析72h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于50mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为10000rpm/min;
步骤302、将0.66g高碘酸钠加入所述体系C中,避光搅拌10h,得到体系D;
步骤303、向所述体系D中加入1.32g乙二醇,以进行1h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析72h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将0.48mL单体吡咯和0.2g盐酸多巴胺溶解在100mL Tris溶液中,得到体系F;所述单体吡咯购买于上海麦克林生化科技有限公司;所述盐酸多巴胺购买自上海阿拉丁生化科技股份有限公司;所述Tris溶液的pH为8.5,浓度为0.01M;
步骤402、取2g过硫酸铵溶解于20mLTris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液缓慢转移到体系F中,8℃剧烈搅拌18h,得到体系G;所述Tris缓冲液的pH为8.5,浓度为0.01M;所述剧烈搅拌的速率为1200rpm/min;所述缓慢转移的加液速率为0.5mL/min;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤3次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为5wt%的QCS溶液;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为5wt%的OP溶液;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于重组胶原蛋白溶液中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液;所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为1wt%;所述重组胶原蛋白为大分子III型重组胶原蛋白,所述重组胶原蛋白由来自天然人III型胶原蛋白的α1链氨基酸序列构成,该胶原蛋白具有良好水溶性,分子量为125.3kDa,购买于西安巨子生物基因技术股份有限公司;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B搅拌混合30s,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为1.25wt%、2.5wt%、1×10
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
实施例19
本实施例提供一种微藻自供氧导电抗菌多功能水凝胶的制备方法,包括:
步骤一、培养扩增小球藻,具体包括:
步骤101、将蛋白核小球藻接种培养并传代,将传代后体系离心分离并用去离子水洗涤,得到扩增后小球藻;所述蛋白核小球藻购买自中国科学院淡水藻种库,编号为FACHB-5,所述小球藻直径为0.3~8μm;所述接种培养并传代的培养温度为25℃,光照强度为4000lx;所述离心分离的离心速率为4000rpm,所述洗涤的次数为3次;
步骤二、提供季铵化壳聚糖QCS,具体包括:
步骤201、将1g壳聚糖溶于100mL质量百分含量为1wt%的醋酸溶液中,室温条件下搅拌使充分溶解,得到体系A;所述壳聚糖分子量为100000;
步骤202、向所述体系A中加入1.884g环氧丙基三甲基氯化铵,充分搅拌使溶解后在55℃条件下继续搅拌以进行18h的反应,得到体系B;
步骤203、将所述体系B在去离子水中透析72h,然后冻干,得到季铵化壳聚糖QCS;所述透析过程中每隔8h更换一次去离子水;
步骤三、提供氧化普鲁兰多糖OP,具体包括:
步骤301、将1g普鲁兰多糖溶于50mL去离子水中,室温条件下搅拌使充分溶解,得到体系C;所述普鲁兰多糖购买自上海麦克林生化科技有限公司,分子量为200000,所述搅拌以能充分溶解为准,搅拌速率可以为10000rpm/min;
步骤302、将0.66g高碘酸钠加入所述体系C中,避光搅拌10h,得到体系D;
步骤303、向所述体系D中加入1.32g乙二醇,以进行1h的终止反应,得到体系E;
步骤304、将所述体系E在去离子水中透析72h,然后冻干,得到氧化普鲁兰多糖OP;所述透析过程中每隔8h更换一次去离子水;
步骤四、提供聚吡咯掺杂聚多巴胺纳米材料PPY@PDA,具体包括:
步骤401、冰水浴条件下,将0.48mL单体吡咯和0.2g盐酸多巴胺溶解在100mL Tris溶液中,得到体系F;所述单体吡咯购买于上海麦克林生化科技有限公司;所述盐酸多巴胺购买自上海阿拉丁生化科技股份有限公司;所述Tris溶液的pH为8.5,浓度为0.01M;
步骤402、取2g过硫酸铵溶解于20mLTris缓冲液中,得到过硫酸铵溶液,将所述过硫酸铵溶液缓慢转移到体系F中,8℃剧烈搅拌18h,得到体系G;所述Tris缓冲液的pH为8.5,浓度为0.01M;所述剧烈搅拌的速率为1200rpm/min;所述缓慢转移的加液速率为0.5mL/min;
步骤403、将所述体系G过滤,得到截留物,将所述截留物用去离子水和无水乙醇依次洗涤3次,离心收集沉淀物,将所述沉淀物冻干,得到聚吡咯掺杂聚多巴胺纳米材料PPY@PDA;
步骤五、以扩增后小球藻、季铵化壳聚糖QCS、氧化普鲁兰多糖OP和聚吡咯掺杂聚多巴胺纳米材料PPY@PDA为原料,制备微藻自供氧导电抗菌多功能水凝胶,具体包括:
步骤501、将季铵化壳聚糖QCS溶解于蒸馏水中,得到季铵化壳聚糖质量浓度为5wt%的QCS溶液;
步骤502、将氧化普鲁兰多糖OP溶解于蒸馏水中,得到氧化普鲁兰多糖浓度为5wt%的OP溶液;
步骤503、将聚吡咯掺杂聚多巴胺纳米材料PPY@PDA分散于重组胶原蛋白溶液中,得到聚吡咯掺杂聚多巴胺纳米材料浓度为2mg/mL的PPY@PDA分散液;所述重组胶原蛋白溶液中重组胶原蛋白的质量浓度为1wt%;所述重组胶原蛋白为重组类人胶原蛋白,所述重组胶原蛋白由来自天然人I型胶原蛋白的α1链氨基酸序列构成,该胶原蛋白具有良好水溶性,分子量为6.1kDa,购买于西安巨子生物基因技术股份有限公司;
步骤504、按照体积比为1:1,将步骤501所述QCS溶液与步骤503所述PPY@PDA分散液混合,得到混合体系A;
步骤505、将扩增后小球藻离心洗涤后分散于步骤502所述OP溶液中,得到混合体系B,所述混合体系B中小球藻浓度为2×10
步骤506、按照体积比1:1,将所述混合体系A与混合体系B搅拌混合30s,得到微藻自供氧导电抗菌多功能水凝胶,命名为QPMP1;所述微藻自供氧导电抗菌多功能水凝胶中,QCS、OP、小球藻和PPY@PDA的浓度分别为1.25wt%、2.5wt%、1×10
本实施例的微藻自供氧导电抗菌多功能水凝胶性能与实施例1基本一致。
性能评价
图例说明
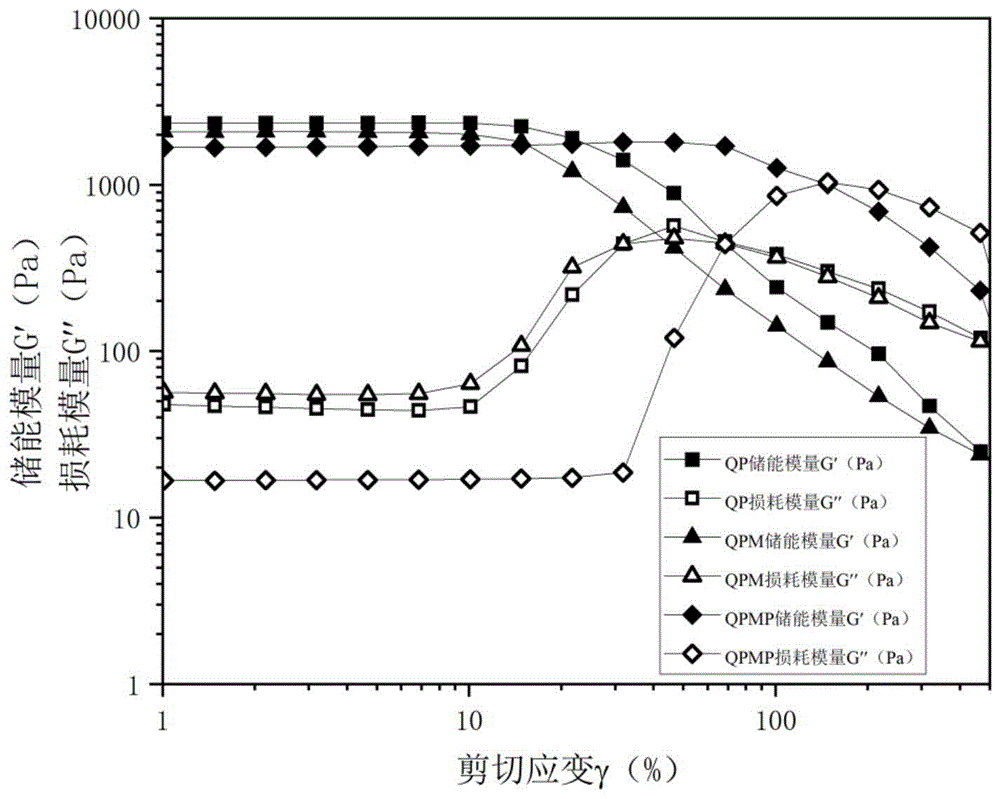
附图中,QPMP1~5依次指代实施例1~5的微藻自供氧导电抗菌多功能水凝胶;所述QP为实施例6所述水凝胶QP;所述QPM为实施例7所述水凝胶QPM。
图1为实施例1、实施例6和实施例7水凝胶的流变学测试,其测试方法包括:将所述水凝胶置于旋转流变仪圆台,在恒定频率25rad/s,温度为25℃条件下,应变范围为1×10
图2为实施例1步骤四所述聚吡咯掺杂聚多巴胺纳米材料PPY@PDA在500nm标尺下的TEM图像,根据图2可知,本发明的方法成功制备得到纳米材料,直径在40~70nm之间,长度约为1μm。
图3为实施例1、实施例10~实施例12的微藻自供氧导电抗菌多功能水凝胶QPMP1的产氧和降糖能力示意图。所述降糖能力测试方法参考文献Acta Pharm Sin B,2023,13,410-424,主要包括:将该水凝胶在含33mmol/L葡萄糖的BG-11培养基中高糖培养,黑暗条件下孵育12h后,以4000rpm离心3min,用葡萄糖试剂盒检测上清液中葡萄糖的浓度。根据图3可见,随着小球藻浓度的升高,该微藻自供氧导电抗菌多功能水凝胶QPMP1在660nm(0.5w/cm
图4为实施例1~7水凝胶的电导率。所述电导率的测试方法包括:使用50mm(长)×10mm(宽)×0.25mm(高)的矩形模具测量水凝胶的电导率(σ),在所述矩形模具内填充水凝胶,在所述矩形模具两侧放置铜片,铜片与水凝胶轴向接触,再用两根导线连接触摸屏数字万用表检测出不同水凝胶的电阻值,电导率计算见式:σ=L/(RS)。其中,R、L和S分别代表测量的电阻(Ω)、两个电极之间的长度(m)和水凝胶样品的有效横截面积(m
图5为实施例1~7水凝胶的DPPH自由基清除效率示意图。DPPH自由基清除效率的方法包括:将9mg水凝胶置于3mL100μM的DPPH/乙醇溶液中,测量517nm处的吸光度变化(OD
根据以下公式计算DPPH清除率(%):
DPPH清除效率(%)=(OD
其中水凝胶样品的干重均为3mg/mL。根据图5可见,在QP水凝胶中,水凝胶的自由基清除率仅为21.3%,表明无小球藻及PPY@PDA的水凝胶所具有的自由基清除率较低,当引入小球藻后,水凝胶QPM的自由基清除率为31.7%,随着PPY@PDA浓度的增加,对DPPH自由基的清除率明显增加,最高可达74.1%,表明本发明的微藻自供氧导电抗菌多功能水凝胶具有优异的抗氧化能力。
图6为实施例1~7水凝胶的体外溶血实验结果示意图。体外溶血实验的测试方法包括:将灭菌后的水凝胶添加到生理盐水中,得到水凝胶浓度为0.1g/mL的水凝胶体系,3d后得到水凝胶生理盐水浸提液。以0.1%Triton X-100作为阳性对照组,纯生理盐水作为阴性对照组。取水凝胶浸提液、生理盐水和0.1%TritonX-100各1mL加入不同离心管中,然后每管分别加入2μL稀释后的鼠血。随后将所有离心管放入37℃的恒温水浴中孵育60min。最后,所有试管以1500rpm的转速离心5min,并在545nm处测量上清液的吸光度。溶血率计算公式为:
Haemolysis rate(%)=[(A
其中,A
图7为实施例1~7水凝胶的体外细胞相容性测试结果示意图。体外细胞相容性测试方法为通过MTT法评估水凝胶浸提液对小鼠成纤维细胞(L929)的细胞毒性,从而获得水凝胶的体外细胞相容性,具体方法包括:将水凝胶浸泡在RPMI-1640培养基中,在37℃孵育24h,制成100mg/mL的浸提液;RPMI-1640培养基为补充有10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基,将L929细胞(每孔1000个细胞)接种到96孔板中,在37℃细胞培养箱中培养24h后,将孔板中的培养液更换成水凝胶浸提液(100μL/孔),继续培养24h后,向每个孔中加入50μLMTT溶液(5mg/mL)并孵育2h,之后,除去每个孔中的培养液并加入150μLDMSO,最后使用酶标仪在490nm处测量吸光度(OD
Cell viability(%)=OD
根据图7可见,所有水凝胶组别细胞存活率无明显差异,细胞存活率均大于90%,表明本发明的水凝胶对细胞增殖无明显影响,具有良好的细胞相容性。
图8为实施例1、实施例6和实施例7水凝胶的体外抗菌性能测试结果示意图。体外抗菌性能测试方法为通过常见的革兰氏阳性菌和革兰氏阴性菌大肠杆菌和金黄色葡萄球菌,利用平板计数法确定水凝胶借助光热及过氧化物酶活性的抗菌能力。具体包括:将上述细菌的细菌悬浮液(10
杀菌率(%)=对照组菌落数-水凝胶组菌落数/对照组菌落数×100%。
根据图8可见,所有水凝胶均显示一定的抗菌性能,这可能与季铵化壳聚糖所具有的抑菌性能有关,在近红外光作用下,该抗菌效果得到一定程度的加强,水凝胶样品处理10min的琼脂糖培养板上几乎看不到细菌菌落。光照十分钟后,本发明的微藻自供氧导电抗菌多功能水凝胶细菌杀死率接近100%,表明本发明的微藻自供氧导电抗菌多功能水凝胶具有显著的体外抗菌性能。
图9为实施例1的微藻自供氧导电抗菌多功能水凝胶QPMP1压力响应性能示意图。压力响应性能测试方法包括:将水凝胶制备成长方体样品(长度=20mm,宽度=10mm,高度=2mm),通过万能材料试验机模拟不同的压缩应变(10%、20%和30%),测试循环压缩过程中水凝胶电阻的变化,采用归一化相对电阻变化率(ΔR/R0)计算应变响应,其中ΔR是实测压力下瞬时电阻的变化,R0是原始电阻。根据图9可见,从10%到30%的循环瞬时压缩过程中,QPMP水凝胶的ΔR/R0具有相应重复性,依次为2.4%,6.2%和8.2%,表明本发明微藻自供氧导电抗菌多功能水凝胶具有良好的重复性和灵敏的压力响应;其中ΔR为实测压力下瞬时电阻的变化,R0为原始电阻。
图10为实施例1的微藻自供氧导电抗菌多功能水凝胶QPMP1渗出物反应性能示意图。渗出物反应性能测试方法包括:将水凝胶制备成长方体样品(长度=20mm,宽度=10mm,高度=2mm),通过从注射器挤出生理盐水溶液来模拟渗出物,采用归一化相对电阻变化率(ΔR/R0),计算渗出液响应,其中ΔR是实测压力下瞬时电阻的变化,R0是原始电阻。根据图10可见,当以生理盐水作为渗出物时,水凝胶的ΔR/R0具有明显响应性,表明本发明的多功能水凝胶可用于伤口渗液的实时监测。
图11为实施例1~7水凝胶对慢性糖尿病伤口修复闭合率测试中的统计结果。其中慢性糖尿病伤口修复闭合率测试的方法包括:采用SD大鼠建立糖尿病大鼠的全层皮肤缺损模型,来研究本发明的QPMP水凝胶促进感染创面愈合的能力。具体包括:将大鼠麻醉后,用脱毛膏去除大鼠背毛并消毒,然后用皮肤取样器在背部皮肤上制作一个直径为8mm的全层圆形皮肤伤口,分别用纱布(阴性对照组)、QP水凝胶、QPM水凝胶、QPMP水凝胶、Heraderm品牌敷料(阳性对照组)覆盖创面,并用聚氨酯膜固定。每2天更换一次敷料。在不同处理伤口后的第3、7、10天对所有的伤口部位进行拍照。然后分批处死大鼠,收集伤口组织并固定在4%多聚甲醛中以供进一步分析。伤口闭合程度计算见式:
Wound healing(%)=[(A
其中,A
图12说明引入重组胶原蛋白可以促进细胞增殖,且随着重组胶原蛋白浓度的增加,细胞增殖率增加。相较于不加重组胶原蛋白的实施例11,当胶原蛋白浓度为实施例13的1wt%时,水凝胶细胞活力提升到实施例11水凝胶的113%,表明本发明的水凝胶在添加重组胶原蛋白后显示出更好的促细胞增殖效果。
综上可知,本发明的微藻自供氧导电抗菌多功能水凝胶在光热性、导电性以及抗氧化特性均具有明显提高的效果,可有效促进慢性糖尿病伤口闭合。
以上所述,仅是本发明的较佳实施例,并非对本发明做任何限制,凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效结构变化,均仍属于本发明技术方案的保护范围内。
- 纤维素离子导电水凝胶的制备方法及制备得到的水凝胶
- 一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法
- 一种藻酸银水凝胶抗菌微球及其制备方法
- 一种自供电多功能水凝胶传感器的制备方法
