小分子肽及其抑制黄嘌呤氧化酶的用途
文献发布时间:2023-06-19 18:58:26
技术领域
本发明涉及一种小分子肽及其抑制黄嘌呤氧化酶的用途,属于酶解加工产品技术领域。
背景技术
牡蛎是世界上最大的养殖贝类之一,是优质的蛋白质库,具有丰富的营养价值。目前对牡蛎的处理方式多为直接食用,其工业价值难以提高,牡蛎多肽的加工是其深加工的一个重要方向。
在嘌呤代谢过程中,黄嘌呤氧化酶(XO)催化中间产物次黄嘌呤转化为黄嘌呤,然后继续催化黄嘌呤转化为尿酸。高嘌呤饮食以及酒精的摄入导致尿酸过量生产以及排泄减少即会引发高尿酸血症及其并发症,包括肾结石及心血管疾病等。目前用于治疗高尿酸血症的药物往往伴随有严重的毒副作用,因此,开发成本低、毒副作用小且易吸收的食品源降尿酸肽对于治疗高尿酸血症具有重要意义。
发明内容
针对上述现有技术,本发明提供了一种小分子肽及其抑制黄嘌呤氧化酶的用途。本发明对高尿酸血症的治疗具有重要意义,且提高了牡蛎的附加产值。
本发明是通过以下技术方案实现的:
一种小分子肽,其氨基酸序列为:VAQDSSY,如SEQ ID NO.4所示。
上述小分子肽制备抑制黄嘌呤氧化酶的药物的用途,制备具有抑制尿酸水平功效的药物的用途。
本发明通过实验研究发现,牡蛎多肽具有黄嘌呤氧化酶抑制(降尿酸)活性,因此牡蛎多肽具有作为抑制尿酸水平的功能性产品的潜力。进一步地,经LC-MS/MS鉴定,利用分子对接筛选得到了小分子肽,对黄嘌呤氧化酶具有更高的抑制活性,因此,该小分子肽具有作为抑制尿酸水平的功能性产品的潜力。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
图1:蛋白酶对黄嘌呤氧化酶抑制率的影响示意图。
图2:酶解时间对黄嘌呤氧化酶抑制率的影响示意图。
图3:加酶量对黄嘌呤氧化酶抑制率的影响示意图。
图4:料液比对黄嘌呤氧化酶抑制率的影响示意图。
图5:初始pH对黄嘌呤氧化酶抑制率的影响示意图。
图6:酶解温度对黄嘌呤氧化酶抑制率的影响示意图。
图7:酶解液经G-15葡聚糖凝胶柱层析的分离结果示意图。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域技术人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
下述实施例中所涉及的仪器、试剂、材料,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料,可通过正规商业途径获得。下述实施例中所涉及的实验方法、检测方法等,若无特别说明,均为现有技术中已有的常规实验方法、检测方法。
实施例1牡蛎酶解工艺的优化
1.筛酶
(1)选取复合风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶、碱性蛋白酶和酸性蛋白酶对原料进行酶解:牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向8g牡蛎肉匀浆中加水,料液比为1:3(g:ml)。分成6份,分别加入复合风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶,加酶量均为2000U/g(酶活/牡蛎肉匀浆),用氢氧化钠溶液或盐酸调节初始pH值至各蛋白酶的最适pH值(复合风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶的最适pH值分别为6.5,6.5,6.5,6.5,10.5,3.0),在各蛋白酶的最适温度(复合风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶的最适温度分别为50℃,50℃,55℃,50℃,50℃,45℃)、200rpm条件下反应4h,得酶解产物。取样,煮沸10min灭酶,冷却至室温,8000rpm离心10min,测定黄嘌呤氧化酶抑制率。每组设置三个平行。
(2)体外XO抑制率的测定:用pH=7.4的PBS缓冲溶液分别配制黄嘌呤溶液(1.5mmol/l)和黄嘌呤氧化酶溶液(0.1U/ml)。向1.5ml离心管中加入125μl的样品、150μl的PBS缓冲液和100μl的黄嘌呤氧化酶溶液,在37℃条件下孵育15min,加入125μl的黄嘌呤溶液,继续孵育20min,最后加入100μl的盐酸(1mol/l)终止反应。分别设置不含样品、不含黄嘌呤氧化酶、不含黄嘌呤氧化酶和样品的对照。测定290nm处的吸光值。
体外XO抑制率的计算公式如下:
体外XO抑制率(%)=[(1-(Abs
其中,Abs
(3)结果如图1所示。由图可知,酸性蛋白酶的酶解产物的体外XO抑制率最高,可达67.62%,优于其他五种蛋白酶,因此选择酸性蛋白酶进行下述的单因素优化实验。
2.酶解时间的优化
牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向4g牡蛎肉匀浆中加水,料液比为1:3(g:ml),调节初始pH值为3,按加酶量2000U/g加入酸性蛋白酶,在40℃、200rpm条件下反应2~6h;分别在2h、3h、4h、5h及6h时取样,沸水浴10min灭酶,冷却至室温,8000rpm离心10min,取上清液测定XO抑制率(测定方法同上述),每组设三个平行。
不同酶解时间对酶解产物体外XO抑制率的影响如图2所示。随着酶解时间的延长,酶解产物的XO抑制率呈现先上升后下降的趋势,到4h时XO抑制率最高,达到58.11%;与3h组相比有显著提高(P<0.05),而与5h组无显著性差异(P>0.05)。因此选择酶解时间为4h进行下一步优化。
3.加酶量的优化
牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向4g牡蛎肉匀浆中加水,料液比为1:3(g:ml),调节初始pH值为3,分成5份,分别按加酶量1000U/g、2000U/g、3000U/g、4000U/g、5000U/g加入酸性蛋白酶,在40℃、200rpm条件下反应4h;取样,沸水浴10min灭酶,冷却至室温,8000rpm离心10min,取上清液测定XO抑制率(测定方法同上述),每组设三个平行。
不同加酶量对酶解产物体外XO抑制率的影响如图3所示。随着加酶量的升高,至加酶量为3000U/g时产物的XO抑制率达到58.74%,且该组抑制活性显著高于其他组(P<0.05),再增加酶量时XO抑制率有下降的趋势。因此选择酸性蛋白酶加酶量为3000U/g进行下一步优化。
4.料液比的优化
牡蛎开壳取肉,打浆,得牡蛎肉匀浆4g;分成5份,向牡蛎肉匀浆中加水,料液比分别为1:2、1:3、1:4、1:5、1:6(g:ml),调节初始pH值为3,按加酶量3000U/g加入酸性蛋白酶,在40℃、200rpm条件下反应4h;取样,沸水浴10min灭酶,冷却至室温,8000rpm离心10min,取上清液测定XO抑制率(测定方法同上述),每组设三个平行。
不同料液比对酶解产物体外XO抑制率的影响如图4所示。随着料液比的降低,XO抑制率是在不断上升的,料液比为1:5时抑制率达到最高,为59.14%,对比之前的选择(料液比为1:3),可以发现XO抑制率得到了显著提高(P<0.05),而对比料液比1:6则没有显著差异(P>0.05)。因此选择料液比为1:5进行下一步优化。
5.初始pH值的优化
牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向4g牡蛎肉匀浆中加水,料液比为1:5(g:ml),分成6份,分别调节初始pH值为1、2、3、4、5、6,按加酶量3000U/g加入酸性蛋白酶,在40℃、200rpm条件下反应4h;取样,沸水浴10min灭酶,冷却至室温,8000rpm离心10min,取上清液测定XO抑制率(测定方法同上述),每组设三个平行。
不同初始pH对酶解产物体外XO抑制率的影响如图5所示。酸性蛋白酶最适pH范围为2~4,pH值偏移该范围会使蛋白酶活性发生改变。在pH为2时产物XO抑制率最高,为68.35%,且显著高于其他组(P<0.05);随着pH值不断地升高,产物的XO抑制活性一直呈现降低的趋势。因此,选择pH值为2继续下一步优化。
6.酶解温度的优化
牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向4g牡蛎肉匀浆中加水,料液比为1:5(g:ml),调节初始pH值为3,按加酶量3000U/g加入酸性蛋白酶,分成5份,分别在20℃、30℃、40℃、50℃、60℃下,200rpm条件下反应4h;取样,沸水浴10min灭酶,冷却至室温,8000rpm离心10min,取上清液测定XO抑制率(测定方法同上述),每组设三个平行。
不同酶解温度对酶解产物体外XO抑制率的影响如图6所示。XO抑制率随着温度的升高呈现先上升后下降的趋势,在温度为40℃时,XO抑制活性达到最强,为68.62%,同时可以发现该组的XO抑制活性显著高于其他组(P<0.05)。因此,选择最佳酶解温度为40℃。
7.正交试验优化
根据上述单因素实验结果,确定酶解时间、加酶量、料液比、初始pH值和酶解温度5个因素的水平,设置5因素4水平正交试验,测定体外XO抑制率,获得最佳酶解条件。实验因素及水平详见表1。
表1正交实验设计因素水平表
牡蛎酶解正交优化实验结果如表2所示。从R值分析可以看出,酶解时间、加酶量、料液比、酶解温度以及初始pH对酶解液氨基态氮含量影响的主次效应为:A>C>B>E>D,即酶解时间影响最大,其次是加酶量及料液比,初始pH对酶解液氨基态氮含量的影响最小。最终得到优化组合为A2B2C3D2E3,即酶解时间4h,加酶量为3000U/g,料液比为1:5,初始pH为2,酶解温度为40℃。
表2正交优化表
实施例2超滤、凝胶过滤层析及其组分活性分析
牡蛎开壳取肉,打浆,得牡蛎肉匀浆;向4g牡蛎肉匀浆中加水,料液比为1:5(g:ml),调节初始pH值为3,按加酶量3000U/g加入酸性蛋白酶,在40℃、200rpm条件下反应4h,得酶解液。
酶解液利用Vivaflow 50R(Sartorius,德国)超滤膜包先获得小于10KDa组分,再获得小于5KDa组分,冻干,加水制成浓度为80mg/mL的溶液,作为下述的上样样品。超滤膜包使用完毕后用浓度为0.5mol/l的NaOH溶液洗涤,再用10%的乙醇溶液密封置于4℃环境。
G-15
葡聚糖凝胶G-15加入适量超纯水煮沸2h,除去浮沫及杂质;再加入超纯水搅拌、静置。除去上层杂质,重复以上操作直至上层无杂质。吸掉凝胶上层多余的水,将填料以玻璃棒引流至26mm×80cm层析柱,避免分层和气泡出现,柱子填好后用纯水冲洗,直至层析柱高度不再发生变化。
上样:上样体积为3ml;流动相为超纯水,洗脱速度为2ml/min;收集出峰的组分,冻干测定不同组分的活性。
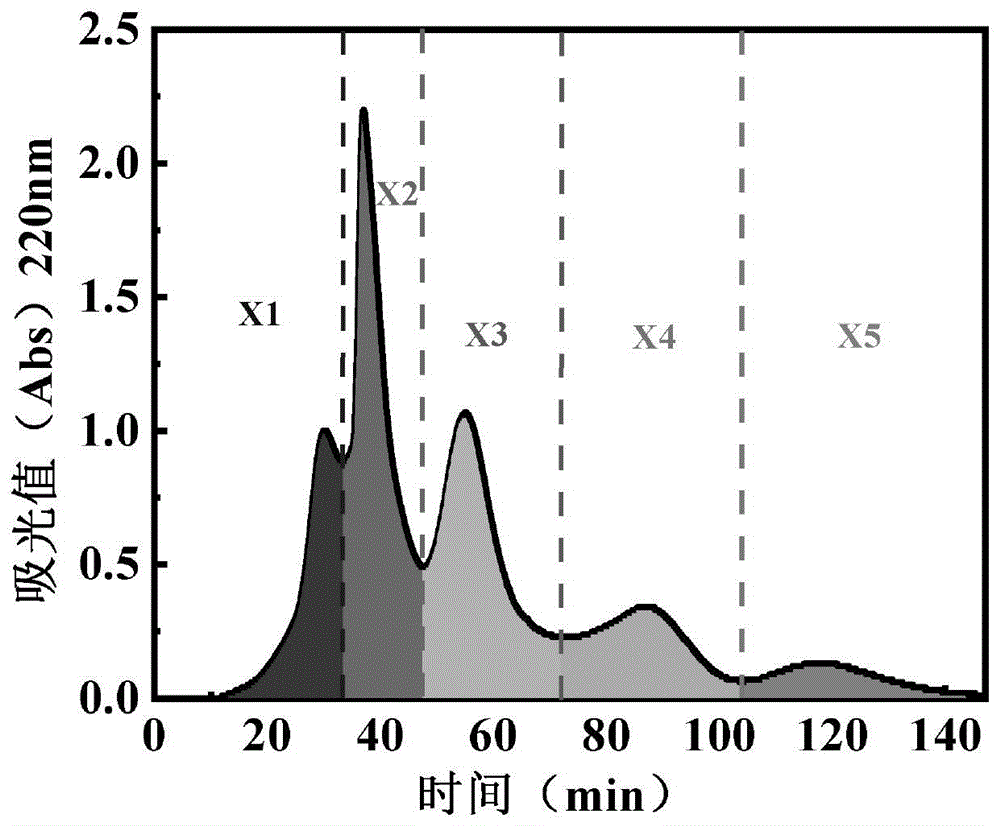
酶解液经凝胶色谱柱的分离结果如图7所示,可见,共5个洗脱峰,分别命名为X1、X2、X3、X4、X5。依次收集洗脱峰X1~X5所对应的洗脱液,冻干后加水复配成浓度为20mg/ml的溶液,测定各组分的XO抑制率,结果如表3所示。洗脱峰X3所对应的洗脱液的抑制率最高,
此选择洗脱峰X3所对应的洗脱液进行下一步的实验。
表3不同组分的XO抑制率
实施例3牡蛎多肽X3肽段组成LC-MS/MS质谱鉴定
1.多肽提取:实施例2中洗脱峰X3所对应的洗脱液冻干,用0.15%乙酸溶液复溶,过10K超滤管,5%乙酸溶液清洗2次,所得滤液使用C18 StageTip脱盐,真空干燥,得肽段。干燥后用浓度0.1%的TFA溶液复溶,测定在260nm处的吸光度值,测定肽段浓度,以备LC-MS/MS分析。
2.LC-MS/MS分析
每例样品取适量肽段使用纳升流速Easy nLC 1200色谱系统(ThermoScientific)进行色谱分离。缓冲液:A液为0.1%甲酸水溶液,B液为甲酸、乙腈和水的混合溶液(乙腈的体积浓度为80%,甲酸的浓度为0.1%)。色谱柱以100%的A液平衡。样品进样到Trap Column(100μm*20mm,5μm,C18,Dr.Maisch GmbH)后经过色谱分析柱(75μm*150mm,3μm,C18,Dr.Maisch GmbH)进行梯度分离,流速为300nl/min。
液相分离梯度如下:0分钟~2分钟,B液线性梯度从3%到5%;2分钟~42分钟,B液线性梯度从5%到25%;42分钟~52分钟,B液线性梯度从25%到45%;52分钟~55分钟,B液线性梯度从45%到90%;55分钟~70分钟,B液维持在90%。
肽段分离后用Q-Exactive Plus质谱仪(Thermo Scientific)进行DDA(数据依赖采集)质谱分析。分析时长为70min,检测模式:正离子,母离子扫描范围:300~1800m/z,一级质谱分辨率:70,000@m/z 200,AGC target:3e6,一级Maximum IT:30ms。
肽段二级质谱分析按照下列方法采集:每次全扫描(full scan)后触发采集20个最高强度母离子的二级质谱图谱(MS2 scan),二级质谱分辨率:17,500@m/z 200,AGCtarget:2e5,二级Maximum IT:60ms,MS2 Activation Type:HCD,Isolation window:1.6m/z,Normalized collisionenergy:30。
3.数据库检索
采用质谱数据库检索软件为pfind;使用如下蛋白质数据库:来源于UniprotProtein Databas。其中MaxQuant搜库软件分析参数设置如表4所示。
表4pFind分析参数设置
X3组分经质谱数据检索后采用PSM FDR≤0.05和Protein FDR≤0.05分别作为肽段与蛋白鉴定的筛选标准,得到19条肽段序列和14条蛋白序列。
实施例4肽段筛选、合成及验证
1.配体的处理
采用Chemdraw 19.0及Chem3D Pro 14.0软件绘制氨基酸、多肽的分子结构式,通过MM2力场优化,保存为mo12。
2.对受体处理
从PDB数据库中下载XO的晶体结构1N5X,采用PyMOL软件将1N5X中的B链删除,并抽离配体非布司他(TEI)保存为pdbqt格式备用。对受体1N5X去水加氢,计算gasteiger电荷,并将所有原子归属于AD4类型,保存为pdbqt格式备用。
3.分子对接
使用PyRx软件的vina功能进行分子对接模拟氨基酸、多肽小分子与大分子蛋白质的相互作用。根据1N5X中原配体非布司他的位置,设置对接中心坐标为(96,54,39)(x,y,z),盒子大小为25×25×25,其它参数采取默认值。然后,将氨基酸和多肽配体逐一与XO晶体结构进行对接处理。
结果:将实施例3中的19条肽段分别与XO进行Vina模拟对接,根据Vina得分,筛选到Gly-Gly-Tyr-Gly-Ile-Phe(GGYGIF)(如SEQ ID NO.1所示)、Ile-Ala-Ser-Gly-Phe-Phe(IASGFF)(如SEQ ID NO.2所示)、Ala-Leu-Ser-Gly-Ser-Trp(ALSGSW)(如SEQ ID NO.3所示)、Val-Ala-Gln-Asp-Ser-Ser-Tyr(VAQDSSY)(如SEQ ID NO.4所示)、Leu-His-Cys-Ser-Thr-Leu(LHCSTL)(如SEQ ID NO.5所示)和Met-Ala-Ile-Gly-Leu-Trp(MAIGLW)(如SEQ IDNO.6所示)六条肽段进行合成。
实施例5肽段合成及活性验证
1.肽段合成
肽段GGYGIF、IASGFF、ALSGSW、VAQDSSY、LHCSTL和MAIGLW均由生工生物工程(上海)股份有限公司采用Fmoc固相合成方法合成。
2.活性验证
XO抑制率的测定:将多肽配成3mg/ml溶液,根据实施例1中的方法测定合成多肽的体外XO抑制率。IC
肽段的相关性质及活性验证结果如表5所示。
表5肽段的相关性质及活性验证结果
注:(1)由于分子对接结果具有随机性,表中显示的Vina得分为10次对接结果(负值)最高值的平均值;(2)“-”指无XO抑制活性。
(2)肽段疏水性及分子量通过http://www.tulane.edu/~biochem/WW/PepDraw/获得。
由表5可见,六条肽段中均具有较高的XO抑制活性,其中,IASGFF、VAQDSSY和LHCSTL表现出更高的XO抑制活性。
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
