一种长效犬α干扰素融合蛋白及其制备方法和应用
文献发布时间:2023-06-19 09:43:16
技术领域
本发明属于生物基因工程的技术领域,具体涉及一种长效犬α干扰素融合蛋白及其制备方法和应用。
背景技术
犬α干扰素(CaIFN-α)是一种具有广谱抗病毒、免疫调节、抗肿瘤等生物活性的蛋白,抗病毒活性为犬α干扰素的主要生物学活性,广泛用于犬病毒性疾病的防治,包括:犬瘟热、犬细小病毒性肠炎、犬腺病毒、犬副流感、犬冠状病毒感染、犬疱疹病毒感染、犬病毒性角膜炎及其他病毒性疾病。其作用机制为犬α干扰素通过一系列的信号传导刺激机体产生ISG(干扰素刺激基因)产物,ISG类产物包括多种抗病毒蛋白,能够有效抑制病毒的复制。同时还可通过提高机体的免疫效应和调整病毒转录过程等有效方式来实现其抗病毒作用。
现有技术中犬α干扰素的相关研究中存在表达量不高、活性低及半衰期短等问题。犬α干扰素的外源表达主要在大肠杆菌、毕赤酵母、动物细胞三种表达系统中的表达,在大肠杆菌表达系统缺少将蛋白质有效的释放分泌机制,面临产量小、包涵体表达的问题,存在变复性、去除内毒素及热源等繁琐的蛋白纯化工艺,同时大肠杆菌表达系统无法有效形成二硫键,不利于犬α干扰素的正确折叠,影响其天然构象及稳定性,进而影响其生物学活性;利用动物细胞表达则存在着工业复杂、成本较高、大规模产业化生产较为困难的情况,在相应表达系统中由于蛋白的翻译折叠等过程中还普遍存在表达的犬α干扰素生物活性低的现象。
在犬病毒病预防方面,国内运用较多的是疫苗和抗体,但是由于母源抗体的干扰及毒株的抗原漂移,有时会导致免疫失败。同时犬α干扰素具有半衰期短的特性,为4h左右,使得应用上存在半衰期较短的瓶颈,犬α干扰素在体内存留时间的长短极大地影响到使用剂量和治疗效果。防止犬α干扰素在体内迅速降解、延长半衰期成为犬α干扰素改造的研究热点,因此研制安全高效的长效犬α干扰素抗病毒制剂具有重大意义。在长效性修饰的研究中,血清白蛋白是现有天然载体蛋白之一,是血浆的主要成分,在体内有维持血液渗透压,运输营养和其它重要生物物质的作用,具有有安全无毒、生物相容性好、低免疫原性,半衰期长(达两周)等稳定剂和多肽运载蛋白的必需性质,它已成功地在哺乳动物细胞和酵母中实现高效表达。现有研究有采用犬血清白蛋白CSA进行犬α干扰素的融合表达的研究,但其所用的CSA为全长序列,全长CSA融合表达时会出现不同程度的断裂及酶降解的情况,给纯化及活性的测定带来诸多不利的影响。
发明内容
针对上述问题,本发明的目的在于提供一种长效犬α干扰素融合蛋白及其制备方法和应用,所得长效犬α干扰素融合蛋白生物学活性高、半衰期延长、稳定性好、不易降解以及二硫键易于形成。
本发明的技术内容如下:
本发明提供了一种长效犬α干扰素融合蛋白,所述犬α干扰素融合蛋白的蛋白片段包括犬α干扰素以及包括CSA截短肽;
所述长效犬α干扰素融合蛋白包括4种组合,4种融合蛋白的氨基酸序列如序列表SEQ ID NO.1~4所示;
所述犬α干扰素CaIFN-α氨基酸序列如序列表SEQ ID NO.5所示;
所述蛋白片段还包括Linker柔性连接肽(GGGGS)n(其氨基酸序列如序列表SEQ IDNO.6所示)以及His-Tag(其氨基酸序列如序列表SEQ ID NO.7所示);
所述蛋白片段的融合方式包括,CSA截短肽位于犬α干扰素的N端,Linker位于CSA截短肽和犬α干扰素之间、His-Tag位于犬α干扰素的C端;
所述CSA截短肽为CSA氨基酸序列(如序列表SEQ ID NO.8)的截短得到,所述截短肽具有高度的稳定性,所述截短的氨基酸序列为29~608,包括4个截短肽CSA1、CSA2、CSA3以及CSA4,4个截短肽的氨基酸序列如序列表SEQ ID NO.9~12所示;所述CSA截短肽不限于表达犬α干扰素;CSA的截短肽不限于第29~608内的任意氨基酸片段。
所述Linker包括柔性连接肽(GGGGS)n,n=1~10,通过调整n的个数,可以优化该连接肽的长度;
所述His-Tag位于犬α干扰素的C端。
本发明还提供了一种长效犬α干扰素融合蛋白的制备方法,包括如下步骤:
将犬α干扰素以及CSA截短肽进行密码子优化之后,合成于质粒载体上,双酶切后克隆获得的目的片段,Linker连接得到重组质粒CSAL-CaIFN-α-载体蛋白,重组质粒经酶切线性化后导入表达宿主菌得到重组酵母菌,经诱导表达、去糖基化、层析纯化得到目的蛋白即长效犬α干扰素融合蛋白。
所述密码子包括毕赤酵母密码子;
所述表达宿主菌包括毕赤酵母宿主菌,所述毕赤酵母宿主菌包括X33、GS115、KM71以及SMD1168,所述毕赤酵母宿主菌有利于二硫键的形成;
所述重组质粒的表达载体包括pPICZαA、pPICZαB、pPICZαC、pGAPZαA、pPIC9K、pPIC9、pHIL-S1以及pYAM75P;
所述诱导表达包括采用甲醇诱导技术;
本发明还提供了一种长效犬α干扰素融合蛋白用于制备抗病毒药物。
本发明的有益效果如下:
本发明的长效犬α干扰素融合蛋白的外源表达具有表达含量高、糖基化适度、二硫键易于形成、表达产物生物学活性好、背景蛋白质少、操作简便及易于工业化生产等特点,用于解决现有技术制备犬α干扰素生物学活性低、半衰期短、稳定性差、容易降解、二硫键难以形成、生产工艺复杂、纯化制备成本高等问题;本发明中优选的CSA截短肽的具有高稳定性,分子大小适中,不易断裂及酶解,在融合表达策略下能够显著地延长犬α干扰素的半衰期及增强生物学活性。其活性及稳定性均优于现有文献报道的犬α干扰素长效性修饰相关研究。
本发明的长效犬α干扰素融合蛋白采用了高效的毕赤酵母甲醇诱导分泌表达系统建立融合蛋白,同时选用具有高稳定性的CSA截短肽、Linker以及高活性的长效犬α干扰素,所制得的长效犬α干扰素融合蛋白可用于制备抗病毒药物。
附图说明
图1为重组质粒的构件示意图;
图2为重组质粒的PCR鉴定结果;
图3为重组酵母菌的PCR鉴定结果;
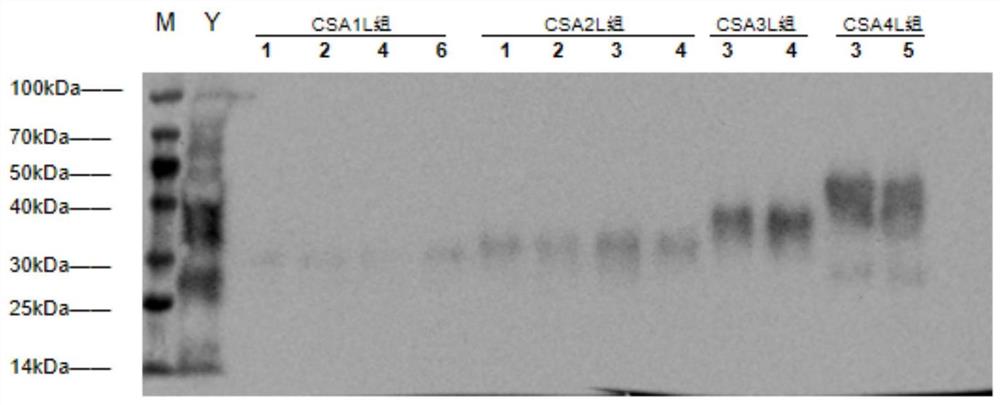
图4为重组酵母菌诱导上清的Western Blot结果。
具体实施方式
以下通过具体的实施案例以及附图说明对本发明作进一步详细的描述,应理解这些实施例仅用于说明本发明而不用于限制本发明的保护范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定。
若无特殊说明,本发明的所有原料和试剂均为常规市场的原料、试剂。
实施例
一种长效犬α干扰素融合蛋白的制备:
1.重组质粒的构建
取犬α干扰素CaIFN-α以及CSA截短肽(CSA1、CSA2、CSA3以及CSA4)进行密码子优化之后(所述犬α干扰素CaIFN-α、CSA1~4截短肽、Linker、His-Tag进行融合表达之前分别进行毕赤酵母密码子修饰,经过密码子修饰后的犬α干扰素CaIFN-α、CSA1~4截短肽、Linker、His-Tag的碱基序列如序列表SEQ ID NO.13~19所示;),合成于质粒载体pUC57上得到CSA1L-CaIFN-α-pUC57、CSA2L-CaIFN-α-pUC57、CSA3L-CaIFN-α-pUC57以及CSA4L-CaIFN-α-pUC57,在目的基因的C端引入组氨酸标签及终止密码子TAA,4个重组质粒经EcoRI、XbaI双酶切后克隆获得的目的片段至相同双酶切的表达载体pPICZαA上,并进行T4连接酶连接及转化感受态DH5α,Linker连接得到重组质粒CSAL-CaIFN-α-载体蛋白;
将得到的重组质粒CSAL-CaIFN-α-载体蛋白进行阳性转化PCR鉴定,采用α-factor和3’Aox1作为鉴定引物,其由广州金唯智生物科技有限公司合成,采用的PCR鉴定体系如表1所示,鉴定程序如表2所示:
表1 PCR鉴定体系
表2 PCR鉴定程序
PCR产物进行1%的琼脂糖凝胶电泳,挑取PCR鉴定为阳性菌进行质粒抽提并测序鉴定,结果如图2所示,由图可见,CSA1L-CaIFN-α-pPICZαA、CSA2L-CaIFN-α-pPICZαA、CSA3L-CaIFN-α-pPICZαA、CSA4L-CaIFN-α-pPICZαA均有阳性菌株,质粒测序结果显示各组测序正确。
2.重组质粒经酶切线性化
参考TAKARA公司酶切试验手册,用SacI单酶切各重组质粒,并进行琼脂糖凝胶电泳检测线性化完全,对线性化产物进行纯化回收,纯化回收方法参考试剂盒使用说明书。
3.将线性化产物导入表达宿主菌
3.1毕赤酵母感受态细胞的制备
1)接种酵母受体菌(包括X33、GS115、KM71以及SMD1168,本实施例采用X33)单菌落于YPD平板,30℃培养2天;
2)挑取平板上的单菌落接种于10mLYPD液体培养基中,30℃摇床震荡过夜;
3)过夜培养后按1%左右的接种量接种到100mLYPD培养基中震荡培养至OD值1.2~1.5;
4)4℃,5000rpm离心5min收集沉淀菌体,用100mL预冷无菌水重悬菌体;
5)4℃,5000rpm离心10min收集沉淀菌体,用100mL预冷无菌水重悬菌体;
6)再次4℃,5000rpm离心10min收集沉淀菌体,用100mL预冷无菌水重悬菌体;
7)20ml,1mol/L山梨醇洗涤1次;
8)将菌体溶于1mL,1M预冷山梨醇中,不加甘油,-80℃放置几小时,待转化。
3.2线性化产物电转化毕赤酵母感受态细胞
1)准备好80μL的X33酵母感受态(本实施例采用X33,其它宿主菌的使用方式相同)与线性化的质粒1~5μg(冰上预冷15min)混合,迅速放入0.2cm的电击杯中(电击杯冰上预冷灭菌),电击;
电转参数为Voltage:1500V;Capacitance:25μF;Resistance:200Ω;Cuvette(mm):2mm;
2)电击结束,迅速加入1mL山梨醇(1M),冰上静置15min,随后30℃温箱中静置培养1h,再加入1mLYPD液体培养基,30℃,200r/min振荡培养1小时,常温4000r/min离心收集菌体,涂至含有100μg/μL的YPDS平板中30℃静置培养3d,得到重组酵母菌。
3.3重组酵母菌的鉴定及高拷贝的筛选
用灭菌枪头细挑YPDS平板上生长的具有Zeocin抗性的单菌落,接种于2mL的YPD液体培养基中(含150μg/mLZeocin),30℃,200r/min振荡培养过夜;
采用菌液PCR分析P.pastoris转化子,PCR鉴定体系同表1,PCR鉴定程序如表3所示:
表3重组酵母菌液PCR鉴定程序
PCR产物进行1%琼脂糖凝胶电泳,以鉴定引物能扩增出目的条带的克隆定为阳性转化子,PCR鉴定结果如图3所示,由图可见,各组均有阳性重组酵母菌株,表明线性化产物电转化导入宿主菌X33成功。
高拷贝的筛选需结合PCR鉴定中的条带亮度及高抗性YPD平板(200μg/mLZeocin)试验结果。
4.高拷贝重组酵母菌诱导表达
1)用灭菌枪头细挑YPD平板上生长的具有Zeocin抗性的单菌落,挑于30mL的BMGY液体培养基中进行激活培养,30℃,200r/min振荡过夜,至OD600=2~6,此时细胞处于对数生长期;
2)3000r/min室温离心5min收集沉淀,重悬于15mL的BMMY中,用四层干净的纱布外加两层报纸包扎,在250mL的三角锥瓶中振荡培养;
3)每间隔24h加入100%甲醇至终浓度为1%,进行诱导培养;
4)培养至96h收集样品,离心,取上清立即作SDS-PAGE、Western Blot或置于-80℃保存。
5.重组酵母菌诱导表达上清的Western Blot分析
重组酵母菌诱导表达4d的上清加入5×Loading Buffer蛋白上样缓冲液,上样量为12μL。SDS-PAGE电泳后进行Western Blot分析,结果如图4所示。
6.表达产物的纯化回收
对表达上清的纯化结合His Tag进行镍柱亲和层析方法进行蛋白的吸附、洗脱纯化,各组样品纯化后浓度见下表4。
表4各组样品纯化后的浓度
7.目的蛋白生物学活性检测
采用MDCK-VSV微量病变抑制法检测目的蛋白的活性,将消化后的MDCK细胞铺96孔细胞培养板,待细胞完全贴壁后每孔加入100μL4倍倍比稀释的纯化后的犬α干扰素融合蛋白,37℃孵育24h后每孔用100TCID
48h后观察细胞病变的抑制结果,以抑制50%细胞病变CPE50的最高干扰素稀释度为1个活性单位,结果如表5所示。
表5各组目的蛋白的活性
各组犬α干扰素融合蛋白的活性均较为理想,且高于现有文献报道的天然犬α干扰素的活性,所述各犬α干扰素融合蛋白的活性CSA3L-CaIFN-α-His
8.犬α干扰素半衰期的测定
对CSA1L-CaIFN-α-His
取体重接近10kg的成年比格犬(6只/组),雌雄各半,按1mg/mL/只剂量颈部皮下注射冻干的各组犬α干扰素融合蛋白,分别在注射后1h、2h、4h、8h、16h、24h、48h、72h静脉采血,血样4℃低温凝固后,3000r/min低温离心5min,获取上层血清;
采用细胞病变抑制法测定不同时间点血清中犬α干扰素融合蛋白的浓度,利用DAS药动学软件进行曲线拟合并计算相关参数;
经测定各组的半衰期如下表6所示,犬α干扰素融合蛋白的半衰期远高于天然犬α干扰素,能够显著延长半衰期。
表6犬α干扰素融合蛋白半衰期
相比较于天然干扰素4h左右的半衰期,各组犬α干扰素融合蛋白的半衰期的均有大幅度的提升,其中,CSA3L-CaIFN-α-His的半衰期提高至5.6倍。
表明本发明的长效犬α干扰素融合蛋白具有生物学活性高、半衰期长、稳定性较好等的特点,且其生产工艺建议、纯化制备的成本不高。
序列表
<110> 广州源博医药科技有限公司
<120> 一种长效犬α干扰素融合蛋白及其制备方法和应用
<160> 19
<170> SIPOSequenceListing 1.0
<210> 1
<211> 202
<212> PRT
<213> Artificial Sequence
<400> 1
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gly Gly Gly Gly Ser
20 25 30
Cys His Leu Pro Asp Thr His Gly Leu Arg Asn Trp Arg Val Leu Thr
35 40 45
Leu Leu Gly Gln Met Arg Arg Leu Ser Ala Gly Ser Cys Asp His Tyr
50 55 60
Thr Asn Asp Phe Ala Phe Pro Lys Glu Leu Phe Asp Gly Gln Arg Leu
65 70 75 80
Gln Glu Ala Gln Ala Leu Ser Val Val His Val Met Thr Gln Lys Val
85 90 95
Phe His Leu Phe Cys Pro Asp Thr Ser Ser Ala Pro Trp Asn Met Thr
100 105 110
Leu Leu Glu Glu Leu Cys Ser Gly Leu Ser Glu Gln Leu Asp Asp Leu
115 120 125
Glu Ala Cys Pro Leu Gln Glu Ala Gly Leu Ala Glu Thr Pro Leu Met
130 135 140
His Glu Asp Ser Thr Leu Arg Thr Tyr Phe Gln Arg Ile Ser Leu Tyr
145 150 155 160
Leu Gln Asp Arg Asn His Ser Pro Cys Ala Trp Glu Met Val Arg Ala
165 170 175
Glu Ile Gly Arg Ser Phe Phe Ser Ser Thr Ile Leu Gln Glu Arg Ile
180 185 190
Arg Arg Arg Lys His His His His His His
195 200
<210> 2
<211> 227
<212> PRT
<213> Artificial Sequence
<400> 2
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu Gly Gly Gly Gly Ser Cys His Leu Pro Asp Thr His
50 55 60
Gly Leu Arg Asn Trp Arg Val Leu Thr Leu Leu Gly Gln Met Arg Arg
65 70 75 80
Leu Ser Ala Gly Ser Cys Asp His Tyr Thr Asn Asp Phe Ala Phe Pro
85 90 95
Lys Glu Leu Phe Asp Gly Gln Arg Leu Gln Glu Ala Gln Ala Leu Ser
100 105 110
Val Val His Val Met Thr Gln Lys Val Phe His Leu Phe Cys Pro Asp
115 120 125
Thr Ser Ser Ala Pro Trp Asn Met Thr Leu Leu Glu Glu Leu Cys Ser
130 135 140
Gly Leu Ser Glu Gln Leu Asp Asp Leu Glu Ala Cys Pro Leu Gln Glu
145 150 155 160
Ala Gly Leu Ala Glu Thr Pro Leu Met His Glu Asp Ser Thr Leu Arg
165 170 175
Thr Tyr Phe Gln Arg Ile Ser Leu Tyr Leu Gln Asp Arg Asn His Ser
180 185 190
Pro Cys Ala Trp Glu Met Val Arg Ala Glu Ile Gly Arg Ser Phe Phe
195 200 205
Ser Ser Thr Ile Leu Gln Glu Arg Ile Arg Arg Arg Lys His His His
210 215 220
His His His
225
<210> 3
<211> 275
<212> PRT
<213> Artificial Sequence
<400> 3
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr
50 55 60
Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr
65 70 75 80
Gly Asp Met Ala Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu
85 90 95
Cys Phe Leu Ala Gly Gly Gly Gly Ser Cys His Leu Pro Asp Thr His
100 105 110
Gly Leu Arg Asn Trp Arg Val Leu Thr Leu Leu Gly Gln Met Arg Arg
115 120 125
Leu Ser Ala Gly Ser Cys Asp His Tyr Thr Asn Asp Phe Ala Phe Pro
130 135 140
Lys Glu Leu Phe Asp Gly Gln Arg Leu Gln Glu Ala Gln Ala Leu Ser
145 150 155 160
Val Val His Val Met Thr Gln Lys Val Phe His Leu Phe Cys Pro Asp
165 170 175
Thr Ser Ser Ala Pro Trp Asn Met Thr Leu Leu Glu Glu Leu Cys Ser
180 185 190
Gly Leu Ser Glu Gln Leu Asp Asp Leu Glu Ala Cys Pro Leu Gln Glu
195 200 205
Ala Gly Leu Ala Glu Thr Pro Leu Met His Glu Asp Ser Thr Leu Arg
210 215 220
Thr Tyr Phe Gln Arg Ile Ser Leu Tyr Leu Gln Asp Arg Asn His Ser
225 230 235 240
Pro Cys Ala Trp Glu Met Val Arg Ala Glu Ile Gly Arg Ser Phe Phe
245 250 255
Ser Ser Thr Ile Leu Gln Glu Arg Ile Arg Arg Arg Lys His His His
260 265 270
His His His
275
<210> 4
<211> 315
<212> PRT
<213> Artificial Sequence
<400> 4
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr
50 55 60
Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr
65 70 75 80
Gly Asp Met Ala Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu
85 90 95
Cys Phe Leu Ala His Lys Asp Asp Asn Pro Gly Phe Pro Pro Leu Val
100 105 110
Ala Pro Glu Pro Asp Ala Leu Cys Ala Ala Phe Gln Asp Asn Glu Gln
115 120 125
Leu Phe Leu Gly Lys Tyr Leu Tyr Glu Ile Ala Arg Gly Gly Gly Gly
130 135 140
Ser Cys His Leu Pro Asp Thr His Gly Leu Arg Asn Trp Arg Val Leu
145 150 155 160
Thr Leu Leu Gly Gln Met Arg Arg Leu Ser Ala Gly Ser Cys Asp His
165 170 175
Tyr Thr Asn Asp Phe Ala Phe Pro Lys Glu Leu Phe Asp Gly Gln Arg
180 185 190
Leu Gln Glu Ala Gln Ala Leu Ser Val Val His Val Met Thr Gln Lys
195 200 205
Val Phe His Leu Phe Cys Pro Asp Thr Ser Ser Ala Pro Trp Asn Met
210 215 220
Thr Leu Leu Glu Glu Leu Cys Ser Gly Leu Ser Glu Gln Leu Asp Asp
225 230 235 240
Leu Glu Ala Cys Pro Leu Gln Glu Ala Gly Leu Ala Glu Thr Pro Leu
245 250 255
Met His Glu Asp Ser Thr Leu Arg Thr Tyr Phe Gln Arg Ile Ser Leu
260 265 270
Tyr Leu Gln Asp Arg Asn His Ser Pro Cys Ala Trp Glu Met Val Arg
275 280 285
Ala Glu Ile Gly Arg Ser Phe Phe Ser Ser Thr Ile Leu Gln Glu Arg
290 295 300
Ile Arg Arg Arg Lys His His His His His His
305 310 315
<210> 5
<211> 164
<212> PRT
<213> Artificial Sequence
<400> 5
Cys His Leu Pro Asp Thr His Gly Leu Arg Asn Trp Arg Val Leu Thr
1 5 10 15
Leu Leu Gly Gln Met Arg Arg Leu Ser Ala Gly Ser Cys Asp His Tyr
20 25 30
Thr Asn Asp Phe Ala Phe Pro Lys Glu Leu Phe Asp Gly Gln Arg Leu
35 40 45
Gln Glu Ala Gln Ala Leu Ser Val Val His Val Met Thr Gln Lys Val
50 55 60
Phe His Leu Phe Cys Pro Asp Thr Ser Ser Ala Pro Trp Asn Met Thr
65 70 75 80
Leu Leu Glu Glu Leu Cys Ser Gly Leu Ser Glu Gln Leu Asp Asp Leu
85 90 95
Glu Ala Cys Pro Leu Gln Glu Ala Gly Leu Ala Glu Thr Pro Leu Met
100 105 110
His Glu Asp Ser Thr Leu Arg Thr Tyr Phe Gln Arg Ile Ser Leu Tyr
115 120 125
Leu Gln Asp Arg Asn His Ser Pro Cys Ala Trp Glu Met Val Arg Ala
130 135 140
Glu Ile Gly Arg Ser Phe Phe Ser Ser Thr Ile Leu Gln Glu Arg Ile
145 150 155 160
Arg Arg Arg Lys
<210> 6
<211> 5
<212> PRT
<213> Artificial Sequence
<400> 6
Gly Gly Gly Gly Ser
1 5
<210> 7
<211> 6
<212> PRT
<213> Artificial Sequence
<400> 7
His His His His His His
1 5
<210> 8
<211> 608
<212> PRT
<213> Artificial Sequence
<400> 8
Met Lys Trp Val Thr Phe Ile Ser Leu Phe Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Leu Val Arg Arg Glu Ala Tyr Lys Ser Glu Ile Ala
20 25 30
His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg Gly Leu Val Leu
35 40 45
Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala Cys Ala Ala Glu
65 70 75 80
Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr Gly Asp Met Ala
100 105 110
Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu Cys Phe Leu Ala
115 120 125
His Lys Asp Asp Asn Pro Gly Phe Pro Pro Leu Val Ala Pro Glu Pro
130 135 140
Asp Ala Leu Cys Ala Ala Phe Gln Asp Asn Glu Gln Leu Phe Leu Gly
145 150 155 160
Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Tyr Tyr Ala Gln Gln Tyr Lys Gly Val Phe Ala Glu Cys
180 185 190
Cys Gln Ala Ala Asp Lys Ala Ala Cys Leu Gly Pro Lys Ile Glu Ala
195 200 205
Leu Arg Glu Lys Val Leu Leu Ser Ser Ala Lys Glu Arg Phe Lys Cys
210 215 220
Ala Ser Leu Gln Lys Phe Gly Asp Arg Ala Phe Lys Ala Trp Ser Val
225 230 235 240
Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Asp Phe Ala Glu Ile Ser
245 250 255
Lys Val Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Met
275 280 285
Cys Glu Asn Gln Asp Ser Ile Ser Thr Lys Leu Lys Glu Cys Cys Asp
290 295 300
Lys Pro Val Leu Glu Lys Ser Gln Cys Leu Ala Glu Val Glu Arg Asp
305 310 315 320
Glu Leu Pro Gly Asp Leu Pro Ser Leu Ala Ala Asp Phe Val Glu Asp
325 330 335
Lys Glu Val Cys Lys Asn Tyr Gln Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Thr Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Glu Tyr Ser Val Ser
355 360 365
Leu Leu Leu Arg Leu Ala Lys Glu Tyr Glu Ala Thr Leu Glu Lys Cys
370 375 380
Cys Ala Thr Asp Asp Pro Pro Thr Cys Tyr Ala Lys Val Leu Asp Glu
385 390 395 400
Phe Lys Pro Leu Val Asp Glu Pro Gln Asn Leu Val Lys Thr Asn Cys
405 410 415
Glu Leu Phe Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Val Ser Arg Lys Leu Gly Lys Val Gly Thr Lys Cys Cys Lys Lys
450 455 460
Pro Glu Ser Glu Arg Met Ser Cys Ala Glu Asp Phe Leu Ser Val Val
465 470 475 480
Leu Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Arg
485 490 495
Val Thr Lys Cys Cys Ser Glu Ser Leu Val Asn Arg Arg Pro Cys Phe
500 505 510
Ser Gly Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala
515 520 525
Glu Thr Phe Thr Phe His Ala Asp Leu Cys Thr Leu Pro Glu Ala Glu
530 535 540
Lys Gln Val Lys Lys Gln Thr Ala Leu Val Glu Leu Leu Lys His Lys
545 550 555 560
Pro Lys Ala Thr Asp Glu Gln Leu Lys Thr Val Met Gly Asp Phe Gly
565 570 575
Ala Phe Val Glu Lys Cys Cys Ala Ala Glu Asn Lys Glu Gly Cys Phe
580 585 590
Ser Glu Glu Gly Pro Lys Leu Val Ala Ala Ala Gln Ala Ala Leu Val
595 600 605
<210> 9
<211> 27
<212> PRT
<213> Artificial Sequence
<400> 9
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu
20 25
<210> 10
<211> 52
<212> PRT
<213> Artificial Sequence
<400> 10
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu
50
<210> 11
<211> 100
<212> PRT
<213> Artificial Sequence
<400> 11
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr
50 55 60
Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr
65 70 75 80
Gly Asp Met Ala Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu
85 90 95
Cys Phe Leu Ala
100
<210> 12
<211> 140
<212> PRT
<213> Artificial Sequence
<400> 12
Ser Glu Ile Ala His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg
1 5 10 15
Gly Leu Val Leu Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe
20 25 30
Glu Asp His Val Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala
35 40 45
Cys Ala Ala Glu Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr
50 55 60
Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr
65 70 75 80
Gly Asp Met Ala Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu
85 90 95
Cys Phe Leu Ala His Lys Asp Asp Asn Pro Gly Phe Pro Pro Leu Val
100 105 110
Ala Pro Glu Pro Asp Ala Leu Cys Ala Ala Phe Gln Asp Asn Glu Gln
115 120 125
Leu Phe Leu Gly Lys Tyr Leu Tyr Glu Ile Ala Arg
130 135 140
<210> 13
<211> 492
<212> DNA
<213> Artificial Sequence
<400> 13
tgtcatttgc cagataccca tggtttacga aactggaggg tgttaacttt gcttggtcaa 60
atgagacgtc tgtcagctgg ttcttgtgat cattacacta atgactttgc tttccccaaa 120
gaactgtttg acggacagcg tttgcaagaa gctcaagctt tatctgtggt ccacgttatg 180
acacaaaagg tattccattt attttgtcct gatacctcaa gtgctccatg gaacatgacc 240
ctattagaag agctatgtag tggtttgtct gaacagctgg atgacctgga ggcatgtccc 300
ttgcaagaag ccggtttggc tgagaccccc ttgatgcacg aggattctac tttgagaact 360
tacttccaac gtatttcatt atatttgcag gatagaaacc actccccttg cgcttgggaa 420
atggttagag ccgaaattgg aagaagtttc tttagttcta ctatcctgca ggaacgtatt 480
agacgtagaa aa 492
<210> 14
<211> 81
<212> DNA
<213> Artificial Sequence
<400> 14
tctgaaattg ctcatagata taatgatttg ggagaagaac attttagagg attggttttg 60
gttgcttttt ctcaatattt g 81
<210> 15
<211> 156
<212> DNA
<213> Artificial Sequence
<400> 15
tctgaaattg ctcatagata taatgatttg ggagaagaac attttagagg attggttttg 60
gttgcttttt ctcaatattt gcaacaatgt ccatttgaag atcatgttaa attggctaaa 120
gaagttactg aatttgctaa agcttgtgct gctgaa 156
<210> 16
<211> 300
<212> DNA
<213> Artificial Sequence
<400> 16
tctgaaattg ctcatagata taatgatttg ggagaagaac attttagagg attggttttg 60
gttgcttttt ctcaatattt gcaacaatgt ccatttgaag atcatgttaa attggctaaa 120
gaagttactg aatttgctaa agcttgtgct gctgaagaat ctggagctaa ttgtgataaa 180
tctttgcata ctttgtttgg agataaattg tgtactgttg cttctttgag agataaatat 240
ggagatatgg ctgattgttg tgaaaaacaa gaaccagata gaaatgaatg ttttttggct 300
<210> 17
<211> 420
<212> DNA
<213> Artificial Sequence
<400> 17
tctgaaattg ctcatagata taatgatttg ggagaagaac attttagagg attggttttg 60
gttgcttttt ctcaatattt gcaacaatgt ccatttgaag atcatgttaa attggctaaa 120
gaagttactg aatttgctaa agcttgtgct gctgaagaat ctggagctaa ttgtgataaa 180
tctttgcata ctttgtttgg agataaattg tgtactgttg cttctttgag agataaatat 240
ggagatatgg ctgattgttg tgaaaaacaa gaaccagata gaaatgaatg ttttttggct 300
cataaagatg ataatccagg atttccacca ttggttgctc cagaaccaga tgctttgtgt 360
gcagcttttc aggacaatga gcaacttttc ttggggaagt atttgtatga aattgcgaga 420
<210> 18
<211> 15
<212> DNA
<213> Artificial Sequence
<400> 18
ggaggtggag gatct 15
<210> 19
<211> 18
<212> DNA
<213> Artificial Sequence
<400> 19
catcatcatc atcatcat 18
- 一种由犬白蛋白与犬干扰素γ组成的融合蛋白及其制备方法和一种重组犬长效干扰素γ
- 犬白蛋白-干扰素α-白介素2融合蛋白、制备方法及其编码基因、一种犬长效干扰素
