一种3D多枝仿生支架及其制备方法与应用
文献发布时间:2023-06-19 13:48:08
技术领域
本发明属于生物医药技术领域,尤其涉及一种3D多枝仿生支架及其制备方法与应用。
背景技术
组织工程是一门前沿交叉科学,其基本原理为:通过在体外构建细胞与支架的三维复合体,模拟生物体内环境,并加以培养和训练,得到具备修复或替代功能的组织。组织工程仿生支架通过仿生细胞外基质,为细胞提供力学支撑,促进细胞黏附、生长、增殖、迁移和新陈代谢,是组织工程的关键因素之一。
另一方面,血管化是组织修复的必要条件。对于代谢旺盛的组织如心肌、肝脏,由于细胞具有很高的物质及能量代谢水平,而氧和营养物质在支架内的传输距离有限,因此如何建立有效的血管网络、解决内层细胞缺氧坏死一直是组织工程所面临的重要难题。现有的灌注培养、提高周围环境氧含量、添加氧载体和体内移植等方式可以使构建的人工组织活细胞层厚度达到500μm。有研究表明,添加内皮细胞、促血管生长因子等物质可以促进体内移植后毛细血管样组织生成。但是上述方法并没有形成类似分级贯通的枝型血管网络,并不能从根本上解决支架内部细胞的供氧问题。
因此,构建含内通道网络的定向3D多枝仿生支架,对于血管组织工程、心肌组织工程、皮肤组织工程及神经组织工程等具有重要意义。
发明内容
本发明针对现有技术的不足,提供一种3D多枝仿生支架及其制备方法与应用,通过“设计-制备-装配”的思路,设计并制备不同尺寸的中空定向纤维管,然后组装形成具有复杂分级结构的3D多枝仿生支架,该3D多枝仿生支架可为缺损组织提供有效力学支撑,其相互贯通的网络框架,有利于细胞定向排布、渗透生长,以及血管和神经长入,也便于营养物质和代谢废物的传递,且该3D多枝仿生支架的制备成本低廉、生产可操作性强、灵活度高,在生物医学材料及组织工程领域中具有理想的推广和应用价值。
为了达到上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种3D多枝仿生支架,其中,所述3D多枝仿生支架包括:主干纤维管,所述主干纤维管的一端连通有至少两个一级分支纤维管,每个一级分支纤维管的端部连通有二级分支纤维管;所述主干纤维管的横截面积等于所有与之连接的一级分支纤维管的横截面积之和,所述主干纤维管的管壁、所述一级分支纤维管的管壁和所述二级分支纤维管的管壁均具有孔隙结构。
可选地,单个分支纤维管的横截面积等于所有与之连接的下一级分支纤维管的横截面积之和。
可选地,所述3D多枝仿生支架还包括套管,所述套管用于将不同纤维管之间的连接处进行加固。
可选地,所述纤维的直径为0.1~25mm,所述孔隙的直径为0.01~100μm。
本发明的第二方面,提供一种本发明所述的3D多枝仿生支架的制备方法,其中,包括如下步骤:
提供混合墨水,所述混合墨水包括生物可降解高分子材料A、生物可降解高分子材料B和溶剂;
采用3D直写或静电纺丝将所述混合墨水制成多个纤维管;
将所述多个纤维管通过自粘连的方式进行拼接组装,得到所述3D多枝仿生支架。
可选地,两纤维管之间具有氢键或金属络合作用,通过氢键或金属络合作用实现自粘连。
可选地,所述生物可降解高分子材料A为丝蛋白、壳聚糖、透明质酸、胶原、海藻酸钠、明胶、聚丙交酯-乙交酯、聚乙烯醇、聚己内酯、聚乳酸中的一种或两种以上的组合;
和/或,所述生物可降解高分子材料B为单宁酸、聚丙烯酰胺、聚乙烯醇、正价金属盐、硼砂、环糊精、丁二酮肟中的一种或两种以上的组合;
和/或,所述溶剂为水、甲酸、乙酸、六氟异丙醇、四氢呋喃、二甲基甲酰胺、二甲基亚砜中的一种或两种以上的组合。
可选地,所述混合墨水中,总的生物可降解高分子材料占比为1~35%w/v,所述生物可降解高分子材料A和生物可降解高分子材料B的质量比为1:4~19:1。
可选地,所述采用3D直写或静电纺丝将所述混合墨水制成多个纤维管的步骤,具体包括:
将所述混合墨水加至3D直写机的注射器中,根据所述3D直写机和预设纤维管尺寸,调整注射器针头到接收器的距离;
设置所述3D直写机中的压强、电场与流速,在所述压强、电场及流速作用下从注射器针头中挤出纤维,所述纤维在不同接收器上定向收集、排布,得到所述多个纤维管;
或者,将所述混合墨水加至静电纺丝机的注射器中,根据根据所述静电纺丝机和预设纤维管尺寸,调整注射器针头到接收器的距离;
设置所述静电纺丝机中的电场、流速,在所述电场、流速作用下从注射器针头中挤出纤维,所述纤维在不同接收器上定向收集、排布,得到所述多个纤维管。
可选地,所述3D直写机注射器针头到接收器的距离为0.1~1.5cm,所述压强为10~100kPa,所述电场为0.5~1.5kV,所述流速为1~30mm/s;
或者,所述静电纺丝机注射器针头到接收器的距离为5~30cm,所述电场为15~25kV,所述流速为0.1~10ml/h。
可选地,所述将所述多个纤维管通过自粘连的方式进行拼接组装的步骤之前,还包括将所述多个纤维管进行后处理的步骤,所述后处理为干燥、除杂、喷涂、造孔中的一种或两种以上的组合。
可选地,所述将所述多个纤维管通过自粘连的方式进行拼接组装的步骤之后,还包括采用套管将不同纤维管之间的拼接处进行加固的步骤。
本发明的第三方面,提供本发明所述的3D多枝仿生支架在作为或制备组织工程支架材料方面中的应用。
与现有技术相比,本发明的优点至少包括:
第一,本发明通过“设计-制备-装配”的思路,实现了多枝、网络结构的仿生支架的成型,既可按需得到天然组织中的多分支细胞外基质模拟结构,又克服了直接成型复杂微通道结构的技术瓶颈。该3D多枝仿生支架可为缺损组织提供有效力学支撑,其相互贯通的网络框架,有利于细胞定向排布、渗透生长,以及血管和神经长入,也便于营养物质和代谢废物的传递,且该3D多枝仿生支架的制备成本低廉、生产可操作性强、灵活度高,在生物医学材料及组织工程领域中具有理想的推广和应用价值;
第二,本发明采用生物可降解高分子材料作为制备3D多枝仿生支架的原料,安全无毒、生物相容性好,在组织工程修复和再生过程中,材料可自动降解;由于生物可降解高分子材料A和生物可降解高分子材料B能够通过氢键或金属络合作用自粘连,因此得到的不同纤维管之间具有自粘连功能,3D多枝仿生支架组装时无需额外添加粘接剂即可实现不同纤维管的直接连接;当将不同生物可降解高分子材料混合使用时,不仅可以根据缺损修复需求实现组织工程支架的精确设计制造,还可以对支架材料的力学性能(如弹性、硬度、强度等)和降解速度进行有效调控,在组织工程支架设计和制备方向具有突出的优势;
第三,本发明采用3D直写或静电纺丝制备的纤维直径与细胞外基质中的微丝相当,加之由纤维构成的微小孔隙结构,以及较好的管道连通性,能够很好地模拟天然细胞外基质结构,为细胞生长提供理想微环境。通过改变制备过程中的供液种类(如改变生物可降解高分子材料的种类)和接收装置模具,设计对应参数(即压强、电场、流速等参数),还可得到具有不同拉伸应变速率和取向结构的纳米级的纤维管,以满足不同的细胞生长需求,对细胞粘附、铺展和增殖具有较好的促进作用。
附图说明
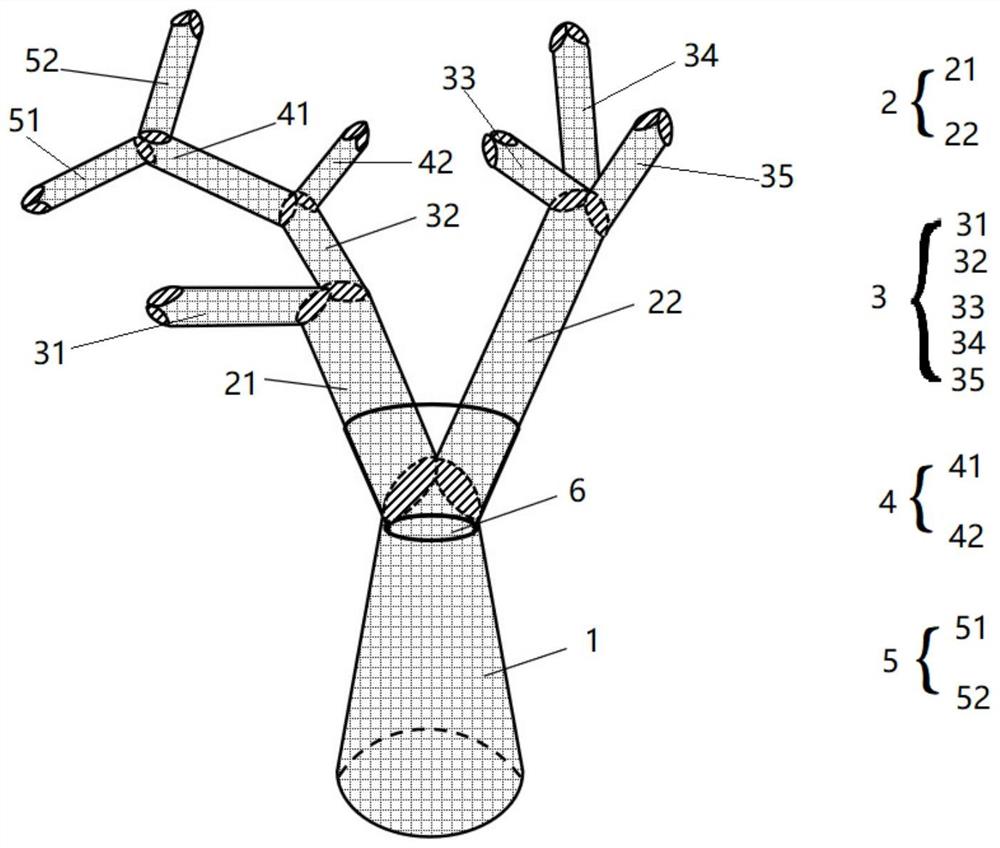
图1是本发明实施例提供的一种3D多枝仿生支架的结构示意图。
图2是本发明实施例1中用于臂丛神经结构修复的3D多枝臂丛神经仿生支架的结构示意图。
图3是本发明实施例2中用于血管组织工程分支结构修复的3D多枝血管仿生支架的结构示意图。
具体实施方式
以下以具体实施例来说明本发明的技术方案,但本发明的保护范围不限于此。
本发明实施例提供一种3D多枝仿生支架,所述3D多枝仿生支架包括:主干纤维管,所述主干纤维管的一端连通有至少两个一级分支纤维管,每个一级分支纤维管的端部连通有二级分支纤维管;所述主干纤维管的横截面积等于所有与之连接的一级分支纤维管的横截面积之和,所述主干纤维管的管壁、所述一级分支纤维管的管壁和所述二级分支纤维管的管壁均具有孔隙结构。
需说明的是,本实施例3D多枝仿生支架中不限于包括一级分支纤维管和二级分支纤维管,还可以包括三级分支纤维管、四级分支纤维管,。。。m级分支纤维管(m为正整数),具体根据需要确定分支纤维管的级数。所述一级分支纤维管至少为两个,具体可以为两个、三个、四个,。。。n个,其中n为正整数。
本实施例中,单个分支纤维管的一端可以连接有若干下一级分支纤维管,所述若干可以为一个、两个、三个或四个等。在一种实施方式中,单个分支纤维管的横截面积等于所有与之连接的下一级分支纤维管的横截面积之和。
在一种实施方式中,所述3D多枝仿生支架还包括套管,所述套管用于将不同纤维管之间的连接处进行加固。
在一种实施方式中,所述纤维的直径为0.1~25mm,所述孔隙的直径为0.01~100μm,有利于细胞渗透生长,以及血管和神经长入,也便于营养物质和代谢废物的传递。
以图1为示例,所述3D多枝仿生支架包括主干纤维管1和分支纤维管,所述分支纤维管包括一级分支纤维管2、二级分支纤维管3、三级分支纤维管4、四级分支纤维管5,所述一级分支纤维管2包括一级分支纤维管21和一级分支纤维管22,所述二级分支纤维管3包括二级分支纤维管31、二级分支纤维管32、二级分支纤维管33、二级分支纤维管34和二级分支纤维管35,所述三级分支纤维管4包括三级分支纤维管41和三级分支纤维管42,所述四级分支纤维管5包括四级分支纤维管51和四级分支纤维管52;所有一级分支纤维管2的一端与所述主干纤维管1的同一端相连接,所述二级分支纤维管3与所述一级分支纤维管2的另一端相连接;所述主干纤维管1与所述一分支纤维管2相连接一端的横截面积等于所有与之连接的一分支纤维管2的横截面积之和,所述主干纤维管1的管壁和所述分支纤维管的管壁均具有孔隙结构。
所述3D多枝仿生支架还包括套管6,所述套管6用于将不同纤维管的连接处进行固定。
本发明实施例提供一种3D多枝仿生支架的制备方法,其中,包括如下步骤:
S1、提供混合墨水,所述混合墨水包括生物可降解高分子材料A、生物可降解高分子材料B和溶剂;
S2、采用3D直写或静电纺丝将所述混合墨水制成多个纤维管;
S3、将所述多个纤维管通过自粘连的方式进行拼接组装,得到所述3D多枝仿生支架。
其中,两纤维管之间具有氢键或金属络合作用,通过氢键或金属络合作用实现自粘连。
与现有技术相比,本实施例的优点至少包括:
第一,本实施例通过“设计-制备-装配”的思路,实现了多枝、网络结构的仿生支架的成型,既可按需得到天然组织中的多分支细胞外基质模拟结构,又克服了直接成型复杂微通道结构的技术瓶颈。该3D多枝仿生支架可为缺损组织提供有效力学支撑,其相互贯通的网络框架,有利于细胞定向排布、渗透生长,以及血管和神经长入,也便于营养物质和代谢废物的传递,且该3D多枝仿生支架的制备成本低廉、生产可操作性强、灵活度高,在生物医学材料及组织工程领域中具有理想的推广和应用价值;
第二,本实施例采用生物可降解高分子材料作为制备3D多枝仿生支架的原料,安全无毒、生物相容性好,在组织工程修复和再生过程中,材料可自动降解;由于生物可降解高分子材料A和生物可降解高分子材料B能够通过氢键或金属络合作用自粘连,因此得到的不同纤维管之间具有自粘连功能,3D多枝仿生支架组装时无需额外添加粘接剂即可实现不同纤维管的直接连接;当将不同生物可降解高分子材料混合使用时,不仅可以根据缺损修复需求实现组织工程支架的精确设计制造,还可以对支架材料的力学性能(如弹性、硬度、强度等)和降解速度进行有效调控,在组织工程支架设计和制备方向具有突出的优势;
第三,本实施例采用3D直写或静电纺丝制备的纤维直径与细胞外基质中的微丝相当,加之由纤维构成的微小孔隙结构,以及较好的管道连通性,能够很好地模拟天然细胞外基质结构,为细胞生长提供理想微环境。通过改变制备过程中的供液种类(如改变生物可降解高分子材料的种类)和接收装置模具,设计对应参数(即压强、电场、流速等参数),还可得到具有不同拉伸应变速率和取向结构的纳米级的纤维管,以满足不同的细胞生长需求,对细胞粘附、铺展和增殖具有较好的促进作用。
本实施例中,生物可降解高分子材料A和生物可降解高分子材料B之间具有氢键或金属络合作用,使得制得的两纤维管之间具有氢键或金属络合作用,通过氢键或金属络合作用实现两纤维管之间的自粘连功能。
其中,由于生物可降解高分子材料A中的羟基(-OH)、羧基(-COOH)和酯基(-COOR)与生物可降解高分子材料B中的胺基(-NH
或者,由于生物可降解高分子材料A中的羟基(-OH)、羧基(-COOH)和酯基(-COOR)与生物可降解高分子材料B中的金属盐所含正价金属离子(如Ca
在一种实施方式中,所述生物可降解高分子材料A可以为丝蛋白、壳聚糖、透明质酸、胶原、海藻酸钠、明胶、聚丙交酯-乙交酯、聚乙烯醇、聚己内酯、聚乳酸等中的一种或两种以上的组合。
在一种实施方式中,所述生物可降解高分子材料B为单宁酸、聚丙烯酰胺、聚乙烯醇、正价金属盐、硼砂、环糊精、丁二酮肟中的一种或两种以上的组合。
步骤S1中,在一种实施方式中,所述混合墨水可以通过以下方法制备得到:
S11、将生物可降解高分子材料A进行预处理,然后分散于第一溶剂中,得到A溶液;
S12、将生物可降解高分子材料B分散于第二溶剂中,得到B溶液;
S13、将所述B溶液加入到所述A溶液中,得到所述混合墨水。
步骤S11中,在一种实施方式中,所述第一溶剂为水、甲酸、乙酸、六氟异丙醇、四氢呋喃、二甲基甲酰胺、二甲基亚砜中的一种或两种以上的组合。
步骤S12中,在一种实施方式中,所述第二溶剂为水、甲酸、乙酸、六氟异丙醇、四氢呋喃、二甲基甲酰胺、二甲基亚砜中的一种或两种以上的组合。
步骤S13中,在一种实施方式中,所述混合墨水中,总的生物可降解高分子材料(即生物可降解高分子材料A和生物可降解高分子材料B的质量之和)占比为1~35%w/v,所述生物可降解高分子材料A和生物可降解高分子材料B的质量比为1:4~19:1。
在一种实施方式中,步骤S2具体包括:
S21、将所述混合墨水加至3D直写机的注射器中,根据所述3D直写机和预设纤维管尺寸,调整注射器针头到接收器的距离;
S22、设置所述3D直写机中的压强、电场与流速,在所述压强、电场及流速作用下从注射器针头中挤出纤维,所述纤维在不同接收器上定向收集、排布,得到所述多个纤维管。
在一种实施方式中,所述3D直写机注射器针头到接收器的距离为0.1~1.5cm,所述压强为10~100kPa,所述电场为0.5~1.5kV,所述流速为1~30mm/s。
在另一种实施方式中,步骤S2具体包括:
S21'、将所述混合墨水加至静电纺丝机的注射器中,根据根据所述静电纺丝机和预设纤维管尺寸,调整注射器针头到接收器的距离;
S22'、设置所述静电纺丝机中的电场、流速,在所述电场、流速作用下从注射器针头中挤出纤维,所述纤维在不同接收器上定向收集、排布,得到所述多个纤维管。
在一种实施方式中,所述静电纺丝机注射器针头到接收器的距离为5~30cm,所述电场为15~25kV,所述流速为0.1~10ml/h。
在一种实施方式中,所述纤维的直径为0.1~25mm,所述纤维之间构成的孔隙直径为0.01~100μm,有利于细胞渗透生长,以及血管和神经长入,也便于营养物质和代谢废物的传递。
步骤S3中,在一种实施方式中,所述将所述多个纤维管通过自粘连的方式进行拼接组装的步骤之前,还包括将所述多个纤维管进行后处理的步骤,所述后处理为干燥、除杂、喷涂、造孔中的一种或两种以上的组合。
在一种实施方式中,所述将所述多个纤维管通过自粘连的方式进行拼接组装的步骤之后,还包括采用套管将不同纤维管之间的拼接处进行加固的步骤。即在不同尺寸的纤维管自修复自粘连后,采用套管进一步加固。
本发明实施例提供所述的3D多枝仿生支架在作为或制备组织工程支架材料方面中的应用。
下面通过若干具体的实施例对本发明作进一步地说明。
实施例1
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白进行提取预处理(5g丝蛋白粉料加入到0.02M的脱胶剂碳酸钠水溶液中煮沸后,经洗涤、干燥获得蛋白纤维;然后将蛋白纤维溶于9.3M LiBr溶液中,在60℃下搅拌4小时,冷却后经过反复渗析去除金属离子后,最后冻干);将经预处理的丝蛋白分散于去离子水中,配制成80ml浓度为5%w/v的A溶液;然后,将1.6ml的浓度为50%w/v的单宁酸水溶液B滴加入A溶液中,配制成溶质总浓度为7%w/v的混合墨水;
S2、将上述混合墨水加至3D直写机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置压强为30kpa,电场为0.8kV,流速为10mm/s,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得10种不同尺寸的纤维管若干;
S3、将上述10种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例1中,不同尺寸的纤维管的尺寸参数如表1所示。进一步对由上述生物可降解高分子材料,经3D直写得到的纤维管进行测试。
材料力学性能测试:纤维管单管的拉伸强度约为5~10MPa,拉伸模量为120~180MPa,断裂伸长率约为10~20%;
吸附量测试:纤维管对蛋白质的吸附量由尺寸不同为5±1.20μg~15±4.20μg。
生物相容性测试:采用CCK-8细胞增殖实验评价纤维管的生物相容性能。具体方法如下:将mMSCs细胞(小鼠骨髓间充质干细胞)以2×10
如图2所示,模拟臂丛神经结构,将上述不同尺寸的纤维管按照臂丛神经结构进行组装,得到用于臂丛神经结构修复的3D多枝臂丛神经仿生支架。
表1、实施例1中10种不同尺寸的纤维管的尺寸参数
实施例2
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白进行提取预处理(5g丝蛋白粉料加入到0.02M的脱胶剂碳酸钠水溶液中煮沸后,经洗涤、干燥获得蛋白纤维;然后将蛋白纤维溶于9.3M LiBr溶液中,在60℃下搅拌4小时,冷却后经过反复渗析去除金属离子后,最后冻干);将经预处理的丝蛋白分散于去离子水中,配制成80ml浓度为5%w/v的A溶液,向该A溶液中加入0.887g的氯化钙,并充分搅拌;然后,将1.6ml的浓度为50%w/v的单宁酸水溶液B滴加入含氯化钙的A溶液中,配制成混合墨水;
S2、将上述混合墨水加至3D直写机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置压强为50kpa,电场为1.2kV,流速为20mm/s,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得8种不同尺寸的纤维管若干;
S3、将上述8种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
如图3所示,模拟血管组织工程分支结构,将上述不同尺寸的纤维管按照血管组织工程分支结构进行组装,得到用于血管组织工程分支结构修复的3D多枝血管仿生支架。
实施例3
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白进行提取预处理(5g丝蛋白粉料加入到0.02M的脱胶剂碳酸钠水溶液中煮沸后,经洗涤、干燥获得蛋白纤维;然后将蛋白纤维溶于9.3M LiBr溶液中,在60℃下搅拌4小时,冷却后经过反复渗析去除金属离子后,最后冻干);将经预处理的丝蛋白分散于去离子水中,配制成浓度为30%w/v的A溶液;然后,按照丝蛋白与聚丙烯酰胺质量比3:2,将浓度为15%w/v的聚丙烯酰胺B水溶液与A溶液混合并用去离子水稀释,配制成溶质总浓度为18%w/v的混合墨水;
S2、将上述混合墨水加至3D直写机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置压强为75kpa,电场为0.5kV,流速为5mm/s,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得5种不同尺寸的纤维管若干;
S3、将上述5种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例4
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白进行提取预处理(5g丝蛋白粉料加入到0.02M的脱胶剂碳酸钠水溶液中煮沸后,经洗涤、干燥获得蛋白纤维;然后将蛋白纤维溶于9.3M LiBr溶液中,在60℃下搅拌4小时,冷却后经过反复渗析去除金属离子后,最后冻干);将壳聚糖进行除杂预处理后,将经预处理的丝蛋白和壳聚糖按4:1质量比例加入到甲酸溶液中,充分搅拌均匀,配制得到总生物可降解高分子材料占比为15%w/v的混合溶液80ml;然后向混合溶液中加入0.887g的氯化钙,充分搅拌,配制成混合墨水;
S2、将上述混合墨水加至静电纺丝机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置电场为20kV,流速为5ml/h,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得6种不同尺寸的纤维管若干;
S3、将上述6种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例5
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白进行提取预处理(5g丝蛋白粉料加入到0.02M的脱胶剂碳酸钠水溶液中煮沸后,经洗涤、干燥获得蛋白纤维;然后将蛋白纤维溶于9.3M LiBr溶液中,在60℃下搅拌4小时,冷却后经过反复渗析去除金属离子后,最后冻干);将经预处理的丝蛋白分散于去离子水中,配制成浓度为15%w/v的A溶液,取20ml的A溶液与80ml的浓度为50%w/v聚乙烯醇B水溶液混合,配制成丝蛋白浓度3%w/v的混合墨水;
S2、将上述混合墨水加至静电纺丝机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置电场为15kV,流速为1ml/h,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得7种不同尺寸的纤维管若干;
S3、将上述7种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例6
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、选取丝蛋白、壳聚糖、聚丙交酯-乙交酯和海藻酸钠的组合作为生物可降解高分子材料A,选取硼砂作为生物可降解高分子材料B。将丝蛋白、壳聚糖、聚丙交酯-乙交酯和海藻酸钠四种原料按3:2:1:1质量比例加入到乙酸溶液中,充分搅拌均匀,配制成80ml浓度为15%w/v的A溶液;然后,将1.6ml的浓度为50%w/v的硼砂水溶液B滴加入A溶液中,配制成溶质总浓度为12%w/v的混合墨水;
S2、将上述混合墨水加至3D直写机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置压强为20kpa,电场为1.5kV,流速为8mm/s,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得15种不同尺寸的纤维管若干;
S3、将上述15种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例7
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将聚乳酸和胶原分别除杂预处理后,按1:1质量比例加入到二甲基甲酰胺中,充分搅拌均匀,配制成80ml浓度为20%w/v的A溶液;然后,将5ml的浓度为30%w/v聚乙烯醇水溶液B滴加入A溶液中,配制成溶质总浓度为15%w/v的混合墨水;
S2、将上述混合墨水加至静电纺丝机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置电场为18kV,流速为3ml/h,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得12种不同尺寸的纤维管若干;
S3、将上述12种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
实施例8
本实施例的3D多枝仿生支架的制备方法,包括如下步骤:
S1、将丝蛋白、壳聚糖和聚己内酯三种原料按3:1:1质量比例加入到甲酸溶液中,充分搅拌均匀,配制成80ml浓度为35%w/v的A溶液;然后,将浓度为20%w/v单宁酸水溶液B滴加入A溶液中,配制成溶质总浓度为30%w/v的混合墨水;
S2、将上述混合墨水加至3D直写机的注射器中,并根据设计调整注射器针头到辊筒接收器的距离;设置压强为80kpa,电场为0.6kV,流速为15mm/s,从注射器针头挤出纤维,纤维在电场和流速的作用下,在不同辊筒接收器模具上定向收集、排布,获得5种不同尺寸的纤维管若干;
S3、将上述5种不同尺寸的纤维管进行干燥后处理,然后拼接组装,通过连接处纤维的自修复性能相互粘连,并采用套管将连接处进行加固,最终得到3D多枝仿生支架。
根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对本发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制。
- 一种3D多枝仿生支架及其制备方法与应用
- 一种含干细胞外泌体的3D仿生生物支架及应用
