基于小细胞肺癌血浆外泌体长链RNAs的诊断及疗效预测模型
文献发布时间:2023-06-19 18:30:43
技术领域
本发明涉及生物检测领域,具体涉及基于小细胞肺癌血浆外泌体长链RNAs的诊断及疗效预测模型。
背景技术
肺癌是全球发病率、死亡率首位的恶性肿瘤,其中小细胞肺癌(SCLC)约占15%-20%。SCLC是一种神经内分泌肿瘤,其疾病进展迅速、侵袭性高,易耐药,恶性程度高。SCLC有较高的肿瘤突变负荷,较常见的基因异常有RB1,TP53等,但酪氨酸激酶信号基因(如KRAS、EGFR)突变罕见;与NSCLC相比,SCLC的基因变异目前没有获批的靶向药物分子。晚期SCLC患者目前一线标准治疗为铂类联合依托泊苷的化疗。虽然初期肿瘤对于化疗较为敏感,整体的ORR在60%-65%,但易发生耐药,疾病迅速复发或进展,预期生存期短,中位OS仍然只有约10个月。通常,对化疗耐药、难治性患者预后更差。然而,目前还没有临床相关的筛查方法和生物标志物来预测化疗敏感性。因此,亟需生物标志物来帮助在治疗前进行风险评估和分层。
因SCLC可手术切除病例少,肿瘤活检组织量少,肿瘤异质性,二次活检可行性差等特点,有关其基因组表达谱等研究较少。近年来发展迅速的液体活检技术,凭借无创、价廉、便捷、重复性高等优势,可以在很大程度上弥补这种不足。通过对血液、尿液、乳汁等体液的取样和分析,在肿瘤的筛查、诊断、预后、疗效预测、分子生物学分析等方面都发挥着极为重要的作用。液体活检技术主要包括检测循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤细胞(circulating tumor cell,CTC)和细胞外囊泡(extracellular vesicles,EVs)三种途径。
EVs分为外泌体和微囊泡,是纳米大小的脂质双分子层结构,包含细胞来源的蛋白质、脂质和各种核酸。EVs由活细胞分泌,包含来自亲代细胞的丰富生物信息,可以反映细胞的生理和病理状态。近年来,外泌体长链RNAs(exLR),包括信使RNA(mRNA)、环状RNA(circRNA)和长链非编码RNA(lncRNA),已成为癌症诊断、预测和预后的研究热点。
Zhao等人(Zhao R et al.Mol Cancer.2018;17(1):68-.doi:10.1186/s12943-018-0817-x.)发现外泌体中的lncRNA HOTTIP可作为胃癌的诊断和预后标志物。Yu等人(YuS et al.Gut.2020;69(3):540-50.doi:10.1136/gutjnl-2019-318860.)描绘了胰腺导管癌的血浆exLR谱,并研发了一种基于exLR的模型用于胰腺癌的诊断。Su等人(Su Y etal.NPJ Breast Cancer.2021;7(1):154-.doi:10.1038/s41523-021-00356-z.)证明了exLR谱作为乳腺癌早期发现和治疗疗效预测的潜在生物标志物的价值。所有这些先前的研究表明,exLR可以作为一种非侵入性诊断和预后的生物标志物。
目前在肺癌领域,血液外泌体的研究主要集中在NSCLC中外泌体的蛋白、利用外泌体RNA识别肿瘤来源的特定体细胞突变、miRNA等,但miRNAs种类较少,候选靶点有限。而在SCLC领域,对于SCLC的血液外泌体研究甚少,SCLC血液外泌体转录谱研究尚属空白。
发明内容
为克服上述问题,本发明对小细胞肺癌患者治疗前后、非小细胞肺癌患者基线、正常人血浆外泌体长链RNAs(exLRs)进行高通量测序及生物信息分析,鉴定小细胞肺癌患者血浆外泌体特异转录谱,结合治疗疗效、预后等因素,筛选相关的生物标志物,探索血浆exLRs在SCLC诊断和疗效预测中的应用价值。
具体地,本发明第一方面提供了小细胞肺癌标志物组合,所述标志物组合由血浆外泌体EPCAM、CCNE2、CDC6、KRT8、LAMB1、CALB2、STMN1、UCHL1、HOXB7和CDCA7共10个长链RNAs组成。
本发明第二方面提供了本发明第一方名所述的标志物组合表达水平的试剂在制备小细胞肺癌诊断、疗效预测、预后风险评估试剂盒中的用途。
在某些实施方式中,所述疗效预测为化疗疗效预测。
在某些实施方式中,所述化疗疗效预测包括如下步骤:1)血浆样本的收集;2)EVs的分离;3)RNA测序分析;4)t分数(t-score)计算;5)根据t分数进行小细胞肺癌诊断、化疗敏感性预测。
在某些实施方式中,所述步骤1)中血浆样本来自体检患者或小细胞肺癌患者;优选地,所述小细胞肺癌患者的血浆收集时间为第一次化疗前或化疗2疗程之后。
在某些实施方式中,所述步骤2)中使用用exoRNeasy Serum/Plasma Kit试剂盒提取血浆外泌体。
在某些实施方式中,所述步骤3)中分离的总EV RNA用DNase I处理以去除DNA,使用SMART cDNA合成技术制备链特异性RNA-seq文库,使用Illumina测序平台完成测序,具有150bp双末端运行指标;使用FastQC过滤原始读数,并使用STAR与GRCh38人类基因组组装进行比对;基因表达水平以每千碱基百万(TPM)的转录本计算;从GENCODE(V.25)中检索到人类基因组中mRNA和lncRNA的注释;RNA-seq原始读取计数被转换为TPM值以缩放所有可比较的变量并在所有样本中标准化。
在某些实施方式中,所述步骤4)中根据十个长链RNAs标志物EPCAM、CCNE2、CDC6、KRT8、LAMB1、CALB2、STMN1、UCHL1、HOXB7和CDCA7所构建的SCLC分类器,计算样本的预测t分数(t-score)。
在某些实施方式中,所述步骤5)中根据t分数进行小细胞肺癌诊断的标准为:若样本的t分数大于等于0.0209,则预测患者为SCLC;若样本的t分数小于0.0209,则预测患者为非SCLC。
在某些实施方式中,所述步骤5)中根据t分数进行小细胞肺癌化疗敏感性预测的标准为:若样本的t分数大于等于0.4238,则预测患者为化疗耐药;若样本的t分数小于0.4238,则预测患者为化疗敏感。
本发明第三方面提供了小细胞肺癌诊断、疗效预测、预后风险评估试剂盒,所述试剂盒包括检测本发明第一方面所述的标志物组合表达水平的试剂。
在某些实施方式中,所述检测标志物组合表达水平的试剂为用于标志物RNA测序(RNA-seq)的试剂。
与现有技术相比,本发明的有益效果在于:
1)本发明从57例SCLC患者(57例基线样本另外加上2化疗疗程后的17例样本)、104例NSCLC患者和59例健康对照者血浆EV样本中获得了exLR-seq表达谱,是SCLC血浆EV中最大的长链RNA-seq表达谱库。本发明首次鉴定了SCLC的exLR谱,并建立了用于SCLC诊断和疗效预测的t-signature。
2)目前,在肺癌领域,SCLC血液外泌体转录谱研究尚属空白。大多数SCLC患者诊断时即为广泛期,手术机会少。因此,建立诊断和疗效预测模型有助于精准和个体化治疗。本发明建立了模型并生成了SCLC的exLR t评分,使用该模型区分了的化疗敏感者和化疗耐药者,AUC为0.909(95% CI:0.837-0.981)。t-score具有预测化疗敏感人群的潜力,有助于个体化精准治疗。
3)根据t值中位数将样本分为低值组和高值组。从多个方面验证了t-score的预测效果。首先进行ROC曲线和Kaplan-Meier分析,较高的t分数与较差的疾病结果显著相关,表明t-signature具有良好的预测价值。此外,治疗前后t值的变化与疾病进展和疾病控制有关,为SCLC患者的预后提供信息。最后,t-score还可用于SCLC的诊断,可有效区分SCLC与健康对照者(AUC 0.9643,95% CI:0.9256-1),以及区分SCLC与NSCLC(AUC 0.721,95% CI:0.6384-0.8036)。这种预测诊断模型有利于SCLC的早期诊断和尽早的精准治疗。本发明是首个表征SCLC患者的exLR谱的研究,并确定了具有良好诊断及疗效预测效力的t模型。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更显著:
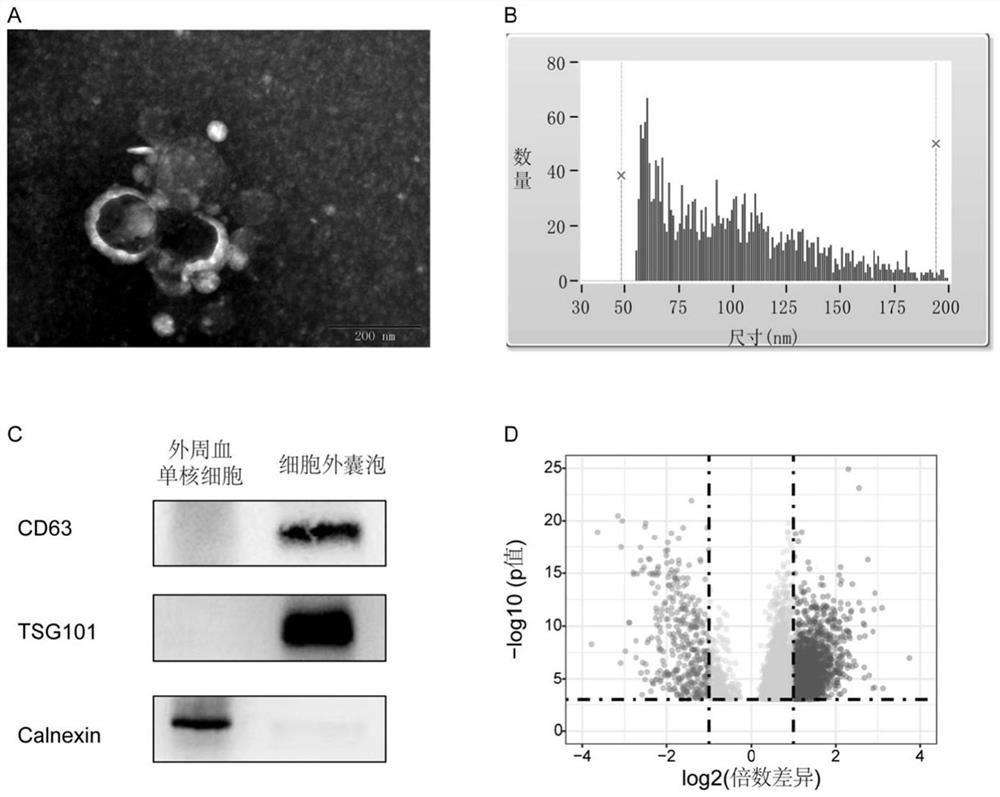
图1.血浆EV验证和exLR-seq分析。(A)细胞外囊泡的透射电子显微镜图像,尺度200nm。(B)细胞外囊泡的粒径分布测量分析。(C)蛋白质印记实验检测EV特异性表面标志物CD63抗原、TSG101和PBMC特异性钙黏蛋白(Calnexin)。所提取的EV可检测到CD63抗原和TSG101的富集,而不能检测到Calnexin的富集(D)SCLC和健康对照组之间差异表达的exLR的火山图。
图2.基于ExLR的t-signature。(A)化辽敏感组(N=33)和化疗耐药组(N=24)的ExLR t模型评分。(B)ExLR t模型在SCLC中预测化疗治疗敏感性的ROC。(C-D)低(n=28)或高(n=29)t值的SCLC组的OS(c)和PFS(d)的Kaplan-Meier生存分析(对数秩检验)。(E)SCLC组临床特征和t值的PFS的多变量Cox比例风险回归分析。
图3.基线和2化疗疗程后配对样本的T值。化疗敏感组(A)和化疗耐药组(B)在基线和2化疗疗程后的T值。(C)化疗敏感组和化疗耐药组的T值差异。具有高和低t值差异的SCLC组的PFS(D)和OS(E)的Kaplan-Meier生存分析(对数秩检验)。
图4.用于SCLC诊断的T值。区分SCLC与健康对照组(A),SCLC与NSCLC(C)的T值。SCLC组和健康对照组(B)、SCLC和NSCLC(D)中t-signature的ROC曲线。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
除非另作定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
以下结合具体实施例对本发明的基于小细胞肺癌血浆外泌体长链RNAs的诊断及疗效预测模型进行阐述。
实施例1研究参与者收集、研究设计及疗效评估
1.1研究参与者收集、研究设计
参与者包括57例SCLC患者、104例NSCLC患者和59例健康参与者。所有参与者均于2018年8月至2021年7月从复旦大学附属肿瘤医院(FUSCC)招募。所有SCLC患者在FUSCC接受含铂化疗(铂类联合依托泊苷或伊立替康)。入组时,所有患者均未接受任何其他形式的治疗。
患者接受依托泊苷联合卡铂/顺铂(EC/EP)的标准一线化疗。在每周期的第一天给予卡铂,(标准AUC 5mg/mL/min(按Calvert公式计算),或顺铂(75mg/m
通过PFS,ORR和DCR进行疗效评估。PFS定义为从接受第一次化疗至疾病进展或死亡的时间。分析时未发生疾病进展的患者在末次随访时间被定义为删失数据。根据实体瘤疗效评价标准RECIST(1.1版本)进行疗效评估,DCR定义为完全缓解(CR),部分缓解(PR)和疾病稳定(SD)的患者百分比。ORR定义为CR和PR患者的百分比。
每6周(42天)评估一次疗效,如果疾病控制(CR+PR+SD)且不良反应可以耐受的患者,则继续化疗,共4疗程。
根据化疗期间最佳疗效评价以及疾病进展情况,将患者分为化疗敏感组及化疗耐受组。
化疗敏感组:患者一线化疗期间最佳疗效评价为CR/PR,且在一线化疗结束后90天内未发生疾病进展的患者。
化疗耐药组:患者一线化疗期间最佳疗效评价为SD/PD,或者患者在一线化疗期间或一线化疗结束后90天内发生疾病进展的患者。
1.2患者基线特征和治疗模式
共220例参与者(57例SCLC患者,104例非小细胞肺癌患者和59例健康者)纳入本发明研究过程。57例SCLC患者中,25例接受依托泊苷+顺铂化疗,31例接受依托泊苷+卡铂治疗,1例接受伊立替康+顺铂治疗。按照化疗敏感组和化疗耐受组的定义,33例SCLC为化疗敏感组,24例为化疗耐药组。化疗敏感组患者的局限期患者占比高于化疗耐药组,两组间其他基线特征没有统计学差异。
1.3疗效评价
SCLC中,42例(73.7%,42/57)患者达到部分缓解(PR),11例患者(19.3%)达到疾病稳定(SD),客观缓解率(ORR)为73.7%(95% CI,60.3%–84.5%),疾病控制率为93.0%(95% CI,83.0%–98.1%)。化疗敏感组的33例患者均达PR,ORR和DCR均为100.0%。在化疗耐受组的24例患者中,9例患者PR,11例患者SD,4例患者PD,ORR为37.5%,DCR为83.3%。在分析截止日期(2021年1月31日),20例患者发生疾病进展,预测的中位无进展生存期(PFS)为7.47个月(95% CI,5.36-9.57个月),预测的中位总生存期(OS)为22.03个月(95% CI,17.65-26.41个月)。
实施例2血浆EVs的分离与验证
2.1血浆样本收集
(1)SCLC患者于基线(第一次化疗前)、化疗2疗程之后(42d),抽全血约10mL至EDTA抗凝采血管,采血后随即轻柔上下颠倒混匀数次。
(2)抽血后2小时内分离血浆,将全血3000×rpm室温离心10分钟。
(3)收集上清至2.0mL EP管(或1.5mL)离心管中,随即在4℃条件下,13000×g离心10min。
(4)收集上清血浆分装转移至2ml可立螺旋盖EP管中,并做好相应标记。
(5)随即置-80℃冰箱长期保存。
2.2EVs的分离
用exoRNeasy Serum/Plasma Kit(Qiagen,Hilden,德国)试剂盒提取血浆外泌体,具体操作步骤如下:(1)取1ml血浆,加入等体积缓冲液XBP,立即轻轻上下颠倒5次,并使混合液平衡至室温。(2)将上述混合液加入到exoRNeasy过滤柱,室温条件下,500×g,离心1min。(3)弃收集管内的液体,并将滤柱重新放回原收集管,在滤柱中加入3.5ml缓冲液XWP,室温条件下,5000×g,离心5min以清洗柱体除去残留的缓冲液。(4)丢弃滤液及收集管,将滤柱放置于新收集管内,加入400μl XE缓冲液(Qiagen,No.76214),静置5min后,室温条件下,5000×g,离心5min。(5)将收集管中的洗脱液加到超滤管内管中(Amicon Ultra-0.5Centrifugal Filter 10kDa,Merck Millipore,德国),超滤管盖连接处对准离心机中心,4℃条件下,12000×rpm,离心17min。(6)在内管中加入PBS至150μl,并将内管置于新收集管。4℃条件下,12000×rpm,离心10min。(7)将内管倒置于收集管内,将收集管盖子打开,4℃条件下,12000×rpm,离心1min。(8)收集收集管内液体,完成EVs的分离与浓缩。
2.3EVs的验证
对于透射电子显微镜(TEM)验证、粒径分布测量验证和蛋白质印迹验证,EVs用400μL XE洗脱缓冲液洗脱。为了减少洗脱液体积(至50μL),使用Amicon Ultra-0.5Centrifugal Filter 10kDa(Merck Millipore,Germany)对样品进行超滤。对于EV-RNA分离,使用QIAzol(Qiagen)在柱上裂解EV,然后用14μL无RNase水洗脱总RNA。
2.3.1透射电子显微镜(TEM)验证
通过用磷钨酸负染色鉴定EVs。具体步骤如下:(1)使用4%的多聚甲醛固定浓缩的外泌体。(2)将10μl外泌体加到含聚乙烯醇缩甲醛树脂(Parafilm)膜支撑的铜网并悬浮3-10分钟以使样品吸收到支撑膜中,使用滤纸从铜网边缘吸收液体。(3)将50μl的磷钨酸负染色液(2%)滴加到Parafilm膜上,覆盖并悬浮3分钟。使用滤纸从铜网的边缘吸收染色溶液。(4)将样品放在白炽光下干燥10分钟。(5)将铜网置于透射电子显微镜(Phillips CM120,东京,日本)下成像,获得透射电子显微照片。
2.3.2粒径分布测量验证
流式纳米分析仪(NanoFCM Inc.,中国)分析所提取EVs的大小,并按照仪器说明书进行尺寸分布分析。以合成的纳米二氧化硅微珠作为尺寸参考标准,构建一条关于颗粒尺寸和散射强度的刻度标准线,利用该标准线可以将每个囊泡的散射强度转换为相应的囊泡尺寸。对重悬于100ul PBS的细胞外囊泡以及作为空白对照的100ul PBS进行测量,分析数据,并构建EVs粒径分布直方图。
2.3.3蛋白质印迹验证
外周血单个核细胞(PBMC)的提取步骤如下:(1)抽全血约6-8mL至EDTA抗凝采血管,采血后随即轻柔上下颠倒混匀数次。(2)抽血后2小时内,将全血3000×rpm室温离心10分钟。(3)收集上清至2.0mL EP管(或1.5mL)离心管中。将下层血细胞吸取3ml至新离心管中,并加入3ml PBS,轻轻上下颠倒5-6次混匀。(4)在另一离心管中加入3ml Lymphoprep
蛋白印迹实验步骤如下:(1)使用含蛋白酶抑制剂的RIPA裂解液,裂解提取的PBMC和浓缩外泌体的蛋白。(2)按BCA试剂盒说明书,将上述蛋白溶液加入45μl PBS,10倍稀释后,加入200μl预先配制好的BCA蛋白浓度测定混合物,充分混匀后,37℃水浴30分钟;孵育结束后,用酶标仪检测样品及BCA溶液在562nm的吸光度,并根据标准曲线,换算出待测蛋白的浓度值。(3)分别吸取80μl上述蛋白溶液,20μl 5×Loading Buffer,及5μl 20×DTT溶液,混合均匀,100℃金属浴5-10分钟,蛋白变性结束后取出,室温放置5分钟后放入-20℃保存,备用。(4)配制SDS-PAGE凝胶,根据目的蛋白分子量大小及实验需求选择合适浓度和上样孔的宽度。蛋白质样品上样,安装电泳置加入缓冲液以20μg蛋白质总量计算所需的上样体积,并选择合适的蛋白marker;为优化实验结果,使用1×loading buffer进行平衡上样孔及每孔中的上样总体积。电泳:70V恒压条件下进行电泳,待蛋白marker分开之后将电压调到130V,直至溴酚蓝跑到分离胶的最下方即可停止。剪取与凝胶大小相同的NC膜一张,放入转膜液中浸泡;再将裁剪好的6张滤纸以及2张海绵滤网放入转膜液中浸泡。电泳结束后,取出凝胶,拆开玻璃板,去掉浓缩胶,放入转膜液中浸泡;然后按照一层海绵滤网、三层滤纸、凝胶、NC膜、三层滤纸、一层海绵滤网的顺序叠放在一起。在NC膜和凝胶之间的气泡要排出,凝胶上蛋白的转移方向是由负极到正极(黑色到红色),然后向转膜槽中加满转膜缓冲液,将整个转膜槽放到盆中,冰倒入盆中并覆盖转膜槽,以确保转膜过程是在低温下进行,电转膜条件:恒流270mA,90分钟。待转膜结束后,取出NC膜,先用TBST清洗一遍,然后置于5%脱脂奶粉封闭液中,放置摇床轻摇1-2小时,或4℃封闭过夜。用5%脱脂奶粉或一抗稀释液(Thermo公司)配制适当比例的抗体稀释液。待封闭结束后,将NC膜从牛奶中取出,加入到上述一抗稀释液中,4℃孵育过夜。从冰箱中取出一抗孵育过夜的NC膜,0.5% TBST洗涤,每10分钟洗一次,洗3次。然后用5%脱脂奶粉配制相应的HRP偶联的二抗稀释液,其中山羊抗兔IgG 1:5000,山羊抗鼠IgG 1:8000。将洗好的NC膜加入到二抗稀释液中,室温下静置或轻摇孵育1-2小时;待孵育结束后,0.5%TBST洗涤,每次10分钟,洗3次。首先1:1混合发光液(Thermo),将其加到NC膜上,避光孵育2-3分钟,然后取出NC膜放到片夹的塑料薄膜上,用吸水纸将液体吸干,电化学发光、显影、定影。
2.4血浆EV的TEM、粒径分布测量和蛋白质印迹验证结果
对所提取的血浆EV进行形态、粒径及特征蛋白的验证(图1)。透射电子显微镜成像(TEM)验证其形态,成像后显示血浆中存在圆形、杯状、双膜的囊泡状结构(图1A)。流式纳米细胞仪显示球形纳米颗粒的囊泡状结构的粒径分布如图1B,平均直径94.50±33.84nm,符合EV的正常粒径大小。蛋白质印迹实验(Western blot)检测EV特异性表面标志物CD63抗原和特异性内容物肿瘤易感基因101(Tumor susceptibility gene 101,TSG101)和外周血单个核细胞特异性钙黏蛋白(Calnexin)。所提取的EV可检测到CD63抗原和TSG101的富集,而不能检测到Calnexin的富集(图1C)。
实施例3RNA测序(RNA-seq)分析
从1mL血浆中分离的总EV RNA用DNase I(NEB,Ipswich,Massachusetts,USA)处理以去除DNA。使用SMART cDNA合成技术(Clontech,USA)制备链特异性RNA-seq文库。用Qubit(Thermo Fisher Scientific,USA)和Qsep100(BiOptic Inc.)控制文库质量。使用Illumina测序平台(San Diego,CA,USA)完成测序,具有150bp双末端运行指标。
使用FastQC过滤原始读数,并使用STAR与GRCh38人类基因组组装进行比对。基因表达水平以每千碱基百万(TPM)的转录本计算。从GENCODE(V.25)中检索到人类基因组中mRNA和lncRNA的注释。
实施例4数据和统计分析
RNA-seq原始读取计数被转换为TPM值以缩放所有可比较的变量并在所有样本中标准化。频率<25%的基因被剔除,剩余的exLRs用于后续分析。
在不同组(SCLC组与健康对照组、化疗敏感组与化疗耐药组)之间评估来自血浆的EV转录谱。Limma R包用于识别差异表达exLR,并通过Benjamini-Hochberg方法调整每个标记的p值以控制错误发现率(FDR)。通过使用'clusterProfiler'包进行基因本体(GO)功能分析和基因富集分析(GSEA)以发现不同组的途径富集和重要分子机制。当p值<0.05时筛选显著差异途径。
为了识别用于SCLC疗效预测和诊断的exLR,发明人使用了多步骤方法。首先,确定了在化疗敏感组和化疗耐药组之间差异表达的exLRs(p<0.05)。还使用Cox比例风险回归模型(p<0.05)对与PFS和OS相关的exLRs进行了分析,并且保留了与PFS和OS相关的基因以获得生存相关基因。同时,发明人比较了SCLC组和健康对照组之间的exLRs,发现了在SCLC组中特异性上调的基因(FDR<0.05,倍数变化>2)。然后,发明人对上述基因进行交叉筛选,获得交叉集exLR。在交叉集中,选择了10个exLR,并在SCLC患者(化疗敏感组vs化疗耐药组)exLR表达的基础上,使用逻辑回归构建一个模型(称为t-signature)。为了评估对化疗敏感性的预测概率,发明人使用R函数“预测”来评估SCLC样本的定量预测强度。通过接受者操作特征(ROC)曲线分析评估t-signature的预测性能。约登指数用以计算准确预测指数的最佳截止点。不同患者组的t-signature分布通过Wilcoxon秩和检验进行检验。Kaplan-Meier曲线和对数秩检验用于比较由t-signature定义的低值组和高值组患者的存活率。Cox回归用于评估t-signature对治疗预测的性能,并且进一步验证了t-signature在健康对照组和NSCLC组患者中的诊断价值。
所有统计分析都是双向的,p值<0.05被认为具有统计学意义,所有检验均为双侧。本研究使用了以下R软件包:“caret”、“enrichplot”、“glmnet”、“ggplot2”、“ggrepel”、“reshape2”、“survival”、“survminer”、“pROC”、“pheatmap”。
实施例5血浆exLR测序(exLR-seq)分析
本发明对59例正常对照组样本,104例NSCLC组样本以及57例SCLC组样本(57例患者基线样本+其中17例患者收集的2疗程化疗之后样本)进行exLR测序(exLR-seq)后分析,在SCLC组、NSCLC组和健康对照组中,分别可靠检测到大约20000、16000和17000个带注释的基因,包括mRNAs,lncRNAs和假基因(pseudogene)。
SCLC组和健康对照组的exLRs分析:
首先,发明人比较了SCLC组和健康对照组之间的基因表达谱。与对照组相比,鉴定了5787个在SCLC组中差异表达的exLRs(FDR<0.001,(倍数变化)>2)。其中,SCLC组2053例上调。基于差异表达的exLRs绘制火山图(图1D)。
通过基因富集分析(Gene Set Enrichment Analysis,GSEA)来探索与差异表达的exLRs相关的通路。KEGG信号通路分析显示,差异表达的exLRs在一些肿瘤相关信号通路富集,如细胞周期、JAK-STAT信号通路、癌症通路、小细胞肺癌、紧密连接和WNT信号通路在SCLC组中富集(p<0.1)。这些结果表明,exLRs具有作为SCLC诊断和疗效预测的生物标志物的潜力。
SCLC化疗敏感组和化疗耐药组exLRs分析:
发明人使用R包“limma”基于p<0.05的过滤标准获得差异表达的exLRs。发明人确定了化疗敏感组和化疗耐受组间存在1297个差异表达的exLRs,其中大多数在化疗耐药组中上调。火山图用于可视化exLRs,通过无监督层次聚类分析并绘制热图。
首先基于这些差异表达的exLRs进行GO富集分析。GO富集分析表明,exLRs主要参与了与有丝分裂细胞周期的G1/S转换、DNA复制和DNA复制起始等相关的生物学过程。为了探索治疗疗效的潜在途径机制,发明人利用GSEA对差异表达的exLRs进行免疫相关通路、KEGG通路和特征分析。化疗耐药组大部分免疫通路的活性高于化疗敏感组。BCR信号通路在化疗耐受组中显著富集。此外,最显著富集的基因组与化疗耐药组呈正相关,许多富集的KEGG通路与癌症密切相关,如DNA复制、细胞周期和WNT信号通路。同样,化疗耐药组富集细胞增殖相关基因组,包括E2F Targets、G2M Checkpoint、MYC Targets v1和MTORC1信号,以及癌症干性相关基因组、Wntβ-catenin信号。
血液exLRs可能反映不同细胞类型成分:
由于血液EVs来源于多种组织,发明人进一步使用EV-origin表征来自exLR-seq谱的细胞部分的来源贡献。EV-origin是一个从23个造血细胞的血浆exLR基因表达数据中解析细胞起源的软件包。首先,剔除频率<10%(即在整个样本中表达不到10%)的成分,其余21个成分用于后续统计分析。根据基因表达谱估计细胞成分,并分别观察到健康对照组与SCLC组,化疗耐药组与化学敏感组之间的差异。其中,NK、CD8_TE和CD4_TE在SCLC组中显著富集(P<0.01,FC>2),表明SCLC组中的肿瘤免疫反应。同时,与化疗敏感组相比,化疗耐药组中观察到单核细胞略有减少(p=0.033)。此外,生存分析结果显示OS与血小板丰度呈负相关。血小板和Th2较高组患者的PFS较短,而在单核细胞和CD4_TE富集的患者中观察到较长的PFS。因此,这些成分应该在SCLC预后预测中发挥作用。
差异表达的长链RNA候选基因的鉴定和模型构建:
上述各组之间的不同exLRs谱意味着exLRs具有作为SCLC分层的生物标志物的潜力。通过综合分析与PFS、OS相关的差异表达的基因,化疗敏感组和化疗耐受组差异表达的基因,SCLC组和健康对照组差异表达的基因,十个exLR标志物(EPCAM、CCNE2、CDC6、KRT8、LAMB1、CALB2、STMN1、UCHL1、HOXB7和CDCA7,如表1所示)被选择并用于构建SCLC分类器。10个exLRs的二元逻辑回归分析用于建立预测模型并生成exLR t-signature。样本的预测分数(t-score,称为t分数)也同样可以获得。
表1构建SCLC分类器
exLR t-score(t分数)的预测性能:
根据t值的分布和疗效评估,化疗耐药组患者的t值显著高于化疗敏感组(p=9.268e-09)(图2A)。t-signature可区分SCLC组,其接受者操作特征曲线(AUC)下面积为0.9091(95% CI:0.837-0.9811)(图4B)。这些结果表明,发明人成功地在SCLC组患者中开发了基于EV的治疗前疗效预测模型。
发明人还对57例SCLC患者进行了Kaplan-Meier Plotte生存分析。发明人以t分数的中位值为界,将患者分为高分组(bi-pred.res=1)和低分组(bi-pred.res=0)。高分组患者的预后明显差于低分组(p值<0.0001)(图2C)。同样,高分组患者的无进展生存期较差(p=0.00012)(图2D)。
为了从其他角度验证t-signature的可靠性,发明人通过多变量Cox回归分析方法来探索分析PFS(t分数、年龄、性别、吸烟史、癌症家族史和分期)。Cox分析中的t分数具有统计学意义(图2E),且显著性最高,风险比为2.74,表明t分数是独立于其他临床病理变量的重要预测因子。
基线和2疗程化疗后17组配对样本的t-score分析:
血浆exLR的一个主要优点是易于获得纵向样本以监测肿瘤进展。为了研究治疗前后t-score变化是否可用于预测治疗疗效,发明人分析了17对基线样本和2疗程化疗后的t-score。化疗敏感组化疗2疗程后70%样本(7/10)的t值上调,化疗耐药组化疗2疗程后85.7%样本(6/7)的t值下调(图3A-B)。进一步分析显示,化疗敏感组的t-score差异的中位数高于化疗耐药组(p=0.02499),这可能反映预后(图3C)。发明人以t-score差异的中位数为界,将患者分为高值组和低值组。高值组的PFS和OS均长于低值组(p=0.0012;p=0.031)(图3D-E)。
exLR t-signature的潜在诊断价值:
由于与健康对照组相比,SCLC组中富集了10个exLRs,发明人进一步探讨了exLRt-signature的诊断价值。提取健康对照组和NSCLC组中这10个exLRs的表达谱数据,计算t值。然后,发明人应用ROC曲线分析来评估其的诊断价值。
与健康对照组相比,SCLC组的t-score显著更高(p<2.2e-16)(图4A)。SCLC组的AUC为0.9643(95% CI:0.9256-1),敏感性和特异性分别为91.23%、98.30%(图4B)。诊断准确率为94.83%(95% CI:89.08%-98.08%)。
将t-signature进一步应用于NSCLC组。如图4C所示,SCLC组的t-score也显著高于NSCLC组(p=3.675e-06)。t-signature可将SCLC患者与NSCLC患者区分开来,AUC为0.721(95% CI:0.6384-0.8036)(图4D)。诊断准确率为72.67%(95% CI:65.10%-79.39%),敏感性为63.15%,特异性为77.88%。总之,t-signature对SCLC具有很高的诊断价值。
实施例6基于血浆外泌体长链RNAs的诊断及疗效预测模型的应用
利用上述标志物进行小细胞肺癌诊断、疗效预测的模型的应用如本实施例所述,具体包括如下步骤:
6.1收集血浆样本
收集体检患者于体检时或SCLC患者于基线(第一次化疗前)、化疗2疗程之后(42d)的血浆样本,方法如实施例2.1所描述。
6.2分离EVs
参照实施例2.2所描述的方法进行EVs的分离和浓缩。
6.3RNA测序(RNA-seq)分析
参照实施例3和4的方法进行RNA测序和分析。
RNA-seq原始读取计数被转换为TPM值以缩放所有可比较的变量并在所有样本中标准化。
6.3计算t分数(t-score)
根据十个exLR标志物(EPCAM、CCNE2、CDC6、KRT8、LAMB1、CALB2、STMN1、UCHL1、HOXB7和CDCA7)所构建的SCLC分类器,计算样本的预测分数(t-score,称为t分数)。由图4B可知,十个exLR标志物用于区分SCLC和非SCLC的AUC下面积达到0.9643,表明十个exLR可区分SCLC患者和非SCLC,且具有较好的准确性。进一步地根据ROC曲线的坐标计算约登指数(约登指数=灵敏度+特异度-1),约登指数最大时对应的t-score为区分SCLC和非SCLC的最佳截断值,采用约登指数计算的临界值t-score为0.0209。
由图2B可知,十个exLR标志物用于区分患者化疗敏感和化疗耐药的AUC下面积达到0.9091,进一步地根据ROC曲线的坐标计算约登指数(约登指数=灵敏度+特异度-1),约登指数最大时对应的t-score为区分化疗敏感和化疗耐药的最佳截断值,采用约登指数计算的临界值t-score为0.4238。
6.4根据t分数预测SCLC/非SCLC
若样本的t分数大于等于0.0209,则预测患者为SCLC;
若样本的t分数小于0.0209,则预测患者为非SCLC。
6.5根据t分数预测SCLC患者化疗敏感/化疗耐药
若样本的t分数大于等于0.4238,则预测患者为化疗耐药;
若样本的t分数小于0.4238,则预测患者为化疗敏感。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点,对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这中叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 外泌体RNA在RTK抑制剂治疗晚期非小细胞肺癌疗效评估中的应用
- 血浆中长链非编码RNA MALAT1、HIF1A-AS1和XIST在非小细胞肺癌早期诊断试剂盒中的应用
