特利加压素组合物及其用途
文献发布时间:2023-06-19 11:26:00
相关申请的交叉引用
本申请要求2018年6月15日提交的美国临时申请62/685,447的优先权权益,将其全部内容通过引用并入本文。
技术领域
本文描述了包含特利加压素(terlipressin)的稳定的药物组合物,以及使用它们的治疗方法。
背景技术
肝硬化是肝脏的慢性障碍,其中瘢痕组织代替了正常肝脏。当流到肾脏的血液不足时,肝硬化患者会发展肾脏疾病,称为肝肾综合征。特利加压素是通过收缩血管来增加到肾脏的血流的一种药物,已经显示可帮助患有肝肾综合征的人。
特利加压素,也称为三甘氨酰赖氨酸后叶加压素,是一种合成肽。它是血管加压素的类似物,血管加压素是一种内源血管活性激素。在美国之外的许多国家,已经批准特利加压素用于治疗肝硬化的危及生命的并发症,包括肝肾综合征(HRS)和食道出血(EVB)。特利加压素的结构式如下:
它还可以表示为如下:
由于特利加压素的短半衰期,它的应用受限于医院环境中。
发明内容
一方面,本文提供药物组合物,所述药物组合物包含特利加压素或其药学上可接受的盐、按提供组合物中5mM或更少的总缓冲液浓度的量的一价有机缓冲盐、任选地等渗剂、和水。所述组合物可以具有从约4.5至约6的pH。在一些实施例中,所述组合物具有从约4.5至约5.5的pH。
在一些实施例中,所述等渗剂是或包含甘露醇。在一些实施例中,所述等渗剂是或包括选自以下中的一种或多种的盐:硫酸钾(K
在一些实施例中,所述缓冲盐是选自乙酸盐缓冲盐和苯甲酸盐缓冲盐中的一种或多种。在一些实施例中,乙酸盐缓冲盐选自以下中的一种或多种:乙酸钠、乙酸铵、和乙酸钾。在一些实施例中,乙酸盐缓冲盐是乙酸钠。在一些实施例中,缓冲盐按以下量存在,所述量提供范围从约0.1mM至约5mM的总缓冲液浓度。
在一些实施例中,药物组合物包含按以下量的特利加压素或其药学上可接受的盐,所述量提供从约0.1mg/mL至约5mg/mL特利加压素游离碱。在一些实施例中,药物组合物包含按以下量的特利加压素乙酸盐,所述量提供从约0.1mg/mL至约5mg/mL特利加压素游离碱。
在一些实施例中,药物组合物包含以下或基本上由以下组成:按提供从约0.1mg/mL至约5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供范围从约0.1mM至约5mM的总乙酸盐浓度的量的乙酸钠、任选地按范围从约1mg/mL至约10mg/mL的浓度的氯化钠、和水。
在一些实施例中,药物组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供2mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供3mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供4mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,其中所述组合物具有约4.8±0.3的pH。
在一些实施例中,药物组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供2mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供3mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供4mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。在一些实施例中,药物组合物包含按提供5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,其中所述组合物具有约4.8±0.3的pH。
根据任何实施例,在室温下,药物组合物可以稳定至少1年。在一些实施例中,在储存在25℃和60%相对湿度下至少一年的时段后,基于特利加压素的总重量,组合物中的总杂质含量小于约1.9%w/w。在一些实施例中,所述时段选自一年、18个月、24个月、和36个月。在一些实施例中,所述时段是12个月。
另一方面,本文提供一种治疗方法,所述方法包括施用本文描述的药物特利加压素组合物中的任一种至有需要的受试者。在一些实施例中,所述方法用于治疗食道出血(EVB)。在一些实施例中,所述方法用于治疗肝肾综合征(HRS)。在一些实施例中,所述方法用于治疗急性肾损伤。在一些实施例中,施用是通过静脉注射。
另一方面,本文提供本文描述的药物特利加压素组合物,用于治疗选自以下的病症:食道出血(EVB)、肝肾综合征、和急性肾损伤。
另一方面,本文提供特利加压素或其药学上可接受的盐在制备药剂中的用途,所述药剂用于治疗食道出血(EVB)、肝肾综合征、或急性肾损伤,其中所述药剂包含本文描述的药物特利加压素组合物中的任一种。
另一方面,本文提供药物组合物,所述药物组合物包含特利加压素或其药学上可接受的盐、至少一种缓冲盐、以及从选自以下中的一种或多种中选择的至少一种盐:硫酸钾(K
附图说明
图1是配制品A和对比配制品在25℃储存26周的杂质总和的图形描述。
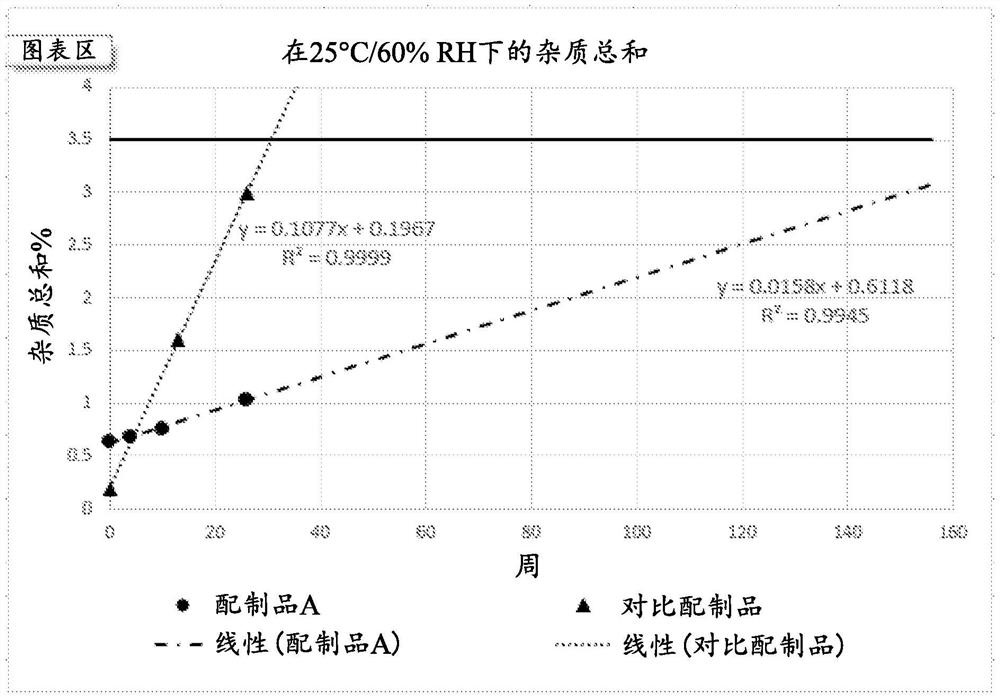
图2是对于配制品1和对比配制品储存在25℃/60%RH而言的杂质总和的图形描述。
图3是对于配制品1和对比配制品储存在30℃/75%RH而言的杂质总和的图形描述。
图4显示了本文描述的特利加压素和具体特利加压素相关杂质的色谱图。
图5是配制品7A和配制品14A(参考配制品)在25℃/60%RH的杂质数据总和的外推的图形描述。
图6是配制品7A和配制品14A(参考配制品)在30℃/75%RH的杂质数据总和的外推的图形描述。
图7是配制品7A在25℃/60%RH和30℃/75%RH的desGly1Gly2数据的外推的图形描述。
具体实施方式
本披露提供药学上可接受的特利加压素组合物,所述组合物包含特利加压素或其药学上可接受的盐、缓冲盐(例如一价有机缓冲盐(例如乙酸盐缓冲盐或苯甲酸盐缓冲盐)、任选地等渗剂(例如甘露醇或选自以下中的一种或多种的盐:硫酸钾(K
本文描述的组合物表现出针对杂质形成的良好稳定性。在一些实施例中,在室温下,组合物稳定至少一年。在一些实施例中,与商业配制品
定义
除非另有定义,否则本文所用的技术和科学术语具有本披露所属的药物配制品领域中的普通技术人员通常所理解的含义。本文参考了本领域普通技术人员已知的各种方法。本领域普通技术人员已知的适合的材料和/或方法可用于实施本披露。然而,描述了特定的材料和方法。除非另有说明,否则在以下说明书和实例中参考的材料、试剂等可从商业来源获得。
如本文所使用的,单数形式“一个或一种(a/an)”和“该/这些(the)”既表示单数也表示复数,除非明确指出仅表示单数。
如本文所使用的,术语“约”意指将如本领域中普通技术人员所理解的,取决于所使用数字或范围的上下文,该数字或范围不限于所阐述的确切数字或范围,而是涵盖所列举的数字或范围附近的值。除非从本领域的上下文或惯例中另外显而易见,否则“约”是指特定术语的正或负10%。
如本文所使用的术语“药学上可接受的盐”是指参考化合物的药学上可接受的有机盐或无机盐。示例性盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、丁二酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖质酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲烷磺酸盐(methanesulfonate)“甲磺酸盐(mesylate)”、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、双羟萘酸盐(即1,1’-亚甲基-双-(2-羟基-3-萘甲酸盐))、碱金属(例如钠和钾)盐、碱土金属(例如镁)盐、和铵盐。在一些实施例中,特利加压素的药学上可接受的盐是乙酸盐。
如本文所使用的,“受试者”表示任何哺乳动物(包括人)。例如,受试者可能患有如下病症或处于发展如下病症的风险中,所述病症可以被诊断,用特利加压素治疗或预防,或者可能正在服用特利加压素用于其他目的。
如本文所使用的,术语“施用(administer、administration或administering)”是指例如,由健康专业人士或其授权的代理人或在其指导下提供、给予、给药和/或开处方;和例如,由健康专业人士或受试者投入、服用或消耗。
如本文所使用的,术语“治疗(treat、treating或treatment)”包括缓解、减轻或改善疾病或病症或其一种或多种症状,无论该疾病或病症是否被认为是“治愈的”或“痊愈的”,以及是否所有症状均已消除。术语还包括减少或预防疾病或病症或其一种或多种症状的进展,阻碍或预防疾病或病症或其一种或多种症状的潜在机制,以及获得任何治疗和/或预防益处。
如本文所使用的,短语“治疗有效量”是指在需要这种治疗的受试者中施用药物时提供特定药理作用的剂量。要强调的是,即使本领域技术人员认为这种剂量是治疗有效量,治疗有效量也不总是有效地治疗本文所述的病症。仅出于方便,以下参考成人受试者提供示例性剂量和治疗有效量。本领域技术人员可以根据治疗特定受试者和/或病症/疾病所需的标准实践来调节此类量。
术语“包含”、“包括”、“含有”等应被广义地解读且是非限制性的。另外,短语“基本上由……组成”将被理解为包括具体陈述的那些要素和并不实质上影响所要求的发明的基本的和新颖的特征的另外要素,例如,并不实质上影响组合物的稳定性或并不促进杂质形成的成分。例如,“基本上由……组成”排除了按实质上影响组合物的稳定性的量存在的柠檬酸盐或丁二酸盐缓冲液。短语“基本上由……组成”排除了任何未指定的元素。
特利加压素
如以上所指出,本文描述的组合物包含特利加压素或其药学上可接受的盐,例如乙酸盐。特利加压素也称为N-[N-(N-甘氨酰基甘氨酰基)甘氨酰基]-8-L-赖氨酸加压素,并且具有分子式C
组合物可以包含按以下量的特利加压素或其药学上可接受的盐,所述量提供从约0.01mg/mL至约10mg/mL特利加压素游离碱,包括从约0.1mg/mL至约5mg/mL特利加压素游离碱,例如从0.1mg/mL至5mg/mL,例如约0.01mg/mL、约0.05mg/mL、约0.1mg/mL、约0.2mg/mL、约0.3mg/mL、约0.4mg/mL、约0.5mg/mL、约0.6mg/mL、约0.7mg/mL、约0.8mg/mL、约0.9mg/mL、约1.0mg/mL、约2.0mg/mL、约3.0mg/mL、约4.0mg/mL、约5mg/mL、约6mg/mL、约7mg/mL、约8mg/mL、约9mg/mL、或约10mg/mL,包括0.01mg/mL、0.05mg/mL、0.1mg/mL、0.2mg/mL、0.3mg/mL、0.4mg/mL、0.5mg/mL、0.6mg/mL、0.7mg/mL、0.8mg/mL、0.9mg/mL、1.0mg/mL、2.0mg/mL、3.0mg/mL、4.0mg/mL、5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、或10mg/mL。组合物可以包含按提供约0.1mg/mL特利加压素游离碱的量(包括按提供0.1mg/mL特利加压素游离碱的量)的特利加压素或其药学上可接受的盐,
在一些实施例中,组合物包含按以下量的特利加压素乙酸盐,所述量提供从约0.01mg/mL至约10mg/mL特利加压素游离碱,包括从约0.1mg/mL至约5mg/mL特利加压素游离碱,例如从0.1mg/mL至5mg/mL,例如约0.01mg/mL、约0.05mg/mL、约0.1mg/mL、约0.2mg/mL、约0.3mg/mL、约0.4mg/mL、约0.5mg/mL、约0.6mg/mL、约0.7mg/mL、约0.8mg/mL、约0.9mg/mL、约1.0mg/mL、约2.0mg/mL、约3.0mg/mL、约4.0mg/mL、约5mg/mL、约6mg/mL、约7mg/mL、约8mg/mL、约9mg/mL、或约10mg/mL,包括0.01mg/mL、0.05mg/mL、0.1mg/mL、0.2mg/mL、0.3mg/mL、0.4mg/mL、0.5mg/mL、0.6mg/mL、0.7mg/mL、0.8mg/mL、0.9mg/mL、1.0mg/mL、2.0mg/mL、3.0mg/mL、4.0mg/mL、5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、或10mg/mL。在一些实施例中,组合物包含按提供约0.1mg/mL特利加压素游离碱的量(包括按提供0.1mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。在一些实施例中,组合物包含按提供约1mg/mL特利加压素游离碱的量(包括按提供1mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。在一些实施例中,组合物包含按提供约2mg/mL特利加压素游离碱的量(包括按提供2mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。在一些实施例中,组合物包含按提供约3mg/mL特利加压素游离碱的量(包括按提供3mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。在一些实施例中,组合物包含按提供约4mg/mL特利加压素游离碱的量(包括按提供4mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。在一些实施例中,组合物包含按提供约5mg/mL特利加压素游离碱的量(包括按提供5mg/mL特利加压素游离碱的量)的特利加压素乙酸盐。
pH
在一些实施例中,药学上可接受的特利加压素组合物具有范围从约3至约6的pH,例如约3、约3.5、约3.7、约4、约4.3、约4.5、约4.7、约5、约5.5、或约6的pH。本文描述的组合物可以具有范围从约4.5至约6、或从约4.5至约5的pH,包括从4.5至6的pH、或从4.5至5的pH,例如约4.5、约4.6、约4.7、约4.8、约4.9、约5.0、约5.1、约5.2、约5.3、约5.4、约5.5、约5.6、约5.5、约5.7、约5.8、约5.9、或约6.0的pH,或其间的任何值。非限制性实例还包括4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.5、5.7、5.8、5.9、或6.0的pH。药学上可接受的特利加压素组合物可以具有范围从约4.5至约5的pH,例如约4.5、约4.6、约4.7、约4.8、约4.9、或约5.0的pH。非限制性实例还包括4.5、4.6、4.7、4.8、4.9、或5.0的pH。
缓冲盐
如以上所指出,本文描述的组合物包含缓冲盐,例如药学上可接受的一价有机缓冲盐(例如乙酸盐缓冲盐或苯甲酸盐缓冲盐)。缓冲盐可以按以下量存在,所述量提供组合物中的范围从约0.1mM至约5mM的总缓冲液浓度,包括其间的任何值,例如从约0.1mM至约1mM。在包含特利加压素乙酸盐的组合物中,所述特利加压素乙酸盐将有助于缓冲液浓度。例如,0.12mg/mL特利加压素乙酸盐对应于0.2mM乙酸盐。因此,例如,在包含0.12mg/mL特利加压素乙酸盐(对应于0.10mg/mL特利加压素游离碱)的组合物中,特利加压素乙酸盐将提供0.2mM乙酸盐缓冲液,在包含1.2mg/mL特利加压素乙酸盐(对应于1.0mg/mL特利加压素游离碱)的组合物中,特利加压素乙酸盐将提供2mM乙酸盐缓冲液,在包含2.4mg/mL特利加压素乙酸盐(对应于2.0mg/mL特利加压素游离碱)的组合物中,特利加压素乙酸盐将提供4mM乙酸盐缓冲液等。因此,在包含特利加压素乙酸盐的组合物中,可以调节使用的缓冲盐的量以考虑特利加压素乙酸盐提供的乙酸盐,使得组合物中的总缓冲液浓度(来自缓冲盐和特利加压素乙酸盐)是本文描述的量中的任一个。
在一些实施例中,缓冲盐包括乙酸盐,例如可以由任何药学上可接受的乙酸盐提供。这样一种组合物可以包含按以下量的乙酸盐缓冲盐,所述量提供组合物中的范围从约0.1mM至约5mM总乙酸盐浓度,包括其间的任何值,例如从约0.1mM至约1mM,包括从0.1mM至1mM。作为非限制性实例,组合物可以包含按约1mM、约3mM、或约5mM的浓度的乙酸盐缓冲盐,或按以下量的乙酸盐缓冲盐,所述量提供组合物中的约1mM、约3mM、或约5mM的总乙酸盐浓度。组合物可以包含按以下范围的浓度的乙酸盐缓冲盐,或按提供组合物中的以下总乙酸盐浓度的量的乙酸盐缓冲盐:约0.1mM至约1mM,包括其间的任何值,例如约0.1mM、约0.2mM、约0.3mM、约0.4mM、约0.5mM、约0.6mM、约0.7mM、约0.8mM、约0.9mM、或约1.0mM、约1.1mM、或约1.2mM。适合的乙酸盐浓度的非限制性实例还包括0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、1.0mM、1.1mM、或1.2mM。如以上所指出,包含0.12mg/mL特利加压素乙酸盐的组合物将具有0.2mM的乙酸盐缓冲液浓度,甚至在没有添加另外的乙酸盐缓冲盐(等)的情况下。
在一些实施例中,乙酸盐缓冲盐是乙酸钠、乙酸铵、或乙酸钾。因此,缓冲盐可以是乙酸钠。另外地或可替代地,缓冲盐可以是乙酸铵。另外地或可替代地,缓冲盐可以是乙酸钾。
在一些实施例中,至少一种缓冲盐包括苯甲酸盐,例如可以由任何药学上接受的苯甲酸盐提供。这样一种组合物可以包含按以下范围的浓度的苯甲酸盐缓冲盐,或按提供组合物中的以下总缓冲液浓度的量的苯甲酸盐缓冲盐:约0.1mM至约5mM,包括其间的任何值,例如从约0.1mM至约1mM,包括从0.1mM至1mM。作为非限制性实例,组合物可以包含按约1mM的浓度的苯甲酸盐缓冲盐,或按提供组合物中的约1mM的总缓冲液浓度的量的苯甲酸盐缓冲盐。组合物可以包含按以下范围的浓度的苯甲酸盐缓冲盐,或按提供组合物中的以下总缓冲液浓度的量的苯甲酸盐缓冲盐:约0.1mM至约1mM,包括其间的任何值,例如约0.1mM、约0.2mM、约0.3mM、约0.4mM、约0.5mM、约0.6mM、约0.7mM、约0.8mM、约0.9mM、或约1.0mM、约1.1mM、或约1.2mM。适合的苯甲酸盐缓冲盐浓度或组合物中的总缓冲液浓度的非限制性实例还包括0.1mM、0.2mM、0.3mM、0.4mM、0.5mM、0.6mM、0.7mM、0.8mM、0.9mM、1.0mM、1.1mM、或1.2mM。
在一些实施例中,至少一种缓冲盐是苯甲酸钠。在一些实施例中,组合物包含约1mM的浓度的苯甲酸钠,或提供组合物中的约1mM的总缓冲液浓度的量的苯甲酸钠。
在包含特利加压素乙酸盐的组合物中,可以调节使用的苯甲酸盐缓冲盐的量以考虑特利加压素乙酸盐提供的乙酸盐,使得组合物中的总缓冲液浓度(苯甲酸盐加上乙酸盐)是以上列出的量中的任一个,例如具有约1mM的总乙酸盐加上苯甲酸盐浓度。
等渗剂/盐
如以上所指出,在一些实施例中,本文描述的组合物包含等渗剂,例如选自以下中的一种或多种的盐:硫酸钾(K
在一些实施例中,等渗剂是盐氯化钠。氯化钠可以按有效使组合物等渗的任何量存在。因此,组合物可以包含按以下范围的浓度的氯化钠:从约1mg/mL至约10mL/mL,包括其间的任何量,例如约1mg/mL、约1.5mg/mL、约2.0mg/mL、约2.5mg/mL、约3.0mg/mL、约3.5mg/mL、约4.0mg/mL、约4.5mg/mL、约5.0mg/mL、约5.5mg/mL、约6.0mg/mL、约6.5mg/mL、约7.0mg/mL、约7.5mg/mL、约8.0mg/mL、约8.5mg/mL、约9.0mg/mL、约9.5mg/mL、或约10.0mg/mL。适合的氯化钠浓度的非限制性实例还包括1mg/mL、1.5mg/mL、2.0mg/mL、2.5mg/mL、3.0mg/mL、3.5mg/mL、4.0mg/mL、4.5mg/mL、5.0mg/mL、5.5mg/mL、6.0mg/mL、6.5mg/mL、7.0mg/mL、7.5mg/mL、8.0mg/mL、8.5mg/mL、9.0mg/mL、9.5mg/mL、或10.0mg/mL。
在一些实施例中,等渗剂是甘露醇。甘露醇可以按有效使组合物等渗的任何量存在。因此,组合物可以包含按以下范围的浓度的甘露醇:从约30mg/mL至约70mL/mL,包括其间的任何量,例如约30mg/mL、约35mg/mL、约40mg/mL、约45mg/mL、约50mg/mL、约55mg/mL、约60mg/mL、约65mg/mL、或约70mg/mL。适合的甘露醇浓度的非限制性实例还包括30mg/mL、35mg/mL、40mg/mL、45mg/mL、50mg/mL、55mg/mL、60mg/mL、65mg/mL、或70mg/mL。在具体实施例中,组合物包含按以下浓度的甘露醇:约50mg/mL,例如50mg/mL。
在一些实施例中,组合物包含盐硫酸钠。进一步在一些实施例中,组合物包含按以下范围的浓度的硫酸钠:约0.1mM至约120mM。在一些实施例中,组合物包含按约120mM的浓度的硫酸钠。在一些实施例中,组合物不包括硫酸钠。
组合物
本披露包括特利加压素组合物,所述特利加压素组合物包含任何量的特利加压素或其药学上可接受的盐、任何量的任何一种或多种以上描述的缓冲盐、以及任选地任何量的一种或多种以上描述的等渗剂(例如一种或多种盐和/或甘露醇),处于任何适合的以上描述的pH下。本披露还包括特利加压素组合物,所述特利加压素组合物包含任何量的特利加压素或其药学上可接受的盐、任何量的任何一种或多种以上描述的药学上可接受的一价有机缓冲盐(其提供组合物中的从约0.1mM至约5mM的总缓冲液浓度)、以及任选地任何量的一种或多种以上描述的等渗剂,处于任何适合的以上描述的pH下。以下内容作为具体的示例性实施例进行披露。
在一些实施例中,组合物包含以下:提供从约0.1mg/mL至约5mg/mL特利加压素游离碱的特利加压素乙酸盐、提供范围从约0.1mM至约5mM的总乙酸盐浓度的量的乙酸盐缓冲盐、任选地范围从约1mg/mL至约10mg/mL的浓度的氯化钠、和水,并且具有从4.5至约5.5的pH。
在一些实施例中,组合物基本上由以下组成:按提供从约0.1mg/mL至约5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供范围从约0.1mM至约5mM的总乙酸盐浓度的量的乙酸盐缓冲盐、任选地按范围从约1mg/mL至约10mg/mL的浓度的氯化钠、和水。这样一种组合物并不包括可以实质上影响组合物的稳定性或促进杂质形成的任何另外的成分。在一些实施例中,这样一种组合物不包括柠檬酸盐缓冲盐,并且不包括丁二酸盐缓冲盐。另外地或可替代地,在一些实施例中,这样一种组合物不包括硫酸盐(例如硫酸钠)。
在一些实施例中,组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供2mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供3mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供4mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供2mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供3mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供4mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,组合物包含按提供5mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水。这样一种组合物可以具有4.8±0.3的pH。
在一些实施例中,本文披露的药学上可接受的特利加压素组合物包含特利加压素或其药学上可接受的盐、至少一种选自乙酸钠和苯甲酸钠、和硫酸钠的缓冲盐。
在一些实施例中,本文披露的药学上可接受的特利加压素组合物包含特利加压素或其药学上可接受的盐、乙酸钠、和硫酸钠。
在一些实施例中,本文披露的药学上可接受的特利加压素组合物包含约0.1mg/mL特利加压素或其药学上可接受的盐、约5mM乙酸钠、和约120mM硫酸钠,并且进一步地,其中所述药学上可接受的特利加压素组合物具有约5的pH。
本披露进一步提供基本上由以下组成的药学上可接受的特利加压素组合物:特利加压素或其药学上可接受的盐和至少一种缓冲盐。在一些实施例中,特利加压素组合物基本上由以下组成:特利加压素或其药学上可接受的盐和乙酸钠。在一些实施例中,特利加压素组合物基本上由以下组成:特利加压素或其药学上可接受的盐和苯甲酸钠。而且,进一步在一些实施例中,特利加压素组合物基本上由以下组成:约0.1mg/mL特利加压素或其药学上可接受的盐和约1mM乙酸钠,并且进一步地,其中所述药学上可接受的特利加压素组合物具有约4.6的pH。
稳定性
如以上所指出,本文描述的组合物表现出针对杂质(包括降解产物)形成的良好稳定性。如以下实例1中更详细地描述,本文描述的研究鉴定了两种主要的特利加压素降解途径:(1)酸催化的水解(由低pH加速),形成[Gly
在一些实施例中,与商业
表A
在一些实施例中,当储存在室温(例如在25℃)下时,本文披露的特利加压素组合物稳定至少一年,例如约一年、约18个月、约24个月、约30个月、或约36个月。在一些实施例中,相对于商业配制品
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约3.5%w/w的总杂质含量,包括小于或等于3.5%w/w,包括以下的总杂质含量:约3.5%、约3.4%、约3.3%、约3.2%、约3.1%、约3.0%、约2.9%、约2.8%、约2.7%、约2.6%、约2.5%、约2.4%、约2.3%、约2.2%、约2.1%、约2.0%、约1.9%、约1.8%、约1.7%、约1.6%、约1.5%、约1.4%、约1.5%、约1.4%、约1.3%、约1.2%、约1.1%、约1.0%、约0.9%、约0.8%、约0.7%、约0.6%、约0.5%、约0.4%、约0.3%、约0.2%、或约0.1%。总杂质含量的非限制性实例包括3.5%、3.4%、3.3%、3.2%、3.1%、3.0%、2.9%、2.8%、2.7%、2.6%、2.5%、2.4%、2.3%、2.2%、2.1%、2.0%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、或0.1%。
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.9%w/w的总杂质含量,包括小于或等于1.9w/w,包括以下的总杂质含量:约1.9%、约1.8%、约1.7%、约1.6%、约1.5%、约1.4%、约1.5%、约1.4%、约1.3%、约1.2%、约1.1%、约1.0%、约0.9%、约0.8%、约0.7%、约0.6%、约0.5%、约0.4%、约0.3%、约0.2%、或约0.1%。总杂质含量的非限制性实例包括1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、或0.1%。在一些实施例中,在储存在室温(例如在25℃)下一个时段(例如至少一年)后,基于特利加压素的总重量,组合物中的总杂质含量小于或等于约1.2%w/w,包括小于或等于1.2%w/w。
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约0.1%w/w的desGly
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的desGly
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的desGly
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的[Gly
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的[Asp
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的[Glu
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的[Ac-Gly
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.0%w/w的单独的特利加压素二聚体含量,包括小于或等于1.0%w/w,包括以下的单独的特利加压素二聚体含量:约1.0%、约0.9%、约0.8%、约0.7%、约0.6%、约0.5%、约0.4%、约0.3%、约0.2%、约0.1%、约0.09%、约0.08%、约0.07%、约0.06%、约0.05%、约0.04%、约0.03%、约0.02%、或约0.01%。任何单独的特利加压素二聚体含量的非限制性实例包括1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、或0.01%。在一些实施例中,在储存在室温(例如在25℃)下一个时段(例如至少一年)后,组合物中的任何单独的特利加压素二聚体的含量小于或等于约0.01%w/w,包括小于或等于0.01%w/w。
在一些实施例中,基于特利加压素的总重量,在室温(例如在25℃)下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约0.5%w/w的任何其他单独的杂质含量(例如除了以上披露的那些之外的任何杂质),包括小于或等于0.5w/w,包括以下的任何其他单独的杂质含量:约0.5%、约0.4%、约0.3%、约0.2%、约0.1%、约0.09%、约0.08%、约0.07%、约0.06%、约0.05%、约0.04%、约0.03%、约0.02%、或约0.01%。任何其他单独的杂质含量的非限制性实例包括0.5%、0.4%、0.3%、0.2%、0.1%、0.09%、0.08%、0.07%、0.06%、0.05%、0.04%、0.03%、0.02%、或0.01%。在一些实施例中,在储存在室温(例如在25℃)下一个时段(例如至少一年)后,组合物中的任何其他单独的杂质的含量小于约0.05%w/w,包括小于0.05%w/w。
在一些实施例中,基于特利加压素的总重量,在25℃和60%相对湿度下储存一个时段(例如至少一年)后,本文披露的特利加压素组合物具有小于或等于约1.9%w/w的总杂质含量,包括小于或等于1.9%w/w,包括以下的总杂质含量:约1.9%、约1.8%、约1.7%、约1.6%、约1.5%、约1.4%、约1.5%、约1.4%、约1.3%、约1.2%、约1.1%、约1.0%、约0.9%、约0.8%、约0.7%、约0.6%、约0.5%、约0.4%、约0.3%、约0.2%、或约0.1%。总杂质含量的非限制性实例包括1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、或0.1%。在一些实施例中,在25℃和60%相对湿度下储存一个时段(例如至少一年)后,基于特利加压素的总重量,组合物中的总杂质含量小于或等于约1.2%w/w,包括小于或等于1.2%w/w。在一些实施例中,所述时段选自一年、18个月、24个月、和36个月。在一些实施例中,所述时段是12个月。在一些实施例中,所述时段是24个月。在一些实施例中,所述时段是36个月。
在一些实施例中,本文披露的特利加压素组合物在储存在室温(例如在25℃或30℃)下一个时段(例如约1个月、约3个月、约6个月、约9个月、约12个月、约18个月、或约2年)时,相对于特利加压素的总重量,按重量计,所述特利加压素组合物中形成的总杂质小于约3.5%。在一些实施例中,本文披露的特利加压素组合物在储存在室温(例如在25℃或30℃)下一个时段(例如约1个月、约3个月、约6个月、约9个月、约12个月、约18个月、或约2年)时,相对于特利加压素的总重量,按重量计,所述特利加压素组合物中形成的总杂质小于约1.9%。
在一些实施例中,组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供1.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供2.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供3.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供4.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供5.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、按约9mg/mL的浓度的氯化钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供0.1mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供1.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供2.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供3.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供4.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
在一些实施例中,组合物包含按提供5.0mg/mL特利加压素游离碱的量的特利加压素乙酸盐、按提供约1mM的总乙酸盐浓度的量的乙酸钠、和水,并且在室温(例如在25℃)下储存至少一年的一个时段后,具有小于或等于约1.9%w/w的总杂质含量。另外地或可替代地,在室温(例如在25℃)下储存至少一年的一个时段后,这样一种组合物可以具有小于或等于约0.1%w/w的desGly
方法/用途
本披露还提供治疗方法,所述方法包括施用如本文描述的药学上可接受的特利加压素组合物至有需要的受试者,例如用于治疗患有肝硬化的受试者,和/或治疗肝肾综合征(HRS)、急性肾损伤、和/或食道出血(EVB)。在一些实施例中,所述方法用于治疗肝肾综合征(HRS)。在一些实施例中,所述方法用于治疗急性肾损伤。在一些实施例中,所述方法用于治疗食道出血(EVB)或食出血性食管曲张。在一些实施例中,施用是通过静脉注射。
本披露还提供任何本文披露的组合物,用于治疗选自以下的病症:肝肾综合征(HRS)、食道出血(EVB)、和/或急性肾损伤。此类组合物可以包含1mg/mL、2mg/mL、3mg/mL、或4mg/mL特利加压素或其药学上可接受的盐。
本披露还提供特利加压素或其药学上可接受的盐在制备药剂中的用途,所述药剂用于治疗肝肾综合征(HRS)、食道出血(EVB)、和/或急性肾损伤,其中所述药剂包含本文描述的特利加压素组合物中的任一种。此类用途包括使用更高剂量的特利加压素或其药学上可接受的盐,其中所述更高剂量可以是1mg/mL、2mg/mL、3mg/mL、或4mg/mL特利加压素或其药学上可接受的盐。
实例
包括以下具体实例作为本文所述组合物的说明。这些实例绝不旨在限制本披露的范围。对于本披露所属领域的技术人员而言,本披露的其他方面将是显而易见的。
实例1
根据析因设计,制备如以下所示的含有0.1mg/mL的特利加压素的配制品,所述配制品具有不同pH、缓冲液量、和缓冲盐,并且将所述配制品储存在25℃/60%RH下6个月。使用超高效液相色谱(UPLC)方法确定特利加压素和杂质的量。
表1.
在研究结束时,发现柠檬酸盐和丁二酸盐与特利加压素反应并且导致高杂质水平。基于此研究,对于特利加压素而言,证实乙酸盐是适合的缓冲盐。
从此研究可知特利加压素存在两种主要的降解途径:
1.酸催化的水解(由低pH加速),形成[Gly
2.通过末端甘氨酸残基的带正电荷的氨基基团的二酮哌嗪闭环(由高pH加速),形成desGly1Gly2-特利加压素。
可以通过调节pH至约pH 5,控制酸催化的水解通路(1)。二酮哌嗪通路(2)会更难控制,因为反应途径是“内置”在分子中的。此外,提高pH来控制降解通路(1)会加速降解通路(2)。降低缓冲液浓度会导致更低量的desGly
实例2
制备三种0.1mg/mL特利加压素配制品:
1. 5mM乙酸盐缓冲液,pH 5.0;
2. 5mM乙酸盐缓冲液,pH 5.0+0.12M硫酸钠;以及
3.零缓冲液,以及0.12M硫酸铵,调节至pH 5.0。
将配制品放置在50℃下,并且在储存0、1、2、4和8天后,分析desGly
-desGly
表2.
此研究显示,添加硫酸根离子减少了二酮哌嗪反应(即,配制品2和3相比于配制品1)。虽然配制品3不含任何缓冲液(对于pH稳定性而言,这可能是个问题),但是在8天的储存结束时,形成的desGly
实例3
将以下两种配制品在25℃/65%RH下储存26周。
-0.1mg/mL的特利加压素、20mM的乙酸盐缓冲液、pH3.7和氯化钠(对比配制品);以及
-0.1mg/mL的特利加压素、0.12M硫酸钠、并且pH 5.0(配制品A)
图1中的结果显示,与对比配制品相比,含有硫酸钠的配制品A具有更低杂质。数据的外推表明,当储存在25℃/65%RH下156周(3年)时,配制品A将可能具有低于3.5%的杂质。两条曲线的斜率表明,与配制品A相比,在对比配制品中,降解速率是高约7倍(0.1077/0.0158)。
实例4
根据析因设计,制备特利加压素配制品,参见下表:
表3.
还将如实例3中描述的对比配制品包括在此研究中,用于进行比较。
在25℃/60%RH和30℃/75%RH下储存这些配制品3个月,并且结果显示,最稳定的配制品是具有最低pH、最低量的乙酸盐缓冲液、并且没有硫酸钠的配制品,本文称为配制品1。图2和图3显示,在25℃/60%RH(图2)和30℃/75%RH(图3)两者下,与对比配制品相比,配制品1的杂质总和。
两条曲线的斜率表明,在25℃/60%RH和30℃/75%RH两者下,在对比配制品中的降解速率与配制品1相比是约7倍更高,分别是(0.1398/0.0180)和(0.2598/0.0348)。
此研究显示,降低乙酸盐含量可以改善特利加压素组合物的总稳定性。在5mM和9mM的乙酸盐浓度下,硫酸盐的稳定效应更加明显,但是在1mM的低乙酸盐浓度下,硫酸盐的稳定效应几乎不存在。
实例5
此实例描述了在特利加压素配制品筛选研究中获得的稳定性结果。此实例含有在25℃和30℃下长达12个月的时间点的结果并且将持续长达3年。此研究的目的是,研究在具有2个中心点(CP)的2
pH: 4.6-5.4
硫酸钠: 0-80mM
乙酸钠: 1-9mM
用于本研究的参考配制品对应于商业特利加压素配制品
表4.
储存条件
配制品筛选样品储存在:
25℃/60%R.H下两年(可以进一步延长至3年);取样间隔在0个月、1个月、3个月、6个月、9个月、12个月、18个月、和24个月
30℃/75%R.H下长达两年(可以进一步延长至3年);0个月、1个月、3个月、6个月、9个月、12个月、18个月、和24个月
将小瓶竖直储存,从而避免配制品和橡皮塞之间的接触。
下表中提供用于测定配制品的稳定性的验收标准。根据欧洲药典,药用物质,表2034.-2(European Pharmacopeia,Substances for Pharmaceutical Use,Table 2034.-2),将每种杂质的极限最初设置在针对合成的肽中的杂质的合格极限。根据欧洲药典,针对单独的未鉴定杂质的极限对应于鉴定极限。
表7.
*杂质的极限,根据欧洲药典,药用物质,表2034.-2
将以下反相UPLC方法用于测定特利加压素溶液(0.1mg/mL)中的特利加压素含量和杂质。在60℃下,在具有梯度洗脱的C18柱(henomenex Luna Omega C
表B
图4显示了本文描述的特利加压素和具体特利加压素相关杂质的色谱图。针对外部一点校准曲线,确定特利加压素含量,并且将杂质评估为总峰面积的面积%。具有<0.05%的相对峰面积的峰并未报道或包括在杂质总和内。
结果
来自30℃/75%RH下12个月时间点的数据进入MINITAB软件(Minitab,LLC公司,州立学院(State College),宾夕法尼亚州)。评估显示,两个稳定性限制性参数是杂质总和以及desGly1Gly2杂质的量。选择这两个参数,用于进一步图4所示进行评估。在25℃/60%RH下的数据的统计评估非常类似并且本文并未显示。
从统计分析,预测最稳定的配制品是具有最低pH(4.6)、最低量的乙酸盐缓冲液(1mM)和最低量的硫酸钠(0mM)的配制品。发现硫酸钠对于desGly1Gly2-杂质的形成具有正面影响,但是对于杂质总和具有负面影响。
下表总结了分别在25℃/60%R.H和30℃/75%R.H下,对于测试的配制品而言,在长达12个月的时间点时,获得的杂质总和。
表8.
表9.
12个月后的结果显示,与参考配制品相比,已经实现了室温下稳定性方面的大改善。以上所示稳定性数据表明,本研究的最稳定的配制品是配制品7A,它不含硫酸钠、含有1mM乙酸盐缓冲液且具有pH 4.6。
下表总结了对于配制品7A,在长达12个月的时间时,获得的稳定性数据。
表10.
NA=未分析
ND=未检出
X=时间点未达到
表11.
NA=未分析
ND=未检出
X=时间点未达到
稳定性数据的外推
图5和6显示在25℃/60%RH和30℃/75%RH下,配制品7A和配制品14A(参考配制品)的杂质数据总和的外推。外推预测配制品7A将保留在规格(≤3.5%杂质)内,对于25℃/60%RH下36个月,具有良好的裕度。可以注意到,在25℃/60%RH下约5个月后,参考配制品(配制品14A)已经超出了规格极限。
尽管温度方面的差异很小,但是在30℃/75%RH下的数据非常不同。在30℃下,预测配制品7A在约24个月后超出杂质总和的规格,完全没有任何裕度。这表明,在建议的规格情况下配制品7A对于气候区III/IV而言最有可能不是适合的配制品。
然而,在两种温度下,与现有产品相比,稳定性方面的改善都是显著的。通过除以现有产品和配制品7A的回归线的斜率,可以评估以下改善倍数:
25℃/60%RH:0.5996/0.0701=8.6倍改善
30℃/75%RH:1.1015/0.1351=8.2倍改善
第二潜在稳定性限制性参数是desGly1Gly2的量,它是二酮哌嗪反应的结果。图7显示在25℃/60%RH和30℃/75%RH下配制品7A的desGly1Gly2数据的外推。外推预测配制品7A将保留在规格(≤1.0%)内,对于25℃/60%RH下36个月,具有良好的裕度。在30℃/75%RH下,预测配制品7A在约23个月后超出杂质总和的规格。
实例6
此实例描述了在按与实例5中描述类似的方式进行的特利加压素配制品筛选研究中获得的稳定性结果。
下表显示,在此实例中测试的配制品的组成,以及对应的在40℃下储存1和3个月后获得的杂质的总和。
表12.
*作为特利加压素乙酸盐提供的特利加压素
*添加作为乙酸钠的乙酸盐总浓度包括由特利加压素乙酸盐贡献的量
结果显示,更低乙酸盐浓度与改善的稳定性相关。例如,配制品7B和8B是相同的,除了配制品8B具有更少乙酸盐并且更稳定。结果还显示,包括NaCl改善了稳定性。例如,配制品4B和8B是相同的,除了配制品8B具有NaCl并且更稳定。
- 特利加压素组合物及其用途
- 一种具有贮存功能的特利加压素粉针组合物注射装置
