用于检测HLA-B*58:01等位基因的引物组、探针、微流控芯片、检测方法及系统
文献发布时间:2023-06-19 11:40:48
技术领域
本发明涉及一种HLA-B*58:01等位基因的检测方法,尤其涉及一种用于检测HLA-B*58:01等位基因的引物组、探针、试剂盒及检测方法,以及一种微流控芯片、便携式控制装置及HLA-B*58:01等位基因检测系统,属于基因检测技术领域。
背景技术
别嘌醇是有效治疗高尿酸血症和痛风的一线药物,其价格低廉,降尿酸效果好,而且多项研究表明别嘌醇还具有抗氧化应激及改善内皮细胞功能,对全身多系统器官具有保护作用,是肾功能不全或排尿酸治疗无效患者的最佳选择,具有不可替代性。别嘌呤醇有引发超敏反应的风险,研究证实别嘌呤醇相关的严重超敏反应与HLA-B*58:01密切相关,亚裔人群的阳性率明显高于白人,故而发生超敏反应的险更大。Hung等人(PNAS,102(11)4134-4139(2015))对台湾地区发生的51例别嘌呤醇所致严重皮肤不良反应的患者和228例别嘌呤醇耐受者的研究中,发现与重症药疹呈强相关的SNP位点都位于MHC基因上,集中在HLA-A,B,C和DRB1基因座,尤其是HLA-B*58:01等位基因。HLA-B*58:01在服用别嘌呤醇后出现严重皮肤不良反应的患者中100%存在,而在未出现皮肤不良反应的患者(耐受人群)和正常对照组中,其携带率仅为15%和20%。在服用别嘌呤醇之前进行HLA-B*58:01等位基因检测,以判断是否属有关高危人群,对指导临床安全用药具有重要意义。因此,2008年我国台湾地区已经对于准备使用别嘌呤醇的患者实施该基因的检测,对于结果阳性的患者禁止使用,2012年美国风湿病学会(ACR)建议:亚裔人群在使用别嘌呤醇前,应该进行HLA-B*58:01检测,2013年中华医学会内分泌学会《高尿酸血症和痛风治疗中国专家共识》也推荐进行HLA-B*58:01检测。
HLA-B*58:01鉴定的“金标准”是国际组织相容性工作组(InternationalHistocompatibility Working Group,IHWG)所公布的碱基序列测序分析方法HLA-SBT,通过测序直接获得的核酸序列以鉴定多态性。但由于HLA系统的高度多态性和复杂性,以及引物设计等因素,测序结果会出现套峰,判读较为复杂。而且,HLA-SBT需要用到造价昂贵的测序仪,且测序样品制备对操作人员的要求较高,使得这一方法在医院常规展开比较困难。另一类方法是采用序列特异性引物PCR(PCR-SSP)进行HLA等位基因型筛查,如瑞士Olerup公司的SSP HLA试剂盒用二十多对引物分别扩增后用琼脂糖凝胶电泳分离进行基因型鉴定,耗时长,易污染,且操作极其繁琐。而且试剂盒针对欧美人群设计,一些欧美人群中常见的HLA等位基因在中国人群中并未出现。因此这类试剂盒不适合在国内医院临床应用。为解决在中国人群中对HLA-B*58:01快速检测的临床需求,台湾世基和苏州旷远分别开发了基于荧光定量PCR的试剂盒并已经CFDA认证。
但总体而言,现有技术检测HLA-B*58:01等位基因,依然存在仪器设备价格昂贵、对实验室环境要求严苛以及对操作人员技能的要求高,周期长、低效率等不足。
微流控技术是指将化学和生物等研究领域中所涉及到样品预处理,化学和生物反应以及分离和检测等基本功能单元通过微/纳加工技术集成到一个几平方厘米或者更小的芯片或者器件上。它可以完成目前只有在常规化学或者生物实验室中依赖于大型仪器设备才能完成的才可完成的诸如样品制备、生化反应、结果检测和分析等一系列复杂工作,因此也被为芯片实验室(Lab on a Chip)。利用微流控技术将HLA-B*58:01检测过程中的样品处理、基因组核酸抽提和核酸扩增集成在一块微流控芯片上,实现“从样品到结果”全自动分析。
重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)是英国TwistDxInc公司开发的恒温核酸扩增技术,被认为是可以替代PCR的核酸检测技术。RPA技术主要依赖于三种酶:能结合单链核酸(寡核苷酸引物)的重组酶、单链DNA结合蛋白(SSB)和链置换DNA聚合酶。RPA反应体系的三种酶的混合物在常温下也有活性,其最适扩增温度在37℃-42℃之间,无需热变性,与PCR相比不需要实现在两个或三个温度之间循环和相应的温控设备,在37℃-42℃之间,甚至在常温下即可进行。将微流控技术和RPA技术结合,可以大大降低HLA-B*58:01检测项目对仪器设备、实验室环境和操作人员技能的要求,实现便携式的快速检测,使得该检测项目在门诊,甚至患者家中开展成为可能。
发明内容
本发明的主要目的就是针对以上现状,提供一种用于检测HLA-B*58:01等位基因的引物组、探针、试剂盒,以克服现有技术中的不足。
本发明的另一主要目的在于提供一种微流控芯片。
本发明的另一主要目的在于提供一种HLA-B*58:01等位基因的检测方法、便携式控制装置及HLA-B*58:01等位基因检测系统。
为实现前述发明目的,本发明采用的技术方案包括:
本发明实施例提供了一种用于检测HLA-B*58:01等位基因的引物组,其包括:
第一引物对,其包括第一正向引物和反向引物;
第二引物对,其包括第二正向引物和反向引物;
第三引物对,其包括第三正向引物和反向引物;
其中,所述第一正向引物、第二正向引物、第三正向引物的序列分别如SEQ IDNO.1、SEQ ID NO.2和SEQ ID NO.3所示,所述反向引物的序列如SEQ ID NO.4所示。
本发明实施例还提供了一种用于检测HLA-B*58:01等位基因的探针,它的序列如SEQ ID NO.5所示。
本发明实施例还提供了一种用于检测HLA-B*58:01等位基因的试剂盒,其包括:至少一引物组和至少一探针,其中一引物组为前述的引物组,一探针组为前述的探针。
本发明实施例还提供了一种微流控芯片,其包括沿设定方向依次设置的盖片层、基片层及控制层;
其中,所述基片层包括相互连通的核酸提取腔室、混合腔室、反应腔室、至少用于连通各腔室的微流道以及设置于各腔室之间的控制阀,所述核酸提取腔室至少用以提取待检测样本中的核酸,所述混合腔室至少用以存储RPA冻干试剂,并使所述RPA冻干试剂与提取的核酸混合,所述反应腔室至少用以存储用于检测HLA-B*58:01等位基因的引物组、探针并与混合腔室内的RPA冻干试剂与提取的核酸进行等温扩增反应;
所述控制层包括第一控制单元、第二控制单元及第三控制单元,所述第一控制单元设置于所述核酸提取腔室上方,至少用以提供驱动液体在各腔室间流动的压力,所述第二控制单元设置于控制阀上方,至少用以使所述控制阀闭合或打开,所述第三控制单元设置于与所述反应腔室连通的出口上方,至少用以使所述反应腔室内的液体排出。
本发明实施例还提供了一种便携式控制装置,与前述微流控芯片配合使用,其包括液体和流路控制单元、热管理和温度控制单元以及荧光激发和采集单元;
其中,所述液体和流路控制单元包括:
液体驱动组件,其至少用以挤压所述微流控芯片的穹顶压力腔,从而驱使液体的流动;
控制阀控制组件,其至少用以挤压所述第二控制单元,从而使所述控制阀闭合或打开;
所述热管理和温度控制单元包括:
第一加热组件,其至少用以加热,并使所述核酸提取腔室内达到核酸洗脱需要的温度;
第二加热组件,其至少用以加热,并使所述反应腔室内达到RPA反应所需的温度;
所述荧光激发和采集单元包括荧光激发组件和荧光图象采集组件。
本发明实施例还提供了一种HLA-B*58:01等位基因的检测系统,其包括:
前述用于检测HLA-B*58:01等位基因的试剂盒;
RPA反应体系;
前述微流控芯片;以及,
前述便携式控制装置。
本发明实施例还提供了前述用于检测HLA-B*58:01等位基因的引物组、探针、试剂盒于制备检测HLA-B*58:01等位基因的产品中的用途。
进一步地,应用所述产品检测HLA-B*58:01等位基因的方法主要基于前述HLA-B*58:01等位基因的检测系统而实施,并且所述检测方法包括:
将待检测样本置于所述微流控芯片的核酸提取腔室内,RPA冻干试剂置于混合腔室内,用于检测HLA-B*58:01等位基因的试剂盒置于反应腔室内;
采用便携式控制装置的第一加热组件进行加热,使所述核酸提取腔室内升温,并对所述待检测样本进行洗脱,得到提取的核酸;
采用便携式控制装置的液体驱动组件挤压所述微流控芯片的穹顶压力腔,同时打开第一控制阀,从而驱使核酸进入混合腔室内与RPA冻干试剂混合;
使所述液体驱动组件继续挤压所述微流控芯片的穹顶压力腔,同时打开第二控制阀,从而驱使核酸、RPA冻干试剂进入反应腔室内与用于检测HLA-B*58:01等位基因的引物组、探针混合;
采用便携式控制装置的第二加热组件进行加热,使所述反应腔室内升温进行RPA反应,以及,
采用便携式控制装置的荧光激发和采集单元对RPA反应产物进行检测。
与现有技术相比,本发明的优点包括:
1)本发明提供了一种基于微流控技术实现重组酶聚合酶扩增实时荧光检测的集成式HLA-B*58:01等位基因的检测方法、引物和荧光探针、微流控芯片和便携式检测装置及检测系统,本方法针对临床检测的要求,引入RPA反应内控,保证检测反应的真实性和准确性;
2)本发明从血样、咽拭子或者唾液等样品进行基因组DNA提取纯化后,进行等温核酸扩增,不需要热循环反应,不必在PCR仪中进行扩增,具有灵敏度高、特异性强、反应程序简单、检测时间短等优点,并且本发明检测过程快速、成本低,具有广泛推广价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明一典型实施方案中用于检测HLA-B*58:01等位基因的引物、探针示意图。
图2是本发明一典型实施方案中微流控芯片的结构示意图。
图3是本发明一典型实施方案中微流控芯片及便携式控制装置的结构示意图。
图4a-图4e是本发明一典型实施方案中HLA-B*58:01等位基因的检测方法步骤示意图。
图5a-图5b是本发明一典型实施方案中HLA-B*58:01等位基因的检测结果示意图。
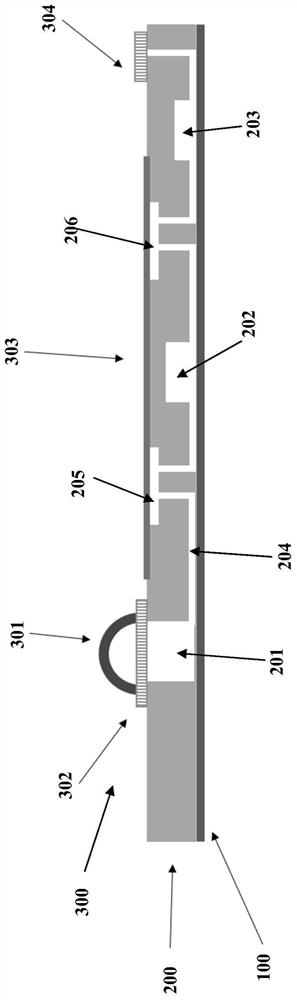
附图标记说明:100-盖片层,200-基片层,201-核酸提取腔室,202-混合腔室,203-反应腔室,204-微流道,205-第一控制阀,206-第二控制阀,300-控制层,301-穹顶,302-多孔膜,303-软材料膜,304-多孔膜,401-第一直线电机,402-第二直线电机,403-第三直线电机,404-红外LED加热组件,405-加热及温控组件,406a-LED光源,406b-激发滤色片,407a-CCD组件,407b-发射滤色片。
具体实施方式
鉴于现有技术检测HLA-B*5801等位基因,仪器设备价格昂贵、对实验室环境要求严苛以及对操作人员技能的要求高,周期长、低效率等不足和缺陷,本案发明人经长期研究和大量实践,得以提出本发明的技术方案,建立了一种基于微流控技术实现重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)实时荧光检测的集成式HLA-B*58:01等位基因的检测方法、引物和荧光探针、微流控芯片和便携式检测装置及检测系统,本方法针对临床检测的要求,引入RPA反应内控,保证检测反应的真实性和准确性。
如下将对该技术方案、其实施过程及原理等作进一步的解释说明。
下文将对本发明的技术方案作更为详尽的解释说明。但是,应当理解,在本发明范围内,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
本发明实施例的一个方面提供了一种用于检测HLA-B*58:01等位基因的引物组,其包括:
第一引物对,其包括第一正向引物和反向引物;
第二引物对,其包括第二正向引物和反向引物;
第三引物对,其包括第三正向引物和反向引物;
其中,所述第一正向引物、第二正向引物、第三正向引物的序列分别如SEQ IDNO.1、SEQ ID NO.2和SEQ ID NO.3所示,所述反向引物的序列如SEQ ID NO.4所示。
本发明根据HLA-B*58:01等位基因序列(GenbankSequence ID:KU319333.1),在HLA-B多态性位点集中区域设计用于检测人HLA-B*58:01等位基因的序列特异性引物引物和荧光探针(如图1所示),序列如下:
进一步地,所述第一正向引物(即正向引物1:B*58:01-FP1)的具体序列SEQ IDNO.1表示为:ATAGAGCAGGAGGGGCCGGAGTATTGGGACG。
进一步地,所述第二正向引物(即正向引物2:B*58:01-FP2)的具体序列SEQ IDNO.2表示为:CCGCGCAGACTTACCGAGAGAACCTGCCGAT。该序列中3’端第四位引入扩增阻滞突变,用c替换g,以提高扩增特异性。
进一步地,所述第三正向引物(即正向引物3:B*58:01-FP3)的具体序列SEQ IDNO.3表示为:CCCGAGTCTCCGTGTCCGAGATCCGCCT。
序列中5’端第十三位引入T替换G,破坏引物二级结构对扩增的影响,这一设计利用了RPA体系对序列5’端和中间部分对错配良好的兼容性。
进一步地,所述反向引物(即B*58:01-RP)的具体序列SEQ ID NO.4表示为:CCCAGGT CGCAGCCATACATCCTCTGGATGA。
本发明实施例的另一个方面还提供了一种用于检测HLA-B*58:01等位基因的探针,它的序列如SEQ ID NO.5所示。
进一步地,所述探针(即B*58:01-Probe)的具体序列SEQ ID NO.5表示为:CCGGCGAGAGCCCCAGGCGCGTTTACCCGG[FAM-dT]T[THF]CA[BHQ-dT]TTTCAGTTGAGGCC[3’-C3],亦即图1中所示的‘CCGGCGAGAGCCCCAGGCGCGTTTACCCGGTTTCATTTTCAGTTG AGGCC’。
其中,FAM-dT为荧光素标记的碱基dT,BHQ-dT为荧光淬灭基团标记的碱基dT,THF为四氢呋喃,被核酸外切酶III切割后,荧光基团和淬灭基团分开,而实现荧光定量,C3为3’端阻断基团,可阻止荧光探针被延伸。
本发明中,Rpa引物相对PCR引物序列较长,同时RPA扩增体系对引物5’端和中间的错配碱基不敏感,而对引物3’端附近错配特异性较好,还可以引入在引物序列中扩增阻滞突变进一步提高特异性,所以可以根据需要更好的设计引物。
进一步地,本发明在全封闭反应体系全自动实现基因检测,低温反应可以避免气溶胶造成的实验室污染,无需专业分子生物学实验室和专业培训人员。
本发明实施例的另一个方面还提供了一种用于检测HLA-B*58:01等位基因的试剂盒,其包括:至少一引物组和至少一探针,其中一引物组为前述的引物组,一探针组为前述的探针。
在一些优选实施例中,所述试剂盒还包括一内参引物对和内参探针,所述内参引物对包括内参正向引物和内参反向引物,所述内参正向引物、内参反向引物的序列分别如SEQ ID NO.6和SEQ ID NO.7所示,所述内参探针的序列如SEQ ID NO.8所示。
进一步地,本发明根据GAPDH基因序列设计一对内参引物和荧光探针:
具体的,所述内参正向引物(即GAPDH-FP)的具体序列SEQ ID NO.6表示为:CCGGGAAACTGTGGCGTGATGGCCGCGG。
具体的,所述内参反向引物(即GAPDH-RP)的具体序列SEQ ID NO.7表示为:GGTGGAGGAGTGGGTGTCGCTGTTGAAGTC。
具体的,所述内参探针(即GAPDH-probe)的具体序列SEQ ID NO.8表示为:AGCTGAACGGGAAGCTCACTGGCATGGCCT[FAM-dT]C[THF]G[BHQ-dT]GTCCCCACTGCCAAC[3’-C3],亦即AGCTGAACGGGAAGCTCACTGGCATGGCCTTCTGTGTCCCCACTGCCAAC。
其中FAM-dT为荧光素标记的碱基dT,BHQ-dT为荧光淬灭基团标记的碱基dT,THF为四氢呋喃,被核酸外切酶III切割后,荧光基团和淬灭基团分开,而实现荧光定量,C3为3’端阻断基团,可阻止荧光探针被延伸。
本发明实施例的另一个方面还提供了一种微流控芯片,其包括沿设定方向依次设置的盖片层、基片层及控制层;
其中,所述基片层包括相互连通的核酸提取腔室、混合腔室、反应腔室、至少用于连通各腔室的微流道以及设置于各腔室之间的控制阀,所述核酸提取腔室至少用以提取待检测样本中的核酸,所述混合腔室至少用以存储RPA冻干试剂,并使所述RPA冻干试剂与提取的核酸混合,所述反应腔室至少用以存储用于检测HLA-B*58:01等位基因的引物组、探针并与混合腔室内的RPA冻干试剂与提取的核酸进行等温扩增反应;
所述控制层包括第一控制单元、第二控制单元及第三控制单元,所述第一控制单元设置于所述核酸提取腔室上方,至少用以提供驱动液体在各腔室间流动的压力,所述第二控制单元设置于控制阀上方,至少用以使所述控制阀闭合或打开,所述第三控制单元设置于与所述反应腔室连通的出口上方,至少用以使所述反应腔室内的液体排出。
在一些实施例中,所述第一控制单元包括一多孔膜,以及设置于所述多孔膜表面的穹顶,所述穹顶与多孔膜之间至少形成用以驱动液体在各腔室间流动的穹顶压力腔。
在一些实施例中,所述穹顶的材质包括硅胶、TPE或TPU等可在压力下变形驱动液体的软材料,但不限于此。
进一步地,所述多孔膜为透气不透水的膜,所述多孔膜的材质包括聚四氟乙烯PTFE等材料,但不限于此。
在一些实施例中,所述第二控制单元覆设于所述基片层的控制阀阀座上。
进一步地,所述第二控制单元包括软材料膜,至少能够在压力作用下拉伸变形,从而控制所述控制阀的状态,所述第二控制单元的材质为软材料,可以包括硅胶膜,乳胶膜,还包括具有一定延展性能的聚碳酸酯(PC)等热塑材料薄膜,可在压力下拉伸变形。
进一步地,所述第三控制单元包括多孔膜,所述多孔膜为透气不透水的膜,所述多孔膜的材质包括聚四氟乙烯PTFE等材料,但不限于此。
进一步地,所述盖片层与所述基片层贴合或键合设置,从而形成的核酸提取腔室、混合腔室、反应腔室和微流道。
进一步地,所述基片层的厚度为0.3~10mm。
进一步地,所述盖片层的厚度为0.01~0.5mm。
在一些实施例中,所述核酸提取腔室与混合腔室之间设置有第一控制阀,所述混合腔室与反应腔室之间设置有第二控制阀。
综上,本发明提出了微流控芯片,可以从FTA样品进行核酸提取洗脱和RPA等温扩增,其特点包括三个微反应腔,依次为核酸提取腔室,混合腔室和RPA反应腔室。核酸提取腔室用于接受采集了血液、咽拭子或者唾液等样本的FTA卡片并加温洗脱核酸;混合腔室存储RPA冻干试剂并与洗脱的核酸混合;RPA反应腔室存储冻干序列特异性引物和探针存储并进行等温扩增反应。
FTA卡使用Whatman公司(现GE Healthcare的一部分)专利的FTA技术,简单的一步法采集捕获DNA。FTA卡上含有独特的化学物质,可以裂解细胞,使蛋白质变性并有效地保护核酸免受核酸酶、氧化剂和紫外线损伤,捕获的核酸便可用于下游各种应用,使核酸的操作和处理变得简单。
本发明实施例的另一个方面还提供了一种便携式控制装置,其配合微流控芯片完成HLA-B*58:01等位基因的检测,便携式控制装置由单片机控制,其包括液体和流路控制单元、热管理和温度控制单元以及荧光激发和采集单元;
其中,所述液体和流路控制单元包括:
液体驱动组件,其至少用以挤压所述微流控芯片的穹顶压力腔,从而驱使液体的流动;
控制阀控制组件,其至少用以挤压所述第二控制单元,从而使所述控制阀闭合或打开;
所述热管理和温度控制单元包括:
第一加热组件,其至少用以加热,并使所述核酸提取腔室内达到核酸洗脱需要的温度;
第二加热组件,其至少用以加热,并使所述反应腔室内达到RPA反应所需的温度;
所述荧光激发和采集单元包括荧光激发组件和荧光图象采集组件。
进一步地,所述液体驱动组件和控制阀控制组件包括直线电机。
进一步地,所述液体和流路控制单元包括三个直线电机:第一直线电机通过挤压微流控芯片上的穹顶压力腔,驱动液体在混合腔室和反应腔室之间的顺序流动;第二直线电机控制样品提取腔与混合腔室之间的微阀(即第一控制阀),其通过向下运动挤压控制微阀阀座上方的软材料膜而闭合微阀,或者通过向上运动脱离软材料膜而打开微阀;第三直线电机控制混合腔室与RPA反应室之间的微阀(即第二控制阀),其通过向下运动挤压控制微阀阀座上方的软材料膜而闭合微阀,或者通过向上运动脱离软材料膜而打开微阀。
进一步地,所述第一加热组件包括红外LED加热组件。
进一步地,所述热管理和温度控制单元包括两部分:第一部分为在核酸提取腔室下方通过红外LED加热组件加热核酸提取腔室内的液体,提供核酸洗脱需要的温度,温度范围为80℃-98℃;第二部分为在RPA反应腔室下方的加热和温单元,提供RPA反应的最佳反应温度37℃-42℃。
在一些优选实施例中,所述荧光激发组件包括LED光源和激发滤色片,所述LED光源设置于所述激发滤色片上方。
在一些优选实施例中,所述荧光图象采集组件包括CCD组件和发射滤色片,所述CCD组件设置于所述发射滤色片上方。
进一步地,所述液体和流路控制单元、热管理和温度控制单元和荧光激发和采集单元均由控制中心控制,所述控制中心包括单片机。
进一步地,所述LED光源、激发滤色片和发射滤色片根据荧光探针所用的染料波长进行选择。
本发明实施例的另一个方面还提供了一种HLA-B*58:01等位基因的检测系统,其包括:
前述的用于检测HLA-B*58:01等位基因的试剂盒;
RPA反应体系;
前述的微流控芯片;以及,
前述的便携式控制装置。
在本发明中,RPA反应体系、微流控芯片以及便携式控制装置组成完整的一体化HLA-B*58:01等位基因的检测系统,在加入样品后,一键式全自动操作,完成检测。在FTA样品加入后盖上穹顶压力腔,即形成全封闭的微流控芯片反应器,扩增产物被封闭在微流控芯片内,不会造成实验室污染。
本发明实施例的另一个方面还提供了前述用于检测HLA-B*58:01等位基因的引物组、探针、试剂盒于制备检测HLA-B*58:01等位基因的产品中的用途。
进一步地,应用所述产品检测HLA-B*58:01等位基因的方法主要基于前述HLA-B*58:01等位基因的检测系统而实施,并且所述检测方法包括:
将待检测样本置于所述微流控芯片的核酸提取腔室内,RPA冻干试剂置于混合腔室内,用于检测HLA-B*58:01等位基因的试剂盒置于反应腔室内;
采用便携式控制装置的第一加热组件进行加热,使所述核酸提取腔室内升温,并对所述待检测样本进行洗脱,得到提取的核酸;
采用便携式控制装置的液体驱动组件挤压所述微流控芯片的穹顶压力腔,同时打开第一控制阀,从而驱使核酸进入混合腔室内与RPA冻干试剂混合;
使所述液体驱动组件继续挤压所述微流控芯片的穹顶压力腔,同时打开第二控制阀,从而驱使核酸、RPA冻干试剂进入反应腔室内与用于检测HLA-B*58:01等位基因的引物组、探针混合;
采用便携式控制装置的第二加热组件进行加热,使所述反应腔室内升温进行RPA反应,以及,
采用便携式控制装置的荧光激发和采集单元对RPA反应产物进行检测。
进一步地,所述待检测样本包括FTA卡采集的咽拭子、血液或唾液等样本,但不限于此。
进一步地,所述洗脱的温度为80~98℃,所述RPA反应的温度为37~42℃。
进一步地,所述检测方法包括:实时监测采集RPA反应产物的光强度,通过荧光强度随时间变化的扩增曲线分析结果。
进一步地,所述采集的时间为15~40min。
本发明的HLA-B*58:01等位基因的检测方法包括:用FTA卡采集咽拭子或血液样本后,加入微流控芯片,全自动完成待测样本的基因组DNA抽提洗脱,使用三对特异性引物、一对内参引物和相应的荧光探针,置于37℃-42℃环境中进行等温扩增,实时监测采集荧光强度,通过荧光强度随时间变化的扩增曲线分析结果。从血样、咽拭子或者唾液等样品进行基因组DNA提取纯化后,进行等温核酸扩增,不需要热循环反应,不必在PCR仪中进行扩增,具有灵敏度高、特异性强、反应程序简单、检测时间短等优点。本发明快速、成本低,具有广泛推广价值。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行详细的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图2所示,本发明一具体实施例中提供的一种微流控芯片可以从FTA样品进行核酸提取洗脱和RPA等温扩增,其结构主要分为三层:分别为盖片层100、基片层200及控制层300。
其中,中间层为基片层200,包括了三个微反应腔(即核酸提取腔室201、混合腔室202和反应腔室203),连接各微反应腔的微流道204以及控制阀(即第一控制阀205、第二控制阀206)阀座,基片层的厚度一般为0.3mm至10mm。核酸提取腔室201用于接受采集了血液、咽拭子或者唾液等样本的FTA卡片并加温洗脱核酸;混合腔室202存储RPA冻干试剂并与洗脱的核酸混合;RPA反应腔室存储冻干序列特异性引物和探针存储并进行等温扩增反应。
微流控芯片的盖片层100与基片层200贴合或键合后,形成闭合的微反应腔和微流道,盖片层的厚度一般为0.01mm至0.5mm。
控制层300包括了三部分:第一控制单元至少用以提供驱动液体在各腔室间流动的压力,其包括多孔膜302,以及设置于所述多孔膜302表面的穹顶301,所述穹顶301与多孔膜302之间至少形成用以驱动液体在各腔室间流动的穹顶压力腔,可在压力下变形驱动液体,所述穹顶301可由硅胶、TPE和TPU等软材料制成,多孔膜302为PTFE等材料制成的透气不透水的膜;第二控制单元至少用以使第一控制阀205、第二控制阀206闭合或打开,其可以是软材料膜303,覆盖于微流控芯片的基片层200的阀座上,可以在压力下拉伸变形将第一控制阀205、第二控制阀206闭合;第三控制单元是透气不透水的多孔膜304,如PTFE材料的膜,可在反应腔室203填充过程中排出原来占据反应腔室的液体。
请参阅图3所示,本发明一具体实施例中提供的一种便携式控制装置,其配合微流控芯片完成HLA-B*58:01等位基因的检测,便携式控制装置由单片机控制,其主要功能单元包括:液体和流路控制单元、热管理和温度控制单元以及荧光激发和采集单元。
所述液体和流路控制单元包括三个直线电机,即第一直线电机401通过挤压微流控芯片上的穹顶压力腔,驱动液体在混合腔室202和反应腔室203之间的顺序流动;第二直线电机402控制核酸提取腔室201与混合腔室202之间的微阀(即第一控制阀205、第二控制阀206),其通过向下运动挤压控制微阀阀座上方的软材料膜303而闭合微阀,或者通过向上运动脱离软材料膜303而打开微阀;第三直线电机403控制混合腔室202与RPA反应腔室203之间的微阀,其通过向下运动挤压控制微阀阀座上方的软材料膜303而闭合微阀,或者通过向上运动脱离软材料膜303而打开微阀。
所述热管理和温度控制单元包括两部分:第一加热组件为在核酸提取腔室201下方通过红外LED加热组件404加热核酸提取腔室内的液体,提供核酸洗脱需要的温度,温度范围为80℃-98℃,第二加热组件为在RPA反应腔室下方的加热和温控组件405,提供RPA反应的最佳反应温度37℃-42℃。
所述荧光激发和采集包括荧光激发组件和荧光图象采集组件。所述荧光激发组件包括LED光源406a和激发滤色片406b组成的荧光激发组件部分;所述荧光图象采集组件包括发射滤色片407b和CCD组件407a组成的荧光图象采集部分。其中,LED光源、激发滤色片和发射滤色片根据荧光探针所用的染料波长进行选择。
本发明一具体实施例中提供的HLA-B*58:01等位基因的检测方法包括:
(a)将待检测的FTA膜放入微流控芯片的核酸提取腔室201;
(b)打开第一加热组件即红外LED加热组件404加热,进行基因组核酸洗脱;
(c)第一直线电机401挤压穹顶压力腔,同时第一控制阀205打开,使核酸提取腔室201的液体充满混合腔室202,液体溶解冻干的RPA试剂;
(d)第一直线电机401继续挤压穹顶压力腔,同时第二控制阀206打开,冻干引物、探针和醋酸镁与RPA反应液混合;
(e)第二控制阀206关闭,第二加热组件即加热和温控组件405加热,使反应腔室203内的RPA反应温度控制在37-42℃,最后以荧光激发和采集单元对RPA反应产物进行检测。
实施例1咽拭子样品采集
用咽拭子样品采集卡(FTA Buccal Collection Kit,P/N:WB120239,GEHealthcare)采集患者口腔细胞,具体方法:(a)患者采样前30分钟不能进食;(b)在采集卡上填写患者信息;(c)用清水漱口后,首先将采样棒放在舌下下等处,蘸取唾唾液后,然后将采样棒一面在口腔内左侧擦拭30秒,将采样棒的另一面在口腔内右侧擦拭30秒;(d)将海绵头的平坦表面按入采集卡样品区域使样品充分吸收;再将海绵头翻转,放在采集卡样品区域重复按压;(e)将采集卡室温放置1小时,至完全干燥。
实施例2指尖血样品采集
用血液样品采集卡(FTA blood sample collection kit,P/N:WB120238,GEHealthcare)采集患者指尖血,具体方法:(a)在采集卡上填写患者信息;(b)用医用酒精消毒采血部位;(c)将医用采血针针尖插入采血部部位,挤压采血部位使血液流出形成血滴;(d)血液自然渗入采集卡样品区域,注意样品区域切勿直接接触血液;(e)用干棉球球轻压采血部位止血;(f)将采集卡室温放置干燥。
实施例3微流控芯片制造
用双面热模压或注塑工艺制造包含微反应腔、微流道和控制阀阀座的微流控芯片基片层,基片层的材质为PMMA,基片层厚度为4mm。核酸提取腔室的直径为6mm,深4mm(穿孔),体积为113μL的微腔;混合腔室的直径为6mm,深1.8mm,体积为50μL的微腔;RPA反应腔室为4个直径为4.6mm,深0.6mm,体积为10μL的微腔。阀座的直径为6mm,深为0.1mm,最大死体积为2.8μL。微流道宽度为0.5mm,深为0.1mm。
微流控芯片盖片层为涂敷了压敏胶的光学膜,施加压力封闭微流道和反应腔室之前,首先在RPA反应腔室加入序列特异性引物,荧光探针和醋酸镁,加热蒸干;然后将
用于微阀开闭控制的软性膜为PDMS膜,厚度为0.2mm,用双面压敏胶粘贴在微流控芯片基片层上,与微阀阀座对应的双面压敏胶区域用刻刀去除。穹顶压力腔用硬度为50的TPE材料加热后注塑成型,底部与PTFE多孔膜用双面压敏胶粘贴。反应腔室出口处用双面压敏胶粘贴PTFE多孔膜。
实施例4HLA-B*58:01等位基因检测流程
本实施例中HLA-B*58:01等位基因的检测流程如图4a-图4e所示,(a)取直径为3mm左右的FTA膜小片,放入微流控芯片的核酸提取腔室,加入约100μL无菌水(如图4a);(b)打开850nm红外激光管加热15分钟,进行基因组核酸洗脱(如图4b);(c)第一直线电机挤压软性材料盖帽即穹顶压力腔,同时第一控制阀打开,约50μL液体充满混合腔室,液体溶解冻干的RPA试剂(如图4c);(d)第一直线电机继续挤压穹顶压力腔,同时第二控制阀打开,冻干引物、探针和醋酸镁与RPA反应液混合(如图4d);(e)第二控制阀关闭,反应温度控制在37-42℃,荧光采集15-40分钟(如图4e),其中本步骤是在510nm荧光采集,470nm激发。其中只有步骤(a)需要人工操作,需要2分钟时间,接下来的步骤在单片机控制下在1小时内自动完成。
实施例5HLA-B*58:01等位基因检测结果
10名痛风患者按照实施例1方法采集唾液样本,按实施例4检测流程,检测结果有1名HLA-B*58:01阳性患者,荧光强度随时间变化如图5a所示,另外选择1名患者检测结果如图5b所示。经过PCR克隆测序和序列比对,这两名患者分别为HLA-B*58:01/HLA-B*52:01杂合子和HLA-B*51:01纯合子。以上结果表明,按本发明实施例得到的检测结果与测序结果一致。
综上所述,藉由上述技术方案,本发明从待检测样品进行基因组DNA提取纯化后,进行等温核酸扩增,不需要热循环反应,不必在PCR仪中进行扩增,具有灵敏度高、特异性强、反应程序简单、检测时间短等优点,本方法针对临床检测的要求,引入RPA反应内控,保证检测反应的真实性和准确性;并且检测过程快速、成本低。
本发明的各方面、实施例、特征及实例应视为在所有方面为说明性的且不打算限制本发明,本发明的范围仅由权利要求书界定。在不背离所主张的本发明的精神及范围的情况下,所属领域的技术人员将明了其它实施例、修改及使用。
在本发明案中标题及章节的使用不意味着限制本发明;每一章节可应用于本发明的任何方面、实施例或特征。
在本发明案通篇中,在将组合物描述为具有、包含或包括特定组份之处或者在将过程描述为具有、包含或包括特定过程步骤之处,预期本发明教示的组合物也基本上由所叙述组份组成或由所叙述组份组成,且本发明教示的过程也基本上由所叙述过程步骤组成或由所叙述过程步骤组组成。
应理解,各步骤的次序或执行特定动作的次序并非十分重要,只要本发明教示保持可操作即可。此外,可同时进行两个或两个以上步骤或动作。
此外,本案发明人还参照前述实施例,以本说明书述及的其它原料、工艺操作、工艺条件进行了试验,并均获得了较为理想的结果。
尽管已参考说明性实施例描述了本发明,但所属领域的技术人员将理解,在不背离本发明的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所述实施例的元件。另外,可在不背离本发明的范围的情况下做出许多修改以使特定情形或材料适应本发明的教示。因此,本文并不打算将本发明限制于用于执行本发明的所揭示特定实施例,而是打算使本发明将包含归属于所附权利要求书的范围内的所有实施例。
序列表
<110> 中国科学院苏州纳米技术与纳米仿生研究所
<120> 用于检测HLA-B*58:01等位基因的引物组、探针、微流控芯片、检测方法及系统
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 31
<212> DNA
<213> 人工序列(人工序列)
<400> 1
atagagcagg aggggccgga gtattgggac g 31
<210> 2
<211> 31
<212> DNA
<213> 人工序列(人工序列)
<400> 2
ccgcgcagac ttaccgagag aacctgccga t 31
<210> 3
<211> 28
<212> DNA
<213> 人工序列(人工序列)
<400> 3
cccgagtctc cgtgtccgag atccgcct 28
<210> 4
<211> 31
<212> DNA
<213> 人工序列(人工序列)
<400> 4
cccaggtcgc agccatacat cctctggatg a 31
<210> 5
<211> 50
<212> DNA
<213> 人工序列(人工序列)
<400> 5
ccggcgagag ccccaggcgc gtttacccgg tttcattttc agttgaggcc 50
<210> 6
<211> 28
<212> DNA
<213> 人工序列(人工序列)
<400> 6
ccgggaaact gtggcgtgat ggccgcgg 28
<210> 7
<211> 30
<212> DNA
<213> 人工序列(人工序列)
<400> 7
ggtggaggag tgggtgtcgc tgttgaagtc 30
<210> 8
<211> 50
<212> DNA
<213> 人工序列(人工序列)
<400> 8
agctgaacgg gaagctcact ggcatggcct tctgtgtccc cactgccaac 50
- 用于检测HLA-B*58:01等位基因的引物组、探针、微流控芯片、检测方法及系统
- 一种检测非洲猪瘟病毒的引物探针组合及基于微流控芯片Digital PCR的检测方法
