一种起始免疫细胞活化扩增体系及其应用
文献发布时间:2023-06-19 11:47:31
技术领域
本发明涉及免疫细胞治疗技术领域,尤其涉及一种起始免疫细胞活化扩增体系及其应用。
背景技术
癌症的过继性细胞治疗(adoptive cell therapy,ACT)依赖于产生具有识别肿瘤活性的抗肿瘤免疫细胞,该疗法的优势在于经体外如抗原负载、基因修饰等操作,赋予免疫细胞特定的抗肿瘤功能,并在体外进一步激活和扩大培养,获得足够量的杀伤肿瘤细胞的免疫效应细胞,且输注的免疫效应细胞在体内尽可能可以长期存活,发挥持续的抗肿瘤效应。对临床有意愿接受过继性细胞治疗的患者,签署知情同意书后,进行常规治疗前的指标筛选和免疫状态评估,根据每位患者外周血中T淋巴细胞计数,静脉采集外周血50~100mL(含8×10
根据过继性细胞治疗的历史发展过程,其产品主要包括早期的广谱非特异性抗肿瘤细胞如LAK、CIK、DC、NK等细胞,以及近几年迅速发展起来的靶向杀伤肿瘤细胞如CAR-T、TCR-T、TIL等新产品。目前以CAR-T和TCR-T为代表的靶向免疫细胞治疗产品在临床抗肿瘤应用上取得了令人可喜的疗效。欧美国家已有四款CAR-T细胞产品获得批准在临床正式上市使用,中国也有多个产品正在临床试验性治疗和研究中,结果显示疗效和安全性与欧美发达国家相似,也即将正式进入临床。
过继性细胞治疗是在传统抗癌治疗方法上开创的一种全新的“抗肿瘤活药治疗技术”,为攻克癌症开创了新起点,虽然临床数据显示目前已上市或正在临床试验的CAR-T产品取得了令人鼓舞的效果,应用前景良好,但同时也发现一些问题,关键问题之一就是对部分患者无法在体外制备获得治疗最低需求量的CAR-T细胞,或者有少数患者即使获得足够数量CAR-T细胞、回输后显示免疫耐药,治疗无反应。究其原因,主要是制备“CAR-T细胞”之前必须采集患者的外周血单个核细胞(PBMC)作为种子细胞——即“起始免疫细胞”进行活化扩增,这些活化扩增的“起始免疫细胞”的质量和数量是决定能否成功制备CAR-T等靶向免疫细胞的重要因素。
因此,提供一种能够保证外周血单个核细胞质量和数量的活化扩增体系成为本领域技术人员亟待解决的技术问题。
发明内容
为了克服现有技术的不足,本发明的目的之一在于提供一种起始免疫细胞活化扩增体系,活化培养基中加入TGF-β拮抗剂,竞争性结合外周血单个核细胞中T细胞表面的TGF-βR,阻断TGF-β与TGF-βR的结合,抑制TGF-β介导的信号通路,从而下调患者“起始免疫细胞”中异常升高的Treg细胞数量和功能,同时上调T效应细胞和抗原呈递细胞的功能活性和扩增能力,能够避免因TGF-β上调Treg细胞等负向免疫调控机制导致的“起始免疫细胞”数量不足和功能下降,为后期成功制备CAR-T等靶向免疫细胞提供高质高量的优良种子细胞。
本发明的目的之二在于提供一种活化扩增起始免疫细胞的方法,在细胞活化过程采用添加TGF-β拮抗剂的活化培养基,阻断TGF-β介导的
本发明的目的之三在于提供一种制备靶向免疫细胞的方法,采用活化培养基含TGF-β拮抗剂的起始免疫细胞活化扩增体系对起始免疫细胞依次进行活化和扩增后,嵌合抗原受体,得到靶向免疫细胞,能够保证靶向免疫细胞的制备数量和质量。
本发明的目的之一采用如下技术方案实现:
一种起始免疫细胞活化扩增体系,包括:活化培养基和扩增培养基;
所述活化培养基包括基础培养基、CD3抗体、CD28抗体、IL-2、IL-7、IL-15和TGF-β拮抗剂。
部分患者因为肿瘤细胞负荷高、前期反复化疗等因素,外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)中含有异常升高的调节性T细胞(Regulatory T cells,Tregs)和抑制性细胞因子,这些免疫负向因素可抑制效应T细胞分化、增殖和功能,直接导致后期CAR-T细胞制备失败或抗肿瘤功能下降,进而使部分患者不能从过继性细胞治疗方法中获益。
转化生长因子β(transforming growth factor beta,TGF-β)系细胞因子TGF超家族中的一个亚型。TGF-β是免疫稳态和免疫耐受的重要促进因子,可诱导
本发明在体外制备CAR-T等靶向免疫细胞之前,对“起始免疫细胞”PBMC进行活化和扩增的过程中,在起始免疫细胞活化扩增体系中添加TGF-β拮抗剂,阻断免疫细胞上的TGF-β/受体信号系统,进而阻断TGF-β对免疫系统的抑制效应,降低Tregs细胞,提升制备CAR-T等靶向免疫细胞的成功率和杀伤功能,使更多患者能够接受靶向免疫细胞的治疗。
本发明起始免疫细胞活化扩增体系在“起始免疫细胞”活化过程中引入TGF-β拮抗剂,竞争性结合T细胞表面的TGF-βR,阻断TGF-β与TGF-βR的结合,抑制TGF-β介导的信号通路,从而下调患者“起始免疫细胞”中异常升高的Treg细胞数量和功能,同时上调T效应细胞和抗原呈递细胞的功能活性和扩增能力,能够避免因TGF-β上调Treg细胞等负向免疫调控机制导致的“起始免疫细胞”数量不足和功能下降,为后期成功制备CAR-T等靶向免疫细胞提供高质高量的优良种子细胞。
本发明起始免疫细胞活化扩增体系中的活化培养基加入TGF-β拮抗剂等细胞因子,在激活免疫细胞的同时,抑制TGF-β介导的
优选的,所述CD3抗体和所述CD28抗体在所述活化培养基的浓度均为50~200ng/mL;
所述IL-2在所述活化培养基的浓度为50~300IU/mL;
所述IL-7在所述活化培养基的浓度为10~20ng/mL;
所述IL-15在所述活化培养基的浓度为10~20ng/mL;
所述TGF-β拮抗剂在所述活化培养基的浓度为10~500ng/mL。
进一步的,所述CD3抗体在所述活化培养基的浓度为100ng/mL;
所述CD28抗体在所述活化培养基的浓度为100ng/mL;
所述IL-2在所述活化培养基的浓度为200IU/mL;
所述IL-7在所述活化培养基的浓度为10ng/mL;
所述IL-15在所述活化培养基的浓度为10ng/mL;
所述TGF-β拮抗剂在所述活化培养基的浓度为50ng/mL。
优选的,所述基础培养基为免疫细胞专用培养基;免疫细胞专用培养基不含动物源或人源血清,免疫细胞专用培养基除含一般细胞生长培养基必需的氨基酸、碳水化合物、无机盐外,还含有转铁蛋白、胆固醇、神经营养因子等促进淋巴细胞生长的特有的成分。
基础培养基可为PRIME-XV T Cell CDM培养基。
所述TGF-β拮抗剂选自TGF-βR抗体和/或ALK5抑制剂(SB431542)。
优选的,所述扩增培养基包括基础培养基、IL-2、IL-7和IL-15。
所述IL-2在所述扩增培养基的浓度为50~300IU/mL;
所述IL-7在所述扩增培养基的浓度为10~20ng/mL;
所述IL-15在所述扩增培养基的浓度为10~20ng/mL。
本发明起始免疫细胞活化扩增体系的扩增培养基同时引入低浓度IL-2及IL-7、IL-15作为免疫细胞扩增因子,即保证了高效的扩增倍数,又保障制备获得的效应免疫细胞具有高比例的中央记忆型T细胞(Central Memory T cell,Tcm),提高后期CAR-T等靶向免疫细胞制备的成功率以及回输进体内后的存留时间和抗肿瘤效应。
进一步的,所述IL-2在所述扩增培养基的浓度为200IU/mL;
所述IL-7在所述扩增培养基的浓度为10ng/mL;
所述IL-15在所述扩增培养基的浓度为10ng/mL。
本发明起始免疫细胞活化扩增体系包括活化培养基和扩增培养基,活化培养基包括基础培养基、CD3抗体、CD28抗体、IL-2、IL-7、IL-15和TGF-β拮抗剂并进一步限定了各组成成分的浓度,能够提高外周血单个核细胞的活性,进而能够提高外周血单个核细胞后续单位时间扩增效率,缩短细胞制备时间,实现在体外对“起始免疫细胞”进行高效、高质量扩增,使既往因“起始免疫细胞”质量问题而无法接受CAR-T等免疫靶向细胞治疗的患者,通过采用本发明起始免疫细胞活化扩增体系后,成为可接受该项治疗技术的受益者。
本发明的目的之二采用如下技术方案实现:
一种活化扩增起始免疫细胞的方法,采用上述技术方案所述起始免疫细胞活化扩增体系,包括以下步骤:
将起始免疫细胞采用所述活化培养基进行活化,再采用所述扩增培养基进行扩增。
优选的,所述起始免疫细胞在所述扩增培养基中的细胞浓度为(0.5~1)×10
本发明中,活化的时间优选为24~48h。
扩增过程中,添加扩增培养基,取样计数,调整细胞浓度为(0.5~1)×10
本发明中,细胞扩增培养方式高效,实验结果表明,在细胞扩增阶段,通过持续的补加扩增培养基,维持细胞浓度在(0.5~1)×10
收获细胞时,采用的细胞洗涤液优选为含1%人血白蛋白(Human Serum Albumin,HSA)的注射用生理盐水。含1%HSA的注射用生理盐水通过取19份体积的注射用生理盐水和1份体积的浓度为20wt%的HSA得到。
优选的,所述扩增之后,还包括:冻存。
优选的,所述冻存的冻存液中的人血白蛋白浓度为0.5wt%~1wt%;
所述冻存的冻存液中的DMSO浓度为5wt%。
冻存液的配制方法为:取1份体积的CS10(BioLife Solutions)、0.05~0.1份体积的市售浓度为20wt%的HSA和0.95-0.9份体积的注射用生理盐水(保证加入的HSA与注射用生理盐水的体积之和等于加入的CS10的体积),即得HSA浓度为0.5wt%~1wt%的冻存液。
本发明中,冻存的冻存液中的人血白蛋白浓度为0.5wt%~1wt%,DMSO浓度为5wt%,可实现冻存细胞解冻复苏后的高活率(85%以上)和高回收率(80%以上)。并且,该冻存液冻存细胞密度范围可满足0.5×10
本发明的目的之三采用如下技术方案实现:
一种制备靶向免疫细胞的方法,包括以下步骤:
采用上述技术方案所述起始免疫细胞活化扩增体系对起始免疫细胞依次进行活化和初步扩增后,嵌合抗原受体,进一步扩增,得到靶向免疫细胞。
相比现有技术,本发明的有益效果在于:
本发明提供的一种起始免疫细胞活化扩增体系中,活化培养基加入TGF-β拮抗剂,竞争性结合外周血单个核细胞中T细胞表面的TGF-βR,阻断TGF-β与TGF-βR的结合,抑制TGF-β介导的信号通路,从而下调患者“起始免疫细胞”中异常升高的Treg细胞数量和功能,同时上调T效应细胞和抗原呈递细胞的功能活性和扩增能力,能够避免因TGF-β上调Treg细胞等负向免疫调控机制导致的“起始免疫细胞”数量不足和功能下降,为后期成功制备CAR-T等靶向免疫细胞提供高质高量的优良种子细胞。
本发明提供的一种活化扩增起始免疫细胞的方法,在细胞活化过程采用添加TGF-β拮抗剂的活化培养基,阻断TGF-β介导的
本发明提供的一种制备靶向免疫细胞的方法,采用活化培养基含TGF-β拮抗剂的起始免疫细胞活化扩增体系对起始免疫细胞依次进行活化和扩增后,嵌合抗原受体,得到靶向免疫细胞,能够保证靶向免疫细胞的制备数量和质量。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1为本发明实施例1细胞活化步骤中细胞培养孔与HBSS放置孔的位置关系图;
图2为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的活细胞总数图;
图3为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的细胞活率图;
图4为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的扩增倍数图;
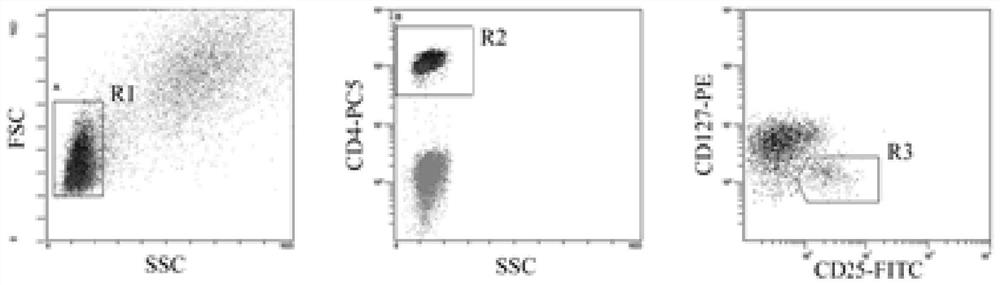
图5从左至右依次为本发明检测淋巴细胞群(R1)的表达、在淋巴细胞群中检测CD4
图6为本发明实施例1(TGF-βR抗体实施1组)检测Treg细胞的流式细胞图;
图7为本发明对比例1(对比组)检测Treg细胞的流式细胞图;
图8为本发明实施例2细胞培养10天的活细胞总数图;
图9为本发明实施例2细胞培养10天的细胞活率图;
图10为本发明实施例2细胞培养10天的扩增倍数图;
图11为本发明实施例2检测Treg细胞的流式细胞图;
图12为本发明实施例2检测T细胞表达CAR阳性细胞的流式细胞图;
图13为本发明实施例2解冻后细胞的活率和活细胞回收率图;
图14为本发明实施例2解冻后细胞表达CAR阳性细胞的流式细胞图;
图示说明:1.细胞培养孔;2.HBSS放置孔。
具体实施方式
下面,结合具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。以下是本发明具体的实施例,在下述实施例中所采用的原材料、设备等除特殊限定外均可以通过购买方式获得。
实施例1
1、配制活化培养基
活化培养基配制方法:取15mL PRIME-XV T Cell CDM培养基,添加CD3抗体至100ng/mL,添加CD28抗体至100ng/mL,添加IL-2至200IU/mL,添加IL-7至10ng/mL,添加IL-15至10ng/mL,添加TGF-βR抗体至50ng/mL。
2、分离PBMC
2.1临床患者A,经知情同意,静脉采集外周血样。接收血样,用体积分数为75%的酒精浸润的无尘布擦拭表面进行消毒,放入生物安全柜内。
2.2取15mL血样,转移至1个洁净无菌的50mL离心管中。
2.3在50mL离心管中补加注射用生理盐水(normal saline,NS)至30mL体积,混匀血细胞。
2.4转移15mL GE Ficoll淋巴细胞分离液至1个洁净无菌的50mL离心管中。
2.5Ficoll室温平衡后,将2.3步骤50mL离心管内的混合血样用10mL吸管加到Ficoll分离液上层,注意添加过程缓慢,保持界面清晰。
2.6设置离心条件,温度20℃,RCF:400g,升6降4,离心30min。
2.7离心结束,吸弃第一层上清,保持上清距离中间白膜层0.5~1cm。用10mL移液管小心轻柔地将白膜层转移至洁净无菌的50mL离心管中,补加NS至40mL,用吸管轻柔吹吸混匀。
2.8设定离心参数,温度4℃,升9降7,600g,离心10分钟。
2.9弃上清,加10mL NS悬浮沉淀,补加NS体积至40mL。
2.10设定离心参数,温度4℃,升9降7,270g,离心10min。
2.11弃上清,尽量弃干净。
2.12用5mL活化培养基悬浮细胞,混匀,得到细胞悬液。
2.13取样50μL,测活率,计算活细胞浓度及活细胞总数。
3、细胞接种、活化
3.1根据计数结果,用1mL移液器吸取4×10
3.2吸取Hank's平衡盐溶液(Hank's Balanced Salt Solution,HBSS)8mL分别放于与细胞培养孔相连的四个孔中,防止培养液蒸发,培养孔尽量放在24孔板中间位置,细胞培养孔1与HBSS放置孔2的位置如图1所示。
3.3将含培养孔的24孔板放入CO
4、配置扩增培养基
扩增培养基组成:取50mL PRIME-XV T Cell CDM培养基,含200IU/mL IL-2,10ng/mL IL-7,10ng/mL IL-15。
5、细胞扩增
5.1Day2,于Day0(细胞接种至24孔板中)操作结束后的48小时进行操作,取出24孔板。
5.2用1mL移液器混匀细胞悬液,取20μL细胞悬液计数。
5.3根据计数结果,补加扩增培养基,调整细胞浓度至0.5×10
5.4根据扩增培养基的体积按照表1方式选择对应的培养容器。
表1培养液体积及对应的培养容器规格
5.5Day3,于Day2操作结束后的24小时进行操作,取出培养容器。按上述5.2-5.4操作方式扩增细胞。
5.6Day4-Day8细胞扩增,每天操作同步骤5.5。
5.7Day9静置培养。
6、细胞收获和质量鉴定
6.1Day10,于Day9操作结束后的24小时进行操作,结束培养。混匀细胞,取样计数,测活率,计算活细胞总数和培养10天细胞扩增倍数。取5×10
调节性T细胞(Treg,Regulatory T cell)为:CD3
对比例1
1、配制活化培养基
活化培养基配制方法:取15mL PRIME-XV T Cell CDM培养基,添加CD3抗体至100ng/mL,添加CD28抗体至100ng/mL,添加IL-2至200IU/mL,添加IL-7至10ng/mL,添加IL-15至10ng/mL。
2、分离PBMC
2.1临床患者A,经知情同意,静脉采集外周血样。接收血样,用体积分数为75%的酒精浸润的无尘布擦拭表面进行消毒,放入生物安全柜内。
2.2取15mL血样,转移至1个洁净无菌的50mL离心管中。
2.3在50mL离心管中补加注射用生理盐水(normal saline,NS)至30mL体积,混匀血细胞。
2.4转移15mL GE Ficoll淋巴细胞分离液至1个洁净无菌的50mL离心管中。
2.5Ficoll室温平衡后,将2.3步骤50mL离心管内的混合血样用10mL吸管加到Ficoll分离液上层,注意添加过程缓慢,保持界面清晰。
2.6设置离心条件,温度20℃,RCF:400g,升6降4,离心30min。
2.7离心结束,吸弃第一层上清,保持上清距离中间白膜层0.5~1cm。用10mL移液管小心轻柔地将白膜层转移至洁净无菌的50mL离心管中,补加NS至40mL,用吸管轻柔吹吸混匀。
2.8设定离心参数,温度4℃,升9降7,600g,离心10分钟。
2.9弃上清,加10mL NS悬浮沉淀,补加NS体积至40mL。
2.10设定离心参数,温度4℃,升9降7,270g,离心10min。
2.11弃上清,尽量弃干净。
2.12用5mL活化培养基悬浮细胞,混匀,得到细胞悬液。
2.13取样50μL,测活率,计算活细胞浓度及活细胞总数。
3、细胞接种、活化
3.1根据计数结果,用1mL移液器吸取4×106个细胞对应2.12步骤细胞悬液的体积,转移至洁净无菌的24孔细胞培养板中,用同一吸头吸取活化培养基至同一孔内,保证细胞孔内总体积为2mL。
3.2吸取Hank's平衡盐溶液(Hank's Balanced Salt Solution,HBSS)8mL分别放于与细胞培养孔相连的四个孔中,防止培养液蒸发,培养孔尽量放在24孔板中间位置,细胞培养孔1与HBSS放置孔2的位置如图1所示。
3.3将含培养孔的24孔板放入CO2培养箱中,确保设置培养箱参数为:温度37℃,CO
4、配置扩增培养基
扩增培养基组成:取50mL PRIME-XV T Cell CDM培养基,含200IU/mL IL-2,10ng/mL IL-7,10ng/mL IL-15。
5、细胞扩增
5.1Day2,于Day0(细胞接种至24孔板中)操作结束后的48小时进行操作,取出24孔板。
5.2用1mL移液器混匀细胞悬液,取20μL细胞悬液计数。
5.3根据计数结果,补加扩增培养基,调整细胞浓度至0.5×106个/mL(注:为减少操作,若计数细胞浓度≤既定细胞浓度的20%,即≤0.6×106/mL时,则不调整细胞浓度)。
5.4根据扩增培养基的体积按照表1方式选择对应的培养容器。
表1培养液体积及对应的培养容器规格
5.5Day3,于Day2操作结束后的24小时进行操作,取出培养容器。按上述5.2-5.4操作方式扩增细胞。
5.6Day4-Day8细胞扩增,每天操作同步骤5.5。
5.7Day9静置培养。
6、细胞收获和质量鉴定
6.1Day10,于Day9操作结束后的24小时进行操作,结束培养。混匀细胞,取样计数,测活率,计算活细胞总数和培养10天细胞扩增倍数。取5×10
调节性T细胞(Treg,Regulatory T cell)为:CD3
请参阅图2至图4,图2为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的活细胞总数图;图3为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的细胞活率图;图4为本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)细胞培养10天的扩增倍数图。图2至图4表明,本发明实施例1(TGF-βR抗体实施1组)和对比例1(对比组)的起始免疫细胞活化扩增体系均能使起始免疫细胞快速扩增,扩增得到的细胞活率高,细胞培养10天实现120倍以上的扩增。
请查阅图5至图7,图5从左至右依次为本发明检测淋巴细胞群(R1)的表达、在淋巴细胞群中检测CD4
实施例2
1、配制活化培养基
活化培养基配制方法:取15mL PRIME-XV T Cell CDM培养基,添加CD3抗体至150ng/mL,添加CD28抗体至75ng/mL,添加IL-2至250IU/mL,添加IL-7至15ng/mL,添加IL-15至15ng/mL,添加TGF-βR抗体至100ng/mL。
2、分离PBMC
2.1临床患者B,经知情同意,静脉采集外周血样。接收血样,用体积分数为75%的酒精浸润的无尘布擦拭表面进行消毒,放入生物安全柜内。
2.2取15mL血样,转移至1个洁净无菌的50mL离心管中。
2.3在50mL离心管中补加注射用生理盐水(normal saline,NS)至30mL体积,混匀血细胞。
2.4转移15mL GE Ficoll淋巴细胞分离液至1个洁净无菌的50mL离心管中。
2.5Ficoll室温平衡后,将2.3步骤50mL离心管内的混合血样用10mL吸管加到Ficoll分离液上层,注意添加过程缓慢,保持界面清晰。
2.6设置离心条件,温度20℃,RCF:400g,升6降4,离心30min。
2.7离心结束,吸弃第一层上清,保持上清距离中间白膜层0.5~1cm。用10mL移液管小心轻柔地将白膜层转移至洁净无菌的50mL离心管中,补加NS至40mL,用吸管轻柔吹吸混匀。
2.8设定离心参数,温度4℃,升9降7,600g,离心10分钟。
2.9弃上清,加10mL NS悬浮沉淀,补加NS体积至40mL。
2.10设定离心参数,温度4℃,升9降7,270g,离心10min。
2.11弃上清,尽量弃干净。
2.12用5mL活化培养基悬浮细胞,混匀,得到细胞悬液。
2.13取样50μL,测活率,计算活细胞浓度及活细胞总数。
3、细胞接种、活化
3.1根据计数结果,用1mL移液器吸取4×10
3.2吸取Hank's平衡盐溶液(Hank's Balanced Salt Solution,HBSS)8mL分别放于与细胞培养孔相连的四个孔中,防止培养液蒸发,培养孔尽量放在24孔板中间位置,细胞培养孔1与HBSS放置孔2的位置如图1所示。
3.3将含培养孔的24孔板放入CO2培养箱中,确保设置培养箱参数为:温度37℃,CO2浓度5%,并确认实时参数满足:37℃±1℃,5%±0.5%CO2,并记录入箱时间。
4、配置扩增培养基
扩增培养基组成:取50mL PRIME-XV T Cell CDM培养基,含250IU/mL IL-2,15ng/mL IL-7,15ng/mL IL-15。
5、细胞载体感染与扩增
5.1Day1于Day0(细胞接种至24孔板中)操作结束后的24小时进行操作,取出24孔板。
5.2用1mL移液器混匀细胞悬液,取20μL细胞悬液计数。根据计数结果,调整细胞浓度至1×10
5.3Day2,于Day1操作结束后的24小时进行操作,取出24孔板。用1mL移液器混匀细胞悬液,取20μL细胞悬液计数。
5.4根据计数结果,补加扩增培养基,调整细胞浓度至0.5×10
5.5根据扩增培养基的体积按照表1方式选择对应的培养容器。
表1培养液体积及对应的培养容器规格
5.6Day3,于Day2操作结束后的24小时进行操作,取出培养容器。按上述5.3-5.5操作方式扩增细胞。
5.7Day4-Day9细胞扩增,每天操作同步骤5.6。
5.8Day10静置培养。
6、细胞收获和质量鉴定
6.1Day11,于Day10操作结束后的24小时进行操作,结束培养。混匀细胞,取样计数,测活率,计算活细胞总数和培养11天细胞扩增倍数,结果请参阅图8至图10,结果表明本发明实施例2的起始免疫细胞活化扩增体系能使起始免疫细胞快速扩增,扩增得到的细胞活率高,可达90%以上,细胞培养11天实现300倍的扩增。取5×10
1)调节性T细胞(Treg,Regulatory T cell):CD3
2)Car T细胞:CD3
6.2配制冻存液(5%DMSO+1%HSA)
取10mL CS10至1个洁净无菌50mL离心管中,取1mL20%浓度的HSA及9mL NS加至上述50mL离心管中,即得20mL 5%DMSO+1%HSA冻存液(细胞冷冻保护剂)。
6.3配置1%HSA的NS细胞洗涤液
取190mL NS至洁净无菌的250mL配液瓶中,10mLHSA至上述同一配液瓶中,吹打混匀,即配制成200mL 1%HSA的NS细胞洗涤液。
6.4离心6.1步骤取样后剩余的所有细胞悬液,离心条件:室温,400g,5min,升9降7。
6.5弃上清,用上述6.3步骤配制细胞洗涤液悬浮细胞,再次离心,离心条件:室温,400g,5min,升9降7。
6.6重复上述6.5洗涤步骤。
6.7弃上清。
6.8用上述6.1步骤配制的冻存液悬浮细胞,混匀细胞,取样计数,测活率。补加冻存液,调整细胞浓度至5×10
6.8对细胞进行程序降温。
6.9转移入液氮容器,即可长期保存,解冻后为可直接回输的免疫细胞制剂。
6.10 37℃解冻细胞,取样进行细胞计数,测活性,结果如图13所示,结果表明实施例2解冻后细胞的活率和活细胞回收率均大于85%。取5×10
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种起始免疫细胞活化扩增体系及其应用
- 一种起始免疫细胞活化扩增体系及其应用
