一种适用于微量眼内液样本cfDNA测序的核酸抽提方法
文献发布时间:2023-06-19 18:34:06
技术领域
本发明涉及生物检测技术领域,具体地说,涉及一种适用于微量眼内液样本cfDNA测序的核酸抽提方法。
背景技术
伪装综合征(masquerade syndrome)是指一系列具有眼内类炎症临床表现,但并非由葡萄膜免疫反应所导致的疾病。因伪装综合征的类炎症性眼内表现可广泛模拟葡萄膜炎(如玻璃体细胞、前房细胞等),其诊断一直是眼科学领域的难点之一。在伪装综合征中,又以肿瘤性伪装综合征在临床诊疗中更具重要性,因其早期准确诊断与及时治疗、改善预后密切相关。
以玻璃体视网膜淋巴瘤(vitreoretinal lymphoma,VRL)为例,VRL是伪装综合征的主要组成病种,是一种罕见的眼部恶性肿瘤,其中大多数是侵袭性B细胞淋巴瘤,通常为弥漫性大B细胞淋巴瘤(DLBCL)。VRL的诊断长期以来一直具有挑战性,一方面,VRL的临床表现极易与葡萄膜炎混淆;另一方面,VRL的诊断金标准为细胞病理学检查中发现恶性淋巴细胞,但其阳性率较低,仅47.5%-80%,其原因可包括①糖皮质激素误用、②玻璃体切割术损伤完整细胞结构、③淋巴瘤细胞极易坏死、④可获得的眼内液量有限(常不超过1ml),从而导致细胞病理学检查中无法观察到足够的完整细胞以供确诊。
近年来,各种新一代基因检测技术可从细胞遗传层面揭示肿瘤的发生与发展,从而实现肿瘤的分子诊断。游离DNA(cell-free DNA,cfDNA)测序技术,是通过检测各类由细胞所释放而游离于体液(如血液、尿液等)中的DNA片段,从而对免疫、凝血、衰老、癌变等各种生理病理现象进行分析的技术。其中,尤以肿瘤来源的cfDNA更受重视,被认为是一种新型的肿瘤分子标志物,文献(Soliman SE,Alhanafy AM,Habib M,Hagag M,IbrahemR.Serum CirculatingCell Free DNA as Potential Diagnostic and PrognosticBiomarker in NonSmall Cell Lung Cancer.Biochem Biophys Rep(2018)15:45–51.2018.06.002),(Osumi H,Shinozaki E,Yamaguchi K,Zembutsu H.Clinical Utilityof Circulating Tumor DNA for Colorectal Cancer.Cancer Sci(2019)110(4):1148–55.13972)报道了通过血液样本对不同种类实体肿瘤进行无创性早期诊断。相较于其他新一代基因测序技术(如全外显子测序、单细胞测序等),cfDNA测序技术对临床样本的处理流程简单,且不会额外消耗本应进行病理检查的样本,因此不会影响临床常规的病理学检查;同时,cfDNA测序所需样本更易于收集与储存,且可耐受样本稀释,因此具有从眼内液标本实现疑难疾病精确诊断的潜力。
然而在目前cfDNA的提取与检测中,由于cfDNA的浓度极低,因此目前主要应用在各类大体积体液中进行(如血液、尿液、腹腔积液、胸腔积液、肺泡灌洗液等),从而获取足够检测的DNA样本量,但眼内液样本往往体积较小,单次可获得的房水量约为100μl,单次可采集的玻璃体液量约为500-1000μl,且经常被眼内灌注液所稀释;此外,常见的肿瘤cfDNA长度通常在150-180bp(碱基对)范围内,常用的cfDNA捕获试剂盒往往针对这一类短链DNA进行捕获,但眼内液样本中常常还含有细胞坏死、玻璃体切割术所致机械性破裂所释放的长链DNA或基因组DNA,则会对短链cfDNA的捕获与测序文库建立(以下简称建库)产生较大影响,测序成功率较低,远无法达到临床应用的要求。
综上所述,cfDNA测序技术具有通过眼内液诊断疑难眼底病的潜力,但现有的cfDNA抽提、检测技术尚无法有效解决眼内液①样本量少、②长链DNA与基因组DNA较多的难题,因此,急需一种适用于微量眼内液样本cfDNA测序的核酸抽提方法。
发明内容
本发明的目的是,针对现有技术中的不足,提供一种适用于微量眼内液样本cfDNA测序的核酸抽提方法。
为实现上述目的,本发明采取的技术方案是:
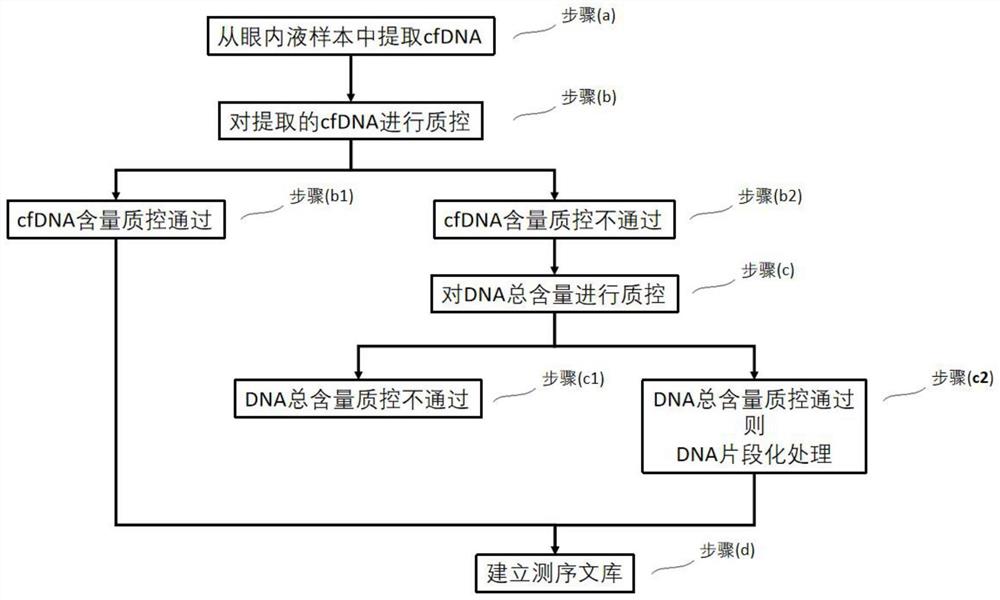
提供一种适用于微量眼内液样本cfDNA测序的核酸抽提方法,包括以下步骤:
(a)从眼内液提取cfDNA;
(b)对提取所得样本中的核酸进行质控;
(c)对质控不通过的样本进行DNA片段化处理;
(d)建立测序文库。
更优选的,所述步骤(c)中的片段化处理为步骤(b)中cfDNA含量不足10ng的样品,处理方法如下:
(c1)若总DNA<10ng,则认为样本所含总DNA不足,质控不通过。
(c2)若总DNA≥10ng、但cfDNA量<10ng,且有长链DNA或基因组DNA污染时,则需要进行DNA片段化处理。
更优选的,所述处理方法(c2)中DNA片段化处理采用的试剂盒为KAPAHyperPlusKit。
更优选的,所述的DNA片段化处理包括以下步骤:
(1)PCR管中配制反应体系;
(2)振荡混匀后,按预冷4℃5min、裂解37℃25-45min,维持4℃的程序进行片段化程序;
(3)纯化cfDNA。
更优选的,所述上述步骤(2)中的裂解时间为25min。
更优选的,所述上述步骤(3)中纯化cfDNA的方法为磁珠法。
更优选的,所述步骤(a)中从眼内液提取cfDNA包括如下步骤:
(a1)将样本在4℃下16000g离心10分钟,留取上清;
(a2)提取cfDNA。
更优选的,所述步骤(b)中的质控为测量其总DNA含量、150-180bp长度范围内的cfDNA含量,然后进行如下判断:
(b1)150-180bp范围内的cfDNA含量≥10ng,则直接进行建库。
(b2)150-180bp范围内的cfDNA含量<10ng,则还需进行优化。
更优选的,所述步骤(d)建立测序文库采用的试剂盒为QIAseq Ultralow inputLibrary Kit。
作为优选例,所述的样品包括稀释或未稀释的玻璃体、房水。
本发明的优点在于:
1、本发明中cfDNA测序方法是首次将KAPA HyperPlus Kit试剂盒应用于cfDNA样本。
2、其他常规测序的DNA裂解步骤后,直接进行后续建库,而本发明中因DNA样本来源为片段更小的cfDNA,因此裂解步骤完成后,新增了磁珠法纯化cfDNA的步骤,从而避免DNA裂解酶的过度裂解所导致的DNA样本损失。
3、本发明进行的改良方法可应用于微量眼内液标本从而获取足够DNA进行cfDNA测序检测,并使之可不受长链DNA与基因组DNA的影响。
附图说明
附图1为本方法的的技术流程图。
附图2为17,20,21,23,26样本的质控曲线、总DNA含量与初步质控结果。
附图3为27,28,29,30,31,32样本的质控曲线、总DNA含量与初步质控结果。
附图4为33,35,36,38,39,40样本的质控曲线、总DNA含量与初步质控结果。
附图5为41,42,43,44,45样本的质控曲线、总DNA含量与初步质控结果。
附图6为46,47,48,49,50样本的质控曲线、总DNA含量与初步质控结果。
附图7为51,52,53,54,55样本的质控曲线、总DNA含量与初步质控结果。
附图8为56,57,58,59,60样本的质控曲线、总DNA含量与初步质控结果。
附图9为61,62样本的质控曲线、总DNA含量与初步质控结果。
具体实施方式
作为一例优选例,下述实施例按照附图1中技术流程图中的步骤进行,其中(c2)为本发明的创新之处。下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
1材料与方法
1.1仪器与试剂
移液枪,(Eppendorf,德国);EP管,(Axygen,美国);超净台,(苏州净化设备工程有限公司,中国);恒温金属浴加热块,(上海培清科技有限公司,中国);低温高速离心机Centrifuge 5804R,(Eppendorf,德国);涡旋混合器Vortex-Genie 2,(ScientificIndustries,美国);电动吸引器7A-23D,(鱼跃,中国);QIAamp Circulating Nucleic AcidKit,(Qiagen,荷兰);Agilent 4200TapeStation,(Agilent Technologies,美国);QIAseqUltralow input Library Kit,(Qiagen,荷兰);KAPA HyperPlus Kit,(RocheSequencing,美国);AMPure XP Beads,(Beckman Coulter,美国);Agencourt SPRIPlateSuper Magnet Plate,(Beckman Coulter,美国)。
1.2实验方法
1.2.1从眼内液提取cfDNA
1.将样本在4℃下16000g离心10分钟,留取上清。
2.使用QIAamp Circulating Nucleic Acid Kit(Qiagen,Venlo,TheNetherlands)提取cfDNA(按1ml眼内液计)。
(1)按如下表格配制提取体系:
(2)振荡30秒混匀反应体系,于60摄氏度孵育30min。
(3)加入Buffer ACB 3.6mL,振荡15-30s。
(4)将混合体系于冰上孵育5min。
(5)将QIAamp Mini column与负压吸引系统连接,将上述混合体系加入QIAampMini column,打开负压泵,至所有液体被吸尽后关闭负压泵。
(6)将600μl的Buffer ACW1加入QIAamp Mini column。打开负压泵,将液体吸尽后关闭负压泵。
(7)将750μl的Buffer ACW2加入QIAamp Mini column。打开负压泵,将液体吸尽后关闭负压泵。
(8)将750μl的无水乙醇加入QIAamp Mini column。打开负压泵,将液体吸尽后关闭负压泵。将QIAamp Mini column自负压吸引系统取下。
(9)关闭QIAamp Mini column的盖子,将其放入2mL的收集管,20000g下离心3min。
(10)将QIAamp Mini column取下放入另一个新的2mL的收集管,打开盖子,于56℃孵育10min至吸附膜完全干燥。
(11)取下QIAamp Mini column放入另一个1.5mL洗脱管,加入20-150μl的BufferAVE至QIAamp Mini column的吸附膜上,关闭盖子室温孵育3min。
(12)20000g下离心1min洗脱所吸附的核酸。
1.2.2对抽提核酸样本进行质控
使用Agilent 4200 TapeStation(Agilent Technologies,Santa Clara,CA,USA)系统对提取的核酸样本进行质控,测量其总DNA含量、150-180bp范围内的cfDNA含量。如cfDNA含量超过10ng,则直接进行后续常规建库操作,此方法中以QIAseq Ultralow inputLibrary Kit为例。如质控测得cfDNA含量不足,则进行下述优化工作流程。
1.2.3对质控不通过样本进行DNA片段化处理
1.若总DNA<10ng,则认为样本所含总DNA不足,质控不通过。
2.若总DNA≥10ng、但cfDNA量<10ng,且有长链DNA或基因组DNA污染时,则使用KAPA HyperPlus Kit(Roche Sequencing,Pleasanton,CA,USA)按以下步骤进行DNA片段化处理。
(1)于PCR管中按如下表格配制反应体系:
(2)振荡混匀后,按预冷4℃5min、裂解37℃25min,维持4℃的程序进行片段化程序。
(3)反应完成后,加入90μl AMPure XP Beads(Beckman Coulter,Indianapolis,IN,USA),混匀后室温孵育5min。
(4)将含有反应体系的PCR管放于Agencourt SPRIPlate Super Magnet Plate(Beckman Coulter,Indianapolis,IN,USA)磁力板2min。
(5)吸除PCR管内上清,留存剩余的5μl上清。
(6)加入200μl 70%乙醇,室温孵育30s后吸除乙醇,重复2次。
(7)自Agencourt SPRIPlate Super Magnet Plate磁力板中取出PCR管,加入洗脱缓冲液冲洗混合10次,孵育2min。
(8)再次将PCR管放于Agencourt SPRIPlate Super Magnet Plate磁力板,孵育1min。
(9)将上清转移至新的PCR管,即为纯化的cfDNA样本。
1.2.4.建立测序文库
以QIAseq Ultralow input LibraryKit试剂盒建立测序文库。
1.末端补平(end-polishing)
(1)于PCR管中配置末端补平反应体系
(2)温和混匀后,按25℃30min、65℃15min、4℃维持的程序进行末端补平反应。
2.对DNA片段添加接头(adapter)
(1)于PCR管或预制孔板中配置反应体系
(2)混匀后按25℃10min、4℃维持的程序进行接头连接,完成后尽快进入下一步。
(3)向反应体系加入80μl AMPure XP Beads。
(4)混匀后室温孵育5min,将含有反应体系的PCR管放于Agencourt SPRIPlateSuper Magnet Plate磁力板5min。
(5)吸除PCR管内上清,留存剩余的5μl上清。
(6)加入200μl 70%乙醇,室温孵育30s后吸除乙醇,重复2次。
(7)在磁力板上孵育5-10min,将PCR管自磁力板上取下。
(8)加入洗脱缓冲液52.5μl并混合,孵育2min后,再次将PCR管放于AgencourtSPRIPlate Super Magnet Plate磁力板,孵育1min。
(9)将其中的50μl上清转移至新的PCR管,再加入50μl AMPure XP Beads。
(10)重复(4)至(7)步后,加入26μl洗脱缓冲液并混合,孵育2min后,再次将PCR管放于Agencourt SPRIPlate Super Magnet Plate磁力板,孵育1min。
(11)将其中的23.5μl上清转移至新的PCR管,即为文库DNA。
3.文库扩增
(1)按下表配置文库扩增体系,混匀
(2)按如下程序进行文库扩增
(3)向反应体系加入50μl AMPure XP Beads,重复上述2.(4)至2.(7)步骤。
(4)加入25μl洗脱缓冲液并混合,孵育2min后,再次将PCR管放于AgencourtSPRIPlate Super Magnet Plate磁力板孵育1min。
(5)将上清转移至新PCR管,即为扩增完成的文库,可供后续的文库质检、捕获、测序,或储存于-20℃。
2结果
2.1常规cfDNA抽提方法与改良cfDNA抽提方法对眼内液标本cfDNA测序成功率的影响
选取眼内液标本使用常规方法进行cfDNA抽提并进行质控与后续的建库、目标基因捕获、测序,记录其成功完成测序例数;对于常规cfDNA抽提后的质控失败样本,进行改良cfDNA抽提后尝试后续建库、目标基因捕获、测序,记录成功完成测序的例数。对比常规cfDNA抽提流程的测序成功率与改良cfDNA抽提流程的测序成功率的差异。结果表明,常规方法抽提cfDNA的62份眼内液样本中成功完成测序23例,成功率37.1%。测序失败样本中,30例为长链DNA或基因组DNA污染致建库风险无法进一步测序、9例为DNA总量低于10ng无法进行后续建库。将常规方法失败、且还有剩余样本共35例采用改良方法抽提cfDNA,最终成功完成测序29例,成功率82.9%。使用卡方检验对比两种方法总成功率,P<0.001,表明改良cfDNA方法具有更高的测序成功率,见表1。
表1:常规抽提法与改良抽提法行cfDNA测序成功例数对比
常规方法抽提后测序失败共39例,其中9例为DNA总量不足无法完成后续测序、30例为长链DNA或基因组DNA污染所致建库风险而未完成后续测序。Low:DNA总量不足;Risk:长链DNA、基因组DNA污染,风险较大不建议建库。详见附图1-8。
需要说明的是:①KAPA HyperPlus Kit试剂盒设计之初并无针对cfDNA测序的功能,本方法中首创将其中的DNA裂解试剂应用于cfDNA样本;②在进行DNA片段化处理中,振荡混匀后的条件为,预冷4℃5min、37℃裂解25分钟,25分钟的裂解时间是在我们前期工作中摸索获得的在眼部cfDNA样本中的最佳时间,而根据试剂盒操作手册,对常规人gDNA样本需要裂解45分钟才能达到cfDNA的长度水平。一般而言,裂解时间越长,片段越小。但裂解时间过长又会导致DNA过度降解以致DNA总量不足以进行后续测序,因此选取合适的裂解时间,在眼科微量标本中尤为重要;③其他常规测序的DNA裂解步骤后,直接进行后续建库,而本方法因DNA样本来源为片段更小的cfDNA,因此裂解步骤完成后,新增磁珠法纯化cfDNA的步骤(即实施例1中对质控不通过样本进行DNA片段化处理的步骤(3)至步骤(9)),从而避免DNA裂解酶的过度裂解所导致的DNA样本损失,此为本方法的另一个创新性改良步骤。
综上,本发明改良了现有的cfDNA抽提技术,并能应用于微量眼内液标本从而获取足够DNA进行测序检测。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 一种针对cfDNA的简化甲基化测序方法及应用
- 一种基于纳米孔对非天然核酸直接测序的错位测序方法
- 一种用于微量标记核酸样本检测和测序的样品制备方法
- 一种用于微量组织样本总RNA抽提的研钵
