对于各种适应症的生物利用度更佳的5-羟色氨酸(5-HTP)制剂
文献发布时间:2023-06-19 10:08:35
相关申请的引证
本申请要求2018年6月19日提交的美国临时专利申请序列号62/686,774的优先权和权益;通过引证将其公开内容以其整体并入本文。
技术领域
本发明涉及一种具有缓释(SR)特性的药物组合物。特别地,其涉及一种具有SR特性的含有治疗有效量5-羟色氨酸(5-HTP)的药物组合物。还进一步地,其涉及一种具有SR特性的胃滞留药物组合物。药物组合物可有效治疗从抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏症、帕金森氏症)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症中选择的病症(condition,病情,疾病,病况)。
背景技术
在本说明书中对显然是先前公开的文献的列举或讨论不一定应认为该文献是现有技术的一部分或是公知常识。
抑制血清素转运蛋白的药物,诸如选择性血清素再摄取抑制剂(SSRI)、血清素-去甲肾上腺素再摄取抑制剂(SNRI)和三环抗抑郁剂(TCA)类药物的某些成员等,当前用于治疗多种CNS障碍,包括抑郁症和焦虑症。例如,据信SSRI通过限制其重新吸收到突触前和突触后神经元中来增加神经递质血清素(也称为5-羟色胺,5-HT)的细胞外水平。这会增加可与突触后和突触前血清素受体结合的血清素水平。进而,据信这会引起神经生物学变化,随着时间的推移会产生治疗反应(例如参见Blier,Pierre,和Claude De Montigny."Currentadvances and trends in the treatment of depression."Trends in pharmacologicalsciences(1994),15(7):220-226.).
当前用于治疗CNS障碍的药物的替代品包括5-羟色氨酸(5-HTP)。5-HTP是血清素的直接前体。在初步研究中,据报道5-HTP对抑郁症(Turner,Erick H.,JenniferM.Loftis,和Aaron D.Blackwell."Serotonin a la carte:supplementation with theserotonin precursor 5-hydroxytryptophan."Pharmacology&therapeutics(2006),109(3):325-338.)和其它CNS适应症(Birdsall TC.“5-Hydroxytryptophan:a clinically-effective serotonin precursor.”Altern Med Rev.(1998),3(4):271-80.Review.PubMed PMID:9727088.)具有一定的临床疗效。5-HTP的消除半衰期为约1.5-2小时,这对于实际的临床使用而言太短,但与高剂量的外周脱羧酶抑制剂(例如卡比多巴或苄丝肼)联合施用时可以增加至长达四小时。参见美国专利号8,969,400。外周脱羧酶抑制剂抑制5-HTP转化为血清素,但仅在脑外,因为外围脱羧酶抑制剂无法穿越血脑屏障。但是,总的来说,由于5-HTP的血浆水平存在较大波动,因此5-HTP的药代动力学可能会限制5-HTP的速释制剂的用途,使得每日需要多次剂量和/或引起交替用药过量(导致副作用)和用药不足(导致治疗效果的间歇性丧失)的可能性(Jacobsen,Jacob PR,et al."Adjunctive 5-Hydroxytryptophan slow-release for treatment-resistant depression:clinicaland preclinical rationale."Trends in pharmacological sciences(2016),37(11):933-944)。如美国专利号8,969,400所述,速释制剂的5-HTP治疗也与某些患者中胃肠道不良事件相关。
因此,仍然需要5-HTP的另外的制剂,特别是5-HTP的另外的缓释制剂。
发明内容
本发明内容列出了本公开的主题的多个实施方式,并且在许多情况下列出了这些实施方式的变化和置换。本发明内容仅是众多不同实施方式的例示。对给定实施方式的一个或多个代表性特征的提及同样是示例性的。此类实施方式通常可以具有或不具有所提及的特征;同样地,不论在本发明内容中列出与否,这些特征可以应用于本公开主题的其它实施方式。为避免过多的重复,本发明内容未列出或建议此类特征的所有可能组合。
在一些实施方式中,本公开的主题提供了一种胃滞留缓释(SR)剂型,包含5-羟色氨酸(5-HTP)或其药学上可接受的盐或溶剂化物以及药学上可接受的载体和/或赋形剂,其中剂型对上胃肠道的释放速率为约2.5毫克每小时(mg/h)至约75mg/h,从而在稳态下提供的稳态血浆水平为约0.1毫克每升(mg/L)至约4mg/L。
在一些实施方式中,剂型至少包含在胃液存在下会溶胀的第一聚合物基体材料(matrix material,基质材料),从而提供可溶胀的剂型,其尺寸增大以促进该剂型在胃中的保留,任选地其中与该剂型的溶胀前体积相比,所述剂型在胃液存在下溶胀到至少约150%。在一些实施方式中,第一聚合物基体材料包含从由聚氧化乙烯氧化物(polyoxyethylene oxide,聚氧环氧乙烷,聚氧化环氧乙烷)、羟乙基纤维素、羧甲基纤维素、聚乙二醇二丙烯酸酯(PEGDA)、明胶、明胶-PEGDA共聚物、透明质酸、壳聚糖、羟丙基纤维素、羟丙基甲基纤维素、丙烯酸钠、以及它们的共聚物组成的组中选择的亲水性聚合物。在一些实施方式中,基于第一聚合物基体材料的重量,5-HTP或其药学上可接受的盐或溶剂化物以约1重量%(wt%)至约50wt%的量直接分散在第一聚合物基体材料中。
在一些实施方式中,剂型进一步包含:分散在第一聚合物基体材料中的多个微粒,其中每个所述微粒包含第二聚合物基体材料以及分散在该第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物,并且其中基于第一聚合物基体材料的重量,第一聚合物基体材料包含以约0wt%至约50wt%的量直接分散在该第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物。在一些实施方式中,第二聚合物基体材料包含:交联的聚合物基体材料,该交联的聚合物基体材料包含从由羟丙基甲基纤维素、羟丙基纤维素、透明质酸、壳聚糖、明胶、明胶-PEGDA、PEGDA和丙烯酸钠组成的组中选择的一种或多种亲水性聚合物;和/或非交联的聚合物基体材料,该非交联的聚合物基体材料包含从由壳聚糖、聚(环氧乙烷)、羟丙基纤维素和羟丙基甲基纤维素组成的组中选择的一种或多种亲水性聚合物。
在一些实施方式中,第一聚合物基体材料含有约5wt%至约50wt%的微粒。在一些实施方式中,基于微粒的重量,每个微粒包含约1wt%至约30wt%的5-HTP或其药学上可接受的盐或溶剂化物。
在一些实施方式中,剂型包含约50毫克(mg)至约1,800mg的5-HTP或其药学上可接受的盐或溶剂。在一些实施方式中,在口服施用的约4小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30重量%(wt%),任选地其中在口服施用约4至约9小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约50wt%。
在一些实施方式中,剂型进一步包含从由血清素增强化合物(serotonin-enhancing compound,血清素促进化合物)、外周脱羧酶抑制剂和气体溶胀剂组成的组中选择的一种或多种另外的药剂。在一些实施方式中,剂型适合于递送在约12小时的时间段内约1mg/h至约42mg/h 5-HTP的释放曲线(the dosage form is adapted to deliver arelease profile of between about 1mg/hr and about 42mg/hr of 5-HTP for aperiod of about 12hours,剂型适合于递送5-HTP约1mg/h至约42mg/h在约12小时的时间段内的释放谱),任选地其中该释放曲线基本上是线性的。在一些实施方式中,剂型向上胃肠道提供的释放速率为约6.25mg/h,以便提供约0.25mg/L的平均稳态5-HTP血浆水平。
在一些实施方式中,本公开的主题提供了一种治疗需要这种治疗的患者中的从由抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症组成的组中选择的病症的方法。在一些实施方式中,所述方法包括施用根据本公开主题的剂型。在一些实施方式中,剂型每日施用一次或两次。在一些实施方式中,剂型随餐一起施用。
在一些实施方式中,剂型每日施用一次或两次并且每日剂量中5-HTP的总量为约50mg至约3600mg。在一些实施方式中,剂型适于递送在约12小时的时间段内约4mg/h至约42mg/h的5-HTP释放曲线,任选地其中释放曲线基本上是线性的。在一些实施方式中,剂型的施用提供约0.1mg/L至约0.9mg/L的稳态5-HTP血浆水平。
在一些实施方式中,该方法进一步包括伴随施用(concomitant administration,同时施用)5-HTP吸收促进剂,以与在不使用吸收促进剂的情况下施用5-HTP时相比,使稳态5-HTP血浆水平增加约1倍至约4倍,任选地其中5-HTP吸收促进剂为外周脱羧酶抑制剂。
在一些实施方式中,提供了一种实现约0.1mg/L至1mg/L的稳态5-HTP血浆水平的方法。在一些实施方式中,该方法包括向上胃肠道施用约2.5mg/h至约25mg/h的5-HTP或其药学上可接受的盐或溶剂化物。在一些实施方式中,所述方法通过向上胃肠道施用约6.25mg/h的5-HTP或其药学上可接受的盐或溶剂化物来实现约0.25mg/L的稳态5-HTP血浆水平。
因此,本公开的主题的一个目的是提供5-HTP的胃滞留缓释制剂。
上面已经陈述了本公开主题的一个目的,并且通过本公开主题全部或部分地实现了该目的,当结合下文中最佳描述的附图和实施例进行描述时,其它目的将变得显而易见。
附图说明
为了使本公开易于理解并付诸实践,现在将参考参照附图说明的实施例。附图与说明书一起用于进一步说明本发明的实施方式并解释各种原理和优点。
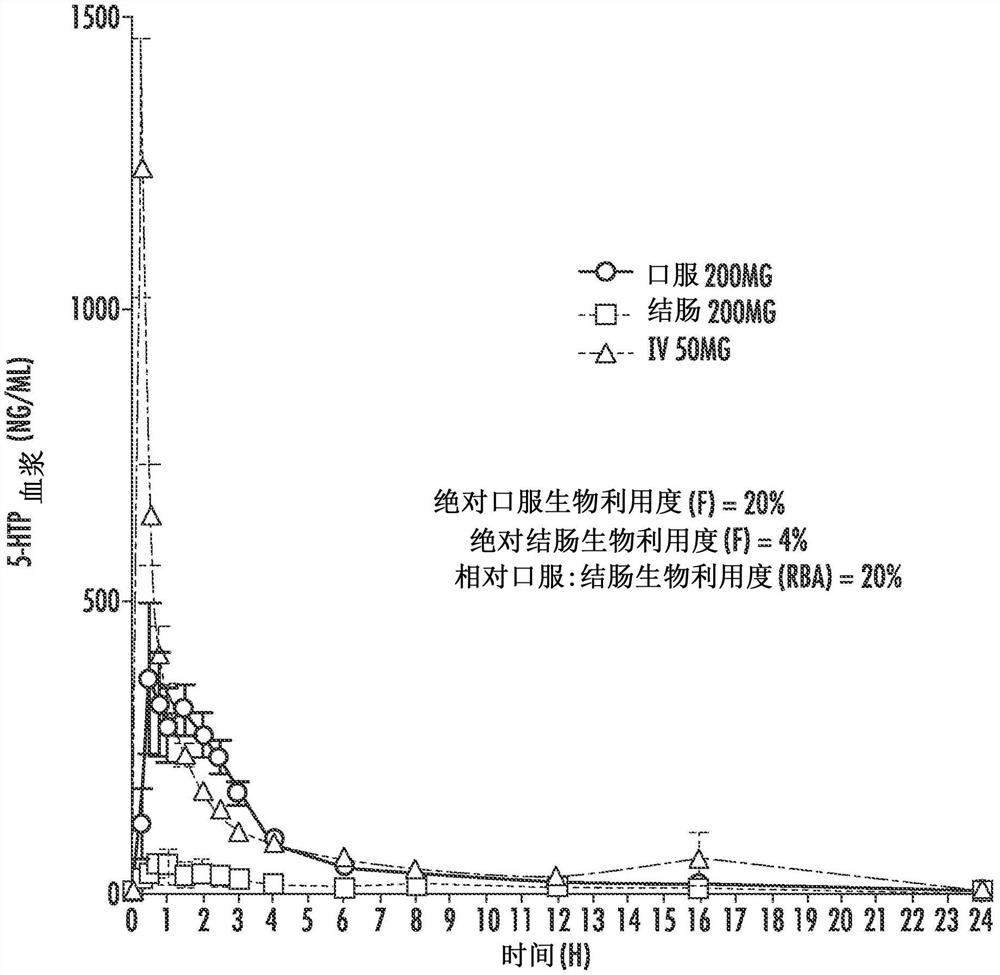
图1是人类志愿者口服(200毫克(mg),圆圈)、结肠(200mg,方形)和静脉内(IV,50mg,三角形)施用5-羟色氨酸(5-HTP)时,5-HTP的血浆浓度(单位:纳克每毫升(ng/ml))与时间(单位:小时(h))的图。
图2A是显示可以实现本公开主题的释放曲线的胃滞留缓释(SR)5-羟色氨酸(5-HTP)制剂进入胃的示意图。该制剂包含第一聚合物基体(椭圆形表示)与分散在第一聚合物基体内的微粒(圆圈)。微粒包含第二聚合物基体与分散于其中的5-HTP(“X”)。在一些实施方式中,外周脱羧酶抑制剂(例如卡比多巴或苄丝肼)也可以被包括在微粒和/或第一基体材料中以降低肠内5-HTP的降解并由此增强5-HTP的吸收和生物利用度。
图2B是显示针对图2A描述的制剂在胃中的胃液中经历溶胀以便该制剂变得太大而无法进入肠道的示意图。
图2C是显示针对图2A和2B描述的制剂示意图,其中微粒(圆圈)将5-羟色氨酸(5-HTP,“X”)释放到溶胀的第一基体材料(由椭圆表示)。
图2D是显示针对图2A-2C描述的制剂的示意图,其中5-羟色氨酸(5-HTP,“X”)和含5-HTP的微粒(圆圈)从溶胀的第一基体材料(由椭圆表示)扩散到胃的胃液中和上肠中。
图3A是显示可以实现本公开主题的释放曲线的胃滞留缓释(SR)5-羟色氨酸(5-HTP)制剂进入胃的示意图。该制剂包含第一聚合物基体(由椭圆表示)与分散于该第一聚合物基体中的微粒(圆圈)。微粒包含第二聚合物基体与分散于其中的5-HTP(“X”)。在一些实施方式中,也可以在微粒和/或第一基体材料中包括外周脱羧酶抑制剂(例如卡比多巴或苄丝肼)以减少5-HTP在肠内的降解并由此增强5-HTP的吸收和生物利用度。
图3B是显示针对图3A描述的制剂在胃中的胃液中经历溶胀以便该制剂变得过大而不能进入肠中的示意图。
图3C是示出针对图3A和3B描述的制剂的示意图,其中微粒(圆圈)将5-羟色氨酸(5-HTP,“X”)释放到第一基体材料(由椭圆表示)。
图3D是示出针对图3A-3C描述的制剂的示意图,其中5-羟色氨酸(5-HTP,“X”)从第一基体材料(由椭圆表示)扩散到胃中的胃液中和上肠,同时微粒保留在第一基体材料中。
图4A是示出本公开主题的胃滞留缓释(SR)5-羟色氨酸(5-HTP)制剂进入胃的示意图。制剂包含聚合物基体(由椭圆表示)与分散在该聚合物基体内的5-HTP(“X”)。在一些实施方式中,还可以在基体材料中包括外周脱羧酶抑制剂(例如卡比多巴或苄丝肼),以减少5-HTP在肠中的降解并由此增强5-HTP的吸收和生物利用度。
图4B是示出针对图4A描述的制剂在胃中的胃液中经历溶胀以便该制剂变得过大而无法进入肠中的示意图。
图4C是示出针对图4A和4B描述的制剂的示意图,其中5-羟色氨酸(5-HTP,“X”)在基体材料(由椭圆表示)中扩散。
图4D是示出针对图4A-4C描述的制剂的示意图,其中5-羟色氨酸(5-HTP,“X”)从基体材料(由椭圆表示)扩散到胃中的胃液中和上肠。
具体实施方式
现在将在下文中参考附图和实施例更全面地描述本公开的主题,其中示出了代表性的实施方式。然而,本公开的主题可以以不同的形式体现,并且不应被解释为限于本文阐述的实施方式。相反,提供这些实施方式以便本公开是透彻且完整的,并将向本领域技术人员充分传达实施方式的范围。
除非另有定义,否则本文中使用的所有技术和科学术语具有与当前描述的主题所属领域的普通技术人员通常所理解的相同含义。本文提及的所有出版物、专利申请、专利和其它参考文献通过引用整体并入本文。
尽管相信以下术语是本领域普通技术人员完全理解的,但是提出以下定义以促进对本公开的主题的解释。
根据长期的专利法惯例,当在包括权利要求在内的本申请中使用时,术语“一个”、“一种”和“该”指的是“一个或多个”。因此,例如,提及“一种药剂”或“一种聚合物”包括多种此类药剂或聚合物等等。
除非另有说明,否则在说明书和权利要求中使用的表示尺寸、反应条件等的量的所有数字在任何情况下均应理解为由术语“约”修饰。因此,除非有相反说明,否则本说明书和所附权利要求中列出的数字参数是近似值,其可以根据试图通过本公开的主题获得的期望特性而变化。
如本文所用,提及尺寸(即直径)、重量、浓度或百分比的值或量时的术语“约”意指涵盖在一个例子中指定量±20%或±10%的变化,在另一例子中指定量±5%的变化,在另一例子中指定量±1%的变化,且还在另一例子中指定量±0.1%的变化,因为此类变化适合于执行所公开的方法。
如本文所用,术语“和/或”在实体列表的上下文中使用时是指实体单独或组合存在。因此,例如,短语“A、B、C和/或D”包括单独的A、B、C和D,但也包括A、B、C和D的任何和所有组合和子组合。
与“包括”、“含有”或“特征在于”同义的术语“包含”是包含性或开放性的,并且不排除其它未列举的要素或方法步骤。“包含”是权利要求语言中使用的技术术语,这意味着提及的元素是必不可少的,但是可以添加其它元素,并且仍然构成权利要求范围内的构造。
如本文所用,短语“由…组成”不包括权利要求中未指定的任何要素、步骤或成分。当在权利要求的正文条款中出现短语“由…组成”而不是紧跟在前序之后时,它仅限制了该条款中列出的要素;权利要求整体上不排除其它要素。
如本文中所使用的,短语“基本上由…组成”将权利要求的范围限制为指定的材料或步骤,加上不实质上影响所要求保护的主题的基本和新特征的那些材料或步骤。
关于术语“包含”、“由…组成”和“基本上由…组成”,在本文中使用这三个术语中的一个时,本公开和要求保护的主题可以包括使用其它两个术语中的任一个。
如本文所用,术语“基体”表示其在制药领域中众所周知的含义,即提供溶胀或结构支撑的固体材料,其任选地掺入有活性成分。
在药代动力学中且如本文所用,“稳态”是指其中活性药物化合物的总体摄入与其消除基本处于动态平衡的情况。因此,化合物的平均血浆水平每天都保持相同,尽管可能会出现与剂量给药(dosing,剂量)相关的日内波动。实际上,对于大多数药物而言,在开始常规剂量给药后通常需要约4至约6个半衰期才能达到稳态。
上肠运输时间约为3-4小时(Hua S,Marks E,Schneider JJ,Keely S.“Advancesin oral nano-delivery systems for colon targeted drug delivery ininflammatory bowel disease:selective targeting to diseased versus healthytissue.”Nanomedicine.(2015),11(5):1117-32)。因此,在禁食状态下口服的常规固体剂型(例如标准片剂、胶囊剂、颗粒剂等)迅速通过胃并且通常在约3-4小时后到达结肠。因此,如果递送过程超过3小时,常规缓释(SR)技术(例如美国专利号7,670,619中描述的技术)需要在结肠中吸收活性化合物,以便在整个SR递送期内递送治疗有效剂量。
例如,美国专利号7,670,619描述了一种包含双层片剂的5-HTP SR制剂,一层含有用于快速释放的5-HTP(“快速”层)且另一层含有用于延迟释放的色氨酸或5-HTP(“延迟”层)。双层片剂的制造工艺要求为“快速”层和“延迟”层分别制备两种共混物,然后用适当的压片装置压片,以确保每一层的分离、完整性和释放特性。片剂可以很容易地通过胃,从而在上肠和下肠(结肠)中递送绝大部分的5-HTP,以在上肠和下肠中吸收。
然而,根据本公开主题的一个方面,已经首次证明,5-HTP在人体结肠中仅被最小吸收。参见图1和以下实施例1。更特别地,如图1和实施例1所描述的,5-HTP在人体的上肠中具有实质性的生物利用度(F=20%),而在结肠中则不是(F=4%)。该数据与小鼠中的发现相反,其中5-HTP在结肠中非常有效地被吸收(Jacobsen et al.,Neuropsychopharmacology(2016),41:2324–2334),并且这不能从以前发表的数据或教导中推断出来。因此,一方面,本公开的主题涉及适于SR至上胃肠(GI)道的5-HTP制剂,并且特别地涉及胃滞留SR制剂技术。本公开的主题进一步提供了用于治疗人类障碍的胃滞留5-HTP SR制剂。例如,本公开的主题提供了适合于在胃中保留数小时(例如长达约12小时)的剂型,并且其具有特定的5-HTP释放速率。因此,该剂型提供了在数小时(例如长达约12小时)的期间内向上GI道的特定5-HTP释放速率。
在一些实施方式中,本公开的主题提供了SR制剂(例如可溶胀的胃滞留SR制剂),其包含掺入在一个剂型中的两种或更多种单独的基体。在一些实施方式中,该制剂可以包含可溶胀的胃滞留基体,其包含另一基体材料的微粒。
与目前可用的剂型相反,本公开的剂型保留在胃中并且在胃和上胃肠道中递送大部分(例如80%或更多)的5-HTP和任选的其它掺入的活性成分,以便仅在上肠中吸收。
在一些实施方式中,本公开的主题提供了一种胃滞留SR剂型,包含5-HTP或其药学上可接受的盐或溶剂化物,其中:
5-HTP或其药学上可接受的盐或溶剂化物存在的量为约50至约1,000mg;
在口服施用的约3小时至约5小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30wt%;和
在口服施用的约8小时至约12小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至多达约100wt%。在一些实施方式中,剂型可以包含多于一种5-HTP的药学上可接受的盐和/或溶剂化物。
附加地或替代地,本公开的主题提供了一种胃滞留SR剂型,包含5-HTP或其药学上可接受的盐或溶剂化物以及药学上可接受的载体和/或赋形剂,其中剂型提供至上胃肠道的释放速率为约2.5mg/h至约25mg/h,以便提供约0.1mg/L至约1mg/L的稳态5-HTP血浆水平(例如剂型可以提供6.25mg/h至上胃肠道的释放速率,以便提供0.25mg/L的5-羟色氨酸血浆水平)。在一些实施方式中,药学上可接受的载体和/或赋形剂包含可溶胀的亲水性聚合物基体材料。
附加地或替代地,本公开的主题提供了一种胃滞留SR剂型,包含5-HTP或其药学上可接受的盐或溶剂化物以及药学上可接受的载体和/或赋形剂,其中剂型提供至上胃肠道的释放速率为约2.5mg/h至约75mg/h,以便提供约0.1mg/L至约3mg/L的稳态5-HTP血浆水平(例如剂型可以提供约6.25mg/h至上胃肠道的释放速率,以便提供约0.25mg/L的稳态5-HTP血浆水平;或至上胃肠道的释放速率为约12.5mg/h,以便提供约0.5mg/L的稳态5-HTP血浆水平)。在一些实施方式中,药学上可接受的载体和/或赋形剂包含可溶胀的亲水性聚合物基体材料。
因此,在本发明的第一方面,提供了一种包含5-HTP或其药学上可接受的盐或溶剂化物的胃滞留缓释(SR)剂型,其中:
5-HTP或其药学上可接受的盐或溶剂化物存在的量为约50至约1,000mg;
在口服施用的约3小时至约5小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30wt%;和
在口服施用的约8小时至约12小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至多达约100wt%。
在某些实施方式中:
(a)在口服施用的约4小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30wt%;和/或
(b)在口服施用的约4小时至约9小时内,诸如在口服施用的约4、5、6、7、8或9小时内,释放5-HTP或其药学上可接受的盐或溶剂化物的至少约50wt%;和/或
(c)在口服施用的约6小时至约12小时内,诸如在口服施用的约8小时至约12小时内(例如在口服施用的约8小时、约9小时或约10小时内),释放5-HTP或其药学上可接受的盐或溶剂化物的至少约80wt%。
在本发明的第二方面,提供了一种包含5-HTP或其药学上可接受的盐或溶剂化物以及药学上可接受的载体和/或赋形剂的剂型,其中剂型提供向上胃肠(GI)道的5-HTP的释放速率为约2.5mg/h至约75mg/h,以便提供约0.1mg/L至约4mg/L的稳态5-HTP血浆水平。在一些实施方式中,向上GI的释放速率是相对线性的(即其中在长达约6、7、8、9、10、11或约12小时或更长的时间内每小时释放约相同量的5-HTP)。在一些实施方式中,剂型提供约0.1mg/L至约3mg/mL的稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约2.5mg/h至约25mg/h(例如约2.5、约5.0、约7.5、约10、约12.5、约15、约20或约25mg/h),从而提供约0.1mg/L至约1mg/L(例如约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或约1.0mg/L)的稳态5-HTP血浆水平。
更特别地,在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约2.5mg/h,从而提供约0.10mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约5.0mg/h,从而提供约0.20mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约7.5mg/h,从而提供约0.30mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约10mg/h,从而提供约0.40mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约12.5mg/h,从而提供约0.50mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约15mg/h,从而提供约0.60mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约17.5mg/h,从而提供约0.70mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约20mg/h,从而提供约0.80mg/L的平均稳态5-HTP血浆水平。在一些实施方式中,剂型提供向上GI道的5-HTP的释放速率为约22.5mg/h,从而提供约0.90mg/L的平均稳态5-HTP血浆水平。
在一些实施方式中,与在不使用吸收促进剂的情况下施用5-HTP时相比,通过伴随施用5-HTP吸收促进剂,稳态5-HTP血浆水平增加了约1倍。在一些实施方式中,与在不使用吸收促进剂的情况下施用5-HTP时相比,通过伴随施用5-HTP吸收促进剂,稳态5-HTP血浆水平增加了约2倍。在一些实施方式中,与在不使用吸收促进剂的情况下施用5-HTP时相比,通过伴随施用5-HTP吸收促进剂,稳态5-HTP血浆水平增加了约3倍。在一些实施方式中,与在不使用吸收促进剂的情况下施用5-HTP时相比,通过伴随施用5-HTP吸收促进剂,稳态5-HTP血浆水平增加了约4倍。因此,在一些实施方式中,剂型包含5-HTP吸收促进剂。在一些实施方式中,5-HTP吸收促进剂是外周脱羧酶抑制剂(例如卡比多巴或苄丝肼)。
在一些实施方式中,剂型至少包含第一聚合物基体材料。在一些实施方式中,第一聚合物基体材料可以在水溶液(例如水和/或胃液)中溶胀,由此提供可溶胀的剂型,其增加尺寸以促进在胃中保留剂型。在一些实施方式中,剂型在胃液存在下溶胀至该剂型溶胀前体积的至少约150%。在一些实施方式中,剂型在胃液存在下溶胀至该剂型溶胀前体积的至少约200%。在一些实施方式中,剂型在胃液存在下溶胀至该剂型溶胀前体积的至少约250%。在一些实施方式中,剂型在胃液存在下溶胀至该剂型溶胀前体积的至少约300%。在一些实施方式中,第一聚合物基体材料包含亲水性聚合物。在一些实施方式中,亲水性聚合物选自聚氧化乙烯氧化物、羟乙基纤维素、羧甲基纤维素、聚乙二醇二丙烯酸酯(PEGDA)、明胶、明胶-PEGDA共聚物、透明质酸、壳聚糖、羟丙基纤维素、羟丙基甲基纤维素、丙烯酸钠、以及它们的共聚物。在一些实施方式中,第一亲水性聚合物基体材料是交联的。在一些实施方式中,第一亲水性聚合物基体材料是非交联的。
在一些实施方式中,5-HTP或其药学上可接受的盐或溶剂化物直接分散在第一聚合物基体材料中。在一些实施方式中,基于第一聚合物基体材料的重量,5-HTP或其药学上可接受的盐或溶剂化物以约1重量%(wt%)至约50wt%的量直接分散在第一聚合物基体材料中。
在一些实施方式中,剂型进一步包含分散在第一聚合物基体材料中的多个微粒。在一些实施方式中,多个微粒中的每一个包含第二聚合物基体材料(例如包含亲水性聚合物,该亲水性聚合物可以与第一基体材料的亲水性聚合物相同或不同)。在一些实施方式中,每个微粒进一步包含5-HTP或其药学上可接受的盐或溶剂化物。当剂型进一步包括含有5-HTP或其药学上可接受的盐或溶剂化物的微粒时,基于第一聚合物基体材料的重量,直接分散在第一基体材料中的5-HTP或其药学上可接受的盐或溶剂化物的量可以为约0wt%至约50wt%。
在一些实施方式中,第二聚合物基体材料包含交联的聚合物基体材料和/或非交联的聚合物基体材料。在一些实施方式中,交联的聚合物基体材料包含从包括羟丙基甲基纤维素、羟丙基纤维素、透明质酸、壳聚糖、明胶、明胶-PEGDA、PEGDA和丙烯酸钠的组中选择的一种或多种亲水性聚合物。在一些实施方式中,非交联的聚合物基体材料包含从包括壳聚糖、聚(环氧乙烷)、羟丙基纤维素和羟丙基甲基纤维素的组中选择的一种或多种亲水性聚合物。
在一些实施方式中,第一聚合物基体材料含有约5wt%至约50wt%的微粒(即与第一聚合物基体材料的重量相比)。在一些实施方式中,基于微粒的重量,每个微粒包含约1wt%至约30wt%的5-HTP或其药学上可接受的盐或溶剂化物。
在一些实施方式中,剂型包含约50mg至约1,800mg的5-HTP或其药学上可接受的盐或溶剂。在一些实施方式中,在口服施用约4小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30wt%。在一些实施方式中,在口服施用约4至约9小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至少约50wt%。
在一些实施方式中,剂型进一步包含另外的活性剂。在一些实施方式中,另外的活性剂是包括血清素增强化合物、外周脱羧酶抑制剂(例如卡比多巴或苄丝肼)和气体溶胀剂的组中的一种或多种。在一些实施方式中,另外的活性剂(例如外周脱羧酶抑制剂)存在于分散在第一聚合物基体材料内的一个或多个微粒中(单独或与5-HTP一起)。
在一些实施方式中,剂型适于递送在约12小时的时间段内约1mg/h至约42mg/h 5-HTP的5-HTP释放曲线。在一些实施方式中,释放曲线基本上是线性的。在一些实施方式中,剂型提供向上胃肠道的释放速率(例如具有线性释放曲线)为约6.25mg/h,从而提供约0.25mg/L的平均稳态5-HTP血浆水平。
在本发明的第三方面,提供了一种治疗从包括抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的组中选择的病症的方法,该方法包括向有需要的患者施用如本发明第一和/或第二方面所述的5-HTP的胃滞留和SR剂型。在一些实施方式中,剂型每日施用一次或两次。在一些实施方式中,剂型随餐施用。在一些实施方式中,剂型每日施用一次或两次并且每日剂量中5-HTP的总量为约50mg至约3,600mg。
在一些实施方式中,剂型适于递送在约12小时的时间内约4mg/h至约42mg/h 5-HTP(例如至上GI)的释放曲线(例如线性释放曲线)。在一些实施方式中,剂型的施用实现约0.1mg/L至约0.9mg/L的稳态5-HTP血浆水平。在一些实施方式中,所述方法进一步包括伴随施用5-HTP吸收促进剂,以与在不使用吸收促进剂的情况下施用5-HTP时相比,将稳态5-HTP增加约1倍至约4倍。在一些实施方式中,5-HTP吸收促进剂是外周脱羧酶抑制剂,例如卡比多巴或苄丝肼。
在本发明的第四方面,提供了一种如本发明第一和/或第二方面所述的剂型,其用于治疗需要这种治疗的患者中的从包括抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的组中选择的病症。
在本发明的第五方面,提供了如本发明第一和/或第二方面的剂型在制备用于治疗需要这种治疗的患者的病症的药物中的用途,该病症选自包括抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的组。
根据本发明的第六方面,提供了一种实现约0.1mg/L至约4mg/L的稳态5-HTP血浆水平的方法,其通过以约2.5mg/h至约75mg/h的释放速率向上GI施用5-HTP或其药学上可接受的盐或溶剂化物。在一些实施方式中,稳态5-HTP血浆水平为约0.1mg/L至约3mg/L。
根据本发明的第七方面,提供了一种实现约0.1mg/L至约1mg/L的5-HTP稳态血浆水平的方法,其通过以约2.5mg/h至约25mg/h的释放速率向上GI施用5-HTP或其药学上可接受的盐或溶剂化物。在一些实施方式中,该方法通过以约6.25mg/h的释放速率向上GI施用5-HTP或其药学上可接受的盐或溶剂化物,实现约0.25mg/L的稳态5-HTP血浆水平。
根据本发明的第八方面,提供了一种实现约0.2mg/L至约2mg/L的5-HTP稳态血浆水平的方法,其通过以约2.5mg/h至约25mg/h的5-HTP释放速率向上GI道施用5-HTP和外周脱羧酶抑制剂,该外周脱羧酶抑制剂将5-HTP生物利用度增加约1倍(至F=40%)。
根据本发明的第九方面,提供了一种实现约0.3mg/L至约3mg/L的5-HTP稳态血浆水平的方法,其通过以约2.5mg/h至约25mg/h的5-HTP释放速率向上GI道施用5-HTP和外周脱羧酶抑制剂,该外周脱羧酶抑制剂将5-HTP生物利用度增强约2倍(至F=60%)。
根据本发明的第十方面,提供了一种实现约0.4mg/L至约4mg/L的5-HTP稳态血浆水平的方法,其通过以约2.5mg/h至约25mg/h的5-HTP释放速率向上GI道施用5-HTP和外周脱羧酶抑制剂,该外周脱羧酶抑制剂将5-HTP生物利用度增强约3倍(至F=80%)。
根据本发明的第十一方面,提供了一种用于向上Gl道递送5-HTP和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂)的胃滞留SR药物组合物(例如剂型),所述组合物包含:
(a)第一亲水性可溶胀的聚合物基体材料;和
(b)直接分散于第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分,其中基于第一聚合物基体材料的重量,5-HTP(或其药学上可接受的盐或溶剂化物)的量为约1wt%至约50wt%。
根据本发明的第十二方面,提供了一种用于向上胃肠道递送5-HTP和任选的其它活性成分的胃滞留SR药物组合物,包含:
(a)第一亲水性可溶胀的聚合物基体材料;
(b)直接分散在第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中基于第一聚合物基体材料的重量,5-HTP(或其药学活性盐或溶剂化物)的量为约0wt%至约50wt%(例如约1wt%至约50wt%);和
(c)分散在所述第一聚合物基体材料中的多个微粒,所述微粒的每一个包含第二聚合物基体材料和一定量分散于该第二聚合物基体材料内的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中:
第一和第二聚合物基体材料均包含可溶胀的且交联的聚合物基体材料。
根据本发明的第十三个方面,提供了一种向上胃肠道递送5-HTP和任选的其它活性成分的胃滞留SR药物组合物,包含:
(a)第一亲水性可溶胀的聚合物基体材料;
(b)直接分散在第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中基于第一聚合物基体材料的重量,5-HTP(或其药学上可接受的盐或溶剂化物)的量为约0wt%至约50wt%(例如约1wt%至约50wt%);和
(c)分散在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散在第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中:
第一和第二聚合物基体材料均为可溶胀的未交联的聚合物基体材料。
根据本发明的第十四方面,提供了一种用于向上胃肠道递送5-HTP和任选的其它活性成分的胃滞留SR药物组合物,包含:
(a)第一聚合物基体材料;
(b)直接分散在第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中基于第一聚合物基体材料的重量,5-HTP(或其药学上可接受的盐或溶剂化物)的量为约0wt%至约50wt%(例如约1wt%至约50wt%);和
(c)分散在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散于该第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中:
第一聚合物基体材料是可溶胀的并且第二聚合物基体材料通过扩散到第一聚合物基体中来释放5-HTP或其药学上可接受的盐或溶剂化物以及任何其它任选的活性成分。
根据本发明的第十五方面,提供了一种用于向上胃肠道递送5-HTP和任选的其它活性成分的胃滞留SR药物组合物,包含:
(a)第一聚合物基体材料;
(b)直接分散在第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中基于第一聚合物基体材料的重量,5-HTP(或其药学上可接受的盐或溶剂化物)的量为约0wt%至约50wt%(例如约1wt%至约50wt%);和
(c)设置在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散在第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中:
第一聚合物基体材料是可溶胀的并且第二聚合物基体材料主要通过侵蚀进入第一聚合物基体而释放5-HTP或其药学上可接受的盐或溶剂化物和任何其它任选的活性成分。
根据本发明的第十六方面,提供了一种用于向上胃肠道递送5-HTP和任选的其它活性成分的胃滞留SR药物组合物,包含:
(a)第一聚合物基体材料;
(b)直接分散于第一聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中基于第一聚合物基体材料的重量,5-HTP或其药学上可接受的盐或溶剂化物的量为约0wt%至约50wt%(例如约1wt%至约50wt%);和
(c)设置在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散在第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物和任选的其它活性成分(例如血清素增强化合物和/或外周脱羧酶抑制剂),其中:
第一聚合物基体材料是可溶胀的并且第二聚合物基体材料呈现为微粒,该微粒在胃滞留药物递送期间基本上保持分散在第一聚合物基体中。
可以提及的药学上可接受的盐包括酸加成盐和碱加成盐。这些盐可以通过常规方法形成,例如通过任选地在溶剂中或在盐不溶的介质中使游离酸或游离碱形式的化合物与一种或多种当量的适当酸或碱反应,随后使用标准技术(例如真空、冷冻干燥或过滤)除去所述溶剂或所述介质。也可以通过例如使用合适的离子交换树脂通过将盐形式化合物的抗衡离子与另一抗衡离子交换来制备盐。
药学上可接受的盐的实例包括衍生自矿物酸和有机酸的酸加成盐,以及衍生自诸如钠、镁或优选钾和钙等金属的盐。
酸加成盐的实例包括用乙酸、2,2-二氯乙酸、己二酸、藻酸、芳基磺酸(例如苯磺酸、萘-2-磺酸、萘-1,5-二磺酸和对甲苯磺酸)、抗坏血酸(例如L-抗坏血酸)、L-天冬氨酸、苯甲酸、4-乙酰氨基苯甲酸、丁酸、(+)樟脑酸、樟脑磺酸、(+)-(1S)-樟脑-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳糖酸、龙胆酸、葡庚糖酸、葡萄糖酸(例如D-葡萄糖酸)、葡萄糖醛酸(例如D-葡萄糖醛酸)、谷氨酸(例如L-谷氨酸)、α-氧代戊二酸、乙醇酸、马尿酸、氢溴酸、盐酸、氢碘酸、羟乙基磺酸、乳酸(例如(+)-L-乳酸和(±)-DL-乳酸)、乳糖酸、马来酸,苹果酸(例如(-)-L-苹果酸)、丙二酸、(±)-DL-扁桃酸、偏磷酸、甲磺酸、1-羟基-2-萘甲酸、烟碱酸、硝酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、磷酸、丙酸、L-焦谷氨酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、鞣酸、酒石酸(例如(+)-L-酒石酸)、硫氰酸、十一碳烯酸和戊酸形成的酸加成盐。
盐的特定例子是由诸如盐酸、氢溴酸、磷酸、偏磷酸、硝酸和硫酸等矿物酸衍生的盐;由诸如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡萄糖酸、琥珀酸、芳基磺酸等有机酸衍生的盐;和由诸如纳、镁或优选的钾和钙等金属衍生的盐。
如上所述,还涵盖5-HTP的任何溶剂化物以及以下提及的其它化合物(例如在组合疗法中使用)和它们的盐。优选的溶剂化物是通过将无毒的药学上可接受的溶剂(以下称为溶剂化溶剂)的分子掺入本文提及的化合物的固态结构(例如晶体结构)中而形成的溶剂化物。此类溶剂的例子包括水、醇(诸如乙醇、异丙醇和丁醇)和二甲基亚砜。可通过用溶剂或含有溶剂化溶剂的溶剂混合物重结晶本发明的化合物来制备溶剂化物。在任何给定的情况下,可以通过使用众所周知的标准技术(诸如热重分析(TGE)、差示扫描量热法(DSC)和X射线晶体学)对化合物的晶体进行分析来确定是否形成溶剂化物。
溶剂化物可以是化学计量的或非化学计量的溶剂化物。溶剂化物可以是水合物,并且水合物的实例包括半水合物、一水合物和二水合物。
有关溶剂化物及其制备和表征方法的更详细讨论,参见美国印第安纳州西拉斐特SSCI,Inc.出版的Bryn et al.,Solid-State Chemistry of Drugs,第二版,1999,ISBN 0-967-06710-3。
尽管在上文中没有明确提及,但是可以理解的是,活性药物成分通常将作为与药学上可接受的佐剂、稀释剂或载体混合使用的药物制剂施用,所述佐剂、稀释剂或载体可以适当考虑预期的施用途径和标准药物实践来选择。此类药学上可接受的载体在化学上对活性化合物是惰性的,并且在使用条件下可以没有有害的副作用或毒性。适合的药物制剂可以在例如Remington The Science and Practice of Pharmacy,19th ed.,Mack PrintingCompany,Easton,Pennsylvania(1995)中找到。例如,诸如片剂或胶囊剂等固体口服组合物可以含有1至99%(w/w)活性成分;0至99%(w/w)稀释剂或填料;0至20%(w/w)崩解剂;0至5%(w/w)润滑剂;0至5%(w/w)助流剂;0至50%(w/w)制粒剂或粘合剂;0至5%(w/w)抗氧化剂;和0至5%(w/w)颜料。SR片剂还可以含有0至90%(w/w)控释聚合物(例如可溶胀的聚合物)。SR片剂还可以附加含有0至90%(w/w)或更多的控释聚合物(例如可溶胀的聚合物)或不同聚合物的混合物。控释片剂还可以附加含有0至90%(w/w)微粒形式的控释基体。
此外,本文提及的制剂还可以含有血清素增强化合物和/或过量用于盐的富马酸或马来酸或上述其它酸,或为增强5-HTP生物利用度,含有外周脱羧酶抑制剂及其盐和溶剂化物。应当理解的是,此处的盐和溶剂化物如上文所定义。
适合使用的血清素增强化合物(及其盐和溶剂化物)包括选择性血清素再摄取抑制剂(SSRI)、血清素-去甲肾上腺素再摄取抑制剂(SNRI)、三环抗抑郁剂(TCA)、非典型抗抑郁剂和单胺氧化酶抑制剂(MAOI)。可在本发明的实施方式中提及的血清素增强化合物的例子包括但不限于西酞普兰、依他普仑、氟西汀、氟伏沙明、帕罗西汀、舍曲林、文拉法辛、度洛西汀、维拉唑酮、沃替西汀、吗氯贝胺、反苯环丙胺、曲唑酮、奈法唑酮、米安色林、米氮平和苯乙肼。
本文中可以提及的外周脱羧酶抑制剂(及其盐和溶剂化物)包括但不限于卡比多巴、苄丝肼(Ro-4-4602)、二氟甲基多巴和α-甲基多巴。例如,如果将卡比多巴与5-HTP组合使用,则抑制了外周中芳香族L-氨基酸脱羧酶(DOPA脱羧酶或DDC)导致的5-HTP分解,并且同时增加了5-HTP的口服生物利用度。芳香族L-氨基酸脱羧酶是一种通常在远低于饱和状态下起作用的高容量酶(Jacobsen,Jacob PR,et al."Adjunctive5-Hydroxytryptophanslow-release for treatment-resistant depression:clinical and preclinicalrationale."Trends in pharmacological sciences(2016),37(11):933-944)。因此,在较低的口服剂量下,外周脱羧酶抑制剂可能仅在肠内局部达到药理活性浓度,并因此将主要或仅增强5-HTP的生物利用度,对全身循环和非胃周围器官中芳香族-L-氨基酸脱羧酶的5-HTP代谢具有适度、轻微或无影响。当与5-HTP同时口服施用时,外周脱羧酶充当5-HTP吸收促进剂,即增强5-HTP的生物利用度。对于给定单位剂量的5-HTP,本领域已知外周脱羧酶可以增强5-HTP生物利用度(Gijsman HJ,van Gerven JM,de Kam ML,Schoemaker RC,Pieters MS,Weemaes M,de Rijk R,van der Post J,Cohen AF.“Placebo-controlledcomparison of three dose-regimens of 5-hydroxytryptophan challenge test inhealthy volunteers.”J Clin Psychopharmacol.(2002),22(2):183-9.PubMed PMID:11910264;Westenberg HG,Gerritsen TW,Meijer BA,van Praag HM.“Kinetics of l-5-hydroxytryptophan in healthy subjects.”Psychiatry Res.(1982),7(3):373-85.PubMed PMID:6187038)。5-HTP和外周脱羧酶抑制剂共同施用可以提高血浆5-HTP水平(例如一倍至在某些情况下的约十五倍),意味着可以减小剂型中所需的5-HTP的量。典型地,与高剂量具有全身活性的卡比多巴共同施用,可使5-HTP的半衰期从约2小时延长加倍到约4小时。在较低的剂量下,外周脱羧酶抑制剂可能主要增强5-HTP的生物利用度,而在较高剂量下,例如约150mg/日(Gijsman HJ,van Gerven JM,de Kam ML,Schoemaker RC,Pieters MS,Weemaes M,de Rijk R,van der Post J,Cohen AF.“Placebo-controlledcomparison of three dose-regimens of5-hydroxytryptophan challenge test inhealthy volunteers.”J Clin Psychopharmacol.(2002),22(2):183-9.PubMed PMID:11910264),5-HTP的生物利用度和半衰期都将得到提高。5-HTP容易越过血脑屏障。因此,血浆5-HTP水平升高可导致中枢神经系统(CNS)中可用于CNS中血清素合成的5-HTP增加。确实,动物和人体研究表明,血浆5-HTP的水平升高会导致CNS血清素水平升高(参见Jacobsenet al.,Neuropsychopharmacology(2016)41:2324–2334)。外周脱羧酶抑制剂不会越过血脑屏障。因此,与5-HTP共同施用外周脱羧酶抑制剂在外周抑制5-HTP向血清素的转化,允许更多的5-HTP进入CNS,导致CNS中血清素的合成和水平增加。
当用作剂型的一部分时,血清素增强化合物和外周脱羧酶抑制剂可以简单地掺入到与5-羟色氨酸相同的剂型隔室中,或者它们可以以不同的方式分布到剂型中。例如,血清素增强化合物和外周脱羧酶抑制剂化合物可以掺入同一基体、单独的隔室、单独的基体、单独的层或颗粒、微粒、包衣颗粒、包衣中,和/或作为散粉、颗粒或固体子剂型并入到胶囊中。
隔室可以是通过连接层结合在一起的不同口服子剂型。隔室也可以是微粒与基体、具有不同活性药物成分的微粒等。例如,子剂型可以包含不同的活性药物化合物,和/或提供不同的释放速率,其组合以提供剂型的总体释放速率。隔室也可以是不同的微粒,例如包含不同的活性药物化合物,和/或提供不同的释放速率,其组合以提供剂型的总体释放速率。不同的隔室可以具有不同组成的聚合物和其它赋形剂,以容纳不同的活性药物化合物,从而为不同的化合物提供相似的释放速率,和/或为相同的化合物提供不同的释放速率。
掺入剂型的上述化合物的量可以标准临床实践中使用的范围进行选择,或者根据治疗需要可以更高或更低。另外,这些化合物可以作为单独的剂型与5-HTP胃滞留SR制剂剂型一起施用,包括但不限于作为试剂盒。血清素增强化合物和外周脱羧酶抑制剂可以单独或一起与如前所述的5-HTP胃滞留制剂剂型合并或使用。例如,5-HTP胃滞留制剂剂量可以将一种或多种血清素增强化合物、一种或多种外周脱羧酶抑制剂、或两种类型的化合物与5-HTP一起合并,要么与5-HTP胃滞留制剂剂型整合,要么各自分开,要么作为试剂盒。
如上所述,本文关于本发明第一至第十六方面所述的剂型包含5-HTP或其药学上可接受的盐或溶剂化物。除非本文另有说明,5-HTP的重量是5-HTP的游离碱的重量。因此,可以使用的任何盐或溶剂化物将具有更高的质量值。在下文所述的本发明的实施方式中,5-HTP存在的量可以便利地为约50mg至约1000mg,诸如约50mg至约150mg,诸如约200mg至400mg,诸如约300mg至约700mg,诸如约400至约500mg,或诸如约700至约1,000mg。在一些实施方式中,代替或除了5-HTP或其药学上可接受的盐或溶剂化物之外,可以包括除了药学上可接受的盐和溶剂化物之外的5-HTP的类似物。例如,在一些实施方式中,类似物是氘化5-HTP。在一些实施方式中,类似物是5-HTP的前药。
如上所述,诸如在本文公开的本发明的第一至第十六方面(及它们的实施方式)等中本文公开的剂量制剂用于在延长的一段时间内释放5-HTP(或其药学活性盐或溶剂化物)。例如,制剂显示如下的释放曲线,其中:
在口服施用约3小时至约5小时内(例如在约4小时内)释放5-HTP或其药学上可接受的盐或溶剂化物的至少约30wt%;和
在口服施用约8小时至约12小时内释放5-HTP或其药学上可接受的盐或溶剂化物的至多达约100wt%。在一些实施方式中,在口服施用约6小时至约10小时内(例如口服施用约6、7、8、9或10小时内)释放5-HTP或其药学上可接受的盐或溶剂化物的至少约80wt%。
在本发明的特定实施方式中,诸如但不限于涉及本发明的第一和第三至第十六方面,剂型可适于递送(deliver,提供)在约12小时的时间段内约1mg/h至约42mg/h 5-HTP释放曲线。例如,剂型可适用在12小时的时间段内递送约4mg/h至约42mg/h 5-HTP的释放曲线(release profile,释放谱)。在某些实施方式中,5-HTP的释放曲线可以基本上是线性的。为了避免疑问,本文中提及的“基本上线性的”可以指体内和更具体地指体外释放曲线测试和/或测量。
有许多可能的剂型可以提供上述期望的释放曲线,下面将对这些剂型进行更详细的讨论。
本文公开的可溶胀的剂型体系使用FDA非活性成分列表上通常被认为是安全的(GRAS)材料或赋形剂。
在一些实施方式中,剂型可以包含至少一种聚合物基体材料,其包含亲水性聚合物,该亲水性聚合物向受试者施用后(例如在进食状态下)溶胀至促进将胃滞留SR剂型的剂型在胃内滞留的程度。5-HTP(或其盐或溶剂)可以作为单一颗粒(即5-HTP的整体颗粒)或更特别地作为多个固体颗粒(例如与合适的赋形剂等组合)分散在聚合物基体材料中。
例如,亲水性聚合物与胃液接触可以溶胀至使得剂型太大而无法穿过幽门括约肌的程度,由此将片剂保留在胃中延长的一段时间,诸如长达约12小时。在这段时间期间,5-HTP通过聚合物的扩散和/或侵蚀而缓慢释放,并由此5-HTP和任何共同掺入的活性成分(例如外周脱羧酶抑制剂和/或血清素增强化合物)被逐渐地释放至患者的胃、十二指肠和小肠(即上GI道)。当在剂型中包括外周脱羧酶抑制剂、血清素增强化合物或其它活性成分时,其可以存在于与5-HTP(或其盐或溶剂化物)相同的聚合物基体材料中或可以存在于不同聚合物基体中。当具有两种聚合物基体时,该两种基体可以在片剂的同一层中,或在不同层中。脱羧酶抑制剂、血清素增强化合物或其它活性成分可以被包括在一种/多种基体中、在包衣中,或作为包衣的颗粒、粒子、丸粒或珠,或作为未包衣的颗粒、粒子等。
作为此类体系的例子,胃滞留SR剂型可以含有具有高溶胀能力的聚合物,诸如但不限于聚环氧乙烷、羟乙基纤维素、羧甲基纤维素和羟丙基甲基纤维素中的一种或多种(例如聚合物基体可以包含聚(环氧乙烷)和羟丙基甲基纤维素)。形成聚合物基体的聚合物可以具有中高分子量(例如聚合物具有的重均分子量可以为至少约5x10
胃滞留SR剂型可以含有一定剂量的外周脱羧酶抑制剂,其将5-HTP的生物利用度增强1倍至4倍(从F=20%至F=100%)。因此,也可以调整外周脱羧酶抑制剂的剂量以将5-HTP半衰期增强至例如约2h、2.5h、3h、3.5h和4h。
在一些实施方式中,可溶胀的体系(例如剂型)还可以包括分散于可溶胀的一种或多种聚合物(即第一聚合物基体材料)中的一个或多个微粒。分散于第一聚合物基体材料中的微粒的例子包括但不限于微珠、晶体、纳米粒子、微型片剂、珠子、丸粒和颗粒。5-HTP(或其盐或溶剂)可以分散于微粒中,微粒分散在第一基体材料中(即5-HTP可间接分散在第一基体材料中),或者5-HTP(或其盐或溶剂)可以直接分散在第一基体材料中,或者两者。
可以使用本领域技术人员可用的普通技术来准备上述体系(参见例如美国专利号6,340,475;6,635,280;7,438,927;和9,161,911)。
因此,在进一步的可溶胀的体系实施方式中,剂型可以包含:
(a)第一聚合物基体材料;
(b)基于第一聚合物基体材料的重量,以约0wt%至约50wt%(例如约1wt%至约50wt%)的量直接分散在第一聚合物基体材料中的5-HTP(或其药学上可接受的盐或溶剂化物);和
(c)设置在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散于第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物,其中:
第一聚合物基体材料是可溶胀的非交联的聚合物基体材料。
在进一步的可溶胀的体系中,剂型可以包含:
(a)第一聚合物基体材料;
(b)基于第一聚合物基体材料的重量,以约0wt%至约50wt%(例如约1wt%至约50wt%)的量直接分散于第一聚合物基体材料中的5-HTP(或其药学上可接受的盐或溶剂化物);和
(c)设置在所述第一聚合物基体材料内的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散在第二聚合物基体材料中的5-HTP或其药学上可接受的盐或溶剂化物,其中:
第一聚合物基体材料是可溶胀的且交联的聚合物基体材料。
当在本文中使用时,术语“可溶胀的”或“溶胀”可以相对于上文对术语“溶胀”的讨论来解释。也就是说,剂型在施用(或放置在含水容器中)后一小时内可以溶胀至其干燥原始体积的约115%至150%或更大,或者在稍后时间可以溶胀至为其原始干燥体积的约130%至300%或更大的体积。替代地,“可溶胀的”可以指聚合物基体吸收一定量水(或胃液)的能力,例如聚合物基体可随时间推移能够在水或胃液中溶胀至其脱水形式时重量的1.5至10倍范围内的重量。在前5至10分钟的溶胀速率应小于50%以避免吞咽或窒息的问题。可以在USP溶出杯中,在固定的时间取出片剂并且测量重量、体积或密度来测量溶胀。
当在本文中使用时,“直接分散在第一聚合物基体材料中”是指活性成分(例如5-HTP)的颗粒与第一聚合物基体材料直接接触,所述活性成分可以作为游离碱、盐或溶剂化物形式存在,并且所述颗粒可以任选地还含有不是聚合物基体材料的常规的药学上可接受的载体材料。可以理解的是,分散在第二聚合物基体材料中的活性成分没有直接分散在第一聚合物材料中。在某些实施方式中,当仅在第一聚合物基体材料中存在5-HTP时,其可以作为游离碱或盐或溶剂化物的颗粒存在。可以类似于5-HTP的方式任选地包括外周脱羧酶抑制剂或血清素增强化合物。
如上所述,如本领域技术人员众所周知的,胃滞留剂型中还可以包括填料、粘合剂、润滑剂和其它添加剂。
第一聚合物材料可以是任何合适的交联的可溶胀的聚合物并因此可以选自包括但不限于PEGDA、明胶(例如明胶+京尼平)、明胶-PEGDA、交联的透明质酸、交联的羟丙基纤维素、交联的羟丙基甲基纤维素和交联的丙烯酸钠的组中的一种或多种。例如,第一聚合物材料可以是明胶-PEGDA。本文中可以提及的其它交联的材料是交联的壳聚糖(例如脱乙酰度范围为20-50%的壳聚糖,其已经与适合的交联剂(例如凝聚条件下的表氯醇或戊二醛)交联)。
替代地,第一聚合物材料可以是任何适合的非交联的具有高溶胀能力的可溶胀性聚合物,诸如聚环氧乙烷、羟乙基纤维素和羟丙基甲基纤维素或它们的组合。聚合物优选具有中高分子量(约5x 10
形成微粒的第二聚合物材料可以由从包括但不限于羟丙基甲基纤维素、羟丙基纤维素、透明质酸、壳聚糖、明胶、明胶-PEGDA、PEGDA和聚丙烯酸(包括它们的盐,诸如丙烯酸钠)的组中的一种或多种选择的交联的聚合物材料制成,或其可以是从由壳聚糖(例如脱乙酰度范围为20-50%的壳聚糖)、聚(环氧乙烷)、羟丙基纤维素和羟丙基甲基纤维素组成的组的一种或多种中选择的非交联的聚合物材料。可以理解的是,这些聚合材料在液体环境中也可以表现出一定程度的溶胀。换句话说,第二聚合物基体可表现出一定程度的溶胀。不希望受到理论的束缚,这种溶胀可以有助于将剂型保持在胃中。
显示出溶胀的本文所述的聚合物在具有低pH值(即pH小于7)的液体环境中可能特别地溶胀,并且几种在整个生理pH范围内显示出pH非依赖性溶胀。
取决于所讨论的聚合物,本文提及的交联的聚合物可以通过任何合适的方法交联,诸如通过化学交联(例如通过使用多价阳离子(例如具有2+或3+电荷的阳离子,诸如Ca
在上述剂型的一些实施方式中,5-HTP或其药学上可接受的盐或溶剂化物分散在第二聚合物基体材料中并且这些材料一起形成微粒,该微粒被放置在第一聚合物基体材料内(例如均匀地分散在第一聚合物基体中)。微粒中可以使用任何合适的5-HTP负载量。本文中可以提及的合适负载量值包括如下实施方式,其中5-HTP或其药学上可接受的盐或溶剂化物存在的量为每个微粒的约1wt%至约50wt%(例如约1wt%至约30wt%)。第一聚合物基体材料可以含有约5wt%至约50wt%(例如约10wt%至约45wt%)所述微粒。
尽管不希望受到理论的束缚,可以相信的是,在这种剂型中,在施用之后,5-HTP从微粒释放到第一个聚合物基体中,然后通过第一聚合物基体扩散到胃液中。可能有一部分微粒也与药物一起完整流出到胃液中,然后将5-HTP直接释放到胃液中(或释放到GI-道下方的液体中)。此外,当组合物在第一基体中含有5-HTP时,该5-HTP会直接扩散到胃液中。在一些实施方式中,活性成分缓释递送的主要要素将由微粒提供,在一些实施方式中,缓释递送可基本上由微粒和第一基体两者共同提供。
可以理解的是,药物负载量、微粒的交联密度、微粒的尺寸和微粒在第一聚合物基体中的浓度可以变化以实现特定的释放曲线。组合物的性质也会影响释放速率。
可以使用本领域技术人员可用的常用技术制备上述可溶胀的体系。例如,可以通过简单的油包水乳液法生产微粒,其中将包括活性药物成分的非交联的聚合物和赋形剂溶解于水中,然后乳化到有机溶剂中。然后蒸发掉溶剂,并且将残留物UV交联并冷冻干燥以产生颗粒。另一种方式是使用多层脂质体作为模板。在这种情况下,通过将脂质溶液干燥成膜形式来形成脂质体,然后用由可交联聚合物、赋形剂和药物活性成分组成的水溶液水合。然后将得到的脂质体UV交联并透析以去除未交联的材料。然后用洗涤剂剥离脂质双层,得到凝胶颗粒。然后通过混合将微粒掺入到以本领域技术人员已知的方式由交联的聚合物制备的可溶胀基体中。如此产生的组合物可以以本领域技术人员已知的方式用于填充胶囊。
在某些实施方式中,以上讨论的溶胀制剂还可以含有气体发生剂。当使本文所述的可溶胀的胃滞留SR制剂接触胃液时,气体溶胀剂在制剂的至少一部分中产生气体,这可以使制剂在胃的胃液和肠中漂浮一段时间。这可以口服施用后不久为本节所描述的制剂提供额外的浮力,可以在上述可溶胀的聚合物在具有充分的时间溶胀至无法通过幽门括约肌的尺寸之前,协助避免剂型意外通过幽门括约肌。因此,任选包括的气体溶胀剂可有用于增强胃滞留。美国专利号4,140,755、4,996,058和6,960,356;以及Timmermans,Moes,AJ,J.Pharm.Sci.(1994),83:18-24中描述了漂浮性胃滞留体系。
可在口服施用后的短时间内(例如五分钟)发生从气体溶胀剂中快速释放气体。可以使用任何适合的气体溶胀剂(即任何合适的产气材料),前提条件是其与胃液接触后释放气体。适合的气体溶胀剂包括但不限于碳酸的一价或二价碱性盐(即碳酸盐和碳酸氢盐),诸如碳酸氢钠、碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、碳酸钙、碳酸镁和甘氨酸碳酸钠;和亚硫酸盐,诸如亚硫酸钠、亚硫酸氢钠和偏亚硫酸氢钠。可以任选地包括诸如柠檬酸、苹果酸、马来酸、富马酸、酒石酸和其它上述酸等酸,以在润湿时与气体发生剂反应。
基于剂型的总重量,产气材料的用量范围可以为约0.1wt%至约50wt%,诸如约1wt%至约10wt%。
可以使用药剂师可用的常用技术将气体溶胀剂掺入到剂型中(例如欧洲专利申请号EP 2 120 887中描述的,该技术通过引用并入本文)。
可以理解的是,以上讨论的剂型可以以包含在胶囊(通常是明胶胶囊)中的形式提供,以便于吞咽。
在一些实施方式中,胃滞留SR剂型可以采用英特制药(Intec Pharma)的‘手风琴’技术。在此类实施方式中,将5-HTP和任选的其它活性成分掺入到可生物降解的聚合物膜中。将该膜多层平面结构折叠成手风琴形状并且包装到标准尺寸胶囊中。在到达胃中之后,胶囊溶解。膜随后展开并具有相当大的尺寸,因此在胃中保留长达12小时。在胃中时,膜以受控方式将药物释放到胃肠道的上部。该剂型可能特别适合于组合剂型(例如包含5-HTP和血清素增强化合物、外周脱羧酶抑制剂或所有三种化合物(例如(i)5-HTP和卡比多巴;(ii)5-HTP和选择性血清素再摄取抑制剂;或(iii)5-HTP、选择性血清素再摄取抑制剂和卡比多巴))。在此通过引用将涉及L-多巴(例如与卡比多巴组合)的美国专利号8,771,730中描述的制剂并入(将L-多巴替换为5-HTP)。
在一些实施方式中,胃滞留SR剂型可以采用Lyndra Therapeutic的技术。在此类实施方式中,将5-HTP和任选的其它活性成分(诸如外周脱羧酶抑制剂或血清素增强化合物)掺入到载体聚合物成分组分中,该载体聚合物成分组分包含i)载体聚合物和ii)治疗成分或其药学上可接受的盐,其中载体聚合物-药剂组分通过一种或多种偶联聚合物组分连接在一起,其中一种或多种偶联聚合物组分中的至少一种是弹性体;其中胃驻留体系被构造成在容器中具有压缩形式,适合于口服或通过饲管施用;和当从容器中释放出时具有未压缩形式,诸如环或星形;其中胃驻留体系在胃中保持8h至24h或更长的驻留期。参见美国专利申请公开号2017/0266112和2018/0311154。
还在本文中公开的是,5-HTP的缓释可以通过在皮下或肌内可注射的5-HTP缓释制剂来实现。
通常,本公开的剂型的片剂或胶囊具有长轴和短轴。这种形状特征将1)便于摄食和通过口腔和食道以及2)溶胀后协助将剂型保留在胃中。并入本文作为参考的美国专利号6,488,962中描述了此类益处。有胃中溶胀之后,在30-60分钟内,短轴将溶胀到至少1.2cm,优选1.3cm或更大,该尺寸过大而无法在进食状态下穿过平均尺寸(mean size)的幽门括约肌。在胃中溶胀后,长轴将溶胀到至少2cm,优选2.5cm或更大,并且最优选3cm或更大。在溶胀之前,短轴长度可以短至0.7cm,优选0.7cm至1.5cm,且优选长度为0.75cm至1.2cm,且长度最优选0.8cm至1.0cm。溶胀前片剂的长轴长度为3.0cm或更小,优选2.5cm或更小,且最优选1.5cm至2.5cm。
优选的形状包括但不限于为长方形、菱形、椭圆形、圆柱和平行四边形的形状。片剂的厚度可以等于或小于长轴和短轴的尺寸。
5-HTP可以以用于治疗CNS障碍的治疗有效量施用,所述CNS障碍为诸如从包括但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的组中选择的病症。典型地,本发明的方法将包括只要病症持续,就每天一次或每天两次施用胃滞留SR 5-HTP剂型。在一些实施方式中,可以每天三次。
可以在剂型中掺入外周脱羧酶抑制剂以增强5-HTP的生物利用度或者同时增强5-HTP的生物利用度以及血浆消除半衰期。
为了避免疑问,在本发明的上下文中,术语“治疗”包括指代对需要这种治疗的患者的治疗性治疗或姑息治疗,以及指代在可能的程度上对易感相关疾病状态的患者的预防性治疗和/或诊断。
术语“患者”和“多位患者”包括指代哺乳动物(例如人类)患者。如本文所用,术语“受试者”或“患者”在本领域是公认的并且在本文中可以替换使用以指代哺乳动物,包括狗、猫、大鼠、小鼠、猴、牛、马、山羊、绵羊、猪、骆驼且最优选人类。在一些实施方式中,受试者是需要治疗的受试者或患有疾病或障碍的受试者。但是,在其它实施方式中,受试者可以是正常受试者。该术语不表示特定年龄或性别。因此,旨在覆盖成人、少年和新生儿受试者,无论是男性还是女性,或者是无法确定为任何特定性别的受试者。
如本文所用,术语“治疗有效量”是指当施用至需要此类治疗的哺乳动物时足以进行治疗的量(例如足以治疗或预防疾病)。效果可以是客观的(即通过一些测试或标志物可测量)或主观的(即受试者给出了效果迹象或感觉到了效果)。治疗有效量可以根据正接受治疗的受试者、疾病状态的严重程度和施用方式来变化,并且可以由本领域技术人员常规地确定。
无论是单独的,还是与外周脱羧酶抑制剂、血清素增强化合物或两者一起,5-HTP的有效剂量典型地范围为约50-3600mg/天,典型地约300-2400mg/天,更典型地约600-1800mg/天。
然而,在本发明的上下文中,施用至哺乳动物(特别是人类)的剂量应足以在合理的时间框架内在哺乳动物中产生治疗反应。本领域技术人员将认识到,确切剂量和组合物的选择以及最合适的递送方案尤其还会受到制剂的药理特性,所治疗病症的性质和严重程度,接受者的身体状况和精神敏锐度、待治疗的患者的年龄、病情、体重、性别和反应以及疾病的阶段/严重程度的影响。
无论如何,医师或其它技术人员将能够例行确定最适合个别患者的实际剂量。上述剂量是一般情况的示例;当然,在个别情况下应使用较高或较低的剂量范围,并且这在本发明的范围内。
在一些实施方式中,施用每日一次或每日两次的胃滞留SR 5-HTP剂型。剂量可以在任何时间施用,但是优选在治疗期间,每天在大约相同的时间并且以大约12小时的间隔施用剂量。此外,优选胃滞留SR 5-HTP剂型随食物一起服用,例如与早餐或晚餐一起服用。因此,在一些实施方式中,胃滞留SR 5-HTP剂型每日施用一次,例如在早上(例如起床时或与早餐一起)或在晚上(例如与晚餐一起或临近睡前)。在一些实施方式中,胃滞留SR 5-HTP剂型每日施用两次,例如早上服用第一剂(例如起床时或与早餐一起)并且晚上服用第二剂(例如与晚餐一起或临近睡前)。
在一些实施方式中,进餐导致与禁食模式相关的蠕动波周期性强迸发的停止,特别是消化期间移行性运动复合波的第三阶段。进食模式是在食物摄入后立即由营养元素引起的,并从上胃肠(GI)道的运动模式迅速而深刻的变化开始。在胃内容物到达远端小肠之前,这种变化几乎同时发生在GI道的所有部位。在进食模式下,胃每分钟产生3-4次连续且规则的收缩,类似于禁食模式,但幅度大约减半。幽门括约肌部分打开,产生筛分效应,其中液体和小颗粒连续地从胃流到肠中,而比幽门开口大的难消化颗粒被排斥并保留在胃中。因此,这种筛分效应导致胃将尺寸超过约1cm的颗粒保留约4至6小时,允许剂型溶胀至足以延长其在胃中的保留和停留时间的尺寸,例如长达约12小时或更长时间。
根据一些实施方式,胃滞留SR 5-HTP剂型可以单独施用(即作为单一疗法,诸如用于治疗抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的单一疗法)。但是,在一些实施方式中,胃滞留5-HTP SR剂型可以与另一治疗剂(例如用于治疗抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症的另一治疗剂)组合施用。
因此,根据本发明的药物治疗(包含5-HTP和药学上可接受的载体)可以进一步包含一种或多种附加治疗剂。上文已经描述了除5-HTP之外还含有血清素增强化合物和/或外周脱羧酶抑制剂的药物组合物。可以理解的是,这些组分可以分别提供给受试者并且分别向受试者施用。
因此,本发明的进一步方面涉及如下:
(a)一种如上文所定义的胃滞留SR 5-HTP剂型和另一治疗剂,用于治疗CNS疾病或障碍,诸如但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症,其中如上文所定义的胃滞留SR 5-HTP剂型可以与其它治疗剂顺序、同时或伴随施用;
(b)一种如上文所定义的胃滞留SR 5-HTP剂型,用于治疗CNS疾病或障碍,诸如但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症,其中胃滞留SR 5-HTP剂型与另一治疗剂顺序、同时或伴随施用;
(c)如上文所定义的胃滞留SR 5-HTP剂型和另一治疗剂用于制备用于治疗CNS疾病或障碍的药物的用途,所述CNS疾病或障碍诸如但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症,其中胃滞留SR 5-HTP剂型与其它治疗剂顺序、同时或伴随施用;
(d)如上文所定义的胃滞留SR 5-HTP剂型用于制备用于治疗CNS疾病或障碍的药物的用途,所述CNS疾病或障碍诸如但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症,任选地其中药物与另一治疗剂组合施用;
(e)一种治疗CNS疾病或障碍的方法,该CNS疾病或障碍诸如但不限于抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症,该方法包括向需要此治疗的患者施用有效量的如上文所限定的胃滞留SR5-HTP剂型和另一治疗剂。
当在本文中使用时,术语“另一治疗剂”包括引用已知有用于(例如已知有效于)治疗CNS疾病或障碍的一种或多种(例如一种)治疗剂(例如一种治疗剂),所述CNS疾病或障碍诸如抑郁症、社交焦虑、恐慌症、广泛性焦虑障碍、OCD、冲动控制障碍、自杀倾向、边缘型人格障碍、纤维肌痛、共济失调、与神经障碍(例如阿尔茨海默氏病、帕金森氏病)有关的情绪症状和躁动、中风恢复、自闭症、偏头痛、睡眠障碍、经前期烦躁、创伤后紧张症、产后抑郁症、苯丙酮尿症和干扰素治疗后抑郁症。在特定的实施方式中,这些另一治疗剂可以选自一种或多种如上文定义的血清素增强化合物和/或外周脱羧酶抑制剂。
5-HTP的剂量可以如上文所定义,考虑到联合疗法可以任选地进行修改。另一治疗剂的剂量可以由医师根据上文所讨论的当单独使用时确定5-HTP剂量的考虑因素来确定。
另一治疗剂可以以适用于人类治疗目的的任何形式施用。不同的“治疗剂”通常需要不同的剂型。但是,例如,当与5-HTP相似的速率释放时,外周脱羧酶抑制剂、卡比多巴可具有很好的效果,因为它具有一些相似的理化特性,并且在大多数制剂中预期会表现出与5-HTP或多或少的相似性。因此,当在本发明的实施方式中使用卡比多巴时,可以方便地将其掺入5-HTP胃滞留SR制剂中。
当在本文中使用时,术语“顺序、同时或伴随施用”包括是指:施用单独的药物制剂(一种含有胃滞留SR 5-HTP剂型,且另一种或多种含有一种或多种其它治疗剂);和施用含有胃滞留SR 5-HTP剂型和其它治疗剂的单一药物制剂。
上述组合产品提供了组分(A)与组分(B)共同施用,并因此可以呈现为单独的制剂,其中这些制剂中的至少一种包含组分(A)且至少一种包含组分(B),或者可以呈现(即配制)为组合制剂(即呈现为包括组分(A)和组分(B)的单一制剂)。因此,进一步提供了一种多部分的试剂盒(kit of parts),包括组分:(i)包括如上文所定义的胃滞留SR 5-HTP剂型的药物制剂;和(ii)包括另一治疗剂与药学上可接受的佐剂、稀释剂或载体混合的药物制剂,其中组分(i)和(ii)各自以适合于彼此共同施用的形式提供。因此,多部分的试剂盒的组分(i)是组分(A),其为如上文所述的5-HTP的制剂。类似地,组分(ii)是组分(B)与药学上可接受的佐剂、稀释剂或载体的混合物。
可以理解的是,上述剂型(包括组合)可以提供5-HTP到受试者的上GI道中的基本线性的释放速率。因此,提供了一种实现约0.1mg/L至1mg/L的5-HTP血浆水平的方法,其通过在稳态下向上胃肠道施用约2.5mg/h至约25mg/h(例如该方法通过在稳态下向上胃肠道施用约6.25mg/h,可以实现约0.25mg/L的稳态5-HTP血浆水平)。因此,提供了一种实现约0.1mg/L至3mg/L的5-HTP血浆水平的方法,其通过在稳态下向上胃肠道施用约2.5mg/h至约75mg/h(例如该方法通过在稳态下向上胃肠道施用约6.25mg/h可以实现约0.25mg/L的稳态5-HTP血浆水平)。可以理解的是,可以使用满足本发明这些方面所述的释放标准的本文公开的任何剂型。可以理解的是,在剂型中包括外周脱羧酶抑制剂可以将由给定递送速率(如前文所述)产生的稳态5-HTP血浆水平增加1倍至4倍。
如前文所提及的,本发明还可涉及一种特定剂型,其可包含将从胃滞留SR制剂中受益的任何合适的活性成分。因此,提供了一种向上胃肠道递送活性药物成分的胃滞留SR药物组合物,包含:
(a)第一聚合物基体材料;
(b)基于第一聚合物基体材料的重量,以约0wt%至约50wt%(例如约1wt%至约50wt%)的量直接分散在第一聚合物基体材料中的第一活性成分(例如5-HTP)或其药学上可接受的盐或溶剂化物;和
(c)设置在所述第一聚合物基体材料中的多个微粒,每个所述微粒包含第二聚合物基体材料和一定量分散在第二聚合物基体材料中的第二活性成分或其药学上可接受的盐或溶剂化物,其中第一聚合物基体材料是可溶胀的。第一和第二聚合物基体材料中的每一种可以是交联的或非交联的。在一些实施方式中,第二聚合物基体材料是可溶胀的。在一些实施方式中,第一和第二聚合物基体材料均是可溶胀的且交联的。在一些实施方式中,第一和第二聚合物基体材料均是可溶胀的且非交联的。
在这一方面的实施方式中,第一和第二聚合物基体材料可以与上文为本发明第一至第四方面所讨论的相同。第一和第二活性成分可以是可从胃滞留SR递送方式受益的任何活性成分。在某些实施方式中,第一和第二活性成分可以各自独立地选自包括下述的组:5-HTP、卡比多巴、苄丝肼、L-DOPA、加巴喷丁、二甲双胍、阿莫西林、甲硝哒唑、克拉霉素、呋喃咀啶、阿昔洛韦、速尿灵、卡托普利、美托洛尔、雷尼替丁、法莫替丁、环丙沙星、氧氟沙星、维拉帕米、阿替洛尔、巴氯芬、环丙沙星、头孢呋辛酯、塞来昔布、地尔硫卓、甲氧氯普胺、美托洛尔和四环素。所有这些活性成分均具有狭窄的吸收窗口,主要限于上GI和/或希望直接在胃中起药理作用。在进一步的实施方式中,活性成分可以选自包括下述的组:卡比多巴、苄丝肼、L-DOPA、加巴喷丁、二甲双胍、阿莫西林、甲硝哒唑、克拉霉素、呋喃咀啶、阿昔洛韦、速尿灵、卡托普利、美托洛尔、雷尼替丁、法莫替丁、环丙沙星、氧氟沙星、维拉帕米、阿替洛尔、巴氯芬、环丙沙星、头孢呋辛酯、塞来昔布、地尔硫卓、甲氧氯普胺、美托洛尔和四环素。可以理解的是,第一和第二活性成分可以相同或可以不同。另外,可以理解的是,第一和/或第二活性成分可以各自是一种或多种活性成分。
现在将描述体现本发明某些方面的非限制性实施例。
实施例
实施例1
完全基于人类口腔和结肠的所需释放速率
5-HTP的生物利用度
人体中5-HTP的绝对和局部肠道生物利用度的确定。
5-HTP剂量施用:使用游离碱形式的5-HTP(5-HTP的水溶解度>10mg/mL)。
结肠:5-HTP游离碱盐溶液200mg。
静脉内:5-HTP游离碱盐溶液50mg。
口腔/上GI:两片100mg 5-HTP游离碱的5-HTP明胶片剂(200mg总剂量)。
受试者:年龄介于18至65岁,体重指数(BMI)为19至28的健康男性和女性志愿者符合研究条件。在接受5-HTP施用之前2小时,受试者被送入研究医疗单位(IMU),之后在IMU中停留24小时,以进行血液采样和安全性评估。
研究顺序:所有受试者3次接受5-HTP 200mg。(1)结肠(通过结肠镜200mg 5-HTP溶液。(2)静脉(IV)。(3)上GI(口腔)。每次访问之间必须至少相隔6天。
血浆样品分析:血浆样品储存在-80℃直至分析。通过液相色谱-质谱检测对5-HTP和代谢物5-羟基吲哚乙酸(5-HIAA)进行定量。
数据分析:使用非房室(NCA)和房室(混合效应)数学建模方法分析PK数据,以计算每次5-HTP施用时每位受试者曲线下的5-HTP血浆面积(AUC)。根据以下提供的公式,将该数据用于计算5-HTP绝对生物利用度和相对上GI道:结肠生物利用度数据。
结果:通过上述各施用途径施用5-HTP并在各个时间点对所得的5-HTP血浆水平进行定量,从而确定了人类受试者中通过这些施用途径的5-HTP的人类生物利用度。所有人类受试者在不同日经由三种施用途径中的一种接受5-HTP。在24小时选定的时间段内采集了用于5-HTP定量的血浆样品,结果如图1所示。
从图1,获得了每种施用途径的曲线下面积(AUC),然后将其用于计算口服和结肠施用途径的绝对生物利用度(F)。例如,以下给出了计算通过口服途径(po)施用药物的F的公式(D为剂量):
结肠剂量施用后使用相似的公式计算绝对生物利用度。口服剂量施用的AUC为1505(h*ng/ml),对于结肠剂量施用为312(h*ng/ml),并且对于静脉剂量施用为2042(h*ng/ml),将这些值用于提供口服和结肠生物利用度,如下所示。
基于上述计算,通过口服途径的绝对5-HTP生物利用度为20%(上GI道),而结肠剂量施用的绝对5-HTP生物利用度为4%。如下计算相对生物利用度口服:结肠:
因此:
如上计算的,相对上GI道:结肠生物利用度为20%(对应于4%的绝对结肠生物利用度)。根据上述,根据缓释药物递送领域内的一般教导(Sutton SC.The use ofgastrointestinal intubation studies for controlled release development.Br JClin Pharmacol.2009Sep;68[3]:342-54),结论是:需要胃滞留技术以实现所需的5-HTP延长释放曲线以及所需的持续且具有治疗活性的5-HTP血浆水平曲线。另外,口服生物利用度(F
释放速率计算:
场景1
对于本发明公开的剂型,当在没有外周脱羧酶抑制剂的情况下施用5-HTP时,如下计算所需的释放速率曲线:
R
其中:
·R
·C
·V
·k
·F=生物利用度,5-HTP为~0.2(对于口服施用途径)。
代入之后,我们获得的R
场景2
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加1倍而基本上不改变5-HTP血浆半衰期:
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.4(对于口服施用途径)。
代入后,我们获得的R
场景3
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加1倍并且将5-HTP血浆半衰期增加至2h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.4(对于口服施用途径)。
代入后,我们获得的R
场景4
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加1倍并且将5-HTP血浆半衰期增加至2.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.4(对于口服施用途径)。
代入后,我们获得的R
场景5
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加1倍并且将5-HTP血浆半衰期增加至3h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.4(对于口服施用途径)。
代入后,我们获得的R
场景6
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加1倍并且将5-HTP血浆半衰期增加至3.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.4(对于口服施用途径)。
代入后,我们获得的R
场景7
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加2倍而基本上不改变5-HTP血浆半衰期:
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景8
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加2倍并且将5-HTP血浆半衰期增加至2h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景9
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加2倍并且将5-HTP血浆半衰期增加至2.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景10
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加2倍并且将5-HTP血浆半衰期增加至3h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景11
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加2倍并且将5-HTP血浆半衰期增加至3.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景12
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加2倍并且将5-HTP血浆半衰期增加至4h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.6(对于口服施用途径)。
代入后,我们获得的R
场景13
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加3倍而基本上不改变5-HTP血浆半衰期:
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
场景14
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加3倍并且将5-HTP血浆半衰期增加至2h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
场景15
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加3倍并且将5-HTP血浆半衰期增加至2.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
场景16
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,外周脱羧酶抑制剂将5-HTP生物利用度增加3倍并且将5-HTP血浆半衰期增加至3h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
场景17
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加3倍并且将5-HTP血浆半衰期增加至3.5h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
场景18
对于本发明公开的剂型,当5-HTP与外周脱羧酶抑制剂(诸如卡比多巴或苄丝肼)一起施用时,如下计算所需的释放速率曲线,所述外周脱羧酶抑制剂将5-HTP生物利用度增加3倍并且将5-HTP血浆半衰期增加至4h。
R
其中:
·R
·C
·V
·k
·F=生物利用度,对于5-HTP为~0.8(对于口服施用途径)。
代入后,我们获得的R
本领域理解的是,确定F将使得能够计算为实现给定的稳态血浆浓度(C
对于例示的以上及以下场景中的稳态血浆浓度(C
R
本领域已知的是,外周脱羧酶抑制剂以依赖于剂量和方案的方式增强5-HTP的生物利用度(Gijsman HJ,van Gerven JM,de Kam ML,Schoemaker RC,Pieters MS,WeemaesM,de Rijk R,van der Post J,Cohen AF.“Placebo-controlled comparison of threedose-regimens of5-hydroxytryptophan challenge test in healthy volunteers.”JClin Psychopharmacol.(2002),22(2):183-9.PubMed PMID:11910264;Westenberg HG,Gerritsen TW,Meijer BA,van Praag HM.“Kinetics of l-5-hydroxytryptophan inhealthy subjects.”Psychiatry Res.(1982),7(3):373-85.PubMed PMID:6187038)。为了确定可将5-HTP生物利用度增强1倍至3倍的外周脱羧酶抑制剂的剂量施用方案,可以简单地向上调整外周脱羧酶抑制剂的剂量直到获得所需的F。
两种代表性临床使用的外周脱羧酶抑制剂是卡比多巴和苄丝肼。当与左旋多巴一起使用治疗帕金森氏病时,常用的左旋多巴:卡比多巴或左旋多巴:苄丝肼比为4:1,并且卡比多巴和苄丝肼的绝对临床剂量水平相似。因此,卡比多巴和苄丝肼剂量水平在功能上可互换。
在一些实施方式中,可将5-HTP生物利用度增强1倍至2倍的外周脱羧酶抑制剂的剂量可以<1mg/kg/天,在一些实施方式中,范围为0.1至0.5mg/kg/天。在一些实施方式中,将5-HTP生物利用度增加约2倍的外周脱羧酶抑制剂的剂量可以为~2mg/kg/天,在一些实施方式中,范围为1至2mg/kg/日。在一些实施方式中,将5-HTP生物利用度增加约3倍的外周脱羧酶抑制剂的剂量可以>2mg/kg/天,在一些实施方式中,范围为2至2.5mg/kg/天。
理想地,在12小时期间,释放速率曲线是线性的或基本线性的,使得每小时释放出足够量的5-HTP以维持体内所需的稳态浓度。
实施例2
双溶胀性体系
提出了一种双溶胀性体系作为实现所需释放曲线的示例性方式。在这一体系中,将5-HTP配制为微粒的一部分,该微粒可以是可溶胀的或不是。然后将所得的微粒放置在可溶胀的聚合物基体中以形成剂型,该可溶胀的聚合物基体也含有5-HTP。如图2A和2B所示,在施用后并且一旦剂型到达胃,围绕微粒的可溶胀基体溶胀起来并且防止该剂型离开胃。因此,微粒中含有的5-HTP以及其它包括的活性成分首先开始从该微粒释放到聚合物基体(参见图2C),之后通过基体将药物扩散到胃液中(参见图2D)。然而,可能的是,一部分微粒也与5-HTP流出,因此将5-HTP和其它包括的活性成分直接释放到胃液中(参见图2D)。直接包含在可溶胀基体中的任何5-HTP或其它包括的活性成分通过该基体扩散到胃液中。
含有5-HTP的微粒:
5-HTP的微粒可以使用以下来制得:
·通过化学交联剂(例如京尼平)交联的明胶;
·通过UV光交联的明胶-PEGDA(明胶-聚乙二醇二丙烯酸酯);
·通过UV光交联的PEGDA;
·使用电荷大于1+的金属离子交联的丙烯酸钠;
·脱乙酰度为20至70%的交联的或非交联的壳聚糖;或
·非交联的聚(环氧乙烷)和/或羟丙基甲基纤维素。
可以微粒重量的1至50wt%的量提供5-HTP。也可以使用本领域技术人员熟知的标准方法,通过混合聚合物和赋形剂而不经交联制得微粒。参见例如美国专利号6,475,521和7,094,427。
可以使用许多常规技术来制造含有5-HTP和其它包括的活性成分的微粒,包括:喷雾干燥基体和5-HTP和/或其它活性成分的溶液;水和油的乳液法;搅拌下沉淀等。取决于使用的聚合物,可以使用不同的方法来交联这些微粒。
例如,可以通过以下方法制备微粒。首先,一种简单的水包油乳液法,其中将非交联聚合物、5-HTP、其它活性成分和赋形剂溶解在水中,然后乳化到有机溶剂中。然后蒸发掉溶剂,并且如有必要,将残留物交联(例如通过UV或化学方法),然后冻干以形成所需的微粒。
在第二示例性方法中,将多层脂质体用作模板。在这种情况下,通过将脂质溶液干燥成膜形式以形成脂质体,然后用由可交联聚合物、5-HTP、其它活性成分和赋形剂组成的水溶液水合。然后将所得的脂质体交联并且渗析去除非交联的材料。然后用洗涤剂剥离脂质层,得到所需的凝胶颗粒。
使用上述技术制得的微粒被设计为在不同的pH值下显示出不同的溶胀。这种溶胀将使5-HTP和其它活性成分从颗粒中缓慢释放,这可以使用现有技术的透析技术进行研究(在单独的微粒中)。要考虑的相关变量包括交联密度和5-HTP的负载量。
聚合材料的交联:
如上文所述,微粒以及封装这些微粒的聚合物基体可以为交联的材料的形式。此类交联性材料可以由非交联的聚合物材料的适当水性制剂形成,其包括:
·水中量为1至20wt%的明胶(其中通过在适当的阶段添加少于1wt%的京尼平来进行交联);
·水中量为1至20wt%的明胶-PEGDA(其中通过在适当的阶段添加0.05至0.5wt%的Irgacure 2959来进行交联);
·水中量为1至20wt%的PEGDA或其它聚丙烯酸(其中通过在适当的阶段添加0.05至0.5wt%的Irgacure 2959来进行交联);
·水中量为0.5至10wt%的丙烯酸钠(其中通过在适当的阶段添加0.1至1.0wt%适当的金属盐来进行交联);
·脱乙酰度为20至70%的壳聚糖(其中使用表氯醇或戊二醛通过凝聚来进行交联;其中洗去多余的交联剂);
·交联的透明质酸(通过本领域技术人员已知的任何合适方式进行交联,诸如通过化学交联或通过UV交联具有甲基丙烯酸酯基团的透明质酸聚合物(例如通过UV交联甲基丙烯酸酯基团);
·交联的羟丙基纤维素(通过本领域技术人员已知的任何合适方法进行交联);和
·交联的羟丙基甲基纤维素(通过本领域技术人员已知的任何合适方法进行交联)。
聚合物基体:
将以上微粒保持在通过交联的明胶-PEGDA基体形成的胶囊中(交联步骤在胶囊模具中进行)或保持在明胶胶囊内的交联的明胶-PEGDA基体中。可以使用的其它材料包括交联的透明质酸、交联的壳聚糖、交联的羟丙基纤维素、交联的羟丙基甲基纤维素和交联的丙烯酸钠。
可将微粒分散在交联性水凝胶基体中,然后将基体交联。该基体材料可以为填充胶囊的形式。胶囊可以溶胀成保留在胃中的球体。
在pH 1.5至3.5(正常胃pH范围)和pH 6.5(模拟小肠)的模拟胃液中研究了交联密度对胶囊溶胀尺寸的影响。
如可以理解的,5-HTP也可以形成可溶胀的基体的一部分,但这是任选的(例如其存在量可以为0至50wt%)。因此,当可溶胀基体(即第一聚合物基体材料)中存在5-HTP时,其量可以为所述可溶胀基体材料重量的1至50wt%(例如1至45wt%)。如果包括其它活性成分,这些范围适用于总活性成分含量。
所得的剂型:
作为根据上述全剂型的一个例子,可以将含有5-HTP(20wt%)的明胶-PEGDA水凝胶的微粒分散在由明胶-PEGDA基体制成的胶囊中。该胶囊被设计为在与胃液接触时溶胀到足够大尺寸的球体,以便将其保留在胃中,由此以上文讨论的方式释放5-HTP并且会提供~25mg/h的所需目标释放速率。
微粒可以在很大程度上从可溶胀基体中释放出来并且在离开可溶胀基体之后在上GI中大量释放5-HTP和其它活性成分。替代地,微粒将主要保留在可溶胀的基体中,同时递送5-HTP和其它活性成分,并且5-HTP和其它活性成分会通过可溶胀基体扩散出去。
实施例3
可溶胀的片剂太大而不能穿过幽门括约肌
根据美国专利号6,340,475、6,635,280和7,438,927(其内容通过引用并入本文)中所讨论的制备可溶胀的片剂,不同之处在于在本文中使用的主要活性化合物是5-HTP。在一些实施方式中,可溶胀的片剂可以如图4A-4D所示。
如以上引用的US专利所讨论的,其中公开的可溶胀片剂在胃中溶胀成太大而不能穿过幽门括约肌(并因此脱离胃)的球体。因此,片剂保留在胃中长达12小时,期间5-HTP缓慢释放,以最终在上GI中吸收。
可以使用标准造粒技术以下表1阐述的成分制造适合的胃滞留5-HTP制剂(GR1、GR2和GR3)。
表1.示例性胃滞留5-HTP制剂
以商品名METHOCEL
这种方式的制剂可允许每日一次或每日两次施用5-HTP,具有线性释放曲线(即其中释放的5-HTP总量与时间的关系图基本上是线性的)。这至少部分基于以下事实:活性化合物加巴喷丁(美国专利号7,438,927的活性化合物)与5-HTP具有相似的分子量和理化性质。
在一些实施方式中,可溶胀的固体剂型可以包含多于一个隔室。在一些实施方式中,第一隔室含有5-HTP而第二隔室含有第二活性成分,诸如外周脱羧酶抑制剂或血清素增强化合物。与前述类似,在一些实施方式中,固体剂型包含三个或更多个隔室,携带不同的活性成分或提供不同的释放曲线。在一些实施方式中,一个隔室主要提供胃滞留要素。
在一些实施方式中,剂型包括包衣。在一些实施方式中,光滑的包衣有助于吞咽,在其它实施方式中,包衣掩盖难吃的味道,在又其它实施方式中,包衣起到美学功能,并且在又其它实施方式中,包衣保护剂型的物理或化学完整性。在一些实施方式中,包衣携带活性成分,其在一些实施方式中可以是血清素增强药物,例如但不限于血清素再摄取抑制剂。另外,包衣可以起到多于一种作用。用于上述目的的固体剂型包衣是本领域众所周知的。
实施例4
可溶胀的片剂太大而不能穿过幽门括约肌
掺入微粒
根据实施例3制备可溶胀的片剂,除此之外,根据通过引用整体并入本文的美国专利号6,475,521中讨论的方法,将微粒掺入到了基体中。含有5-HTP和任选的其它活性成分的微粒分散在基体中。随时间,通过扩散、侵蚀或两者从微粒中释放出5-HTP和任选的其它活性成分。5-HTP和任选的其它活性成分通过基体扩散到胃液中并由其扩散到发生吸收的上肠中(参见图3A-3D)。
实施例5
推拉式渗透泵
除了包括5-HTP作为活性成分之外,基于通过引用整体并入本文的美国专利号4,765,989制备外部尺寸在至少2个维度上大于1cm的推拉式渗透泵。泵上包覆有乙酸纤维素或其它水可渗透但药物不可渗透的膜。芯在一层中包含诸如聚环氧乙烷等的溶胀剂,而在第二层中包含具有渗透剂的单独药物。第二层与半透膜的部分接触,通过半透膜的该部分制造或设计出在剂量施用后出现一个或多个孔洞。剂型的益处是两种药物的恒定释放曲线或其它模式的释放曲线。药物递送时间应设计成不长于9小时且不短于5小时。
参考文献
本文列出的所有参考文献,包括但不限于所有专利、专利申请及其出版物、科学期刊文章和数据库条目,均通过引用全文并入本文,其在一定程度上补充、解释、提供背景知识、或教导本文采用的方法、技术和/或组合物。
Birdsall TC.“5-Hydroxytryptophan:a clinically-effective serotoninprecursor.”Altern Med Rev.(1998),3(4):271-80.Review.PubMed PMID:9727088.
Blier,Pierre,and Claude De Montigny."Current advances and trends inthe treatment of depression."Trends in pharmacological sciences(1994),15(7):220-226.
Bryn et al.,Solid-State Chemistry of Drugs,Second Edition,publishedby SSCI,Inc of West Lafayette,IN,USA,1999,ISBN 0-967-06710-3.
欧洲专利号2,120,887.
Gijsman HJ,van Gerven JM,de Kam ML,Schoemaker RC,Pieters MS,WeemaesM,de Rijk R,van der Post J,Cohen AF.“Placebo-controlled comparison of threedose-regimens of 5-hydroxytryptophan challenge test in healthy volunteers.”JClin Psychopharmacol.(2002),22(2):183-9.PubMed PMID:11910264.
Hua S,Marks E,Schneider JJ,Keely S.“Advances in oral nano-deliverysystems for colon targeted drug delivery in inflammatory bowel disease:selective targeting to diseased versus healthy tissue.”Nanomedicine.(2015),11(5):1117-32.
Jacobsen,Jacob PR,et al."Adjunctive 5-Hydroxytryptophan slow-releasefor treatment-resistant depression:clinical and preclinical rationale."Trendsin pharmacological sciences(2016),37(11):933-944.
Jacobsen,J.P.,et al.,"SSRI Augmentation by 5-Hydroxytryptophan SlowRelease:Mouse Pharmacodynamic Proof of Concept."Neuropsychopharmacology(2016),41(9):2324-34.
Remington The Science and Practice of Pharmacy,19th ed.,Mack PrintingCompany,Easton,Pennsylvania(1995).
Sutton SC.“The use of gastrointestinal intubation studies forcontrolled release development.”Br J Clin Pharmacol.(2009),68(3):342-54.
Timmermans,Moes,AJ.J.Pharm.Sci.(1994),83:18-24.
Turner,Erick H.,Jennifer M.Loftis,and Aaron D.Blackwell."Serotonin ala carte:supplementation with the serotonin precursor 5-hydroxytryptophan."Pharmacology&therapeutics(2006),109(3):325-338.
美国专利申请公开号2017/0266112.
美国专利申请公开号2018/0311154.
美国专利号4,140,755.
美国专利号7,765,989.
美国专利号4,996,058.
美国专利号6,340,475.
美国专利号6,475,521.
美国专利号6,488,962.
美国专利号6,635,280.
美国专利号6,960,356.
美国专利号7,094,427.
美国专利号7,438,927.
美国专利号7,670,619.
美国专利号8,771,730.
美国专利号8,969,400.
美国专利号9,161,911.
Westenberg HG,Gerritsen TW,Meijer BA,van Praag HM.“Kinetics of l-5-hydroxytryptophan in healthy subjects.”Psychiatry Res.(1982),7(3):373-85.PubMed PMID:6187038.
将理解的是,在不脱离本公开主题的范围的情况下,可以改变本公开主题的各种细节。此外,以上描述仅出于说明性目的,而非出于限制性目的。
- 对于各种适应症的生物利用度更佳的5-羟色氨酸(5-HTP)制剂
- 增强5-羟色氨酸的生物利用度的组合物和方法
