新型环状二核苷酸衍生物及其抗体药物偶联物
文献发布时间:2023-06-19 10:44:55
技术领域
本发明涉及具有STING激动剂活性的具有新结构的环状二核苷酸衍生物、经由连接子将该新型环状二核苷酸衍生物和针对靶细胞的抗体结合而成的抗体药物偶联物、含有该抗体药物偶联物的医药组合物等。
背景技术
STING(Stimulator of Interferon Genes:干扰素基因刺激蛋白)是位于内质网的跨膜型衔接蛋白(adapter protein)(非专利文献1)。STING起到哺乳动物的自然免疫活化的中枢分子的功能,是抵御如细菌、病毒之类的病原体进入的最前线。已知STING的活化是由多个细胞质DNA传感器感知到外因性以及内因性的DNA时的信号引起的。一般认为在细胞质DNA传感器中,cGAS(Cyclic GMP-AMP Synthase:环状GMP-AMP合酶)为重要的DNA传感器。cGAS感知DNA时,产生环状二核苷酸(2’,3’-cGAMP),该2’,3’-cGAMP与STING直接结合而使STING活化(非专利文献2)。活化后的STING向高尔基体移动,在那里促进TBK1(Tank-binding kinase 1:Tank结合激酶1)的自磷酸化。进行自磷酸化而活化的TBK-1将IRF3(Interferon Regulatory Factor 3:干扰素调节因子3)转录途径(非专利文献3)以及NFκB转录途径(非专利文献4)两者活化,增加被称为干扰素或细胞因子(I型IFN(Interferon:干扰素)、IL-6(Interleukin-6:白细胞介素-6)、TNF-α(Tumor NecrosisFactor-α:肿瘤坏死因子-α))的炎性蛋白质的产生。这些蛋白质通过复杂的级联(cascade)而使包含破坏病原体或癌细胞的T细胞的获得性免疫体系启动。
根据最近的研究显示:STING不仅仅促进针对微生物的宿主防御,也促进抗肿瘤免疫。例如,向STING缺损小鼠移植免疫原性肿瘤时,比起野生型小鼠或TRIF(Toll/Interleukin-1(IL-1)receptor domain containing adaptor-inducinginterferon-β:受体域含衔接子诱导干扰素-β)缺损小鼠,肿瘤急速增殖。另外,STING缺损小鼠与TLR(Toll-like receptor:Toll样受体)、MyD88(Myeloid differentiationprimary response 88:髓样分化因子初次应答88)、MAVS(Mitochondrial antiviral-signaling protein:线粒体抗病毒信号蛋白)缺损小鼠不同,对肿瘤的自发性CD8
作为血管破坏剂而广为人知的类黄酮系低分子化合物DMXAA由于诱导巨噬细胞的I型IFN,因此在小鼠肿瘤模型中显示具有强的抗肿瘤活性(非专利文献8)。DMXAA由于在临床前的优良抗肿瘤效果,因此被期待作为非小细胞肺癌的免疫疗法药,但是在人类的临床试验中失败了(非专利文献9)。根据最近的研究清楚表明,DMXAA为针对小鼠的STING的特异性激动剂,对于人类的STING因没有物种交叉性而不能结合(非专利文献10)。就结果而言,DMXAA对人类是无效的,但是根据小鼠模型的研究表明,低分子药介入STING而有效地致敏CD8
作为其它的低分子化合物,环状二核苷酸(Cyclic dinucleotide、CDN)显示:在向荷瘤小鼠给药时,由于STING介入而抗肿瘤免疫应答增强,肿瘤增殖被显著阻碍,可改善小鼠的生存率(非专利文献11)。CDN分为具有来自细菌的标准的2个3’-5’磷酸键的CDN(cyclic-di-GMP,cyclic-di-AMP,3’,3’-cGAMP)和具有哺乳动物的cGAS所产生的非标准的2’-5’磷酸键的混合结合型CDN(2’,3’-cGAMP)。根据最近的研究显示,比起标准的CDN,混合结合型的CDN更能普遍地活化多样的STING(非专利文献12)。
天然型的CDN因为会像多数的核酸分子那样被血液中的核酸分解酶快速地分解,因此无法以原本的形态给药。因此,开发了在活体内具有STING激动剂活性的合成低分子化合物(例如专利文献1~26)。
现在,作为抗肿瘤剂推进临床试验的STING激动剂MIW-815(有时也称之为ADU-S100、ML RR-S2 CDA或ML-RR-CDA·2Na
现有技术文献
专利文献
专利文献1:WO2014/099824
专利文献2:WO2014/179335
专利文献3:WO2014/189805
专利文献4:WO2014/189806
专利文献5:WO2015/074145
专利文献6:WO2015/185565
专利文献7:WO2016/096714
专利文献8:WO2016/012305
专利文献9:WO2016/145102
专利文献10:WO2017/027646
专利文献11:WO2017/027645
专利文献12:WO2017/075477
专利文献13:WO2017/093933
专利文献14:WO2017/100305
专利文献15:WO2017/123669
专利文献16:WO2017/161349
专利文献17:WO2017/175147
专利文献18:WO2017/175156
专利文献19:WO2018/009466
专利文献20:WO2018/045204
专利文献21:WO2018/060323
专利文献22:WO2018/067423
专利文献23:WO2018/065360
专利文献24:WO2014/093936
专利文献25:WO2018/009648
专利文献26:WO2018/100558
非专利文献
非专利文献1:Nature 2008,455,674-678
非专利文献2:Mol.Cell,2013,51,226-235
非专利文献3:Science 2015a,347,aaa2630
非专利文献4:J.Virol.2014,88,5328-5341
非专利文献5:Immunity 2014,41,830-842
非专利文献6:Immunity 2014,41,843-852
非专利文献7:Nat.Med.2015,21,1209-1215
非专利文献8:J.Immunol.1994,153,4684-4693
非专利文献9:J.Clin.Oncol.2011,29,2965-2971
非专利文献10:J.Immunol.2013,190,5216-5225
非专利文献11:Sci.Rep.2016,6,19049
非专利文献12:Mol.Cell,2015,59,891-903
非专利文献13:Cell Rep.2015,11,1018-1030
非专利文献14:AACR Tumor Immunology and Immunotherapy,2017,Poster#A25
发明内容
发明所要解决的问题
期望开发具有STING激动剂活性、增加干扰素或细胞因子(cytokine)等炎性蛋白质的产生而活化免疫细胞的具有新骨架的CDN衍生物,以及使用该新型CDN衍生物的STING激动剂活性相关联的疾病、例如能基于免疫活化而治疗的疾病(例如,癌)的治疗剂和/或治疗方法。另外,期望开发能够全身给药、且能够特异性地将STING激动剂送达至目标细胞或脏器(例如,肿瘤部位)的将该新型CDN衍生物与针对靶细胞的抗体通过连接子结合而成的抗体药物偶联物,以及使用该抗体药物偶联物的STING激动剂活性相关联的疾病、例如能基于免疫活化而治疗的疾病(例如,癌)的治疗剂和/或治疗方法。
用于解决问题的方案
本发明人等为了解决上述技术问题,发现了特征在于具有稠合三环性取代基的新型CDN衍生物,并发现了该新型CDN衍生物具有强的STING激动剂活性且显示出强的抗肿瘤活性。本发明人等还发现了将本发明的新型CDN衍生物与抗体通过连接子结合而成的抗体药物偶联物,并发现了若全身给药该抗体药物偶联物,则在表达抗原的肿瘤中显示出抗肿瘤效果,从而完成本发明。
即,本发明如下所述。
[1]一种抗体药物偶联物,其由下式(II)表示:
式中,m
在此,L与L
在此,R
在此,星号表示与W
[2]根据[1]所述的抗体药物偶联物,其中,W
[3]根据[2]所述的抗体药物偶联物,其中,W
[4]根据[1]所述的抗体药物偶联物,其中,W
[5]根据[1]所述的抗体药物偶联物,其中,W
[6]根据[1]所述的抗体药物偶联物,其中,W
[7]根据[6]所述的抗体药物偶联物,其中,W
[8]根据[1]~[7]中任一项所述的抗体药物偶联物,其中,Z
[9]根据[1]~[7]中任一项所述的抗体药物偶联物,其中,Z
[10]根据[1]~[7]中任一项所述的抗体药物偶联物,其中,Z
[11]根据[1]~[10]中任一项所述的抗体药物偶联物,其中,W
[12]根据[1]~[10]中任一项所述的抗体药物偶联物,其中,W
[13]根据[1]~[12]中任一项所述的抗体药物偶联物,其中,R
[14]根据[1]~[12]中任一项所述的抗体药物偶联物,其中,R
[15]根据[1]~[14]中任一项所述的抗体药物偶联物,其中,L
[16]根据[1]~[15]中任一项所述的抗体药物偶联物,其中,L
在此,R
[17]根据[1]~[15]中任一项所述的抗体药物偶联物,其中,L
在此,R
[18]根据[1]~[15]中任一项所述的抗体药物偶联物,其中,L
在此,R
[19]根据[1]~[18]中任一项所述的抗体药物偶联物,其中,L
[20]根据[1]~[18]中任一项所述的抗体药物偶联物,其中,L
[21]根据[1]~[20]中任一项所述的抗体药物偶联物,其中,Q
[22]根据[1]~[21]中任一项所述的抗体药物偶联物,其中,X
[23]根据[1]~[22]中任一项所述的抗体药物偶联物,其中,Y
[24]根据[1]~[23]中任一项所述的抗体药物偶联物,其中,X
[25]根据[1]~[24]中任一项所述的抗体药物偶联物,其中,X
[26]根据[1]~[25]中任一项所述的抗体药物偶联物,其中,R
[27]根据[1]~[26]中任一项所述的抗体药物偶联物,其中,D由以下的2个结构式中的任一结构式表示:
在此,L
[28]根据[27]所述的抗体药物偶联物,其中,D由以下的2个结构式中的任一结构式表示:
在此,L
[29]根据[27]或[28]所述的抗体药物偶联物,其中,D由以下的8个结构式中的任一结构式表示:
在此,L
[30]根据[27]~[29]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,L
[31]根据[27]~[30]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,L
[32]根据[27]~[30]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,L
[33]根据[1]~[26]中任一项所述的抗体药物偶联物,其中,D由下式表示:
在此,L
[34]根据[33]所述的抗体药物偶联物,其中,D由以下的2个结构式中的任一结构式表示:
在此,L
[35]根据[1]~[34]中任一项所述的抗体药物偶联物,其中,L
[36]根据[1]~[34]中任一项所述的抗体药物偶联物,其中,L
式中,星号表示与L结合。
[37]根据[33]、[34]或[36]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,星号表示与L结合,Q
[38]根据[33]、[34]、[36]或[37]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,星号表示与L结合。
[39]根据[33]、[34]、[36]或[37]中任一项所述的抗体药物偶联物,其中,D由以下的3个结构式中的任一结构式表示:
在此,星号表示与L结合。
[40]根据[33]、[34]、[36]或[37]中任一项所述的抗体药物偶联物,其中,D由以下的4个结构式中的任一结构式表示:
在此,星号表示与L结合。
[41]根据[1]~[40]中任一项所述的抗体药物偶联物,其中,连接子L以-Lb-La-Lp-Lc-*表示,式中,星号表示与药物D结合,Lp表示在靶细胞中能够切断的由氨基酸序列形成的连接子或者不存在,La表示选自以下的组中的任意一个:-C(=O)-(CH
[42]根据[41]所述的抗体药物偶联物,其中,Lc不存在。
[43]根据[41]所述的抗体药物偶联物,其中,Lc为-NH-CH
[44]根据[41]~[43]中任一项所述的抗体药物偶联物,其中,Lp表示选自由以下构成的组中的任意一个:-GGVA-、-VA-、-GGFG-、-FG-、-GGPI-、-PI-、-GGVCit-、-VCit-、-GGVK-、-VK-、-GGFCit-、-FCit-、-GGFM-、-FM-、-GGLM-、-LM-、-GGICit-以及-ICit-。
[45]根据[44]所述的抗体药物偶联物,其中,Lp为-GGVA-、-VA-、-GGFG-、-FG-、-GGVCit-、-VCit-、-GGFCit-或-FCit-中的任意一个。
[46]根据[41]~[43]中任一项所述的抗体药物偶联物,其中,Lp为-GGFG-、-GGPI-、-GGVA-、-GGFM-、-GGVCit-、-GGFCit-、-GGICit-、-GGPL-、-GGAQ-或-GGPP-中的任意一个。
[47]根据[46]所述的抗体药物偶联物,其中,Lp为-GGFG-或-GGPI-。
[48]根据[41]~[47]中任一项所述的抗体药物偶联物,其中,La表示选自由以下构成的组中的任意一个:-C(=O)-CH
[49]根据[41]~[48]中任一项所述的抗体药物偶联物,其中,Lb由下述结构式中的任一结构式表示:
或,
在上述所示的Lb的结构式中,星号表示与La结合,波浪线表示与Ab的糖链或重构的糖链结合。
[50]根据[41]~[48]中任一项所述的抗体药物偶联物,其中,Lb为-(琥珀酰亚胺-3-基-N)-,在此,-(琥珀酰亚胺-3-基-N)-表示以下的结构式:
在此,星号表示与La结合,波浪线表示与抗体的半胱氨酸残基的侧链形成硫醚而结合。
[51]根据[41]、[46]~[49]中任一项所述的抗体药物偶联物,其中,连接子L以-Lb-La-Lp-Lc-*表示,式中,星号表示与药物D结合,Lp为-GGFG-、或-GGPI-,La表示-C(=O)-CH
在上述所示的Lb的结构式中,星号表示与La结合,波浪线表示与Ab的糖链或重构的糖链结合,Lc表示-NH-CH
[52]根据[1]~[51]中任一项所述的抗体药物偶联物,其中,抗体药物偶联物中的每一分子抗体的平均药物结合数在1~10个的范围。
[53]根据[52]所述的抗体药物偶联物,其中,抗体药物偶联物中的每一分子抗体的平均药物结合数在1~5个的范围。
[54]根据[1]~[53]中任一项所述的抗体药物偶联物,其中,抗体从与抗体的Asn297结合的糖链(N297糖链)与L结合。
[55]根据[54]所述的抗体药物偶联物,其中,N297糖链为重构的糖链。
[56]根据[54]或[55]所述的抗体药物偶联物,其中,N297糖链为N297-(Fuc)MSG1或N297-(Fuc)SG。
[57]根据[1]~[56]中任一项所述的抗体药物偶联物,其中,抗体为抗HER2抗体、抗HER3抗体、抗DLL3抗体、抗FAP抗体、抗CDH11抗体、抗CDH6抗体、抗A33抗体、抗CanAg抗体、抗CD19抗体、抗CD20抗体、抗CD22抗体、抗CD30抗体、抗CD33抗体、抗CD56抗体、抗CD70抗体、抗CD98抗体、抗TROP2抗体、抗CEA抗体、抗Cripto抗体、抗EphA2抗体、抗G250抗体、抗MUC1抗体、抗GPNMB抗体、抗Integrin(整合素)抗体、抗PSMA抗体、抗Tenascin-C(肌腱蛋白-C)抗体、抗SLC44A4抗体、抗Mesothelin(间皮素)抗体、抗ENPP3抗体、抗CD47抗体、抗EGFR抗体、抗GPR20抗体或抗DR5抗体。
[58]根据[57]所述的抗体药物偶联物,其中,抗体为抗HER2抗体。
[59]根据[58]所述的抗体药物偶联物,其中,抗体为包含由序列号1所述的氨基酸序列形成的轻链以及由序列号2所述的氨基酸序列形成的重链的抗体、或包含由序列号1所述的氨基酸序列形成的轻链以及由序列号3所述的氨基酸序列形成的重链的抗体。
[60]根据[58]所述的抗体药物偶联物,其中,抗体为包含由序列号28所述的氨基酸序列形成的轻链以及由序列号29所述的氨基酸序列形成的重链的抗体、或包含由序列号28所述的氨基酸序列形成的轻链以及由序列号30所述的氨基酸序列形成的重链的抗体。
[61]根据[57]所述的抗体药物偶联物,其中,抗体为包含由序列号31所述的氨基酸序列形成的轻链以及由序列号32所述的氨基酸序列形成的重链的抗体、包含由序列号33所述的氨基酸序列形成的轻链以及由序列号34所述的氨基酸序列形成的重链的抗体、或包含由序列号35所述的氨基酸序列形成的轻链以及由序列号36所述的氨基酸序列形成的重链的抗体。
[62]一种下式(Ia)所示的化合物或其药理上可接受的盐:
在此,L
在此,R
在此,星号表示与W
[63]根据[62]所述的化合物或其药理上可接受的盐,其中,W
[64]根据[63]所述的化合物或其药理上可接受的盐,其中,W
[65]根据[62]所述的化合物或其药理上可接受的盐,其中,W
[66]根据[62]所述的化合物或其药理上可接受的盐,其中,W
[67]根据[62]所述的化合物或其药理上可接受的盐,其中,W
[68]根据[67]所述的化合物或其药理上可接受的盐,其中,W
[69]根据[62]~[68]中任一项所述的化合物或其药理上可接受的盐,其中,Z
[70]根据[62]~[68]中任一项所述的化合物或其药理上可接受的盐,其中,Z
[71]根据[62]~[68]中任一项所述的化合物或其药理上可接受的盐,其中,Z
[72]根据[62]~[71]中任一项所述的化合物或其药理上可接受的盐,其中,W
[73]根据[62]~[71]中任一项所述的化合物或其药理上可接受的盐,其中,W
[74]根据[62]~[73]中任一项所述的化合物或其药理上可接受的盐,其中,R
[75]根据[62]~[73]中任一项所述的化合物或其药理上可接受的盐,其中,R
[76]根据[62]~[75]中任一项所述的化合物或其药理上可接受的盐,其中,L
[77]根据[62]~[76]中任一项所述的化合物或其药理上可接受的盐,其中,L
在此,R
[78]根据[62]~[76]中任一项所述的化合物或其药理上可接受的盐,其中,L
在此,R
[79]根据[62]~[76]中任一项所述的化合物或其药理上可接受的盐,其中,L
在此,R
[80]根据[62]~[79]中任一项所述的化合物或其药理上可接受的盐,其中,L
[81]根据[62]~[80]中任一项所述的化合物或其药理上可接受的盐,其中,Q
[82]根据[62]~[81]中任一项所述的化合物或其药理上可接受的盐,其中,X
[83]根据[62]~[82]中任一项所述的化合物或其药理上可接受的盐,其中,Y
[84]根据[62]~[83]中任一项所述的化合物或其药理上可接受的盐,其中,X
[85]根据[62]~[84]中任一项所述的化合物或其药理上可接受的盐,其中,X
[86]根据[62]~[85]中任一项所述的化合物或其药理上可接受的盐,其中,R
[87]根据[62]~[86]中任一项所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的2个结构式中的任一结构式表示:
在此,L
[88]根据[87]所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的2个结构式的任一结构式表示:
在此,L
[89]根据[87]或[88]所述的化合物或其药理上可接受的盐,其中,所述化合物以下的8个结构式中的任一结构式表示:
在此,L
[90]根据[87]~[89]中任一项所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的4个结构式中的任一结构式表示:
在此,L
[91]根据[87]~[90]中任一项所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的4个结构式中的任一结构式表示:
在此,L
[92]根据[87]~[90]中任一项所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的4个结构式中的任一结构式表示:
在此,L
[93]根据[62]~[86]中任一项所述的化合物或其药理上可接受的盐,其中,所述化合物由下式表示:
在此,L
[94]根据[93]所述的化合物或其药理上可接受的盐,其中,所述化合物由以下的2个结构式中的任一结构式表示:
在此,L
[95]根据[62]~[94]中任一项所述的化合物或其药理上可接受的盐,其中,L
[96]根据[62]~[94]中任一项所述的化合物或其药理上可接受的盐,L
[97]根据[93]、[94]或[96]中任一项所述的化合物或其药理上可接受的盐,其中,D由以下的4个结构式中的任一结构式表示:
在此,Q
[98]根据[93]、[94]、[96]或[97]中任一项所述的化合物或其药理上可接受的盐,其中,D由以下的4个结构式中的任一结构式表示:
[99]根据[93]、[94]、[96]或[97]中任一项所述的化合物或其药理上可接受的盐,其中,D由以下的3个结构式中的任一结构式表示:
[100]根据[93]、[94]、[96]或[97]中任一项所述的化合物或其药理上可接受的盐,其中,D由以下的4个结构式中的任一结构式表示:
[101]一种STING激动剂,其含有选自由[1]~[61]所述的抗体药物偶联物以及[62]~[100]所述的化合物或其药理上可接受的盐构成的组中的任意种。
[102]一种医药组合物,其含有选自由[1]~[61]所述的抗体药物偶联物以及[62]~[100]所述的化合物或其药理上可接受的盐构成的组中的任意种。
[103]一种抗肿瘤剂,其含有选自由[1]~[61]所述的抗体药物偶联物以及[62]~[100]所述的化合物或其药理上可接受的盐构成的组中的任意种。
[104]根据[103]所述的抗肿瘤剂,其中,肿瘤为肺癌、肾癌、尿道上皮癌、大肠癌、前列腺癌、多形性神经胶质母细胞瘤、卵巢癌、胰腺癌、乳腺癌、黑色素瘤、肝癌、膀胱癌、胃癌、食道癌、子宫体癌、睾丸癌、子宫颈癌、胎盘绒毛膜癌、多形性神经胶质母细胞瘤、脑肿瘤、头颈部癌、甲状腺癌、间皮瘤、胃肠道间质瘤(GIST)、胆囊癌、胆管癌、肾上腺癌、鳞状细胞癌、白血病、恶性淋巴瘤、浆细胞瘤、骨髓瘤或肉瘤;
[105]一种癌的治疗方法,其包括:给药选自由[1]~[61]所述的抗体药物偶联物、[62]~[100]所述的化合物或其药理上可接受的盐、[101]所述的STING激动剂、[102]所述的医药组合物、以及[103]或[104]所述的抗肿瘤剂构成的组中的任意种。
[106]根据[105]所述的方法,其中,癌为肺癌、肾癌、尿道上皮癌、大肠癌、前列腺癌、多形性神经胶质母细胞瘤、卵巢癌、胰腺癌、乳腺癌、黑色素瘤、肝癌、膀胱癌、胃癌、食道癌、子宫体癌、睾丸癌、子宫颈癌、胎盘绒毛膜癌、多形性神经胶质母细胞瘤、脑肿瘤、头颈部癌、甲状腺癌、间皮瘤、胃肠道间质瘤(GIST)、胆囊癌、胆管癌、肾上腺癌、鳞状细胞癌、白血病、恶性淋巴瘤、浆细胞瘤、骨髓瘤或肉瘤。
发明效果
本发明提供一种新型CDN衍生物。本发明的新型CDN衍生物具有强的STING激动剂活性,且显示高的抗肿瘤活性。另外,本发明还提供一种能够全身给药,且在表达抗原的肿瘤中显示抗肿瘤效果的新型抗体CDN衍生物偶联物。
附图说明
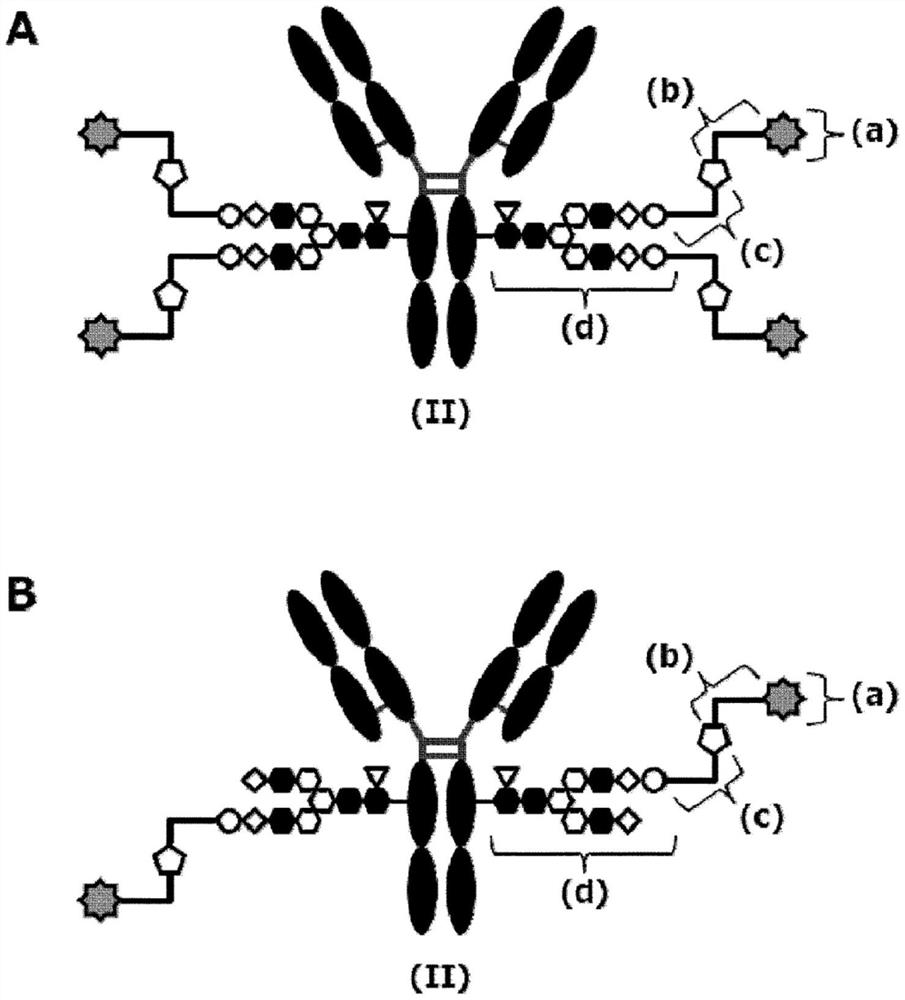
图1示意地表示作为本发明的药物偶联物((II)的分子)的、由SG型糖链重构抗体得到的药物偶联物(图1的A的(II)的分子)以及由MSG型糖链重构抗体得到的药物偶联物(图1的B的(II)的分子)。(a)表示药物D,(b)表示连接子L,(c)表示PEG连接子(L(PEG)),(d)表示N297糖链(在此,白色的圆形表示NeuAc(Sia)、白色的六角形表示Man、黑色的六角形表示GlcNAc、白色的菱形表示Gal以及白色的倒三角形表示Fuc)。白色的五角形表示来自连接子L的炔烃与来自PEG连接子的叠氮基反应而生成的三唑环。Y字型表示抗体Ab。PEG连接子与位于非还原末端的唾液酸的2位羧基经由酰胺键连接。只要没有特别说明,该表示方法在本说明书中全部适用。
图2是表示作为本发明的药物偶联物的制造中间体的(Fucα1,6)GlcNAc-抗体(图2的A的(III)的分子)、SG型糖链重构抗体(图2的B的(IV)的分子)、以及MSG型糖链重构抗体(图2的C的(IV)的分子)的结构的示意图。在所有的图中,Y字型与图1一样表示抗体Ab。在图2的A中,(e)表示在Fuc的1位与GlcNAc的6位由α糖苷键合的双糖构成的N297糖链。在图2的B以及C中,(d)表示与图1同样的N297糖链,(f)为具有叠氮基的PEG连接子,表示在末端提供给与连接子L的结合的叠氮基。具有叠氮基的PEG连接子的结合方式与图1的PEG连接子相同。
图3为从在动物细胞产生的抗体制造SG型糖链重构抗体以及MSG型糖链重构抗体的工序的示意图。图中的分子(III)以及(IV)与图2同样,分别表示(Fucα1,6)GlcNAc-抗体以及SG型糖链重构抗体或MSG型糖链重构抗体。(V)的分子为在动物细胞产生的抗体,是N297糖链不均匀的分子的混合物。图3的A表示将(V)的不均匀N297糖链用EndoS之类的水解酶处理而制作均匀的(Fucα1,6)GlcNAc-抗体(III)的工序。图3的B表示对抗体(III)的N297糖链的GlcNAc,使用EndoS D233Q/Q303L变异体之类的糖基转移酶使SG型糖链供体分子进行糖链转移,从而制作(IV)的SG型糖链重构抗体的工序。图3的C与图3的B同样,是对抗体(III)使MSG型糖链供体分子进行糖链转移而制作(IV)的MSG型糖链重构抗体的工序。在此使用的SG型糖链供体分子以及MSG型糖链供体分子是各自的非还原末端的唾液酸被具有叠氮基的PEG连接子修饰而成的,在制作的SG型N297糖链重构抗体以及MSG型N297糖链重构抗体中,如图2的B以及C所示,非还原末端的唾液酸也进行了同样的修饰。
图4表示曲妥珠单抗(Trastuzumab)的轻链的氨基酸序列(序列号1)以及重链的氨基酸序列(序列号2)。
图5表示改造抗HER2抗体的轻链的氨基酸序列(序列号1)以及重链的氨基酸序列(序列号3)。
图6表示(a)人类STING野生型的氨基酸序列、(b)人类STING REF变异型(R232H)的氨基酸序列、以及(c)人类STING HAQ变异体(R71H、G230A、R293Q)的氨基酸序列。
图7表示基于CDN衍生物的肿瘤内给药的抗肿瘤效果。图中的黑四方线表示媒液(vehicle)组、白四方线表示化合物编号6a给药组、白倒三角线表示化合物编号8b给药组、白圆形线表示化合物编号9b给药组。纵轴表示肿瘤体积(mm
图8表示基于抗HER2抗体-CDN偶联物(1)以及抗LPS抗体-CDN偶联物(1)的静脉给药的抗肿瘤效果。图中的黑四方线为媒液组,白三角线表示使参考例1中制作的改造抗HER2抗体与实施例8b的化合物偶联而成的抗HER2抗体-CDN偶联物(1)给药组,黑三角线表示使参考例2中制作的改造抗LPS抗体同样地与实施例8b的化合物偶联而成的抗LPS抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
图9表示基于抗HER2抗体-CDN偶联物(2)以及(3)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白四方线表示抗HER2抗体-CDN偶联物(2)给药组,白三角线表示抗HER2抗体-CDN偶联物(3)给药组。纵轴表示肿瘤体积(mm
图10表示基于抗HER2抗体-CDN偶联物(19)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白三角线表示抗HER2抗体-CDN偶联物(19)给药组。抗HER2抗体-CDN偶联物(19)为药物连接子用半胱氨酸偶联(cysteine conjugation)与抗体结合。纵轴表示肿瘤体积(mm
图11表示基于抗HER2抗体-CDN偶联物(1)以及(9)~(12)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白三角线表示抗HER2抗体-CDN偶联物(9)给药组,白倒三角线表示抗HER2抗体-CDN偶联物(10)给药组,白菱形线表示抗HER2抗体-CDN偶联物(11)给药组、白圆形线表示抗HER2抗体-CDN偶联物(12)给药组、白四方线表示抗HER2抗体-CDN偶联物(1)给药组。抗HER2抗体-CDN偶联物(9)、(10)、(11)、(12)、(1)分别用不同的连接子偶联实施例8b的化合物。纵轴表示肿瘤体积(mm
图12表示基于抗HER2抗体2-CDN偶联物(1)、抗HER2抗体2以及化合物编号8b的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白三角线表示抗HER2抗体2-CDN偶联物(1)的60μg给药组,黑倒三角线表示抗HER2抗体2的59μg给药组,黑圆形线表示化合物编号8b的1.2μg给药组。抗HER2抗体2以及化合物编号8b的给药量为构成抗HER2抗体2-CDN偶联物(1)的各成分的当量。纵轴表示肿瘤体积(mm
图13(a)表示基于抗HER2抗体2-CDN偶联物(2)以及(3)的静脉给药的抗肿瘤效果。图13(b)表示基于抗HER2抗体2-CDN偶联物(4)、(5)、(7)以及(8)的静脉给药的抗肿瘤效果。图13(c)表示基于抗HER2抗体2-CDN偶联物(6)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,各白符号线表示评价的各抗HER2抗体2-CDN偶联物(2)~(8)给药组。纵轴表示肿瘤体积(mm
图14表示基于抗HER2抗体2-CDN偶联物(9)以及(10)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白三角线表示抗HER2抗体2-CDN偶联物(9)给药组,白圆形线表示抗HER2抗体2-CDN偶联物(10)给药组。抗HER2抗体2-CDN偶联物(9)、(10)为使用药物平均结合数约2的MSG型糖链重构抗体的抗体-CDN偶联物。纵轴表示肿瘤体积(mm
图15表示基于抗EphA2抗体以及抗EphA2抗体-CDN偶联物(1)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白圆形线表示抗EphA2抗体给药组,白三角线表示抗EphA2抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
图16表示基于抗CD33抗体以及抗CD33抗体-CDN偶联物(1)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白圆形线表示抗CD33抗体给药组,白三角线表示抗CD33抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
图17表示帕妥珠单抗(Pertuzumab)的轻链的氨基酸序列(序列号28)以及重链的氨基酸序列(序列号29)。
图18表示改造抗HER2抗体2的轻链的氨基酸序列(序列号28)以及重链的氨基酸序列(序列号30)。
图19表示抗CD33抗体的轻链的氨基酸序列(序列号31)以及重链的氨基酸序列(序列号32)。
图20表示抗EphA2抗体的轻链的氨基酸序列(序列号33)以及重链的氨基酸序列(序列号34)。
图21表示抗CDH6抗体的轻链的氨基酸序列(序列号35)以及重链的氨基酸序列(序列号36)。
图22表示基于抗HER2抗体2-CDN偶联物(11)以及(12)的静脉给药的抗肿瘤效果。图中的黑四方线表示媒液组,白三角线表示抗HER2抗体2-CDN偶联物(11)给药组,白圆形线表示抗HER2抗体2-CDN偶联物(12)给药组。
具体实施方式
本发明涉及具有STING激动剂活性的新型CDN衍生物及其抗体药物偶联物、以及它们的应用。本发明的新型CDN衍生物具有STING激动剂活性,活化免疫细胞而诱导干扰素、细胞因子的产生。另外,本发明的新型CDN衍生物通过该免疫细胞的活化而发挥抗肿瘤效果。新型CDN衍生物可以直接给药至欲使免疫功能活化的目标组织,或者可以与能够识别并结合靶细胞(例如,肿瘤细胞或免疫细胞)的抗体经由任意的连接子连接而被全身给药。
STING(Stimulator of Interferon Genes)是指位于内质网的跨膜型的衔接蛋白。已知在STING高频率存在先天的多型(PLoS One、2013Oct、21、8(10)、e77846)。就STING变异型而言,已知有例如,第232位氨基酸从精氨酸(R)变异成组氨酸(H)的R232H变异,第71位精氨酸(R)变异成组氨酸(H)、第230位甘氨酸(G)变异成丙氨酸(A)、第293位精氨酸(R)变异成谷氨酰胺(Q)的HAQ变异。已知此类STING的多型在通过STING激动剂刺激而被诱导的细胞因子产生量等的反应强度上存在差异(Genes and Immunity、2011、12、263-269)。因此,为了STING激动剂对人类稳定地作用,优选对各STING的型具有活性。
在本说明书中,“癌”、“癌症”以及“肿瘤”具有相同的含义。
在本发明中,“免疫活化活性”是指以任何形式而引起单核细胞、巨噬细胞、树突状细胞、T细胞、B细胞、NK细胞、中性粒细胞等参与抗肿瘤免疫的免疫细胞的活化,例如引起细胞因子以及趋化因子的产生、免疫活化标记的表达上升、免疫抑制性标记的表达降低、细胞内信号转导系统的磷酸化等变化、基因表达的变化等所有的免疫细胞的结构或功能上的变化。另外,也包含引起肿瘤细胞诱导抗肿瘤免疫的变化,例如是指使免疫细胞活化或诱导游离的细胞因子以及趋化因子的产生、诱导对免疫细胞的感受性亢进等。
在本发明中,“抗肿瘤效果”是指通过药物直接或间接地影响肿瘤细胞,由此诱导肿瘤的减少或退缩。例如,通过药物直接对肿瘤细胞给予伤害,肿瘤细胞由于受到药物的刺激而使抗肿瘤免疫活化,被送达至肿瘤细胞的药物向细胞外释放等而肿瘤细胞周围的抗肿瘤免疫活化等,而引起肿瘤细胞数的减少以及伤害,或肿瘤的退缩,称之为抗肿瘤效果。
本发明中,“细胞毒性”是指以任何形式对细胞引起病理的变化,不仅是指直接的外伤,也指引起DNA的切断或碱基的二聚体的形成、染色体的切断、细胞分裂装置的损伤、各种酶活性的降低等所有的细胞的结构、功能上的损伤。
本发明中,“细胞”也包含动物个体内的细胞,培养细胞。
本说明书中,“卤素原子”是指氟原子、氯原子、溴原子、碘原子。
本说明书中,“C1-C6烷基”是指碳原子数1~6的直链或支链的烷基。“C1-C6烷基”如果总碳原子数不超过6,在烷基上也可以具有环丙烷。“C1-C6烷基”例如可以举出以下的结构,但不限定于此。
波浪线表示取代位置。
本说明书中,“C2-C6烯基”是指碳原子数2~6的直链或支链的烯基。
本说明书中,“C2-C6炔基”是指碳原子数2~6的直链、支链的炔基。
本说明书中,“C3-C6环烷基”是指碳原子数3~6的饱和环状烃基。“C3-C6环烷基”如果总碳原子数不超过6,也可以被多个烷基取代。“C3-C6环烷基”例如可以举出以下的结构,但并不限定于此。
波浪线表示取代位置。
本说明书中,“羟基C1-C6烷基”是指在碳原子数1~6的直链、支链的烷基的任意的位置上有1或2个羟基取代的烷基。“羟基C1-C6烷基”如果总碳原子数不超过6,也可以在烷基上具有环丙烷。“羟基C1-C6烷基”例如可以举出如下的结构,但并不限定于此。
波浪线表示取代位置。
本发明中,“氨基C1-C6烷基”是指在碳原子数1~6的直链或支链的烷基的任意位置上有1个或2个氨基取代的烷基。“氨基C1-C6烷基”如果总碳原子数不超过6,也可以在烷基上具有环丙烷。“氨基C1-C6烷基”可以举出例如以下的结构,但并不限定于此。
波浪线表示取代位置。
<1.新型CDN衍生物>
本发明的新型CDN衍生物具有下式(Ia)所示的结构:
L
(式中,R
另外,L
(式中,R
L
(式中,R
另外,L
(式中,R
此外,L
(式中,R
L
L
Q
Q
Q
Q
X
Y
X
X
R
R
R
R
W
R
W
R
Z
(式中,星号表示与W
另外,本发明的新型CDN衍生物优选具有下式所示的结构:
L
Q
R
W
本发明的新型CDN衍生物的制造方法记载于后述的<3.制造方法>。
<2.抗体药物偶联物>
本发明的新型CDN衍生物可以直接给药于目标组织(例如,肿瘤内给药),或者也可以作为将本发明的新型CDN衍生物与能够识别并结合靶细胞(例如,肿瘤细胞或免疫细胞)的抗体经由任意的连接子连接而成的抗体药物偶联物进行给药。
本发明的抗体药物偶联物如下式(II)所示:
m
药物D是具有活化免疫细胞的活性,具体而言具有STING激动剂活性的化合物。药物D在连接子的一部分或全部在靶细胞(例如,肿瘤细胞或免疫细胞)内被切断时,以原本的结构游离而发挥免疫活化效果。通过靶细胞对免疫细胞的感受性亢进或经由靶细胞的免疫细胞的活化而发挥目标功能。作为目标功能,只要是与STING激动剂活性相关联的功能则没有特别的限定,优选抗肿瘤活性。即,与以肿瘤作为靶的抗体(例如,抗HER2抗体)通过任意的连接子而连接的药物D被送达至靶细胞或组织,连接子的一部分或全部被切断,通过靶细胞对免疫细胞的感受性亢进或经由靶细胞的免疫细胞的活化(例如,干扰素或细胞因子的产生)发挥抗肿瘤效果。
与本发明的抗体药物偶联物结合的药物D如下式(I)所示:
式中,L与L
L
本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的2个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的2个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的8个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的4个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的4个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的4个结构式中的任一结构式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由下式表示:
(式中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D中,L
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D中,L
(式中,星号表示与L结合)。
另外,本发明的新型CDN衍生物或本发明的抗体药物偶联物中使用的药物D优选由以下的4个结构式中的任一结构式表示:
(式中,星号表示与L结合,Q
<2.1.连接子结构>
对本发明的抗体药物偶联物中将药物与抗体结合的连接子结构进行说明。本发明的抗体药物偶联物中使用的连接子只要是作为将抗体与药物连接的连接子,本领域技术人员所理解的连接子,就没有特别的限定。作为本发明的抗体药物偶联物中使用的连接子,可以举出例如Protein Cell、2018、9(1):33-46、Pharm Res、2015、32:3526-3540、或Int.J.Mol.Sci.、2016、17、561中记载的连接子,但并不限定于此。连接子可以是在活体内被切断的连接子,也可以是在活体内未被切断的连接子,但是优选为在活体内被切断的连接子。
作为本发明的抗体药物偶联物中使用的连接子,可以举出例如将药物与抗体的Fc部分的糖链或重构的糖链结合的(本说明书中有时称为“糖链偶联(sugar chainconjugation)”)连接子(例如,记载于WO2018/003983)、或使药物与抗体的任意的氨基酸残基(例如,半胱氨酸残基或赖氨酸残基)结合的连接子(例如,记载于WO2014/057687),但并不限定于此。作为将药物与抗体的任意的氨基酸残基结合的连接子,优选可以举出与Ab的半胱氨酸的巯基(SH基)形成硫醚而结合的情况(本说明书中有时称为“半胱氨酸偶联”)或与Ab的赖氨酸的氨基(NH
本发明的优选连接子L以下式表示。
-Lb-La-Lp-Lc-*
(式中,星号表示与药物D的L
首先,对Lp进行说明。
Lp表示在活体内或靶细胞中能够切断的由氨基酸序列形成的连接子(以下,在本说明书中也称为肽连接子)或者不存在。
Lp在例如肽酶、酯酶等酶的作用下被切断。Lp是由2~7个(优选2~4个)氨基酸构成的肽。Lp在其N末端与后述的La的右端的羰基形成酰胺键,在C末端与Lc的氨基(-NH-)形成酰胺键。通过所述肽酶等酶将Lp的C末端侧的酰胺键切断。
构成Lp的氨基酸没有特别的限定,例如为L-或D-氨基酸,优选为L-氨基酸。另外,除了α-氨基酸之外,可为β-丙氨酸、ε-氨基己酸、γ-氨基丁酸等结构的氨基酸,进而,可为例如N-甲基化的氨基酸等非天然型的氨基酸。Lp的氨基酸序列没有特别的限定,作为构成的氨基酸,可列举甘氨酸(Gly;G)、缬氨酸(Val;V)、丙氨酸(Ala;A)、苯丙氨酸(Phe;F)、谷氨酸(Glu;E)、异亮氨酸(Ile;I)、脯氨酸(Pro;P)、瓜氨酸(Cit)、亮氨酸(Leu;L)、蛋氨酸(Met;M)、丝氨酸(Ser;S)、赖氨酸(Lys;K)以及天冬氨酸(Asp;D)等。其中,优选甘氨酸(Gly;G)、缬氨酸(Val;V)、丙氨酸(Ala;A)、苯丙氨酸(Phe:F)、瓜氨酸(Cit)。这些氨基酸可以重复,具有包含任意选择的氨基酸的氨基酸序列。另外,可以通过氨基酸的种类控制药物游离的样式。
作为Lp的具体例,可以举出例如-GGVA-、-VA-、-GGFG-、-FG-、-GGPI-、-PI-、-GGVCit-、-VCit-、-GGVK-、-VK-、-GGFCit-、-FCit-、-GGFM-、-FM-、-GGLM-、-LM-、-GGICit-、-ICit-。连接子Lp优选为-GGVA-、-VA-、-GGFG-、-FG-、-GGVCit-、-VCit-、-GGFCit-、-FCit-。连接子Lp更优选为-GGVA-、-GGFG-、-GGVCit-。另外,连接子Lp优选为-GGFG-或-GGPI-。
以下对La进行说明。
La表示选自以下构成的组中的任一个:-C(=O)-(CH
(在此,式中,n
La优选表示选自以下构成的组中的任一个:-C(=O)-CH
La更优选为-C(=O)-CH
La更优选为-C(=O)-CH
接着对Lb进行说明。
Lb表示糖链偶联的连接子中使用的间隔子(本说明书中也称为“糖链偶联的连接子的间隔子”)、或半胱氨酸偶联中使用的间隔子(本说明书中也称为“半胱氨酸偶联的连接子的间隔子”)。
在Lb为“糖链偶联的连接子的间隔子”的情况下,Lb没有特别的限定,可以举出例如下式所示的间隔子。
上述所示的各个结构式中,星号(*)表示与La的左端的-(C=O)-或-CH
在Lb选择Lb-1、Lb-2或Lb-3中的任一者时,三唑环部位具有几何异构结构,且在1个Lb中包含2种结构中的任一种,或包含这些的混合物。本发明的抗体药物偶联物可以使多个药物与1分子抗体结合。在1分子抗体上结合多个药物时,也存在多个Lb(例如,参照后述的<3.制造方法>的E法中所示的抗体药物偶联物的模式图(1e))。Lb选自Lb-1、Lb-2或Lb-3中的任一种、在1分子抗体存在多个该Lb时(例如,后述的m
Lb为“半胱氨酸偶联的连接子的间隔子”的情况下,Lb没有特别的限定,可以举出例如-(琥珀酰亚胺-3-基-N)-。本发明中,“-(琥珀酰亚胺-3-基-N)-”具有下式所示的结构:
上述所示的结构式中,星号表示与La结合,波浪线与抗体的半胱氨酸残基的侧链形成硫醚而结合。
接着,对Lc进行说明。
Lc表示-NH-CH
就本发明更优选的连接子L而言,当药物与抗体的结合方式为“糖链偶联”时,连接子L为-Z
或者,药物与抗体的结合方式为“半胱氨酸偶联”时,连接子L为-Z
本发明的更优选的连接子L为药物与抗体的结合方式为“糖链偶联”,为-Z
上述的“优选的连接子L”以及“更优选的连接子L”中的右端与式(I)的L
<2.2.抗体及其糖链修饰>
<2.2.1抗体>
本说明书中,“基因”是指编码蛋白质的氨基酸的核苷酸序列所含的核苷酸或核苷酸序列、或其互补链,例如,编码蛋白质的氨基酸的核苷酸序列所含有的核苷酸序列或作为其互补链的多核苷酸、寡核苷酸、DNA、mRNA、cDNA、RNA等也包含在“基因”的含义中。
本说明书中,“核苷酸”、“多核苷酸”或“核苷酸序列”与“核酸”为同样的含义,例如,DNA、RNA、探针、寡核苷酸、多核苷酸、引物等也包含在“核苷酸”或“核苷酸序列”的含义中。
本说明书中,无区别地使用“多肽”、“肽”、“蛋白质”。
本说明书中,“抗体的功能性片段”也称为“抗体的抗原结合片段”,是指具有与抗原的结合活性的抗体的部分片段,包含Fab、F(ab’)2、Fv、scFv、diabody(双链抗体)、线状抗体以及由抗体片段形成的多特异性抗体等。另外,将F(ab’)2在还原条件下进行处理后的抗体的可变区域的单价片段Fab’也包含在抗体的抗原结合片段中。但是,只要具有与抗原的结合能力,就不限定于这些分子。另外,这些抗原结合片段不仅包含将抗体蛋白质的全长分子用适当的酶处理后的分子,也包含使用经过基因工程改造的抗体基因而在适当的宿主细胞中产生的蛋白质。
本发明的功能性片段包含保持受到在IgG重链的Fc区域中良好地保存的N结合型糖链所致的修饰的天冬酰胺(Asn297)及其周边的氨基酸,且具有与抗原的结合能力的功能性片段。
本发明的抗体药物偶联物中使用的抗体是指免疫球蛋白,是含有与抗原免疫特异性结合的抗原结合部位的分子。作为本发明的抗体,可以是IgG、IgE、IgM、IgD、IgA以及IgY中的任一类,优选IgG。另外,作为亚类(subclass),可以是IgG1、IgG2、IgG3、IgG4、IgA1以及IgA2中的任一种,优选IgG1、IgG2或IgG4(包含IgG重链的Fc区域中具有影响ADCC以及ADCP活性的变异的抗体)。
使用IgG1作为本发明的抗体的同型(isotype)时,可以将恒定区的氨基酸残基的一部分取代而调整效应物(effector)功能(参照WO88/07089、WO94/28027、WO94/29351)。作为IgG1的变异体,可以举出例如IgG1 LALA变异(IgG1-L234A、L235A)。上述L234A、L235A表示依据EU index(Proceedings of the National Academy of Sciences of the UnitedStates of America,Vol.63,No.1(May 15,1969),pp.78-85)所特定的234位以及235位的亮氨酸被丙氨酸取代。
抗体可以源自任一物种,优选可以例示人类、大鼠、小鼠以及兔子。抗体源自人类以外的物种时,优选使用公知的技术而嵌合化或人源化。本发明的抗体可以是多克隆抗体,也可以是单克隆抗体,优选单克隆抗体。单克隆抗体包含大鼠抗体、小鼠抗体、兔子抗体等源自非人动物的单克隆抗体、嵌合抗体、人源化抗体、人类抗体、它们的功能性片段或它们的修饰体。
抗体优选以肿瘤细胞或免疫细胞为靶细胞的抗体,但是并不限定于此。抗体更优选以肿瘤细胞为靶细胞的抗体。
使用以肿瘤细胞为靶细胞的抗体时,作为抗体,优选具备能够识别肿瘤细胞的特性、能够与肿瘤细胞结合的特性、被吞入肿瘤细胞内而内化的特性、以及伤害肿瘤细胞的特性中的一种以上的特性。与本发明的抗体通过连接子结合的药物具有STING激动剂活性。本发明的药物使干扰素控制因子3(interferon regulatory factor-3(IRF3))的信号活化而诱导干扰素。因此,本发明的抗体药物偶联物中使用以肿瘤细胞为靶细胞的抗体时,抗体药物偶联物被体内给药后,送达到肿瘤部位,被吞入肿瘤细胞内后被肽酶等切断连接子部分,药物部分游离。认为游离的药物部分通过STING激动剂活性使抗肿瘤免疫活化从而发挥抗肿瘤效果。
抗体与肿瘤细胞的结合性可以使用流式细胞仪来确认。抗体向肿瘤细胞内的吞入可以使用下述方式进行确认:(1)使用与治疗抗体结合的二次抗体(荧光标识)通过荧光显微镜将吞入细胞内的抗体可视化的分析(Cell Death and Differentiation(2008)15,751-761),(2)使用与治疗抗体结合的二次抗体(荧光标识)测定吞入细胞内的荧光量的分析(Molecular Biology of the Cell Vol.15,5268-5282,December 2004),或(3)使用与治疗抗体结合的免疫毒素,当被吞入细胞内时,毒素被释放从而抑制细胞增殖的Mab-ZAP分析(Bio Techniques 28:162-165,January 2000)。作为免疫毒素,也可以使用白喉毒素的催化区与蛋白G的重组复合蛋白质。
本发明中,“高内化能力”是指添加了该抗体与皂草素标识抗小鼠或大鼠IgG抗体的靶抗原表达细胞(例如,使用抗HER2抗体时,为HER2表达细胞)的生存率(以未添加抗体时的细胞生存率为100%的相对率来表示),优选为70%以下,更优选为60%以下。
本发明的抗体药物偶联物使用以肿瘤细胞为靶点的抗体时,优选抗体本身具有抗肿瘤效果,但不是必须的。本发明的抗体药物偶联物中使用的抗体优选具有转移至肿瘤细胞内的内化的性质。
药物以及抗体药物偶联物的抗肿瘤活性是指对肿瘤细胞的细胞毒性、抗细胞效果、肿瘤体积的萎缩。可以使用公知的体外(in vitro)或体内(in vivo)的评价系统来确认抗肿瘤活性。
药物以及抗体药物偶联物的免疫活化活性是指肿瘤细胞对免疫细胞的感受性亢进或通过肿瘤细胞的免疫细胞的活化。可以使用公知的体外(in vitro)或体内(in vivo)的评价系统来确认免疫活化活性。
作为本发明中使用的抗体,可以举出例如抗HER2抗体、抗HER3抗体、抗DLL3抗体、抗FAP抗体、抗CDH11抗体、抗CDH6抗体、抗A33抗体、抗CanAg抗体、抗CD19抗体、抗CD20抗体、抗CD22抗体、抗CD30抗体、抗CD33抗体、抗CD56抗体、抗CD70抗体、抗CD98抗体、抗TROP2抗体、抗CEA抗体、抗Cripto抗体、抗EphA2抗体、抗G250抗体、抗MUC1抗体、抗GPNMB抗体、抗Integrin抗体、抗PSMA抗体、抗Tenascin-C抗体、抗SLC44A4抗体、抗Mesothelin抗体、抗ENPP3抗体、抗CD47抗体、抗EGFR抗体、抗GPR20抗体或抗DR5抗体,但并不限定于此。作为本发明的抗体,优选抗HER2抗体(例如,曲妥单抗或帕妥珠单抗)、抗CDH6抗体、抗CD33抗体或抗EphA2抗体,更优选抗HER2抗体。
本发明的抗体可以通过使用本领域通常实施的方法,使用作为抗原的多肽对动物进行免疫,并采集和精制活体内产生的抗体来获得。抗原的来源不仅限于人类,还可以使用来源于小鼠、大鼠等人类以外的动物的抗原对动物进行免疫。这种情况下,可以通过试验与所获得的异种抗原相结合的抗体与人类抗原之间的交叉性来挑选能够适用于人类疾病的抗体。
另外,也可以根据公知的方法(例如,Kohler and Milstein,Nature(1975)256,p.495-497、Kennett,R.ed.,Monoclonal Antibodies,p.365-367,Plenum Press,N.Y.(1980)),通过使产生对抗原的抗体的抗体产生细胞与骨髓瘤细胞融合来建立杂交瘤,获得单克隆抗体。
予以说明,可以通过基因操作在宿主细胞内产生编码抗原蛋白质的基因来获得抗原。
本发明的人源化抗体可使用公知的方法(例如,Proc.Natl.Acad.Sci.U.S.A.,81,6851-6855,(1984)、Nature(1986)321,p.522-525、WO90/07861)来获得。
例如,抗HER2抗体(US5821337、WO2004/008099等)、抗CD33抗体(WO2014/057687等)、抗CD70抗体(WO2004/073656等)、抗EphA2抗体(WO2009/028639等)、抗CDH6抗体(WO2018/212136等)可使用公知的方法获得。
本发明的抗HER2抗体没有特别的限定,优选例如具有以下的特性的抗体。
(1)一种抗HER2抗体,其特征在于,具有以下的特性:(a)与HER2特异性结合。(b)具有通过与HER2结合而内化于HER2表达细胞的活性。
(2)如上述(1)所述的抗体,其与HER2的细胞外结构域结合。
(3)如上述(1)或(2)所述的抗体,所述抗体为单克隆抗体。
(4)如上述(1)~(3)中任一项所述的抗体,其具有抗体依赖性细胞毒性(ADCC)和/或补体依赖性细胞毒性(CDC)。
(5)如上述(1)~(4)中任一项所述的抗体,其为小鼠单克隆抗体、嵌合单克隆抗体或人源化单克隆抗体。
(6)如上述(1)~(3)所述的抗体,其中,重链恒定区为人类IgG1的重链恒定区,包含引起ADCC以及ADCP活性降低的变异。
(7)如上述(1)~(4)中任一项所述的抗体,其为包含由序列号2所述的氨基酸序列形成的重链以及由序列号1所述的氨基酸序列形成的轻链的人源化单克隆抗体。
(8)如上述(5)所述的抗体,其中,重链恒定区为人类IgG1的重链恒定区,依据EUINDEX所示的234位以及235位的亮氨酸被丙氨酸取代。
(9)如上述(8)所述的抗体,其为包含由序列号3所述的氨基酸序列形成的重链以及由序列号1所述的氨基酸序列形成的轻链的人源化单克隆抗体。
(10)如上述(1)~(4)所述的抗体,其为包含由序列号29所述的氨基酸序列形成的重链以及由序列号28所述的氨基酸序列形成的轻链的人源化单克隆抗体。
(11)如上述(1)~(4)所述的抗体,其为包含由序列号30所述的氨基酸序列形成的重链以及由序列号28所述的氨基酸序列形成的轻链的人源化单克隆抗体。
(12)如上述(1)~(11)中任一项所述的抗体,在重链羧基末端缺失1个或2个氨基酸。
(13)一种抗体,其由包含下述工序的该抗体的制造方法得到:培养通过含有编码上述(1)~(12)中任一项所述的抗体的多核苷酸的表达载体被转化后的宿主细胞的工序;以及从由该工序得到的培养物中采集目标抗体的工序。
<2.2.2抗体的糖链重构>
近年来,报道了通过酶反应重构不均匀的抗体的糖链,均匀地导入具有官能团的糖链的方法(ACS Chem.Biol.2012,7,110-112,ACS Med.Chem.Lett.2016,7,1005)。已经尝试使用这种糖链重构技术,部位特异性地导入药物,合成均匀的ADC(BioconjugateChem.2015,26,2233-2242,Angew.Chem.Int.Ed.2016,55,2361-2367,US2016361436)。
糖链的重构首先使用水解酶切除附加到蛋白质(抗体等)中的不均匀的糖链仅仅留下末端的GlcNAc,制备添加了GlcNAc的均匀的蛋白质部分(以下称为“受体”)。接着,准备另外制备的任意的糖链(以下称为“供体”),使用糖基转移酶连结该受体和供体。由此可以合成具有任意糖链结构的均匀的糖蛋白质。
本发明中,“糖链”是指有两个以上的单糖通过糖苷键结合的结构单元。具体的单糖或者糖链有时可以缩写形式表示,例如“GlcNAc-”、“SG-”。结构式中使用这些缩写描述时,除非另有说明,否则还原末端上归属于与其它结构单元的糖苷键的氧原子或氮原子并不包含在表示该糖链的缩写中。
本发明中,除非另有说明,为方便起见,在作为糖链的基本单元的单糖的记载中,在环结构中与构成环的氧原子结合且与羟基(或归属于糖苷键的氧原子)直接结合的碳原子标记为1位(仅唾液酸中为2位)。实施例化合物的名称以化学结构整体来标记,并不一定适用该规则。
本发明中,以符号(例如SG、MSG、GlcNAc等)记载糖链时,除非有特别定义,连还原末端的碳都包含在该符号中,但归属于N-或O-糖苷键中的N或O不包含在该符号中。
本发明的抗体药物偶联物由下式表示:
抗体Ab或其功能性片段从其氨基酸残基(例如,半胱氨酸、赖氨酸等)的侧链直接与L结合,或者从Ab的糖链或重构的糖链与L结合。
本发明的Ab的糖链为N连接型糖链或O连接型糖链,优选N连接型糖链。
N连接型糖链通过N糖苷键与抗体的氨基酸侧链结合,O连接型糖链通过O糖苷键与抗体的氨基酸侧链结合。
本发明的Ab为IgG,优选为IgG1、IgG2或IgG4。
已知IgG在其重链的Fc区域中的第297位天冬酰胺残基(以下称为“Asn297或N297”)中具有高度保守的N连接型糖链,有助于抗体分子的活性或动态等(Eon-Duval,A.etal,Biotechnol.Prog.2012,28,608-622、Sanglier-Cianferani,S.,Anal.Chem.2013,85,715-736)。
IgG的恒定区中的氨基酸序列高度保守,在Edelman等人的报告(Proc.Natl.Acad.Sci.U.S.A.,63,78-85,(1969))中,各氨基酸被EU编号(EU INDEX)确定。例如,Fc区域中附加N连接型糖链的Asn297相当于EU编号中的297位,即使由于分子的片段化或区域缺损而实际的氨基酸位置发生变化,也可以通过以EU编号表示而唯一地确定氨基酸。
下图表示本发明的抗体药物偶联物从抗体或其功能性片段的所述N297糖链与L结合的情况。
予以说明,将具有该重构的糖链的抗体称为糖链重构抗体。
SGP(α2,6-SGP)为Sialylglycopeptide(唾液酸糖肽)的简称,是N连接型糖肽的代表。可以从鸡蛋的蛋黄中根据例如WO2011/0278681所述的方法分离、精制得到SGP。另外,SGP的精制品由东京化成工业、以及伏见制药所销售。在本说明书中,将SGP的糖链部分称为SG,将缺少一个SG的还原末端的GlcNAc的糖链称为SG(10)。SG(10)可以例如参照梅川等人的报告(Biochim.Biophys.Acta 2010,1800,1203-1209),通过SGP的酶水解来制备。另外,SG(10)也可以从东京化成工业、以及伏见制药所购入。
本说明书中,将仅仅在SG(10)的β-Man支链中的任意一方缺失了非还原末端的唾液酸的糖链结构称为MSG(9),将仅仅在支链的1-3糖链具有唾液酸的糖链称为MSG1,将仅仅在支链的1-6糖链具有唾液酸的糖链称为MSG2。
本发明的重构的糖链为N297-(Fuc)SG、N297-(Fuc)MSG1、N297-(Fuc)MSG2、或N297-(Fuc)MSG1与N297-(Fuc)MSG2的混合物,优选为N297-(Fuc)SG、N297-(Fuc)MSG1或N297-(Fuc)MSG2,更优选为N297-(Fuc)SG或N297-(Fuc)MSG1。
N297-(Fuc)SG以下述的结构式或序列式表示。
上式中,波浪线表示与抗体的Asn297结合,L(PEG)表示-(CH
N297-(Fuc)MSG1如以下的结构式或序列式所示。
上式中,波浪线表示与抗体的Asn297结合,L(PEG)表示-(CH
N297-(Fuc)MSG2如以下的结构式或序列式所示。
上式中,波浪线表示与抗体的Asn297结合,L(PEG)表示-(CH
本发明的抗体药物偶联物的抗体的N297糖链为N297-(Fuc)SG时,抗体为二聚物,因此,抗体药物偶联物为结合了4个连接子L以及4个药物D的分子(上述m
本发明的抗体药物偶联物的抗体的N297糖链为N297-(Fuc)MSG1或者N297-(Fuc)MSG2或它们的混合物时,抗体为二聚物,因此,抗体药物偶联物为结合了2个连接子L以及2个药物D的分子(上述m
N297糖链优选N297-(Fuc)SG或N297-(Fuc)MSG1或N297-(Fuc)MSG2,更优选N297-(Fuc)SG。
本发明的抗体药物偶联物中的抗体的N297糖链为N297-(Fuc)SG或N297-(Fuc)MSG1或者N297-(Fuc)MSG2时,可获得均匀性高的ADC。
<3.制造方法>
对本发明的新型CDN衍生物及其抗体药物偶联物或它们的制造中间体的代表性制造方法进行说明。予以说明,以下为了表示化合物,使用各反应式中所示的化合物的编号。即,称为“式(1)的化合物”、“化合物(1)”等。另外,这些以外的编号的化合物也同样记载。
下述的A法~E法中,取代基R
A法
本发明的(1)所示的CDN衍生物可根据以下记载的A法来制造。
本制造法为用于制造通式(1)所示的化合物的方法。本制造法的A-1工序~A-5工序可以一锅合成(one pot synthesis),可参照Gaffney等人的报告(Org.Lett.2010,12,3269-3271)而实施。
(A-1工序)
本工序是通过对式(1a)的化合物使用公知的有机化学的方法而连续进行水解反应和除去氰基乙基来制造式(2a)的化合物的工序。
将化合物(1a)在溶剂(乙腈、四氢呋喃、N,N-二甲基甲酰胺或它们的混合溶剂)中,在-10℃至反应中使用的溶剂的沸点之间的温度下,优选在15℃~35℃的温度下通过水以及酸(吡啶三氟乙酸盐、4,5-二氰基咪唑、1H-四唑等)进行处理而实施水解反应。相对于化合物(1a)1摩尔,水使用2摩尔~过量摩尔,优选使用2摩尔~10摩尔,酸使用1摩尔~过量摩尔,优选使用1摩尔~5摩尔。反应时间为1分钟~3小时,优选为5分钟~30分钟。接着,在该反应液中添加碱(叔丁胺等)除去氰基乙基。碱相对于化合物(1a)1摩尔,使用过量摩尔,优选使用30摩尔~50摩尔。反应时间为5分钟~6小时,优选为15分钟~1小时。将反应液在减压下浓缩,得到化合物(2a)的粗产物。化合物(2a)的粗产物可以在不精制的情况下进入下一工序。
(A-2工序)
本工序是对式(2a)的化合物使用公知的有机化学方法除去羟基的保护基来制造式(3a)的化合物的工序。在开始本工序的反应前,根据需要使用乙腈共沸1~3次,使式(2a)的粗产物干燥。
PRO
(A-3工序)
本工序是通过对式(3a)的化合物使用公知的有机化学方法,连续进行与式(4a)的化合物的偶联反应以及得到的偶联体的硫化反应,制造式(5a)的化合物的工序。
在开始本工序的反应前,使用脱水乙腈将化合物(4a)共沸3次~5次。在最后的共沸时乙腈残留,制备化合物(4a)的0.01M~1M的乙腈溶液。在该溶液中加入干燥剂(粉末状或团块状的分子筛3A或分子筛4A),在使用溶液之前在氮或氩气氛下保存。
通过在化合物(3a)的乙腈溶液中,在5℃~35℃的温度下添加经共沸干燥的化合物(4a)的乙腈溶液实施偶联反应。反应时间为1分钟~24小时,优选为5分钟~6小时。接着,在该反应液中添加硫化剂(N,N-二甲基-N’-(3-亚巯基-3H-1,2,4-二噻唑-5-基)甲脒、3H-1,2-苯并二硫醇-3-酮等)实施硫化反应。相对于化合物(3a)1摩尔,硫化剂使用1摩尔~5摩尔,优选使用1摩尔~2摩尔。反应时间为5分钟~24小时,优选为30分钟~6小时。将反应液在减压下浓缩,得到化合物(5a)的粗产物。得到的化合物(5a)的粗产物直接进入下一工序。
(A-4工序)
本工序是对式(5a)的化合物使用公知的有机化学方法除去羟基的保护基制造式(6a)的化合物的工序。
PRO
(A-5工序)
本工序是对式(6a)的化合物使用公知的有机化学方法连续进行环化反应和硫化反应来制造式(7a)的化合物的工序。
将化合物(6a)溶解至吡啶后,在减压下浓缩,制备0.01M~0.5M的吡啶溶液。通过在该吡啶溶液中,在5℃~35℃的温度下添加脱水缩合剂(2-氯-5,5-二甲基-1,3,2λ
(A-6工序)
本工序是对式(7a)的化合物使用公知的有机化学方法将氰基乙基以及全部的酰基系保护基同时除去,制造式(8a)的化合物的工序。本工序根据需要在高压釜中、或密封管中实施。
PRO
(A-7工序)
本工序是对式(8a)的化合物使用公知的有机化学方法将全部的甲硅烷基系保护基同时除去来制造式(9a)的化合物的工序。
PRO
(A-8工序)
本工序是对式(9a)的化合物使用公知的有机化学方法进行离子交换,制造式(1)的化合物的工序。
将阳离子交换树脂(BT AG(注册商标)50W-X2树脂,100-200目,氢型)悬浮在纯水中,填充于空的柱管(column cartridge)中。阳离子交换树脂使用以重量比计为化合物(9a)的10倍~50倍量。使过量的纯水自然流下后,使1M氢氧化钠水溶液自然流下3柱体积,接着,使6柱体积的纯水自然流下。将化合物(9a)溶解于约3柱体积的纯水并装填于柱中。化合物难以溶解于纯水时,可以使用与少量的有机溶剂(乙腈、甲醇等)的混合液。将自然流下的溶液分离萃取后,进一步用6柱体积的纯水等进行洗脱分离萃取组分(fraction)。合并包含目标产物的组分进行冷冻干燥,以单一的非对映异构体的形式得到化合物(1)。
A’法
本发明的(1’)所示的CDN衍生物可根据以下记载的A’法进行制造。
本制造法是变更A法的一部分用来制造通式(1’)所示的化合物的方法。具体而言,通式(1’)的化合物可通过将A法A-5工序变更为以下所示的A’-5工序来制造。另外,取代基R
(A’-5工序)
本工序是对式(6a’)的化合物使用公知的有机化学方法连续进行环化反应和氧化反应来制造式(7a’)的化合物的工序。
将化合物(6a’)溶解于吡啶之后,在减压下浓缩,制备0.01M~0.5M的吡啶溶液。在该吡啶溶液中,在5℃~35℃的温度下添加脱水缩合剂(2-氯-5,5-二甲基-1,3,2λ
A”法
本发明的(1”)所示的CDN衍生物可以根据以下记载的A”法进行制造。
本制造法是变更A法的一部分用于制造通式(1”)所示的化合物的方法。具体而言,通式(1”)的化合物可通过将A法的A-3工序变更为以下所示的A”-3工序来制造。另外,取代基R
(A”-3工序)
本工序是通过对式(3a”)的化合物使用公知的有机化学方法,连续进行与式(4a”)的化合物的偶联反应以及得到的偶联体的氧化反应来制造式(5a”)的化合物的工序。
在开始本工序的反应之前,使用脱水乙腈将化合物(4a”)共沸3次~5次。在最后的共沸时乙腈残留,制备化合物(4a”)的0.01M~1M的乙腈溶液。在该溶液中添加干燥剂(粉末状或团块状的分子筛3A或分子筛4A),在使用溶液之前在氮或氩气氛下保存。
通过在化合物(3a”)的乙腈溶液中,在5℃~35℃的温度下添加经共沸干燥的化合物(4a”)的乙腈溶液来实施偶联反应。反应时间为1分钟~24小时、优选5分钟~6小时。接着,在该反应液中添加氧化剂(叔丁基过氧化氢等)实施氧化反应。相对于化合物(3a”)1摩尔,氧化剂使用1摩尔~5摩尔、优选使用2摩尔~3摩尔。反应时间为5分钟~24小时、优选30分钟~6小时。在反应液中加入饱和硫代硫酸钠水溶液,搅拌10分钟~12小时进行反应停止处理。将反应液用有机溶剂(二氯甲烷与甲醇的混合溶剂等)萃取1次~5次后,合并萃取液用无水盐(无水硫酸钠或无水硫酸镁)进行干燥。将干燥剂过滤除去,将滤液在减压下浓缩,得到化合物(5a”)的粗产物。得到的化合物(5a”)的粗产物直接进入下一工序。
A”’法
本发明的(1”’)所示的CDN衍生物可以根据以下记载的A”’法进行制造。
本制造法是变更A法的一部分用于制造通式(1”’)所示的化合物的方法。具体而言,通式(1”’)的化合物可将A法的A-3工序变更为A”-3工序、将A-5工序变更为A’-5工序进行制造。另外,取代基R
B法:偶联前体(糖链偶联)
本发明的(2)所示的偶联前体可根据以下记载的B法进行制造。
本制造法是用于制造在L
(B-1工序)
本工序是对式(1b)的化合物使用公知的有机化学方法除去保护基来制造式(2b)的化合物的工序。
PRO
(B-2工序)
本工序是对式(2b)的化合物使用公知的有机化学方法进行与式(3b)的化合物的酰胺化制造式(4b)的化合物的工序。
通过将化合物(2b)在溶剂(N,N-二甲基甲酰胺、N-甲基吡咯烷酮、N,N-二甲基乙酰胺、乙腈等)中,在5℃~35℃的温度下与碱(三乙胺、N,N-二异丙基乙基胺等)以及化合物(3b)反应,实施酰胺化。相对于化合物(2b)1摩尔,碱使用1摩尔~5摩尔,化合物(3b)使用0.5摩尔~1.5摩尔。反应时间为10分钟~72小时、优选1小时~24小时。将反应液注入有机溶剂(二氯甲烷、氯仿、乙酸乙酯、甲醇或其混合溶剂)与水或酸性水溶液(0.1~1M的盐酸、柠檬酸水溶液等)这二层,用有机溶剂萃取1次~5次。合并萃取液,再用饱和食盐水清洗后,用无水盐(无水硫酸钠或无水硫酸镁)进行干燥。滤去干燥剂,将滤液在减压下浓缩。予以说明,可省略上述分液操作,将反应液直接在减压下进行浓缩而进行下一步的硅胶柱精制。将得到的残留物用硅胶柱层析[二氯甲烷/甲醇、乙酸乙酯/甲醇等]进行精制,得到化合物(4b)。可以根据需要,将得到的化合物(4b)溶解于良溶剂(乙酸乙酯、乙腈、二氯甲烷、甲醇或这些的混合溶剂)后,加入不良溶剂(二乙基醚、二异丙基醚、己烷等)进行再沉淀,通过滤取固体而提高纯度。
(B-3工序)
本工序是对式(4b)的化合物使用公知的有机化学方法进行酯化来制造式(5b)的化合物的工序。
通过将化合物(4b)在溶剂(N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基吡咯烷酮、乙腈等)中,在5℃~35℃的温度下与N-羟基琥珀酰亚胺以及缩合剂(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐等)反应实施酯化。N-羟基琥珀酰亚胺以及缩合剂相对于化合物(4b)1摩尔分别使用1摩尔~3摩尔。反应时间为30分钟~72小时、优选2小时~24小时。将反应液用有机溶剂(二氯甲烷、氯仿、乙酸乙酯或其混合溶剂)稀释后,用冰水洗涤3次~5次。将有机层用无水盐(无水硫酸钠或无水硫酸镁)干燥。滤去干燥剂后,将滤液在减压下浓缩得到化合物(5b)的粗产物。可以根据需要,将得到的化合物(5b)用C18硅胶柱层析[仅乙腈]进行精制。另外,可以将得到的化合物(5b)溶解于良溶剂(乙酸乙酯、乙腈、二氯甲烷或这些的混合溶剂)中后,使用不良溶剂(二乙基醚、二异丙基醚、己烷等)进行再沉淀,通过滤取固体提高纯度。
(B-4工序)
本工序是通过对式(5b)的化合物使用公知的有机化学方法进行与式(6b)的化合物的缩合反应,制造式(2)的化合物的工序。
通过将化合物(6b)在溶剂(N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基吡咯烷酮、乙腈等)中,在-10℃~100℃的温度下,优选在15℃~35℃的温度下,与碱(三乙胺、N,N-二异丙基乙基胺等)以及化合物(5b)反应实施缩合反应。相对于化合物(6b)1摩尔,碱使用2摩尔~5摩尔,化合物(5b)使用1摩尔~2摩尔。反应时间为5分钟~24小时、优选1小时~6小时。向反应液中加入苄基胺进行反应停止处理。苄基胺相对于化合物(6b)1摩尔使用4摩尔~10摩尔。根据需要将反应液在减压下部分浓缩,将残留的溶液用制备型HPLC[缓冲液/乙腈、缓冲液/甲醇等]、C18硅胶柱层析[缓冲液/乙腈、缓冲液/甲醇等]或它们的组合进行精制,得到化合物(2)。
B’法:偶联前体(半胱氨酸偶联)
B’法
本发明的(2’)所示的偶联前体可根据以下记载的B’法进行制造。
本制造法是用于制造在L
(B-5工序)
本工序是通过对式(2b’)的化合物使用公知的有机化学方法与式(7b)的化合物进行酰胺化来制造式(8b)的化合物的工序。除了不使用碱以外,根据B法B-2工序记载的方法得到化合物(8b)。
(B-6工序)
本工序是通过对式(8b)的化合物使用公知的有机化学方法除去保护基制造式(9b)的化合物的工序。PRO
(B-7工序)
本工序是通过对式(9b)的化合物使用公知的有机化学方法进行酯化,制造式(10b)的化合物的工序。根据B法B-3工序记载的方法得到化合物(10b)。
(B-8工序)
本工序是通过对式(6b)的化合物使用公知的有机化学方法进行与式(10b)的化合物的缩合反应,来制造式(2’)的化合物的工序。根据B法B-4工序记载的方法得到化合物(2’)。
C法
本发明的(3)所示的偶联前体可根据以下记载的C法来制造。
本制造法是用于制造在L
(C-1工序)
本工序是通过对式(1c)的化合物使用公知的有机化学方法与式(2c)的化合物进行酰胺化来制造式(3c)的化合物的工序。根据B法B-2工序记载的方法得到化合物(3c)。
(C-2工序)
本工序是通过对式(3c)的化合物使用公知的有机化学方法进行酯化来制造式(4c)的化合物的工序。根据B法B-3工序记载的方法得到化合物(4c)。
(C-3工序)
本工序是通过对式(5c)的化合物使用公知的有机化学方法连续进行与式(6c)的化合物的偶联反应(氨基亚甲基化)和得到的偶联体的脱保护,来制造式(7c)的化合物的工序。
PRO
(C-4工序)
本工序是通过对式(7c)的化合物使用公知的有机化学方法除去保护基,制造式(8c)的化合物的工序。PRO
(C-5工序)
本工序是通过对式(8c)的化合物使用公知的有机化学方法与式(4c)的化合物进行缩合反应,来制造式(3)的化合物的工序。根据B法B-4工序记载的方法得到化合物(3)。
C’法
本发明的(3’)所示的偶联前体可根据以下记载的C’法进行制造。
本制造法是用于制造在L
(C’-1工序)
本工序是通过对式(1c’)的化合物使用公知的有机化学方法连续进行水解反应和氰基乙基的除去,来制造式(2c’)的化合物的工序。根据A法A-1工序记载的方法得到化合物(2c’)。
(C’-2工序)
本工序是通过对式(2c’)的化合物使用公知的有机化学方法除去羟基的保护基来制造式(3c’)的化合物的工序。根据A法A-2工序记载的方法得到化合物(3c’)。
(C’-3工序)
本工序是通过对式(3c’)的化合物使用公知的有机化学方法连续进行与式(4c’)的化合物的偶联反应以及得到的偶联体的硫化反应或氧化反应,来制造式(5c’)的化合物的工序。根据A法A-3工序或A”法A”-3工序记载的方法得到化合物(5c’)。
(C’-4工序)
本工序是通过对式(5c’)的化合物使用公知的有机化学方法除去羟基的保护基来制造式(6c’)的化合物的工序。根据A法A-4工序记载的方法得到化合物(6c’)。
(C’-5工序)
本工序是通过对式(6c’)的化合物使用公知的有机化学方法连续进行环化反应和硫化反应或氧化反应来制造式(7c’)的化合物的工序。根据A法A-5工序或A’法A’-5工序记载的方法得到化合物(7c’)。
(C’-6工序)
本工序是通过对式(7c’)的化合物使用公知的有机化学方法同时除去氰基乙基以及全部的酰基系保护基,来制造式(8c’)的化合物的工序。根据A法A-6工序记载的方法得到化合物(8c’)。
(C’-7工序)
本工序是通过对式(8c’)的化合物使用公知的有机化学方法同时除去全部的甲硅烷基系保护基来制造式(9c’)的化合物的工序。PRO
(C’-8工序)
本工序是通过对式(9c’)的化合物使用公知的有机化学方法与式(4c)的化合物进行缩合反应,来制造式(3’)的化合物的工序。根据B法B-4工序记载的方法得到化合物(3’)。
D法:糖链重构抗体的制造
糖链重构抗体可根据例如WO2018/003983等所述的方法用下式所示的方法来制造。
(D-1工序)
本工序是对目标抗体使用公知的酶反应,利用水解将与抗体的氨基酸序列第297位的天冬酰胺结合的N连接型糖链(N297结合糖链)的还原末端壳二糖结构的GlcNAcβ1-4GlcNAc之间的糖苷键切断,来制造糖链切断抗体的工序。
将目标抗体(1d)(10mg/mL)在缓冲液(磷酸盐缓冲液等)中,在0℃~40℃的温度下,使用野生型EndoS酶等水解酶实施还原末端的壳二糖结构的GlcNAcβ1与4GlcNAc之间的糖苷键的水解反应。反应时间为10分钟~72小时、优选1小时~6小时。相对于抗体(1d)100mg,野生型EndoS酶使用0.1mg~10mg、优选使用0.1mg~3mg。反应结束后,用亲和层析(HiTrap rProtein A FF(5ml)(GE HEALTH CARE制))和/或羟基磷灰石柱(Bio-ScaleMini CHT Type I管(5ml)(BIO-RAD制))进行精制而得到(Fucα1,6)GlcNAc抗体(2d)。
(D-2工序)
本工序是对D-1工序中得到的(Fucα1,6)GlcNAc抗体(2d)使用公知的酶反应,使具有含有叠氮基的PEG连接子的SG型或MSG(MSG1、MSG2)型糖链恶唑啉体(以下称为“叠氮基糖链恶唑啉体”)结合,制造糖链重构抗体(3d)的工序。
将抗体(2d)在缓冲液(磷酸盐缓冲液等)中在0℃~40℃的温度下,在EndoS(D233Q/Q303L)等糖基转移酶存在下,与叠氮基糖链恶唑啉体反应实施糖链转移反应。反应时间为10分钟~72小时、优选1小时~6小时。相对于抗体100mg,EndoS酶(D233Q/Q303L)使用1mg~10mg、优选使用1mg~3mg,叠氮基糖链恶唑啉体使用2当量~过量当量、优选使用4当量~20当量。反应结束后,用亲和层析(HiTrap rProtein A FF(5ml)(GEHEALTH CARE制))以及羟基磷灰石柱(Bio-Scale Mini CHT Type I管(5ml)(BIO-RAD制))进行精制而得到糖链重构抗体(3d)。
在上述的糖链重构抗体的制备中,抗体水溶液的浓缩、浓度测定、以及缓冲液交换可根据后述的共通操作A~C进行。
予以说明,SG型的叠氮基糖链恶唑啉体根据WO2018/003983所述的方法进行合成。作为一例,[N
MSG型的叠氮基糖链恶唑啉体也根据WO2018/003983所述的方法进行合成。作为一例,[N
E法:抗体与药物的偶联(糖链偶联1)
(式中,抗体药物偶联物(1e)的左侧的2个星号(*)表示右侧的星号所示的药物连接子部分。)
本制造法是使D法D-2工序中得到的糖链重构抗体(3d)与B法B-4工序中得到的偶联前体(2)通过SPAAC(应变促进叠氮炔环加成strain-promoted azide-alkynecycloaddition:J.Am.Chem.Soc.2004,126,15046-15047)反应而结合,制造抗体药物偶联物(1e)的方法。
(E-1工序)
通过将糖链重构抗体(3d)的缓冲溶液(磷酸盐缓冲液、乙酸缓冲液、硼酸缓冲液等)与将偶联前体(2)溶解于适当的溶剂(二甲基亚砜、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲基吡咯烷酮、丙二醇或这些的混合溶剂)中而得到的溶液混合,由此实施SPAAC反应。相对于糖链重构抗体(3d)1摩尔,偶联前体(2)使用2摩尔~过量摩尔、优选使用4摩尔~30摩尔,有机溶剂的比率优选相对于抗体的缓冲溶液为1%~200%(v/v)。反应温度为0℃~37℃、优选为15℃~25℃,反应时间为1小时~150小时、优选6小时~72小时。反应溶液的pH优选为5~9。将反应溶液依照后述的共通操作D所述的方法进行精制得到抗体药物偶联物(1e)。
E’法:抗体与药物的偶联(半胱氨酸偶联)
具有半胱氨酸偶联的本发明的抗体药物偶联物可使用根据参考例1等制备的目标抗体与B’法B-8工序中得到的具有马来酰亚胺基的偶联前体(2’),依照WO2014/057687等所述的方法进行制造。
E”法:抗体与药物的偶联(糖链偶联2)
通过在E法中,将偶联前体(2)变为C’法C’-8工序中得到的偶联前体(3’)得到下式所示的抗体药物偶联物(1e”)。
(式中,抗体药物偶联物(1e”)左侧的2个星号(*
抗体药物偶联物可通过后述的共通操作D~G进行缓冲液交换、精制、抗体浓度的测定以及每一分子抗体的药物平均结合数的测定,进行抗体药物偶联物的鉴定。
共通操作A:抗体水溶液的浓缩
在Amicon(注册商标)Ultra离心式过滤器装置(50000NMWL,Merck MilliporeLtd.)中加入抗体或抗体药物偶联物溶液,通过使用离心机(Allegra X-15R,BeckmanCoulter,Inc.)的离心操作(在2000G~4000G下离心5分钟~20分钟)使抗体以及抗体药物偶联物溶液浓缩。
共通操作B:抗体的浓度测定
使用UV测定器(Nanodrop 1000,Thermo Fisher Scientific,Inc.),根据制造商规定的方法测定抗体浓度。此时,按每种抗体使用不同的280nm吸光系数(1.3mLmg
共通操作C:抗体的缓冲液交换
在抗体水溶液中加入缓冲液(磷酸盐缓冲生理食盐水(pH6.0)、磷酸盐缓冲液(pH6.0)等),根据共通操作A所述的方法进行浓缩。该操作进行数次之后,根据共通操作B所述的方法测定抗体浓度。在该抗体缓冲溶液加入适当缓冲液(磷酸盐缓冲生理食盐水(pH6.0)、磷酸盐缓冲液(pH6.0)等)来制备目标浓度(例如,约10mg/mL)的抗体缓冲溶液。
共通操作D:抗体药物偶联物的精制(凝胶过滤层析法)
用乙酸缓冲液(10mM Acetate Buffer,5%山梨糖醇Sorbitol,pH5.5;本说明书中称为ABS)或其它的适当的缓冲液使NAP柱(NAP-5,NAP-10,NAP-25(GEHEALTH CARE制))平衡化。在该NAP柱中装填抗体药物偶联物反应溶液,使制造商规定量的缓冲液自然流下,分取抗体组分。将该组分再次装填到NAP柱中,使制造商规定量的缓冲液自然流下,分取抗体组分。将该操作重复操作共计2次~3次,得到除去了未结合的药物连接子、二甲基亚砜、丙二醇的抗体药物偶联物。根据需要通过共通操作A以及C调节抗体药物偶联物溶液的浓度。
共通操作E:抗体药物偶联物的抗体浓度以及每一分子抗体的药物平均结合数的测定(UV法)
抗体药物偶联物的结合药物浓度通过使用吸光光度计(UV/VIS SpectrometerLambda 25,PerkinElmer,Inc.)测定抗体药物偶联物水溶液的280nm以及260nm(有时也使用260nm以外的波长)这2个波长下的吸光度后,进行下述的计算来算出。由于某个波长下的总吸光度等同于体系内存在的全部的吸收化学物种的吸光度之和(吸光度的加成性),因此若假定为抗体与药物的偶联前后,抗体以及药物的摩尔吸光系数没有变化,则抗体药物偶联物的抗体浓度以及药物浓度如下述关系式所示。
A
A
式中,A
共通操作F:抗体药物偶联物中的抗体浓度以及每一分子抗体的药物平均结合数的测定(反相高效液相色谱法:RP-HPLC)
抗体药物偶联物的抗体浓度以及每一分子抗体的药物平均结合数除了上述的共通操作E之外,还可通过使用以下的方法的高效液相色谱分析求得。
[F-1.HPLC分析用样品的制备(抗体药物偶联物的还原)]
将抗体药物偶联物溶液(约1mg/mL、60μL)与二硫苏糖醇(DTT)水溶液(100mM、15μL)混合。将混合物在37℃下保温(incubate)30分钟,将抗体药物偶联物的L链以及H链之间的二硫键切断。将该反应溶液直接使用于HPLC分析。
[F-2.HPLC分析]
代表性的分析条件如下所述。
HPLC系统:Agilent 1290HPLC系统(Agilent Technologies)
检测器:紫外吸光度计(测定波长:280nm)
柱:Acquity BEH Phenyl(2.1×50mm、1.7μm、Waters制)
柱温度:75℃
流速:0.8mL/min
样品注入量:10μL
流动相A:0.1%三氟乙酸(TFA),15%异丙醇水溶液
流动相B:0.075%TFA,15%异丙醇乙腈溶液
梯度程序(流动相B):14%-36%(0分-15分),36%-80%(15-17分),80%-14%(17分-17.1分),14%-14%(17.1分-23分)
[F-3.数据解析]
〔F-3-1〕相对于未结合药物的抗体的L链(L0)以及H链(H0),结合了药物的H链(结合了一个药物的H链:H1、结合了2个药物的H链:H2)与结合的药物数成比例地疏水性增加,保留时间变长,因此,原则上依照L0、H0、H1、H2的顺序被洗脱。通过比较与L0以及H0的保留时间,可将检测波峰分配为L0、H0、H1、H2的任一者。
〔F-3-2〕药物连接子具有UV吸收,因此,根据药物连接子的结合数使用H链以及药物连接子的摩尔吸光系数并根据下式进行峰面积的修正。
式中,各抗体的L链以及H链的摩尔吸光系数(280nm)使用由共通操作E记载的已知的计算方法计算的推定值。在改造抗HER2抗体的情况下,L链的摩尔吸光系数使用26213,H链的摩尔吸光系数使用81478。同样,在改造抗LPS抗体的情况下,L链的摩尔吸光系数使用27703,H链的摩尔吸光系数使用85948。药物连接子的摩尔吸光系数(280nm)在SPAAC反应下的偶联的情况下,使用偶联前体的实测值,在半胱氨酸偶联的情况下,使用将各偶联前体与巯基乙醇或N-乙酰基半胱氨酸反应,将马来酰亚胺基转换为琥珀酰亚胺硫醚的化合物的实测值。
〔F-3-3〕根据下式计算相对于峰面积修正值合计的各链峰面积比(%)。
〔F-3-4〕根据下式计算抗体-药物偶联物的每一分子抗体的药物平均结合数(DAR)。
〔F-3-5〕根据下式计算抗体-药物偶联物的抗体浓度。
在此,抗体药物偶联物的吸光度(280nm)使用抗体药物偶联物水溶液的实测值。稀释倍数表示测定吸光度时将抗体药物偶联物水溶液稀释几倍,通常稀释4倍。抗体的摩尔吸光系数(280nm)使用由共通操作E记载的已知的计算方法算出的推定值。药物平均结合数使用〔F-3-4〕中得到的值。药物连接子的摩尔吸光系数(280nm)在SPAAC反应下的偶联的情况下,使用偶联前体的实测值,在半胱氨酸偶联的情况下,使用使各药物连接子与巯基乙醇或N-乙酰基半胱氨酸反应,将马来酰亚胺基转换为琥珀酰亚胺硫醚的化合物的实测值。
共通操作G:抗体药物偶联物的抗体浓度以及每一分子抗体的药物平均结合数的测定(疏水性相互作用-高效液相色谱法:HI-HPLC)
抗体药物偶联物的抗体浓度以及每一分子抗体的药物平均结合数除了上述共通操作E以及F之外,还可通过使用以下的方法的高效液相色谱分析求出。
[G-1.HPLC分析用样品的制备]
将抗体药物偶联物溶液(约1mg/mL、60μL)直接使用于HPLC分析。
[G-2.HPLC分析]
代表性的分析条件如下述两种。
HPLC系统:SHIMADZU CBM-20A(岛津制作所)
检测器:紫外吸光度计(测定波长:280nm)
柱:TSK-gel Butyl-NPR(4.6×100mm,2.5μm,TOSOH制)
柱温度:25℃附近的固定温度
流动相A:含有1.5M硫酸铵的25mM磷酸盐缓冲液(pH=7.0)
流动相B:25mM磷酸盐缓冲液(pH=7.0)/异丙醇混合液(3:1)
流速:0.8mL/min
样品注入量:15μL
梯度程序(流动相B):10%-15%(0分-5分),15%-65%(5分-20分)
或,HPLC系统:SHIMADZU CBM-20A(岛津制作所)
检测器:紫外吸光度计(测定波长:280nm)
柱:PolyPROPYL A(4.6×100mm,3μm,
柱温度:40℃附近的固定温度
流动相A:含有1.5M硫酸铵的20mM磷酸盐缓冲液(pH=7.4)
流动相B:20mM磷酸盐缓冲液(pH=7.4)
流速:0.8mL/min
样品注入量:15μL
梯度程序(流动相B):40%-80%(0分-20分)
[G-3.数据解析]
〔G-3-1〕与抗体结合的药物数成比例地疏水性增加,保留时间变大,因此,在SPAAC反应下的偶联的情况下,原则上按照DAR=0、DAR=2、DAR=4的顺序被洗脱。通过比较与DAR=0的保留时间,可将检测波峰分配为DAR=2以及DAR=4中的任一者。有时也取决于抗体或药物连接子的种类,检测出DAR=1以及DAR=3的波峰。检测波峰的DAR也有以HI-HPLC分离出该波峰后,测定质谱来推定的情况。
〔G-3-2〕药物连接子具有UV吸收,因此,根据药物连接子的结合数使用抗体以及药物连接子的摩尔吸光系数并根据下式进行峰面积值的修正。
式中,抗体的摩尔吸光系数(280nm)使用由共通操作E记载的已知的计算方法算出的推定值。药物连接子的摩尔吸光系数(280nm)使用偶联前体的实测值。
〔G-3-3〕根据下式计算相对于峰面积修正值合计的抗体峰面积比(%)。
〔G-3-4〕根据下式计算抗体-药物偶联物的每一分子抗体的药物平均结合数。
〔G-3-5〕抗体-药物偶联物的抗体浓度按照〔F-3-5〕所述的算式计算。此时,药物平均结合数使用〔G-3-4〕中得到的值。
本发明的新型CDN衍生物、抗体药物偶联物或它们的制造中间体有时也存在立体异构体或者来自不对称碳原子的光学异构体、几何异构体、互变异构体或d体、l体、阻转异构体等光学异构体,这些异构体、光学异构体以及这些的混合物均包含在本发明中。
本发明的抗体药物偶联物中,药物与一分子抗体的结合数是影响其有效性、安全性的重要因子。抗体药物偶联物的制造虽以使药物的结合数成为固定数的方式规定反应使用的原料、试剂的使用量等反应条件来实施,但与低分子化合物的化学反应不同,通常会获得不同数目的药物结合的混合物。药物与一分子抗体的结合数可特定为平均值、即平均药物结合数(DAR)。环状二核苷酸衍生物与抗体分子的结合数可以控制,作为每一分子抗体的药物平均结合数可结合1~10个范围的环状二核苷酸衍生物,优选1~8个,更优选1~5个。
本发明的抗体药物偶联物中,抗体Ab从抗体Ab的重构的糖链与L结合时,抗体药物偶联物中的每一分子抗体的药物结合数m
予以说明,本领域技术人员可以按照本申请的实施例的记载设计使抗体与所需数的药物结合的反应,可得到控制了环状二核苷酸衍生物的结合数的抗体。
予以说明,本发明的CDN衍生物、抗体药物偶联物、这些的制造中间体通过放置在大气中,或进行重结晶,吸收水分,有时会附着吸附水或者形成水合物,这些包含水的化合物及盐也包含在本发明中。
本发明的CDN衍生物、抗体药物偶联物、这些的制造中间体具有氨基等碱性基时,根据预期可以制成医药上可接受的盐。作为这种盐,可以举出例如盐酸盐、氢碘酸盐等氢卤酸盐;硝酸盐、高氯酸盐、硫酸盐、磷酸盐等无机酸盐;甲磺酸盐、三氟甲磺酸盐、乙磺酸盐等低级烷磺酸盐;苯磺酸盐、对甲苯磺酸盐等芳基磺酸盐;甲酸、乙酸、苹果酸、富马酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、草酸盐、马来酸盐等有机酸盐;以及鸟氨酸盐、谷氨酸盐、天冬氨酸盐等氨基酸盐。
本发明的CDN衍生物或抗体药物偶联物因为在其结构中含有磷酸基和/或硫代磷酸基,因此一般而言可形成碱加成盐。另外,在这些制造中间体具有羧基等酸性基的情况下,一般而言也可形成碱加成盐。作为医药上可接受的盐,可以举出例如钠盐、钾盐、锂盐等碱金属盐;钙盐、镁盐等碱土金属盐;铵盐等无机盐;二苄胺盐、吗啉盐、苯基甘氨酸烷基酯盐、乙二胺盐、N-甲基葡萄糖胺盐、二乙胺盐、三乙胺盐、环己胺盐、二环己胺盐、N,N’-二苄基乙二胺盐、二乙醇胺盐、N-苄基-N-(2-苯基乙氧基)胺盐、哌嗪盐、四甲基铵盐、三(羟基甲基)氨基甲烷盐等有机胺盐等。
本发明的CDN衍生物、抗体药物偶联物、它们的制造中间体有时通过吸收空气中的水分等而以水合物的形式存在。作为本发明的溶剂合物,只要是医药上可接受的,就没有特别的限定,具体而言,优选为水合物、乙醇合物、2-丙醇合物等。另外,在本发明的CDN衍生物、抗体药物偶联物、它们的制造中间体中存在氮原子时,可以形成N-氧化物,这些溶剂合物以及N-氧化物也包含在本发明的范围内。另外,本发明的CDN衍生物、抗体药物偶联物、它们的制造中间体存在硫原子时,也可形成亚砜体,这些溶剂合物以及亚砜体也包含在本发明的范围内。
另外,本发明也包括被各种放射性或非放射性同位素标记的化合物。构成本发明的CDN衍生物、抗体药物偶联物、这些的制造中间体的原子的一个以上也可含有原子同位素的非天然比例。作为原子同位素,也可举出例如氘(2H)、氚(3H)、碘-125(125I)或碳-14(14C)等。另外,本发明化合物也可例如被氚(3H)、碘-125(125I)或碳-14(14C)之类的放射性同位素进行放射性标记。被放射性标记的化合物作为治疗或预防剂、研究试剂(例如分析试剂)、以及诊断剂(例如体内诊断显像剂)是有用的。本发明的抗体药物偶联物的所有同位素变异体无论是否为放射性,都包括在本发明的范围内。
<4.医药>
本发明的CDN衍生物或抗体药物偶联物对癌细胞显示出抗肿瘤免疫活性或细胞毒性,因此可用作医药,特别是针对癌症的治疗剂和/或预防剂、或抗肿瘤剂。
作为本发明的CDN衍生物或抗体药物偶联物适用的癌症种类,可以举出肺癌(非小细胞肺癌、小细胞肺癌等)、肾癌、尿道上皮癌、大肠癌、前列腺癌、多形性神经胶质母细胞瘤、卵巢癌(表层上皮性肿瘤、间质性肿瘤、胚细胞肿瘤等)、胰腺癌、乳腺癌、黑色素瘤、肝癌、膀胱癌、胃癌、食道癌、子宫体癌、睾丸癌(精原细胞瘤、非精原细胞瘤)、子宫颈癌、胎盘绒毛膜癌、多形性神经胶质母细胞瘤、脑肿瘤、头颈部癌、甲状腺癌、间皮瘤、胃肠道间质瘤(Gastrointestinal Stromal Tumor,GIST)、胆囊癌、胆管癌、肾上腺癌、鳞状细胞癌、白血病、恶性淋巴瘤、浆细胞瘤、骨髓瘤、肉瘤等,但抗体药物偶联物只要在作为治疗对象的癌细胞中有抗体药物偶联物中的抗体能够识别的蛋白质表达的癌细胞,就并不限定于此。
本发明的CDN衍生物或抗体药物偶联物优选能给药于哺乳动物,更优选给药于人。
作为含有本发明的CDN衍生物或抗体药物偶联物的医药组合物中使用的物质,可根据给药量、给药浓度从本领域中通常使用的制剂添加物等中适当选择进行使用。
本发明的CDN衍生物或抗体药物偶联物能以包含一种以上的药学相容性成分的医药组合物的形式给药。例如,代表性地,上述医药组合物包含1种以上的药学载体(carrier)(例如,灭菌液体(例如,包含水以及油(石油、动物、植物或合成起源的油(例如,花生油、大豆油、矿物油、芝麻油等))))。在上述医药组合物静脉给药的情况下,水是更具有代表性的载体。食盐水溶液、以及葡萄糖(dextrose)水溶液以及甘油水溶液也可用作液体载体,特别可用于注射用溶液。合适的药学赋形剂为本领域公知的。上述组合物根据需要还可以包含微量的湿润剂或乳化剂、或pH缓冲化剂。适合的药学载体的例子在E.W.Martin的“Remington’s Pharmaceutical Sciences”中有记载。该处方对应于给药方式。
各种传送系统是公知的,可用于本发明的CDN衍生物或抗体药物偶联物的给药。作为导入方法,可以举出皮内、肌内、腹腔内、静脉内、以及皮下途径,但并不限定于此。给药例如可通过输注或弹丸式注射(bolus injection)方式进行。在特定的优选实施方式中,上述CDN衍生物或抗体药物偶联物的给药是通过输注进行的。非消化道给药是优选的给药途径。
在代表性实施方式中,包含上述抗体药物偶联物的医药组合物根据常规的程序设计适合于对人类的静脉给药的医药组合物的处方。代表性地,用于静脉给药的组合物为灭菌等渗水性缓冲液中的溶液。必要时,上述医药还可以含有增溶剂以及用于缓和注射部位疼痛的局部麻醉剂(例如,利多卡因)。通常,上述成分例如以显示活性剂的量的安瓿或药囊(Sachet)等经过密封而封口的容器中的干燥冻干粉末或无水浓缩物的形式分开供给,或在单位剂型中一起混合供给。在预定上述医药组合物通过输注给药的情况下,可通过例如装有灭菌的制药用级的水或盐水的注入瓶来给药。通过注射给药上述医药时,注射用灭菌水或盐水的安瓿可以例如可在给药之前将上述成分混合的方式提供。上述医药组合物有时以溶液的形式提供。
本发明的医药组合物可为仅仅包含本申请的CDN衍生物或抗体药物偶联物的医药组合物,也可为包含CDN衍生物或抗体药物偶联物以及至少一种该CDN衍生物或抗体药物偶联物以外的癌治疗剂的医药组合物。本发明的CDN衍生物或抗体药物偶联物可与其它的癌治疗剂一起给药,由此可增强抗癌效果。以该目的使用的其它抗癌剂可与CDN衍生物或抗体药物偶联物同时、分开或连续地给药至个体,也可改变各自的给药间隔进行给药。作为此类癌治疗剂,可以举出白蛋白结合型紫杉醇(abraxane)、卡铂(carboplatin)、顺铂(cisplatin)、吉西他滨(gemcitabine)、伊立替康(CPT-11)(irinotecan)、紫杉醇(paclitaxel)、培美曲塞(pemetrexed)、索拉非尼(sorafenib)、长春花碱(vinblastin)或国际公开第WO2003/038043号小册子中记载的药物和LH-RH类似物(亮丙瑞林、戈舍瑞林等)、磷酸雌莫司汀、雌激素拮抗剂(他莫昔芬、雷洛昔芬等)、芳香酶抑制剂(阿那曲唑、来曲唑、依西美坦等)、免疫检查点抑制剂(纳武单抗(nivolumab)、伊匹单抗(ipilimumab))等。只要是具有抗肿瘤活性的药剂,就没有限定。
这样的医药组合物制剂成冻干制剂或者液态制剂作为具有所选择的组成和所需纯度的制剂即可。当制剂成冻干制剂时,可以为包含本领域使用的适当的制剂添加物的制剂。另外,同样液体制剂也可以制剂成包含本领域中使用的各种制剂添加物的液态制剂。
医药组合物的组成以及浓度也根据给药方法而变化,就本发明的医药组合物中含有的抗体药物偶联物而言,在抗体药物偶联物对抗原的亲和性,即对于抗原的解离常数(Kd值)方面,亲和性越高(Kd值越低),即使是少量的给药量也可以发挥药效。因此,在决定抗体药物偶联物的给药量时,可根据抗体药物偶联物与抗原的亲和性的状况设定给药量。本发明的CDN衍生物或抗体药物偶联物对人类给药时,例如,将约0.001~100mg/kg一次给药,或者以1~180天一次的间隔多次给药即可。
以下基于实施例对本发明进行说明,但本发明并不限定于此。
实施例
以下的实施例中,室温表示15℃~35℃。脱水乙腈使用由关东化学销售的乙腈(脱水)-Super-或由和光纯药工业销售的乙腈(超脱水)。吡啶使用由关东化学销售的吡啶(脱水)-Super-。硅胶层析使用Biotage SNAP Ultra(Biotage制)、Chromatorex Q-PackSI(富士Silysia制)或Purif-Pack-Ex SI(昭光Science制)而实施。DIOL硅胶柱层析使用Chromatorex Q-pack DIOL(富士Silysia制)而实施。C18硅胶柱层析使用Biotage SNAPUltra C18(Biotage制)而实施。氨基硅胶柱层析使用Biotage SNAP Isolute NH
各种光谱数据的测定使用以下的机器。
实施例1:CDN1的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-碘基-7H-吡咯并[2,3-d]嘧啶-4-胺
在文献已知(Tetrahedron 2007,63,9850-9861)的5-碘代杀结核菌素(1.0g)的N,N-二甲基甲酰胺(10mL)溶液中,在0℃下缓慢滴入二-叔丁基甲硅烷基双(三氟甲磺酸酯)(1.24mL)之后,在同样的温度下搅拌30分钟。在0℃下加入咪唑(868mg)后,升温至室温而搅拌30分钟。在室温下加入叔丁基二甲基氯硅烷,在同样的温度下搅拌一整夜。在反应液中加入饱和碳酸氢钠水溶液,停止反应之后用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(910mg)。
MS(ESI)m/z:647(M+H)
(工序2)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(3,3-二乙氧基丙-1-炔-1-基)-7H-吡咯并[2,3-d]嘧啶-4-胺
在上述工序1得到的化合物(910mg)的N,N-二甲基甲酰胺(3.0mL)-四氢呋喃(9.0mL)混合溶液中依次加入炔丙醛二甲基缩醛(1.01mL)、三乙胺(0.392mL)、四(三苯基膦)钯(0)(163mg)、以及碘化铜(I)(53.6mg),在40℃下搅拌18小时。在反应液中加入饱和碳酸氢钠水溶液和乙酸乙酯,用乙酸乙酯进行萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(878mg)。
MS(ESI)m/z:647(M+H)
(工序3)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序2得到的化合物(878mg)的乙醇(8.8mL)溶液中加入10%钯碳(M)wet(500mg),在氢气氛下,在室温下搅拌9小时。过滤除去催化剂后,用二氯甲烷进行清洗,将滤液减压浓缩。在残留物的乙酸(8.8mL)溶液中加入10%钯碳(M)wet(500mg),在氢气氛下、40℃下搅拌2天。过滤除去催化剂后,用二氯甲烷进行清洗,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(603mg)。
MS(ESI)m/z:561(M+H)
(工序4)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序3得到的化合物(2.17g)的二氯甲烷(21.7mL)溶液中,在室温下依次加入吡啶(1.56mL)、N,N-二甲基氨基吡啶(94.5mg)以及苯甲酰氯(0.898mL),在50℃下搅拌15小时。在反应液中加入饱和碳酸氢钠水溶液,使反应停止。用二氯甲烷萃取后,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(1.91g)。
MS(ESI)m/z:665(M+H)
(工序5)
6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序4得到的化合物(1.91g)的二氯甲烷(15mL)溶液中,加入在0℃调配的氟化氢-吡啶(0.30mL)与吡啶(1.88mL)的混合液,在0℃下搅拌2小时。在反应液中加入饱和碳酸氢钠水溶液使反应停止。将反应液用二氯甲烷萃取后,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物溶解于吡啶(15mL),再加入4,4’-二甲氧基三苯甲基氯(1.17g),在0℃下搅拌12小时。加入甲醇搅拌30分钟后,加入饱和碳酸氢钠水溶液使反应停止。将反应液用二氯甲烷萃取后,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]精制,得到标题化合物(1.98g)。
MS(ESI)m/z:827(M+H)
(工序6)
6-苯甲酰基-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基(phosphanyl)}-β-D-呋喃核糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序5得到的化合物(1.98g)的二氯甲烷(23.9mL)溶液中加入N,N-二异丙基乙基胺(1.02mL)和2-氰基乙基N,N-二异丙基氯亚磷酰胺(1.07mL),在室温下搅拌15小时。在反应液中加入饱和碳酸氢钠水溶液使反应停止。将反应液用二氯甲烷萃取后,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物(非对映异构体比=7:3)形式的标题化合物(2.06g)。
MS(ESI)m/z:1027(M+H)
(工序7)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-[羟基(桥氧基)-λ
在上述工序6得到的化合物(1.37g)的乙腈(6.67mL)溶液中加入水(48μL)和三氟乙酸吡啶盐(335mg),在室温下搅拌15分钟。在反应液中加入叔丁胺(6.67mL),在室温下搅拌15分钟。将反应液减压浓缩后,将残留物在乙腈(5mL)中共沸2次。在残留物的二氯甲烷(16.7mL)溶液中加入水(0.240mL)后,加入二氯乙酸(0.953mL)的二氯甲烷(16.7mL)溶液,在室温下搅拌15分钟。加入吡啶(1.82mL)使反应停止后,将反应液减压浓缩。将残留物用脱水乙腈(10mL)共沸3次,最后一次残留5mL左右的乙腈。将得到的标题化合物的乙腈溶液直接用于下一个反应中。
(工序8)
将市售(ChemGenes)的N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(1.31g)用脱水乙腈(10mL)共沸3次,最后一次残留5mL左右的乙腈,加入分子筛3A,1/16(团块状的5粒)。在上述工序7合成的溶液中加入上述的乙腈溶液,在氮气氛下、室温下搅拌20分钟。在反应液中加入N,N-二甲基-N’-(3-亚巯基-3H-1,2,4-二噻唑-5-基)甲脒(300mg),在室温下搅拌30分钟后,将反应液减压浓缩。在残留物的二氯甲烷(19.0mL)溶液中加入水(0.240mL)后,加入二氯乙酸(1.20mL)的二氯甲烷(19.0mL)溶液,在室温下搅拌15分钟。在反应液中加入吡啶(13.2mL)使反应停止后,进行减压浓缩。将得到的粗产物直接使用于接下来的反应中。
(工序9)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
将上述工序8得到的粗产物的吡啶(39.6mL)溶液浓缩至25mL左右后,加入2-氯-5,5-二甲基-1,3,2λ
MS(ESI)m/z:1219(M+H)
(工序10)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序9得到的化合物(507mg)的甲醇(5mL)溶液中加入28%氨水(5mL),在室温下搅拌14小时。将反应液浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(301mg)。
MS(ESI)m/z:958(M+H)
(工序11)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序10得到的化合物(301mg)中加入三乙胺三氢氟酸盐(3.84mL),在45℃下搅拌3小时。在室温下,在反应液中加入冰冷的1M碳酸氢三乙基铵水溶液(20mL)和三乙胺(4mL)的混合液。将反应液减压浓缩后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:0%-25%(0分-40分)]进行精制,分离磷原子上的非对映异构体。将得到的化合物(三乙胺盐)用以下的方法转换为钠盐。
[转换为钠盐]
将BT AG(注册商标)50W-X2 Resin(biotechnology grade,100-200mesh,hydrogen form)(500mg)悬浮于纯水中,填充至空柱子中。使过量的纯水自然流下后,依次自然流下1M氢氧化钠水溶液(5mL)和纯水(10mL)。将上述得到的化合物溶解于纯水(5mL)中并装填于柱子中。将自然流下的溶液分离提取后,进一步用纯水(10mL)进行溶解析出。合并包含目标产物的组分进行冷冻干燥得到标题化合物的非对映异构体1(83.4mg)、非对映异构体2(44.8mg)、以及非对映异构体3(13.1mg)(HPLC的保留时间:非对映异构体1>2,3)。
非对映异构体1
MS(ESI)m/z:730(M+H)
非对映异构体2
MS(ESI)m/z:730(M+H)
非对映异构体3
MS(ESI)m/z:730(M+H)
实施例2:CDN2的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(实施例1记载的化合物1的非对映异构体4)
[合成路径]
(工序1)
N-苯甲酰基-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-[羟基(桥氧基)-λ
使用市售(ChemGenes)的N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(962mg),以与实施例1工序7同样的方法进行反应,得到标题化合物的乙腈溶液。将该乙腈溶液直接使用于接下来的反应。
(工序2)
使用上述工序1所得到的化合物和实施例1工序6所得到的化合物(1.00g),以与实施例1工序8同样的方法进行反应。将得到的粗产物直接使用于接下来的反应。
(工序3)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2-(2-氰基乙氧基)-10-桥氧基-10-巯基-2-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(367mg)。
MS(ESI)m/z:1219(M+H)
(工序4)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(367mg),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(115mg:含有杂质)和非对映异构体4(101mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:958(M+H)
非对映异构体4(高极性)
MS(ESI)m/z:958(M+H)
(工序5)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(化合物1的非对映异构体4)
使用上述工序4所得到的化合物(非对映异构体4)(101mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:5%-25%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇、甲醇:5%-100%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(28.5mg)。
MS(ESI)m/z:730(M+H)
实施例3:CDN3的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-2,10,15,16-四羟基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在实施例1工序11所得到的化合物(非对映异构体1)(30.0mg)的丙酮(0.5mL)-水(0.2mL)溶液中加入三乙胺(0.27mL)和碘甲烷(60μL),搅拌1天。将反应液减压浓缩后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:0%-20%(0分-40分)]进行精制。将得到的化合物以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21.2mg)。
MS(ESI)m/z:698(M+H)
实施例4:CDN4的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
实施例1工序7的反应按照以下的规模进行实施(原料:1.01g)。使用得到的化合物的乙腈溶液和市售(Wuhu Nuowei Chemistry)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-N-(2-甲基丙酰基)鸟苷(954mg),以与实施例1工序8相同的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序2)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(357mg)。
MS(ESI)m/z:1201(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(357mg),以与实施例1工序10同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(241mg)。
MS(ESI)m/z:974(M+H)
(工序4)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(241mg),以与实施例1工序11同样的方法进行反应后,在以下的[精制条件]下分离磷原子上的非对映异构体,分别得到三乙胺盐形式的标题化合物的2种非对映异构体。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:5%-20%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物的非对映异构体1(56.7mg)和非对映异构体2(25.9mg)(HPLC的保留时间:非对映异构体1>2)。
非对映异构体1(低极性)
MS(ESI)m/z:746(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:746(M+H)
实施例5:CDN5的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2’,3’,5’-三-O-乙酰基-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]肌苷
在2’,3’,5’-三-O-乙酰基肌苷(5.00g)的四氢呋喃(90mL)悬浮液中加入2-(三甲基甲硅烷基)乙基(2-羟基乙基)氨基甲酸酯(3.12g)和三苯基膦(3.99g)之后,加入二丙烷-2-基(E)-二氮烯-1,2-二甲酸酯(3.05mL)的四氢呋喃(10mL)溶液,在室温下搅拌15小时。将反应液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇]进行精制,得到标题化合物(3.01g)。
MS(ESI)m/z:582(M+H)
(工序2)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]肌苷
在上述工序1所得到的化合物(3.01g)的四氢呋喃(15mL)-甲醇(15mL)溶液中加入碳酸钾(100mg),在室温下搅拌2小时。在反应液中加入乙酸(83μL),进行减压浓缩,将残留物用吡啶进行共沸。再次在吡啶(30mL)中溶解后,在0℃下加入4,4’-二甲氧基三苯甲基氯(2.10g),搅拌30分钟后,用冰箱保管一晚。在反应液中加入甲醇(1mL),搅拌30分钟后,进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(3.61g)。
MS(ESI)m/z:758(M+H)
(工序3)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]肌苷在上述工序2所得到的化合物(3.61g)的二氯甲烷(18mL)溶液中加入咪唑(811mg)和叔丁基(氯)二甲基硅烷(861mg),在室温下搅拌17小时。在反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷进行萃取。将有机层用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,分别得到标题化合物(1.61g)及标题化合物的位置异构体5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]肌苷(1.31g)。
MS(ESI)m/z:872(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:872(M+H)
(工序4)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]肌苷
在上述工序3所得到的化合物(1.61g)的二氯甲烷(18.5mL)溶液中加入4,5-二氰基咪唑(240mg)和2-氰基乙基N,N,N’,N’-四异丙基亚磷酰二胺(0.703mL),在室温下搅拌15小时。在反应液中加入饱和碳酸氢钠水溶液使反应停止。将反应液用二氯甲烷萃取后,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用DIOL硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物(非对映异构体比=61:39)形式的标题化合物(1.95g)。
MS(ESI)m/z:1072(M+H)
(工序5)
按照以下的规模实施与实施例1工序7相同的反应(原料:910mg)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(950mg),以与实施例1工序8同样的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序6)
2-(三甲基甲硅烷基)乙基(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(602mg)。
MS(ESI)m/z:1303(M+H)
(工序7)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-7-{6-桥氧基-1-[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]-1,6-二氢-9H-嘌呤-9-基}-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(602mg),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(205mg:含有杂质)和非对映异构体2(244mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1146(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1146(M+H)
(工序8-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
在上述工序7所得到的化合物(非对映异构体1)(145mg:含有杂质)中加入三乙胺三氢氟酸盐(1.31mL),在45℃下搅拌3小时。在室温下在反应液中加入冰冷的1M碳酸氢三乙基铵溶液(10mL)和三乙胺(2mL)的混合溶液。将反应液减压浓缩后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制。在得到的化合物的四氢呋喃(4mL)溶液中加入氟化四丁基铵的四氢呋喃溶液(约1M,2mL),在室温下搅拌39小时。在反应液中加入10mM乙酸三乙基铵水溶液(4mL)进行减压浓缩。将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:5%-50%(0分-40分)]进行精制。在得到的化合物(三乙胺盐)进行盐转换时,除了在溶解化合物的溶剂以及洗脱液的一部分使用乙腈-甲醇-纯水(1:1:1)的混合液以外,以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(72.5mg)。
MS(ESI)m/z:774(M+H)
(工序8-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7所得到的化合物(非对映异构体2)(133mg:含有杂质),以与上述工序8-1同样的方法进行反应以及盐转换,得到标题化合物(55.4mg)。
MS(ESI)m/z:774(M+H)
实施例6:CDN6的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2’,3’,5’-三-O-乙酰基-1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)肌苷
在市售(Ark Pharm)的2’,3’,5’-三-O-乙酰基肌苷(10.0g)的四氢呋喃(100mL)悬浮液中,加入2-{[叔丁基(二甲基)甲硅烷基]氧基}乙烷-1-醇(5.37g)和三苯基膦(7.69g)后,再加入二丙烷-2-基(E)-二氮烯-1,2-二甲酸酯(6.10mL),在室温下搅拌6小时。将反应液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯/二氯甲烷]进行精制,得到与三苯基膦氧化物的混合物(10.6g)形式的标题化合物。
MS(ESI)m/z:553(M+H)
(工序2)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)肌苷
使用上述工序1所得到的化合物(10.6g),以与实施例5工序2同样的方法进行反应,得到与三苯基膦氧化物的混合物(7.21g)形式的标题化合物。
MS(ESI)m/z:729(M+H)
(工序3)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)肌苷
使用上述工序2所得到的化合物(7.21g),以与实施例5工序3同样的方法进行反应,得到标题化合物(2.17g)及标题化合物的位置异构体5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)肌苷(2.55g)。
MS(ESI)m/z:843(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:843(M+H)
(工序4)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}肌苷
使用上述工序3所得到的化合物(2.17g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(2.65g)。
MS(ESI)m/z:1043(M+H)
(工序5)
按照以下的规模实施与实施例1工序7相同的反应(原料:935mg)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(950mg),以与实施例1工序8同样的方法进行反应。将得到的粗产物直接使用于接下来的反应。
(工序6)
3-({(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(494mg)。
MS(ESI)m/z:1274(M+H)
(工序7)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(494mg),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(88.5mg:含有杂质)和非对映异构体2(70.7mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1003(M-C
非对映异构体2(高极性)
MS(ESI)m/z:1003(M-C
(工序8-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7所得到的化合物(非对映异构体1)(88.5mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(25.7mg)。
MS(ESI)m/z:775(M+H)
(工序8-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7所得到的化合物(非对映异构体2)(70.7mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:5%-25%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇、甲醇:15%-70%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(17.8mg)。
MS(ESI)m/z:775(M+H)
实施例7:CDN7的合成
N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
在实施例5工序8-1所得到的化合物(10.0mg)的N,N-二甲基甲酰胺(0.5mL)溶液中加入三乙胺(8μL)和1-[(羟基乙酰基)氧基]吡咯烷-2,5-二酮(5.3mg),在室温下搅拌2小时。将反应液用10mM乙酸三乙基铵水溶液进行稀释,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:0%-30%(0分-40分)]进行精制。将得到的化合物(三乙胺盐)以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(10.5mg)。
MS(ESI)m/z:832(M+H)
(工序1-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用实施例5工序8-2所得到的化合物(30.0mg),以与上述工序1-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(23.6mg)。
MS(ESI)m/z:832(M+H)
实施例8:CDN8的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’,3’-双-O-[叔丁基(二甲基)甲硅烷基]-2-氯腺苷
在文献已知(J.Med.Chem.1989,32,1135-1140)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-氯腺苷(29.1g)的N,N-二甲基甲酰胺(145mL)溶液中加入咪唑(16.4g)和叔丁基二甲基氯硅烷(18.2g),在室温下搅拌18小时。在反应液中加入水使反应停止后,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(34.9g)。
MS(ESI)m/z:832(M+H)
(工序2)
N-乙酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’,3’-双-O-[叔丁基(二甲基)甲硅烷基]-2-氯腺苷
在上述工序1所得到的化合物(34.9g)的吡啶(210mL)溶液中加入乙酸酐(140mL)和4-二甲基氨基吡啶(515mg),在氮气氛下、室温下搅拌21小时。将反应液用二氯甲烷(100mL)稀释后,加入饱和碳酸氢钠水溶液,用二氯甲烷进行萃取。将有机层用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。在残留物中加入二氯甲烷(210mL)和吗啉(7.30mL),在室温下搅拌1小时。在反应液中加入饱和氯化铵水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(45.4g:含有杂质)。将得到的化合物不进行上述的精制直接在接下来的反应中使用。
(工序3)
N-乙酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-氯腺苷
在上述工序2所得到的化合物(45.4g:含有杂质)的四氢呋喃(200mL)溶液中加入氟化四丁基铵的四氢呋喃溶液(约1.0M,100mL),在氮气氛下、室温下搅拌3小时。在反应液中加入饱和氯化铵水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[二氯甲烷/丙酮/0.1%三乙胺]进行精制,得到标题化合物(23.0g)。
(工序4)
N-乙酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2-氯腺苷
在上述工序3所得到的化合物(23.0g)的N,N-二甲基甲酰胺(178mL)溶液中加入咪唑(5.94g)和叔丁基二甲基氯硅烷(6.44g),在氮气氛下、室温下搅拌18小时。在反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(9.01g)。
(工序5)
N-乙酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2-氯-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷
使用上述工序4所得到的化合物(9.01g),以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=65:35)形式的标题化合物(10.6g)。
(工序6)
N,N-二乙基乙铵(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-乙酰胺-2-氯-9H-嘌呤-9-基)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
按照以下的规模实施与实施例1工序7相同的反应(原料:2.06g)。使用得到的化合物的乙腈溶液和上述工序5所得到的化合物(1.98g),以与实施例1工序8以及实施例1工序9同样的方法进行反应,得到标题化合物的非对映异构体1(180mg)和非对映异构体2(167mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1191(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1191(M+H)
(工序7-1)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
MS(ESI)m/z:1016(M+H)
(工序7-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序6所得到的化合物(非对映异构体2)(50.0mg:含有杂质)的甲醇(1.29mL)溶液中加入乙二胺(25.8μL),在60℃下搅拌2小时后,使用微波反应装置在120℃下反应2小时。用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-50%(0分-30分)]进行精制,得到标题化合物(23.7mg)。
MS(ESI)m/z:1016(M+H)
(工序8-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7-1所得到的化合物(37.2mg),以与实施例1工序11同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(16.5mg)。
MS(ESI)m/z:788(M+H)
(工序8-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7-2所得到的化合物(23.7mg),以与实施例1工序11同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(14.9mg)。
MS(ESI)m/z:788(M+H)
实施例9:CDN9的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
MS(ESI)m/z:1017(M+H)
(工序1-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在实施例8工序6所得到的化合物(非对映异构体2)(49.3mg:含有杂质)的甲醇(1.27mL)溶液中加入2-氨基乙醇(254μL),在60℃下搅拌2小时后,使用微波反应装置在120℃下反应3小时。使用制备型HPLC[10mM乙酸三乙基铵溶液/乙腈,乙腈:20%-60%(0分-30分)]进行精制,得到标题化合物(26.1mg)。
MS(ESI)m/z:1017(M+H)
(工序2-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序1-1所得到的混合物(39.4mg),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(16.8mg)。
MS(ESI)m/z:789(M+H)
(工序2-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序1-2所得到的化合物(26.1mg),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(18.6mg)。
MS(ESI)m/z:789(M+H)
实施例10:CDN10的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基-2-甲基丙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基-2-甲基丙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在实施例8工序6所得到的化合物(非对映异构体1)(41.0mg)的甲醇(1.10mL)溶液中加入1,2-二氨基-2-甲基丙烷(210μL),在60℃下搅拌2小时后,使用微波反应装置在120℃下反应6小时。使用制备型HPLC[10mM乙酸三乙基铵溶液/乙腈,乙腈:20%-60%(0分-30分)]进行简易精制,得到标题化合物(16.3mg:含有杂质)。将得到的化合物不经过上述精制直接使用于接下来的反应。
MS(ESI)m/z:1044(M+H)
(工序2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基-2-甲基丙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的化合物(16.3mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(6.4mg)。
MS(ESI)m/z:816(M+H)
实施例11:CDN11的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(氨基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-氰基腺苷
在文献已知(J.Am.Chem.Soc.1989,111,8502-8504)的2-氰基腺苷(440mg)的吡啶(8.00mL)溶液中加入4,4’-二甲氧基三苯甲基氯(642mg),在氮气氛下、室温下搅拌4小时。在反应液中加入甲醇(10mL)使反应停止后进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(528mg)。
(工序2)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]腺苷
在上述工序1所得到的化合物(14.3g)的四氢呋喃(500mL)溶液中加入氢化锂铝的四氢呋喃溶液(约2.5M,29.0mL),在氮气氛下、40℃下搅拌2小时。将反应液冰冷,加入饱和碳酸氢钠水溶液(450mL)搅拌10分钟后,加入1-({[2-(三甲基甲硅烷基)乙氧基]羰基}氧基)吡咯烷-2,5-二酮(25.0g),在室温下反应18小时。加入饱和罗谢尔盐(Rochellesalt)水溶液,搅拌2.5小时后,用二氯甲烷/甲醇的混合液萃取。将有机层用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(10.8g)。
(工序3)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]腺苷
在上述工序2所得到的化合物(10.8g)的吡啶(70.0mL)溶液中加入氯三甲基硅烷(15.0mL),在氮气氛下、室温下搅拌2小时。在反应液中加入苯甲酰氯(8.44mL)再搅拌2小时。将反应液冷却至0℃,加入水(21.0mL)搅拌10分钟后,加入28%氨水(31.4mL),在同温度下进一步搅拌20分钟。升温至室温进一步搅拌3小时后,将反应液减压浓缩。将残留物悬浮于乙酸乙酯中,过滤除去固体。将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(9.47g)。
MS(ESI)m/z:847(M+H)
(工序4)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]腺苷
使用上述工序3所得到的化合物(9.47g),以与实施例8工序4同样的方法得到标题化合物(3.13g)。
MS(ESI)m/z:961(M+H)
(工序5)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]腺苷
在上述工序4所得到的化合物(1.49g)的二氯甲烷(15.5mL)溶液中加入N,N-二异丙基乙基胺(1.58mL)和2-氰基乙基N,N-二异丙基氯亚磷酰胺(1.04mL),在氮气氛下、室温下搅拌2小时。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]以及C18硅胶柱层析[乙腈:100%]进行精制,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(1.39g)。
(工序6)
N,N-二乙基乙铵(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-苯甲酰胺-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]-9H-嘌呤-9-基}-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
按照以下的规模实施与实施例1工序7同样的反应(原料:1.94g)。使用得到的化合物的乙腈溶液和上述工序5所得到的化合物(2.19g),以与实施例1工序8以及实施例1工序9同样的方法进行反应,得到标题化合物的非对映异构体1(138mg)和非对映异构体2(82.8mg)。
非对映异构体1(低极性)
非对映异构体2(高极性)
MS(ESI)m/z:1392(M+H)
(工序7-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(非对映异构体1)(42.3mg),以与实施例1工序10同样的方法进行反应,得到标题化合物(25.9mg)。
MS(ESI)m/z:1131(M+H)
(工序7-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(非对映异构体2)(82.8mg),以与实施例1工序10同样的方法进行反应,得到标题化合物(45.2mg)。
(工序8-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序7-1所得到的化合物(25.9mg)中加入三乙胺三氢氟酸盐(700μL),在55℃下搅拌2小时。在室温下,在反应液中加入冰冷的1M碳酸三乙基铵水溶液(3.5mL)与三乙胺(1.10mL)的混合液,使用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-40%(0分-30分)]进行精制,得到标题化合物(19.1mg)。
MS(ESI)m/z:903(M+H)
(工序8-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)甲基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7-2所得到的化合物(45.2mg),以与上述工序8-1同样的方法进行反应,得到标题化合物(37.1mg)。
MS(ESI)m/z:903(M+H)
(工序9-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(氨基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
在上述工序8-1所得到的化合物(19.1mg)的四氢呋喃(576μL)溶液中加入氟化四丁基铵的四氢呋喃溶液(约1M,288μL),在氮气氛下,在室温下搅拌一整夜后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:0%-30%(0分-40分)]以及Sep-Pak(注册商标)C18[水/乙腈].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(8.4mg)。
MS(ESI)m/z:759(M+H)
(工序9-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(氨基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序8-2所得到的化合物(37.1mg),以与上述工序9-1同样的方法进行反应,得到标题化合物(12.8mg)。
MS(ESI)m/z:759(M+H)
实施例12:CDN12的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(羟基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
6-氯-2-碘基-9-{2,3,5-三-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤
在市售(Amadis Chemical)的6-氯-2-碘基-9-β-D-呋喃核糖基-9H-嘌呤(9.65g)的乙二醇二甲基醚(120mL)溶液中,在0℃下加入N,N-二异丙基乙基胺(40.7mL)和叔丁基二甲基甲硅烷基三氟甲磺酸酯(26.9mL),在氮气氛下升温至室温,搅拌19小时。将反应液冷却至0℃,在反应液中加入饱和碳酸氢钠水溶液使反应停止后用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(13.7g)。
(工序2)
2-[(苯甲酰基氧基)甲基]-6-氯-9-{2,3,5-三-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤
在上述工序1所得到的化合物(13.7g)的四氢呋喃(121mL)溶液中,在氮气氛下加入四(三苯基膦)钯(0)(2.10g)和根据下述的方法制备的苄基氧基甲基碘化锌(约0.9M,30.2mL),在室温下搅拌20小时。在反应液中加入饱和氯化铵水溶液使反应停止后用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(7.29g)。
[苄基氧基甲基碘化锌的制备]
在氮气氛下,用超声波处理了锌粉末(5.99g)的四氢呋喃(17.1mL)悬浮液后,在10~15℃下加入苯甲酸碘甲酯(12.0g)的四氢呋喃(21.3mL)溶液,在同样的温度下搅拌1.5小时,得到苄基氧基甲基碘化锌的四氢呋喃溶液(约0.9M,38.4mL)。
MS(ESI)m/z:763(M+H)
(工序3)
2-[(苯甲酰基氧基)甲基]-6-氯-9-β-D-呋喃核糖基-9H-嘌呤
在上述工序2所得到的化合物(7.29g)的四氢呋喃(47.7mL)溶液中,在氮气氛、0℃下加入氟化四丁基铵的四氢呋喃溶液(约1M,38mL),在同样的温度下搅拌2.5小时。在反应液加入饱和氯化铵水溶液使反应停止后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(3.69g)。
(工序4)
2-[(苯甲酰基氧基)甲基]-9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃核糖基}-6-氯-9H-嘌呤
在上述工序3所得到的化合物(2.36g)的吡啶(56mL)溶液中加入4,4’-二甲氧基三苯甲基氯(2.30g),在氮气氛下、室温下搅拌17小时。在反应液中加入乙醇(20mL),进一步搅拌10分钟左右后,进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(1.41g)。
MS(ESI)m/z:745(M+Na)
(工序5)
2-[(苯甲酰基氧基)甲基]-9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6-氯-9H-嘌呤
在上述工序4所得到的化合物(2.61g)的乙二醇二甲基醚(72.0mL)溶液中加入N,N-二异丙基乙基胺(1.89mL)和叔丁基二甲基甲硅烷基三氟甲磺酸酯(1.24mL),在氮气氛下、室温下搅拌1.5小时。在反应液中加入饱和碳酸氢钠水溶液使反应停止后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(1.10g)。
(工序6)
2-[(苯甲酰基氧基)甲基]-9-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-2-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-6-氯-9H-嘌呤
使用上述工序5所得到的化合物(511mg),以与实施例1工序6同样的方法进行反应,得到磷原子相关的非对映异构体混合物形式的标题化合物(569mg)(非对映异构体比=6:4)。
(工序7)
N,N-二乙基乙铵(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{2-[(苯甲酰基氧基)甲基]-6-氯-9H-嘌呤-9-基}-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
按以下的规模实施与实施例1工序7相同的反应(原料:2.72g)。使用得到的化合物的乙腈溶液和上述工序6所得到的化合物(3.03g),以与实施例1工序8以及实施例1工序9同样的方法进行反应,得到标题化合物的非对映异构体1(351mg)和非对映异构体2(351mg)。
非对映异构体1(低极性)
MS(ESI)m/z:1268(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1268(M+H)
(工序8-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[6-氨基-2-(羟基甲基)-9H-嘌呤-9-基]-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序7所得到的化合物(非对映异构体1)(37.3mg)的甲醇(0.500mL)溶液中加入28%氨水溶液(0.500mL),在密封管中60℃下搅拌3小时。将反应液直接用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:35%-55%(0分-30分)]进行精制,得到标题化合物(22.0mg:含有杂质)。
MS(ESI)m/z:988(M+H)
(工序8-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[6-氨基-2-(羟基甲基)-9H-嘌呤-9-基]-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序7所得到的化合物(非对映异构体2)(37.7mg)的四氢呋喃(0.500mL)溶液中加入28%氨水溶液(0.500mL),在密封管中60℃下搅拌3小时。追加28%氨水溶液(0.500mL)进一步搅拌3小时。追加28%氨水溶液(0.500mL)再搅拌一夜。将反应液直接用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-50%(0分-30分)]进行精制,得到标题化合物(19.3mg)。
MS(ESI)m/z:988(M+H)
(工序9-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(羟基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8-1所得到的化合物(22.0mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(8.0mg)。
MS(ESI)m/z:760(M+H)
(工序9-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-(羟基甲基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8-2所得到的化合物(19.3mg),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(6.5mg)。
MS(ESI)m/z:760(M+H)
实施例13:CDN13的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6-氯-9H-嘌呤
使用文献已知(J.Org.Chem.2000,65,5104-5113)的9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃核糖基}-6-氯-9H-嘌呤(15.3g),以与实施例5工序3同样的方法进行反应,得到标题化合物(8.44g)和标题化合物的位置异构体9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6-氯-9H-嘌呤(5.77g)。
MS(ESI)m/z:703(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:703(M+H)
(工序2)
9-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-2-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-6-氯-9H-嘌呤
使用上述工序1所得到的化合物(5.39g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(5.78g)。
MS(ESI)m/z:903(M+H)
(工序3)
按照以下的规模实施与实施例1工序7同样的反应(原料:1.84g)。使用得到的化合物的乙腈溶液和上述工序2所得到的化合物(1.62g),以与实施例1工序8同样的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序4)
3-{[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-(6-氯-9H-嘌呤-9-基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(626mg)。
MS(ESI)m/z:1134(M+H)
(工序5)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序4所得到的化合物(299mg:非对映异构体混合物)的乙醇(10mL)溶液中加入乙二胺(0.352mL)和三乙胺(0.735mL),在60℃下搅拌15小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(122mg:含有杂质)和非对映异构体2(111mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1001(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1001(M+H)
(工序6-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序5所得到的化合物(非对映异构体1)(122mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(29.6mg)。
MS(ESI)m/z:773(M+H)
(工序6-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序5所得到的化合物(非对映异构体2)(119mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(15.6mg)。
MS(ESI)m/z:773(M+H)
实施例14:CDN14的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-{6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-{6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在实施例13工序4所得到的化合物(313mg)的乙醇(10mL)溶液中加入2-氨基乙醇(0.330mL)和三乙胺(0.769mL),在60℃下搅拌15小时。将反应液减压浓缩后,将残留物利用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(111mg:含有杂质)和非对映异构体2(102mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1002(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1002(M+H)
(工序2-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-{6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序1所得到的化合物(非对映异构体1)(111mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(47.1mg)。
MS(ESI)m/z:774(M+H)
(工序2-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-{6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序1所得到的化合物(非对映异构体2)(102mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(27.1mg)。
MS(ESI)m/z:774(M+H)
实施例15:CDN15的合成
N-[2-({9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-(6-{[2-(2-羟基乙酰胺)乙基]氨基}-9H-嘌呤-9-基)-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例13工序6-2所得到的化合物(10.0mg),以与实施例7工序1-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-35%(0分-40分)]
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(6.6mg)。
MS(ESI)m/z:831(M+H)
实施例16:CDN16的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{2-氨基-6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2-乙酰胺-2’,3’,5’-三-O-乙酰基-N-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)腺苷
在市售(东京化成工业)的6-氯-9-β-D-呋喃核糖基-9H-嘌呤-2-胺(5.00g)的乙醇(30mL)溶液中加入2-{[叔丁基(二甲基)甲硅烷基]氧基}乙烷-1-胺(3.49g)和N,N-二异丙基乙基胺(4.33mL),在80℃下搅拌65小时。将反应液减压浓缩后,在残留物中加入吡啶(15mL)和乙酸酐(15mL),在70℃下搅拌4小时。将反应液减压浓缩后,加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(8.91g)。
MS(ESI)m/z:609(M+H)
(工序2)
2-乙酰胺-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-N-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)腺苷
在上述工序1所得到的化合物(4.00g)的二氯甲烷(40mL)溶液中加入甲醇钠的甲醇溶液(1.0M,6.64mL),在0℃下搅拌1小时。在反应液中加入乙酸(0.413mL)和吡啶(0.5mL)使反应停止后,将反应液减压浓缩。在残留物中加入吡啶后,在减压下浓缩一部分,制备吡啶(约20mL)溶液。在该溶液中在0℃下加入4,4’-二甲氧基三苯甲基氯(4.68g),在同温度下搅拌30分钟后,在4℃保存一夜。在反应液中加入甲醇(2mL),搅拌30分钟后,进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(4.41g)。
MS(ESI)m/z:785(M+H)
(工序3)
2-乙酰胺-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-N-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)腺苷
使用上述工序2所得到的化合物(4.41g),以与实施例5工序3同样的方法进行反应,得到标题化合物(1.75g)以及标题化合物的位置异构体2-乙酰胺-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-N-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)腺苷(1.31g)。
MS(ESI)m/z:899(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:899(M+H)
(工序4)
2-乙酰胺-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-N-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷
使用上述工序3所得到的化合物(1.75g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(2.08g)。
MS(ESI)m/z:1099(M+H)
(工序5)
按以下的规模实施与实施例1工序7相同的反应(原料:981mg)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(1.05g),以与实施例1工序8同样的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序6)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(413mg)。
MS(ESI)m/z:1330(M+H)
(工序7)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{2-氨基-6-[(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)氨基]-9H-嘌呤-9-基}-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使上述工序6所得到的化合物(413mg)溶解于甲醇(5mL)和28%氨水(5mL)中,在室温下搅拌63小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行简易精制,将低极性的非对映异构体1和高极性的非对映异构体2分离。将各个非对映异构体再次溶解于甲醇(5mL)和28%氨水(5mL)中,在100℃下搅拌2天。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(70.4mg:含有杂质)和非对映异构体2(65.1mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1131(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1131(M+H)
(工序8-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{2-氨基-6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7所得到的化合物(非对映异构体1)(70.4mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(20.8mg)。
MS(ESI)m/z:789(M+H)
(工序8-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{2-氨基-6-[(2-羟基乙基)氨基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7所得到的化合物(非对映异构体2)(65.1mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇、甲醇:0%-60%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(7.9mg)。
MS(ESI)m/z:789(M+H)
实施例17:CDN17的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[6-(羟基甲基)-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
6-[(苯甲酰基氧基)甲基]-9-{2,3,5-三-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤
使用文献已知(J.Org.Chem.1997,62,6833-6841)的6-氯-9-{2,3,5-三-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤(10.7g),以与实施例12工序2同样的方法进行反应,得到标题化合物(10.4g)。
MS(ESI)m/z:729(M+H)
(工序2)
6-[(苯甲酰基氧基)甲基]-9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃核糖基}-9H-嘌呤
在上述工序1所得到的化合物(10.3g)的四氢呋喃(50mL)溶液中加入氟化四丁基铵的四氢呋喃溶液(约1M,49.4mL),在0℃下搅拌4小时。在反应液中加入乙酸(2.83mL)之后进行减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行粗精制。在粗产物的吡啶(50mL)溶液中,在0℃下加入4,4’-二甲氧基三苯甲基氯(10.1g),在4℃下搅拌一夜。在反应液中加入甲醇(2mL),搅拌1小时。在反应液中加入饱和碳酸氢钠水溶液,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(4.62g)。
MS(ESI)m/z:689(M+H)
(工序3)
6-[(苯甲酰基氧基)甲基]-9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤
使用上述工序2所得到的化合物(4.53g),以与实施例5工序3同样的方法进行反应,得到标题化合物(2.09g)以及标题化合物的位置异构体6-[(苯甲酰基氧基)甲基]-9-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-9H-嘌呤(1.81g)。
MS(ESI)m/z:803(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:803(M+H)
(工序4)
6-[(苯甲酰基氧基)甲基]-9-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-2-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-9H-嘌呤
使用上述工序3所得到的化合物(2.04g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=56:44)形式的标题化合物(2.37g)。
MS(ESI)m/z:1003(M+H)
(工序5)
按以下的规模实施与实施例1工序7相同的反应(原料:783mg)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(765mg),以与实施例1工序8同样的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序6)
{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(345mg)。
MS(ESI)m/z:1234(M+H)
(工序7)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[6-(羟基甲基)-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(345mg),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(101mg:含有杂质)和非对映异构体2(89.9mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:973(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:973(M+H)
(工序8-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[6-(羟基甲基)-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7所得到的化合物(非对映异构体1)(101mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(59.2mg)。
MS(ESI)m/z:745(M+H)
(工序8-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[6-(羟基甲基)-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7所得到的化合物(非对映异构体2)(88.5mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇、甲醇:10%-70%(0分-40分)]。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(27.7mg)。
MS(ESI)m/z:745(M+H)
实施例18:CDN18的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[4-氨基-5-(3-氨基丙基)-7H-吡咯并[2,3-d]嘧啶-7-基]-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
4-叠氮基-5-碘基-7-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-7H-吡咯并[2,3-d]嘧啶
在文献已知(Synth.Commun.2012,42,358-374)的4-氯-5-碘基-7-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-7H-吡咯并[2,3-d]嘧啶(17.96g)的N,N-二甲基甲酰胺(90mL)溶液中加入叠氮化四丁基铵(10.1g),在80℃下搅拌30分钟。将反应液恢复到室温,在反应液中加入饱和碳酸氢钠水溶液和乙酸乙酯,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(17.66g)。
(工序2)
4-叠氮基-7-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙-1-炔-1-基]-7H-吡咯并[2,3-d]嘧啶
在上述工序1所得到的化合物(9.64g)的N,N-二甲基甲酰胺(30mL)-四氢呋喃(100mL)混合溶液中,依次加入2-(三甲基甲硅烷基)乙基丙-2-炔-1-基氨基甲酸酯(6.58g)、三乙胺(4.57mL)、四(三苯基膦)钯(0)(763mg)、以及碘化铜(I)(251mg),在室温下搅拌一整夜。在反应液中加入水,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(7.20g)。
(工序3)
7-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺
在上述工序2所得到的化合物(7.20g)的甲醇(70mL)-四氢呋喃(70mL)混合溶液中加入20%氢氧化钯碳(2g),在氢气氛下、室温下搅拌2小时。将催化剂过滤除去后,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(5.45g)。
(工序4)
N,N-二苯甲酰基-7-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺
在上述工序3所得到的化合物(5.45g)的二氯甲烷(60mL)溶液中在0℃下依次加入吡啶(1.69mL)和苯甲酰氯(2.01mL),在0℃下搅拌5分钟后,再加入三乙胺(2.91mL),在室温下搅拌2小时。在反应液中加入饱和碳酸氢钠水溶液和二氯甲烷,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,再用乙酸乙酯和己烷粉末化。过滤得到的固体,得到标题化合物(6.16g)。
(工序5)
N-苯甲酰基-7-β-D-呋喃核糖基-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺
在上述工序4所得到的化合物(6.16g)的四氢呋喃(250mL)溶液中在0℃下滴入甲醇钠的甲醇溶液(1.0M,12.0mL),在室温下搅拌1小时。在0℃下在反应液中加入乙酸(1.07mL)后进行减压浓缩。将残留物用硅胶柱层析[乙酸乙酯/甲醇]进行精制,进一步用乙酸乙酯和己烷粉末化。过滤得到的固体,得到标题化合物(3.35g)。
(工序6)
N-苯甲酰基-7-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃核糖基}-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺
用吡啶将上述工序5所得到的化合物(3.35g)共沸,在残留物的无水吡啶(50mL)溶液中在0℃下加入4,4’-二甲氧基三苯甲基氯(2.38g),在室温下搅拌一整夜。在反应液中加入乙醇(5mL)使反应停止后进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(4.34g)。
(工序7)
N-苯甲酰基-7-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺(3’-O-TBS体)
使用上述工序6所得到的化合物(4.34g),以与实施例8工序4同样的方法进行反应,分别得到标题化合物(1.51g)、标题化合物的位置异构体N-苯甲酰基-7-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺(2’-O-TBS体)(2.01g)。
(3’-OTBS体)(高极性)
(2’-OTBS体)(低极性)
(工序8)
N-苯甲酰基-7-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-[叔丁基(二甲基)甲硅烷基]-2-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-5-[3-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)丙基]-7H-吡咯并[2,3-d]嘧啶-4-胺
使用上述工序7所得到的化合物(3’-OTBS体)(1.51g),以与实施例1工序6同样的方法进行反应,分别得到作为磷原子上的非对映异构体的标题化合物的非对映异构体1(0.77g)和非对映异构体2(0.48g)。
非对映异构体1(低极性)
非对映异构体2(高极性)
(工序9)
2-(三甲基甲硅烷基)乙基(3-{4-苯甲酰胺-7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
按以下的规模实施与实施例1工序7同样的反应(原料:1.08g)。使用得到的化合物的乙腈溶液和上述工序8所得到的化合物(1.25g:非对映异构体混合物),以与实施例1工序8以及实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物。用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-50%(0分-35分)]将磷原子上的非对映异构体分离,得到标题化合物的非对映异构体1(0.19g)和非对映异构体2(0.043g)。
非对映异构体1(低极性)
MS(ESI)m/z:1419(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1419(M+H)
(工序10-1)
2-(三甲基甲硅烷基)乙基(3-{4-氨基-7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(非对映异构体1)(0.19g),以与实施例12工序8-1同样的方法进行反应。利用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:40%-70%(0分-35分)]进行精制,得到标题化合物(58mg)。
MS(ESI)m/z:1158(M+H)
(工序10-2)
2-(三甲基甲硅烷基)乙基(3-{4-氨基-7-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(非对映异构体2)(43mg),以与实施例12工序8-1同样的方法进行反应。利用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-60%(0分-35分)]进行精制,得到标题化合物(15mg)。
MS(ESI)m/z:1158(M+H)
(工序11-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[4-氨基-5-(3-氨基丙基)-7H-吡咯并[2,3-d]嘧啶-7-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序10-1所得到的化合物(58mg)的四氢呋喃(1mL)溶液中,加入氟化四丁基铵的四氢呋喃溶液(约1M,5mL),在室温下搅拌一整夜。由于反应还没有结束,因此再在40℃下搅拌3小时。将反应液减压浓缩后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-40%(0分-35分)]进行精制。再用Sep-Pak(注册商标)C18[0.1%三乙胺水溶液/乙腈,乙腈:0%-30%]进行精制,得到标题化合物(25mg)。
MS(ESI)m/z:786(M+H)
(工序11-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[4-氨基-5-(3-氨基丙基)-7H-吡咯并[2,3-d]嘧啶-7-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序10-2所得到的化合物(15mg),以与上述工序11-1同样的方法进行反应,得到标题化合物(7.2mg)。
MS(ESI)m/z:786(M+H)
(工序12-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[4-氨基-5-(3-氨基丙基)-7H-吡咯并[2,3-d]嘧啶-7-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序11-1所得到的化合物(25mg),以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(17mg)。
MS(ESI)m/z:786(M+H)
(工序12-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[4-氨基-5-(3-氨基丙基)-7H-吡咯并[2,3-d]嘧啶-7-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序11-2所得到的化合物(7.2mg),以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(6.0mg)。
MS(ESI)m/z:786(M+H)
实施例19:CDN19的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
3-溴-N-(丙-2-烯-1-基)-1H-吡唑并[3,4-d]嘧啶-4-胺
将市售(Bepharm)的3-溴-4-氯-1H-吡唑并[3,4-d]嘧啶(8.50g)悬浮于二恶烷(140mL)中,在室温下加入N,N,-二异丙基乙基胺(12.5mL)和烯丙基胺(11mL),在相同的温度下搅拌70小时。将反应液减压浓缩,将残留物用二氯甲烷和乙酸乙酯制成浆料状以后,过滤得到固体(固体1)。将滤液减压浓缩后,重复2次同样的操作,分别得到固体2和固体3。将最后的滤液用硅胶柱[己烷/乙酸乙酯]进行精制得到固体4。进而,将固体1用硅胶柱[己烷/乙酸乙酯]进行精制得到固体5。合并固体4和固体5,得到标题化合物(4.48g)。合并固体2和固体3得到包含杂质的标题化合物(3.78g)。
MS(ESI)m/z:254(M+H)
(工序2)
3-溴-N-(丙-2-烯-1-基)-1-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-1H-吡唑并[3,4-d]嘧啶-4-胺
将上述工序1所得到的化合物(1.00g)和市售(Ark Pharm)的1-O-乙酰基-2,3,5-三-O-苯甲酰基-β-D-呋喃核糖(2.58g)悬浮于硝基甲烷(50mL)后,加热使其溶解。在加热回流下,加入三氟化硼二乙基醚络合物(0.63mL),在相同的温度下搅拌1小时。追加1-O-乙酰基-2,3,5-三-O-苯甲酰基-β-D-呋喃核糖(0.40g)和三氟化硼二乙基醚络合物(0.10mL)再搅拌3小时。将反应液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.80g)。
MS(ESI)m/z:698(M+H)
(工序3)
3-乙烯基-N-(丙-2-烯-1-基)-1-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-1H-吡唑并[3,4-d]嘧啶-4-胺
在上述工序2所得到的化合物(11.65g)的甲苯(120mL)中,在减压下超声波处理溶液而脱气。在氮气氛下,在反应液中加入三丁基乙烯基锡(12.8mL)和四(三苯基膦)钯(0)(2.73g),加热回流2小时。将反应液减压浓缩后,将残留物用硅胶柱层析[二氯甲烷/乙酸乙酯]进行精制,得到标题化合物(10.07g)。
MS(ESI)m/z:646(M+H)
(工序4)
2-(2,3,5-三-O-苯甲酰基-β-D-呋喃核糖基)-6,7-二氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
将上述工序3所得到的化合物(9.0g)用苯共沸2次。在残留物的二氯甲烷溶液(480mL)中加入(+)-10-樟脑磺酸(4.2g)和亚苄基[1,3-双(2,4,6-三甲基苯基)咪唑烷-2-亚基]二氯化物(三环己基-λ
MS(ESI)m/z:618(M+H)
(工序5)
2-β-D-呋喃核糖基-6,7-二氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
在上述工序4所得到的化合物(620mg)的甲醇(10mL)-四氢呋喃(5.0mL)混合溶液中,在室温下加入甲醇钠的甲醇溶液(1.0M,0.10mL),在同样的温度下搅拌18小时。将反应液用1N盐酸中和后,进行减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(279mg)。
MS(ESI)m/z:306(M+H)
(工序6)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-6,7-二氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
使用上述工序5所得到的化合物(2.81g),以与实施例1的工序1同样的方法进行反应,得到标题化合物(4.72g)。
(工序7)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
在上述工序6所得到的化合物(2.12g)的四氢呋喃(20mL)溶液中加入乙酸(巴氏吸管3滴)、10%钯碳(AD)wet(0.82g),在氢气氛下、室温下搅拌3小时。将催化剂过滤除去后,用四氢呋喃进行清洗,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(2.09g)。
(工序8)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
使用上述工序7所得到的化合物(2.09g),以与实施例1工序4同样的方法进行反应,得到标题化合物(2.23g)。
(工序9)
6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
使用上述工序8所得到的化合物(2.23g),以与实施例1工序5同样的方法进行反应,得到标题化合物(2.69g)。
(工序10)
6-苯甲酰基-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁
使用上述工序9所得到的化合物(2.69g),以与实施例5的工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(2.93g)。
(工序11)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序10所得到的化合物(1.04g),以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-(二羟基膦基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁的乙腈溶液。使用该乙腈溶液和市售(Cool Pharm)的N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(1.20g),以与实施例1工序8、实施例1工序9、实施例1工序10同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物。用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-50%(0分-35分)]对磷原子上的非对映异构体进行分离,得到标题化合物的非对映异构体1(15mg)和非对映异构体2(55mg)(HPLC的保留时间:非对映异构体1>2)。
非对映异构体1(低极性)
MS(ESI)m/z:959(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:959(M+H)
(工序12-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序11所得到的化合物(非对映异构体1)(20mg)中加入三乙胺三氢氟酸盐(1mL),在45℃下搅拌2小时。在反应液中加入冰冷的1M碳酸氢三乙基铵水溶液(3mL)和三乙胺(1mL)的混合溶液使反应停止。用Sep-Pak(注册商标)C18[0.1%三乙胺水/乙腈,乙腈:0%-17%]进行精制,得到标题化合物(15mg)。
MS(ESI)m/z:731(M+H)
(工序12-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序11所得到的化合物(非对映异构体2)(43mg),以与上述工序12-1同样的方法进行反应,得到标题化合物(34mg)。
MS(ESI)m/z:731(M+H)
(工序13-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序12-1所得到的化合物(15mg),以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物的非对映异构体混合物(12mg)。
MS(ESI)m/z:731(M+H)
(工序13-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-1,2,3,5,6-五氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序12-2所得到的化合物(34mg),以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物的非对映异构体混合物(28mg:非对映异构体比=4:1)。
MS(ESI)m/z:731(M+H)
实施例20:CDN20的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-4-氯-5-碘基-7H-吡咯并[2,3-d]嘧啶
使用文献已知(J.Med.Chem.2008,51,3934-3945)的4-氯-5-碘基-7-β-D-呋喃核糖基-7H-吡咯并[2,3-d]嘧啶(3.15g),以与实施例1的工序1同样的方法进行反应,得到标题化合物(2.97g)。
(工序2)
4-(苄基氧基)-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-碘基-7H-吡咯并[2,3-d]嘧啶
在上述工序1所得到的化合物(4.97g)和苄基醇(1.0mL)的四氢呋喃(50mL)溶液中,在冰冷下加入氢化钠(含有37%的矿物油)(426mg),升温至室温搅拌一整夜。在冰冷下向反应液中加入饱和氯化铵水溶液使反应停止。将反应液用乙酸乙酯萃取后,用水、饱和食盐水清洗有机层,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(3.38g)。
(工序3)
4-(苄基氧基)-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(3-羟基丙-1-炔-1-基)-7H-吡咯并[2,3-d]嘧啶
使用上述工序2所得到的化合物(3.38g)和2-丙炔-1-醇(1.35mL),将反应温度设为室温,以与实施例1工序2同样的方法进行反应,得到标题化合物(2.22g)。
(工序4)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(3-羟基丙基)-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-酮
使用上述工序3所得到的化合物(3.38g),将反应溶剂设为甲醇(20mL)-四氢呋喃(20mL)的混合液,以与实施例19工序7同样的方法进行反应,得到标题化合物(0.92g)。
(工序5)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
在上述工序4所得到的化合物(0.92g)的四氢呋喃(32mL)溶液中在冰冷下加入三苯基膦(0.62g)和偶氮二羧酸二异丙酯(0.47mL),升温至室温搅拌1小时。将反应液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(0.77g)。
(工序6)
2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
使用上述工序5所得到的化合物(0.95g),以与实施例1工序5同样的方法进行反应,得到标题化合物(1.13g)。
(工序7)
2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
使用上述工序6所得到的化合物(1.13g),精制使用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺],除此以外,以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(1.00g)。
(工序8)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的化合物(1.00g),以与实施例1工序7同样的方法进行反应,得到2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-(二羟基膦基)-β-D-呋喃核糖基}-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁的乙腈溶液。使用该乙腈溶液与市售(Cool Pharm)的N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(1.28g),以与实施例1工序8、实施例1工序9同样的方法进行反应,分别得到标题化合物的含非对映异构体1的混合物和含非对映异构体2的混合物。
非对映异构体1(低极性)
MS(ESI)m/z:1116(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1116(M+H)
(工序9-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用总量的上述工序8所得到的化合物(含非对映异构体1的混合物),以与实施例1工序10同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物(73mg)。
[精制条件]HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-60%(0分-35分)]。
MS(ESI)m/z:959(M+H)
(工序9-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用总量的上述工序8所得到的化合物(含非对映异构体2的混合物),以与实施例1工序10同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物(58mg)。
[精制条件]HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-50%(0分-35分)]。
MS(ESI)m/z:959(M+H)
(工序10-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序9-1所得到的化合物(68mg),以与实施例19工序12-1同样的方法进行反应后,以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(42mg)。
MS(ESI)m/z:731(M+H)
(工序10-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序9-2所得到的化合物(58mg),以与实施例19工序12-1同样的方法进行反应后,以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(35mg)。
MS(ESI)m/z:731(M+H)
实施例21:药物连接子1的合成
[合成路径]
(工序1)
N-(铵基(azaniumyl)乙酰基)甘氨酰基-L-苯基丙氨酰基甘氨酸三氟乙酸盐
在市售(BACHEM)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸(3.00g)的二氯甲烷(30mL)溶液中,在室温下加入三氟乙酸(15mL),在同温度下搅拌3小时。将反应液减压浓缩后悬浮于甲苯中,再次进行减压浓缩。进一步重复2次该浓缩操作。将残留物用二乙基醚(100mL)制成浆料状后,过滤得到标题化合物(3.27g)的粗产物。
MS(ESI)m/z:337(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸
在上述工序1所得到的化合物(2.09g)的N,N-二甲基甲酰胺(46.4mL)溶液中加入三乙胺(0.804mL)和1-{[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]氧基}吡咯烷-2,5-二酮(1.87g),在室温下搅拌21小时。将反应液减压浓缩,将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制。在得到的化合物的二氯甲烷溶液中加入二乙基醚制成浆料状后,过滤得到标题化合物(2.10g)。
MS(ESI)m/z:624(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸酯
在上述工序2所得到的化合物(2.10g)的N,N-二甲基甲酰胺(33.7mL)溶液中加入N-羟基琥珀酰亚胺(426mg)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(710mg),在氮气氛下、室温下搅拌16小时。将反应液用二氯甲烷稀释后,用冰水洗涤3次,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。在油状的残留物中加入乙酸乙酯使固体析出。将溶剂在减压下蒸馏除去,在得到的固体中加入二乙基醚制成浆料状后,过滤得到标题化合物(2.18g)。
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子1)
在实施例5工序8-2所得到的化合物(10.0mg)的N,N-二甲基甲酰胺(1mL)溶液中加入三乙胺(8μL)和上述工序3所得到的化合物(17.6mg),在室温下搅拌2小时。在反应液中加入苄基胺(3μL),在室温下搅拌1小时。在反应液中加入10mM乙酸三乙基铵水溶液和甲醇,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-50%(0分-40分)]进行精制,得到标题化合物(10.9mg)。
MS(ESI)m/z:1379(M+H)
3.16-2.73(5H,m),2.40-2.23(2H,m),2.06-1.94(4H,m),1.29(18H,t,J=7.3Hz).
实施例22:药物连接子2的合成
[合成路径]
(工序1)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷
在肌苷(10.0g)的吡啶(50mL)和N,N-二甲基乙酰胺(50mL)溶液中在0℃下加入4,4’-二甲氧基三苯甲基氯(15.2g)后,在4℃下搅拌64小时。在反应液中加入甲醇(2mL),搅拌10分钟后,浓缩至50mL左右。在残留物中加入2-溴乙基苯甲酸酯(7.02mL)和2,3,4,6,7,8,9,10-八氢嘧啶并[1,2-a]氮杂
MS(ESI)m/z:719(M+H)
(工序2)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]肌苷
使用上述工序1所得到的化合物(3.01g),以与实施例5工序3同样的方法进行合成,得到标题化合物(1.20g)与标题化合物的位置异构体1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]肌苷(1.22g)。
MS(ESI)m/z:833(M+H)
(2’-O-TBS体)
MS(ESI)m/z:833(M+H)
(工序3)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}肌苷
使用上述工序2所得到的化合物(1.20g),以与实施例5工序4同样的方法进行合成,得到磷原子上的非对映异构体混合物(非对映异构体比=0.55:0.45)形式的标题化合物(1.41g)。
MS(ESI)m/z:1033(M+H)
(工序4)
按以下的规模实施与实施例1工序7相同的反应(原料:1.40g)。使用得到的化合物的乙腈溶液和上述工序3所得到的化合物(1.41g),以与实施例1工序8同样的方法进行反应。得到的粗产物直接使用于接下来的反应。
(工序5)
2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(778mg)。
MS(ESI)m/z:1264(M+H)
(工序6)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(778mg),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(255mg)和非对映异构体2(含有杂质)。将非对映异构体2用制备型HPLC[水/0.2%含有三乙胺的乙腈,0.2%含有三乙胺的乙腈:5%-50%(0分-40分)]再一次进行精制,得到标题化合物的非对映异构体2(94.6mg)。
非对映异构体1(低极性)
MS(ESI)m/z:1003(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1003(M+H)
(工序7-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
在上述工序6所得到的化合物(非对映异构体1)(30mg)的四氢呋喃(0.5mL)溶液中加入[(N-{[(9H-芴-9-基)甲氧基]羰基}甘氨酰基)氨基]甲基乙酸酯(91.7mg)和对甲苯磺酸1水合物(11.8mg),在室温下搅拌6小时。在反应液中加入N,N-二甲基甲酰胺(0.5mL)和1,8-二氮杂双环[5.4.0]-7-十一烯(56μL),在室温下搅拌3小时。在反应液中加入10mM乙酸三乙基铵水溶液,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到含有作为杂质的原料的标题化合物(25.6mg)。
MS(ESI)m/z:1089(M+H)
(工序7-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(84.6mg),以与上述工序7-1同样的方法进行反应,得到含有作为杂质的原料的标题化合物(70.9mg)。
MS(ESI)m/z:1089(M+H)
(工序8-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
非对映异构体1
在上述工序7-1所得到的化合物(25.6mg)中加入三乙胺三氢氟酸盐(2mL),在45℃下搅拌3小时。在室温下,在反应液中加入冰冷的1M碳酸氢三乙基铵溶液(10mL)和三乙胺(2mL)的混合液。将反应液减压浓缩后用C18硅胶柱层析(10mM乙酸三乙基铵水溶液/乙腈)进行精制,得到标题化合物(16.6mg:含有来自工序7-1的原料的杂质)。
MS(ESI)m/z:861(M+H)
(工序8-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7-2所得到的化合物(70.9mg),以与上述工序8-1同样的方法进行反应,得到标题化合物(51.7mg:含有来自工序7-2的原料的杂质)。
MS(ESI)m/z:861(M+H)
(工序9-1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子2a:非对映异构体1)
在上述工序8-1所得到的化合物(16.6mg)的N,N-二甲基甲酰胺(0.5mL)溶液中加入三乙胺(6μL)和后述的工序11所得到的化合物(15.5mg),在室温下搅拌3小时。在反应液中加入苄基胺(3μL),在室温下搅拌1小时。加入10mM乙酸三乙基铵水溶液和甲醇,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-45%(0分-30分)]进行精制,得到标题化合物(5.1mg)。
MS(ESI)m/z:1409(M+H)
(工序9-2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子2b:非对映异构体2)
使用上述工序8-2所得到的化合物(51.7mg),以与上述工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(33.7mg)
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-50%(0分-30分)]。
MS(ESI)m/z:1409(M+H)
(工序10)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酸
在市售(BACHEM)的(2S)-2-[[2-[(2-氨基乙酰基)氨基]乙酰基]氨基]-3-苯基丙酸(2.86g)的N,N-二甲基甲酰胺(51.2mL)溶液中加入三乙胺(2.56mL)和市售(Click Chemistry Tools)的1-{[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]氧基}吡咯烷-2,5-二酮(3.69g),在室温下搅拌24小时。在反应液中加入柠檬酸一水合物(24.0g)的水(500mL)溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物溶解于乙酸乙酯/乙腈混合溶液中后,用二异丙基醚使其析出,过滤得到标题化合物(4.30g)。
(工序11)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酸酯
在上述工序10所得到的化合物(2.10g)的N,N-二甲基甲酰胺(75.9mL)溶液中加入N-羟基琥珀酰亚胺(961mg)和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1.60g),在氮气氛下、室温下搅拌21小时。将反应液用二氯甲烷进行稀释,用冰水清洗3次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。在残留物中加入甲苯,再次进行减压浓缩。将残留物溶解于乙腈中,用C18硅胶柱层析[乙腈:100%]进行精制。将含有目标物的馏分减压浓缩后,在残留物中加入二异丙基醚制成浆料状。将得到的固体过滤得到标题化合物(2.59g)。
实施例23:药物连接子3的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子3)
在实施例8工序8-2所得到的化合物(4.8mg)的N,N-二甲基甲酰胺(0.29mL)溶液中加入三乙胺(1.9μL)和实施例21工序3所得到的化合物(5.2mg),在氮气氛下、室温下搅拌1.5小时。加入苄基胺(3.2μL)使反应停止后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-40%(0分-30分)]进行精制,得到标题化合物(8.0mg)。
MS(ESI)m/z:1393(M+H)
实施例24:药物连接子4的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[6-氨基-2-({2-[(甘氨酰基氨基)甲氧基]乙基}氨基)-9H-嘌呤-9-基]-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例9工序1-2所得到的化合物(17.6mg),以与实施例22工序7-1同样的方法进行反应,得到标题化合物(8.3mg)。
MS(ESI)m/z:1103(M+H)
(工序2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-({2-[(甘氨酰基氨基)甲氧基]乙基}氨基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的化合物(10.7mg),以与实施例22工序8-1同样的方法进行反应,得到标题化合物(7.6mg)。
MS(ESI)m/z:875(M+H)
(工序3)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-{[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子4)
使用上述工序2所得到的化合物(7.6mg),以与实施例22工序9-1同样的方法进行反应。按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物(7.6mg)。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-40%(0分-30分)].
MS(ESI)m/z:1423(M+H)
实施例25:糖链重构抗体1的合成
改造抗HER2抗体-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-改造抗HER2抗体的制备
在根据参考例1制备的改造抗HER2抗体的磷酸盐缓冲生理食盐水溶液(20mL,12.6mg/mL,pH6.0)中加入野生型EndoS的磷酸盐缓冲生理食盐水溶液(0.147mL,7.70mg/mL,pH6.0),在37℃下震荡2小时15分钟。用Experion电泳工作站(BIO-RAD制)确认反应的进度。反应结束后,依照以下的方法进行基于亲和层析的精制和基于羟基磷灰石柱层析的精制。
(1)基于亲和层析的精制
精制装置:AKTA avant 25(GE HEALTH CARE制)
柱:HiTrap rProtein A FF(5mL)(GE HEALTH CARE制)
流速:5mL/min(装填时为1.25mL/min)
将上述得到的反应液分两次进行精制。在与柱结合时,将反应液加入柱中,将结合缓冲液[20mM磷酸盐缓冲液(pH6.0)]以1.25mL/min,2CV流入,再以5mL/min,5CV流入。中间洗涤时,将洗涤溶液[20mM磷酸盐缓冲液(pH7.0),0.5M氯化钠溶液]以15CV流入。在洗脱时,将洗脱缓冲液(ImmunoPure IgG Elution buffer、PIERCE制)以6CV流入。将洗脱液立即用1MTris缓冲液(pH9.0)中和。根据共通操作C所述的方法将含有目标物的馏分进行与5mM磷酸盐缓冲液,50mM 2-吗啉乙磺酸(MES)溶液(pH6.8)的缓冲液交换。根据共通操作B所述的方法测定得到的缓冲溶液的抗体浓度,获得粗精制的标题抗体溶液(26.57mg/mL,9.0mL)。
(2)基于羟基磷灰石层析的精制
精制装置:AKTA avant 25(GE HEALTH CARE制)
柱:Bio-Scale Mini CHT Type I管(5mL)(BIO-RAD制)
流速:5mL/min(装填时为1.25mL/min)
将上述(1)中获得的溶液添加到柱中,使A液[5mM磷酸盐缓冲液,50mM MES溶液(pH6.8)]以1.25mL/min,2CV流入,再以5mL/min,3CV流入。然后,使用A液和B液[5mM磷酸盐缓冲液,50mM MES溶液(pH 6.8)、2M氯化钠溶液]进行洗脱。洗脱条件为A液:B液=100:0至0:100(5CV)。此外,使洗涤溶液[500mM磷酸盐缓冲液(pH 6.5)]以5CV流入。根据共通操作C中所述的方法,将含有目标物的馏分进行与20mM磷酸盐缓冲液(pH 6.0)的缓冲液交换。根据共通操作B中记载的方法测量获得的缓冲溶液的抗体浓度,获得标题抗体溶液(17.29mg/mL,约13mL)。
(工序2)
改造抗HER2抗体-[SG-(N
在上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(17.29mg/mL,13mL,pH6.0)中加入[N
实施例26:糖链重构抗体2的合成
改造抗LPS抗体-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-改造抗LPS抗体的制备
使用依照参考例2制备的改造抗LPS抗体的磷酸盐缓冲生理食盐水溶液(8.5mL,10.96mg/mL,pH6.0),进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(11.70mg/mL,7.5mL,pH6.0)。
(工序2)
改造抗LPS抗体-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(11.70mg/mL,7.5mL,pH6.0)和[N
实施例27:抗体药物偶联物1的合成(抗HER2抗体-CDN偶联物1的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.97mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子3的二甲基亚砜溶液(10mM,0.0907mL,相对于1分子抗体为24当量)与丙二醇(0.159mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS(10mM Acetate Buffer,5%Sorbitol,pH5.5)溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.97mg/mL
抗体产量:3.41mg(62%)
药物平均结合数:3.6
实施例28:抗体药物偶联物2的合成(抗HER2抗体-CDN偶联物2的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.97mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子4的二甲基亚砜溶液(10mM,0.0907mL,相对于1分子抗体为24当量)和丙二醇(0.159mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.08mg/mL
抗体产量:3.78mg(69%)
药物平均结合数:3.2
实施例29:抗体药物偶联物3的合成(抗HER2抗体-CDN偶联物3的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.97mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2a的二甲基亚砜溶液(10mM,0.0907mL,相对于1分子抗体为24当量)和丙二醇(0.159mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应47小时。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.91mg/mL
抗体产量:3.17mg(58%)
药物平均结合数:3.6
实施例30:抗体药物偶联物4的合成(抗LPS抗体-CDN偶联物1的合成)
将糖链重构抗体2的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.55mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子3的二甲基亚砜溶液(10mM,0.174mL,相对于1分子抗体为24当量)和丙二醇(0.326mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(6.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.11mg/mL
抗体产量:7.23mg(69%)
药物平均结合数:3.9
实施例31:CDN21的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
4-(苄基氧基)-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(4-羟基丁-1-炔-1-基)-7H-吡咯并[2,3-d]嘧啶
使用实施例20工序2所得到的化合物(3.37g)和3-丁炔-1-醇(1.72mL),将反应温度设定为室温,以与实施例1工序2同样的方法进行反应,得到标题化合物(2.74g)。
(工序2)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(4-羟基丁基)-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-酮
使用上述工序1所得到的化合物(2.74g),将反应溶剂设为甲醇(30mL)-四氢呋喃(30mL)混合溶剂,以与实施例19工序7同样的方法进行反应,得到标题化合物(2.21g)。
(工序3)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚
使用上述工序2所得到的化合物(1.89g),以与实施例20工序5同样的方法进行反应,得到标题化合物(1.40g)。
(工序4)
2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚
使用上述工序3所得到的化合物(1.61g),以与实施例1的工序5同样的方法进行反应,得到标题化合物(1.95g)。
(工序5)
2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚
使用上述工序4所得到的化合物(1.95g),进行与实施例5工序4同样的操作,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(2.20g)。
(工序6)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-双(巯基)-14-(7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(1.18g),以与实施例1工序7同样的方法进行反应,得到2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-[羟基(桥氧基)-λ
非对映异构体1(低极性)
MS(ESI)m/z:973(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:973(M+H)
(工序7-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序6所得到的化合物(非对映异构体1)(50mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基铵水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(33mg)。
MS(ESI)m/z:745(M+H)
(工序7-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(7,8,9,10-四氢-2H-6-氧代-2,3,5-三氮杂环辛烷[1,2,3-cd]茚-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(34mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基铵水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21mg)。
MS(ESI)m/z:745(M+H)
实施例32:CDN22的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-14-[(7S)-7-甲基-8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基]-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
4-(苄基氧基)-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-[(3R)-3-羟基丁-1-炔-1-基]-7H-吡咯并[2,3-d]嘧啶
使用实施例20工序2所得到的化合物(2.54g)和(R)-(+)-3-丁炔-2-醇(1.36mL),将反应温度设定为室温,以与实施例1工序2同样的方法进行反应,得到标题化合物(1.85g)。
(工序2)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-[(3R)-3-羟基丁基]-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-酮
使用上述工序1所得到的化合物(1.85g),将反应溶剂设为甲醇(15mL)-四氢呋喃(15mL)混合溶剂,以与实施例19工序7同样的方法进行反应,得到标题化合物(1.34g)。
(工序3)
(7S)-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-7-甲基-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
使用上述工序2所得到的化合物(1.34g),以与实施例20工序5同样的方法进行反应,得到标题化合物(0.70g)。
(工序4)
(7S)-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-7-甲基-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
使用上述工序3所得到的化合物(0.70g),以与实施例1的工序5同样的方法进行反应,得到标题化合物(0.82g)。
(工序5)
(7S)-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-7-甲基-2,7,8,9-四氢-6-氧代-2,3,5-三氮杂苯并[cd]薁
使用上述工序4所得到的化合物(0.82g),进行与实施例5的工序4同样操作,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(0.85g)。
(工序6)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-14-[(7S)-7-甲基-8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基]-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(0.85g),以与实施例1工序7同样的方法进行反应,得到(7S)-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-[羟基(桥氧基)-λ
非对映异构体1(低极性)
MS(ESI)m/z:973(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:973(M+H)
(工序7-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-14-[(7S)-7-甲基-8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基]-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序6所得到的化合物(非对映异构体1)(95mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基铵水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(57mg)。
MS(ESI)m/z:745(M+H)
(工序7-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-14-[(7S)-7-甲基-8,9-二氢-6-氧代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基]-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(44mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(30mg)。
MS(ESI)m/z:745(M+H)
实施例33:CDN23的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
4-(苄基氧基)-5-{3-[双(4-甲氧基苯基)(苯基)甲氧基]丙-1-炔-1-基}-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-7H-吡咯并[2,3-d]嘧啶
使用实施例20工序3所得到的化合物(4.17g),将反应溶剂设为二氯甲烷(40mL)-吡啶(40mL)混合溶剂,以与实施例11工序1同样的方法进行反应,得到标题化合物(5.70g)。
(工序2)
5-{3-[双(4-甲氧基苯基)(苯基)甲氧基]丙基}-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-酮
在上述工序1所得到的化合物(5.70g)的甲醇(100mL)-四氢呋喃(50mL)混合溶液中加入甲酸铵(3.71g)和10%钯碳(AD)wet(2g),在室温下搅拌3小时。将催化剂过滤后将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(4.56g)。
(工序3)
5-{3-[双(4-甲氧基苯基)(苯基)甲氧基]丙基}-7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-硫酮
在上述工序2所得到的化合物(1.01g)的二氯甲烷(10mL)溶液中加入吡啶(0.461mL),在冰冷下滴入三氟甲磺酸酐(0.385mL),搅拌30分钟。在相同的温度下在反应液中加入一硫化氢钠n水合物(2.54g)的N,N-二甲基甲酰胺(25mL)悬浮液,在室温下搅拌2小时。在反应液中加入饱和碳酸氢钠水溶液和乙酸乙酯,用硅藻土过滤后,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(0.51g)。
(工序4)
7-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-5-(3-羟基丙基)-3,7-二氢-4H-吡咯并[2,3-d]嘧啶-4-硫酮
在上述工序3所得到的化合物(2.79g)的二氯甲烷(80mL)溶液中加入蒸馏水(4mL),在冰冷下滴入二氯乙酸(1.28mL),搅拌30分钟。在相同的温度下在反应液中加入吡啶(2.50mL)后,进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(0.96g)。
(工序5)
2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-O-(二-叔丁基次甲硅烷基)-β-D-呋喃核糖基}-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
使用上述工序4所得到的化合物(0.35g),以与实施例20工序5同样的方法进行反应,得到标题化合物(0.25g)。
(工序6)
2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
使用上述工序5所得到的化合物(0.41g),以与实施例1工序5同样的方法进行反应,得到标题化合物(0.46g)。
(工序7)
2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-β-D-呋喃核糖基)-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
使用上述工序6所得到的化合物(0.46g),与实施例5工序4同样操作,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(0.48g)。
(工序8)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的化合物(0.48g),以与实施例1工序7同样的方法进行反应,得到2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-[羟基(桥氧基)-λ
非对映异构体1(低极性)
MS(ESI)m/z:1132(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1132(M+H)
(工序9-1)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的化合物(非对映异构体1)(40mg),以与实施例1工序10同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-60%(0分-35分)]进行精制,得到标题化合物(35mg)。
MS(ESI)m/z:975(M+H)
(工序9-2)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的化合物(非对映异构体2)(18mg),以与实施例1工序10同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-50%(0分-35分)]进行精制,得到标题化合物(15mg)。
MS(ESI)m/z:975(M+H)
(工序10-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序9-1所得到的化合物(35mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基铵水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(18mg)。
MS(ESI)m/z:747(M+H)
(工序10-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15,16-二羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序9-2所得到的化合物(15mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(8.1mg)。
MS(ESI)m/z:747(M+H)
实施例34:CDN24的合成
1-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
按照以下的规模实施实施例1工序7的反应(原料:1.01g)。使用得到的化合物的乙腈溶液和市售(ANGENE)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}尿苷(1.03g),以与实施例1的工序8、工序9、以及工序10同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物。将该混合物用HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-60%(0分-35分)]进行精制,得到标题化合物的非对映异构体1(50mg)和非对映异构体2(23mg)。
非对映异构体1(低极性)
MS(ESI)m/z:935(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:935(M+H)
(工序2-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(2,4-二桥氧基-3,4-二氢嘧啶-1(2H)-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序1所得到的化合物(非对映异构体1)(50mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(30mg)。
MS(ESI)m/z:707(M+H)
(工序2-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(2,4-二桥氧基-3,4-二氢嘧啶-1(2H)-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序1所得到的化合物(非对映异构体2)(23mg),以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈=5:1]进行精制,得到标题化合物的三乙胺盐。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(11mg)。
MS(ESI)m/z:707(M+H)
实施例35:CDN25的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-(6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-7-(6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在实施例13工序4所得到的化合物(313mg)的四氢呋喃(5.0mL)溶液中加入N-[(E)-(吡啶-2-基)次甲基]羟基胺(337mg)和N,N,N’,N’-四甲基胍(0.346mL),在室温下搅拌1天。在反应液中加入甲醇(5.0mL)和28%氨水(5.0mL),在50℃下搅拌5小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(106mg:含有杂质)和非对映异构体2(105mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:959(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:959(M+H)
(工序2-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-7-(6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序1所得到的化合物(非对映异构体1)(106mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):7%-50%(0分-40分)]
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(43.4mg)。
MS(ESI)m/z:731(M+H)
(工序2-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-7-(6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序1所得到的化合物(非对映异构体2)(105mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):7%-45%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21.5mg)。
MS(ESI)m/z:731(M+H)
实施例36:CDN26的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(3-羟基丙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-[3-(苯甲酰基氧基)丙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷
在3-溴丙烷-1-醇(1.14mL)的四氢呋喃(25mL)溶液中加入三乙胺(1.83mL)和苯甲酰氯(1.43mL),在室温下搅拌6小时。将反应溶液过滤,用四氢呋喃进行洗涤,将滤液减压浓缩。在残留物的脱水N,N-二甲基乙酰胺(25mL)溶液中加入市售(Aamdis Chemical)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷(5.0g)和1,8-二氮杂双环[5.4.0]-7-十一烯(2.75mL),在室温下搅拌3天。在反应液中加入水,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇]进行精制,得到标题化合物(4.41g)。
MS(ESI)m/z:733(M+H)
(工序2)
1-[3-(苯甲酰基氧基)丙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]肌苷
使用上述工序1所得到的化合物(4.41g),以与实施例5工序3同样的方法进行反应,得到标题化合物(1.60g)和标题化合物的位置异构体1-[3-(苯甲酰基氧基)丙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]肌苷(1.70g)。
MS(ESI)m/z:847(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:847(M+H)
(工序3)
1-[3-(苯甲酰基氧基)丙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}肌苷
使用上述工序2所得到的化合物(1.60g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=67:33)形式的标题化合物(1.91g)。
MS(ESI)m/z:1047(M+H)
(工序4)
按以下的规模实施与实施例1工序7相同的反应(原料:981mg)。使用得到的化合物的乙腈溶液和上述工序3所得到的化合物(1.03g),以与实施例1工序8同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序5)
3-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(774mg)。
MS(ESI)m/z:1278(M+H)
(工序6)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(3-羟基丙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(774mg),以与实施例1工序10同样的方法进行反应,用C18硅胶柱层析[0.2%三乙基胺水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(101mg:含有杂质)和非对映异构体2(90.8mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1017(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1017(M+H)
(工序7-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(3-羟基丙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序6所得到的化合物(非对映异构体1)(101mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(48.8mg)。
MS(ESI)m/z:789(M+H)
(工序7-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[1-(3-羟基丙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(90.8mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:3%-20%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(22.3mg)。
MS(ESI)m/z:789(M+H)
实施例37:CDN27的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[2-氨基-1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-N-[(二甲基氨基)次甲基]鸟苷
在文献已知(Journal of Organic Chemistry,1994,59,7243-7248)的N-[(二甲基氨基)次甲基]鸟苷(10.0g)的N,N-二甲基乙酰胺(50mL)-吡啶(50mL)混合溶液中,在0℃下加入4,4’-二甲氧基三苯甲基氯(10.5g),在4℃下搅拌16小时。在反应液中加入苯甲酸2-溴乙酯(6.54mL)和1,8-二氮杂双环[5.4.0]-7-十一烯(11.0mL),在室温下搅拌2天。在反应液中加入饱和碳酸氢钠水溶液和水,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇]进行精制,得到与三苯基膦氧化物的混合物(16.7g)形式的标题化合物。
MS(ESI)m/z:789(M+H)
(工序2)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-N-[(二甲基氨基)次甲基]鸟苷
使用上述工序1所得到的化合物(15.7g),以与实施例5工序3同样的方法进行反应,得到标题化合物(4.82g)和标题化合物的位置异构体1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-N-[(二甲基氨基)次甲基]鸟苷(6.01g)。
MS(ESI)m/z:903(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:903(M+H)
1H-NMR(CDCl3)δ:8.23(1H,s),7.97-7.91(2H,m),7.82(1H,s),7.56-7.50(1H,m),7.45-7.36(4H,m),7.35-7.26(6H,m),7.25-7.19(1H,m),6.85-6.79(4H,m),5.98(1H,d,J=5.4Hz),4.88-4.77(2H,m),4.73-4.62(3H,m),4.32-4.27(1H,m),4.23-4.19(1H,m),3.79(3H,s),3.79(3H,s),3.47(1H,dd,J=10.9,3.6Hz),3.37(1H,dd,J=10.9,3.6Hz),2.90(3H,s),2.76(1H,d,J=2.5Hz),2.75(3H,s),0.84(9H,s),0.02(3H,s),-0.15(3H,s).
(工序3)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-N-[(二甲基氨基)次甲基]鸟苷
使用上述工序2所得到的化合物(4.81g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=7:3)形式的标题化合物(5.41g)。
MS(ESI)m/z:1103(M+H)
(工序4)
按以下的规模实施与实施例1工序7相同的反应(原料:1.68g)。使用得到的化合物的乙腈溶液和上述工序3所得到的化合物(1.81g),以与实施例1工序8同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序5)
2-(9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(1.15g)。
MS(ESI)m/z:1334(M+H)
(工序6)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[2-氨基-1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(1.15g),以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(134mg:含有杂质)和非对映异构体2(127mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1018(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1018(M+H)
(工序7-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[2-氨基-1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序6所得到的化合物(非对映异构体1)(134mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(36.0mg)。
MS(ESI)m/z:790(M+H)
(工序7-2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[2-氨基-1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(127mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:3%-20%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(20.1mg)。
MS(ESI)m/z:790(M+H)
实施例38:CDN28的合成
N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[2-(2-羟基乙酰胺)乙基]氨基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例8工序8-2所得到的化合物(6.6mg),以与实施例7工序1-1同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(2.9mg)。
MS(ESI)m/z:846(M+H)
实施例39:CDN29的合成
N-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-羟基乙酰胺)甲基]-9H-嘌呤-9-基}-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例11工序9-2所得到的化合物(4.6mg),以与实施例7工序1-1同样的方法进行反应后,使用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(4.0mg)。
MS(ESI)m/z:817(M+H)
实施例40:CDN30的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-氯-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例8工序6所得到的化合物(非对映异构体1)(590mg),以与实施例1工序10同样的方法进行反应,得到标题化合物(420mg)。
MS(ESI)m/z:992(M+H)
(工序1-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-氯-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例8工序6所得到的化合物(非对映异构体2)(710mg),以与实施例1工序10同样的方法进行反应,得到标题化合物(452mg)。
MS(ESI)m/z:992(M+H)
(工序2-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在1-(氨基甲基)环丙烷-1-胺·2HCl(309mg)的甲醇(40mL)溶液中加入MP-Carbonate树脂(5.45g),在室温下搅拌2小时。过滤除去树脂,将滤液减压浓缩。将残留物的甲醇(0.837mL)溶液加入上述工序1-1所得到的化合物(30.0mg)中,使用微波反应装置,在120℃下反应4小时。将反应液减压浓缩后,将残留物用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-60%(0分-30分)]进行精制,得到含有标题化合物的混合物。将得到的混合物直接使用于接下来的工序。
MS(ESI)m/z:1042(M+H)
(工序2-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1-2所得到的化合物(58.6mg),以与上述工序2-1同样的方法得到含有标题化合物的混合物。将得到的混合物直接使用于接下来的反应中。
MS(ESI)m/z:1042(M+H)
(工序3-1)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序2-1所得到的混合物,以与实施例1工序11同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(2.0mg)。
MS(ESI)m/z:812(M-2Na+1H)
(工序3-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2-2所得到的混合物,以与实施例1工序11同样的方法得到含有标题化合物的混合物。将得到的混合物直接使用于接下来的反应中。
(工序4)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-[6-氨基-2-({[1-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)环丙基]甲基}氨基)-9H-嘌呤-9-基]-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序3-2所得到的混合物的N,N-二甲基甲酰胺(1.0mL)溶液中加入三乙胺(40.8μL)和2,5-二桥氧基吡咯烷-1-基(2-(三甲基甲硅烷基)乙基)碳酸酯(39.5mg),在室温下搅拌1小时。在反应液中加入水而骤冷后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-50%(0分-30分)]进行精制,得到标题化合物(11.0mg)。
MS(ESI)m/z:958(M+H)
(工序5)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[(1-氨基环丙基)甲基]氨基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
在上述工序4所得到的化合物(11.0mg)的四氢呋喃(474μL)溶液中加入氟化四丁基铵的四氢呋喃溶液(约1M,237μL),在氮气氛下、40℃下搅拌3小时。在反应液中加入10mM乙酸三乙基铵水溶液而骤冷后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)]以及Sep-Pak(注册商标)C18[水/乙腈/0.1%三乙胺]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(4.1mg)。
MS(ESI)m/z:812(M-2Na+1H)
实施例41:CDN31的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[2-(羟基甲基)-6-(甲基氨基)-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-[2-(羟基甲基)-6-(甲基氨基)-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
MS(ESI)m/z:1002(M+H)
(工序2)
二钠(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-7-[2-(羟基甲基)-6-(甲基氨基)-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的混合物,以与实施例1工序11同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-20%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(16.0mg)。
MS(ESI)m/z:774(M+H)
实施例42:CDN32的合成
(5R,7R,8R,12aR,14R,15aS,16R)-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
5-(3,3-二乙氧基丙-1-炔-1-基)-7H-吡咯并[2,3-d]嘧啶-4-胺
在市售(PharmaBlock)的5-碘基-7H-吡咯并[2,3-d]嘧啶-4-胺(22g)的N,N-二甲基甲酰胺(70mL)溶液中加入碘化铜(1.61g)、双(三苯基膦)钯二氯化物(5.94g)、以及三乙胺(35mL)。花2小时加入炔丙醛二乙基缩醛(22mL),在室温下搅拌一夜。在反应液中加入氯仿(350mL),用水洗涤2次。将有机层用硫酸镁干燥后,滤去干燥剂,将滤液减压浓缩。在残留物中加入乙酸乙酯(350mL),搅拌一整夜。将析出的固体过滤得到标题化合物(9.60g)。
MS(ESI)m/z:261(M+H)
(工序2)
5-(3,3-二乙氧基丙基)-7H-吡咯并[2,3-d]嘧啶-4-胺
在上述工序1所得到的化合物(17.9g)的四氢呋喃(160mL)-乙醇(80mL)混合溶液中加入10%钯碳(M)wet(25.0g),在氢气氛下、室温下搅拌一整夜。将催化剂用硅藻土过滤除去,将滤液减压浓缩,得到标题化合物(17.0g)的粗产物。
MS(ESI)m/z:265(M+H)
(工序3)
6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
将上述工序2所得到的化合物(50.21g)溶解于90%乙酸水溶液(344mL),在50℃下搅拌一整夜。确认到原料消失后,在反应液中加入钯碳(M)wet(60g),在氢气氛下、40℃下搅拌一整夜。将催化剂用硅藻土过滤除去,将滤液减压浓缩。在残留物中加入饱和碳酸氢钠水溶液(350mL),用氯仿/甲醇(9:1)萃取7次。将有机层减压浓缩后,将残留物用硅胶柱层析[氯仿/甲醇]进行精制,得到标题化合物(18.47g)。
MS(ESI)m/z:175(M+H)
(工序4)
苯基(2,7,8,9-四氢-6H-2,3,5,6-四氮杂苯并[cd]薁-6-基)甲酮
在上述工序3所得到的化合物(8.47g)的二氯甲烷(120mL)悬浮液中依次加入脱水吡啶(39.2mL)、N,N-二甲基氨基吡啶(2.38g)、以及苯甲酰氯(22.6mL),在室温下搅拌1小时。将反应液减压浓缩后,在残留物中加入氯仿(150mL)、甲醇(60mL)、以及三乙胺(50mL),在室温下搅拌3小时。将反应液注入氯仿与水的二层中,用氯仿进行萃取。将有机层用25w/v%硫酸氢钾水溶液洗涤2次,用无水硫酸镁进行干燥。滤去干燥剂,将滤液减压浓缩。在残留物中依次加入乙酸乙酯(50mL)和己烷(125mL)制成浆料状后,搅拌1小时。过滤析出的固体,得到标题化合物(9.89g)。
MS(ESI)m/z:279(M+H)
(工序5)
6-苯甲酰基-2-[2-脱氧基-3,5-双-O-(4-甲基苯甲酰基)-β-D-赤型-呋喃戊糖基]-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序4所得到的化合物(7.10g)的乙腈(80mL)悬浮液中,在氮气氛下加入粉末状的氢氧化钾(2.9g)和三[2-(2-甲氧基乙氧基)乙基]胺(0.41mL),在室温下搅拌15分钟。在冰冷下,加入文献已知(Synlett 2004(2):335-337)的2-脱氧基-3,5-双-O-(4-甲基苯甲酰基)-α-D-赤型-呋喃戊糖基氯化物(10.12g)和乙腈(60mL),升温至室温,搅拌一整夜。在反应液中加入饱和氯化铵水溶液使反应停止。过滤析出的固体,用水洗涤得到标题化合物(9.70g)。
MS(ESI)m/z:631(M+H)
(工序6)
6-苯甲酰基-2-(2-脱氧基-β-D-赤型-呋喃戊糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序5所得到的化合物(8.69g)的甲醇(45mL)-四氢呋喃(135mL)混合溶液中,在-10℃下花20分钟加入2N氢氧化钠水溶液(27.6mL)。在相同的温度下搅拌2小时后加入1N盐酸(58mL),使反应停止。将反应液减压浓缩后,将残留物用硅胶柱层析[氯仿/甲醇]进行精制,得到标题化合物(4.09g)。
MS(ESI)m/z:395(M+H)
(工序7)
6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-脱氧基-β-D-赤型-呋喃戊糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序6所得到的化合物(4.55g)以与实施例11工序1同样的方法进行反应,得到标题化合物(6.38g)。
MS(ESI)m/z:697(M+H)
(工序8)
6-苯甲酰基-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-脱氧基-β-D-赤型-呋喃戊糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序7所得到的化合物(6.37g)以与实施例1工序6同样的方法进行反应,得到非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(6.05g)。
(工序9)
使用上述工序8所得到的化合物(868mg),以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-3-O-[羟基(桥氧基)-λ
(工序10)
2-{9-[(5R,7R,8R,12aR,14R,15aS,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(702mg)。
MS(ESI)m/z:1134(M+H)
(工序11)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15aS,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序10所得到的化合物(702mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(119mg:含有杂质)和非对映异构体2(113mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:873(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:873(M+H)
(工序12-1)
二钠(5R,7R,8R,12aR,14R,15aS,16R)-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序11所得到的化合物(非对映异构体1)(119mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(51.8mg)。
MS(ESI)m/z:759(M+H)
(工序12-2)
二钠(5R,7R,8R,12aR,14R,15aS,16R)-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序11所得到的化合物(非对映异构体2)(113mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(65.4mg)。
MS(ESI)m/z:759(M+H)
实施例43:CDN33的合成
(5R,7R,8R,12aR,14R,15S,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-(2,7,8,9-四氢-6H-2,3,5,6-四氮杂苯并[cd]薁-6-基)乙烷-1-酮
将实施例42工序3所得到的化合物(6.88g)溶解于乙酸酐(48mL)中,在90℃下搅拌。将反应液减压浓缩,将残留物溶解于氯仿(100mL)-甲醇(50mL)-三乙胺(30mL)的混合液中。在室温下搅拌4小时后,将反应液注入氯仿与水的二层中,用氯仿进行萃取。将有机层用硫酸镁进行干燥后,滤去干燥剂,将滤液减压浓缩。在残留物中加入己烷/乙酸乙酯(1:2)制成浆料状后,过滤固体得到标题化合物(7.18g)。
MS(ESI)m/z:217(M+H)
(工序2)
6-乙酰基-2-(3,5-二-O-苯甲酰基-2-脱氧基-2-氟-β-D-阿拉伯呋喃糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序1所得到的化合物(6.00g)和市售(CARBOSYNTH)的[(2R,3R,4S,5R)-3-苯甲酰基氧基-5-溴-4-氟-四氢呋喃-2-基]甲基苯甲酸酯(14.1g),以与实施例42工序5同样的方法进行反应,得到标题化合物(11.45g)。
MS(ESI)m/z:559(M+H)
(工序3)
6-乙酰基-2-(2-脱氧基-2-氟-β-D-阿拉伯呋喃糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序2所得到的化合物(8.70g)的甲醇(58mL)-四氢呋喃(117mL)混合溶液中在-20℃下花12分钟滴入2N氢氧化钠水溶液(32mL)。在相同的温度下搅拌3小时后,加入1N盐酸(66mL)使反应停止。将反应液减压浓缩后,将残留物用硅胶柱层析[氯仿/甲醇]进行精制,得到标题化合物(3.27g)。
MS(ESI)m/z:351(M+H)
(工序4)
6-乙酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-脱氧基-2-氟-β-D-阿拉伯呋喃糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序3所得到的化合物(3.95g)以与实施例11工序1同样的方法进行反应,得到标题化合物(5.66g)。
MS(ESI)m/z:653(M+H)
(工序5)
6-乙酰基-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-脱氧基-2-氟-β-D-阿拉伯呋喃糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序4所得到的化合物(5.68g)以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(5.08g)。
MS(ESI)m/z:853(M+H)
(工序6)
使用上述工序5所得到的化合物(1.00g)以与实施例1工序7同样的方法进行反应,得到6-乙酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序7)
2-{9-[(5R,7R,8R,12aR,14R,15S,15aR,16R)-14-(6-乙酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(757mg)。
MS(ESI)m/z:1090(M+H)
(工序8)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15S,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的化合物(757mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(113mg:含有杂质)和非对映异构体2(108mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:891(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:891(M+H)
(工序9-1)
二钠(5R,7R,8R,12aR,14R,15S,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序8所得到的化合物(非对映异构体1)(113mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(28.8mg)。
MS(ESI)m/z:777(M+H)
(工序9-2)
二钠(5R,7R,8R,12aR,14R,15S,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序8所得到的化合物(非对映异构体2)(108mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-20%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(3.2mg)。
MS(ESI)m/z:777(M+H)
实施例44:CDN34的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在实施例1工序4所得到的化合物(35.80g)的二氯甲烷(322mL)-吡啶(35mL)混合溶液中,在冰冷下花5分钟加入氟化氢-吡啶(6.33g)的二氯甲烷(36mL)溶液,在相同的温度下搅拌3小时。在反应液中依次加入饱和碳酸氢钠水溶液(268mL)和饱和食盐水(143mL)使反应停止,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。在残留物中加入己烷/乙酸乙酯(1:1)(108mL)制成浆料状后,在50℃下搅拌30分钟,追加己烷(161mL)进一步搅拌2小时。将析出的固体过滤,用己烷/乙酸乙酯(4:1)(143mL)进行洗涤,得到标题化合物(26.81g)。
MS(ESI)m/z:525(M+H)
(工序2)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3,5-双-O-(四氢吡喃(Oxane)-2-基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序1所得到的化合物(19.93g)和3,4-二氢-2H-吡喃(35mL)的N,N-二甲基甲酰胺(200mL)溶液中,在冰冷下加入对甲苯磺酸一水合物(7.25g),在室温下搅拌3小时。在冰冷下,在反应液中加入饱和碳酸氢钠水溶液使反应停止,用乙酸乙酯萃取。将有机层依次用水和饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(24.73g)。
(工序3)
6-苯甲酰基-2-[3,5-双-O-(四氢吡喃-2-基)-β-D-呋喃核糖基]-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序2所得到的化合物(24.73g)和乙酸(3.1mL)的四氢呋喃(250mL)溶液中,在冰冷下加入氟化四丁基铵的四氢呋喃溶液(约1M,55mL),在室温下搅拌一整夜。将反应液减压浓缩,在残留物中加入乙酸乙酯,依次用水和饱和食盐水进行洗涤。将有机层用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(18.74g)。
(工序4)
6-苯甲酰基-2-[3,5-双-O-(四氢吡喃-2-基)-β-D-阿拉伯呋喃糖基]-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序3所得到的化合物(18.74g)和吡啶(13.1mL)的二氯甲烷(300mL)溶液中,在冰冷下滴入三氟甲磺酸酐(11mL),搅拌10分钟。在反应液中加入饱和食盐水使反应停止,用二氯甲烷进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物溶解于四氢呋喃(300mL)中,在冰冷下滴入亚硝酸四丁基铵(28.34g)的四氢呋喃(150mL)溶液,在室温下搅拌一整夜。将反应液减压浓缩,在残留物中加入乙酸乙酯,依次用水和饱和食盐水进行洗涤。将有机层用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(10.46g)。
(工序5)
6-苯甲酰基-2-[2-脱氧基-2-氟-3,5-双-O-(四氢吡喃-2-基)-β-D-呋喃核糖基]-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序4所得到的化合物(10.46g)和吡啶(7.3mL)的二氯甲烷(200mL)溶液中,在冰冷下滴入三氟甲磺酸酐(6.1mL),搅拌10分钟。在反应液中加入饱和食盐水使反应停止,用二氯甲烷进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物溶解于四氢呋喃(200mL)中,在冰冷下,加入氟化四丁基铵的四氢呋喃溶液(约1M,150mL),在相同的温度下搅拌3小时。在反应液中加入饱和氯化铵水溶液,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠进行干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(7.65g)。
(工序6)
6-苯甲酰基-2-(2-脱氧基-2-氟-β-D-呋喃核糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
在上述工序5所得到的化合物(7.65g)的乙醇(150mL)溶液中加入对甲苯磺酸吡啶盐(6.62g),在50℃下搅拌3小时。将反应液减压浓缩,在残留物中加入乙酸乙酯,依次用饱和碳酸氢钠水溶液和饱和食盐水进行洗涤。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(3.55g)。
(工序7)
6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-脱氧基-2-氟-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序6所得到的化合物(3.55g)以与实施例11工序1同样的方法进行反应,得到标题化合物(5.77g)。
(工序8)
6-苯甲酰基-2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-脱氧基-2-氟-β-D-呋喃核糖基)-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序7所得到的化合物(5.77g)以与实施例1的工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(5.95g)。
(工序9)
使用上述工序8所得到的化合物(1.02g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序10)
2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(818mg:含有杂质)。
MS(ESI)m/z:1152(M+H)
(工序11)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序10所得到的化合物(818mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(107mg:含有杂质)和非对映异构体2(101mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:891(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:891(M+H)
(工序12-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序11所得到的化合物(非对映异构体1)(107mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(29.1mg)。
MS(ESI)m/z:777(M+H)
(工序12-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序11所得到的化合物(非对映异构体2)(101mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-20%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(11.2mg)。
MS(ESI)m/z:777(M+H)
实施例45:CDN35的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15-氟-16-羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]肌苷
在市售(Aamdis Chemical)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷(13.0g)的N,N-二甲基乙酰胺(60mL)悬浮液中加入N-(2-溴乙基)邻苯二甲酰亚胺(7.02g)和1,8-二氮杂双环[5.4.0]-7-十一烯(4.1mL),在室温下搅拌一整夜。追加N-(2-溴乙基)邻苯二甲酰亚胺(1.75g)和1,8-二氮杂双环[5.4.0]-7-十一烯(1.1mL),再搅拌1天。在反应液中加入水使反应停止,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[乙酸乙酯/甲醇]进行精制,得到标题化合物(12.4g)。
(工序2)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]肌苷
使用上述工序1所得到的化合物(12.4g)以与实施例5工序3同样的方法进行反应,得到标题化合物(4.18g)和标题化合物的位置异构体5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]肌苷(6.31g)。
位置异构体(2’-O-TBS体)
(工序3)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]肌苷
使用上述工序2所得到的化合物(8.89g)以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(9.45g)。
(工序4)
使用实施例44工序8所得到的化合物(1.30g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序5)
3-{[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-7-{1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的粗产物,以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(828mg)。
MS(ESI)m/z:1177(M+H)
(工序6)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序5所得到的化合物(828mg)的乙醇(5.0mL)-四氢呋喃(5.0mL)混合溶液中加入肼一水合物(0.342mL),在50℃下搅拌6小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(90.9mg:含有杂质)和非对映异构体2(91.1mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:890(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:890(M+H)
(工序7-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15-氟-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序6所得到的化合物(非对映异构体1)(90.9mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-50%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(20.2mg)。
MS(ESI)m/z:776(M+H)
(工序7-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15-氟-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序6所得到的化合物(非对映异构体2)(91.1mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-45%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(26.3mg)。
MS(ESI)m/z:776(M+H)
实施例46:CDN36的合成
N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用实施例45工序7-1所得到的化合物(15.0mg),以与实施例7工序1-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-45%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(10.3mg)。
MS(ESI)m/z:834(M+H)
(工序1-2)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用实施例45工序7-2所得到的化合物(15.0mg),以与实施例7工序1-1同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-45%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(10.6mg)。
MS(ESI)m/z:834(M+H)
实施例47:CDN37的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15-氟-16-羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2-[(2-铵基乙基)氨基]腺苷二氯化物
在文献已知(WO2012/159072)的2-({2-[(叔丁氧基羰基)氨基]乙基}氨基)腺苷(28.7g)的甲醇(240mL)溶液中加入氯化氢的二恶烷溶液(约4M,240mL),在室温下搅拌一整夜。将反应液减压浓缩至50mL左右后,将析出的固体用二乙基醚进行悬浮,过滤得到标题化合物(28.8g)。
(工序2)
2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
在上述工序1所得到的化合物(28.8g)的四氢呋喃(330mL)-水(70mL)混合液中加入三乙胺(37mL)和1-({[2-(三甲基甲硅烷基)乙氧基]羰基}氧基)吡咯烷-2,5-二酮(18.4g),在室温下搅拌3小时。将反应液减压浓缩,用甲苯进行共沸。将残留物悬浮于甲苯中,过滤固体。将得到的固体溶解于二氯甲烷和甲醇中,进行减压浓缩。在残留物中加入四氢呋喃,将析出的固体进行过滤,将滤液减压浓缩。将残留物溶解于二氯甲烷和甲醇,进行减压浓缩。将析出的固体悬浮于二氯甲烷中,过滤得到标题化合物(22.5g)。
(工序3)
N-苯甲酰基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序2所得到的化合物(24.7g)以与实施例11工序3同样的方法进行反应,得到标题化合物(22.1g)。
(工序4)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序3所得到的化合物(22.1g)以与实施例11工序1同样的方法进行反应,得到标题化合物(29.5g)。
(工序5)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序4所得到的化合物(29.5g)以与实施例5工序3同样的方法进行反应,得到标题化合物(6.85g)。
(工序6)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序5所得到的化合物(6.22g)以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(6.18g)。
(工序7)
使用实施例44工序8所得到的化合物(1.03g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序8)
2-(三甲基甲硅烷基)乙基[2-({6-苯甲酰胺-9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的混合物以与实施例1工序9同样的方法进行反应,得到标题化合物的非对映异构体1(370mg:含有杂质)和非对映异构体2(201mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1307(M-H)
非对映异构体2(高极性)
MS(ESI)m/z:1307(M-H)
(工序9-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的化合物(非对映异构体1)(370mg:含有杂质)以与实施例1工序10同样的方法进行反应,得到标题化合物(134mg:含有杂质)。
MS(ESI)m/z:1048(M+H)
(工序9-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的化合物(非对映异构体2)(201mg:含有杂质),以与实施例1工序10同样的方法进行反应,得到标题化合物(49.1mg:含有杂质)。
MS(ESI)m/z:1048(M+H)
(工序10-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15-氟-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序9-1所得到的化合物(134mg)以与实施例40工序5同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(22mg)。
MS(ESI)m/z:790(M+H)
(工序10-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15-氟-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序9-2所得到的化合物(49.1mg:含有杂质)以与实施例40工序5同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21mg)。
MS(ESI)m/z:790(M+H)
实施例48:CDN38的合成
(5S,7R,8R,12aR,14R,15R,15aS)-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-3’-O-(1H-咪唑-1-硫代甲酰基)肌苷
在实施例22工序2所得到的化合物(2’-O-TBS体)(1.45g)的N,N-二甲基甲酰胺(8.7mL)溶液中,在室温下加入N,N-二甲基-4-氨基吡啶(213mg)和二(1H-咪唑-1-基)甲硫酮(1.55g),搅拌20小时。将反应液用乙酸乙酯稀释,依次用饱和碳酸氢钠水溶液和饱和食盐水进行洗涤。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.58g)。
MS(ESI)m/z:943(M+H)
(工序2)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-3’-脱氧基肌苷
在上述工序1所得到的化合物(1.69g)的苯(10mL)溶液中,在室温下加入氢化三丁基锡(1.42mL)和2,2’-偶氮双(异丁腈)(29.4mg),在80℃下搅拌4小时。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.12g)。
MS(ESI)m/z:817(M+H)
(工序3)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基肌苷
在上述工序2所得到的化合物(1.75g)的四氢呋喃(11mL)溶液中,在0℃加入氟化四丁基铵的四氢呋喃溶液(约1M,2.6mL),在室温下搅拌3小时。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.29g)。
MS(ESI)m/z:703(M+H)
(工序4)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-3’-脱氧基肌苷
使用上述工序3所得到的化合物(1.28g),以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(1.47g)。
MS(ESI)m/z:820(M-C
(工序5)
按以下的规模实施与实施例1工序7相同的反应(原料:836mg)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(735mg),以与实施例1工序8同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序6)
2-{9-[(5S,7R,8R,12aR,14R,15R,15aR)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物以与实施例1工序9同样的方法进行反应,得到标题化合物的非对映异构体1(67.6mg)和非对映异构体2(91.6mg)(HPLC的保留时间:非对映异构体1>2)。
非对映异构体1(低极性)
MS(ESI)m/z:1134(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1134(M+H)
(工序7-1)
(5S,7R,8R,12aR,14R,15R,15aR)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(非对映异构体1)(67.6mg),以与实施例1工序10同样的方法进行反应,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:0%-50%(0分-30分)]进行精制,得到标题化合物(34.9mg)。
MS(ESI)m/z:873(M+H)
(工序7-2)
(5S,7R,8R,12aR,14R,15R,15aR)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序6所得到的化合物(非对映异构体2)(91.6mg),以与实施例1工序10同样的方法进行反应,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:0%-50%(0分-30分)]进行精制,得到标题化合物(44.2mg)。MS(ESI)m/z:873(M+H)
(工序8-1)
二钠(5S,7R,8R,12aR,14R,15R,15aS)-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7-1所得到的化合物(34.9mg)以与实施例1工序11同样的方法进行反应后,用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21.9mg)。
MS(ESI)m/z:759(M+H)
(工序8-2)
二钠(5S,7R,8R,12aR,14R,15R,15aS)-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7-2所得到的化合物(44.2mg)以与实施例1工序11同样的方法进行反应后,使用Sep-Pak(注册商标)C18[0.1%三乙基胺水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(26.5mg)。
MS(ESI)m/z:759(M+H)
实施例49:CDN39的合成
(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
1-[2-(苯甲酰基氧基)乙基]-2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷
在市售(Amadis Chemical)的5’-O-[双(4-甲氧基苯基)(苯基)甲基]肌苷(20.0g)的吡啶(50mL)-N,N-二甲基乙酰胺(70.1mL)混合溶液中加入4,4’-二甲氧基三苯甲基氯(12.5g)、2-溴乙基苯甲酸酯(6.60mL)、以及1,8-二氮杂双环[5.4.0]-7-十一烯(13.1mL),在室温下搅拌20小时。在反应液中加入饱和碳酸氢钠水溶液和水,使反应停止后,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(24.1g:含有杂质)。
MS(ESI)m/z:1121(M+H)
(工序2)
1-[2-(苯甲酰基氧基)乙基]-2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-(三氟甲烷磺酰基)肌苷
在上述工序1所得到的化合物(24.1g)的二氯甲烷(120mL)溶液中加入吡啶(19.0mL)后,在0℃下缓慢滴入三氟甲磺酸酐(5.96mL),在相同的温度下搅拌1小时。在反应液中加入饱和碳酸氢钠水溶液和水使反应停止后,用二氯甲烷进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(19.7g:含有杂质)。
MS(ESI)m/z:1153(M+H)
(工序3)
9-{2,5-双-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃木糖基}-1-(2-羟基乙基)-1,9-二氢-6H-嘌呤-6-酮
在上述工序2所得到的化合物(19.7g)的N,N-二甲基甲酰胺(85.4mL)溶液中加入乙酸铯(8.20g),在室温下搅拌16小时。在反应液中加入甲醇(85.4mL)和碳酸钾(4.72g),在室温下搅拌2小时。在反应液中加入水使反应停止后,用乙酸乙酯萃取。将有机层用饱和食盐水洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(12.2g:含有杂质)。
MS(ESI)m/z:917(M+H)
(工序4)
1-[2-(苯甲酰基氧基)乙基]-9-{2,5-双-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃木糖基}-1,9-二氢-6H-嘌呤-6-酮
在上述工序3所得到的化合物(12.2g)的二氯甲烷(48.8mL)溶液中加入吡啶(1.61mL)和苯甲酸酐(3.16g),在室温下搅拌64小时。在反应液中加入饱和碳酸氢钠水溶液和水,使反应停止后用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(7.36g:含有杂质)。
MS(ESI)m/z:1021(M+H)
(工序5)
1-[2-(苯甲酰基氧基)乙基]-2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-3’-氟肌苷
在上述工序4所得到的化合物(7.36g)的二氯甲烷(37.0mL)溶液中加入2,6-二甲吡啶(3.34mL)后,在-78℃下加入三氟化N,N-二乙基氨基硫(1.42g),在氮气氛下缓慢升温至室温后,搅拌一整夜。在反应液中缓慢加入饱和碳酸氢钠水溶液使反应停止后加入水,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯0.1%三乙胺]进行精制,得到标题化合物(6.89g:含有杂质)。
MS(ESI)m/z:1023(M+H)
(工序6)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-3’-氟肌苷
在上述工序5所得到的化合物(6.89g)的二氯甲烷(25.0mL)溶液中加入水(0.303mL)和二氯乙酸(1.39mL),在室温下搅拌63小时。在反应液中加入吡啶(2.0mL)进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇]以及DIOL硅胶柱层析[己烷/乙酸乙酯]进行粗精制。在得到的化合物的吡啶(25.0mL)溶液中在0℃下加入4,4’-二甲氧基三苯甲基氯(1.83g),在4℃下搅拌21小时。在反应液中加入甲醇(1.0mL),在4℃下搅拌1小时后进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(1.33g)。
MS(ESI)m/z:721(M+H)
(工序7)
1-[2-(苯甲酰基氧基)乙基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-3’-脱氧基-3’-氟肌苷
使用上述工序6所得到的化合物(1.33g)以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(1.49g)。
MS(ESI)m/z:921(M+H)
(工序8)
按以下的规模实施与实施例1工序7相同的反应(原料:948mg)。使用得到的化合物的乙腈溶液和上述工序7所得到的化合物(850mg),以与实施例1工序8同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序9)
2-{9-[(5R,7R,8S,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-16-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(709mg)。
MS(ESI)m/z:1152(M+H)
(工序10)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(709mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(108mg:含有杂质)和非对映异构体2(102mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:891(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:891(M+H)
(工序11-1)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序10所得到的化合物(非对映异构体1)(108mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:3%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(40.1mg)。
MS(ESI)m/z:777(M+H)
(工序11-2)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序10所得到的化合物(非对映异构体2)(102mg:含有杂质),以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:3%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(26.7mg)。
MS(ESI)m/z:777(M+H)
实施例50:CDN40的合成
(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-16-氟-15-羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
3’-脱氧基-3’-氟肌苷
在市售(Angene)的3’-脱氧基-3’-氟腺苷(2.38g)的乙酸(120mL)溶液中一点一点地加入亚硝酸钠(6.10g)的水溶液(48mL),在室温下搅拌43小时。将反应溶液减压浓缩,用甲苯共沸2次。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(3.76g)。
MS(ESI)m/z:271(M+H)
1H-NMR(CD
(工序2)
3’-脱氧基-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-3’-氟肌苷
在上述工序1所得到的化合物(3.76g)的N,N-二甲基乙酰胺(37.6mL)溶液中加入2-(2-溴乙基)-1H-异吲哚-1,3(2H)-二酮(6.60mL)和1,8-二氮杂双环[5.4.0]-7-十一烯(3.12mL),在室温下搅拌3天。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇]进行精制,得到标题化合物(3.51g:含有杂质)。
MS(ESI)m/z:444(M+H)
(工序3)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-3’-氟肌苷
使用上述工序2所得到的化合物(3.51g)以与实施例11工序1同样的方法进行反应,得到标题化合物(4.05g)。
MS(ESI)m/z:746(M+H)
(工序4)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-3’-脱氧基-1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-3’-氟肌苷
使用上述工序3所得到的化合物(4.05g)以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(4.35g)。
MS(ESI)m/z:946(M+H)
(工序5)
按以下的规模实施与实施例1工序7相同的反应(原料:1.47g)。使用得到的化合物的乙腈溶液和上述工序4所得到的化合物(1.35g),以与实施例1工序8同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序6)
3-{[(5R,7R,8S,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-7-{1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-16-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(1.25g)。
MS(ESI)m/z:1177(M+H)
(工序7)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序6所得到的化合物(1.25g)的乙醇(7.5mL)-四氢呋喃(7.5mL)混合溶液中加入肼一水合物(0.599mL),在50℃下搅拌6小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(145mg:含有杂质)和非对映异构体2(198mg:含有杂质)(HPLC的保留时间:非对映异构体1>2)。
非对映异构体1(低极性)
MS(ESI)m/z:890(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:890(M+H)
(工序8-1)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序7所得到的化合物(非对映异构体1)(145mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):5%-50%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(70.7mg)。
MS(ESI)m/z:776(M+H)
(工序8-2)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序7所得到的化合物(非对映异构体2)(198mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):5%-50%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(69.7mg)。
MS(ESI)m/z:776(M+H)
实施例51:CDN41的合成
N-(2-{9-[(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-2,10-二桥氧基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用实施例50工序8-1所得到的化合物(25.0mg)以与实施例7工序1-1同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(18.6mg)。
MS(ESI)m/z:834(M+H)
(工序1-2)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-16-氟-15-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用实施例50工序8-2所得到的化合物(非对映异构体2)(15.0mg)以与实施例7工序1-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(7.4mg)。
MS(ESI)m/z:834(M+H)
实施例52:CDN42的合成
(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-16-氟-15-羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]-2-碘腺苷
将市售(Amadis Chemical)的2-碘腺苷(1.35g)用吡啶共沸3次。在残留物的脱水吡啶(17.0mL)溶液中加入4,4’-二甲氧基三苯甲基氯(2.35g),在氮气氛下、室温下搅拌一整夜。在反应液中加入甲醇(5.00mL)使反应停止后进行减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(1.96g:含有杂质)。
MS(ESI)m/z:998(M+H)
(工序2)
2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]-2-碘基-3’-O-(三氟甲烷磺酰基)腺苷
将上述工序1所得到的化合物(100mg)用甲苯共沸3次。在残留物的脱水二氯甲烷(1.0mL)溶液中在氮气氛下、0℃下加入吡啶(0.20mL)和三氟甲磺酸酐(27.0μL),在相同的温度下搅拌80分钟。追加三氟甲磺酸酐(27.0μL),进一步搅拌80分钟。在反应液中加入饱和碳酸氢钠水溶液使反应停止后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(57.2mg)。
MS(ESI)m/z:1130(M+H)
(工序3)
9-{2,5-双-O-[双(4-甲氧基苯基)(苯基)甲基]-β-D-呋喃木糖基}-2-碘基-9H-嘌呤-6-胺
在上述工序2所得到的化合物(2.76g)的N,N-二甲基甲酰胺(24.4mL)溶液中加入乙酸铯(1.20g),在室温下搅拌3小时。在反应液中加入甲醇(24.4mL)和碳酸钾(675mg),再搅拌2小时。在反应液中加入水而使固体析出后,在减压下使甲醇成分蒸馏除去。过滤得到的固体得到标题化合物(2.38g)。
(工序4)
2’,5’-双-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-3’-氟-2-碘腺苷
在上述工序3所得到的化合物(2.54g)的二氯甲烷(17.0mL)溶液中加入吡啶(1.13mL)后,在冰冷下加入三氟化N,N-二乙基氨基硫(0.397mL),在氮气氛下、室温下搅拌40分钟。在反应液中加入饱和碳酸氢钠水溶液使反应停止后,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/0.1%三乙胺]进行精制,得到标题化合物(2.02g:含有杂质)。
MS(ESI)m/z:1000(M+H)
(工序5)
3’-脱氧基-3’-氟-2-碘腺苷
在上述工序4所得到的混合物(2.02g)的二氯甲烷溶液(20.2mL)中在冰冷下加入水(0.364mL)和二氯乙酸(0.996mL),在室温下搅拌15分钟。在反应液中加入吡啶(1.95mL)使反应停止后,减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.34g:含有杂质)。
(工序6)
2-[(2-氨基乙基)氨基]-3’-脱氧基-3’-氟腺苷
在上述工序5所得到的化合物(1.34g)中加入乙二胺(1.35mL),在110℃下搅拌1小时。将反应液减压浓缩,将残留物用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物(543mg:含有杂质)。
(工序7)
3’-脱氧基-3’-氟-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
在上述工序6得到的化合物(543mg)的四氢呋喃溶液(10mL)中加入1-({[2-(三甲基甲硅烷基)乙氧基]羰基}氧基)吡咯烷-2,5-二酮(961mg)、N,N-二甲基甲酰胺(5.0mL)、以及甲醇(5.0mL),在室温下搅拌1.5小时。追加1-({[2-(三甲基甲硅烷基)乙氧基]羰基}氧基)吡咯烷-2,5-二酮(800mg),再搅拌40分钟。将反应液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(483mg)。
(工序8)
N-苯甲酰基-3’-脱氧基-3’-氟-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序7得到的化合物(483mg)以与实施例11工序3同样的方法进行反应,得到标题化合物(374mg)。
(工序9)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-3’-氟-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序8所得到的化合物(374mg)以与实施例11工序1同样的方法进行反应,得到标题化合物(398mg)。
MS(ESI)m/z:878(M+H)
(工序10)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-3’-脱氧基-3’-氟-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}腺苷
使用上述工序9所得到的化合物(398mg)以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(434mg)。
(工序11)
化合物A:
N,N-二乙基乙铵(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-苯甲酰胺-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-16-氟-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
化合物B:
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-苯甲酰胺-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
按以下的规模实施与实施例1工序7相同的反应(原料:502mg)。使用得到的化合物的乙腈溶液和上述工序10所得到的化合物(434mg),以与实施例1工序8以及实施例1工序9同样的方法进行反应,得到标题化合物A的非对映异构体1(43.9mg)以及非对映异构体2(27.0mg),以及标题化合物B的非对映异构体1(55.0mg)以及非对映异构体2(121mg)(分别含有杂质)。
化合物A的非对映异构体1(低极性)
MS(ESI)m/z:1309(M+H)
化合物A的非对映异构体2(高极性)
MS(ESI)m/z:1309(M+H)
化合物B的非对映异构体1(低极性)
MS(ESI)m/z:1256(M+H)
化合物B的非对映异构体2(高极性)
MS(ESI)m/z:1256(M+H)
(工序12-1)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序11所得到的化合物A(非对映异构体1)(43.9mg)以与实施例1工序10同样的方法进行反应,得到标题化合物。
MS(ESI)m/z:1048(M+H)
(工序12’-1)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序11所得到的化合物B(非对映异构体1)(55.0mg)以与实施例1工序10同样的方法进行反应,得到标题化合物。
MS(ESI)m/z:1048(M+H)
(工序12-2)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-16-氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序11所得到的化合物A(非对映异构体2)(27.0mg:含有杂质),以与实施例1工序10同样的方法进行反应,得到标题化合物。
MS(ESI)m/z:1048(M+H)
(工序13-1)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
合并上述工序12-1以及12’-1所得到的化合物,以与实施例1工序11同样的方法进行反应,得到标题化合物(36.4mg)。
MS(ESI)m/z:934(M+H)
(工序13-2)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序12-2所得到的化合物,以与实施例1工序11同样的方法进行反应,得到标题化合物(12.4mg)。
MS(ESI)m/z:934(M+H)
(工序14-1)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序13-1所得到的化合物(36.4mg)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-40分)]以及Sep-Pak(注册商标)C18[水/乙腈/0.1%三乙胺].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21.0mg)。
MS(ESI)m/z:790(M+H)
(工序14-2)
双(N,N,N-三丁基丁烷-1-铵)(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序13-2所得到的化合物(29.5mg)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(24.2mg:含有杂质)。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)]、Sep-Pak(注册商标)C18[水/乙腈/0.1%三乙胺]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-25%(0分-30分)].
(工序14-2’)
二钠(5R,7R,8S,12aR,14R,15R,15aS,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-16-氟-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
将上述工序14-2所得到的化合物(19.0mg:含有杂质)用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-25%(0分-30分)]进行精制。
将得到的化合物以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(8.4mg)。
MS(ESI)m/z:790(M+H)
实施例53:CDN43的合成
(5S,7R,8R,12aR,14R,15R,15aS,16R)-16-氨基-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15-羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
2’-O-乙酰基-3’-叠氮基-5’-O-苯甲酰基-3’-脱氧基-N-(2-甲基丙酰基)鸟苷
在文献已知(Recl.Trav.Chim.Pay-Bas 1986,105,85-91)的1,2-二-O-乙酰基-3-叠氮基-5-O-苯甲酰基-3-脱氧基-D-呋喃核糖(4.0g)的乙腈(60mL)溶液中,在室温下加入N2-异丁酰基鸟嘌呤(3.65g)和N,O-双(三甲基甲硅烷基)乙酰胺(8.08mL),在70℃下搅拌3小时。在70℃下加入三甲基甲硅烷基三氟甲磺酸酯(2.98mL),在相同的温度下搅拌1天。将反应液冷却后,加入饱和碳酸氢钠水溶液使反应停止,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(4.82g)。
(工序2)
3’-叠氮基-3’-脱氧基-N-(2-甲基丙酰基)鸟苷
在上述工序1所得到的化合物(5.48g)的四氢呋喃(64mL)-甲醇(32mL)混合溶液中在0℃加入5M氢氧化钠(17mL),搅拌15分钟。在反应液中加入乙酸(5.08mL)使反应停止,将反应液减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(3.8g)。
(工序3)
3’-叠氮基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-N-(2-甲基丙酰基)鸟苷
使用上述工序2所得到的化合物(3.8g)以与实施例11工序1同样的方法进行反应,得到标题化合物(5.78g)。
(工序4)
3’-氨基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-N-(2-甲基丙酰基)鸟苷
在上述工序3所得到的化合物(5.17g)的甲醇(60mL)溶液中加入三苯基膦(3.98g),在室温下搅拌4小时。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(2.22g)。
(工序5)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-脱氧基-N-(2-甲基丙酰基)-3’-(2,2,2-三氟乙酰胺)鸟苷
在上述工序4所得到的化合物(2.22g)的N,N-二甲基甲酰胺(20mL)溶液中加入三氟乙酸乙酯(4.0mL),在50℃下搅拌2天。将反应液冷却后,加入饱和碳酸氢钠水溶液使反应停止,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(2.06g)。
MS(ESI)m/z:751(M+H)
(工序6)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-3’-脱氧基-N-(2-甲基丙酰基)-3’-(2,2,2-三氟乙酰胺)鸟苷
使用上述工序5所得到的化合物(1.0g)以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(780mg)。
(工序7)
2-甲基丙烷-2-铵6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-[氧基(oxide)(桥氧基)-λ
在实施例1工序6所得到的化合物(5.0g)的乙腈(30mL)溶液中加入水(0.18mL)和三氟乙酸吡啶盐(1.2g),在室温下搅拌30分钟。在反应液中加入叔丁胺(30mL),在室温下搅拌30分钟。将反应液减压浓缩后,将残留物用乙腈共沸2次。在残留物的二氯甲烷(50mL)溶液中依次加入水(0.88mL)和二氯乙酸(3.2mL)的二氯甲烷(50mL)溶液,在室温下搅拌1小时。加入甲醇(5mL)和吡啶(6.3mL)使反应停止后,将反应液减压浓缩。将残留物用DIOL硅胶柱层析[己烷/乙酸乙酯→二氯甲烷/甲醇]进行精制,得到标题化合物(3.0g)。
MS(ESI)m/z:589(M+H)
(工序8)
二核苷酸A
在上述工序7所得到的化合物(543mg)的二氯甲烷(6.0mL)-乙腈(6.0mL)混合溶液中加入分子筛3A,1/16(500mg)和4,5-二氰基咪唑(126mg),在室温下搅拌15分钟。在反应液中加入上述工序6所得到的化合物(780mg),搅拌5小时后,加入N,N-二甲基-N’-(3-亚巯基-3H-1,2,4-二噻唑-5-基)甲脒(219mg),进一步搅拌2小时。从反应液中过滤除去分子筛3A,在滤液中加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制。在得到的化合物(740mg)的二氯甲烷(6.0mL)溶液中依次加入水(0.086mL)和二氯乙酸(0.158mL)的二氯甲烷(6.0mL)溶液,在室温下搅拌1.5小时。加入吡啶(0.31mL)使反应停止后,将反应液减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(520mg)。
MS(ESI)m/z:1168(M+H)
(工序9)
N-{9-[(5S,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基-16-(2,2,2-三氟乙酰胺)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序8所得到的化合物(270mg)以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(110mg)。
MS(ESI)m/z:1182(M+H)
(工序10)
双(N,N-二乙基乙铵)(5S,7R,8R,12aR,14R,15R,15aR,16R)-16-氨基-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15-{[叔丁基(二甲基)甲硅烷基]氧基}-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(110mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(34.2mg)和非对映异构体2(19.3mg)。
非对映异构体1(低极性)
MS(ESI)m/z:859(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:859(M+H)
(工序11-1)
二钠(5S,7R,8R,12aR,14R,15R,15aS,16R)-16-氨基-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序10所得到的化合物(非对映异构体1)(34.2mg)以与实施例1工序11同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(8.9mg)。
MS(ESI)m/z:745(M+H)
(工序11-2)
二钠(5S,7R,8R,12aR,14R,15R,15aS,16R)-16-氨基-7-(2-氨基-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-15-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序10所得到的化合物(非对映异构体2)(19.3mg)以与实施例1工序11同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(5.6mg)。
MS(ESI)m/z:745(M+H)
实施例54:CDN44的合成
(5R,7R,8S,12aR,14R,15R,15aR,16R)-15,16-二氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(636mg)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
2-{9-[(5R,7R,8S,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-10-(2-氰基乙氧基)-15,16-二氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(228mg:含有杂质)。
MS(ESI)m/z:1040(M+H)
(工序3)
二钠(5R,7R,8S,12aR,14R,15R,15aR,16R)-15,16-二氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
将上述工序2所得到的化合物(228mg)溶解于甲醇(5mL)和28%氨水溶液(5mL)中,在60℃下搅拌12小时。将反应液减压浓缩后,依次用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-30%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):7%-50%(0分-40分)]进行精制,分别得到三乙胺盐形式的标题化合物的非对映异构体1和非对映异构体2(HPLC的保留时间:非对映异构体1>2)。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物的非对映异构体1(12.5mg)和非对映异构体2(15.8mg)。
非对映异构体1(低极性)
MS(ESI)m/z:779(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:779(M+H)
实施例55:CDN45的合成
(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二氟-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(696mg)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
2-(三甲基甲硅烷基)乙基[2-({6-苯甲酰胺-9-[(5R,7R,8S,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-10-(2-氰基乙氧基)-15,16-二氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的混合物以与实施例1工序9同样的方法进行反应,得到含有标题化合物的混合物(1.31g)。将得到的混合物直接使用于接下来的反应中。
MS(ESI)m/z:1195(M-H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-15,16-二氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的混合物(1.31g)以与实施例1工序10同样的方法进行反应,分别得到标题化合物的非对映异构体1(249mg:含有杂质)和非对映异构体2(344mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:936(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:936(M+H)
(工序4-1)
二钠(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序3所得到的化合物(非对映异构体1)(249mg:含有杂质)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-40%(0分-30分)]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:0%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(9.2mg)。
MS(ESI)m/z:792(M+H)
(工序4-2)
二钠(5R,7R,8S,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-15,16-二氟-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序3所得到的化合物(非对映异构体2)(344mg:包含杂质)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-40%(0分-30分)]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(4.7mg)。
MS(ESI)m/z:792(M+H)
实施例56:CDN46的合成
(5R,7R,8R,12aR,14R,15S,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)十氢-2H,10H-5,8-甲桥-2λ
[合成路径]
(工序1)
(1R,2S,3R,5R)-3-(4-氯-5-碘基-7H-吡咯并[2,3-d]嘧啶-7-基)-5-(羟基甲基)环戊烷-1,2-二醇
在文献已知(WO2015/199136)的7-[(3aS,4R,6R,6aR)-6-({[叔丁基(二甲基)甲硅烷基]氧基}甲基)-2,2-二甲基四氢-2H,3aH-环戊[d][1,3]间二氧杂环戊烯-4-基]-4-氯-5-碘基-7H-吡咯并[2,3-d]嘧啶(6.0g)中依次加入三氟乙酸(36mL)和水(12mL),在室温下搅拌3小时。将反应液减压浓缩,得到标题化合物的粗产物。将得到的粗产物直接使用于接下来的反应。
(工序2)
(1R,2S,3R,5R)-3-(4-氨基-5-碘基-7H-吡咯并[2,3-d]嘧啶-7-基)-5-(羟基甲基)环戊烷-1,2-二醇
在上述工序1所得到的化合物(4.4g)的1,4-二恶烷(40mL)溶液中加入28%氨水(40mL),在90℃下搅拌72小时。将反应液减压浓缩后,将残留物用C18硅胶柱层析[水/甲醇]进行精制,得到标题化合物(3.4g)。
(工序3)
7-[(4aR,6R,7S,7aR)-2,2-二-叔丁基-7-{[叔丁基(二甲基)甲硅烷基]氧基}六氢-2H-环戊[d][1,3,2]二氧杂硅烷(dioxasilin)-6-基]-5-碘基-7H-吡咯并[2,3-d]嘧啶-4-胺
使用上述工序2所得到的化合物(3.3g)以与实施例1工序1同样的方法进行反应,得到标题化合物(4.6g)。
(工序4)
7-[(4aR,6R,7S,7aR)-2,2-二-叔丁基-7-{[叔丁基(二甲基)甲硅烷基]氧基}六氢-2H-环戊[d][1,3,2]二氧杂硅烷-6-基]-5-(3,3-二乙氧基丙-1-炔-1-基)-7H-吡咯并[2,3-d]嘧啶-4-胺
使用上述工序3所得到的化合物(4.6g)以与实施例1工序2同样的方法进行反应,得到标题化合物(3.6g)。
(工序5)
2-[(4aR,6R,7S,7aR)-2,2-二-叔丁基-7-{[叔丁基(二甲基)甲硅烷基]氧基}六氢-2H-环戊[d][1,3,2]二氧杂硅烷-6-基]-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序4所得到的化合物(3.60g)以与实施例1工序3同样的方法进行反应,得到标题化合物(2.44g)。
MS(ESI)m/z:589(M+H)
(工序6)
{2-[(4aR,6R,7S,7aR)-2,2-二-叔丁基-7-{[叔丁基(二甲基)甲硅烷基]氧基}六氢-2H-环戊[d][1,3,2]二氧杂硅烷-6-基]-2,7,8,9-四氢-6H-2,3,5,6-四氮杂苯并[cd]薁-6-基}(苯基)甲酮
使用上述工序5所得到的化合物(2.44g)以与实施例1工序4同样的方法进行反应,得到标题化合物(2.01g)。
MS(ESI)m/z:663(M+H)
(工序7)
{2-[(1R,2S,3R,4R)-4-{[双(4-甲氧基苯基)(苯基)甲氧基]甲基}-2-{[叔丁基(二甲基)甲硅烷基]氧基}-3-羟基环戊基]-2,7,8,9-四氢-6H-2,3,5,6-四氮杂苯并[cd]薁-6-基}(苯基)甲酮
使用上述工序6所得到的化合物(2.01g)以与实施例1工序5同样的方法进行反应,得到标题化合物(2.13g)。
(工序8)
(1R,2S,3R,5R)-3-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-5-{[双(4-甲氧基苯基)(苯基)甲氧基]甲基}-2-{[叔丁基(二甲基)甲硅烷基]氧基}环戊基4-桥氧基戊酸酯
在乙酰丙酸(2.96g)的四氢呋喃(20mL)溶液中加入N,N-二环己基碳二亚胺(2.63g),在室温下搅拌12小时。过滤除去析出物后将滤液减压浓缩。在残留物的二氯甲烷(20mL)溶液中加入上述工序7所得到的化合物(2.10g)和4-二甲基氨基吡啶(155mg),在室温下搅拌1小时。在反应液中加入饱和碳酸氢钠水溶液使反应停止后,用乙酸乙酯进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(2.35g)。
(工序9)
(1R,2S,3R,5R)-3-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-2-{[叔丁基(二甲基)甲硅烷基]氧基}-5-(羟基甲基)环戊基-4-桥氧基戊酸酯
在上述工序8所得到的化合物(2.35g)的二氯甲烷(25mL)溶液中依次加入水(0.24mL)和二氯乙酸(1.05mL)的二氯甲烷(25mL)溶液,在室温下搅拌1小时。在反应液中加入甲醇(1.0mL)和饱和碳酸氢钠水溶液使反应停止后,用乙酸乙酯进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.15g)。
MS(ESI)m/z:621(M+H)
(工序10)
N-苯甲酰基-2’-O-[({(1R,2R,3S,4R)-4-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-3-{[叔丁基(二甲基)甲硅烷基]氧基}-2-[(4-氧戊烷酰基)氧基]环戊基}甲氧基)(2-氰基乙氧基)硫代磷酰基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]腺苷
在上述工序9所得到的化合物(550mg)的乙腈(12mL)溶液中加入分子筛3A,1/16(500mg)和N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(1.23g),在室温下搅拌15分钟。在反应液中加入4,5-二氰基咪唑,搅拌1小时后加入3H-1,2-苯硫酚-3-酮1,1-二氧化物(355mg),再搅拌1个小时。从反应液中过滤除去分子筛3A,在滤液中加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(1.17g)。
MS(ESI)m/z:1539(M+H)
(工序11)
N-苯甲酰基-2’-O-[{[(1R,2R,3S,4R)-4-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-3-{[叔丁基(二甲基)甲硅烷基]氧基}-2-羟基环戊基]甲氧基}(2-氰基乙氧基)硫代磷酰基]-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]腺苷
在上述工序10所得到的化合物(1.22g)的乙腈(2.0mL)溶液中加入肼一水合物(0.25mL)的乙酸(5.0mL)-吡啶(7.5mL)混合溶液,在室温下搅拌30分钟。在反应液中加入水使反应停止后,用乙酸乙酯进行萃取,将有机层用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(770mg)。
MS(ESI)m/z:1442(M+H)
(工序12)
N-苯甲酰基-2’-O-[{[(1R,2R,3S,4R)-4-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-3-{[叔丁基(二甲基)甲硅烷基]氧基}-2-{[羟基(桥氧基)-λ
在上述工序11所得到的化合物(770mg)的吡啶(8.0mL)溶液中加入亚磷酸二苯酯(0.61mL),在室温下搅拌2小时。在反应液中加入水(20mL)、乙腈(8.0mL)、以及乙酸三乙基铵水溶液(2M,1.6mL),搅拌1小时后,将反应液进行减压浓缩。在残留物的二氯甲烷(5.0mL)溶液中依次加入水(0.096mL)和二氯乙酸(0.22mL)的二氯甲烷(5.0mL)溶液,搅拌30分钟。加入吡啶(0.43mL)使反应停止后,将反应液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(400mg)。
MS(ESI)m/z:1203(M+H)
(工序13)
N-{9-[(5R,7R,8R,12aR,14R,15S,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-2-桥氧基-2-巯基-10-亚巯基十氢-2H,10H-5,8-甲桥-2λ
使用上述工序12所得到的化合物(400mg)以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(300mg)。
MS(ESI)m/z:1217(M+H)
(工序14)
二钠(5R,7R,8R,12aR,14R,15S,15aR,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)十氢-2H,10H-5,8-甲桥-2λ
在上述工序13所得到的化合物(300mg)的甲醇(10mL)溶液中加入28%氨水(10mL),在室温下搅拌12小时。将反应液减压浓缩后,在残留物中加入三乙胺三氢氟酸盐(3.0mL),在45℃下搅拌2小时。在冰冷的1M碳酸氢三乙基铵溶液(18mL)-三乙胺(6.0mL)混合溶液中加入反应液使反应停止。将反应液减压浓缩后,对C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,分别得到三乙胺盐形式的标题化合物的非对映异构体1和非对映异构体2。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物的非对映异构体1(45.6mg)和非对映异构体2(12.6mg)。
非对映异构体1(低极性)
MS(ESI)m/z:728(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:728(M+H)
实施例57:CDN47的合成
(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2,10-双(巯基)-10-亚巯基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-O-[叔丁基(二甲基)甲硅烷基]-3-O-(4-氧戊烷酰基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用实施例1工序5所得到的化合物以与实施例56工序8同样的方法进行反应,得到标题化合物(2.8g)。
(工序2)
6-苯甲酰基-2-{2-O-[叔丁基(二甲基)甲硅烷基]-3-O-(4-氧戊烷酰基)-β-D-呋喃核糖基}-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁
使用上述工序1所得到的化合物(2.8g)以与实施例56工序9同样的方法进行反应,得到标题化合物(1.74g)。
(工序3)
N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-[(2-氰基乙氧基){[(2,4-二氯苯基)甲基]巯基}硫代磷酰基]腺苷
在市售(ChemGenes)的N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}腺苷(3.73g)的乙腈(30mL)溶液中加入分子筛3A,1/16(1.0g)和2,4-二氯苄基硫醇(1.8mL),在室温下搅拌10分钟。在反应液中加入咪唑过氯酸盐(3.18g)搅拌2.5小时后,加入硫(242mg),再搅拌1小时。从反应液中除去分子筛3A,在滤液中加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(2.73g)。
MS(ESI)m/z:1111(M+H)
(工序4)
N,N-二乙基乙铵N-苯甲酰基-5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-[{[(2,4-二氯苯基)甲基]巯基}(硫醚)磷酰基]腺苷
在上述工序3所得到的化合物(2.66g)的乙腈(30mL)溶液中加入三乙胺(30mL),在室温下搅拌4小时。将反应液减压浓缩,将残留物用DIOL硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(2.5g)。
MS(ESI)m/z:1058(M+H)
(工序5)
二核苷酸B
在上述工序4所得到的化合物(2.5g)的二氯甲烷(10mL)溶液中依次加入分子筛4A,1/16(1.0g)、上述工序2所得到的化合物(930mg)、以及1-甲基咪唑(1.18mL),在室温下搅拌20分钟。在反应液中加入2,4,6-三异丙基苯磺酰氯(905mg),再搅拌4小时。从反应液中滤去分子筛4A,在滤液中加入饱和碳酸氢钠水溶液,用乙酸乙酯萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到磷原子上的非对映异构体混合物形式的标题化合物(1.04g)。
MS(ESI)m/z:1662(M+H)
(工序6)
二核苷酸C
使用上述工序5所得到的化合物(1.04g)以与实施例56工序11同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(820mg)。
MS(ESI)m/z:1564(M+H)
(工序7)
二核苷酸D
使用上述工序6所得到的化合物(820mg)以与实施例56工序12同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(440mg)。
(工序8)
N-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-10-{[(2,4-二氯苯基)甲基]巯基}-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的化合物(440mg)以与实施例1工序9同样的方法进行反应,得到标题化合物(360mg)。
MS(ESI)m/z:1340(M+H)
(工序9)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-苯甲酰胺-9H-嘌呤-9-基)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序8所得到的化合物(360mg)的二甲基亚砜溶液中加入1-十二烷硫醇(434mg)和1,8-二氮杂双环[5.4.0]-7-十一烯(0.40mL),在室温下搅拌6小时。将反应液直接用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物(130mg)。
MS(ESI)m/z:1182(M+H)
(工序10)
二钠(2S,5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-氨基-9H-嘌呤-9-基)-15,16-二羟基-2-桥氧基-10-亚巯基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(130mg)以与实施例56工序14同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到三乙胺盐形式的标题化合物。
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(62.8mg)。
MS(ESI)m/z:746(M+H)
实施例58:CDN48的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
4-氯-5-碘基-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶
在市售(PharmaBlock)的4-氯-5-碘基-7H-吡咯并[2,3-d]嘧啶(73.8g)的N,N-二甲基甲酰胺(10mL)溶液中,在冰冷却下加入氢化钠(含有45%的矿物油)(13.3g),边升温至室温边搅拌40分钟。再次冰冷却,花10分钟加入[2-(氯甲氧基)乙基](三甲基)硅烷(51.0mL)后,在相同的温度下搅拌30分钟。在大部分固化的反应液中一点点加入水(260mL)使反应停止。过滤固体,用水(1500mL)和己烷(600mL)洗涤后,在减压下、40℃进行干燥,得到标题化合物(97.63g)。
MS(ESI)m/z:410(M+H)
(工序2)
4-(苄基氧基)-5-碘基-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶
在苄基醇(27mL)的N,N-二甲基甲酰胺(170mL)溶液中,在冰冷却下加入氢化钠(含有45%矿物油)(12g),边升温至室温边搅拌40分钟。再次冰冷却,花40分钟加入上述工序1所得到的化合物(97.63g)的N,N-二甲基甲酰胺(360mL)悬浮液,在相同的温度下搅拌35分钟。在反应液中加入碎冰和饱和氯化铵水溶液,使反应停止。将反应液注入饱和氯化铵水溶液和乙酸乙酯这二层中,用乙酸乙酯:甲苯(9:1)进行萃取。将有机层用水和饱和食盐水分别洗涤2次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(107.7g)。
MS(ESI)m/z:482(M+H)
(工序3)
4-(苄基氧基)-5-(3,3-二乙氧基丙-1-炔-1-基)-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶
在上述工序2所得到的化合物(113.4g)的乙腈(1000mL)-三乙胺(98mL)混合溶液中,在氮气氛下、室温下加入碘化铜(4.49g)、四三苯基膦钯(0)(8.17g)、以及3,3-二乙氧基丙-1-炔(104mL),在相同的温度下搅拌4.5小时。将反应液减压浓缩后,在残留物中加入乙酸乙酯和己烷,将析出的固体过滤除去。将固体用乙酸乙酯:己烷(1:1)的混合液洗涤后,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(145.5g:含有杂质)。
MS(ESI)m/z:482(M+H)
(工序4)
5-(3,3-二乙氧基丙基)-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶-4-醇
在上述工序3所得到的化合物(145.5g)的乙醇(900mL)溶液中加入10%钯碳催化剂(M)wet(50.2g),在氢气氛下、室温下搅拌5小时。在反应液中加入二氯甲烷(500mL),用硅藻土过滤除去催化剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]精制2次,得到标题化合物(59.6g)。
MS(ESI)m/z:418(M+Na)
(工序5)
5-(3,3-二乙氧基丙基)-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶-4-硫醇
在上述工序4所得到的化合物(59.6g)的脱水二氯甲烷(300mL)溶液中,在氮气氛下加入2,6-二甲吡啶(42mL)。在-20℃下花20分钟滴入三氟甲磺酸酐(31mL),在相同的温度下搅拌20分钟。在冰冷却下加入N,N-二甲基甲酰胺(500mL)和一硫化氢钠n水合物(33.5g),升温至室温后搅拌2.5小时。将反应液减压浓缩,蒸馏除去低沸点成分。将残留物注入乙酸乙酯和冰冷的饱和氯化铵水溶液的两层中,用乙酸乙酯:甲苯(9:1)的混合液进行萃取。将有机层用饱和氯化铵水溶液洗涤1次,用饱和食盐水洗涤2次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物和2,6-二甲吡啶的混合物。将得到的混合物注入乙酸乙酯和1N盐酸的二层中,用乙酸乙酯萃取2次。将有机层用饱和食盐水洗涤3次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩,得到标题化合物(57.6g)。
MS(ESI)m/z:410[M-H]
(工序6)
3-(4-巯基-7-{[2-(三甲基甲硅烷基)乙氧基]甲基}-7H-吡咯并[2,3-d]嘧啶-5-基)丙烷-1-醇
将上述工序5所得到的化合物(31.62g)溶解于80%乙酸水溶液(300mL),在室温下搅拌30分钟。确认原料消失后,进行冰冷却,小心一点点地加入硼氢化钠(1.45g),在相同的温度下搅拌30分钟。接着,花15分钟加入三乙酰氧基硼氢化钠(24.4g),在相同的温度下搅拌1.5小时。将反应液减压浓缩至五分之一左右的量。在残留物中小心地加入碳酸氢钠(固体)中和到某种程度后,用乙酸乙酯萃取。将有机层依次用饱和碳酸氢钠和饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(17.93g)。
MS(ESI)m/z:340[M+H]
(工序7)
2-{[2-(三甲基甲硅烷基)乙氧基]甲基}-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序6所得到的化合物(31.31g)的脱水四氢呋喃(600mL)溶液中在氮气氛下、0℃加入三苯基膦(25.4g)和偶氮二甲酸二异丙酯(21.8g),在相同的温度下搅拌1小时。将反应液减压浓缩后,依次将残留物用硅胶柱层析[二氯甲烷/乙酸乙酯]以及硅胶柱层析[己烷/乙酸乙酯]进行精制,得到标题化合物(35.93g:含有杂质)。
MS(ESI)m/z:322[M+H]
(工序8)
(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)甲醇
在上述工序7所得到的化合物(35.93g)的二氯甲烷(150mL)溶液中在室温下加入三氟乙酸(150mL),在相同的温度下搅拌1.5小时。将反应液减压浓缩后,用甲苯共沸4次,在残留物中加入二氯甲烷:己烷(1:2)的混合液,过滤除去析出的固体(固体1)。将滤液减压浓缩后,将残留物用硅胶柱层析[己烷/乙酸乙酯→乙酸乙酯/甲醇]进行精制,得到固体2。合并固体1和固体2,得到标题化合物(20.13g)。
MS(ESI)m/z:222[M+H]
(工序9)
2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序8所得到的化合物(20.13g)的甲醇(250mL)悬浮液中加入28%氨水溶液(150mL),在室温下搅拌1.5小时。在减压下将反应液浓缩至半份左右的量。将析出的固体过滤再用乙醇洗涤,得到固体1。将滤液进行减压浓缩,基于同样的操作得到固体2。将滤液涂布硅胶后,用硅胶柱层析[二氯甲烷/甲醇]进行精制。将含有目标物的馏分进行减压浓缩,用乙醇浆化洗涤后,过滤固体(固体3)。合并固体1、固体2、以及固体3,得到标题化合物(12.36g)。
MS(ESI)m/z:192[M+H]
(工序10)
2-(2,3,5-三-O-苄基-β-D-阿拉伯呋喃糖基)-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序9所得到的化合物(13.47g)的脱水乙腈(350mL)悬浮液中,在氮气氛下加入粉末状的氢氧化钾(10.3g)和三[2-(2-甲氧基乙氧基)乙基]胺(1.13mL),在室温下搅拌1.5小时。在冰冷却下一点点地加入文献已知(J.Med.Chem.1976,19,6,814-816)的2,3,5-三-O-苄基-α-D-阿拉伯呋喃糖基氯化物(40.2g)的乙腈(100mL)溶液后,升温至室温,搅拌4小时。过滤除去不溶解物,用乙腈洗涤。将滤液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯]精制2次,得到标题化合物(26.19g)。
MS(ESI)m/z:594[M+H]
(工序11)
2-β-D-阿拉伯呋喃糖基-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序10所得到的化合物(26.19g)的脱水二氯甲烷(300mL)溶液中,在氮气氛下、-78℃加入三氯化硼的二氯甲烷溶液(1M,200mL),在相同的温度下搅拌2小时后,升温至0℃,再搅拌4小时。将反应液再冷却至-78℃,加入甲醇(80mL)的二氯甲烷(160mL)溶液,边升温至室温边搅拌30分钟。将反应液减压浓缩,用乙醇共沸2次。在残留物中加入乙醇(200mL)和二乙基醚(100mL)制成浆料状,过滤固体(固体1)。将滤液减压浓缩,将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制。将含有目标物的馏分减压浓缩后,加入乙醇制成浆料状,过滤得到固体(固体2)。合并固体1和固体2得到标题化合物(13.2g)。
MS(ESI)m/z:324[M+H]
(工序12)
2-[3,5-双-O-(四氢吡喃-2-基)-β-D-阿拉伯呋喃糖基]-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序11所得到的化合物(15.35g)的脱水二甲基亚砜(160mL)溶液中,在0℃下加入3,4-二氢-2H-吡喃(17.2mL)和对甲苯磺酸一水合物(9.02g),在室温下搅拌3小时。追加3,4-二氢-2H-吡喃(8.6mL),搅拌45分钟后,立即加入三乙胺(13mL)使反应停止。将反应液注入乙酸乙酯和饱和碳酸氢钠水溶液的二层中,用乙酸乙酯萃取。将有机层用水洗涤一次,用饱和食盐水洗涤2次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制,得到4种非对映异构体混合物形式的标题化合物(10.81g)。
MS(ESI)m/z:492[M+H]
(工序13)
2-[2-脱氧基-2-氟-3,5-双-O-(四氢吡喃-2-基)-β-D-呋喃核糖基]-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序12所得到的化合物(10.81g)的脱水二氯甲烷(150mL)溶液中在氮气氛下、0℃下加入吡啶(5.3mL)和三氟甲磺酸酐(5.6mL),在相同的温度下搅拌1小时。在反应液中加入碎冰使反应停止后,将反应液注入乙酸乙酯和饱和碳酸氢钠水溶液的二层中,用乙酸乙酯萃取。将有机层用饱和食盐水洗涤2次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液进行减压浓缩,得到无定形的三氟甲磺酸酯的粗产物。将得到的三氟甲磺酸酯的粗产物溶解于脱水四氢呋喃(150mL)中,在冰冷却下,一点一点地加入氟化四丁基铵的四氢呋喃溶液(约1M,154mL),在相同的温度下搅拌一整夜。在反应液中加入饱和氯化铵水溶液使反应停止。将反应液减压浓缩至一半左右的量。将残留物注入乙酸乙酯和饱和氯化铵水溶液的二层中,用乙酸乙酯萃取。将有机层用饱和氯化铵水溶液洗涤一次,再用饱和食盐水洗涤2次。将水层用乙酸乙酯再一次萃取,将萃取液用饱和食盐水进行洗涤。合并有机层,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩,得到标题化合物(40.37g)的粗产物。
MS(ESI)m/z:494[M+H]
(工序14)
2-(2-脱氧基-2-氟-β-D-呋喃核糖基)-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
在上述工序13所得到的化合物(40.37g)的甲醇(400mL)溶液中加入对甲苯磺酸一水合物(2.09g),在60℃下搅拌4小时。在反应液中加入三乙胺(16mL)使反应停止。将反应液减压浓缩,将残留物用硅胶柱层析[己烷/乙酸乙酯→乙酸乙酯/甲醇]进行精制。将含有目标物的馏分减压浓缩至浆料状,过滤得到固体。将得到的固体用己烷/乙酸乙酯(1:1)进行洗涤,得到固体1。将滤液进行减压浓缩,将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到固体2。合并固体1和固体2得到标题化合物(5.32g)。
MS(ESI)m/z:326[M+H]
(工序15)
2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-脱氧基-2-氟-β-D-呋喃核糖基}-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
使用上述工序14所得到的化合物(5.32g)以与实施例11工序1同样的方法进行反应,得到标题化合物(10.1g)。
MS(ESI)m/z:628[M+H]
(工序16)
2-(5-O-[双(4-甲氧基苯基)(苯基)甲基]-3-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-2-脱氧基-2-氟-β-D-呋喃核糖基)-2,7,8,9-四氢-6-硫代-2,3,5-三氮杂苯并[cd]薁
使用上述工序15所得到的化合物(10.1g)以与实施例1工序6同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=1:1)形式的标题化合物(12.6g)。
(工序17)
使用上述工序16所得到的化合物(740mg)以与实施例1工序7同样的方法进行反应,得到2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序18)
2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序17所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(502mg:含有杂质)。MS(ESI)m/z:1065(M+H)
(工序19)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序18所得到的化合物(502mg),使用与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(67.8mg:含有杂质)和非对映异构体2(69.5mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:908(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:908(M+H)
(工序20-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序19所得到的化合物(非对映异构体1)(67.8mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:25%-75%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(21.2mg)。
MS(ESI)m/z:794(M+H)
(工序20-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序19所得到的化合物(非对映异构体2)(69.5mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:25%-75%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(14.9mg)。
MS(ESI)m/z:794(M+H)
实施例59:CDN49的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例58工序16所得到的化合物(1.80g)以与实施例1工序7同样的方法进行反应,得到2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
3-{[(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-7-{1-[2-(1,3-二桥氧基-1,3-二氢-2H-异吲哚-2-基)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(1.22g)。
MS(ESI)m/z:1090(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-16-{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的化合物(1.22g)以与实施例45工序6同样的方法进行反应后,通过C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(108mg:含有杂质)和非对映异构体2(111mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:907(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:907(M+H)
(工序4-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序3所得到的化合物(非对映异构体1)(108mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-50%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(44.4mg)。
MS(ESI)m/z:793(M+H)
(工序4-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-[1-(2-氨基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序3所得到的化合物(非对映异构体2)(111mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:20%-60%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(40.6mg)。
MS(ESI)m/z:793(M+H)
实施例60:CDN50的合成
N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用实施例59工序4-1所得到的化合物(20.0mg)以与实施例7工序1-1同样的方法进行反应后,按以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-30%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(15.6mg)。
MS(ESI)m/z:851(M+H)
(工序1-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-7-{1-[2-(2-羟基乙酰胺)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用实施例59工序4-2所得到的化合物(10.0mg)以与实施例7工序1-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:7%-25%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(6.6mg)。
MS(ESI)m/z:851(M+H)
实施例61:CDN51的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-双(巯基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例58工序16所得到的化合物(1.80g)以与实施例1工序7同样的方法进行反应,得到2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
2-(三甲基甲硅烷基)乙基[2-({6-苯甲酰胺-9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例1工序9同样的方法进行反应,得到标题化合物(1.83g:含有杂质)。
MS(ESI)m/z:1222(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-(6-氨基-2-{[2-({[2-(三甲基甲硅烷基)乙氧基]羰基}氨基)乙基]氨基}-9H-嘌呤-9-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的混合物(1.83g)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(151mg:含有杂质)和非对映异构体2(103mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1065(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1065(M+H)
(工序4-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序3所得到的化合物(非对映异构体1)(151mg:含有杂质)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(10.6mg)。
MS(ESI)m/z:807(M+H)
(工序4-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{6-氨基-2-[(2-氨基乙基)氨基]-9H-嘌呤-9-基}-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序3所得到的化合物(非对映异构体2)(103mg:含有杂质)以与实施例40工序5同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-30%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(12.1mg)。
MS(ESI)m/z:807(M+H)
实施例62:CDN52的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-2,16-二羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-10-巯基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(1.00g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-羟基-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
将上述工序1所得到的粗产物的吡啶(32.5mL)溶液浓缩到25mL左右后,加入2-氯-5,5-二甲基-1,3,2λ
MS(ESI)m/z:1136(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的化合物(671mg)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(55.6mg:含有杂质)和非对映异构体2(65.7mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:875(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:875(M+H)
(工序4-1)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序3所得到的化合物(非对映异构体1)(55.6mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:5%-25%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(11.3mg)。
MS(ESI)m/z:761(M+H)
(工序4-2)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序3所得到的化合物(非对映异构体2)(65.7mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:3%-20%(0分-30分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(23.5mg)。
MS(ESI)m/z:761(M+H)
实施例63:CDN53的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-10,16-二羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2-巯基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(1.02g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
N,N-二乙基乙铵(5R,7R,8R,12aR,14R,15R,15aR,16R)-7-{1-[2-(苯甲酰基氧基)乙基]-6-桥氧基-1,6-二氢-9H-嘌呤-9-基}-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
将上述工序1所得到的粗产物以与实施例1工序9同样的方法进行反应,得到标题化合物(122mg:含有杂质)。
MS(ESI)m/z:1136(M+H)
(工序3)
(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-10-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2-巯基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的化合物(122mg,含有杂质)以与实施例1工序10同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
MS(ESI)m/z:875(M+H)
(工序4)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的粗产物以与实施例1工序11同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:2%-30%(0分-30分)]进行精制,得到三乙胺盐形式的标题化合物。将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(30mg)。
MS(ESI)m/z:761(M+H)
实施例64:CDN54的合成
(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-2,10,16-三羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(1.00g)和实施例22工序3所得到的化合物(1.13g)以与实施例63工序1同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序2)
2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例62工序2同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(602mg:含有杂质)。
MS(ESI)m/z:1120(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的化合物(602mg)以与实施例1工序10同样的方法进行反应,得到标题化合物(90.8mg:含有杂质)。
MS(ESI)m/z:859(M+H)
(工序4)
二钠(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-7-[1-(2-羟基乙基)-6-桥氧基-1,6-二氢-9H-嘌呤-9-基]-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(90.8mg:含有杂质)以与实施例1工序11同样的方法进行反应后,按照以下的[精制条件]进行精制,得到三乙胺盐形式的标题化合物。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:1%-20%(0分-40分)].
将得到的三乙胺盐以与实施例1工序11所述的[转换为钠盐]同样的方法进行盐转换,得到标题化合物(40.4mg)。
MS(ESI)m/z:745(M+H)
实施例65:药物连接子5的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15,16-双{[叔丁基(二甲基)甲硅烷基]氧基}-7-(6-{[(甘氨酰基氨基)甲氧基]甲基}-9H-嘌呤-9-基)-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用实施例17的工序7所得到的化合物(非对映异构体2)(80.6mg)以与实施例22工序7-1同样的方法进行反应,得到标题化合物(66.1mg:含有杂质)。
MS(ESI)m/z:1059(M+H)
(工序2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aS,16R)-7-(6-{[(甘氨酰基氨基)甲氧基]甲基}-9H-嘌呤-9-基)-15,16-二羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的化合物(66.1mg)以与实施例22工序8-1同样的方法进行反应,得到标题化合物(40.4mg:含有杂质)。
MS(ESI)m/z:831(M+H)
(工序3)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[({9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子5)
使用上述工序2所得到的化合物(40.4mg)以与实施例22工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]以及制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-45%(0分-30分)]进行精制,得到标题化合物(5.0mg)。
MS(ESI)m/z:1379(M+H)
实施例66:药物连接子6的合成
[合成路径]
(工序1)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-({2-[(2,5-二桥氧基吡咯烷-1-基)氧基]-2-桥氧基乙氧基}甲基)甘氨酰胺
在文献已知(WO2014/057687)的{[(N-{[(9H-芴-9-基)甲氧基]羰基}甘氨酰基)氨基]甲氧基}乙酸(955mg)的N,N-二甲基甲酰胺(8.0mL)溶液中加入1,8-二氮杂双环[5.4.0]-7-十一烯(0.74mL),在室温下搅拌1小时(反应液A)。在实施例22工序10所得到的化合物(938mg)的N,N-二甲基甲酰胺(8.0mL)溶液中加入N-羟基琥珀酰亚胺(229mg)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(380mg),在室温下搅拌50分钟(反应液B)。将反应液A加入反应液B中,在室温下搅拌1小时。在反应液中加入二氯甲烷(50mL)和10%柠檬酸水溶液(10mL),用二氯甲烷萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[氯仿/(氯仿/甲醇/水=7:3:1的下层)]进行精制。在得到的化合物的N,N-二甲基甲酰胺(8.0mL)溶液中加入N-羟基琥珀酰亚胺(229mg)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(380mg),在室温下搅拌30分钟。在反应液中加入二氯甲烷(100mL)和水(25mL),用二氯甲烷萃取。将有机层用饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[氯仿/甲醇]进行精制。将包含目标物的馏分进行减压浓缩,在残留物中加入二乙基醚制成浆料状。将得到的固体过滤得到标题化合物(412mg)。
(工序2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-({2-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子6)
使用实施例5工序8-2所得到的化合物(20.0mg)和上述工序1所得到的化合物(23.7mg),以与实施例21工序4同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:30%-80%(0分-40分)]进行精制,得到标题化合物(14.1mg)。
MS(ESI)m/z:1466(M+H)
实施例67:药物连接子7的合成
[合成路径]
(工序1)
[(N-{[(9H-芴-9-基)甲氧基]羰基}-L-异亮氨酰基)氨基]甲基乙酸酯
在市售(IRIS)的N-{[(9H-芴-9-基)甲氧基]羰基}-L-异亮氨酰基甘氨酸(2.50g)的四氢呋喃(45mL)-甲苯(15mL)混合液中在室温下加入吡啶(0.588mL)和四乙酸铅(3.24g),在65℃下搅拌3小时。将反应液用乙酸乙酯进行稀释,依次用水和饱和食盐水进行洗涤。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(2.06g)。
MS(ESI)m/z:447(M+Na)
(工序2)
{[(N-{[(9H-芴-9-基)甲氧基]羰基}-L-异亮氨酰基)氨基]甲氧基}乙酸苄基酯
在上述工序1所得到的化合物(2.06g)的四氢呋喃(48mL)悬浮液中,在0℃加入乙醇酸苄酯(1.38mL)和对甲苯磺酸一水合物(92.3mg),在室温下搅拌4小时。将反应液用乙酸乙酯进行稀释,用饱和碳酸氢钠水洗涤后,将水层用乙酸乙酯萃取。合并有机层,用饱和食盐水进行洗涤,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(1.72g)。
MS(ESI)m/z:553(M+Na)
(工序3)
N-[(苄基氧基)羰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-{[2-(苄基氧基)-2-桥氧基乙氧基]甲基}-L-异亮氨酰胺
在上述工序2所得到的化合物(1.72g)的乙腈(40mL)悬浮液中在室温下加入1,8-二氮杂双环[5.4.0]-7-十一烯(0.290mL),搅拌1小时(反应液A)。在市售的N-[(苄基氧基)羰基]甘氨酰基甘氨酰基-L-脯氨酸(1.41g)的乙腈(20mL)悬浮液中在室温下加入3H-[1,2,3]三唑并[4,5-b]吡啶-3-醇(529mg)、1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(746mg)、以及N,N-二异丙基乙基胺(0.678mL),搅拌1小时。将该反应液在室温下加入上述反应液A中,搅拌6小时后,减压浓缩。将残留物用硅胶柱层析[氯仿/甲醇]进行精制,得到标题化合物(1.56g)。
MS(ESI)m/z:676(M+Na)
(工序4)
甘氨酰基甘氨酰基-L-脯氨酰基-N-[(羧基甲氧基)甲基]-L-异亮氨酰胺
在上述工序3所得到的化合物(1.56g)的甲醇(8mL)-四氢呋喃(24mL)-二氯甲烷(8mL)混合液中加入10%钯碳(M)wet(1.4g),在氢气氛下、在室温下搅拌23小时。在反应液中加入甲醇/四氢呋喃(1:1)混合液(50mL),用硅藻土进行过滤。将硅藻土用甲醇/四氢呋喃(1:1)混合液进行洗涤。将滤液减压浓缩后,在残留物中加入甲醇(20mL)、四氢呋喃(20mL)、以及10%钯碳(M)wet(1.0g),在氢气氛下、室温下搅拌3小时。将反应液用硅藻土过滤后,将硅藻土用甲醇/四氢呋喃(1:1)进行洗涤。将滤液减压浓缩,得到标题化合物的粗产物(1.02g)。
MS(ESI)m/z:430(M+H)
(工序5)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-[(羧基甲氧基)甲基]-L-异亮氨酰胺
在上述工序4所得到的化合物(1.02g)的N,N-二甲基甲酰胺(24mL)溶液中加入1-{[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]氧基}吡咯烷-2,5-二酮(956mg)和N,N-二异丙基乙基胺(0.496mL),在室温下搅拌1小时。将反应液减压浓缩,将残留物用硅胶柱层析[氯仿/甲醇]进行精制。将含有目标物的馏分减压浓缩后,在残留物中加入乙酸乙酯使其固化。将得到的固体过滤得到标题化合物(1.06g)。
MS(ESI)m/z:739(M+Na)
(工序6)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-({2-[(2,5-二桥氧基吡咯烷-1-基)氧基]-2-桥氧基乙氧基}甲基)-L-异亮氨酰胺
在上述工序5所得到的化合物(1.06g)的N,N-二甲基甲酰胺(16mL)悬浮液中加入N-羟基琥珀酰亚胺(187mg)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(312mg),在室温下搅拌16小时。将反应液用氯仿进行稀释,用水洗涤3次。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。在残留物中加入乙酸乙酯,过滤得到的固体。在过滤得到的固体中加入二乙基醚,制成浆料状后,过滤固体得到标题化合物(767mg)。
MS(ESI)m/z:836(M+Na)
(工序7)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-({2-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子7)
使用实施例5工序8-2所得到的化合物(20.0mg)和上述工序6所得到的化合物(20.9mg),以与实施例21工序4同样的方法进行反应后,通过C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:30%-80%(0分-40分)]进行精制,得到标题化合物(11.9mg)。
MS(ESI)m/z:1472(M+H)
实施例68:药物连接子8的合成
[合成路径]
(工序1)
N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-缬氨酰基-L-丙氨酸
在市售(ChemFun)的N-(叔丁氧基羰基)甘氨酰基甘氨酸(5.00g)和N-羟基琥珀酰亚胺(2.97g)的N,N-二甲基甲酰胺(50mL)溶液中,在氮气氛下、0℃下加入1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(4.95g),升温至室温搅拌1小时。在反应液中加入三乙胺(3.6mL)和市售(国产化学)的L-缬氨酰基-L-丙氨酸(4.05g),在同温度下搅拌6小时。将反应液减压浓缩,将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制。将包含目标物的馏分进行减压浓缩,加入二乙基醚制成浆料状。过滤得到的固体,得到标题化合物(4.99g)。
MS(ESI)m/z:401(M-H)
(工序2)
N-(铵基乙酰基)甘氨酰基-L-缬氨酰基-L-丙氨酸三氟乙酸酯
使用上述工序1所得到的化合物(1.00g)以与实施例21工序1同样的方法进行反应,得到标题化合物(1.10g)的粗产物。
MS(ESI)m/z:301(M-H)
(工序3)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-L-丙氨酸
使用上述工序2所得到的化合物(861mg)以与实施例21工序2同样的方法进行反应,得到标题化合物(737mg)。
MS(ESI)m/z:590(M+H)
(工序4)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-L-丙氨酸酯
使用上述工序3所得到的化合物(260mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(84mg)。
MS(ESI)m/z:687(M+H)
(工序5)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子8)
使用实施例8工序8-2所得到的化合物(5.3mg)和上述工序4所得到的化合物(4.5mg),以与实施例23工序1同样的方法进行反应后,通过制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-35%(0分-30分)]进行精制,得到标题化合物(5.1mg)。
MS(ESI)m/z:1359(M+H)
实施例69:药物连接子9的合成
[合成路径]
(工序1)
N-(铵基乙酰基)甘氨酰基-L-脯氨酰基-L-异亮氨酸三氟乙酸酯
使用市售(Hangzhou Peptide Biochem)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-脯氨酰基-L-异亮氨酸(1.00g),以与实施例21工序1同样的方法进行反应,得到标题化合物(1.02g)的粗产物。
MS(ESI)m/z:343(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-L-异亮氨酸
使用上述工序1所得到的化合物(1.02g)以与实施例21工序2同样的方法进行反应,得到标题化合物(993mg)。
MS(ESI)m/z:630(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-L-异亮氨酸酯
使用上述工序2所得到的化合物(300mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(287mg)。
MS(ESI)m/z:727(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子9)
使用实施例8工序8-2所得到的化合物(51.8mg)和上述工序3所得到的化合物(36.9mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-35%(0分-30分)]进行精制,得到标题化合物(62.5mg)。
MS(ESI)m/z:1397(M-H)
实施例70:药物连接子10的合成
[合成路径]
(工序1)
N-(铵基乙酰基)甘氨酰基-L-苯基丙氨酰基-L-蛋氨酸三氟乙酸酯
使用市售(Hangzhou Peptide Biochem)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-苯基丙氨酰基-L-蛋氨酸(1.00g)以与实施例21工序1同样的方法进行反应,得到标题化合物(1.19g)的粗产物。
MS(ESI)m/z:411(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-L-蛋氨酸
使用上述工序1所得到的化合物(1.03g)以与实施例21工序2同样的方法进行反应,得到标题化合物(652mg)。
MS(ESI)m/z:698(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-L-蛋氨酸酯
使用上述工序2所得到的化合物(201mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(95mg)。
MS(ESI)m/z:795(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子10)
使用实施例8工序8-2所得到的化合物(6.0mg)和上述工序3所得到的化合物(5.5mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-40%(0分-30分)]进行精制,得到标题化合物(2.0mg)。
MS(ESI)m/z:1467(M+H)
实施例71:药物连接子11的合成
[合成路径]
(工序1)
N-(铵基乙酰基)甘氨酰基-L-缬氨酰基-N
使用市售(Hangzhou Peptide Biochem)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-缬氨酰基-N
MS(ESI)m/z:389(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-N
使用上述工序1所得到的化合物(1.02g)以与实施例21工序2同样的方法进行反应,得到标题化合物(795mg)
MS(ESI)m/z:676(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-N
使用上述工序2所得到的化合物(300mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(177mg)。
MS(ESI)m/z:773(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-缬氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子11)
使用实施例8工序8-2所得到的化合物(5.0mg)和上述工序3所得到的化合物(3.8mg)以与实施例23工序1同样的方法进行反应后,通过制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-35%(0分-30分)]进行精制,得到标题化合物(3.0mg)。
MS(ESI)m/z:1443(M-H)
实施例72:药物连接子12的合成
[合成路径]
(工序1)
N-(铵基乙酰基)甘氨酰基-L-苯基丙氨酰基-N
使用市售(Hangzhou Peptide Biochem)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-苯基丙氨酰基-N
MS(ESI)m/z:437(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N
使用上述工序1所得到的化合物(1.05g)以与实施例21工序2同样的方法进行反应,得到标题化合物(550mg)。
MS(ESI)m/z:724(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N
使用上述工序2所得到的化合物(225mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(226mg)。
MS(ESI)m/z:821(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子12)
使用实施例8工序8-2所得到的化合物(5.1mg)和上述工序3所得到的化合物(4.0mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-35%(0分-30分)]进行精制,得到标题化合物(4.6mg)。
MS(ESI)m/z:1493(M+H)
实施例73:药物连接子13的合成
[合成路径]
(工序1)
N-(铵基乙酰基)甘氨酰基-L-异亮氨酰基-N
使用市售(Hangzhou Peptide Biochem)的N-(叔丁氧基羰基)甘氨酰基甘氨酰基-L-异亮氨酰基-N
MS(ESI)m/z:403(M+H)
(工序2)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-异亮氨酰基-N
使用上述工序1所得到的化合物(1.08g)以与实施例21工序2同样的方法进行反应,得到标题化合物(524mg)。
MS(ESI)m/z:690(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-异亮氨酰基-N
使用上述工序2所得到的化合物(250mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(224mg)。
MS(ESI)m/z:787(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-异亮氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子13)
使用实施例8工序8-2所得到的化合物(5.4mg)和上述工序3所得到的化合物(4.0mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-35%(0分-30分)]进行精制,得到标题化合物(4.7mg)。
MS(ESI)m/z:1457(M-H)
实施例74:药物连接子14的合成
[合成路径]
(工序1)
N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酸
使用市售(东京化成工业)的甘氨酰基甘氨酸(0.61g)以与实施例21工序2同样的方法进行反应,得到标题化合物(1.08g)。
MS(ESI)m/z:420(M+H)
(工序2)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酸酯
使用上述工序1所得到的化合物(1.07g)以与实施例21工序3同样的方法进行反应,得到标题化合物(942mg)。
MS(ESI)m/z:517(M+H)
(工序3)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-L-亮氨酸酯
在上述工序2所得到的化合物(250mg)和市售(国产化学)的L-脯氨酰基-L-亮氨酸(166mg)的N,N-二甲基甲酰胺(5.0mL)悬浮液中加入N,N-二异丙基乙基胺(0.25mL),在室温下搅拌2.5小时。追加L-脯氨酰基-L-亮氨酸(833mg)搅拌一整夜。将反应液减压浓缩后,在残留物中加入氯仿(50mL)和10%柠檬酸水溶液(10mL),用氯仿进行萃取。将有机层减压浓缩,将残留物用硅胶柱层析[氯仿/(氯仿:甲醇:水=7:3:1)的下层]进行粗精制。在粗产物的N,N-二甲基甲酰胺(5.0mL)溶液中加入N-羟基琥珀酰亚胺(67mg)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(111mg),在室温下搅拌1.5小时。将反应液减压浓缩,在残留物中加入氯仿(40mL)和水(15mL),用氯仿进行萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物依次用硅胶柱层析[氯仿/甲醇]、[乙酸乙酯/甲醇]进行精制,得到标题化合物(127mg)。
MS(ESI)m/z:727(M+H)
(工序4)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子14)
使用实施例8工序8-2所得到的化合物(6.9mg)和上述工序3所得到的化合物(4.7mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-40%(0分-30分)]进行精制,得到标题化合物(7.2mg)。
MS(ESI)m/z:1397(M-H)
实施例75:药物连接子15的合成
[合成路径]
(工序1)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-丙氨酰基-L-谷氨酸酯
使用市售(和光纯药工业)的L-丙氨酰基-L-谷氨酰胺(263mg)和实施例74工序2所得到的化合物(250mg)以与实施例74工序3同样的方法进行反应,得到标题化合物(90mg)。
MS(ESI)m/z:716(M+H)
(工序2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-丙氨酰基-N
(药物连接子15)
使用实施例8工序8-2所得到的化合物(6.9mg)和上述工序1所得到的化合物(4.7mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈、乙腈:20%-40%(0分-30分)]进行精制,得到标题化合物(3.9mg)。
MS(ESI)m/z:1388(M+H)
实施例76:药物连接子16的合成
[合成路径]
(工序1)
2,5-二桥氧基吡咯烷-1-基N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-L-脯氨酸酯
使用市售(Cool Pharm)的1-(叔丁氧基羰基)-L-脯氨酰基-L-脯氨酸(777mg)以与实施例21工序1同样的方法进行反应,得到1-[(2S)-吡咯烷-1-鎓-2-羰基]-L-脯氨酸三氟乙酸酯的粗产物。使用该粗产物和实施例74工序2所得到的化合物(428mg)以与实施例74工序3同样的方法进行反应,得到标题化合物(238mg)。
MS(ESI)m/z:711(M+H)
(工序2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-脯氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子16)
使用实施例8工序8-2所得到的化合物(6.9mg)和上述工序1所得到的化合物(4.6mg)以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-40%(0分-30分)]进行精制,得到标题化合物(5.8mg)。
MS(ESI)m/z:1383(M+H)
实施例77:药物连接子17的合成
[合成路径]
(工序1)
乙酸[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲酯
使用市售(SUNDIA)的N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基甘氨酸(9.32g)以与实施例67工序1同样的方法进行反应,得到标题化合物(8.24g)。
(工序2)
2’,3’,5’-三-O-[叔丁基(二甲基)甲硅烷基]-1-(2-羟基乙基)肌苷
在文献已知(Chem.Pharm.Bull.1987,35(1),72-79)的2’,3’,5’-三-O-[叔丁基(二甲基)甲硅烷基]肌苷(31.3g)的四氢呋喃(75mL)-N,N-二甲基乙酰胺(75mL)混合溶液中加入2-溴乙醇(4.82mL)和1,8-二氮杂双环[5.4.0]-7-十一烯(7.65mL),在室温下搅拌23小时。在反应液中加入水和乙酸乙酯,用乙酸乙酯萃取。将有机层用饱和食盐水进行洗涤,用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(29.4g)。
MS(ESI)m/z:655(M+H)
(工序3)
2’,3’,5’-三-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)肌苷
在上述工序2所得到的化合物(15.6g)的甲苯(46.8mL)溶液中加入上述工序1所得到的化合物(10.4g)和吡啶(9.63mL),在110℃下搅拌12小时。在反应液中加入上述工序1所得到的化合物(3.46g),在110℃下搅拌1天。在反应液中加入饱和碳酸氢钠水溶液和二氯甲烷,用二氯甲烷萃取。将有机层用无水硫酸钠干燥后,滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯]进行精制得到标题化合物(20.6g:含有杂质)。
MS(ESI)m/z:885(M+H)
(工序4)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)肌苷
在上述工序3所得到的化合物(20.6g)的四氢呋喃(50mL)溶液中加入三乙胺三氢氟酸盐(10mL),在室温下搅拌17小时。在冰冷却下、在反应液中缓慢加入1M碳酸氢三乙基铵溶液(50mL)和三乙胺(10mL)的混合液后,将反应液减压浓缩。将残留物用C18硅胶柱层析[水/乙腈]进行粗精制后,冷冻干燥。将得到的粗产物用吡啶共沸,在残留物的吡啶(50mL)溶液中,在0℃下加入4,4’-二甲氧基三苯甲基氯(4.73g),在4℃下搅拌17小时。在反应液中加入甲醇(2mL),在室温下搅拌15分钟后减压浓缩。将残留物用硅胶柱层析[己烷/乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(9.18g:含有杂质)。
MS(ESI)m/z:845(M+H)
(工序5)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)肌苷
使用上述工序4所得到的化合物(5.96g)以与实施例5工序3同样的方法进行反应,得到标题化合物(2.33g)和标题化合物的位置异构体5’-O-[双(4-甲氧基苯基)(苯基)甲基]-2’-O-[叔丁基(二甲基)甲硅烷基]-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)肌苷(2.45g)。
MS(ESI)m/z:959(M+H)
位置异构体(2’-O-TBS体)
MS(ESI)m/z:959(M+H)
(工序6)
5’-O-[双(4-甲氧基苯基)(苯基)甲基]-3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-{(2-氰基乙氧基)[二(丙-2-基)氨基]膦基}-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)肌苷
使用上述工序5所得到的化合物(2.33g)以与实施例5工序4同样的方法进行反应,得到磷原子上的非对映异构体混合物(非对映异构体比=6:4)形式的标题化合物(2.72g)。
MS(ESI)m/z:1159(M+H)
(工序7)
使用实施例44工序8所得到的化合物(2.15g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序8)
2-(三甲基甲硅烷基)乙基(2-{[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-桥氧基-2-巯基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序7所得到的粗产物以与实施例1工序9同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(1.47g:含有杂质)。
MS(ESI)m/z:1278(M+H)
(工序9)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-7-[6-桥氧基-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)-1,6-二氢-9H-嘌呤-9-基]-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
在上述工序8所得到的化合物(1.47g)的甲醇(10mL)-四氢呋喃(10mL)混合溶液中加入28%氨水(10mL),在50℃下搅拌6小时。将反应液减压浓缩后,将残留物使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]进行精制,得到标题化合物的非对映异构体1(204mg:含有杂质)和非对映异构体2(205mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1121(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1121(M+H)
(工序10-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(非对映异构体1)(204mg)以与实施例11工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-50%(0分-40分)]进行精制,得到标题化合物(40.7mg:含有杂质)。
MS(ESI)m/z:863(M+H)
(工序10-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序9所得到的化合物(非对映异构体2)(205mg)以与实施例11工序9-1同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-50%(0分-40分)]进行精制,得到标题化合物(50.8mg:含有杂质)。
MS(ESI)m/z:863(M+H)
(工序11-1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子17a:非对映异构体1)
使用上述工序10-1所得到的化合物(40.7mg)以与实施例22工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:40%-90%(0分-40分)]进行精制,得到标题化合物(25.1mg)。
MS(ESI)m/z:1411(M+H)
(工序11-2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子17b:非对映异构体2)
使用上述工序10-2所得到的化合物(50.8mg)以与实施例22工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:45%-90%(0分-40分)]进行精制,得到标题化合物(23.4mg)。
MS(ESI)m/z:1411(M+H)
实施例78:药物连接子18的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子18)
使用实施例45工序7-2所得到的化合物(10.0mg)和实施例21工序3所得到的化合物(8.8mg)以与实施例21工序4同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-50%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:45%-90%(0分-40分)]进行精制,得到标题化合物(10.9mg)。
MS(ESI)m/z:1381(M+H)
实施例79:药物连接子19的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-({2-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子19)
使用实施例45工序7-2所得到的化合物(20.0mg)和实施例66工序1所得到的化合物(19.8mg)以与实施例21工序4同样的方法进行反应后,用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:20%-45%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:30%-80%(0分-40分)]进行精制,得到标题化合物(22.1mg)。
MS(ESI)m/z:1468(M+H)
实施例80:药物连接子20的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子20)
使用实施例59工序4-2所得到的化合物(25.0mg)和实施例21工序3所得到的化合物(25.8mg)以与实施例21工序4同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-50%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:50%-90%(0分-40分)]进行精制,得到标题化合物(33.1mg)。
MS(ESI)m/z:1398(M+H)
实施例81:药物连接子21的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-({2-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子21)
使用实施例59工序4-2所得到的化合物(15.0mg)和实施例66工序1所得到的化合物(17.4mg)以与实施例21工序4同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-50%(0分-40分)]、以及制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:40%-90%(0分-40分)]进行精制,得到标题化合物(21.8mg)。
MS(ESI)m/z:1485(M+H)
实施例82:药物连接子22的合成
[合成路径]
(工序1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(8,9-二氢-6-硫代-2,3,5-三氮杂苯并[cd]薁-2(7H)-基)-15-氟-16-羟基-2,10-二桥氧基-2,10-二硫醚八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子22)
使用实施例61工序4-2所得到的化合物(4.4mg)和实施例21工序3所得到的化合物(3.5mg)以与实施例21工序4同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:25%-45%(0分-30分)]进行精制,得到标题化合物(6.4mg)。
MS(ESI)m/z:1412(M+H)
实施例83:药物连接子23的合成
[合成路径]
(工序1)
叔丁基N-[(苄基氧基)羰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸酯
在市售(BACHEM)的N-[(苄基氧基)羰基]甘氨酰基甘氨酰基-L-苯基丙氨酸(5.00g)和甘氨酸叔丁基酯盐酸盐(2.03g)的N,N-二甲基甲酰胺(50mL)溶液中,在冰冷却下加入N,N-二异丙基乙基胺(4.11mL)和1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(3.01g),升温至室温的同时搅拌一整夜。将反应液注入氯仿和饱和碳酸氢钠水溶液的二层中,用氯仿进行萃取。将有机层用水和饱和食盐水进行洗涤后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩后,用甲苯共沸2次。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(4.51g)。
MS(ESI)m/z:527(M+H)
(工序2)
叔丁基甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸酯
在上述工序1所得到的化合物(4.51g)的甲醇(20mL)-二氯甲烷(80mL)混合液中加入10%钯碳(M)wet(750mg),在氢气氛下、室温下搅拌一整夜。追加10%钯碳(M)wet(1.5g),在氢气氛下、室温下搅拌一整夜。将反应液用硅藻土过滤,将滤液减压浓缩。将残留物用氨基硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(3.18g)。
MS(ESI)m/z:393(M+H)
(工序3)
叔丁基N-[6-(2,5-二桥氧基-2,5-二氢-1H-吡咯-1-基)己酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸酯
将上述工序2所得到的化合物(2.65g)和市售(东京化成工业)的6-马来酰亚胺己烷酸N-琥珀酰亚胺酯(2.20g)溶解于N,N-二甲基甲酰胺(20mL),在室温下搅拌7小时。将反应液减压浓缩后,将残留物注入二氯甲烷和水的二层中,用二氯甲烷萃取。用水洗涤有机层3次,用饱和食盐水洗涤1次后,用无水硫酸钠进行干燥。滤去干燥剂,将滤液减压浓缩。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(3.52g)。
MS(ESI)m/z:586(M+H)
(工序4)
N-[6-(2,5-二桥氧基-2,5-二氢-1H-吡咯-1-基)己酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸
在上述工序3所得到的化合物(1.00g)的二氯甲烷(9.0mL)溶液中,在0℃下加入三氟乙酸(4.5mL),在室温下搅拌2.5小时。将反应液减压浓缩后,用甲苯共沸2次。将残留物用硅胶柱层析[二氯甲烷/甲醇]进行精制,得到标题化合物(534mg)。
MS(ESI)m/z:530(M+H)
(工序5)
2,5-二桥氧基吡咯烷-1-基N-[6-(2,5-二桥氧基-2,5-二氢-1H-吡咯-1-基)己酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基甘氨酸酯
使用上述工序4所得到的化合物(462mg)以与实施例21工序3同样的方法进行反应,得到标题化合物(258mg)。
MS(ESI)m/z:627(M+H)
(工序6)
双(N,N-二乙基乙铵)N-[6-(2,5-二桥氧基-2,5-二氢-1H-吡咯-1-基)己酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[2-({6-氨基-9-[(5R,7R,8R,12aR,14R,15R,15aS,16R)-15,16-二羟基-2,10-二桥氧基-2,10-二硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子23)
使用实施例8工序8-2所得到的化合物(9.5mg)和上述工序5所得到的化合物(7.5mg),以与实施例23工序1同样的方法进行反应后,用制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:10%-30%(0分-30分)]进行精制,得到标题化合物(7.8mg)。
MS(ESI)m/z:1299(M+H)
实施例84:糖链重构抗体3的合成
抗HER2抗体2-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-抗HER2抗体2的制备
依据共通操作C对市售的PERJETA(注册商标)点滴静注420mg/14mL(中外制药)(3.5mL)进行缓冲液交换,得到磷酸盐缓冲生理食盐水溶液(6.0mL,15.39mg/mL,pH6.0)。进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(12.96mg/mL,7.5mL,pH6.0)。
(工序2)
抗HER2抗体2-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(12.96mg/mL,7.5mL,pH6.0)和[N
实施例85:糖链重构抗体4的合成
改造抗HER2抗体2-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-改造抗HER2抗体2的制备
使用按参考例5制备的改造抗HER2抗体2的磷酸盐缓冲生理食盐水溶液(24mL,12.25mg/mL,pH6.0)进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(20.86mg/mL,12.5mL,pH6.0)。
(工序2)
改造抗HER2抗体2-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(20.86mg/mL,12.5mL,pH6.0)和[N
实施例86:糖链重构抗体5的合成
抗CD33抗体-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-抗CD33抗体的制备
使用根据参考例6制备的抗CD33抗体的磷酸盐缓冲生理食盐水溶液(9.0mL,11.56mg/mL,pH6.0)进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(11.62mg/mL,8mL,pH6.0)。
(工序2)
抗CD33抗体-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(11.62mg/mL,8mL,pH6.0)和[N
实施例87:糖链重构抗体6的合成
抗EphA2抗体-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-抗EphA2抗体的制备
使用根据参考例7制备的抗EphA2抗体的磷酸盐缓冲生理食盐水溶液(8.0mL,12.83mg/mL,pH6.0)进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(13.51mg/mL,7mL,pH6.0)。
(工序2)
抗EphA2抗体-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(13.51mg/mL,7mL,pH6.0)和[N
实施例88:糖链重构抗体7的合成
抗CDH6抗体-[SG-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-抗CDH6抗体的制备
根据共通操作C将根据参考例8制备的抗CDH6抗体的HBSor(25mM组氨酸/5%山梨糖醇,pH=6.0)缓冲液(5.0mL,20.0mg/mL)与磷酸盐缓冲生理食盐水溶液(pH=6.0)进行缓冲液交换后,进行与实施例25工序1同样的操作,得到标题抗体的20mM磷酸盐缓冲溶液(9.58mg/mL,9.0mL,pH6.0)。
(工序2)
抗CDH6抗体-[SG-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(9.58mg/mL,9.0mL,pH6.0)和[N
实施例89:糖链重构抗体8的合成
改造抗HER2抗体2-[MSG1-(N
[合成路径]
(工序1)
(Fucα1,6)GlcNAc-改造抗HER2抗体2的制备
进行与实施例85工序1同样的反应,由原料抗体的缓冲溶液(10mL,12.25mg/mL,pH6.0)得到标题抗体的20mM磷酸盐缓冲溶液(14.84mg/mL,7.5mL,pH6.0)。
(工序2)
改造抗HER2抗体2-[MSG1-(N
使用上述工序1所得到的抗体的20mM磷酸盐缓冲溶液(14.84mg/mL,7.5mL,pH6.0)和[N
实施例90:抗体药物偶联物5的合成(抗HER2抗体-CDN偶联物4的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.97mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子1的二甲基亚砜溶液(10mM,0.091mL,相对于1分子抗体为24当量)和丙二醇(0.159mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.49mg/mL
抗体产量:1.71mg(31%)
药物平均结合数:3.6
实施例91:抗体药物偶联物6的合成(抗HER2抗体-CDN偶联物5的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.97mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2a的二甲基亚砜溶液(10mM,0.091mL,相对于1分子抗体为24当量)和丙二醇(0.159mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.91mg/mL
抗体产量:3.17mg(58%)
药物平均结合数:3.6
实施例92:抗体药物偶联物7的合成(抗HER2抗体-CDN偶联物6的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,4.00mL)用丙二醇(2.00mL)进行稀释。在该溶液中加入药物连接子2b的二甲基亚砜溶液(10mM,0.707mL,相对于1分子抗体为24当量)和丙二醇(1.293mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(24.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.96mg/mL
抗体产量:23.57mg(59%)
药物平均结合数:3.7
实施例93:抗体药物偶联物8的合成(抗HER2抗体-CDN偶联物7的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,4.00mL)用丙二醇(2.00mL)进行稀释。在该溶液中加入药物连接子5的二甲基亚砜溶液(10mM,0.707mL,相对于1分子抗体为24当量)和丙二醇(1.293mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(24.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.10mg/mL
抗体产量:26.86mg(67%)
药物平均结合数:3.7
实施例94:抗体药物偶联物9的合成(抗HER2抗体-CDN偶联物8的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,4.00mL)用丙二醇(2.00mL)进行稀释。在该溶液中加入药物连接子6的二甲基亚砜溶液(10mM,0.707mL,相对于1分子抗体为24当量)和丙二醇(1.293mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(24.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.34mg/mL
抗体产量:32.92mg(82%)
药物平均结合数:3.7
实施例95:抗体药物偶联物10的合成(抗LPS抗体-CDN偶联物2的合成)
将糖链重构抗体2的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.55mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2a的二甲基亚砜溶液(10mM,0.087mL,相对于1分子抗体为24当量)和丙二醇(0.163mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.88mg/mL
抗体产量:3.08mg(62%)
药物平均结合数:3.6
实施例96:抗体药物偶联物11的合成(抗EphA2抗体-CDN偶联物1的合成)
将糖链重构抗体6的磷酸盐缓冲生理食盐水(pH6.0)溶液(8.91mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2b的二甲基亚砜溶液(10mM,0.073mL,相对于1分子抗体为24当量)和丙二醇(0.177mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
根据共通操作E以及F所述的方法进行分析得到下述的结果。
抗体浓度:0.60mg/mL
抗体产量:2.10mg(47%)
药物平均结合数:3.8
实施例97:抗体药物偶联物12的合成(抗CD33抗体-CDN偶联物1的合成)
将糖链重构抗体5的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.01mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2b的二甲基亚砜溶液(10mM,0.083mL,相对于1分子抗体为24当量)和丙二醇(0.167mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.73mg/mL
抗体产量:2.57mg(51%)
药物平均结合数:3.9
实施例98:抗体药物偶联物13的合成(抗CDH6抗体-CDN偶联物1的合成)
将糖链重构抗体7的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.69mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子2b的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.96mg/mL
抗体产量:3.37mg(63%)
药物平均结合数:3.8
实施例99:抗体药物偶联物14的合成(抗HER2抗体2-CDN偶联物1的合成)
将糖链重构抗体3的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.21mg/mL,1.50mL)用丙二醇(0.750mL)进行稀释。在该溶液中加入药物连接子3的二甲基亚砜溶液(10mM,0.253mL,相对于1分子抗体为24当量)和丙二醇(0.497mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(9.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.02mg/mL
抗体产量:9.73mg(64%)
药物平均结合数:3.7
实施例100:抗体药物偶联物15的合成(抗HER2抗体-CDN偶联物9的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子8的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.93mg/mL
抗体产量:3.24mg(61%)
药物平均结合数:3.6
实施例101:抗体药物偶联物16的合成(抗HER2抗体-CDN偶联物10的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.35mg/mL,13.50mL)用丙二醇(6.750mL)进行稀释。在该溶液中加入药物连接子9的二甲基亚砜溶液(10mM,2.310mL,相对于1分子抗体为24当量)和丙二醇(4.440mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(74.3mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.36mg/mL
抗体产量:100.8mg(72%)
药物平均结合数:3.7
实施例102:抗体药物偶联物17的合成(抗HER2抗体-CDN偶联物11的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子10的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.63mg/mL
抗体产量:2.22mg(42%)
药物平均结合数:3.5
实施例103:抗体药物偶联物18的合成(抗HER2抗体-CDN偶联物12的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子11的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.94mg/mL
抗体产量:3.29mg(62%)
药物平均结合数:3.6
实施例104:抗体药物偶联物19的合成(抗HER2抗体-CDN偶联物13的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子12的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.92mg/mL
抗体产量:3.20mg(60%)
药物平均结合数:3.5
实施例105:抗体药物偶联物20的合成(抗HER2抗体-CDN偶联物14的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子13的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.01mg/mL
抗体产量:3.52mg(66%)
药物平均结合数:3.5
实施例106:抗体药物偶联物21的合成(抗HER2抗体-CDN偶联物15的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子14的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.78mg/mL
抗体产量:2.74mg(51%)
药物平均结合数:3.6
实施例107:抗体药物偶联物22的合成(抗HER2抗体-CDN偶联物16的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子15的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.32mg/mL
抗体产量:4.61mg(86%)
药物平均结合数:3.6
实施例108:抗体药物偶联物23的合成(抗HER2抗体-CDN偶联物17的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子16的二甲基亚砜溶液(10mM,0.088mL,相对于1分子抗体为24当量)和丙二醇(0.162mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.93mg/mL
抗体产量:3.25mg(61%)
药物平均结合数:3.6
实施例109:抗体药物偶联物24的合成(抗HER2抗体-CDN偶联物18的合成)
将糖链重构抗体1的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.70mg/mL,4.00mL)用丙二醇(2.00mL)进行稀释。在该溶液中加入药物连接子7的二甲基亚砜溶液(10mM,0.707mL,相对于1分子抗体为24当量)和丙二醇(1.293mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(24.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.33mg/mL
抗体产量:32.64mg(82%)
药物平均结合数:3.7
实施例110:抗体药物偶联物25的合成(抗HER2抗体2-CDN偶联物2的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.87mg/mL,8.00mL)用丙二醇(4.00mL)进行稀释。在该溶液中加入药物连接子17a的二甲基亚砜溶液(10mM,1.079mL,相对于1分子抗体为18当量)和丙二醇(2.921mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(44.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.16mg/mL
抗体产量:51.5mg(59%)
药物平均结合数:3.8
实施例111:抗体药物偶联物26的合成(抗HER2抗体2-CDN偶联物3的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.87mg/mL,8.00mL)用丙二醇(4.00mL)进行稀释。在该溶液中加入药物连接子17b的二甲基亚砜溶液(10mM,1.079mL,相对于1分子抗体为18当量)和丙二醇(2.921mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(44.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.24mg/mL
抗体产量:54.99mg(63%)
药物平均结合数:3.9
实施例112:抗体药物偶联物27的合成(抗HER2抗体2-CDN偶联物4的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子19的二甲基亚砜溶液(10mM,0.180mL,相对于1分子抗体为24当量)和丙二醇(0.320mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.79mg/mL
抗体产量:5.53mg(51%)
药物平均结合数:3.9
实施例113:抗体药物偶联物28的合成(抗HER2抗体2-CDN偶联物5的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子21的二甲基亚砜溶液(10mM,0.180mL,相对于1分子抗体为24当量)和丙二醇(0.320mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.84mg/mL
抗体产量:5.91mg(54%)
药物平均结合数:3.9
实施例114:抗体药物偶联物29的合成(抗HER2抗体2-CDN偶联物6的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子22的二甲基亚砜溶液(10mM,0.180mL,相对于1分子抗体为24当量)和丙二醇(0.320mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(5.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.92mg/mL
抗体产量:4.60mg(42%)
药物平均结合数:3.5
实施例115:抗体药物偶联物30的合成(抗HER2抗体2-CDN偶联物7的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子18的二甲基亚砜溶液(10mM,0.180mL,相对于1分子抗体为24当量)和丙二醇(0.320mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.08mg/mL
抗体产量:7.53mg(69%)
药物平均结合数:3.9
实施例116:抗体药物偶联物31的合成(抗HER2抗体2-CDN偶联物8的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子20的二甲基亚砜溶液(10mM,0.180mL,相对于1分子抗体为24当量)和丙二醇(0.320mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.09mg/mL
抗体产量:7.62mg(70%)
药物平均结合数:3.8
实施例117:抗体药物偶联物32的合成(抗HER2抗体2-CDN偶联物9的合成)
将糖链重构抗体8的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.48mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子17a的二甲基亚砜溶液(10mM,0.087mL,相对于1分子抗体为12当量)和丙二醇(0.413mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.77mg/mL
抗体产量:5.36mg(51%)
药物平均结合数:1.8
实施例118:抗体药物偶联物33的合成(抗HER2抗体2-CDN偶联物10的合成)
将糖链重构抗体8的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.48mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子17b的二甲基亚砜溶液(10mM,0.087mL,相对于1分子抗体为12当量)和丙二醇(0.413mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.91mg/mL
抗体产量:6.34mg(61%)
药物平均结合数:1.8
实施例119:抗体药物偶联物34的合成(抗HER2抗体-CDN偶联物19的合成)
将依照参考例1制备的抗HER2抗体的磷酸盐缓冲溶液通过共通操作C进行缓冲液交换,制备磷酸盐缓冲生理食盐水/5mM-EDTA的抗体溶液(7.69mg/mL)。在该抗体溶液(0.65mL)中加入三(2-羧基乙基)膦盐酸盐的水溶液(10mM,20.7μL)和磷酸氢二钾水溶液(1M,9.8μL)。确认反应液的pH为7.4±1.0以内后,在37℃下搅拌2小时。加入药物连接子23的DMSO溶液(10mM,0.0689mL)使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应1小时。在反应液中加入N-乙酰基-L-半胱氨酸水溶液(100mM,6.9μL)使反应停止。将反应液通过共通操作C所述的方法进行缓冲液交换,得到目标抗体药物偶联物的ABS溶液(1.6mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.46mg/mL
抗体产量:2.34mg(47%)
药物平均结合数:6.5
实施例120:药物连接子24的合成
[合成路径]
(工序1)
使用实施例44工序8所得到的化合物(1.55g)以与实施例1工序7同样的方法进行反应,得到6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
(工序2)
2-(三甲基甲硅烷基)乙基(2-{[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-羟基-2-桥氧基-10-亚巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例62工序2同样的方法进行反应,得到磷原子上的非对映异构体混合物形式的标题化合物(1.07g:含有杂质)。
MS(ESI)m/z:1262(M+H)
(工序3)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-7-[6-桥氧基-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)-1,6-二氢-9H-嘌呤-9-基]-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的(1.07g)以与实施例1工序10同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇(1:1),乙腈-甲醇(1:1):25%-90%(0分-40分)]进行精制,得到标题化合物的非对映异构体1(67.8mg:含有杂质)和非对映异构体2(56.6mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1105(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1105(M+H)
(工序4-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(非对映异构体1)(67.8mg)以与实施例11工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇(1:1),乙腈-甲醇(1:1):10%-60%(0分-30分)]进行精制,得到标题化合物(33.7mg:含有杂质)。
MS(ESI)m/z:847(M+H)
(工序4-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(非对映异构体2)(56.6mg)以与实施例11工序9-1同样的方法进行反应后,通过C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇(1:1),乙腈-甲醇(1:1):10%-60%(0分-30分)]进行精制,得到标题化合物(32.6mg:含有杂质)。
MS(ESI)m/z:847(M+H)
(工序5-1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2-氧基-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体1)
使用上述工序4-1所得到的化合物(33.7mg)和实施例22工序11所得到的化合物(21.3mg)以与实施例22工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(11.2mg)。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:40%-90%(0分-40分)].
MS(ESI)m/z:1395(M+H)
(工序5-2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2-氧基-2,10-二桥氧基-10-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(非对映异构体2)
使用上述工序4-2所得到的化合物(32.6mg)和实施例22工序11所得到的化合物(20.6mg)以与实施例22工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(16.7mg)。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]、制备型HPLC[10mM乙酸三乙基铵水溶液/甲醇,甲醇:40%-90%(0分-40分)]、以及制备型HPLC[100mM六氟-2-丙醇,8mM三乙基胺水溶液/乙腈,乙腈:10%-45%(0分-40分)].
MS(ESI)m/z:1395(M+H)
实施例121:药物连接子25的合成
[合成路径]
(工序1)
N,N-二乙基乙铵6-苯甲酰基-2-{5-O-[双(4-甲氧基苯基)(苯基)甲基]-2-脱氧基-2-氟-3-O-[氧基(桥氧基)-λ
在实施例44工序7所得到的化合物(1.49g)的吡啶(10.4mL)溶液中,在冰冷下加入亚磷酸二苯酯(599μL),升温至室温搅拌30分钟。追加亚磷酸二苯酯(200μL),再搅拌2小时。在冰冷却下、在反应液中加入水(1.5mL),在室温下搅拌30分钟后,减压浓缩。将残留物用硅胶柱层析[乙酸乙酯/甲醇/0.1%三乙胺]进行精制,得到标题化合物(1.41g)。
MS(ESI)m/z:779(M+H)
(工序2)
6-苯甲酰基-2-{2-脱氧基-2-氟-3-O-[羟基(桥氧基)-λ
在上述工序1所得到的化合物(1.41g)的二氯甲烷(20.0mL)溶液中加入水(289μL)和二氯乙酸(1.14mL)的二氯甲烷(20.0mL)溶液,在室温下搅拌10分钟。在反应液中加入吡啶(2.19mL)使反应停止后进行减压浓缩。在残留物中加入三氟乙酸吡啶盐(402mg),用脱水乙腈(15mL)共沸3次,最后一次残留10mL左右的乙腈。得到的乙腈溶液直接使用于接下来的反应。
MS(ESI)m/z:477(M+H)
(工序3)
使用实施例77工序6所得到的化合物(2.15g)和上述工序2所得到的化合物的乙腈溶液,以与实施例63工序1同样的方法进行反应,将得到的粗产物直接使用于接下来的反应。
(工序4)
2-(三甲基甲硅烷基)乙基(2-{[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2,10-二桥氧基-2-巯基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的粗产物以与实施例1工序9同样的方法进行反应,得到标题化合物(1.00g:含有杂质)。
MS(ESI)m/z:1262(M+H)
(工序5)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-15-氟-2,10-二桥氧基-7-[6-桥氧基-1-(2-{[(N-{[2-(三甲基甲硅烷基)乙氧基]羰基}甘氨酰基)氨基]甲氧基}乙基)-1,6-二氢-9H-嘌呤-9-基]-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的化合物(1.00g)以与实施例1工序10同样的方法进行反应,得到标题化合物的非对映异构体1(191mg:含有杂质)和非对映异构体2(369mg:含有杂质)。
非对映异构体1(低极性)
MS(ESI)m/z:1105(M+H)
非对映异构体2(高极性)
MS(ESI)m/z:1105(M+H)
(工序6-1)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(非对映异构体1)(191mg)以与实施例40工序5同样的方法进行反应,得到标题化合物(21.9mg:含有杂质)。
MS(ESI)m/z:847(M+H)
(工序6-2)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序5所得到的化合物(非对映异构体2)(369mg)以与实施例40工序5同样的方法进行反应,得到标题化合物(137mg:含有杂质)。
MS(ESI)m/z:847(M+H)
(工序7-1)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-10-氧基-2,10-二桥氧基-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子25a:非对映异构体1)
使用上述工序6-1所得到的化合物(21.9mg)以与实施例22工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(26.3mg)。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-50%(0分-30分)]以及Sep-Pak(注册商标)C18[水/乙腈/0.1%三乙胺].
MS(ESI)m/z:1395(M+H)
(工序7-2)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-10-氧基-2,10-二桥氧基-2-硫醚-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
(药物连接子25b:非对映异构体2)
使用上述工序6-2所得到的化合物(47.5mg)以与实施例22工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(15.1mg)。
[精制条件]制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈,乙腈:30%-50%(0分-30分)]以及Sep-Pak(注册商标)C18[水/乙腈/0.1%三乙胺].
MS(ESI)m/z:1395(M+H)
实施例122:药物连接子26的合成
[合成路径]
(工序1)
使用实施例77工序6所得到的化合物(1.26g)以与实施例1工序7同样的方法进行反应,得到3’-O-[叔丁基(二甲基)甲硅烷基]-2’-O-[羟基(桥氧基)-λ
(工序2)
2-(三甲基甲硅烷基)乙基(2-{[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序1所得到的粗产物以与实施例62工序2同样的方法进行反应,得到标题化合物(678mg:含有杂质)。
MS(ESI)m/z:1246(M+H)
(工序3)
2-(三甲基甲硅烷基)乙基(2-{[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-14-(6-苯甲酰基-6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)-16-{[叔丁基(二甲基)甲硅烷基]氧基}-10-(2-氰基乙氧基)-15-氟-2-羟基-2,10-二桥氧基八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序2所得到的化合物(678mg)以与实施例1工序10同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):25%-90%(0分-30分)]进行精制,得到标题化合物(99.6mg:含有杂质)。
MS(ESI)m/z:1089(M+H)
(工序4)
双(N,N-二乙基乙铵)(5R,7R,8R,12aR,14R,15R,16R)-15-氟-7-(1-{2-[(甘氨酰基氨基)甲氧基]乙基}-6-桥氧基-1,6-二氢-9H-嘌呤-9-基)-16-羟基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序3所得到的化合物(99.6mg)以与实施例11工序9-1同样的方法进行反应后,使用C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[10mM乙酸三乙基铵水溶液/乙腈-甲醇溶液(1:1),乙腈-甲醇溶液(1:1):10%-60%(0分-30分)]进行精制,得到标题化合物(60.8mg:含有杂质)。
MS(ESI)m/z:831(M+H)
(工序5)
双(N,N-二乙基乙铵)N-[4-(11,12-二去氢二苯并[b,f]氮杂环辛四稀-5(6H)-基)-4-桥氧基丁酰基]甘氨酰基甘氨酰基-L-苯基丙氨酰基-N-[(2-{9-[(5R,7R,8R,12aR,14R,15R,15aR,16R)-15-氟-16-羟基-2,10-二氧基-2,10-二桥氧基-14-(6,7,8,9-四氢-2H-2,3,5,6-四氮杂苯并[cd]薁-2-基)八氢-2H,10H,12H-5,8-甲桥-2λ
使用上述工序4所得到的化合物(60.8mg)和实施例22工序11所得到的化合物(21.3mg)以与实施例22工序9-1同样的方法进行反应后,按照以下的[精制条件]进行精制,得到标题化合物(30.5mg)。
[精制条件]C18硅胶柱层析[10mM乙酸三乙基铵水溶液/乙腈]和制备型HPLC[100mM六氟-2-丙醇,8mM三乙基胺水溶液/乙腈,乙腈:10%-45%(0分-40分)].
MS(ESI)m/z:1379(M+H)
实施例123:抗体药物偶联物35的合成(抗HER2抗体2-CDN偶联物11的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.87mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子24a的二甲基亚砜溶液(10mM,0.135mL,相对于1分子抗体为18当量)和丙二醇(0.365mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
根据共通操作E以及F所述的方法得到下述的结果。
抗体浓度:1.08mg/mL
抗体产量:7.54mg(69%)
药物平均结合数:3.8
实施例124:抗体药物偶联物36的合成(抗HER2抗体2-CDN偶联物12的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.87mg/mL,1.00mL)用丙二醇(0.500mL)进行稀释。在该溶液中加入药物连接子24b的二甲基亚砜溶液(10mM,0.135mL,相对于1分子抗体为18当量)和丙二醇(0.365mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(7.0mL)。
根据共通操作E以及F所述的方法进行分析得到下述的结果。
抗体浓度:1.12mg/mL
抗体产量:7.85mg(72%)
药物平均结合数:3.8
实施例125:抗体药物偶联物37的合成(抗HER2抗体2-CDN偶联物13的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.87mg/mL,2.00mL)用丙二醇(1.00mL)进行稀释。在该溶液中加入药物连接子26的二甲基亚砜溶液(10mM,0.270mL,相对于1分子抗体为18当量)和丙二醇(0.730mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(14.0mL)。
根据共通操作E以及F所述的方法进行分析得出下述的结果。
抗体浓度:1.05mg/m
抗体产量:14.71mg(68%)
药物平均结合数:3.8
实施例126:抗体药物偶联物38的合成(抗HER2抗体2-CDN偶联物14的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,3.00mL)用丙二醇(1.50mL)进行稀释。在该溶液中加入药物连接子25a的二甲基亚砜溶液(10mM,0.540mL,相对于1分子抗体为24当量)和丙二醇(0.960mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下搅拌3天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(19mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:1.38mg/mL
抗体产量:26.28mg(80%)
药物平均结合数:3.7
实施例127:抗体药物偶联物39的合成(抗HER2抗体2-CDN偶联物15的合成)
将糖链重构抗体4的磷酸盐缓冲生理食盐水(pH6.0)溶液(10.89mg/mL,0.500mL)用丙二醇(0.250mL)进行稀释。在该溶液中加入药物连接子25b的二甲基亚砜溶液(10mM,0.090mL,相对于1分子抗体为24当量)和丙二醇(0.160mL)的混合液,使用试管旋转器(MTR-103,AS ONE株式会社)在室温下反应2天。依照共通操作D所述的方法对反应液进行精制,得到目标抗体药物偶联物的ABS溶液(3.5mL)。
依照共通操作E以及G所述的方法进行分析得到下述结果。
抗体浓度:0.93mg/mL
抗体产量:3.25mg(60%)
药物平均结合数:3.5
(参考例1:抗HER2抗体的制作)
在本说明书中,“曲妥珠单抗”有时也称之为HERCEPTIN(注册商标)、huMAb4D5-8、rhuMAb4D5-8,是具有由序列号1所述的氨基酸序列形成的轻链以及由序列号2所述的氨基酸序列形成的重链的人源化IgG1抗体。氨基酸序列参照US5821337。曲妥珠单抗的轻链氨基酸序列(序列号1)以及重链氨基酸序列(序列号2)如图4所示。
在本说明书中使用的抗HER2抗体是设计使曲妥珠单抗的重链氨基酸序列的EUINDEX第234位以及第235位的白氨酸(L)变异成丙氨酸(A)(本说明书中也称为LALA变异)的曲妥珠单抗的恒定区改造IgG1抗体(本说明书中也称为改造抗HER2抗体)而制成的。改造抗HER2抗体的轻链氨基酸序列(序列号1)以及重链氨基酸序列(序列号3)如图5所示。
(参考例2:抗LPS抗体的制作)
抗LPS抗体参照WO2015/046505进行制作。在本实施例中使用的抗LPS抗体的同种型为IgG1,具有LALA变异(本说明书中也称为改造抗LPS抗体)。本实施例中使用的改造抗LPS抗体的轻链以及重链的氨基酸序列如序列号26以及序列号27所示。
(参考例3:ML-RR-CDA·2Na
本说明书中作为参照化合物使用的ML-RR-CDA·2Na
(参考例4:2’,3’-cGAMP的合成)
在本说明书中,作为参照化合物使用的2’,3’-cGAMP使用cGAS由ATP和GTP在酶的促进下合成。cGAS的制备以及酶反应适当改变文献记载的方法(Immunity,2013,39,1019-1031、Cell Rep.2014,6,421-430)来实施。通过使用弱碱性阴离子交换树脂(DIAIONWA10)以及合成吸附剂(SEPABEADS SP207SS)的柱层析来实施精制。
(参考例5:抗HER2抗体2的制作)
“帕妥珠单抗”也称为PERJETA(注册商标),是具有由序列号28所述的氨基酸序列形成的轻链以及由序列号29所述的氨基酸序列形成的重链的人源化IgG1抗体。氨基酸序列参照WO2004/008099。本说明书中也称为抗HER2抗体2。帕妥珠单抗的轻链氨基酸序列(序列号28)以及重链氨基酸序列(序列号29)如图17所示。
本说明书中,设计除了LALA变异以外,将重链氨基酸序列的EU INDEX第214位赖氨酸(K)变异成精氨酸(R)的具有G1m3同种异型的恒定区的抗HER2抗体2来制作(本说明书中也称为改造抗HER2抗体2)。本实施例中使用的改造抗HER2抗体2的轻链氨基酸序列(序列号28)以及重链氨基酸序列(序列号30)如图18所示。
(参考例6:抗CD33抗体的制作)
抗CD33抗体参照WO2014/057687进行制作。在本实施例中使用的抗CD33抗体的同种型为IgG1,具有LALA变异。在本实施例中使用的抗CD33抗体的轻链氨基酸序列(序列号31)以及重链氨基酸序列(序列号32)如图19所示。
(参考例7:抗EphA2抗体的制作)
抗EphA2抗体参照WO2009/028639进行制作。在本实施例使用的抗EphA2抗体的同种型为IgG1。本实施例中使用的抗EphA2抗体的轻链氨基酸序列(序列号33)以及重链氨基酸序列(序列号34)如图20所示。
(参考例8:抗CDH6抗体的制作)
抗CDH6抗体参照WO2018/212136进行制作。在本实施例中使用的抗CDH6抗体的同种型为IgG1,除了具有LALA变异,还具有将重链氨基酸序列的EU INDEX第329号的脯氨酸(P)变异为甘氨酸(G)的变异。本实施例中使用的抗CDH6抗体的轻链氨基酸序列(序列号35)以及重链氨基酸序列(序列号36)如图21所示。
(试验例1)使用报告细胞的STING激动剂活性评价
<报告基因分析>
人类STING激动剂活性使用可确认位于STING路径的下游的干扰素控制因子3(interferon regulatory factor-3(IRF3))的路径的活化的THP1-Dual
分析通过以下的方式实施。首先,在透明96孔板(Corning,NY,US)中,以20μL/well对用PBS稀释后的实验化合物进行分注。接着,以180μL/well(1×10
[表1]
该结果表明,本申请化合物具有对人类STING的激动剂活性。另外,对于小鼠STING,也确认了与现有CDN同等以上的激动剂活性。
(试验例2)使用重组STING C末端结合域蛋白质的Protein thermal shift assay
(i)各种表达质粒的构建
<人类TMEM173表达质粒的构建>
人类STING(本说明书中,有时也称为人类TMEM173)的哺乳动物细胞表达用质粒购买第232位精氨酸(R)变异为组氨酸(H)的(本说明书中也称为H232变异或REF变异)人类TMEM173 cDNA Clone(Accession NM_198282.3,H232(REF)变异型STING表达质粒)(GeneCopoeia,MD,US)。将人类H232(REF)变异型STING的氨基酸序列示于序列号4、将核苷酸序列示于序列号5。另外,以H232变异型STING表达质粒作为模板,基于Inverse PCR法进行部位特异性变异导入而制作野生型STING以及变异型STING的表达质粒。详细而言,首先使用2种引物(Primer)(5’-CGTGCTGGCATCAAGGATCGGGTTTAC-3’(H232R(WT)fwd)(序列号12)以及5’-GTCACCGGTCTGCTGGGGCAGTTTATC-3’(H232R(WT)rev))(序列号13)和KOD-Plus-Mutagenesis Kit(SMK-101)(东洋纺)实施PCR,通过DNA测序确认目标野生型(R232)STING表达质粒的构建。将人类野生型STING的氨基酸序列示于序列号6,将核苷酸序列示于序列号7。
接着,以与野生型STING表达质粒同样的方法制作HAQ(R71H,G230A以及R293Q)变异型。具体而言,以H232变异型STING表达质粒为模板,使用2种引物(5’-GCTGACCGTGCTGGCATCAAGGATCGGGTTTAC-3’(H232R/G230A fwd)(序列号14)以及5’-GGTCTGCTGGGGCAGTTTATCCAGG-3’(H232R/G230A rev)(序列号15))和Mutagenesis Kit实施PCR。通过在2处同时导入变异,得到G230A变异型STING质粒。进而,以G230A变异型STING表达质粒作为模板,使用2种引物(5’-CACCACATCCACTCCAGGTACCGG-3’(R71H fwd)(序列号16)以及5’-CAGCTCCTCAGCCAGGCTGCAGAC-3’(R71H rev)(序列号17))与MutagenesisKit实施PCR,得到R71H/G230A变异型STING表达质粒。
接着,以R71H/G230A变异型的STING表达质粒作为模板,使用2种引物(5’-CAGACACTTGAGGACATCCTGGCAG-3’(R293Q fwd)(序列号18)以及5’-GCAGAAGAGTTTGGCCTGCTCAA-3’(R293Q rev)(序列号19))和Mutagenesis Kit实施PCR,得到HAQ(R71H/G230A/R293Q)变异型的表达质粒。人类HAQ变异型STING的氨基酸序列示于序列号8,核苷酸序列示于序列号9。
人类的野生型STING、REF型STING,HAQ型STING的氨基酸序列如图6所示。
<重组STING C末端结合域蛋白质表达质粒等的构建>
人类STING C末端结合域(aa139-342)蛋白质(UniProt entry Q86WV6)cDNA通过使用2种引物(5’-ACCTGTATTTTCAGGGCCTGGCCCCAGCTGAGATCTCTG-3’(hST Fw_v2)(序列号20)以及5’-CAGAATTCGCAAGCTTTTAAGTAACCTCTTCCTTTTCCTCCTGC-3’(hST Rv_V3)(序列号21))的PCR,由全长的人类TMEM173 cDNA clone表达质粒(野生型、H232变异型以及HAQ变异型)而制作。使用In-Fusion HD Cloning Kit(Takara Bio),将PCR产物插入至作为大肠菌表达用载体的pET15b,使在N末端具有由组氨酸6碱基构成的6xHis标签、Avidin(抗生物素蛋白)标签以及TEV蛋白酶切断位点,构建pET15b-HisAviTEV-hSTING(139-342)人类野生型、pET15b-HisAviTEV-hSTING(139-342)人类REF变异型以及pET15b-HisAviTEV-hSTING(139-342)人类AQ变异型的表达质粒。
对于小鼠STING C末端结合域(aa138-341)蛋白质(UniProt entry Q3TBT3)表达用cDNA,使用通过eurofins Genomics人工合成对应小鼠TMEM173 cDNA序列第138号~第341号氨基酸的cDNA的cDNA。将小鼠STING的氨基酸序列示于序列号10,将核苷酸序列示于序列号11。使用In-Fusion HD Cloning Kit,将合成的cDNA插入至作为大肠菌表达用载体的pET15b,使在N末端具有由组氨酸6碱基构成6xHis标签、Avidin标签以及TEV蛋白酶切断位点,构建pET15b-HisAviTEV-mSTING(138-341)小鼠野生型的表达质粒。
在pCDF_Duet-1载体插入人工合成的大肠菌BirA(UniProt entry P06709)cDNA,构建pCDF_Duet-1BirA(1-321)表达质粒。
(ii)STING C末端结合域蛋白质的制备法
制作的各pET15b-HisAviTEV-hSTING(139-342)(人类野生型、人类REF变异型以及人类AQ变异型的STING C末端结合域蛋白质)表达质粒以及pET15b-HisAviTEV-mSTING(138-341)(小鼠野生型的STING C末端结合域蛋白质)表达质粒分别与pCDF_Duet-1BirA(1-321)表达质粒同时转化为Competent E.coli Rosetta 2(DE3)(MerckMillipore,MA,US),制作各HisAviTEV-STING表达株。将这些表达株添加至含有100μg/mL氨苄西林、50μg/mL链霉素、以及30μg/mL卡那霉素的TB培养基中,在37℃下培养后,用100μMIPTG进行诱导表达,进一步在16℃下培养。
将培养液离心,将得到的菌体悬浮于50mM HEPES pH8.0,500mM NaCl,20mMimidazole(咪唑),1mM DTT,5%(w/v)glycerol(甘油)、Complete EDTA free中后,冷冻溶解。添加Lysozyme、DNase I后,通过超声波破碎萃取蛋白质,通过离心回收上清液。将得到的上清液使用AKTAexpress层析系统(GE Healthcare,IL,US)以HisTrap FF柱(GEHealthcare)进行精制,通过Superdex20016/60柱(GE Healthcare)用缓冲液(20mM HEPESpH7.5,120mM NaCl,20%Glycerol,0.8mM DTT)进行洗脱。用SEC回收含有目标分子量的蛋白质的组分,以His-Avi-TEV-hSTING(139-342)人类野生型蛋白质、HisAviTEV-hSTING(139-342)人类REF变异型蛋白质、HisAviTEV-hSTING(139-342)人类AQ变异型蛋白质以及His-Avi-TEV-mSTING(138-341)小鼠野生型蛋白质的形式回收。蛋白质浓度使用Nanodrop2000(Thermo Fisher Scientific,MA,US)进行测定,在-80℃下冷冻保存直至使用。
将HisAviTEV-hSTING(139-342)人类野生型蛋白质的氨基酸序列示于序列号22、将HisAviTEV-hSTING(139-342)人类REF变异型蛋白质的氨基酸序列示于序列号23、将HisAviTEV-hSTING(139-342)人类AQ变异型蛋白质的氨基酸序列示于序列号24、将His-Avi-TEV-mSTING(138-341)小鼠野生型蛋白质的氨基酸序列示于序列号25。
(iii)STING结合试验
化合物与STING C末端结合域蛋白质的结合性通过以蛋白质的热变性温度上升为指标的Protein thermal shift assay来进行。
具体而言,在384孔的实时PCR板上使用分析缓冲液(20mM Tris-HCl pH 7.5,120mM NaCl),将3μL实验化合物(终浓度0.5mM)、3μL的SYPRO Orange Protein Gel Stein(Thermo Fisher Scientific)(终浓度20×浓度)和6μL的STING蛋白质混合,并用平板振荡器混合。使用实时PCR系统(Thermo Fisher Scientific),以每秒0.03℃的速度将温度从25℃升高到95℃,将SYPRO Orange发出的荧光作为指标测量蛋白质的热变性温度。获得的测量值使用分析软件Protein Thermal Shift软件(Thermo Fisher Scientific),求出Tm(the midpoint of the unfolding transition)(℃)作为荧光强度的增加速率显示最大值的温度。通过从各化合物的Tm值中减去不添加化合物的孔的Tm值,将实验化合物的Tm的位移计算为ΔTm(℃)。表2表示了对STING蛋白质的结合试验的结果。
[表2]
该结果清楚表明本申请化合物对于人类的野生型STING以及变异型STING、小鼠的野生型STING具有结合活性。
(试验例3)抗肿瘤试验(1)
小鼠:将5周龄的雌性BALB/c小鼠(BALB/cAnNCrlCrlj)(日本Charles River)在实验使用前在SPF条件下驯化4天以上。
测定、计算式:在所有的研究中,使用电子式数显卡尺(CD15-CX、Mitutoyo)每周测定2~3次肿瘤的长径以及短径,计算肿瘤体积(mm
肿瘤体积(mm
试验化合物通过生理食盐水(大塚制药工厂)稀释而使用。给药时在肿瘤内给药50μL。
使用从American Type Culture Collection公司购入的小鼠大肠癌细胞株CT26.WT(CRL2638)细胞。将CT26.WT细胞悬浮于生理食盐水中,将1.0×10
将结果表示于图7a以及图7b。图中的黑四方线表示媒液组、白四方线表示化合物编号6a给药组、白倒三角线表示化合物编号8b给药组、白圆形线表示化合物编号9b给药组。纵轴表示肿瘤体积(mm
如上所述,确认了基于环状二核苷酸衍生物的肿瘤内给药的抗肿瘤效果。
(试验例4)抗肿瘤试验(2)
制作了在从American Type Culture Collection公司购入的小鼠大肠癌细胞株CT26.WT(CRL2638)中导入了人类HER2基因的CT26.WT-hHER2细胞。具体而言,使用包含人类HER2的cDNA的质粒(Clone ID IOH82145;Thermo Fisher Scientific)使cDNA扩增,将其使用In-Fusion HD Cloning Kit(Clontech)插入到pQCXIN反转录病毒载体(Takara Bio)中。使用Lipofectamine 3000(Thermo Fisher Scientific)将人类HER2插入pQCXIN反转录病毒载体导入至EcoPack2-293细胞株(Takara Bio)中,回收上清液,使CT26.WT感染。细胞在添加250μg/mL Geneticin(Thermo Fisher Scientific)的培养基中维持。
抗体-CDN偶联物通过乙酸盐缓冲液(10mM Acetate Buffer,5%Sorbitol,pH5.5)(Nacalai Tesque)稀释使用。给药时,尾静脉给药200μL。
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
结果如图8所示。图中的黑四方线表示媒液组、白三角线表示参考例1中制作的改造抗HER2抗体偶联了实施例8b的化合物的抗HER2抗体-CDN偶联物(1)给药组、黑三角线表示参考例2中制作的改造抗LPS抗体同样地偶联了实施例8b的化合物的抗LPS抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
如上所述,确认到了基于抗HER2抗体-CDN偶联物(1)的静脉给药的抗体靶向依赖性的抗肿瘤效果。
(试验例5)抗肿瘤试验(3)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图9。图中的黑四方线表示媒液组、白四方线表示抗HER2抗体-CDN偶联物(2)给药组、白三角线表示抗HER2抗体-CDN偶联物(3)给药组。纵轴表示肿瘤体积(mm
综上所述,确认到抗HER2抗体-CDN偶联物的强抗肿瘤效果。
(试验例6)抗肿瘤试验(4)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图10。图中的黑四方线表示媒液组、白三角线表示抗HER2抗体-CDN偶联物(19)给药组。抗HER2抗体-CDN偶联物(19)的药物连接子与抗体通过半胱氨酸偶联进行结合。纵轴表示肿瘤体积(mm
综上所述,确认到了将抗体和药物连接子半胱氨酸偶联的抗HER2抗体-CDN偶联物的强抗肿瘤效果。
(试验例7)抗肿瘤试验(5)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图11。图中的黑四方线表示媒液组、白三角线表示抗HER2抗体-CDN偶联物(9)给药组、白倒三角线表示抗HER2抗体-CDN偶联物(10)给药组、白菱形线表示抗HER2抗体-CDN偶联物(11)给药组、白圆形线表示抗HER2抗体-CDN偶联物(12)给药组、白四方线表示抗HER2抗体-CDN偶联物(1)给药组。抗HER2抗体-CDN偶联物(9)、(10)、(11)、(12)以及(1)分别用不同的连接子将实施例8b的化合物偶联。纵轴表示肿瘤体积(mm
如上所述,确认到抗HER2抗体-CDN偶联物即使改变了连接子,也会显示抗肿瘤效果。
(试验例8)抗肿瘤试验(6)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图12。图中的黑四方线表示媒液组、白三角线表示抗HER2抗体2-CDN偶联物(1)的60μg给药组、黑倒三角线表示抗HER2抗体2的59μg给药组、黑圆形线表示化合物编号8b的1.2μg给药组。抗HER2抗体2以及化合物编号8b的给药量为构成抗HER2抗体2-CDN偶联物(1)的各成分的当量。纵轴表示肿瘤体积(mm
综上所述,抗HER2抗体2-CDN偶联物(1)显示了抗肿瘤效果,当量的抗HER2抗体2以及化合物编号8b在尾静脉给药中没有显示抗肿瘤效果。
(试验例9)抗肿瘤试验(7)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图13(a)~(c)。图中的黑四方线表示媒液组、各白符号线表示评价的各抗HER2抗体2-CDN偶联物(2)、(3)、(4)、(5)、(6)、(7)以及(8)给药组。纵轴表示肿瘤体积(mm
综上所述,确认了抗HER2抗体2-CDN偶联物的强抗肿瘤效果。
(试验例10)抗肿瘤试验(8)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图14。图中的黑四方线表示媒液组、白三角线表示抗HER2抗体2-CDN偶联物(9)给药组、白圆形线表示抗HER2抗体2-CDN偶联物(10)给药组。抗HER2抗体2-CDN偶联物(9)以及(10)是使用了药物平均结合数为约2的MSG型糖链重构抗体的抗体-CDN偶联物。纵轴表示肿瘤体积(mm
综上所述,确认到药物平均结合数为约2的抗HER2抗体2-CDN偶联物的强抗肿瘤效果。
(试验例11)抗肿瘤试验(9)
制作在从American Type Culture Collection公司购入的小鼠大肠癌细胞株CT26.WT(CRL2638)中导入了人类EphA2基因的CT26.WT-hEphA2细胞。详细而言,使用包含人类EphA2的cDNA的pDONR221(Thermo Fisher Scientific)对cDNA进行扩增,将其使用Gateway vector conversion system(Thermo Fisher Scientific)插入pLNCX反转录病毒载体(Takara Bio)中。将人类EphA2插入pLNCX反转录病毒载体使用Lipofectamine 2000(Thermo Fisher Scientific)导入EcoPack2-293细胞株(Takara Bio)中,回收上清液,使CT26.WT感染。细胞在添加500μg/mL Geneticin(Thermo Fisher Scientific)的培养基中维持。
将CT26.WT-hEphA2细胞悬浮于磷酸盐缓冲液中,将1.9×10
将结果表示于图15。图中的黑四方线表示媒液组、白圆形线表示抗EphA2抗体给药组、白三角线表示抗EphA2抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
综上所述,使用抗EphA2抗体没有显示抗肿瘤效果的模型,确认了抗EphA2抗体-CDN偶联物的强抗肿瘤效果。
(试验例12)抗肿瘤试验(10)
制作在从American Type Culture Collection公司购入的小鼠淋巴细胞样细胞株P388D1(CCL-46)中导入了人类CD33基因的P388D1-hCD33细胞。详细而言,制作插入了人类CD33的cDNA的pLVSIN慢病毒(Lentivirus)载体(Takara Bio),使用Lentiviral HighTiter Packaging Mix(Takara Bio)导入Lenti-X293T细胞株(Takara Bio)中,回收上清液,使P388D1感染。细胞在添加2μg/mL Puromycin(Thermo Fisher Scientific)的培养基中维持。
对于小鼠,购入4周龄的雌性DBA/2小鼠(DBA/2NCrl)(日本Charles River),在实验使用前在SPF条件下驯化5天。
将P388D1-hCD33细胞悬浮于磷酸盐缓冲液中,将1.0×10
将结果表示于图16。图中的黑四方线表示媒液组、白圆形线表示抗CD33抗体给药组、白三角线表示抗CD33抗体-CDN偶联物(1)给药组。纵轴表示肿瘤体积(mm
综上所述,使用抗CD33抗体未显示抗肿瘤效果的模型,确认到了抗CD33抗体-CDN偶联物的强抗肿瘤效果。
(试验例13)抗肿瘤试验(11)
将CT26.WT-hHER2细胞悬浮于生理食盐水中,将5.0×10
将结果表示于图22。图中的黑四方线表示媒液组、白三角线表示抗HER2抗体2-CDN偶联物(11)给药组、白圆形线表示抗HER2抗体2-CDN偶联物(12)给药组。与抗HER2抗体2-CDN偶联物(11)以及(12)偶联的化合物编号52a以及52b为具有磷酸基的CDN。纵轴表示肿瘤体积(mm
综上所述,确认到偶联了具有磷酸基的CDN的抗HER2抗体2-CDN偶联物(11)以及(12)的强抗肿瘤效果。
产业上的可利用性
根据本发明可以提供一种具有较强的STING激动剂活性,显示强抗肿瘤效果的新型CDN衍生物。另外,基于本发明可以提供包含该新型CDN衍生物的抗体药物偶联物。这些作为STING激动剂活性关联的疾病(例如,癌)的治疗剂是有用的。
序列表自由文本
序列号1:曲妥珠单抗的轻链的氨基酸序列
序列号2:曲妥珠单抗的重链的氨基酸序列
序列号3:改造抗HER2抗体的重链的氨基酸序列
序列号4:人类H232(REF)变异型STING的氨基酸序列
序列号5:人类H232(REF)变异型STING的核苷酸序列
序列号6:人类野生型STING的氨基酸序列
序列号7:人类野生型STING的核苷酸序列
序列号8:人类HAQ变异型STING的氨基酸序列
序列号9:人类HAQ变异型STING的核苷酸序列
序列号10:小鼠STING的氨基酸序列
序列号11:小鼠STING的核苷酸序列
序列号12~21:引物的序列
序列号22:HisAviTEV-hSTING(139-342)人类野生型蛋白质的氨基酸序列
序列号23:HisAviTEV-hSTING(139-342)人类REF变异型蛋白质的氨基酸序列
序列号24:HisAviTEV-hSTING(139-342)人类AQ变异型蛋白质的氨基酸序列
序列号25:His-Avi-TEV-mSTING(138-341)小鼠野生型蛋白质的氨基酸序列
序列号26:改造抗LPS抗体的轻链的氨基酸序列
序列号27:改造抗LPS抗体的重链的氨基酸序列
序列号28:帕妥珠单抗轻链的氨基酸序列
序列号29:帕妥珠单抗重链的氨基酸序列
序列号30:改造抗HER2抗体2的重链的氨基酸序列
序列号31:抗CD33抗体轻链的氨基酸序列
序列号32:抗CD33抗体重链的氨基酸序列
序列号33:抗EphA2抗体轻链的氨基酸序列
序列号34:抗EphA2抗体重链的氨基酸序列
序列号35:抗CDH6抗体轻链的氨基酸序列
序列号36:抗CDH6抗体重链的氨基酸序列。
序列表
<110> 第一三共株式会社
<120> 新型环状二核苷酸衍生物及其抗体药物偶联物
<130> SAP-855-PCT
<141> 2019-09-06
<150> JP 2018167369
<151> 2018-09-06
<160> 36
<170> PatentIn 版本 3.5
<210> 1
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 曲妥珠单抗 轻链
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 2
<211> 450
<212> PRT
<213> 人工序列
<220>
<223> 曲妥珠单抗 重链
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 3
<211> 450
<212> PRT
<213> 人工序列
<220>
<223> 改造 HER2 抗体 重链
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 4
<211> 379
<212> PRT
<213> 智人
<400> 4
Met Pro His Ser Ser Leu His Pro Ser Ile Pro Cys Pro Arg Gly His
1 5 10 15
Gly Ala Gln Lys Ala Ala Leu Val Leu Leu Ser Ala Cys Leu Val Thr
20 25 30
Leu Trp Gly Leu Gly Glu Pro Pro Glu His Thr Leu Arg Tyr Leu Val
35 40 45
Leu His Leu Ala Ser Leu Gln Leu Gly Leu Leu Leu Asn Gly Val Cys
50 55 60
Ser Leu Ala Glu Glu Leu Arg His Ile His Ser Arg Tyr Arg Gly Ser
65 70 75 80
Tyr Trp Arg Thr Val Arg Ala Cys Leu Gly Cys Pro Leu Arg Arg Gly
85 90 95
Ala Leu Leu Leu Leu Ser Ile Tyr Phe Tyr Tyr Ser Leu Pro Asn Ala
100 105 110
Val Gly Pro Pro Phe Thr Trp Met Leu Ala Leu Leu Gly Leu Ser Gln
115 120 125
Ala Leu Asn Ile Leu Leu Gly Leu Lys Gly Leu Ala Pro Ala Glu Ile
130 135 140
Ser Ala Val Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala
145 150 155 160
Trp Ser Tyr Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln
165 170 175
Ala Arg Ile Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly
180 185 190
Ala Val Ser Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val
195 200 205
Pro Asp Asn Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys
210 215 220
Leu Pro Gln Gln Thr Gly Asp Arg Ala Gly Ile Lys Asp Arg Val Tyr
225 230 235 240
Ser Asn Ser Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr
245 250 255
Cys Val Leu Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser
260 265 270
Gln Tyr Ser Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala
275 280 285
Lys Leu Phe Cys Arg Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu
290 295 300
Ser Gln Asn Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp
305 310 315 320
Ser Ser Phe Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu
325 330 335
Glu Lys Glu Glu Val Thr Val Gly Ser Leu Lys Thr Ser Ala Val Pro
340 345 350
Ser Thr Ser Thr Met Ser Gln Glu Pro Glu Leu Leu Ile Ser Gly Met
355 360 365
Glu Lys Pro Leu Pro Leu Arg Thr Asp Phe Ser
370 375
<210> 5
<211> 1140
<212> DNA
<213> 智人
<400> 5
atgccccact ccagcctgca tccatccatc ccgtgtccca ggggtcacgg ggcccagaag 60
gcagccttgg ttctgctgag tgcctgcctg gtgacccttt gggggctagg agagccacca 120
gagcacactc tccggtacct ggtgctccac ctagcctccc tgcagctggg actgctgtta 180
aacggggtct gcagcctggc tgaggagctg cgccacatcc actccaggta ccggggcagc 240
tactggagga ctgtgcgggc ctgcctgggc tgccccctcc gccgtggggc cctgttgctg 300
ctgtccatct atttctacta ctccctccca aatgcggtcg gcccgccctt cacttggatg 360
cttgccctcc tgggcctctc gcaggcactg aacatcctcc tgggcctcaa gggcctggcc 420
ccagctgaga tctctgcagt gtgtgaaaaa gggaatttca acgtggccca tgggctggca 480
tggtcatatt acatcggata tctgcggctg atcctgccag agctccaggc ccggattcga 540
acttacaatc agcattacaa caacctgcta cggggtgcag tgagccagcg gctgtatatt 600
ctcctcccat tggactgtgg ggtgcctgat aacctgagta tggctgaccc caacattcgc 660
ttcctggata aactgcccca gcagaccggt gaccatgctg gcatcaagga tcgggtttac 720
agcaacagca tctatgagct tctggagaac gggcagcggg cgggcacctg tgtcctggag 780
tacgccaccc ccttgcagac tttgtttgcc atgtcacaat acagtcaagc tggctttagc 840
cgggaggata ggcttgagca ggccaaactc ttctgccgga cacttgagga catcctggca 900
gatgcccctg agtctcagaa caactgccgc ctcattgcct accaggaacc tgcagatgac 960
agcagcttct cgctgtccca ggaggttctc cggcacctgc ggcaggagga aaaggaagag 1020
gttactgtgg gcagcttgaa gacctcagcg gtgcccagta cctccacgat gtcccaagag 1080
cctgagctcc tcatcagtgg aatggaaaag cccctccctc tccgcacgga tttctcttag 1140
<210> 6
<211> 379
<212> PRT
<213> 智人
<400> 6
Met Pro His Ser Ser Leu His Pro Ser Ile Pro Cys Pro Arg Gly His
1 5 10 15
Gly Ala Gln Lys Ala Ala Leu Val Leu Leu Ser Ala Cys Leu Val Thr
20 25 30
Leu Trp Gly Leu Gly Glu Pro Pro Glu His Thr Leu Arg Tyr Leu Val
35 40 45
Leu His Leu Ala Ser Leu Gln Leu Gly Leu Leu Leu Asn Gly Val Cys
50 55 60
Ser Leu Ala Glu Glu Leu Arg His Ile His Ser Arg Tyr Arg Gly Ser
65 70 75 80
Tyr Trp Arg Thr Val Arg Ala Cys Leu Gly Cys Pro Leu Arg Arg Gly
85 90 95
Ala Leu Leu Leu Leu Ser Ile Tyr Phe Tyr Tyr Ser Leu Pro Asn Ala
100 105 110
Val Gly Pro Pro Phe Thr Trp Met Leu Ala Leu Leu Gly Leu Ser Gln
115 120 125
Ala Leu Asn Ile Leu Leu Gly Leu Lys Gly Leu Ala Pro Ala Glu Ile
130 135 140
Ser Ala Val Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala
145 150 155 160
Trp Ser Tyr Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln
165 170 175
Ala Arg Ile Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly
180 185 190
Ala Val Ser Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val
195 200 205
Pro Asp Asn Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys
210 215 220
Leu Pro Gln Gln Thr Gly Asp His Ala Gly Ile Lys Asp Arg Val Tyr
225 230 235 240
Ser Asn Ser Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr
245 250 255
Cys Val Leu Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser
260 265 270
Gln Tyr Ser Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala
275 280 285
Lys Leu Phe Cys Arg Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu
290 295 300
Ser Gln Asn Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp
305 310 315 320
Ser Ser Phe Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu
325 330 335
Glu Lys Glu Glu Val Thr Val Gly Ser Leu Lys Thr Ser Ala Val Pro
340 345 350
Ser Thr Ser Thr Met Ser Gln Glu Pro Glu Leu Leu Ile Ser Gly Met
355 360 365
Glu Lys Pro Leu Pro Leu Arg Thr Asp Phe Ser
370 375
<210> 7
<211> 1140
<212> DNA
<213> 智人
<400> 7
atgccccact ccagcctgca tccatccatc ccgtgtccca ggggtcacgg ggcccagaag 60
gcagccttgg ttctgctgag tgcctgcctg gtgacccttt gggggctagg agagccacca 120
gagcacactc tccggtacct ggtgctccac ctagcctccc tgcagctggg actgctgtta 180
aacggggtct gcagcctggc tgaggagctg cgccacatcc actccaggta ccggggcagc 240
tactggagga ctgtgcgggc ctgcctgggc tgccccctcc gccgtggggc cctgttgctg 300
ctgtccatct atttctacta ctccctccca aatgcggtcg gcccgccctt cacttggatg 360
cttgccctcc tgggcctctc gcaggcactg aacatcctcc tgggcctcaa gggcctggcc 420
ccagctgaga tctctgcagt gtgtgaaaaa gggaatttca acgtggccca tgggctggca 480
tggtcatatt acatcggata tctgcggctg atcctgccag agctccaggc ccggattcga 540
acttacaatc agcattacaa caacctgcta cggggtgcag tgagccagcg gctgtatatt 600
ctcctcccat tggactgtgg ggtgcctgat aacctgagta tggctgaccc caacattcgc 660
ttcctggata aactgcccca gcagaccggt gaccgtgctg gcatcaagga tcgggtttac 720
agcaacagca tctatgagct tctggagaac gggcagcggg cgggcacctg tgtcctggag 780
tacgccaccc ccttgcagac tttgtttgcc atgtcacaat acagtcaagc tggctttagc 840
cgggaggata ggcttgagca ggccaaactc ttctgccgga cacttgagga catcctggca 900
gatgcccctg agtctcagaa caactgccgc ctcattgcct accaggaacc tgcagatgac 960
agcagcttct cgctgtccca ggaggttctc cggcacctgc ggcaggagga aaaggaagag 1020
gttactgtgg gcagcttgaa gacctcagcg gtgcccagta cctccacgat gtcccaagag 1080
cctgagctcc tcatcagtgg aatggaaaag cccctccctc tccgcacgga tttctcttag 1140
<210> 8
<211> 379
<212> PRT
<213> 智人
<400> 8
Met Pro His Ser Ser Leu His Pro Ser Ile Pro Cys Pro Arg Gly His
1 5 10 15
Gly Ala Gln Lys Ala Ala Leu Val Leu Leu Ser Ala Cys Leu Val Thr
20 25 30
Leu Trp Gly Leu Gly Glu Pro Pro Glu His Thr Leu Arg Tyr Leu Val
35 40 45
Leu His Leu Ala Ser Leu Gln Leu Gly Leu Leu Leu Asn Gly Val Cys
50 55 60
Ser Leu Ala Glu Glu Leu His His Ile His Ser Arg Tyr Arg Gly Ser
65 70 75 80
Tyr Trp Arg Thr Val Arg Ala Cys Leu Gly Cys Pro Leu Arg Arg Gly
85 90 95
Ala Leu Leu Leu Leu Ser Ile Tyr Phe Tyr Tyr Ser Leu Pro Asn Ala
100 105 110
Val Gly Pro Pro Phe Thr Trp Met Leu Ala Leu Leu Gly Leu Ser Gln
115 120 125
Ala Leu Asn Ile Leu Leu Gly Leu Lys Gly Leu Ala Pro Ala Glu Ile
130 135 140
Ser Ala Val Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala
145 150 155 160
Trp Ser Tyr Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln
165 170 175
Ala Arg Ile Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly
180 185 190
Ala Val Ser Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val
195 200 205
Pro Asp Asn Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys
210 215 220
Leu Pro Gln Gln Thr Ala Asp Arg Ala Gly Ile Lys Asp Arg Val Tyr
225 230 235 240
Ser Asn Ser Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr
245 250 255
Cys Val Leu Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser
260 265 270
Gln Tyr Ser Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala
275 280 285
Lys Leu Phe Cys Gln Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu
290 295 300
Ser Gln Asn Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp
305 310 315 320
Ser Ser Phe Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu
325 330 335
Glu Lys Glu Glu Val Thr Val Gly Ser Leu Lys Thr Ser Ala Val Pro
340 345 350
Ser Thr Ser Thr Met Ser Gln Glu Pro Glu Leu Leu Ile Ser Gly Met
355 360 365
Glu Lys Pro Leu Pro Leu Arg Thr Asp Phe Ser
370 375
<210> 9
<211> 1140
<212> DNA
<213> 智人
<400> 9
atgccccact ccagcctgca tccatccatc ccgtgtccca ggggtcacgg ggcccagaag 60
gcagccttgg ttctgctgag tgcctgcctg gtgacccttt gggggctagg agagccacca 120
gagcacactc tccggtacct ggtgctccac ctagcctccc tgcagctggg actgctgtta 180
aacggggtct gcagcctggc tgaggagctg caccacatcc actccaggta ccggggcagc 240
tactggagga ctgtgcgggc ctgcctgggc tgccccctcc gccgtggggc cctgttgctg 300
ctgtccatct atttctacta ctccctccca aatgcggtcg gcccgccctt cacttggatg 360
cttgccctcc tgggcctctc gcaggcactg aacatcctcc tgggcctcaa gggcctggcc 420
ccagctgaga tctctgcagt gtgtgaaaaa gggaatttca acgtggccca tgggctggca 480
tggtcatatt acatcggata tctgcggctg atcctgccag agctccaggc ccggattcga 540
acttacaatc agcattacaa caacctgcta cggggtgcag tgagccagcg gctgtatatt 600
ctcctcccat tggactgtgg ggtgcctgat aacctgagta tggctgaccc caacattcgc 660
ttcctggata aactgcccca gcagaccgct gaccgtgctg gcatcaagga tcgggtttac 720
agcaacagca tctatgagct tctggagaac gggcagcggg cgggcacctg tgtcctggag 780
tacgccaccc ccttgcagac tttgtttgcc atgtcacaat acagtcaagc tggctttagc 840
cgggaggata ggcttgagca ggccaaactc ttctgccaga cacttgagga catcctggca 900
gatgcccctg agtctcagaa caactgccgc ctcattgcct accaggaacc tgcagatgac 960
agcagcttct cgctgtccca ggaggttctc cggcacctgc ggcaggagga aaaggaagag 1020
gttactgtgg gcagcttgaa gacctcagcg gtgcccagta cctccacgat gtcccaagag 1080
cctgagctcc tcatcagtgg aatggaaaag cccctccctc tccgcacgga tttctcttag 1140
<210> 10
<211> 378
<212> PRT
<213> 小鼠
<400> 10
Met Pro Tyr Ser Asn Leu His Pro Ala Ile Pro Arg Pro Arg Gly His
1 5 10 15
Arg Ser Lys Tyr Val Ala Leu Ile Phe Leu Val Ala Ser Leu Met Ile
20 25 30
Leu Trp Val Ala Lys Asp Pro Pro Asn His Thr Leu Lys Tyr Leu Ala
35 40 45
Leu His Leu Ala Ser His Glu Leu Gly Leu Leu Leu Lys Asn Leu Cys
50 55 60
Cys Leu Ala Glu Glu Leu Cys His Val Gln Ser Arg Tyr Gln Gly Ser
65 70 75 80
Tyr Trp Lys Ala Val Arg Ala Cys Leu Gly Cys Pro Ile His Cys Met
85 90 95
Ala Met Ile Leu Leu Ser Ser Tyr Phe Tyr Phe Leu Gln Asn Thr Ala
100 105 110
Asp Ile Tyr Leu Ser Trp Met Phe Gly Leu Leu Val Leu Tyr Lys Ser
115 120 125
Leu Ser Met Leu Leu Gly Leu Gln Ser Leu Thr Pro Ala Glu Val Ser
130 135 140
Ala Val Cys Glu Glu Lys Lys Leu Asn Val Ala His Gly Leu Ala Trp
145 150 155 160
Ser Tyr Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Gly Leu Gln Ala
165 170 175
Arg Ile Arg Met Phe Asn Gln Leu His Asn Asn Met Leu Ser Gly Ala
180 185 190
Gly Ser Arg Arg Leu Tyr Ile Leu Phe Pro Leu Asp Cys Gly Val Pro
195 200 205
Asp Asn Leu Ser Val Val Asp Pro Asn Ile Arg Phe Arg Asp Met Leu
210 215 220
Pro Gln Gln Asn Ile Asp Arg Ala Gly Ile Lys Asn Arg Val Tyr Ser
225 230 235 240
Asn Ser Val Tyr Glu Ile Leu Glu Asn Gly Gln Pro Ala Gly Val Cys
245 250 255
Ile Leu Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser Gln
260 265 270
Asp Ala Lys Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala Lys
275 280 285
Leu Phe Cys Arg Thr Leu Glu Glu Ile Leu Glu Asp Val Pro Glu Ser
290 295 300
Arg Asn Asn Cys Arg Leu Ile Val Tyr Gln Glu Pro Thr Asp Gly Asn
305 310 315 320
Ser Phe Ser Leu Ser Gln Glu Val Leu Arg His Ile Arg Gln Glu Glu
325 330 335
Lys Glu Glu Val Thr Met Asn Ala Pro Met Thr Ser Val Ala Pro Pro
340 345 350
Pro Ser Val Leu Ser Gln Glu Pro Arg Leu Leu Ile Ser Gly Met Asp
355 360 365
Gln Pro Leu Pro Leu Arg Thr Asp Leu Ile
370 375
<210> 11
<211> 1137
<212> DNA
<213> 小鼠
<400> 11
atgccatact ccaacctgca tccagccatc ccacggccca gaggtcaccg ctccaaatat 60
gtagccctca tctttctggt ggccagcctg atgatccttt gggtggcaaa ggatccacca 120
aatcacactc tgaagtacct agcacttcac ctagcctcgc acgaacttgg actactgttg 180
aaaaacctct gctgtctggc tgaagagctg tgccatgtcc agtccaggta ccagggcagc 240
tactggaagg ctgtgcgcgc ctgcctggga tgccccatcc actgtatggc tatgattcta 300
ctatcgtctt atttctattt cctccaaaac actgctgaca tatacctcag ttggatgttt 360
ggccttctgg tcctctataa gtccctaagc atgctcctgg gccttcagag cttgactcca 420
gcggaagtct ctgcagtctg tgaagaaaag aagttaaatg ttgcccacgg gctggcctgg 480
tcatactaca ttgggtactt gcggttgatc ttaccagggc tccaggcccg gatccgaatg 540
ttcaatcagc tacataacaa catgctcagt ggtgcaggga gccgaagact gtacatcctc 600
tttccattgg actgtggggt gcctgacaac ctgagtgtag ttgaccccaa cattcgattc 660
cgagatatgc tgccccagca aaacatcgac cgtgctggca tcaagaatcg ggtttattcc 720
aacagcgtct acgagattct ggagaacgga cagccagcag gcgtctgtat cctggagtac 780
gccaccccct tgcagaccct gtttgccatg tcacaggatg ccaaagctgg cttcagtcgg 840
gaggatcggc ttgagcaggc taaactcttc tgccggacac ttgaggaaat cctggaagat 900
gtccccgagt ctcgaaataa ctgccgcctc attgtctacc aagaacccac agacggaaac 960
agtttctcac tgtctcagga ggtgctccgg cacattcgtc aggaagaaaa ggaggaggtt 1020
accatgaatg cccccatgac ctcagtggca cctcctccct ccgtactgtc ccaagagcca 1080
agactcctca tcagtggtat ggatcagcct ctcccactcc gcactgacct catctga 1137
<210> 12
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 12
cgtgctggca tcaaggatcg ggtttac 27
<210> 13
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 13
gtcaccggtc tgctggggca gtttatc 27
<210> 14
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 14
gctgaccgtg ctggcatcaa ggatcgggtt tac 33
<210> 15
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 15
ggtctgctgg ggcagtttat ccagg 25
<210> 16
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 16
caccacatcc actccaggta ccgg 24
<210> 17
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 17
cagctcctca gccaggctgc agac 24
<210> 18
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 18
cagacacttg aggacatcct ggcag 25
<210> 19
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 19
gcagaagagt ttggcctgct caa 23
<210> 20
<211> 39
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 20
acctgtattt tcagggcctg gccccagctg agatctctg 39
<210> 21
<211> 44
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 21
cagaattcgc aagcttttaa gtaacctctt ccttttcctc ctgc 44
<210> 22
<211> 243
<212> PRT
<213> 人工序列
<220>
<223> HisAviTEV-hSTING (139-342) 人类 WT
<400> 22
Met Gly Ser Ser His His His His His His Ser Ser Gly Ser Gly Leu
1 5 10 15
Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu Gly Gly Ser
20 25 30
Glu Asn Leu Tyr Phe Gln Gly Leu Ala Pro Ala Glu Ile Ser Ala Val
35 40 45
Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala Trp Ser Tyr
50 55 60
Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln Ala Arg Ile
65 70 75 80
Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly Ala Val Ser
85 90 95
Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val Pro Asp Asn
100 105 110
Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys Leu Pro Gln
115 120 125
Gln Thr Gly Asp Arg Ala Gly Ile Lys Asp Arg Val Tyr Ser Asn Ser
130 135 140
Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr Cys Val Leu
145 150 155 160
Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser Gln Tyr Ser
165 170 175
Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala Lys Leu Phe
180 185 190
Cys Arg Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu Ser Gln Asn
195 200 205
Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp Ser Ser Phe
210 215 220
Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu Glu Lys Glu
225 230 235 240
Glu Val Thr
<210> 23
<211> 243
<212> PRT
<213> 人工序列
<220>
<223> HisAviTEV-hSTING (139-342) 人类 REF 突变体
<400> 23
Met Gly Ser Ser His His His His His His Ser Ser Gly Ser Gly Leu
1 5 10 15
Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu Gly Gly Ser
20 25 30
Glu Asn Leu Tyr Phe Gln Gly Leu Ala Pro Ala Glu Ile Ser Ala Val
35 40 45
Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala Trp Ser Tyr
50 55 60
Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln Ala Arg Ile
65 70 75 80
Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly Ala Val Ser
85 90 95
Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val Pro Asp Asn
100 105 110
Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys Leu Pro Gln
115 120 125
Gln Thr Gly Asp His Ala Gly Ile Lys Asp Arg Val Tyr Ser Asn Ser
130 135 140
Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr Cys Val Leu
145 150 155 160
Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser Gln Tyr Ser
165 170 175
Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala Lys Leu Phe
180 185 190
Cys Arg Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu Ser Gln Asn
195 200 205
Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp Ser Ser Phe
210 215 220
Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu Glu Lys Glu
225 230 235 240
Glu Val Thr
<210> 24
<211> 243
<212> PRT
<213> 人工序列
<220>
<223> HisAviTEV-hSTING (139-342) 人类 AQ 突变体
<400> 24
Met Gly Ser Ser His His His His His His Ser Ser Gly Ser Gly Leu
1 5 10 15
Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu Gly Gly Ser
20 25 30
Glu Asn Leu Tyr Phe Gln Gly Leu Ala Pro Ala Glu Ile Ser Ala Val
35 40 45
Cys Glu Lys Gly Asn Phe Asn Val Ala His Gly Leu Ala Trp Ser Tyr
50 55 60
Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Glu Leu Gln Ala Arg Ile
65 70 75 80
Arg Thr Tyr Asn Gln His Tyr Asn Asn Leu Leu Arg Gly Ala Val Ser
85 90 95
Gln Arg Leu Tyr Ile Leu Leu Pro Leu Asp Cys Gly Val Pro Asp Asn
100 105 110
Leu Ser Met Ala Asp Pro Asn Ile Arg Phe Leu Asp Lys Leu Pro Gln
115 120 125
Gln Thr Ala Asp Arg Ala Gly Ile Lys Asp Arg Val Tyr Ser Asn Ser
130 135 140
Ile Tyr Glu Leu Leu Glu Asn Gly Gln Arg Ala Gly Thr Cys Val Leu
145 150 155 160
Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser Gln Tyr Ser
165 170 175
Gln Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala Lys Leu Phe
180 185 190
Cys Gln Thr Leu Glu Asp Ile Leu Ala Asp Ala Pro Glu Ser Gln Asn
195 200 205
Asn Cys Arg Leu Ile Ala Tyr Gln Glu Pro Ala Asp Asp Ser Ser Phe
210 215 220
Ser Leu Ser Gln Glu Val Leu Arg His Leu Arg Gln Glu Glu Lys Glu
225 230 235 240
Glu Val Thr
<210> 25
<211> 243
<212> PRT
<213> 人工序列
<220>
<223> HisAviTEV-hSTING (139-342) 小鼠 WT
<400> 25
Met Gly Ser Ser His His His His His His Ser Ser Gly Ser Gly Leu
1 5 10 15
Asn Asp Ile Phe Glu Ala Gln Lys Ile Glu Trp His Glu Gly Gly Ser
20 25 30
Glu Asn Leu Tyr Phe Gln Gly Leu Thr Pro Ala Glu Val Ser Ala Val
35 40 45
Cys Glu Glu Lys Lys Leu Asn Val Ala His Gly Leu Ala Trp Ser Tyr
50 55 60
Tyr Ile Gly Tyr Leu Arg Leu Ile Leu Pro Gly Leu Gln Ala Arg Ile
65 70 75 80
Arg Met Phe Asn Gln Leu His Asn Asn Met Leu Ser Gly Ala Gly Ser
85 90 95
Arg Arg Leu Tyr Ile Leu Phe Pro Leu Asp Cys Gly Val Pro Asp Asn
100 105 110
Leu Ser Val Val Asp Pro Asn Ile Arg Phe Arg Asp Met Leu Pro Gln
115 120 125
Gln Asn Ile Asp Arg Ala Gly Ile Lys Asn Arg Val Tyr Ser Asn Ser
130 135 140
Val Tyr Glu Ile Leu Glu Asn Gly Gln Pro Ala Gly Val Cys Ile Leu
145 150 155 160
Glu Tyr Ala Thr Pro Leu Gln Thr Leu Phe Ala Met Ser Gln Asp Ala
165 170 175
Lys Ala Gly Phe Ser Arg Glu Asp Arg Leu Glu Gln Ala Lys Leu Phe
180 185 190
Cys Arg Thr Leu Glu Glu Ile Leu Glu Asp Val Pro Glu Ser Arg Asn
195 200 205
Asn Cys Arg Leu Ile Val Tyr Gln Glu Pro Thr Asp Gly Asn Ser Phe
210 215 220
Ser Leu Ser Gln Glu Val Leu Arg His Ile Arg Gln Glu Glu Lys Glu
225 230 235 240
Glu Val Thr
<210> 26
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 改造 LPS 抗体 轻链
<400> 26
Asn Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Ser Cys Lys Ala Ser Glu Asn Val Gly Asn Ser
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 27
<211> 451
<212> PRT
<213> 人工序列
<220>
<223> 改造 LPS 抗体 重链
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Arg Ser Ser Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Val Tyr Tyr Asp His Val Gly Tyr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 28
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> 帕妥珠单抗 轻链
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 29
<211> 449
<212> PRT
<213> 人工序列
<220>
<223> 帕妥珠单抗 重链
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 30
<211> 449
<212> PRT
<213> 人工序列
<220>
<223> 改造 HER2 抗体2 重链
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 31
<211> 218
<212> PRT
<213> 人工序列
<220>
<223> 抗CD33 抗体 轻链
<400> 31
Asp Ile Gln Leu Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Leu Asp Asn Tyr
20 25 30
Gly Ile Arg Phe Leu Thr Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Met Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Lys
85 90 95
Glu Val Pro Trp Ser Phe Gly Gln Gly Thr Lys Val Glu Val Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 32
<211> 446
<212> PRT
<213> 人工序列
<220>
<223> 抗CD33 抗体 重链
<400> 32
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile Thr Asp Ser
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Gly Gly Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Lys Asn Arg Ala Thr Leu Thr Val Asp Asn Pro Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Phe Tyr Tyr Cys
85 90 95
Val Asn Gly Asn Pro Trp Leu Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 33
<211> 219
<212> PRT
<213> 人工序列
<220>
<223> 抗EphA2 抗体 轻链
<400> 33
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Ser Gly Ile Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 34
<211> 449
<212> PRT
<213> 人工序列
<220>
<223> 抗EphA2 抗体 重链
<400> 34
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ile Asp Tyr
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ser Asp Asp Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Tyr Tyr Arg Tyr Glu Arg Asp Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 35
<211> 213
<212> PRT
<213> 人工序列
<220>
<223> 抗CDH6 抗体 轻链
<400> 35
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Ile Tyr Lys Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Asn Thr Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Tyr Tyr Ser Gly Trp Ala
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 36
<211> 452
<212> PRT
<213> 人工序列
<220>
<223> 抗CDH6 抗体 重链
<400> 36
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Asn
20 25 30
Phe Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Glu Thr Glu Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Tyr Gly Gly Phe Ala Gly Gly Tyr Phe Asp Phe Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
- 新型环状二核苷酸衍生物及其抗体药物偶联物
- 环状二核苷酸类似物、其药物组合物及应用
