用于治疗血癌的组合疗法
文献发布时间:2023-06-19 10:48:02
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求于2018年9月18日提交的第62/732,816号美国临时专利申请的权益,所述美国临时专利申请通过援引整体并入本文。
背景
技术领域
本公开内容提供了用于治疗血癌,特别是急性骨髓性白血病的组合疗法。
急性骨髓性白血病(AML)的特征在于白血病干细胞(LSC)和骨髓前体细胞(母细胞)的克隆性扩增,导致造血功能受损和骨髓(BM)衰竭(1-3)。它是高度异质性的,具有多达9个遗传学改变的独立类别(1,2,4-6)。尽管最近在确认分子和遗传亚型方面取得了重大进展,但在过去的40年中,AML疗法和长期患者的结果没有显著改善(3,4,7)。因此,5年存活率对于<60岁的患者保持在小于40%,而对于更年老的患者仅为10%至20%(1,8)。尽管标准的诱导化学疗法(例如蒽环类或阿糖胞苷类)在大多数患者中导致骨髓母细胞的初始减少,但目前可用的治疗均非治愈性的。耐药性和复发仍然是治疗失败的主要原因,突出了对更有效疗法的需要(9-11)。此外,已经证明来自人血癌的LSC及其祖细胞对目前的疗法高度耐受,这在许多患者中保持了复发的可能性(12-17)。因此,AML迫切需要改善的疗法。
发明内容
本公开内容涉及提供优于目前可用的疗法的治疗结果的组合疗法。各种实施方案涉及在有需要的对象中治疗血癌(例如,AML)的方法,所述方法包括向所述对象施用至少一种TAM家族激酶抑制剂(例如,Axl抑制剂)与至少一种BCL-2家族蛋白抑制剂的组合。有利地,与单独施用的单一疗法相比,本文公开的组合疗法被证明为提供了更多的叠加效力和协同治疗效果。
在一个实施方案中,在组合疗法中使用的TAM家族激酶抑制剂是有效的Axl抑制剂。
在更具体的实施方案中,所述Axl抑制剂是式(I)的化合物,其立体异构体、对映异构体或互变异构体,其药物可接受的盐或其药物组合物:
其中,
A、A
R
R
每个R
R
在优选的实施方案中,所述Axl抑制剂是3-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺(化合物A):
在另一个实施方案中,所述BCL-2家族蛋白抑制剂是式(II)的化合物:
其中
n是0或1;
R
R
R
Y
在更具体的实施方案中,所述BCL-2抑制剂是维奈托克(Venetoclax)(
在更具体的实施方案中,所述组合疗法包括Axl抑制剂和BCL-2家族蛋白抑制剂的相伴施用来治疗血癌,包括例如白血病、淋巴瘤或骨髓瘤。在更具体的实施方案中,所述血癌是AML。
另一实施方案提供了能够确定式(I)的化合物与一种或多种化疗剂组合在预防、治疗或控制患者的血癌(例如AML)中的有效性的体内测定。
附图简述
图1A和图1B分别示出Axl/BCL-2抑制剂组合疗法针对Molm-13和MV4-11 AML细胞系的组合指数值。
图2A和图2B分别示出CD34+AML和富集干的CD34+CD38-AML的AML患者样品和正常骨髓(NBM)供体细胞的Axl的细胞表面表达。
图3A和图3B分别示出CD34+AML和富集干的CD34+CD38-AML的AML患者样品和NBM供体细胞的Axl的平均细胞表面表达。
图4A和图4B示出在用Axl抑制剂单一疗法、BCL-2抑制剂单一疗法和Axl/BCL-2抑制剂组合疗法治疗之前(图4A)和之后(图4B),来自AML的患者源性异种移植物(PDX)模型的小鼠的生物发光图像。
图5示出来自如每个患者同期组所指定的每个治疗组的AML的PDX模型的代表性安乐死小鼠的脾脏大小和重量。
图6A和图6B示出在AML的PDX模型中对来自每个治疗组的代表性安乐死小鼠的外周血(PB)中的转导的(GFP+)和未转导的(GFP-)人白血病细胞的移植的荧光激活的细胞分选(FACS)分析。
图6C和图6D示出在AML的PDX模型中来自每个治疗组的代表性安乐死小鼠的骨髓(BM)中的转导的(GFP+)和未转导的(GFP-)人白血病细胞的移植的荧光激活的细胞分选(FACS)分析
图7A和图7B分别示出治疗组同期组1和同期组2的AML的PDX模型中白血病小鼠的存活曲线。
图8A和图8B示出在用Axl抑制剂单一疗法、BCL-2抑制剂单一疗法和Axl/BCL-2组合疗法治疗之前(图8A)和治疗之后(图8B),AML的MV4-11细胞系异种移植物模型中的小鼠的生物发光图像。
图9A示出来自如指定的每个治疗组的AML的MV4-11细胞系异种移植物模型中的代表性安乐死小鼠的脾脏大小和重量。
图9B示出来自如指定的每个治疗组的AML的MV4-11细胞系异种移植物模型中的代表性安乐死小鼠的苏木精和曙红染色。
图10示出来自如指定的每个治疗组的AML的MV4-11细胞系异种移植物模型中的代表性小鼠的PB、BM、脾脏和肝脏中的白血病细胞移植的FACS分析。
图11示出指定的治疗小组的AML的MV4-11细胞系异种移植物模型中的白血病小鼠的存活曲线。
具体实施方式
本公开内容的各种实施方案涉及使用TAM家族激酶抑制剂(例如,Axl抑制剂)与BCL-2家族蛋白抑制剂组合用于治疗血癌,特别是急性骨髓性白血病(AML)的组合疗法。
GAS6/Axl信号传导是AML的发病机理和疗法耐受性的关键。用于治疗AML的一个候选靶标是Axl,它是受体酪氨酸激酶的TAM(TRYO3、Axl和MER)家族的成员(18,19)。有四个公认的TAMR配体:生长停滞特异性基因6(GAS6)、蛋白S、TUBBY和TUBBY样蛋白1(TULP1)(18,20)。有趣地,GAS6对Axl具有亚纳摩尔亲和力,并且是Axl的唯一活化配体。TAMR在许多实体瘤中过表达并且增强存活和对细胞凋亡的抗性(18,19)。Axl在介导癌细胞的迁移和侵袭中起关键作用。特别地,除了BCL-2和CD34的异常表达之外(18,21-23),已报道在一些AML和慢性骨髓性白血病(CML)患者中Axl和GAS6表达增加,这与较差的预后相关。通过证明通过shRNA或小分子抑制剂实现的Axl抑制在体外和体内增加细胞凋亡并且抑制AML/CML细胞系和患者细胞的增殖,也已经报道了其作为人类白血病的治疗靶标的潜在作用(21,23-25)。AML细胞刺激BM-衍生的基质细胞以上调GAS6,这增加AML细胞的化学抗性(21,23)。因此,靶向GAS6/Axl活性结果是AML中的合理的新治疗策略。用于治疗实体瘤和AML/CML的几种Axl和/或MER抑制剂处于各种发展阶段(19)。然而,许多是多激酶抑制剂;对健康造血细胞的脱靶作用和/或毒性仍然具有挑战性,并且大多数研究是用细胞系和未纯化的或CD34+大量AML细胞进行的(19,21,26,27)。关于GAS6/Axl途径是否在具有特定染色体异常或突变的AML患者的亚组中,或在可能表达最高水平的Axl和其它家族成员并因此对Axl抑制最敏感的某些亚群中被特异性激活知之甚少。Axl抑制剂是否可以使AML干细胞和祖细胞对化学疗法或靶向疗法敏感也是未知的,因为这些细胞对目前的抗癌疗法高度耐受(12-14,17)。
已知BCL-2蛋白家族是针对凋亡反应的重要关守。这组结构上相关的蛋白质包括彼此相互作用的促凋亡成员和抗凋亡成员。BCL-2和该蛋白家族的其它成员共有的氨基酸的短序列被称为BCL-2同源(BH)基序。在BCL-2家族成员的每一个中包含至少一个BH基序。这些基序部分地有助于每个成员的功能。BCL-2家族成员可分为3个功能组:抗凋亡蛋白(例如BCL-2)、促凋亡效应子和促凋亡激活子。临床前数据表明,仅含有单个BH3基序的激活子是针对诸如DNA损伤的应激的细胞应答中的重要介体。效应子是与线粒体膜密切相关的那些BCL-2蛋白,并且当被仅BH3激活子刺激时,促进线粒体膜中孔的形成,启动凋亡程序。肿瘤细胞可能为了存活而变得依赖于BCL-2。与其中肿瘤细胞为了存活而依赖单一显性基因的致癌基因成瘾类似,肿瘤细胞也可以为了存活而依赖于BCL-2。响应于应激信号,恶性细胞可以表达促凋亡激活子。一些癌细胞过表达BCL-2,这可以抑制这种促凋亡应答。结果在许多情况下是大量的促凋亡激活子被BCL-2结合和螯合。在这种情况下,癌细胞被认为是准备凋亡,因为它们可以含有如果从BCL-2离开则诱导程序性细胞死亡的足够量的促凋亡激活子。为了存活而以这种方式依赖于BCL-2的癌症可能对BCL-2调节敏感。
本公开内容描述了同时靶向Axl和BCL-2来治疗血癌,特别是AML的协同作用。通过同时将Axl抑制剂和BCL-2抑制剂施用于有需要的患者,该组合疗法提供了优于单一疗法或使用Axl抑制剂的其它当前组合疗法的治疗结果。
特别地,本文证明了其对急性骨髓性白血病模型的协同作用。如实施例所述,在急性骨髓性白血病的多种模型中观察到协同作用,包括体外和体内生物学测定,以及跨多种AML细胞系。
更具体地,使用Molm-13和MV4-11 AML细胞系,在体外测试Axl抑制剂(化合物A)与BCL-2抑制剂(ABT-199或ABT-263)的药物组合。相对于ABT-199或ABT-263单一疗法,当与化合物A组合时BCL-2敏感细胞系证实了对ABT-199和ABT-263的敏感性增加。数据的组合指数(CI)分析提供了小于1的指数,表明Axl抑制剂(化合物A)与BCL-2抑制剂(ABT-199或ABT-263)的两种组合分别对两种AML细胞系产生协同效应。参见例如,实施例1。
另外,在体内测定中证实Axl抑制剂(化合物A)与BCL-2抑制剂(ABT-199)的药物组合在靶向原始白血病细胞和/或预防白血病发展方面比单独的化合物A更有效。简而言之,在小鼠中使用来自AML患者的纯化的CD34+干细胞和祖细胞开发患者源性异种移植物模型测定,所述细胞用GFP/萤光素酶慢病毒报告基因转导,以允许小鼠的非侵入性体内成像(IVIS)来追踪白血病发展。令人惊讶地,化合物A/ABT-199组合在延迟和消除早期时间点的白血病发展方面高度有效,而单一药剂单一疗法显示出白血病进展。
经由荧光激活细胞分选(FACS)分析进一步检查安乐死的小鼠的脾肿大(增大的脾脏)和外周血(PB)和骨髓(BM)中白血病细胞的存在。组合疗法组的脾脏大小和重量与非白血病小鼠的脾脏大小和重量一致。相反,单一药剂单一疗法组证实增加的脾脏大小和重量。同样,相对于接受单一疗法的对象,组合疗法组证实PB和BM中白血病细胞的存在减少。另外,对照组和治疗组的存活曲线证实在组合疗法组与单一疗法组之间的显著差异(P<0.05)。总而言之,在用原代AML患者细胞的患者源性异种移植物(PDX)模型中,用化合物A和ABT-199的组合治疗降低了白血病负荷并且显著增强了白血病小鼠的存活。参见例如,实施例3。
此外,在动物模型中证实了Axl抑制剂(化合物A)与BCL-2抑制剂(ABT-199)的药物组合的功效和安全性。特别地,当与单独用化合物A或单独用ABT-199的单一疗法相比时,显示该组合在体内消除人白血病细胞是有效的。简而言之,使用用GFP/萤光素酶慢病毒载体转导的MV4-11细胞进行基于细胞系的异种移植小鼠研究,以允许分选/分析小鼠中的人白血病细胞和小鼠的非侵入性体内成像(IVIS),以追踪白血病发展和白血病形成位点。值得注意地,化合物A/ABT-199组合疗法在消除白血病发展方面高度有效,因为治疗之后观察到的生物发光信号低于检测阈值。相反地,虽然用化合物A的单一药剂单一疗法也降低了生物发光信号但在更小的程度上,而媒介物和ABT-199单一疗法均显示侵袭性白血病进展。经由荧光激活细胞分选(FACS)分析进一步检查安乐死的小鼠的脾脏(脾肿大)和肝脏白血病细胞浸润以及外周血(PB)、骨髓(BM)、脾脏和肝脏中白血病细胞的存在。组合疗法组以及化合物A单一疗法的脾脏大小和重量与非白血病小鼠的脾脏大小和重量一致。相反地,ABT-199单一疗法和媒介物(对照)组证实脾脏的大小和重量增加。类似地,相对于接受单一疗法的对象,FACS分析表明组合疗法组证实BM、PB、脾脏和肝脏中GFP转导的白血病细胞的存在急剧减少。另外,对照组和治疗组的存活曲线证实在组合疗法组与单一疗法组之间的显著差异(P<0.05)。总而言之,在这种MV4-11动物模型中,单独的化合物A治疗可以降低体内白血病增殖活性,并且这种抑制作用在与ABT-199组合治疗之后急剧增强。
因此,本文更详细地描述了用于治疗有需要的患者中的血癌的方法,该方法包括相伴地施用一种或多种Axl抑制剂与一种或多种BCL-2家族蛋白抑制剂(“BCL-2抑制剂”)。得到的治疗效果令人惊讶地大于单独使用每种类型的抑制剂的单一疗法的仅叠加效果。此类协同组合还伴有低毒性。
1.
适用于公开的组合疗法的Axl抑制剂是氨基吡啶衍生物,已知是TAM家族激酶抑制剂。参见例如,WO2015/081257。特别地,Axl抑制剂是具有式(I)的结构的化合物,或其立体异构体、对映异构体或互变异构体,其药物可接受的盐或其药物组合物:
其中
A、A
R
R
每个R
R
式(I)的化合物中,另一个实施方案提供式(Ia)的化合物:
其中,R
式(I)的化合物中,另一个实施方案提供式(Ib)的化合物:
其中,R
式(I)的化合物中,另一个实施方案提供式(Ic)的化合物:
其中,R
式(I)的化合物中,实施方案提供式(Id)的化合物:
其中:
R
式(I)的化合物中,另一个实施方案提供式(Ie)的化合物:
其中,R
式(I)的化合物中,另一个实施方案提供式(If)的化合物:
其中,R
在更具体的实施方案中,Axl抑制剂是如上所述的式(I)、式(Ia)、式(Ib)、式(Ic)、式(Id)、式(Ie)或式(If)的化合物,其中化合物选自选自:
4-(4-(6-氨基-5-(5-苯基噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-苯基噁唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(4-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-(4-氯苯基)噁唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
1-(4-(4-(6-氨基-5-(5-(4-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)乙酮;
(4-(4-(6-氨基-5-(5-(4-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(环丙基)甲酮;
3-(5-(3-氯苯基)噁唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
1-(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)乙酮;
3-(5-(3-氯苯基)噁唑-2-基)-5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(环丙基)甲酮;
(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(苯基)甲酮;
1-(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-2-苯基乙酮;
(4-(4-(6-氨基-5-(5-(4-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(苯基)甲酮;
1-(4-(4-(6-氨基-5-(5-(4-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-2-苯基乙酮;
3-(5-(4-氯苯基)噁唑-2-基)-5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
1-(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-2,2-二甲基丙-1-酮;
(4-(4-(6-氨基-5-(5-(3-氯苯基)噁唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(4-氟苯基)甲酮;
5-(1-(1-乙基哌啶-4-基)-1H-吡唑-4-基)-3-(5-苯基噁唑-2-基)吡啶-2-胺;
3-(5-苯基噁唑-2-基)-5-(1-(四氢-2吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(4-氯苯基)噁唑-2-基)-5-(1-(四氢-2吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(3-氯苯基)噁唑-2-基)-5-(1-环己基-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(4-氯苯基)噁唑-2-基)-5-(1-环己基-1H-吡唑-4-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(5-苯基噁唑-2-基)吡啶-2-胺;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(吡啶-3-基)噁唑-2-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(5-苯基异噁唑-3-基)吡啶-2-胺;
3-(5-苯基异噁唑-3-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-苯基异噁唑-3-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-3-(5-苯基异噁唑-3-基)吡啶-2-胺;
3-(5-苯基呋喃-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-3-(5-苯基呋喃-2-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(5-苯基呋喃-2-基)吡啶-2-胺;
3-(5-苯基呋喃-2-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-苯基-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-苯基-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(2,6-二氯-3-氟苯基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(4-(叔丁基)苯基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(4-(叔丁基)苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-(2,5-二氟苯基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-(4-氟苯基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(4-氟苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
1-(4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)乙酮;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
1-(4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-4-甲基戊-1-酮;
(4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(环丙基)甲酮;
(4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(苯基)甲酮;
1-(4-(4-(6-氨基-5-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-2-苯基乙酮;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1-(1-乙基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1-(1-十二烷基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(吡嗪-2-基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
4-(4-(6-氨基-5-(5-(吡啶-2-基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(吡嗪-2-基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(吡啶-2-基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(噻唑-2-基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(噻唑-2-基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(吡啶-3-基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(吡啶-3-基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
4-(4-(6-氨基-5-(5-(4-(三氟甲基)-噻唑-2-基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
5-(1-(哌啶-4-基)-1H-吡唑-4-基)-3-(5-(4-(三氟甲基)噻唑-2-基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
4-(4-(6-氨基-5-(5-苄基-1,3,4-噁二唑-2-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯;
3-(5-苄基-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1H-吡唑-4-基)吡啶-2-胺;
3-(5-苯基-1,3,4-噁二唑-2-基)-5-(1H-吡唑-4-基)吡啶-2-胺;
3-(5-(4-(叔丁基)苯基)-1,3,4-噁二唑-2-基)-5-(1H-吡唑-4-基)吡啶-2-胺;
3-(5-(2,5-二氟苯基)-1,3,4-噁二唑-2-基)-5-(1H-吡唑-4-基)吡啶-2-胺;
3-(5-(4-氟苯基)-1,3,4-噁二唑-2-基)-5-(1H-吡唑-4-基)吡啶-2-胺;5-
(1-环己基-1H-吡唑-4-基)-3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(5-苯基-1,3,4-噁二唑-2-基)吡啶-2-胺;
3-(5-(2,6-二氯苯基)-1,3,4-噁二唑-2-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-苯基-1,3,4-噁二唑-2-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(3-苯基-1,2,4-噁二唑-5-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
1-(4-(4-(6-氨基-5-(3-苯基-1,2,4-噁二唑-5-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)乙酮;
(4-(4-(6-氨基-5-(3-苯基-1,2,4-噁二唑-5-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(环丙基)甲酮;
5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-3-(3-苯基-1,2,4-噁二唑-5-基)吡啶-2-胺;
(4-(4-(6-氨基-5-(3-苯基-1,2,4-噁二唑-5-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)(苯基)甲酮;
1-(4-(4-(6-氨基-5-(3-苯基-1,2,4-噁二唑-5-基)吡啶-3-基)-1H-吡唑-1-基)哌啶-1-基)-2-苯基乙酮;
3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)-5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)-5-(1-(1-乙基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
5-(1-(1-乙基哌啶-4-基)-1H-吡唑-4-基)-3-(3-苯基-1,2,4-噁二唑-5-基)吡啶-2-胺;
3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)-5-(1-(1-十二烷基哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(3-苯基-1,2,4-噁二唑-5-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)吡啶-2-胺;
3-(3-苯基-1,2,4-噁二唑-5-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺
3-(3-(2,6-二氯苯基)-1,2,4-噁二唑-5-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(3-苯基-1,2,4-噁二唑-5-基)-5-(1H-吡唑-4-基)吡啶-2-胺;
5-(1-环己基-1H-吡唑-4-基)-3-(5-苯基-1,2,4-噁二唑-3-基)吡啶-2-胺;
3-(5-苯基-1,2,4-噁二唑-3-基)-5-(1-(四氢-2H-吡喃-4-基)-1H-吡唑-4-基)吡啶-2-胺;
3-(5-苯基-1,2,4-噁二唑-3-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;
5-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-3-(5-苯基-1,2,4-噁二唑-3-基)吡啶-2-胺;
3-(5-(2,5-二氯苯基)-1,2,4-噁二唑-3-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺;或者
3-(5-苯基-1,2,4-噁二唑-3-基)-5-(1H-吡唑-4-基)吡啶-2-胺。
在优选的实施方案中,组合疗法使用具有由式(Ia)表示的结构的Axl抑制剂。
在更优选的实施方案中,Axl抑制剂是3-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺。
本文描述的Axl抑制剂可以根据WO2015/081257中公开的方法制备,其通过援引整体并入本文。
2.
根据各种实施方案,适用于组合疗法的BCL-2抑制剂是式(II)的化合物,其立体异构体、对映异构体或互变异构体,其药物可接受的盐或其药物组合物:
其中
n是0或1;
R
R
R
Y
在更具体的实施方案中,BCL-2抑制剂式(II)的化合物,其中R
在更具体的实施方案中,R
其中
Z是-O-、-S-或-NH;
Z
在具体实施方案中,R
其中
X
X
X
R
在更具体的实施方案中,BCL-2抑制剂具有式(IIa)或式(IIb)的结构:
其中,R
在各种实施方案中,R
在更具体的实施方案中,R
在各种实施方案中,Y
在更具体的实施方案中,Y
如以上所述的式(II)、式(IIa)和式(IIb)的BCL-2抑制剂可以根据第7,390,799号美国专利和第9,345,702号公开的美国专利中公开的方法制备,上述专利通过援引整体并入。
在优选的实施方案中,一种或多种BCL-2抑制剂是维奈托克
本文命名的某些化学基团前缀有指定在所指定的化学基团中存在的碳原子总数的简化符号例如:C
因此,除非指明相反,否则如说明书和所附权利要求中所用,以下术语具有所指定的含义:
“氨基”是指-NH
“甲氧基”是指-OCH
“氰基”是指-CN基团。
“硝基”是指-NO
“三氟甲基”是指-CF
“氧代”是指=O。
“硫代”是指=S。
“酰基”是指-C(O)R
“烷基”是指直链或支链的烃链基团,当未取代时其仅由碳原子和氢原子组成,不含不饱和度,具有一个至十二个碳原子、优选一个至八个碳原子或者一个至六个碳原子,并且其通过单键连接至分子的其余部分,例如,甲基、乙基、正丙基、1-甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)等。除非在说明书中另外具体规定,否则烷基基团可以被一个或多个取代基任选取代。“烯基”是指直链或支链的烃链基团,当未取代时其仅由碳原子和氢原子组成,含有至少一个双键,具有两个至十二个碳原子、优选一个至八个碳原子并且其通过单键连接至分子的其余部分,例如,乙烯基、丙-1-烯基、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。除非在说明书中另外具体规定,否则烯基基团可以被一个或多个如本文定义的取代基任选取代。
“炔基”是指直链或支链的烃链基团,当未取代时其仅由碳原子和氢原子组成,含有至少一个叁键,任选地含有至少一个双键,具有两个至十二个碳原子、优选一个至八个碳原子并且其通过单键连接至分子的其余部分,例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基等。除非在说明书中另外具体规定,否则炔基基团可以被一个或多个如本文定义的取代基任选取代。“亚烷基”和“亚烷基链”是指直链或支链的二价烃链,其将分子的其余部分连接至基团,仅由碳和氢组成,不含不饱和度并且具有一个至十二个碳原子、优选具有一个至八个碳,例如,亚甲基、亚乙基、亚丙基、亚正丁基等。亚烷基链可以通过链内的一个碳或通过链内的任两个碳连接至分子的其余部分并且连接至基团。
“亚烯基”和“亚烯基链”是指直链或支链的二价烃链,其将分子的剩余部分连接至基团,仅由碳和氢组成,含有至少一个双键并且具有两个至十二个碳原子,例如,亚乙烯基、亚丙烯基、亚正丁烯基等。亚烯基链通过单键连接至分子的其余部分,并且通过双键或单键连接至基团。亚烯基链与分子的其余部分的连接点和与基团的连接点可以是通过链内的一个碳或任两个碳。
“烷氧基”是指式-OR
“芳基”是指芳香族单环或多环烃环体系,当未取代时其仅由氢和碳组成并且含有6个至19个碳原子、优选6个至10个碳原子,其中所述环体系可以部分或完全饱和。芳基基团包括但不限于诸如芴基、苯基和萘基的基团。除非在说明书中另外具体规定,否则术语“芳基”或前缀“芳(ar-)”(例如在“芳烷基”中)意指包括被一个或多个如本文定义的取代基任选取代的芳基基团。“芳烷基”是指式-R
“芳烯基”是指式-R
“芳炔基”是指式-R
“环烃基”是指稳定的非芳香族单环或双环烃基团,当未取代时仅由碳原子和氢原子组成,具有三个至十五个碳原子,优选具有三个至十二个碳原子,并且其是饱和的或不饱和的并且通过单键连接至分子的其余部分,例如,环丙基、环丁基、环戊基、环己基、十氢萘基等。除非在说明书中另外具体规定,否则术语“环烃基”意指包括被一个或多个如本文定义的取代基任选取代的环烃基基团。“环烃基烷基”是指式-R
“吸电子基团”是指降低它们所连接的部分的电子密度(相对于没有取代基的部分的密度)的基团。此类基团包括,例如,-F、-Cl、-Br、-I、-CN、-CF
“卤素”是指溴、氯、氟或碘。
“卤代烷基”是指被一个或多个如以上定义的卤素基团取代的如以上定义的烷基基团。烷基基团的一个或多个碳可以被一个或多个卤素基团取代。卤代烷基的实例包括三氟甲基、二氟甲基、三氯甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基、3-溴-2-氟-丙基、1-溴甲基-2-溴乙基等。如以上关于烷基基团所定义,卤代烷基基团的烷基部分可以被任选取代。
“卤代烯基”是指被一个或多个如以上定义的卤素基团取代的如以上定义的烯基基团,例如,2-溴乙烯基、3-溴丙-1-烯基等。如以上关于烷基基团所定义,卤代烯基基团的烯基部分可以被任选取代。
“杂烃基”是指稳定的直链或支链或其组合,包含至少一个碳原子和至少一个杂原子(例如,选自O、N、P、Si和S),并且其中氮和硫原子可以被任选地氧化,并且氮杂原子可以被任选地季铵化。杂原子(例如,O、N、P、S、B、As和Si)可以位于杂烃基基团的任何内部位置处或烷基连接至分子的其余部分的位置处。实例包括但不限于:-CH
“杂环基”是指稳定的3元至18元非芳香族环基团,其包含作为环原子的至少一个碳原子和一个至五个选自氮、氧和硫的杂原子。为了本公开内容的目的,杂环基基团可以是单环、双环、三环或四环的环体系,其可以包括稠环或桥环体系;并且杂环基基团中的氮、碳或硫原子可以被任选地氧化;并且氮原子可以被任选地季铵化;并且杂环基基团可以部分或完全饱和。此类杂环基基团的实例包括但不限于二氧戊环基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、噻唑烷基、四氢呋喃基、三噻烷基、四氢吡喃基、硫代吗啉基、硫代吗啉基(thiamorpholinyl)、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在说明书中另外具体规定,否则术语“杂环基”意指包括被一个或多个如本文定义的取代基任选取代的杂环基基团。
“杂环基烷基”是指式-R
“杂芳基”是指5元至18元芳香族环基团,其包含作为环原子的至少一个碳原子和一个至五个选自氮、氧和硫的杂原子。为了本公开内容的目的,杂芳基基团可以是单环、双环、三环或四环的环体系,其可以包括稠环或桥环体系;并且杂芳基基团中的氮、碳或硫原子可以被任选地氧化;并且氮原子可以被任选地季铵化。实例包括但不限于吖庚因基、吖啶基、苯并咪唑基、苯并噻唑基、苯并吲哚基、苯并噻二唑基、苯并萘并呋喃基、苯并噁唑基、苯并二氧戊环基、苯并二噁英基、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并噻吩基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、二苯并呋喃基、呋喃基、呋喃酮基、异噻唑基、咪唑基、吲哚基、吲唑基、异吲哚基、二氢吲哚基、异二氢吲哚基、吲哚嗪基、异噁唑基、萘啶基、噁二唑基、2-氧代吖庚因基、噁唑基、环氧乙烷基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡咯并[2,3-b]吡啶基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基、喹啉基、奎宁环基、异喹啉基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基和噻吩基。除非在说明书中另外具体规定,否则术语“杂芳基”意指包括被一个或多个如本文定义的取代基任选取代的杂芳基基团。如本文定义的杂芳基可以是单价或二价的。当杂芳基是另一个部分的取代基时,杂芳基是单价的,这意指杂芳基通过单个环原子连接至其它部分。单价杂芳基的实例可以存在于杂芳基烷基的基团中,其中烷基被杂芳基取代。
“杂芳基烷基”是指式-R
“杂芳基烯基”是指式-R
“N-杂芳基”是杂芳基的子集,并且是指具有至少一个氮环原子的杂芳基。杂芳基另外如本文定义。N-杂芳基的实例包括但不限于苯并咪唑基、苯并吲哚基、苯并三唑基、苯并[4,6]咪唑并[1,2a]吡啶基、咔唑基、噌啉基、咪唑基、吲哚基、吲唑基、异吲哚基、二氢吲哚基、异二氢吲哚基、吲哚嗪基、异噁唑基、萘啶基、噁二唑基、2-氧代吖庚因基、噁唑基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基、喹啉基、奎宁环基、异喹啉基、噻唑基、噻二唑基、三唑基、四唑基和三嗪基。
“取代基”是指键合或者可以键合至另一个分子的基团(单个非氢原子或官能团)。因此,取代基是以下基团中的任一种:烷基、烯基、氨基、卤素、卤代烷基、卤代烯基、氰基、氧代、硫代、硝基、芳基、芳烷基、环烃基、环烃基烷基、杂环基、杂环基烷基、杂芳基、杂芳基烷基、-OR
“前药”是指可以在生理条件下或通过溶剂分解转化为式(I)或式(II)的生物活性化合物或各自亚结构中的任一种的化合物。因此,术语“前药”是指式(I)或式(II)的化合物的代谢前体或者各自亚结构中药物可接受的任一种;后者也称为“母体化合物”。前药当施用于有需要的对象时可以是非活性的,但在体内转化为活性化合物,即母体化合物。通常例如通过在血液中水解,前药在体内快速转换以得到母体化合物。
术语“前药”还意指包括任何共价键合的载体,当将此类前药施用于哺乳动物对象时,该载体在体内释放本公开内容的活性化合物。可以通过修饰存在于式(I)的化合物或亚结构中的任一种中的官能团,以这样的方式使得修饰在常规操作中或在体内裂解成母体化合物来制备本公开内容的化合物的前药。前药包括本公开内容的化合物,其中羟基、氨基或硫基基团键合至任何基团,当将本公开内容的前药施用于哺乳动物对象时,其裂解以分别恢复游离的羟基、游离的氨基或游离的硫基基团。前药的实例包括但不限于式(I)、式(II)的化合物或亚结构中的任一种的醇或胺官能团的乙酸酯、甲酸酯和苯甲酸酯以及磷酸酯衍生物。
“哺乳动物”或“哺乳动物对象”包括人和家养动物,例如猫、狗、猪、牛、绵羊、山羊、马、兔等。
“任选的”或“任选地”意指随后描述的情况事件可以发生或可以不发生,并且该描述包括其中所述事件或情况发生的情形和所述事件或情况不发生的情形。例如,“任选取代的芳基”意指芳基基团可以被取代或可以不被取代,并且该描述包括取代的芳基基团和没有取代的芳基基团。
“药物可接受的载体、稀释剂或赋形剂”包括但不限于已经被美国食品和药品管理局批准为可接受用于人或家养动物的佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。
“药物可接受的酸加成盐”是指保留游离碱的生物有效性和性质的那些盐,所述药物可接受的酸加成盐不是生物学上或其它方式不期望的,并且其是与无机酸或有机酸形成的,所述无机酸例如但不限于盐酸、氢溴酸、硫酸、硝酸、磷酸等,所述有机酸例如但不限于乙酸、2,2-二氯乙酸、己二酸、海藻酸、抗坏血酸、天冬氨酸、苯磺酸、苯甲酸、4-乙酰氨基苯甲酸、樟脑酸、樟脑-10-磺酸、癸酸、己酸、辛酸、碳酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、葡糖酸、葡糖醛酸、谷氨酸、戊二酸、2-氧代-戊二酸、甘油磷酸、乙醇酸、马尿酸、异丁酸、乳酸、乳糖酸、月桂酸、马来酸、苹果酸、丙二酸、扁桃酸、甲磺酸、粘酸、萘-1,5-二磺酸、萘-2-磺酸、1-羟基-2-萘甲酸、烟酸、油酸、乳清酸、草酸、棕榈酸、扑酸、丙酸、焦谷氨酸、丙酮酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、酒石酸、硫氰酸、对甲苯磺酸、三氟乙酸、十一烯酸等。
“药物可接受的碱加成盐”是指保留游离酸的生物有效性和性质的那些盐,所述药物可接受的碱加成盐不是生物学上或其它方式不期望的。这些盐由无机碱或有机碱与游离酸的加成制备。衍生自无机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。优选的无机盐是铵盐、钠盐、钾盐、钙盐和镁盐。衍生自有机碱的盐包括但不限于以下物质的盐:伯胺、仲胺和叔胺,取代的胺(包括天然存在的取代的胺),环状胺和碱性离子交换树脂,例如氨、异丙基胺、三甲胺、二乙胺、三乙胺、三丙胺、二乙醇胺、乙醇胺、二甲基乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、苯乙苄胺、苄星青霉素、乙二胺、葡萄糖胺、甲葡萄糖胺、可可碱、三乙醇胺、氨丁三醇、嘌呤、哌嗪、哌啶、N-乙基哌啶、多胺树脂等。特别优选的有机碱是异丙胺、二乙胺、乙醇胺、三甲胺、二环己胺、胆碱和咖啡因。
通常,结晶化产生本公开内容的化合物的溶剂化物。如本文所用,术语“溶剂化物”是指包含一种或多种本公开内容的化合物分子与一种或多种溶剂分子的聚集体。溶剂可以是水,在这种情况下溶剂化物可以是水合物。替代地,溶剂可以是有机溶剂。因此,本公开内容的化合物可以作为水合物存在,包括一水合物、二水合物、半水合物、倍半水合物、三水合物、四水合物等,以及相应的溶剂化形式。本公开内容的化合物可以是真溶剂化物,而在其它情况下,本公开内容的化合物可以仅保留不定的水或者是水加一些不定的溶剂的混合物。
“药物组合物”是指本公开内容的化合物和本领域通常接受的用于将生物活性化合物递送至哺乳动物(例如,人)的介质的制剂。此类介质包括所有药物可接受的载体、稀释剂或赋形剂。
“治疗有效量”是指当施用于哺乳动物(优选为人)时,足以如以下定义有效治疗哺乳动物(优选为人)中的疾病或病况的本公开内容的化合物的量。构成“治疗有效量”的本公开内容的化合物的量将根据化合物、病况及其严重程度、以及待治疗的哺乳动物的年龄而变化,但可以由本领域普通技术人员以其自身的知识和本公开内容常规确定。
如本文所用的“治疗(treating)”或“治疗(treatment)”涵盖了治疗在患有目标疾病或病症的哺乳动物(优选为人)中的目标疾病或病况,并且包括:
(i)预防疾病或病况在哺乳动物中发生,特别是当此类哺乳动物易患该病况但尚未诊断出患有该病况时;
(ii)抑制疾病或病况,即,遏制其发展或逆转其进展;或者
(iii)缓解疾病或病况,即,使疾病或病况消退。
本公开内容的化合物或其药物可接受的盐可以含有一个或多个不对称中心,并且因此可以产生对映异构体、非对映异构体和其它立体异构形式,这些形式可以根据绝对立体化学被定义为(R)-或(S)-,或者对于氨基酸定义为(D)-或(L)-。本公开内容意指包括所有此类可能的异构体以及其外消旋和光学纯的形式。光学活性(+)和(-)、(R)-和(S)-、或(D)-和(L)-的异构体可以使用手性合成子或手性试剂制备,或者使用常规技术拆分,例如使用手性柱的HPLC。
“立体异构体”是指由通过相同键键合的相同原子构成但具有不可互换的不同三维结构的化合物。本公开内容预期各种立体异构体及其混合物并且包括“对映异构体”,所述对映异构体是指分子是彼此不可重叠的镜像的两种立体异构体。
“互变异构体”是指从分子的一个原子至同一分子的另一个原子的质子迁移。本公开内容包括任何所述化合物的互变异构体。
当键显示为虚线(---)时,应理解位置允许双键的可能性。例如,接头“A”的结构-环部分显示为:
其中每个虚线键可以但不一定表示双键的存在。例如,当A是-NH=时,A分别通过单键和双键连接至两个相邻的碳原子。另一方面,如果A限定为-O-,则A分别通过单键连接至两个相邻碳原子。给定的“A”-环结构中的双键的位置和数量应满足化合价要求,如本领域技术人员将认识到的。
根据各种实施方案,将一种或多种Axl抑制剂(优选式(I)的化合物或由式(Ia)至式(If)表示的亚结构中的任一种)用作活性成分与一种或多种BCL-2抑制剂(优选式(II)的化合物或由式(IIa)至式(IIb)表示的亚结构中的任一种)组合。组合疗法在预防、治疗或控制一种或多种血癌方面有效。
如本文所用,血癌是指三种主要类型的血液癌症(即白血病、淋巴瘤和骨髓瘤)中的任一种。组合疗法对AML特别有效。
有利地,当与单独施用的每种疗法相比时,此类组合疗法发挥大于叠加效应,即协同效果。因此,如本文所用的“组合疗法”是指施用一种或多种Axl抑制剂(例如,式(I)的化合物)与施用一种或多种BCL-2抑制剂的组合。除非另外规定,“组合疗法”可以包括以任何顺序、以任何剂型同时或依次施用Axl抑制剂和BCL-2抑制剂。
本发明的组合疗法可用于预防、治疗或控制一种或多种血癌,特别是白血病。白血病的实例包括急性白血病、急性淋巴细胞白血病、急性骨髓细胞白血病(例如,成髓细胞白血病、早幼粒细胞白血病、骨髓单核细胞白血病、单核细胞白血病、红白血病和骨髓增生异常综合征)、慢性白血病(例如但不限于慢性骨髓细胞(粒细胞)白血病、慢性淋巴细胞白血病)、毛细胞白血病。
本发明的组合疗法的抗增殖作用可以通过将组合疗法的活性成分施用于培养的肿瘤细胞系来评估。在体外测定的背景中,活性成分的施用可以简单地通过使培养物中的细胞与有效抑制细胞增殖的量的活性成分接触来实现。替代地,本发明的组合疗法的抗增殖作用可以通过将组合疗法的活性成分施用于批准的细胞增殖体内模型中的动物来评估。
可以通过使用表达人Axl的癌细胞系在SCID小鼠模型中的异种移植物中测试组合疗法来测试本发明的组合疗法对于白血病和淋巴瘤的治疗,所述人Axl表达癌细胞系包括但不限于Molm-13、MV4-11、HeLa、MDA-MB-231、SK-OV-3、OVCAR-8、DU145、H1299、ACHN、A498和Caki-1。此外,组合疗法可以使用表达人Axl的AML和CML白血病细胞系测试其在SCID或nu/nu小鼠模型中的异种移植物中治疗白血病的用途。
在本发明的组合疗法中使用的活性成分的优选预防有效剂量或治疗有效剂量的选择可以由技术人员基于几个因素的考虑来确定(例如,通过临床试验),所述因素包括:所使用的具体化合物的活性;化合物的代谢稳定性和作用时长;患者的年龄、体重、一般健康状况、性别和饮食;施用方式和施用时间;排泄率;药物组合;以及转移性癌症的严重程度。
在本发明的组合疗法中使用的Axl抑制剂或一种或多种BCL-2抑制剂的精确剂量也将取决于施用途径和白血病的严重程度来确定,并且应根据医疗从业者的判断和每个患者的情况来决定。有效剂量可以从体外或动物模型测试系统得到的剂量-响应曲线外推。
例如,对于70kg哺乳动物,Axl抑制剂或BCL-2抑制剂的治疗有效日剂量可以是约0.001mg/kg(即,0.07mg)至约300mg/kg(即,21.0gm);优选治疗有效剂量是约0.01mg/kg(即,0.7mg)至约100mg/kg(即,7.0gm);更优选治疗有效剂量是约0.1mg/kg(即,7mg)至约50mg/kg(即,3.5gm);并且更优选治疗有效剂量是约0.5mg/kg(即,35mg)至约25mg/kg(即,1.75gm)。
优选地,本发明提供了施用比先前已知有效预防、治疗和控制血癌的剂量更低剂量的用于本发明的组合疗法中的一种或多种BCL-2抑制剂的任何方法。甚至更优选地,在本发明的组合疗法中施用更低剂量的一种或多种BCL-2抑制剂与更低剂量的Axl抑制剂。
在本发明的组合疗法中,通过相同的施用途径或通过不同的施用途径将Axl抑制剂与一种或多种BCL-2抑制剂如本文所述同时、在一种或多种BCL-2抑制剂之前或之后施用。此类组合疗法包括施用含有Axl抑制剂和一种或多种额外的化疗剂的单一药物剂量制剂,以及以其自身独立的药物剂量制剂施用Axl抑制剂和各种BCL-2抑制剂。例如,Axl抑制剂和其它一种或多种BCL-2抑制剂可以以单一口服剂量组合物(例如片剂或胶囊)一起施用于患者,或者每种药剂可以以独立的口服剂量制剂施用。在使用独立的剂量制剂的情况下,Axl抑制剂和一种或多种BCL-2抑制剂可以基本上在相同时间(即同时)或分别错开的时间(即依次)施用于患者。所有此类施用组合均涵盖在本发明的组合疗法中。
在本发明的组合疗法的某些实施方案中,将Axl抑制剂与一种或多种可用于治疗癌症的BCL-2抑制剂相伴地施用于患者。术语“相伴地”或“同时地”不限于在完全相同的时间施用活性成分(即,Axl抑制剂和一种或多种BCL-2抑制剂),而是意指Axl抑制剂和BCL-2抑制剂按顺序在一定时间间隔内施用于患者,使得TAM抑制剂可以与BCL-2抑制剂一起作用,以便与以其它方式施用相比提供协同益处。例如,本发明的组合疗法的每种活性成分可以在相同的时间或在不同时间点以任何顺序依次施用;然而,如果不是在相同的时间施用,则它们应在足够接近的时间内施用以提供所需的治疗或预防效果。例如,化疗剂可每周施用一次,并且Axl抑制剂可以每天施用。换而言之,即使活性成分没有同时或在同一患者就诊内施用,活性成分的给药方案也在同时进行。
在某些实施方案中,将本发明的活性成分循环施用于患者。循环疗法包括将第一种活性成分(例如Axl抑制剂)施用一段时间,随后将第二种和/或第三种活性成分施用一段时间,并且重复这种依次施用。循环疗法可以减少对一种或多种疗法的抗性的发展,避免或减少一种疗法的副作用,和/或改善治疗的功效。
在其它实施方案中,本发明的组合疗法的活性成分以节律给药方案通过连续输注或频繁施用而不延长休息期来施用。这种节律施用可以包括以恒定的间隔给药,而没有休息期。通常,以较低剂量使用化疗剂,特别是细胞毒性剂。此类给药方案包括长期日施用相对低剂量,持续延长的时间段。在一个实施方案中,使用较低剂量的化疗剂可以最小化毒副作用并且消除休息期。在某些实施方案中,通过约24小时至约2天、至约1周、至约2周、至约3周、至约1个月、至约2个月、至约3个月、至约4个月、至约5个月、至约6个月的长期低剂量或连续输注施用活性成分。此类剂量方案的安排可以由熟练的肿瘤医师来优化。
在优选的实施方案中,Axl抑制剂每24小时施用于患者,并且一种或多种BCL-224小时施用于患者。
本领域技术人员还熟知确定施用方法(口服、静脉内、吸入、皮下等)、剂型、适合的药物赋形剂及与将化合物递送至有需要的对象有关的其它事项。
可以经由任何起到类似效用的试剂的被接受的施用模式来进行本公开内容的化合物或其药物可接受的盐以纯形式或以适当的药物组合物的施用。可以通过使本公开内容的化合物与适当的药物可接受的载体、稀释剂或赋形剂组合来制备本公开内容的药物组合物,并且可以配制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊、散剂、颗粒、软膏、溶液、栓剂、注射剂、吸入剂、凝胶、微球和气溶胶。施用此类药物组合物的典型途径包括但不限于口服、局部、经皮、吸入、肠胃外、舌下、颊部、直肠、阴道和鼻内。如本文所用的术语肠胃外包括皮下注射、静脉内、肌内、胸骨内注射或输注技术。将本公开内容的药物组合物配制成使得在向患者施用该组合物时其中含有的活性成分是生物可利用的。将施用于对象或患者的组合物采取一种或多种剂量单位的形式,其中例如片剂可以是单一剂量单位,并且气溶胶形式的本公开内容的化合物的容器可以容纳多个剂量单位。制备此类剂型的实际方法对于本领域技术人员而言是已知的,或者将是显而易见的;例如,参见Remington:TheScience and Practice of Pharmacy,第20版(Philadelphia College of Pharmacy andScience,2000)。无论如何,待施用的组合物将含有治疗有效量的本公开内容的化合物或其药物可接受的盐,用于治疗根据本公开内容的教导的目标疾病或病况。
本公开内容的药物组合物可以是固体或液体的形式。在一个方面,载体是颗粒,使得组合物例如是片剂、胶囊或散剂形式。载体可以是液体,组合物例如是口服油状物、可注射液体或可用于例如吸入施用的气溶胶。
(1)Dohner H,Estey EH,Amadori S等人,Diagnosis and management of acutemyeloid leukemia in adults:recommendations from an international expertpanel,on behalf of the European Leukemia Net.Blood.2010;115:453-474。
(2)Khwaja A,Bjorkholm M,Gale RE等人,Acute myeloid leukaemia.Nat RevDis Primers.2016;2:16010。
(3)Dohner H,Weisdorf DJ,Bloomfield CD.Acute Myeloid Leukemia.N Engl JMed.2015;373:1136-1152。
(4)Ley TJ,Miller C,Ding L等人,Genomic and epigenomic landscapes ofadult de novo acute myeloid leukemia.N Engl J Med.2013;368:2059-2074。
(5)Altieri DC.AML therapy:wake up the guardian and cut loose theexecutioners.Cancer Cell.2017;32:719-720。
(6)Papaemmanuil E,Gerstung M,Bullinger L等人,Genomic Classificationand Prognosis in Acute Myeloid Leukemia.N Engl J Med.2016;374:2209-2221。
(7)Burnett A,Wetzler M,Lowenberg B.Therapeutic advances in acutemyeloid leukemia.J Clin Oncol.2011;29:487-494。
(8)Kantarjian H.Acute myeloid leukemia--major progress over fourdecades and glimpses into the future.Am J Hematol.2016;91:131-145。
(9)Tamamyan G,Kadia T,Ravandi F等人,Frontline treatment of acutemyeloid leukemia in adults.Crit Rev Oncol Hematol.2017;110:20-34。
(10)Dombret H,Gardin C.An update of current treatments for adultacute myeloid leukemia.Blood.2016;127:53-61。
(11)Thomas D,Majeti R.Biology and relevance of human acute myeloidleukemia stem cells.Blood.2017;129:1577-1585。
(12)Shlush LI,Zandi S,Mitchell A等人,Identification of pre-leukaemichaematopoietic stem cells in acute leukaemia.Nature.2014;506:328-333。
(13)Wang JC,Dick JE.Cancer stem cells:lessons from leukemia.TrendsCell Biol.2005;15:494-501。
(14)Clarke MF,Dick JE,Dirks PB等人,Cancer stem cells--perspectives oncurrent status and future directions:AACR Workshop on cancer stemcells.Cancer Res.2006;66:9339-9344。
(15)Jiang X,Saw KM,Eaves A,Eaves C.Instability of BCR-ABL gene inprimary and cultured chronic myeloid leukemia stem cells.J Natl CancerInst.2007;99:680-693。
(16)Jiang X,Zhao Y,Smith C等人,Chronic myeloid leukemia stemcellspossess multiple unique features of resistance to BCR-ABL targetedtherapies.Leukemia.2007;21:926-935。
(17)Kreso A,Dick JE.Evolution of the cancer stem cell model.Cell StemCell.2014;14:275-291。
(18)Graham DK,DeRyckere D,Davies KD,Earp HS.The TAM family:phosphatidylserine sensing receptor tyrosine kinases gone awry in cancer.NatRev Cancer.2014;14:769-785。
(19)Schoumacher M,Burbridge M.Key Roles of Axl and MER ReceptorTyrosine Kinases in Resistance to Multiple Anticancer Therapies.Curr OncolRep.2017;19:19。
(20)Schmidt T,Ben Batalla I,Schultze A,Loges S.Macrophage-tumorcrosstalk:role of TAMR tyrosine kinase receptors and of their ligands.CellMol Life Sci.2012;69:1391-1414。
(21)Janning M,Ben Batalla I,Loges S.Axl inhibition:a potential roadto a novel acute myeloid leukemia therapy?Expert Rev Hematol.2015;8:135-138。
(22)Rochlitz C,Lohri A,Bacchi M等人,Axl expression is associated withadverse prognosis and with expression of BCL-2and CD34in de novo acutemyeloid leukemia(AML):results from a multicenter trial of the Swiss Group forClinical Cancer Research(SAKK).Leukemia.1999;13:1352-1358。
(23)Ben Batalla I,Schultze A,Wroblewski M等人,Axl,a prognostic andtherapeutic target in acute myeloid leukemia mediates paracrine crosstalk ofleukemia cells with bone marrow stroma.Blood.2013;122:2443-2452。
(24)Park IK,Mishra A,Chandler J等人,Inhibition of the receptortyrosine kinase Axl impedes activation of the FLT3 internal tandemduplication in human acute myeloid leukemia:implications for Axl as apotential therapeutic target.Blood.2013;121:2064-2073。
(25)Ben Batalla I,Erdmann R,Jorgensen H等人,Axl Blockade by BGB324Inhibits BCR-ABL Tyrosine Kinase Inhibitor-Sensitive and-Resistant ChronicMyeloid Leukemia.Clin Cancer Res.2017;23:2289-2300。
(26)Myers SH,Brunton VG,Unciti-Broceta A.Axl inhibitors in cancer:Amedicinal chemistry perspective.J Med Chem.2016;59:3593-3608。
(27)Sheridan C.First Axl inhibitor enters clinical trials.NatBiotechnol.2013;31:775-776。
实施例
通过例示的方式提供以下组合疗法实施例,而非限制。在以下组合疗法实施例中,测定3-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1H-吡唑-4-基)吡啶-2-胺(其为式(I)的化合物并且在以下实施例和图1至图11中指定为“化合物A”或“Cmpd A”)单独或与BCL-2家族蛋白抑制剂组合来预防、治疗或控制转移性癌症的能力。
实施例1
基于细胞的测定中的组合指数的测定
AML细胞系MOLM-13和MV4-11获得自DSMZ。在37℃/5%CO
将AML细胞Molm-13和MV4-11以5×10
为了确定BCL-2抑制剂与Axl抑制剂之间的潜在协同性,选择对BCL-2抑制剂维奈托克和纳维托克敏感的AML细胞系Molm-13和MV4-11进行研究。已经证明这两种细胞系对所测试的BCL-2抑制剂具有低纳摩尔IC
为了组合研究,选择四个浓度,使得每个单一化合物浓度低于其单一药剂IC
实施例2
Axl表面染色
为了研究何种AML患者样品表达高蛋白水平的Axl,用Axl-APC抗体对各种不同的AML样品(具有混合谱系白血病(MLL)融合体以及没有MLL融合体)进行表面染色。包括CD34
如图2A和图2B所证明,AML患者样品在表面上比正常骨髓(NBM)供体细胞表达更高水平的Axl。图2A是使用CD34
图3A和图3B进一步证明MLL AML患者样品在表面上表达高水平的Axl。图3A是使用CD34
结果表明,与健康CD34
实施例3
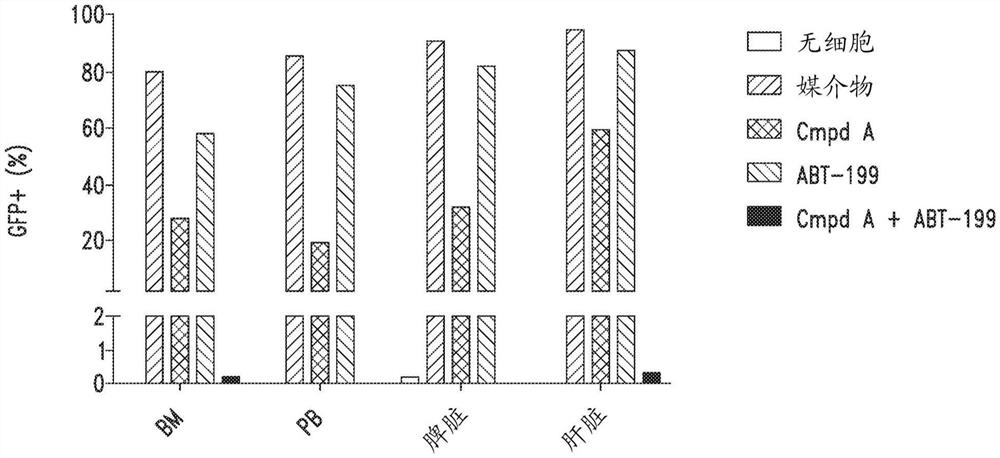
化合物A和ABT-199在患者源性异种移植物(PDX)模型中的组合疗法
在体内测定中研究化合物A以及化合物A和ABT-199的组合在靶向原始白血病细胞和/或预防白血病发展中的相对有效性。首先,将来自两个不同AML患者(具有高Axl和GAS6表达;同期组1=AML患者#2,同期组2=AML患者#14,如实施例2中所确定)的高度纯化的CD34+干细胞和祖细胞用GFP/萤光素酶慢病毒报告基因转导以允许小鼠的非侵入性体内成像(IVIS)来追踪白血病发展。然后,将每只小鼠50,000个细胞的优化细胞数静脉内注射到经辐射的雌性免疫受损的NRG-3GS小鼠(产生人IL-3、GMC-SF和青灰因子)中,随后在细胞注射后第1天和第2天腹膜内抗白喉毒素注射以消除可能潜在地杀死小鼠的残余T-细胞。三周之后,进行IVIS以确认所有小鼠中的白血病引发。随后,在进行另一轮IVIS以评估治疗有效性之前,通过口服管饲4周(总计20剂)开始使用媒介物(对照)、50mg/kg单独的化合物A QD、50mg/kg单独的ABT-199QD或者化合物A(50mg/kg,QD)和ABT-199 50mg/kg(QD)的组合的治疗。
图4A和图4B分别显示了在使用指定治疗的口服管饲之前和之后代表性小鼠的生物发光成像。黑暗区域代表由GFP/萤光素酶白血病细胞的存在引起的观察到的生物发光的位点。
还在一组安乐死小鼠(分别来自两个同期组中的每个治疗组的一只小鼠)的外周血(PB)、骨髓(BM)和脾脏中测量白血病细胞负荷,并且用荧光标记的CD45、CD34、CD38、CD33、CD15、CD14、CD19表面标记物测定移植细胞的免疫表型。通过脾大小和重量评估脾肿大(图5)。图6显示荧光激活细胞分选(FACS)分析在来自如每个患者同期组所指定的每个治疗组的代表性安乐死小鼠的PB和BM中的转导的(GFP+)和未转导的(GFP-)人白血病细胞的移植。
监测所有剩余的小鼠的疾病发展的症状(体重减轻、嗜睡等)并且比较治疗组之间的存活率。图7A和图7B显示两个患者同期组的指定治疗组的白血病小鼠的存活曲线。每个治疗组的平均存活率以括号中的天数表示。用Log-rank(Mantel-Cox)试验计算p值,并且指出各组之间的显著差异。
化合物A与ABT-199的组合不仅在延迟还在消除早期时间点的白血病发展方面高度有效,而单一药剂并且尤其媒介物对照显示出白血病进展。参见例如,AML治疗前的PDX模型(图4A)和治疗后的PDX模型(图4B)。
此外,同时靶向Axl和BCL-2的组合方法能够预防脾肿大。图5显示健康的非白血病小鼠(无细胞)、媒介物对照(无治疗)、单独使用化合物A的单一疗法、单独使用ABT-199的单一疗法以及化合物A和ABT-199的组合疗法的大小和重量。如所示,当与健康的非白血病小鼠的脾脏相比时,媒介物对照和单一疗法组中的脾脏显著增大;而经历组合疗法的小鼠没有表现出脾肿大的迹象。
图6A至图6D进一步证实了在PB(图6A和图6B)和BM(图6C和图6D)中的人白血病细胞的移植以及白血病细胞浸润脾脏的减少。结果,在两个患者同期组中,与用单一药剂或媒介物治疗的小鼠相比,在组合疗法组中显示出显著的存活率优势(图7A和图7B,P<0.025)。对代表性白血病小鼠的BM的详细分析表明,Axl和BCL-2同时抑制在消除移植的干细胞、祖细胞和分化的母细胞以及骨髓细胞和骨髓母细胞方面非常有效。总而言之,在用原代AML患者细胞的患者源性异种移植物(PDX)模型中,用化合物A和ABT-199的组合治疗降低了白血病负荷并且显著增强了白血病小鼠的存活。
实施例4
化合物A和ABT-199在MV4-11细胞系异种移植物模型中的组合疗法
为了研究化合物A单一疗法和与ABT-199的组合疗法用于消除动物中的人白血病细胞的安全性和有效性,进行了基于细胞系的异种移植小鼠研究。首先,用GFP/萤光素酶慢病毒载体转导MV4-11细胞,以允许分选/分析小鼠中的人白血病细胞和小鼠的非侵入性体内成像(IVIS),以追踪白血病发展和白血病形成位点。然后,将每只小鼠2.5百万的GFP阳性MV4-11细胞静脉内注射到经辐射的雄性NRG小鼠中。注射之后两周,进行IVIS成像以确认白血病形成且每只小鼠中的白血病负荷水平一致。随后,小鼠接受3周(总计15剂)的用媒介物(对照)、50mg/kg单独的化合物A QD、50mg/kg单独的ABT-199QD或化合物A(50mg/kg,QD)和ABT-199(50mg/kg,QD)的组合的口服治疗。
在治疗期之后,进行另一轮IVIS成像以评价治疗的有效性。图8A和图8B分别显示了在治疗之前和在使用指定治疗的口服管饲之后代表性小鼠的生物发光成像。黑暗区域代表由GFP/萤光素酶白血病细胞的存在引起的观察到的生物发光的位点。为了比较,还显示了没有转导的白血病细胞(“无细胞”)的健康小鼠。
然后处死一组代表性小鼠以比较每个治疗组的外周血(PB)、骨髓(BM)、脾脏和肝脏中的白血病细胞的移植。通过重量和组织病理学分析评估白血病细胞至诸如脾脏和肝脏的造血器官的浸润。图9A和图9B分别显示了如指定的每个治疗组的代表性小鼠的脾脏大小和重量,以及苏木精和曙红染色。图10显示来自如指定的每个治疗组的代表性小鼠的BM、PB、脾脏和肝脏中的白血病细胞移植的FACS分析。
监测治疗组之间剩余小鼠的存活率。图11显示指定的治疗组的白血病小鼠的存活曲线。每个治疗组的平均存活率以括号中的天数表示。用Log-rank(Mantel-Cox)试验计算p值,并且指出各组之间的显著差异。
在口服管饲三周之后,与媒介物和ABT-199治疗的小鼠相比,化合物A治疗的小鼠具有急剧降低强度的生物发光信号,并且组合治疗的小鼠的信号甚至低于检测阈值(图8B)。与媒介物对照和ABT-199治疗的小鼠相比,在用化合物A治疗或与ABT-199组合治疗的小鼠中,这种观察结果进一步被证实为没有脾肿大的迹象(图9A)。组织学分析进一步证实组合治疗防止了白血病细胞在脾脏中的浸润(图9B)。荧光激活的细胞分选(FACS)分析显示组合疗法减少了人白血病细胞在PB、BM、脾脏和肝脏中的移植(图10),与用单一药剂或媒介物治疗的小鼠相比导致显著延长的存活(图11,P<0.007)。总而言之,在这种MV4-11动物模型中,单独的化合物A治疗可以降低体内白血病增殖活性,并且这种抑制作用在与ABT-199组合治疗之后急剧增强。
本说明书中提及和/或在申请数据表中列出的所有美国专利、美国专利申请公开、美国专利申请、外国专利、外国专利申请和非专利出版物均通过援引整体并入本文。
从上述内容可以理解,尽管本文出于例示的目的已经描述了本公开内容的具体实施方案,但在不背离本公开的主旨和范围的情况下可以进行各种修改。因此,除了所附权利要求之外,本公开内容不受限制。
- 用于治疗血癌的组合疗法
- 用于预防或治疗实体癌或血癌的包含1,2-萘醌衍生化合物的药物组合物
