AG10的制剂
文献发布时间:2023-06-19 10:58:46
相关申请的交叉引用
根据35U.S.C§119(e),本申请要求2018年8月17日提交的美国临时申请序列号62/765,154的优先权,其全部内容通过引用合并于此。
联邦支持的研究与开发所产生发明的权利声明
不适用
参照光盘提交的“序列表”,表格或计算机程序列表附录
不适用
发明背景
异常的蛋白质相互作用和聚集(无论是通过蛋白质错误折叠还是通过信号通路的过度激活)是许多人类退化性疾病的根本原因。因此,靶向蛋白质相互作用(PPI)具有治疗意义。
迄今为止,批准的PPI抑制剂是蛋白质,而不是小分子抑制剂。例如,治疗性单克隆抗体(mAb)用于治疗癌症,自身免疫性疾病,传染性疾病和神经退行性疾病。治疗性单克隆抗体的生产成本高昂,需要通过注射给药,并且可能对患者产生免疫反应。由于这些原因,仍然有兴趣开发PPI的小分子抑制剂。
异常蛋白质聚集的一个例子是可溶性蛋白质运甲状腺素蛋白(TTR或前白蛋白)。野生型(WT)TTR是存在于血液和脑脊液中的55kDa同源四聚体蛋白。当从其同四聚体形式解离时,WT TTR二聚体可错误折叠成淀粉样单体。已观察淀粉样蛋白生成单体的形成伴随着WT TTR以及超过100种不同的变异体。研究表明,稳定TTR的四聚体形式可抑制淀粉样蛋白单体的错误折叠和随后的TTR淀粉样蛋白形成。
最近的工作已确定3-(3-(3-,3,5-二甲基-1H-吡唑-4-基)丙氧基)-4-氟苯甲酸(AG10)是治疗TTR淀粉样蛋白相关疾病,如TTR淀粉样蛋白心肌病和ATTR多发性神经病的有希望候选对象。该化合物已在WO
2014/100227中公开。尽管公开了该化合物,但仍难以获得提供稳定性增加和药代动力学数据一致的改进的药物制剂。
因此,需要生产适合施用于人或其他动物的药物制剂。本公开解决了这些需求并且还提供了相关的优点。
发明内容
本公开内容提供了AG10或其药学上可接受的盐和选自以下的至少一种药物赋形剂的高负载片剂:一种或多种填充剂,一种或多种粘合剂,一种或多种崩解剂和一种或多种润滑剂。在一些实施方案中,该片剂用包衣剂包衣。
附图的简要说明
图1显示了实施例2中用于制备所述的AG10制剂的工艺流程图。
图2显示了实施例2中制备的AG10 HCl包衣片剂的图像。
图3显示了实施例2中所述的AG10固体片剂的溶出度图像。
图4显示了制备实施例3中所述的AG10制剂的工艺流程图。
图5显示了水性包衣悬浮液制剂或制备实施例3所述AG10制剂的工艺流程。
图6显示的图像说明了对L018A(高硬度,左)和L018B(中硬度,右)(在AG3下为33.0%)进行脆性测试后,片剂边缘没有受到侵蚀。
图7显示了脆性测试后,L016(左)和L017(右)的片剂主要边缘腐蚀的图像(两种配方均具有40%的AG10负荷和最大硬度)。
图8说明了实施例4中描述的33%AG10 HCl片剂的工艺流程图。
图9说明了实施例4中描述的66.7%AG10 HCl片剂的工艺流程图。
图10显示了在40℃/75%相对湿度条件下储存后,33.3%AG10 HCl片剂的溶出度曲线。T=0(空心三角形);T=1个月(空心菱形)T=3个月(实心圆);T=6个月(实心方块)。
图11显示了在40℃/75%相对湿度条件下储存后,66.7%AG10 HCl片剂的溶出度曲线。T=0(空心三角形);T=3个月(实心圆);T=6个月(实心方块)。
具体实施方式
总述
本公开部分地基于以下发现:可以将含有40%或更多AG10的制剂成功制成片剂。这些片剂特别适合于对人和动物受试者给药,因为这些量满足口服制剂所需的稳定性和药代动力学要求。其他制剂,例如胶囊剂,不能满足这些需求。
使用高级微晶纤维素可以成功获得高负荷速释AG10片剂。相反,使用标准等级的微晶纤维素的AG10含量超过33.3%的片剂,在脆性测试后显示出片剂腐蚀的迹象,并且在长时间储存后溶出度降低。
I.定义
除非另外特别指出,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。另外,与本文描述的方法或材料相似或等同的任何方法或材料都可以用于实施本发明。为了本发明的目的,定义以下术语。
本文使用的术语“一个”,“一种”或“该”不仅包括一个成员的方面,还包括超过一个成员的方面。例如,单数形式的“一个”,“一种”或“该”包括复数对象,除非上下文另有明确规定。因此,例如,提及“一个细胞”包括多个这样的细胞,而提及“药剂”包括本领域技术人员已知的一种或多种药剂,等等。
如本文所使用,术语“约”是指包括指定值在内的数值范围,本领域普通技术人员将认为该范围合理地类似于该指定值。在一些实施例中,术语“约”是指在使用本领域通常可接受的测量方法的标准偏差内。在一些实施例中,约是指范围扩大到特定值的+/-10%。在一些实施例中,大约是指特定值。
术语“片剂”是指具有和不具有包衣的固体药物制剂。术语“片剂”还指具有一层,两层,三层或甚至更多层的片剂,其中上述每种类型的片剂可以不具有或具有一个或多个包衣。在一些实施方案中,本公开的片剂可以通过辊压或本领域已知的其他合适的方式制备。术语“片剂”还包括微型,熔融,可咀嚼,泡腾和口腔崩解的片剂。片剂包括AG10和至少一种以及一种选自以下的药物赋形剂:一种或多种填充剂,一种或多种粘合剂,一种或多种崩解剂和一种或多种润滑剂。任选地,还包括包衣剂。为了计算片剂的重量百分比,在计算中不包括包衣剂的量。即,本文报道的重量百分比是未包衣片剂的重量百分比。
术语“盐”是指本公开化合物的酸或碱式盐。药学上可接受的盐的说明性实例是无机酸(盐酸,氢溴酸,磷酸等)盐,有机酸(乙酸,丙酸,谷氨酸,柠檬酸等)盐,季铵(甲基碘,碘乙烷等)盐。可以理解,药学上可接受的盐是无毒的。关于合适的药学上可接受的盐的其他信息可以在《雷明顿药物科学》(Remington's Pharmaceutical Sciences),第17版,马克出版公司(Mack Publishing Company),伊斯顿,宾夕法尼亚州,1985中找到,其通过引用并入本文。
II.本公开的实施方式
本公开内容尤其提供了AG10或其药学上可接受的盐的片剂。AG10是下式的化合物:
在一些实施方案中,AG10的药学上可接受的盐对应于式I。
其中X是质子酸的药学上可接受的阴离子。
多种质子酸适合于制备式I的药学上可接受的盐。可以看出,质子酸的药学上可接受的阴离子取决于所用的质子酸。例如,可用于本公开的质子酸包括盐酸,氢溴酸,磺酸,甲苯磺酸(对甲苯磺酸),甲磺酸,硝酸或乙酸。因此,质子酸的可药用阴离子包括氯离子(Cl
在一些实施方案中,质子酸的药学上可接受的阴离子是甲磺酸根。
在一些实施方案中,质子酸的药学上可接受的阴离子是甲苯磺酸酯。
在一些实施方案中,质子酸的药学上可接受的阴离子是氯,并且式I的药学上可接受的盐由式(Ia)表示
式I的药学上可接受的盐可以使用本领域中的许多常规方法来生产。例如,式I化合物的游离酸形式可以与化学计量的适当酸在水中,有机溶剂或两者的混合物中接触。在一些实施方案中,式I的药学上可接受的盐在非水介质如醚,乙酸乙酯,乙醇,异丙醇或乙腈中制备。在一些实施方案中,式I的药学上可接受的盐是通过将式IX的化合物溶解在水中,添加适量的HX以形成混合物,并添加非水溶剂(例如上述非水介质)来结晶所述的盐。在一些实施方案中,合适的HX量是化学计量的量。应当理解,HX包括氢,并且X是如上定义的质子酸的药学上可接受的阴离子。
本公开的片剂制剂可以包含例如按重量计约40至85或约50至75%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约50%至70%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约50%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约66.7%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约75%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约80%的AG10或其药学上可接受的盐。在一些实施方案中,片剂包含按重量计约85%的AG10或其药学上可接受的盐。
片剂中AG10或其药学上可接受的盐的量可以为约0.1至约500mg,约0.1至约250mg或约0.1至约100mg。在一些实施方案中,片剂中存在的AG10的量为约10、25、50、100、200、300、400或500mg。在一些实施方案中,片剂中AG10的存在量为约50、100、200或400mg。在一些实施方案中,片剂的总重量(例如,活性成分加赋形剂-不包括包衣)为约50至约1500mg。例如,固体剂型的总重量为约100、150、200、300、400、500、600、700、800、900、1000或1500mg。
本公开的片剂制剂可以包含选自以下的至少一种成分:一种或多种填充剂,一种或多种粘合剂,一种或多种崩解剂,以及一种或多种润滑剂或其他成分。在一些实施方案中,片剂包含选自高级微晶填充剂,无机盐填充剂,崩解剂和润滑剂的一种或多种赋形剂。
在一些实施方案中,本公开的片剂制剂包含一种或多种填充剂。合适的填充剂描述如下。在一些实施方案中,一种或多种填充剂的存在量为按重量计约1%至60%,5%至55%,10%至50%或15%至45%。在一些实施方案中,一种或多种填充剂以按重量计约42.5%存在。在一些实施方案中,一种或多种填充剂以按重量计约25.8%存在。在一些实施方案中,一种或多种填充剂以按重量计约17.5%存在。
在一些实施方案中,本公开的片剂制剂包含1-3种填充剂。在一些实施方案中,本公开的片剂制剂包含1-2种填充剂。在一些实施方案中,本公开的片剂制剂包含两种填充剂。
合适的填充剂包括例如寡糖(例如乳糖),糖,淀粉,改性淀粉,糖醇(例如甘露醇,山梨糖醇,木糖醇,乳糖醇),无机盐,纤维素衍生物(例如微晶纤维素,硅化微晶纤维素,纤维素,羟丙甲纤维素),硫酸钙,硅酸铝和镁的复合物和氧化物等。无机盐填充剂的实例包括磷酸盐,例如磷酸氢二钙脱水盐,硫酸盐和二氧化硅。在一些实施方案中,一种或多种填充剂包括纤维素衍生物或氯化物,磷酸盐,硫酸盐等的碱土金属盐。在一些实施方案中,一种或多种填充剂包括纤维素衍生物和无机盐。在一些实施方案中,一种或多种填充剂是微晶纤维素和二氧化硅。在一些实施方案中,一种或多种填充剂是微晶纤维素。在一些实施方案中,微晶纤维素是高级微晶纤维素。
高档微晶纤维素是具有特定特性的纤维素衍生产品,这些特性不是微晶纤维素更标准制剂中的主要特征。例如,在一些实施方案中,高级微晶纤维素的特征在于具有球形形态和多孔结构的纤维素聚合物。这些特性可在CEOLUS
高级纤维素填充剂可以以约1至60%重量的量存在。在一些实施方案中,高级微晶纤维素以按重量计约5至55%的量存在。在一些实施方案中,高级微晶纤维素以约10至50%重量的量存在。在一些实施方案中,高级微晶纤维素以按重量计约15%至45%的量存在。在一些实施方案中,高级微晶纤维素的存在量为约15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31,32、33、34、35、36、37、38、39、40、41、42、43、44或45%重量。在一些实施方案中,高级微晶纤维素以约17%的量存在。在一些实施方案中,高级微晶纤维素以约26%的量存在。在一些实施方案中,高级微晶纤维素以约42%的量存在。
在一些实施方案中,本公开的片剂制剂包含一种或多种粘合剂。合适的粘合剂描述如下。在一些实施方案中,一种或多种粘合剂的存在量为按重量计约0.5%至15%,约0.5%至10%或约1%至10%。一些实施方案中,一种或多种粘合剂的存在量为约3至8%重量。在一些实施方案中,一种或多种粘合剂的存在量为按重量计约1、2、3、4、5、6、7、8、9或10%。在一些实施方案中,一种或多种粘合剂的存在量为约5%重量。
在一些实施方案中,本公开的片剂制剂包含1-3种粘合剂。在一些实施方案中,本公开的片剂制剂包含一种粘合剂。
合适的粘合剂包括例如聚维酮,乳糖,淀粉,改性淀粉,糖,阿拉伯胶,黄蓍树胶,瓜尔胶,果胶,蜡粘合剂,甲基纤维素,羧甲基纤维素,羟丙基甲基纤维素,羟乙基纤维素,羟丙基纤维素,共聚维酮,明胶,钠海藻酸盐等。非纤维素粘合剂包括缺乏纤维素主链的聚合物粘合剂和其他粘合剂。非纤维素粘合剂的实例包括聚维酮,乳糖,淀粉,改性淀粉,树胶,瓜尔胶,果胶,蜡,明胶,藻酸盐等。在一些实施方案中,制剂包含非纤维素粘合剂,例如聚维酮或共聚维酮。在一些实施方案中,非纤维素粘合剂是共聚维酮。
在一些实施方案中,本公开的片剂制剂包含一种或多种崩解剂。合适的崩解剂描述如下。在一些实施方案中,一种或多种崩解剂以按重量计约1%至15%,约1%至约12%或约1%至约10%的量存在。在一些实施方案中,一种或多种崩解剂以按重量计约3-8%存在。在一些实施方案中,制剂包含按重量计约3、4、5、6、7或8%的崩解剂。在一些实施方案中,所述制剂包含按重量计约5%的崩解剂。在一些实施方案中,制剂包含按重量计约6%的崩解剂。
在一些实施方案中,本公开的片剂制剂包含1-3种崩解剂。在一些实施方案中,本公开的片剂制剂包含一种崩解剂。
合适的崩解剂包括例如交联羧甲基纤维素钠,交联维酮,聚乙烯吡咯烷酮,淀粉羟乙酸钠,玉米淀粉。在一些实施方案中,所述制剂包含崩解剂,例如羟乙酸淀粉钠或交聚维酮。在一些实施方案中,崩解剂是交联羧甲基纤维素钠。
在一些实施方案中,本公开的片剂制剂包含一种或多种润滑剂。合适的润滑剂如下所述。在一些实施方案中,一种或多种润滑剂的存在量为约0.1至8%重量,0.5至5%重量,0.5至3%重量。在一些实施方案中,一种或多种润滑剂的存在量为按重量计约0.5、0.75、1、1.5、2、3、4或5%。在一些实施方案中,一种或多种润滑剂以按重量计约2%的量存在。在一些实施方案中,一种或多种润滑剂的存在量为约1.5%重量。
在一些实施方案中,本公开的片剂制剂包含1-3种润滑剂。在一些实施方案中,本公开的片剂制剂包含一种润滑剂。
合适的润滑剂包括例如硬脂酸镁,硬脂酸,棕榈酸,硬脂酸钙,滑石粉,巴西棕榈蜡,氢化植物油,矿物油,聚乙二醇和硬脂富马酸钠。在一些实施方案中,一种或多种润滑剂是硬脂酸镁和/或硬脂富马酸钠。在一些实施方案中,一种或多种润滑剂是硬脂酸镁。
可以使用的其他合适的填充剂,粘合剂,崩解剂,润滑剂和其他赋形剂在《药物赋形剂手册》(Handbook of Pharmaceutical Excipients),第二版,美国拉克曼,里昂,(American Lachman,Leon,)1976年;药物剂型形式(Pharmaceutical Dosage Forms):片剂体积,第1卷,第2版,利伯曼,赫伯特A(Lieberman,Herbert A.)等;1989;现代医药(ModernPharmaceutics)班克(Banker),吉尔伯特和罗德斯(Gilbert and Rhodes),克里斯托弗·T(Christopher T),1979年;和《雷明顿药物科学》(Remington's PharmaceuticalSciences),第15版,1975年,中有描述,它们每一个通过引用将其全部内容并入本文。
在一些实施方案中,片剂用包衣剂包衣。合适的包衣剂包括乙基纤维素,聚甲基丙烯酸酯以及由OPADRY
13B50579,欧巴代白色(Opadry White)33628707,欧巴代QX 321A180025或欧巴代II(33G28707)。在一些实施方案中,包衣剂是欧巴代白色33628707。在一些实施方案中,包衣剂是欧巴代QX 321A180025。在一些实施方案中,涂层剂是欧巴代II(33G28707)。为了计算片剂的重量百分比,在计算中不包括包衣剂的量。即,本文报道的重量百分比是未包衣片剂的重量百分比。
在一些实施方案中,所述片剂包含按重量计约40%至85%的AG10或其药学上可接受的盐;和约5至55%重量的一种或多种填料;约0-15%重量的一种或多种粘合剂;约1至15%重量的一种或多种崩解剂;和约0.1至8%重量的一种或多种润滑剂。在一些实施方案中,所述制剂包括包衣剂。
在一些实施方案中,片剂包含按重量计约50%至75%的AG10或其药学上可接受的盐;和约10至50%重量的一种或多种填料;约3至约8%重量的一种或多种崩解剂;0.5至3%重量的一种或多种润滑剂。在一些实施方案中,所述制剂包括包衣剂。
在一些实施方案中,所述片剂制剂包含按重量计约50%的AG10或其药学上可接受的盐;约42.5%重量的一种或多种填料;约6%重量的崩解剂;和约1.5%重量的润滑剂。在一些实施方案中,所述制剂包括包衣剂。
在一些实施方案中,所述片剂制剂包含按重量计约66.7%的AG10或其药学上可接受的盐;约25.8重量%的一种或多种填料;约6%重量的崩解剂;和约1.5%重量的润滑剂。在一些实施方案中,所述制剂包括包衣剂。
在一些实施方案中,所述片剂制剂包含按重量计约75%的AG10或其药学上可接受的盐;约17.5%重量的一种或多种填料;约6%重量的崩解剂;和约1.5%重量的润滑剂。在一些实施方案中,所述制剂包括包衣剂。
在一些实施方案中,在装置II(桨法)中,在37±0.5℃下,约50rpm的桨速度,10分钟后,本发明的片剂在0.1N HCl的溶液中至少溶解75%。在一些实施方案中,在在装置II(桨法)中,在37±0.5℃下,约50rpm的桨速度,10分钟后,本发明的片剂在0.1N HCl的溶液中至少溶解85%。在一些实施方案中,在装置II(桨法)中,在37±0.5℃下,约50rpm的桨速度,10分钟后,本发明的片剂在0.1N HCl的溶液中至少溶解95%。在一些实施方案中,所测试的片剂是在溶出度测试的一周内制备的。在一些实施方案中,所测试的片剂是在进行溶出度测试之前至少一个月制备的。在一些实施方案中,所测试的片剂是在进行溶出度测试之前至少三个月制备的。在一些实施方案中,所测试的片剂是在进行溶出度测试之前至少六个月制备的。在一些实施方案中,在进行溶出度测试之前,将片剂在25℃和60%相对湿度(室温)下温育一个月。在一些实施方案中,在进行溶出度测试之前,将片剂在25℃和60%相对湿度(室温)下温育两个月。在一些实施方案中,在进行溶出度测试之前,将片剂在25℃和60%相对湿度(室温)下温育三个月。在一些实施方案中,在进行溶出度测试之前,将片剂在40℃和75%相对湿度(室温)下温育一个月。在一些实施方案中,在进行溶出度测试之前,将片剂在40℃和75%相对湿度(室温)下温育三个月。在一些实施方案中,在进行溶出度测试之前,将片剂在40℃和75%相对湿度(室温)下温育六个月。
III.实施例
提供以下实施例以说明但不限制要求保护的发明。
实施例1:胶囊和片剂评估,胶囊提供的口服药代动力学数据不一致
当每天一次以20、60和200mg/kg的剂量通过管饲法对狗给药3天时,测定AG10的药代动力学特性(研究编号1)。每组由两只动物/性别/组组成。在给药前第1天,给药后0.25、0.5、1、2、4、8、12和24小时,给药前第3天,给药后0.25、0.5、1、2、2、4、8、12、24、48和72小时,从动物身上采集血样。通过LCMS/MS测定血浆样品的AG10。总体上,在AG10的平均C
还对非幼稚的雄性和雌性比格犬口服给药后确定了AG10的药代动力学特性(研究编号2)。研究设计包括三个治疗组(n=2/性别/组)。第1组和第2组分别接受5mg/kg和20mg/kg AG10的0.5%甲基纤维素(MC)制剂。第3组动物接受明胶胶囊形式的20mg/kg AG10。在给药前和给药后约2、4、6、8、12和24小时收集血液样品。通过LC-MS/MS测定血浆样品的AG10。给予20mg/kg AG10(0.5%甲基纤维素配制的悬浮液)的狗的AG10血浆暴露量(AUC
将AG10口服给予4只雄性比格犬,每只为50mg片剂,200mg片剂和200mg胶囊(第3号)。在给药前和给药后约0.25、0.5、1、2、4、8、24、48、72和96小时收集血液样品。通过LC-MS/MS测定血浆样品的AG10。用未配对的t检验确定200mg片剂和200mg胶囊给药的狗的C
表1:口服强饲法对狗给予AG10的各种制剂的药代动力学特性比较
在比较AG10甲基纤维素制剂的狗研究中,研究1达到最大浓度(Tmax)的时间为0.44±0.38hr,研究2中为2.5±1hr。研究2号中的胶囊未用赋形剂配制,相比于甲基纤维素比较剂,显示出较低的变异性(Tmax=2±0小时)。在第3号研究中,即使AG10片剂的最大暴露量与胶囊的相当,在口服含赋形剂胶囊的四只动物中,动物之间的AG10吸收变异性也更大。对于50mg片剂,达到最大浓度(Tmax)的时间为0.500±0小时,对于200mg片剂,Tmax为1.00±0小时。对于含赋形剂的200mg胶囊,Tmax在1.38±0.750hr时变化更大。因此,在头对头比较中,片剂可产生更一致的AG10口服吸收。
实施例2:AG10的高负荷速释片剂制剂
以下实施例描述了成功制备含有大量AG10的片剂的方法。
制备了包含不同量的AG10的三种片剂。表2提供有关每种配方中使用的相对含量的信息。
表2:高负荷AG10片剂配方
压制后,将片剂用欧巴代QX白色薄膜包衣。
使用图1中提供的一般示意图制备片剂。下表3提供了用66.7%的AG10 HCl配制片剂(第二批)的示例性用量,并且表4和表5提供了所用设备的清单以及制备片剂的步骤概述。参考表2,在制作第一批和第三批时执行了类似的过程。
表3:高负荷AG10片剂配方
表4:使用的设备
表5:程序摘要
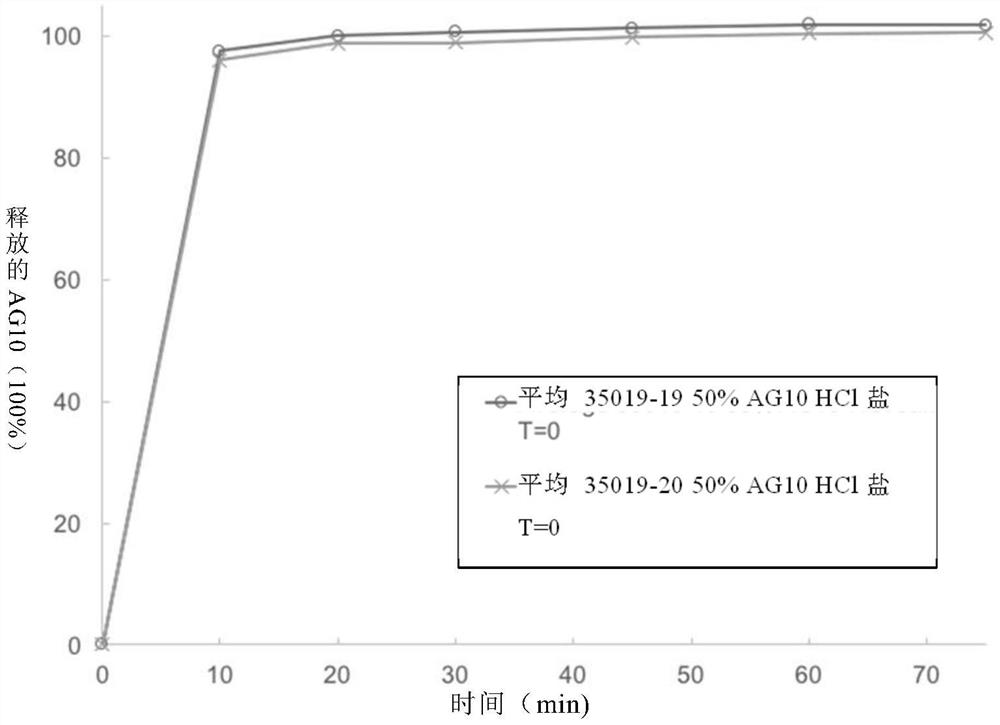
图2中显示了50%(w/w)和66.7(w/w)AG10 HCl包衣片剂的图。用8x 17.5mm胶囊状模具压制50%的片剂,而在7.5x 15mm胶囊状模具中压制66.7%的片剂。所展示的两种片剂的物理性能总结于表6。
表6:物理性质总结
易碎性的测量:如表格所示,根据USP方法<1216>,通过在压碎机(EF-2型,Electrolab)中翻滚,以25rpm转100轮的NLT 6.5克片剂的失重百分比来评估片剂的易碎性。将片剂除尘,将由于破裂或磨损引起的重量损失记录为重量损失百分数。低于1%的易碎性被认为是可接受的。
接下来,确定了50%(w/w)和66.7(w/w)AG10 HCl包衣片剂的溶出度。通过将片剂放入表7描述的0.1N HCl溶液中进行溶出实验。
表7:溶出参数
图3显示了50%(w/w)和66.7(w/w)AG10 HCl包衣片剂的溶出曲线。配制片剂后,在没有明显温育时间的情况下进行了溶出实验。如图3所见,两种片剂在10分钟内溶出达到100%释放。
实施例3:易碎性测试期间,超过33.3%的AG10片剂配方显示出片剂侵蚀
下列实施例描述了AG10片剂,其中易碎性测试中如果没有片剂侵蚀,则不能超过33.3%的载药量。
AG10的制剂按照图4和图5的概述进行制备。AG10和其他成分的量在表8中描述。
表8:制备的AG10片剂配方
上述参考配方中的每一个均制备为200mg片剂,并按照实施例2的方法进行易碎性测试。在33.0%的药物负荷下配制的L018A和L018B片剂(分别在高和中硬度kP值下压缩)具有抗碎裂性,在易碎性试验后仅出现了轻微的片剂边缘侵蚀(如果有的话)。参见图6。相比之下,在40%的药物负载下制备并在可达到的最大硬度下压缩的L016和L017在脆性测试后呈现出主要的片剂边缘侵蚀。参见图7。
上面讨论的制剂使用标准等级的微晶纤维素,并且AG10含量大于33.0%的所得片剂具有易碎性问题,损害了其临床用途。相比之下,实施例2的制剂使用高级微晶纤维素,可靠地提供了具有良好物理性能且不易碎的片剂。
实施例4:“加速稳定性条件”溶出度测试证明了高负荷AG10片剂的稳定性
以下实施例描述了含33%AG10 HCl(200mg)与标准微晶纤维素的速释片剂和含有66.7%AG10 HCl(400mg)与高纯度微晶纤维素的片剂的制备和随后的溶出度试验。
每种片剂的配方分别示于表9和表10。
表9 33%AG10 HCl片剂的定量组成
表10 66.7%AG10 HCl片剂的定量组成
图8和图9中显示了两种片剂的制造过程。
将33%的AG10 HCl片剂装瓶并置于加速储存(40℃/75%相对湿度(RH))条件下。图10结果表明,在加速储存条件下储存,大大降低了33%AG10 HCl片剂的溶出率。
也将66.7%的AG10 HCl片剂装瓶并置于加速储存条件下。图11结果表明,400mgAG10 HCl片剂在储存6个月后未显示溶出度降低。
使用相同的溶解方法(USP 2仪器(浆法),900mL 0.1N HCl,75RPM,37℃)评估AG10HCl片剂的两种制剂的释放和稳定性。就储藏后的溶解速度而言,66.7%的AG10 HCl片剂比33%的AG10 HCl片剂优越,表明66.7%的AG10 HCl片剂具有优秀的储藏能力。
尽管出于清楚理解的目的已经通过图示和示例的方式详细地描述了前述发明,但是本领域技术人员将理解,可以在所附权利要求的范围内进行某些改变和修改。另外,本文提供的每个参考文献通过引用整体并入本文,其程度与每个参考文献通过引用单独并入的程度相同。在本申请与本文提供的参考文献之间存在冲突的情况下,以本申请为准。
- AG10的制剂
- 包含神经营养剂、凋亡信号传导片段抑制剂(FAS)或FAS配体(FASL)抑制剂、肿瘤坏死因子-α(TNF-α)或TNF受体抑制剂、线粒体肽、寡核苷酸、趋化因子抑制剂或半胱氨酸-天冬氨酸蛋白酶的药物递送系统
