活体外诱导成体干细胞增殖及分化
文献发布时间:2023-06-19 11:14:36
优先权:
本发明主张于2018年7月2日提交的美国临时申请案,申请号No.62/692,862 的优先权,其标题为“体外诱导CD34阳性成体干细胞增殖”,其全部公开内容通过引用并入于此。
技术领域
本发明大体上是关于一种诱导成体干细胞(ASC)活体外增殖及/或分化的组合物及其使用方法,其使用某些较小非编码RNA(snRNA)以及一些定义蛋白因子,包括小发夹样RNA(shRNA)、microRNA前驱物(pre-miRNA)及/或短干扰RNA(siRNA)以及由以下组成的一或多个定义因子:碱性纤维母细胞生长因子(bFGF)/纤维母细胞生长因子2(FGF-2)、白血病抑制因子(LIF)、似胰岛素生长因子(IGF)、表皮生长因子(EGF)、血小板分化的生长因子(PDGF)、血管内皮生长因子(VEGF)、转型生长因子(TGF)、肿瘤坏死因子(TNF)、干细胞因子(SCF)、同源盒蛋白质(HOX)、 Notch、GSK、Wnt/β-连环蛋白信号、介白素及/或骨成形性蛋白质(BMP)。具体而言,本发明是关于一种诱导CD34+成体干细胞(CD34+ASC)活体外增殖及/或分化的组合物及其使用方法,其使用miR-302模拟shRNA、pre-miRNA 及/或siRNA,含有与5'-UAAGUGCUUC CAUGUUU-3'同源的共用序列,且进一步结合使用选自以下的一或多个定义因子:bFGF/FGF-2、LIF、IGF、EGF、 PDGF、VEGF、TGF、TNF、SCF、HOX、Notch、GSK、Wnt/β-连环蛋白、介白素及/或BMP。诱导成体干细胞增殖及分化的原理与近年来在皮肤伤口愈合活体内模型中发现的新颖的诱导性对称成体干细胞分裂机制有关。所得扩增的成体干细胞适用于治疗多种人类衰老相关病症及细胞功能障碍相关病症,包含但不限于阿兹海默症(Alzheimer's disease)、帕金森氏症 (Parkinson's disease)、运动神经元疾病、中风、糖尿病、骨质疏松症、心肌梗塞、血友病、贫血症、艾滋病(AIDS)、白血病、淋巴瘤及许多类型的癌症。值得注意地,本发明亦适用于由向身体供应无限扩增的自身成体干细胞,以便活体内修复及再生受损及/或衰老组织及器官来预防衰老以及治疗衰老相关的退行性不适。
背景技术
干细胞类似于含有众多有效成分的生命百宝箱,其适用于刺激新细胞及组织再生、修复及/或再生受损/老化组织、治疗退行性疾病及预防肿瘤/癌症形成及进展。因此,可设想,我们可使用此等干细胞作为新颖药物筛检、鉴别、分离及制造的工具。因此,由此获得的药物可适用于开发医药及治疗应用,诸如用于研究、诊断及/或疗法使用的生物医学利用、装置及/或设备及其组合。
MicroRNA(miRNA)为人胚胎干细胞(hESC)中的主要有效成分之一。主要hESC特异性miRNA包括但不限于miR-200家族、miR-290 至295家族、miR-302家族、miR-371至373家族及miR-520家族的成员。其中,已发现miR-302家族在多能性维持及肿瘤抑制中起关键作用(Lin及 Ying,2008;Lin等人,2008,2010及2011)。MiR-302含有八个(8)家族成员,包括四个(4)正义miR-302(a、b、c及d)及四个(4)反义miR-302* (a*、b*、c*及d*)序列。此等正义及反义成员彼此部分互补且可分别形成双螺旋构形。举例而言,miR-302的前驱物为分别由miR-302a与a* (pre-miR-302a;SEQ.ID.NO.1)、miR-302b与b*(pre-miR-302b; SEQ.ID.NO.2)、miR-302c与c*(miR-302c;SEQ.ID.NO.3)及miR-302d与 d*(pre-miR-302d;SEQ.ID.NO.4)的双螺旋(茎臂)形成的发夹样小RNA,在一端有连接的核苷酸序列(茎环)。为了活化miR-302功能,miR-302前驱物(pre-miR-302)首先由细胞RNase III Dicer加工为成熟miR-302及miR-302*且进一步与某些阿尔古(AGO)蛋白形成RNA诱导的沉默复合物 (RISC),随后导致靶基因转录物(mRNA)、尤其发育基因及致癌基因mRNA 的RNA干扰(RNAi)介导的直接降解或转译抑制(Lin等人,2008,2010及 2011)。
MiR-302为hESC及诱导多能干细胞(induced pluripotent stem cell,iPSC)中发现的最丰富非编码(ncRNA)物种。我们先前研究已显示,miR-302超出hESC中所见含量的异位过度表现能够以类似于桑椹胚期的早期人类受精卵的相对缓慢细胞周期速率(20-24小时/周期)将人类正常及癌组织细胞两者皆重新编程为hESC类iPSC(Lin等人,2008,2010 及2011;Lin的EP 2198025;U.S.9,567,591;U.S.9,394,538及美国专利申请案第12/318,806号)。相对静止为此等miR-302诱导的iPSC的确定特征,而hESC及其他先前报导的四因子诱导的(Oct4-Sox2-Klf4-c-Myc或 Oct4-Sox2-Nanog-Lin28)iPSC全部展示类似于肿瘤/癌细胞的高度增殖性细胞周期速率(12-15小时/周期)(Takahashi等人,2006;Yu等人,2007;Wernig等人,2007;Wang等人,2008)。为研究miR-302的肿瘤抑制效应,我们已鉴别涉及两种miR-302靶向G1-检查点调节子,包括周期素依赖性激酶2(CDK2)及周期素D(Lin等人,2010;Lin的U.S.9,394,538及 U.S.9,422,559)。已知细胞周期进程是由周期素依赖性激酶(CDK)的活动驱动,其与正调节亚单位、周期素以及负调节子、CDK抑制剂(CKI,诸如 p14/p19Arf、p15Ink4b、p16Ink4a、p18Ink4c、p21Cip1/Waf1及p27Kip1) 形成功能复合物。在哺乳动物中,不同周期素-CDK复合物参与调节不同细胞周期过渡,诸如周期素-D-CDK4/6用于G1期进程、周期素-E-CDK2用于 G1-S过渡、周期素-A-CDK2用于S期进程及周期素-A/B-CDC2(周期素 -A/B-CDK1)用于进入M期。因此,我们研究表明,miR-302的肿瘤抑制功能由在G1-S过渡期间周期素-E-CDK2及周期素-D-CDK4/6路径的共抑制产生。
尽管miR-302适用于设计及开发新颖抗癌药物/疫苗,但其制造成问题,因为天然miR-302及其前驱物仅可见于人多能干细胞(诸如 hESC)中,其资源极其有限。或者,合成小干扰RNA(siRNA)可用以模拟天然miR-302前驱物(pre-miR-302);然而,因为发夹样pre-miR-302结构的茎臂区域是由两个不完美互补的正义miR-302及反义miR-302*股形成,所以合成性完美匹配的siRNA-302模拟物无法取代天然miR-302*的功能,其序列不同于siRNA的反义股。举例而言,siRNA-302a模拟物的反义股为 5'-UCACCAAAAC AUGGAAGCAC UUA-3'(SEQ.ID.NO.5),而天然miR-302a*为 5'-ACUUAAACGU GGAUGUACUU GCU-3'(SEQ.ID.NO.6)。因为全miR-302功能由其正义miR-302及反义miR-302*股两者产生,所以使用彼等siRNA模拟物的先前报导已展示一些与实际天然miR-302功能不同的结果。此外,由于正义miR-302与反义miR-302*序列之间存在高度(23%至46%)错配的核苷酸,所以合成性miR-302及miR-302*不可能形成自然界中的任何正确的杂合双螺旋,尤其在无茎环结构的帮助下。pre-miRNA茎环结构的功能应使得两个错配的正义及反义miRNA序列接近且足够长以形成稳定及正确的杂合双螺旋构形。在另一方面,我们近期iPSC探索可提供pre-miR-302制造的替代性解决方案(Lin的EP 2198025;U.S.9,567,591及美国专利申请案第 12/318,806号)。尽管如此,使此等iPSC生长的成本仍过高以致无法用于产业生产。
除了iPSC产生,我们近期研究进一步发现miR-302亦可诱导CD34+成体干细胞(CD34+ASC)活体内增殖及分化(Lin的U.S.9,879,263 及美国专利申请案第15/661,346号)。试图增殖成体干细胞(ASC)群的先前技术包括使用GSK-3的Moon的美国专利第7,850,960号、使用Wnt/β- 连环蛋白信号传导路径的Moon的美国专利第8,372,397号及欧洲专利第 EP2415480A2号、使用G-CSF/GM-CSF加SCF的Rudd的美国专利申请案第 11/614,345号,及使用Wnt7a的Rudnicki的美国专利申请案第13/266,428 号。此外,若干科学报导亦已表明HOXB4及Notch1/4涉及诱导人类CD34+ 造血干细胞(HSC)离体增殖(Antonchuk等人,Cell109:39-45,2002;Karlsson S.Blood 104:2210-2211,2004;Schiedlmeier等人,PNAS USA104:16952-16957,2007)。此外,Miller等人(PNAS USA 94:13648-13653, 1997)进一步证实使用IL-6/11、flt3-配位体及Steel因子(SF)诱导鼠类(CD34-阴性)HSC活体外增殖。尽管如此,如Walasek等人(Ann.N.Y. Acad.Sci.1266:138-150,2012)汇总的最新综述中所描述,其陈述「由于不可能产生足够的干细胞数目及起始细胞群的过度分化,试图提高离体增殖的造血干细胞及前驱细胞(HSPC)的造血复原及移植可能性在很大程度上是不成功的。尽管造血干细胞(HSC)将在活体内移植之后迅速地增殖,但活体外研究的经验表明控制HSPC在培养基中的自我更新及分化仍有困难。基于造血细胞激素(cytokines)的方案尚不能支援培养基中不成熟干细胞的可靠扩增,从而表明需要额外因子」。具体而言,应注意此等增殖的成体干细胞不能重复地培养多个活体外或离体继代。因此,所有此等先前技术仅可提供起始成体干细胞群的最大限度地十至几百倍扩增,其不足以用于临床疗法。
鉴于先前成体干细胞增殖方法的低扩增率及较差多潜能性品质,期望拥有克服此等问题的新颖解决方案。明显地,如Walasek陈述,尽管的前无人知道因子是什么,可能需要满足此工作的额外关键因子。为达至此目的,我们近期研究已鉴别出能够克服所有先前技术问题的新颖关键因子,使用较小microRNA(miRNA)、miR-302而非蛋白质。先前技术忽略此miRNA,因为并不知道其DNA脱甲基化功能,其需要用于解锁细胞基因体中的天然障壁,诸如基因甲基化及组蛋白乙酰化,以便活化在各种活体外、离体及活体内条件下诱导成体干细胞增殖及/或分化所需要的基因调节过程的全机制。
发明内容
本发明的原理主要依赖于miR-302的DNA脱甲基化功能。可想象地,其他小RNA,诸如shRNA、siRNA及发夹样pre-miRNA或化学物质以及具有类似功能的蛋白因子可用于替换miR-302,以用于诱导细胞中的 DNA脱甲基化及活化成体干细胞活体外、离体以及活体内增殖及/或分化的相同目的。众所周知,干细胞含有高度脱甲基化基因体以便保存且维持其多能性(pluripotency)(亦即hESC及iPSC)或多潜能性(multipotency) (亦即成体干细胞)。在细胞基因体中,DNA甲基化充当建立所有种类的细胞类型特异性基因表现图谱的锁且因此阻止任何可能的体细胞逆向进展或重新编程回至干细胞。因此,DNA脱甲基化为解锁基因体且将基因表现模式重设为独特的干细胞特异性图谱所需的最重要的关键步骤,以便诱导且维持在干细胞更新及/或重新编程期间的多能性或多潜能性。为研究此DNA脱甲基化过程,我们为发现hESC及iPSC中miR-302介导的DNA脱甲基化的机制的第一批科学家(Lin及Ying,2008;Lin等人,2008及2011;Ying等人, 2018)。我们先前研究已揭示miR-302可下调多个关键表观遗传调节子,诸如MECP1/2、AOF1/2(或称作KDM1b/1a或LSD2/1)、DNMT1、HDAC2/4及MBD2,以便于基因体DNA脱甲基化及iPSC重新编程(Lin及Ying,2008;Lin等人,2008,2011及2013)。同样地,miR-302可能够下调全部或一些此等关键表观遗传调节子以诱导且维持成体干细胞更新及增殖。
microRNA(miRNA)-介导的基因调节的强度是取决于miRNA 浓度及miRNA与其靶基因之间的亲和力。换言的,较强靶基因将呈现与miRNA 的更高亲和力且因此需要更低miRNA浓度沉默,且反的亦然。因此,不同靶基因将在所使用的不同水准的miRNA浓度下经下调。举例而言,我们已发现使用更高miR-302浓度(高于hESC H1及H9细胞株的miR-302含量)可诱导体细胞重新编程以形成hESC样iPSC(Lin等人,2008,2010及2011;Lin 的EP 2198025、U.S.9,567,591、U.S.9,394,538、美国专利申请案第 12/318,806号),而我们最新发明亦展示使用相对更低miR-302浓度(hESC H1及H9中miR-302含量的约10%至50%)诱导CD34+成体干细胞活体内增殖 (Lin的U.S.9,879,263及美国专利申请案第15/661,346号)。此证据表明此等两个不同事件的机制有可能彼此不同且可涉及略微不同的miR-302 靶基因集合。具体而言,因为使用仅miR-302可仅诱导CD34+成体干细胞在伤口愈合条件下活体内增殖,而非在活体外细胞培养基增殖,可设想参与伤口愈合的其他定义因子可能亦需要连同miR-302起作用,以建立诱导成体干细胞活体外增殖及/或分化所必需的成体干细胞特异性基因图谱。此等伤口愈合相关定义因子可包括但不限于碱性纤维母细胞生长因子(bFGF)/纤维母细胞生长因子2(FGF-2)、白血病抑制因子(LIF)、似胰岛素生长因子 (IGF)、表皮生长因子(EGF)、血小板衍生的生长因子(PDGF)、血管内皮生长因子(VEGF)、转型生长因子(TGF)、肿瘤坏死因子(TNF)、干细胞因子(SCF)、同源盒蛋白质(HOX)、Notch、GSK、Wnt/β-连环蛋白信号、介白素及/或骨成形性蛋白质(BMP)。
miR-302家族为hESC及iPSC中最丰富的miRNA物种。全部正义miR-302家族成员共用其5'-末端十七个(17)核苷酸的相同共有序列 5'-UAAGUGCUUC CAUGUUU-3'(SEQ.ID.NO.7),且其全长23-核苷酸成熟序列中含有>82%同源性。基于在线计算程式TARGETSCAN (http://www.targetscan.org/)及PICTAR-VERT(
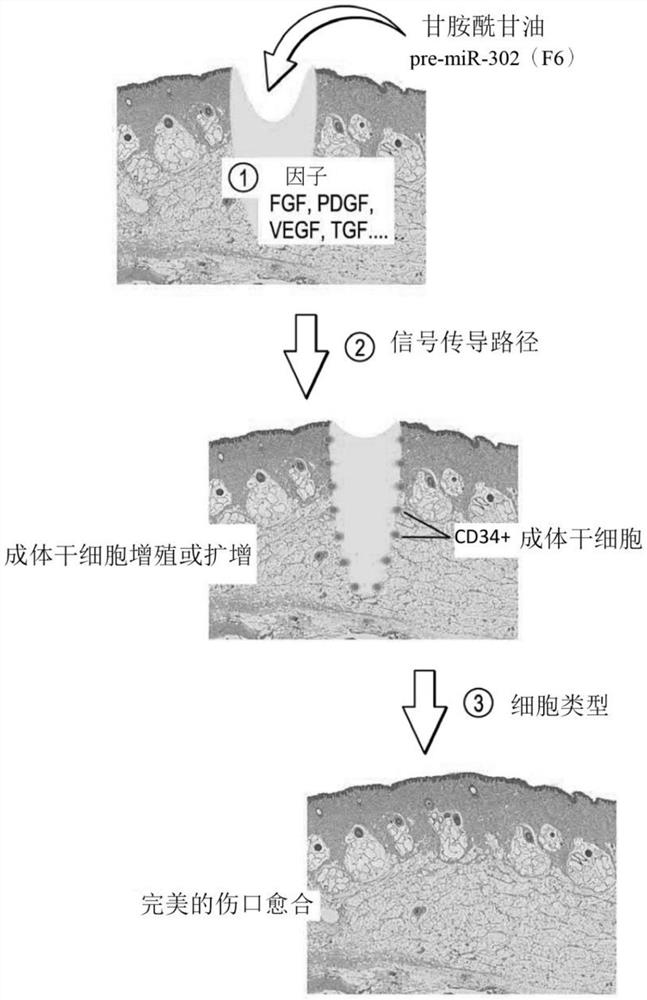
干细胞研究是开发新型再生医疗的关键。为此目的,我们研究集中于自干细胞筛检、探索及分离新颖药品以用于治疗各种人类疾病。iPSC的首次亮相极大地推动了我们在此研究方向上的进展。使用iPSC,我们已将「甘胺酰甘油」分离且鉴别为一组保护胚胎干细胞特异性miRNA (ESC-miRNA)(包括miR-302)以避免分解且因此保存其保持iPSC及ESC 的多能性的功能的新颖糖类化学物质(Lin的美国专利第9,387,251号)。我们近期研究(LinSL,2018)已进一步证实一些经分离甘氨酰甘油结合的 ESC-miRNA(具体而言miR-302)可用于经由诱导CD34+成体干细胞 (CD34+ASC)活体内增殖来促进无疤痕的(或称作完美的)伤口愈合。因为的前无任何类似机制的报导,本发明在本文中提供第一证据:(1)miR-302 及其他伤口愈合相关定义因子参与成体干细胞活体内以及活体外增殖机制的新颖功能;(2)诱导CD34+成体干细胞活体外增殖的第一复原模型;及 (3)分化自所诱导的CD34+成体干细胞(iCD34+ASCs)的可能体细胞组织细胞类型。本发明诱导的CD34+成体干细胞活体外增殖及分化提供能够活体外提供无限的及足够的患者自身的成体干细胞,以用于活体内执行自体移植疗法以治疗各种人类疾病,包含但不限于阿兹海默症、帕金森氏症、运动神经元疾病、中风、糖尿病、骨质疏松症、心肌梗塞、血友病、贫血症、AIDS、白血病、淋巴瘤、及许多类型的癌症,以及衰老。自体移植是预防免疫排斥的最佳干细胞治疗方式。因此,本发明将确实为推进新颖干细胞疗法的突破性发展奠定坚实的基础,从而对未来再生医疗产生显著的影响。
活体内诱导成体干细胞增殖模型。
我们在2011年使用自iPSC分离的miR-302前驱物 (pre-miR-302)建立第一个诱导性成体干细胞活体内增殖模型。使用小鼠皮肤伤口愈合模型,我们观测到在pre-miR-302处理之后活体内形成成体干细胞样增殖囊(pouch)(但为CD34阴性)(Chen等人,2013;Lin SL,2018)。因为CD34为人类及猪成体干细胞而非小鼠成体干细胞的有效干细胞标记物,所以对此我们于2014年使用相同处理方法建立另一猪皮肤伤口愈合模型,其展示类似的囊样CD34+成体干细胞活体内增殖(图1至5)。因此,我们目前已具有用于研究成体干细胞活体内、离体以及活体外增殖及分化的机制的猪(CD34阳性)及小鼠(CD34阴性)成体干细胞增殖模型。
伤口愈合为研究成体干细胞活动的最佳活体内模型。在旧有的理论上,成体干细胞可不对称地分裂以得到一个自身复本(成体干细胞) 及另一分化子细胞(称作前驱细胞),其中前驱细胞可进一步分裂并分化成多种用于修补受损组织的新颖组织细胞。因此,完美的(无疤痕)伤口愈合事件需要足够的成体干细胞以提供充足的用于充分修补及恢复全部受伤组织区域的新颖组织细胞。在此情境下,如何维持足够的成体干细胞群活体内的稳定平衡(homeostasis)是关键步骤。尽管如此,旧的「不对称干细胞分裂」理论不能维持此类成体干细胞的稳定平衡,因为存在如此多的能够损坏成体干细胞的内部及环境风险,包括但不限于污染、毒害、辐射、应力、损伤、病痛及甚至衰老。为克服此问题,我们尝试使用miR-302的DNA脱甲基化功能以诱导及/或增强对称的成体干细胞分裂。
使用活体内猪皮肤伤口愈合处理模型(图1及3),我们发现相较于未处理对照组及其他对照miR-434-模拟siRNA(miR-434)处理组的结果,经分离pre-miR-302(miR-302)及iPSC裂解物两者的处理在全部活体内测试样本(各组n=12/12)中可诱导快速及无疤痕的伤口愈合。针对更多细节,图5进一步展示相较于未处理对照组(亦即样本190-CR3)的组织学结果,在miR-302处理之后(亦即样本190-BR2)的无疤痕伤口愈合的组织学结果。在全部定量量测之后,图4的直线图分别概述了图3的不同处理组的时程伤口闭合率。因为iPSC裂解物亦含有大量miR-302,其展示 miR-302及iPSC裂解物处理两者在第11天得到高达90%的伤口闭合率,而其他对照处理组仍需要多6天(第17天)以达至相同愈合结果。最重要地,在前3天伤口愈合阶段期间,经miR-302及iPSC裂解物处理的样本两者已展示≥10%至20%的伤口收缩,其是无疤痕伤口愈合所需的最关键步骤!众所周知,伤口收缩为愈合期间组织修补的关键期且因此伤口收缩的任何延迟将导致愈合组织的外形损伤及疤痕形成。
使用绿萤光抗CD34抗体进行免疫组织化学(IHC)染色(图5),我们在miR-302及iPSC裂解物处理的皮肤两者中,而非在未处理或经 miR-434处理样本中,鉴别出经增殖CD34+成体干细胞囊的规律分布模式。此等增殖囊中的每一者含有大致≥20至1200的CD34+成体干细胞。因为不对称的干细胞分裂不会产生如此多的成体干细胞增殖囊,所以其必须由 miR-302处理诱导的「对称的干细胞分裂」机制来产生。值得注意地,此等 CD34+成体干细胞囊规律地分布于真皮及表皮层的整个接合区域中且通常保持彼此不随机地相距约240至290μm的距离,从而表示经诱导CD34+成体干细胞是自皮肤组织中的原始成体干细胞而非随机体细胞重新编程事件而特定地扩增且增殖。未处理样本亦展示两个单一CD34+成体干细胞之间的相同距离,但在愈合组织区域中无任何成体干细胞增殖的迹象。两个成体干细胞之间的此规律距离可表示皮肤组织中修补及恢复系统的完整网路。
鉴于图1至5中所展示的结果,我们研究已确定(1)与习知抗生素软膏处理的伤口闭合率相比,miR-302处理使伤口闭合率增加超过 70%至90%(图3及4);(2)miR-302处理在全部测试样本(n=12/12)中产生极小疤痕或无疤痕伤口愈合(图3至5);及(3)miR-302处理在全部经处理样本(n=12/12)中诱导CD34+成体干细胞增殖在活体内增加超过20 至1000倍(图5)。基于此等研究结果,我们对此得出结论,需要在伤口愈合条件下使用miR-302以诱导及保持CD34+成体干细胞活体内增殖,以便促使完美的伤口愈合结果。可想象地,miR-302及某些伤口愈合相关因子的组合使用同样可能够诱导及维持成体干细胞活体外增殖。然而,由于活体内存在许多伤口愈合相关因子,所以其在成体干细胞增殖机制中的功能作用的个别意义仍待测定。为此,本发明已揭示一些此等定义因子。
为鉴别参与成体干细胞增殖的定义因子,我们已进一步执行雷射捕获显微切割(LCM)及基因微阵列分析以研究经分离CD34+成体干细胞的基因图谱及成体干细胞活体内增殖的相关基因调节机制(图1及2)。基于鉴别出的基因图谱,我们发现诱导成体干细胞增殖及分化的过程(步骤) 包括:(1)miR-302下调若干关键表观遗传基因(具体而言MECP1/2及HDAC2/4)以建立细胞基因体中的特异性DNA脱甲基化模式,(2)特异性 DNA脱甲基化模式随后诱导特定的对称干细胞分裂(SSCD)相关基因集合的表现且由此活化其下游信号传导路径,及(3)经诱导SSCD相关基因及伤口愈合相关定义因子随后一起工作以刺激且维持成体干细胞增殖;但最重要地,其必须在特异性DNA脱甲基化条件下持续地保持一起作用,以便充分完成成体干细胞增殖及分化的完整机制。鉴于此新确定的机制,全部先前技术方法已明显地不能提供此类特异性DNA脱甲基化条件以保持成体干细胞活体外或离体增殖且因此可能不会产生足够的经扩增成体干细胞用于临床疗法。为克服此问题,本发明是使用miR-302介导的DNA脱甲基化建立与伤口愈合相关定义因子一起工作所需的条件,以便完成成体干细胞活体外增殖及分化的全过程的第一方法。
活体外诱导CD34+成体干细胞增殖模型.
使用LCM及微阵列分析(图1、2及6),我们已鉴别出若干用于诱导CD34+成体干细胞活体外增殖的定义因子。起始CD34+成体干细胞可自人类或猪的以酶促方式解离的皮肤细胞分离(图6,上图)。在补充有经鉴别定义因子(诸如bFGF/FGF2、LIF及一些其他视情况存在的伤口愈合相关因子)的无饲养层MSC增殖培养条件下,我们发现miR-302或其siRNA /shRNA模拟物的处理可诱导每一活体外处理组的经分离皮肤CD34+成体干细胞扩增超过20至100倍(一个细胞培养继代约≥6至8次细胞分裂)。由每3至4天更新补充有新制miR-302、LIF、bFGF/FGF2及/或其他视情况存在的定义因子的细胞培养基,我们可重复地培养此等经诱导CD34+成体干细胞(iCD34+ASCs)超过5至6个继代且最终达至超过1千万至1亿倍的净CD34+成体干细胞活体外增加。LIF为成体干细胞增殖所需的经鉴别SSCD 相关基因中的一种,而其他选择性的愈合相关定义因子可增强miR-302诱导的成体干细胞增殖的效果,但并非需要的,包括IGF、EGF、PDGF、VEGF、 TGF、TNF、SCF、HOX、Notch、GSK、Wnt/β-连环蛋白、介白素及/或BMP。
最受关注的,全部此等经增殖CD34+成体干细胞由CD34+成体干细胞衍生的膜薄层(弱或无CD34表现)包围且因此并不直接与其他CD34 阴性组织细胞接触(图6,左下图)。因此,我们可容易地分离且收集纯诱导CD34+成体干细胞集落用于进一步扩增。迄今为止,我们已成功地培养且保持经增殖诱导CD34+成体干细胞超过10个继代而在核型分析中无任何可侦测变化。此后,自细胞培养基去除miR-302暂停经诱导CD34+成体干细胞分裂但并不影响细胞存活率(图6,右下图)。在因培养基中缺失某一定义因子而不同的细胞培养条件下,经诱导CD34+成体干细胞可进一步分化成若干类型的不同组织细胞类型,尤其在活体外外胚层谱系中(图6,包括神经元及皮肤细胞类型的右下图)。举例而言,当去除miR-302及bFGF/FGF2两者时,该等经诱导CD34+成体干细胞分化成神经元细胞。替代地,当去除 miR-302及LIF两者时,该等经诱导CD34+成体干细胞分化成皮肤型组织细胞。经分离诱导CD34+成体干细胞进一步移植至裸鼠中形成各种活体内组织细胞类型,尤其在外胚层及中胚层谱系中(图7)。鉴于此等研究结果,我们对此得出结论,miR-302及某些定义因子的组合使用可诱导且维持成体干细胞活体外增殖以及分化,进而产生使用经扩增成体干细胞或成体干细胞分化的组织细胞或两者来产生丰富及足够的适用于各种细胞疗法的诱导CD34+ 成体干细胞的新颖方法。
因为小鼠及大鼠ESC更新中先前研究已报导使用LIF/STAT3 及BMP4/Id蛋白质可维持活体外ESC更新而不需要血清或饲养层(feeder) (Ying等人,2003;Xu等人,2005),我们当前的LIF用以诱导CD34+成体干细胞增殖的研究结果可提出ESC及成体干细胞更新系统两者共用的类似或平行机制。基于此情形,我们发现LIF阻碍CD34+成体干细胞分化成中胚层谱系,而bFGF/FGF2防止CD34+成体干细胞分化成神经元外胚层谱系。因此,LIF及bFGF/FGF2的协同活动消除CD34+成体干细胞的全部分化可能性以便维持其干细胞多潜能性。然而,不同于ESC,大多数成体干细胞并不共表现较强的Oct3/4及Nanog以绕过复制性衰老(replicative senescence)。因此,成体干细胞如何可绕过复制性衰老以达至无限的较长生命周期是本文的关键问题。为此,因为我们先前研究(Lin等人,2011; Lin及Ying,2013)已进一步展示miR-302可直接使AOF2/KDM1、DNMT1及 HDAC2/4沉默以增强端粒酶反转录酶(TERT)活性且因此防止iPSC衰老,所以我们在本文中提出本发明中经微阵列鉴别出的SSCD基因,包括但不限于AOF2/KDM1、DNMT1、HDAC2/4及其下游TERT,有可能用以防止经诱导CD34+ 成体干细胞衰老以便延长经诱导CD34+成体干细胞在活体外细胞培养中的复制性生命及继代。
展示经诱导CD34+成体干细胞的多潜能性分化的活体内移植模型.
我们认为不同组织/器官的内部环境可导引并且影响经诱导 CD34+成体干细胞活体内分化的细胞命运。为测试经诱导CD34+成体干细胞分化,我们采用使用NOD-SCID小鼠(n=3)的活体内移植模型。另外,为追踪细胞活体内分布及分化,我们用表现红色萤光蛋白(RFP)的慢病毒载体 pLVX-EF1a-HcRed-N1(Clontech)标记此等经诱导CD34+成体干细胞且随后用流式细胞量测术选择所得RFP阳性CD34+成体干细胞。此后,将大致5× 105个经RFP标记的诱导CD34+成体干细胞注入至每一只NOD-SCID小鼠的尾部静脉来完成移植。在移植后3周之后,我们观测到大量RFP阳性CD34+ 成体干细胞及其分化细胞在许多活体内组织及器官中存活并持续生长,该等组织及器官包括骨髓、大脑、心脏、肺、脾脏、甲状腺…等,其中大多数分化自外胚层或中胚层谱系但很少分化自内胚层谱系。因此,图7清晰地展示经植入CD34+成体干细胞及其分化组织细胞充分地位于活体内骨髓、大脑及甲状腺组织中。
最值得注意地,经植入诱导CD34+成体干细胞可保持存活且在造血干细胞(HSC)亦定位于其中的骨髓中进一步形成许多干细胞囊/利基(niches)。然而,当前不明确的是此等两个类型的CD34+成体干细胞类型是否相关或如何相关?因为在萤光显微镜下使用血液涂片检查鉴别出,甚至在移植后3周内在末梢血流中仍可见到许多分化RFP阳性血球,所以其表明经植入诱导CD34+成体干细胞可活体内分化成至少一些类型的血球。可想象地,若HSC及经植入诱导CD34+成体干细胞的生理功能就活体内提供身体的各种造血细胞类型而言是可互换的,则我们可能够使用患者自身的诱导 CD34+成体干细胞以治疗许多血液相关疾病,具体而言包括但不限于中风、心肌梗塞、AIDS、白血病、淋巴瘤及镰状细胞性贫血。此类别的自体移植是预防免疫排斥的最佳治疗方式。
此外,如图7中所示,大脑中经诱导CD34+成体干细胞囊及相关RFP阳性神经元细胞的研究结果是开发适用于治疗各种退行性神经元相关病症,具体而言包括但不限于中风、糖尿病痴呆症、阿兹海默症、帕金森氏症及运动神经元疾病的新颖疗法的另一重要依据。
当前关于成体干细胞寿命及其细胞分裂调节的特定方式(亦即不对称与对称的干细胞分裂)的知识是极其有限的。另外,不明确HSC与其他CD34+成体干细胞之间存在多少差异及/或类似性。为解决此等问题,我们当前于本发明中展示的活体外及活体内CD34+成体干细胞增殖模型可充当研究此等受关注点的适用工具。使用此等新建立的经诱导CD34+成体干细胞增殖模型,我们已发现(1)miR-302可用以诱导CD34+成体干细胞活体内增殖,其在完美的伤口愈合中起关键作用;(2)使用miR-302及某些定义因子,诸如bFGF/FGF2及LIF可诱导CD34+成体干细胞活体外增殖,从而提供充足的经扩增诱导CD34+成体干细胞以用于研究及医疗用途;(3)经增殖诱导CD34+成体干细胞的活体内移植可在多种器官/组织中生长并形成多种分化组织细胞,表示此等诱导CD34+成体干细胞尤其于外胚层及中胚层谱系中的多潜能性;及(4)经移植诱导CD34+成体干细胞可在骨髓、大脑、脾脏及甲状腺中生长并形成囊状干细胞利基,进而展示用于开发适用于治疗以下疾病等的新颖再生医疗及疗法的极大可能性:阿兹海默症、帕金森氏症、运动神经元疾病、中风、糖尿病、骨质疏松症、心肌梗塞、血友病、贫血症、 AIDS、白血病、淋巴瘤及许多类型的癌症以及衰老。
A.定义
为促进对本发明的理解,多个术语定义于下文中:
核苷酸:由糖部分(戊醣)磷酸酯及含氮杂环碱基组成的 DNA或RNA单体单元。碱基是经由糖苷碳(戊醣的1'碳)连接至糖部分且碱基与糖的组合为核苷。含有至少一个磷酸酯基键结至戊糖的3'或5'位置的核苷是核苷酸。DNA及RNA由不同类型的分别称作去氧核糖核苷酸及核糖核苷酸的核苷酸单元组成。
寡核苷酸:由两个或更多个,较佳大于三个,且通常大于十个DNA及/或RNA构成的分子。长于13个核苷酸单体的寡核苷酸亦称作聚核苷酸。确切大小将视多种因素而定,其又视寡核苷酸的最终功能或用途而定。寡核苷酸可以任何方式产生,包括化学合成DNA复制、RNA转录、反转录或其组合。
核苷酸类似物:在结构上与腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)、胞嘧啶(C)或尿嘧啶(U)不同,但与核酸分子中的正常核苷酸的替代物充分类似的嘌呤或嘧啶核苷酸。
核酸组合物:核酸组合物是指单链或双链分子结构中的寡核苷酸或聚核苷酸,诸如DNA或RNA序列,或混合DNA/RNA序列。
基因:其寡核苷酸或聚核苷酸序列编码RNA及/或多肽(蛋白质)的核酸组合物。基因可为RNA或DNA。基因可编码非编码RNA,诸如小发夹RNA(shRNA)、microRNA(miRNA)、rRNA、tRNA、snoRNA、snRNA、及其RNA前驱物以及衍生物。或者,基因可编码蛋白质/肽合成必需的蛋白质编码RNA,诸如信使RNA(mRNA)及其RNA前驱物以及衍生物。在一些情况下,基因可编码亦含有至少一微RNA或shRNA序列的蛋白质编码RNA。
初级RNA转录物:直接自基因转录而无任何RNA加工或修饰的RNA序列,其可选自由以下组成的群:mRNA、hnRNA、rRNA、tRNA、snoRNA、 snRNA、pre-microRNA、病毒RNA及其RNA前驱物以及分化物。
前驱信使RNA(pre-mRNA):蛋白质编码基因的初级RNA转录物,其由真核II型RNA聚合酶(Pol-II)机制于真核生物中经由称为转录的胞内机制来产生。pre-mRNA序列含有5'-非转译区(UTR)、3'-UTR、外显子及内含子。
内含子:编码非蛋白质阅读框架的基因转录物序列的一或多个部分,诸如框内内含子、5'-UTR及3'-UTR。
外显子:编码蛋白质阅读框架的基因转录物序列(cDNA)的一或多个部分,诸如用于细胞基因、生长因子、胰岛素、抗体及其类似物/ 同系物以及衍生物的cDNA。
信使RNA(mRNA):pre-mRNA外显子的集合,其在由胞内 RNA剪接机制(剪接体)移除内含子之后形成且充当用于肽/蛋白质合成的蛋白质编码RNA。由mRNA编码的肽/蛋白质包括但不限于酶、生长因子、胰岛素、抗体及其类似物/同系物以及衍生物。
互补DNA(cDNA):含有与mRNA序列互补的序列且不含任何内含子序列的单股或双股DNA。
正义:与同源mRNA呈相同序列次序及组成的核酸分子。正义构形以「+」、「s」或「正义」符号指示。
反义:与各别mRNA分子互补的核酸分子。反义构形以「-」或「*」符号或以DNA或RNA前面的「a」或「反义」指定,例如「aDNA」或「aRNA」。
碱基对(bp):双股DNA分子中腺嘌呤(A)与胸腺嘧啶(T),或胞嘧啶(C)与鸟嘌呤(G)的配对关系。在RNA中,尿嘧啶(U)取代胸嘧啶。一般而言,配对关系经由氢键结实现。
碱基对(bp):双股DNA分子中腺嘌呤(A)与胸腺嘧啶(T),或胞嘧啶(C)与鸟嘌呤(G)的配对关系。在RNA中,尿嘧啶(U)取代胸嘧啶。一般而言,配对关系是经由氢键结实现。举例而言,正义核苷酸序列「5'-A-T-C-G-U-3'」可与其反义序列「5'-A-C-G-A-T-3'」形成完全碱基配对。
5'-端:在连续核苷酸的5'位处不具有核苷酸的末端,其中一个核苷酸的5'-羟基是由磷酸二酯键接合至下一核苷酸的3'-羟基。其他基团(诸如一或多个磷酸酯)存在于该末端上。
3'-端:在连续核苷酸的3'位处不具有核苷酸的末端,其中一个核苷酸的5'-羟基是由磷酸二酯键接合至下一核苷酸的3'-羟基。其他基团(最通常羟基)可存在于该末端上。
模板:由核酸聚合酶复制的核酸分子。取决于聚合酶,模板可为单股、双股或部分双股的。合成的复本与模板或与双股或部分双股模板的至少一股互补。RNA及DNA两者皆以5'至3'方向合成。核酸双螺旋体的两股始终对齐,以使得两股的5'端在双螺旋体的相对端(且必然地3'末端亦如此)。
保守:若核苷酸序列与预选(参考)序列的确切互补序列非随机地杂合,则其关于该预选序列是保守的。
同源或同源性:指示聚核苷酸与基因或mRNA序列之间的相似性的术语。举例而言,核酸序列可与特定基因或mRNA序列部分或完全同源。同源性可表示为由类似核苷酸数比总核苷酸数确定的百分比。
互补的或互补性或互补:关于两个聚核苷酸(亦即mRNA及 cDNA的序列)之间由上述「碱基对(bp)」规则相连的匹配碱基配对使用的术语。举例而言,序列「5'-A-G-T-3'」与序列「5'-A-C-T-3'」以及「5'-A-C-U-3'」互补。互补可在两个DNA股、一个DNA与一个RNA股或两个RNA股之间。互补性可为「部分」或「完全」或「全部」。当仅一些核酸碱基根据碱基配对规则匹配时,出现部分互补性或互补。当核酸股之间碱基完全或完美地匹配时,出现完全或全部互补性或互补。核酸股之间的互补性程度对核酸股之间杂交的效率及强度具有显著影响。此对于扩增反应以及视核酸之间的结合而定的侦测方法特别重要。互补性或互补百分比是表示核酸的一股中错配碱基数比全部碱基数。因此,50%互补意谓一半碱基错配且一半碱基匹配。即使核酸的两股的碱基数不同,两股亦可互补。在此情况下,互补发生于较长股的一部分与较短股之间,其中较长股的该部分的股上为对应于与较短股的碱基配对的碱基。
互补碱基:当DNA或RNA采用双股构型时正常配对的核苷酸。
互补核苷酸序列:单股DNA或RNA分子中的核苷酸序列,其与另一单股上的核苷酸序列充分互补以用随应的氢键结于两股之间特异性杂合。
杂合或杂交(Hybridize及Hybridization):在充分互补以经由碱基配对形成复合物的核苷酸序列之间形成双螺旋体。在引子(或剪接模板)与标靶(模板)「杂合」时,该等复合物(或杂合体)充分稳定以提供DNA聚合酶起始DNA合成所需的引发功能(primingfunction)。两个互补聚核苷酸之间存在可受竞争性抑制的特异性(亦即非随机)相互作用。
转录后基因静默:靶基因在mRNA降解或转译抑制的层级下的基因剔除或基因敲落效应,其通常由外来/病毒DNA或RNA转殖基因或小抑制性RNA触发。
RNA干扰(RNAi):真核生物中的转录后基因静默机制,其可由小抑制性RNA分子(诸如microRNA(miRNA)、小发夹RNA(shRNA)及小干扰RNA(siRNA))触发。此等小RNA分子通常充当基因静默子,干扰与小RNA完全或部分互补的胞内基因的表现。
基因静默效应:在基因功能受抑制之后的细胞反应,由但不限于以下组成:细胞周期减弱、G0/G1-检查点停滞、肿瘤抑制、抗致肿瘤性、癌细胞的细胞凋亡及其组合。
非编码RNA(ncRNA):无法用以经由胞内转译机制合成肽或蛋白质的RNA转录物。非编码RNA包括长及短调节性RNA分子,诸如 microRNA(miRNA)、小发夹RNA(shRNA)、小干扰RNA(siRNA)及双股 RNA(dsRNA)。此等调节性RNA分子通常充当基因静默子,干扰与非编码RNA完全或部分互补的胞内基因的表现。
MicroRNA(miRNA):能够结合至与microRNA的序列部分互补的靶基因转录物(mRNA)的单股RNA。成熟microRNA通常大小为约17-27 个寡核苷酸长,且能够视microRNA与其靶mRNA之间的互补性而直接降解其胞内mRNA标靶或抑制其靶mRNA的蛋白质转译。天然microRNA见于几乎所有真核生物中,充当针对病毒感染的防御,且可在植物及动物发育期间调节特异性基因表现。原则上,一个microRNA通常靶向多个靶mRNA以实现其全部功能,而另一方面,多个miRNA可靶向相同基因转录物以增强基因静默的效应。
MicroRNA前驱物(Pre-miRNA):含有茎-臂及茎-环区的发夹样单股RNA,用于与胞内RNase III Dicer核糖核酸内切酶 (endoribonucleases)相互作用,以产生一或多个成熟microRNA(miRNA), microRNA(miRNA)能够使与成熟microRNA序列完全或部分互补的靶基因或靶基因的特定基团静默。pre-miRNA的茎-臂可形成完美(100%)或部分(错配)杂合的双螺旋体,而茎-环连接茎-臂双螺旋体的一端,以形成与一些阿尔古蛋白(AGO)组装至RNA诱导的静默复合物(RISC)中所需的圆圈或发夹-环构形。
小干扰RNA(siRNA):大小约为18-27个完美碱基配对的核糖核苷酸双螺旋体且能够降解具有几乎完美互补性的靶基因转录物的短双股RNA。
小或短发夹RNA(shRNA):含有一对由不匹配环寡核苷酸隔开以形成发夹样结构的部分或完全匹配的茎-臂核苷酸序列的单股RNA。多种天然miRNA是衍生自发夹样RNA前驱物,亦即前驱microRNA (pre-miRNA)。
载体:能够在不同基因环境中移动及滞留的重组核酸组合物,诸如重组DNA(rDNA)。一般而言,另一核酸可操作地连接于其中。载体可能够在细胞中自主复制,在此情况下,载体及连接的区段经复制。一种类型的较佳载体为游离基因体(episome),亦即能够进行染色体外复制的核酸分子。较佳载体为能够自主复制及表现核酸的彼等载体。能够引导编码一或多种多肽的基因及/或非编码RNA的表现的载体在本文中称为「表现载体」或「表现胜任载体」。特别重要的载体允许使用反转录酶自产生的mRNA 选殖cDNA。载体可含有由以下组成的组分:病毒或II型RNA聚合酶(Pol-II 或pol-2)启动子或两者、科扎克(Kozak)共有转译起始位点、聚腺苷酸化信号、复数个限制/选殖位点、pUC复制起点、用于于复制胜任原核细胞中表现至少一抗生素抗性基因的SV40早期启动子、用于于哺乳动物细胞中复制的视情况选用的SV40起点及/或四环素(tetracycline)反应性元件。载体的结构可为选自由以下组成的群组的线形或圆形的单或双股DNA:质体、病毒载体、转座子、反转录转座子、DNA转殖基因、跳跃基因及其组合。
启动子:聚合酶分子识别或可能结合并起始RNA转录的核酸。出于本发明的目的,启动子可为已知聚合酶或其辅因子结合位点、增强子及其类似物,可由所要聚合酶起始RNA转录物的合成的任何序列。
顺反子:DNA分子中编码胺基酸残基序列且包括上游及下游 DNA表现控制元件的核苷酸序列。
内含子切除:引起RNA加工、成熟及降解的细胞机制,包括 RNA剪接,外泌体消化,无义介导的衰变(NMD)加工及其组合。
RNA加工:引起RNA成熟、修饰及降解的细胞机制,包括RNA 剪接;内含子切除;外泌体消化;无义介导的衰变(NMD);RNA编辑;RNA 加工;及其组合。
靶细胞:单个或复数个选自由以下组成的群组的人类细胞:体细胞、组织、干细胞、生殖系细胞、畸胎瘤细胞、肿瘤细胞、癌细胞及其组合。
癌组织:衍生自由以下组成的群组的赘生性组织:皮肤癌、前列腺癌、乳癌、肝癌、肺癌、脑肿瘤/脑癌、淋巴瘤、白血病及其组合。
基因递送:选自由以下组成的群组的基因工程化方法:多聚核糖体转染、脂质转染、化学转染、电穿孔、病毒感染、DNA重组、转座子插入、跳跃基因插入、显微注射、基因枪穿透及其组合。
基因工程化:选自由以下组成的群组的DNA重组方法:DNA 限制及连接、同源重组、转殖基因并入、转座子插入、跳跃基因整合、反转录病毒感染及其组合。
细胞周期调节子:参与控制细胞分裂及增殖速率的细胞基因,由(但不限于)以下组成:CDK2、CDK4、CDK6、细胞周期蛋白、BMI-1、 p14/p19Arf、p15Ink4b、p16Ink4a、p18Ink4c、p21Cip1/Waf1及p27Kip1 及其组合。
肿瘤抑制效应:由(但不限于)以下组成的细胞抗肿瘤及/ 或抗癌机制及反应:细胞周期减弱、细胞周期停滞、肿瘤细胞生长抑制、细胞致肿瘤性抑制、肿瘤/癌细胞转形的抑制、肿瘤/癌细胞的细胞凋亡的诱导、正常细胞恢复的诱导、高度恶性癌细胞重新编程至更良性的低度状态(肿瘤消退)及其组合。
癌症治疗效应:由药物治疗产生的细胞反应及/或细胞机制,包括但不限于致癌基因表现的抑制、癌细胞增殖的抑制、癌细胞侵入及/或迁移的抑制、癌症转移的抑制、癌细胞死亡的诱导、肿瘤/癌症形成的预防、癌症复发的预防、癌症进程的抑制、受损组织细胞修复、高度恶性癌症重新编程至更良性的低度状态(癌症消退/缓解)及其组合。
基因沉默效应:在基因功能经抑制之后的细胞反应,由(但不限于)以下组成:致癌基因表现的抑制、细胞增殖的抑制、细胞周期停滞、肿瘤抑制、癌症消退、癌症预防、细胞的细胞凋亡、细胞修复及/或复原 (rejuvenation)、细胞重新编程、患病细胞重新编程至相对正常状态(自发愈合)及其组合。
癌症逆转:在活体外、离体或活体内使高度癌症的恶性特性复位回至相对正常样低度状态的重新编程机制。
抗体:具有编码能够结合预选配位体的受体的预选保守域结构的肽或蛋白质分子。
人类退行性疾病(HDD):HDD包括但不限于阿兹海默症、帕金森氏症、运动神经元疾病、中风、糖尿病、骨质疏松症、心肌梗塞、血友病、贫血症、白血病、淋巴瘤及许多类型的癌症以及衰老相关的病症。
医药及/或治疗应用:适用于诊断、干细胞产生、干细胞研究及/或疗法开发、组织/器官修复及/或复原、伤口愈合治疗、肿瘤抑制、癌症疗法及/或预防、疾病治疗、药物生产及其组合的生物医学利用、装置及/或设备。
B.组合物及应用
一种诱导成体干细胞(ASC)活体外增殖及/或分化的组合物及其使用方法,其使用miR-302样pre-miRNA、shRNA及/或siRNA,其皆在 5'-末端中含有5'-UAAGUGCUUC CAUGUUU-3'(SEQ.ID.NO.7)的共用序列,且进一步结合使用一些伤口愈合相关定义因子,包括但不限于碱性纤维母细胞生长因子(bFGF)/纤维母细胞生长因子2(FGF-2)、白血病抑制因子(LIF)、似胰岛素生长因子(IGF)、表皮生长因子(EGF)、血小板衍生的生长因子(PDGF)、血管内皮生长因子(VEGF)、转型生长因子(TGF)、肿瘤坏死因子(TNF)、干细胞因子(SCF)、同源盒蛋白质(HOX)、Notch、 GSK、Wnt/β-连环蛋白信号、介白素及/或骨成形性蛋白质(BMP)。所得经扩增成体干细胞适用于治疗多种人类衰老相关病症及细胞功能障碍相关病症,包括但不限于阿兹海默症、帕金森氏症、运动神经元疾病、中风、糖尿病、骨质疏松症、心肌梗塞、血友病、贫血症、AIDS、白血病、淋巴瘤及许多类型的癌症以及衰老。
原则上,本发明是关于一种近年来在活体内皮肤伤口愈合模型中发现的新颖的诱导性对称成体干细胞分裂机制(Lin的U.S.9,879,263 及美国专利申请案第15/661,346号)。然而,我们先前发明并不揭示需要与miR-302一起用以诱导成体干细胞活体外增殖的任一定义因子。为克服此问题,本发明进一步教示参与经诱导成体干细胞活体外增殖机制的全部所需及选择性定义因子。
附图说明
专利或申请案文件含有至少一个彩制图式。在申请且支付必要费用时,USPTO将提供具有彩色图式的本专利或专利申请公开案的副本。
具体而言,仅出于说明目的且非限制地参看图式,其中说明:
图1展示所提出的活体内miR-302介导的完美(无疤痕)伤口愈合机制模型。
图2展示在两种活体内分离的不同组织样本之间发现差异性表现基因的LCM微阵列分析技术。举例而言,可使用雷射捕获显微切割机(LCM)收集两种获自不同样本区域的不同类型的组织细胞。此后,个别mRNA/cDNA库是自此等LCM解剖的组织细胞样本中的每一者单独地扩增及收集且随后分别地进一步用于微阵列分析。使用此LCM微阵列方式,我们已研究且比较活体内经分离CD34+成体干细胞与活体外经诱导CD34+成体干细胞以及其他非成体干细胞的组织细胞之间的差异性基因表现模式。
图3展示以下处理中的活体内伤口愈合速率的比较:仅抗生素软膏(顶图)、具有1mg/mL的miR-434-模拟siRNA的抗生素软膏(第2排图)、具有1mg/mL的经分离miR-302前驱物的抗生素软膏(第3排图)及具有5 mg/mL的经分离iPSC裂解物的抗生素软膏(底图)。miR-302及iPSC裂解物处理组的样本数大小各别地为n=12,而空白对照组(仅软膏)及miR-434处理组的样本数大小各别地为n=6。
图4展示在以下处理之后的伤口闭合率(%)的时程结果:(A)iPSC 裂解物(蓝色菱形)、(B)miR-302前驱物(miR-302;红色正方形)、(C1) 仅抗生素软膏(空白对照组;绿色三角形)、及(C2)miR-434-模拟siRNA (紫色十字形)。结果表明iPSC裂解物及miR-302处理两者可显著地增加活体内快速的伤口愈合率(p<0.01),而其他对照组不会。
图5展示活体内未处理(顶图;190-CR3)与经miR-302处理(底图; 190-BR2)皮肤样本之间的伤口愈合结果的比较。经分离pre-miR-302(20 至1000μg/mL)与抗生素软膏一起调配且直接活体内施用于猪背部皮肤上的2cm×2cm的开放性伤口。处理后大致2至3周,一部分愈合伤口样本经剥离且进一步制成组织切片以用于组织学检查。结果显示,经miR-302处理的样本中无可见疤痕或可见极小疤痕(无疤痕)(完美愈合率,n=6/6),而几乎所有未经处理(仅经抗生素软膏处理)的伤口含有大疤痕。值得注意地,相较于未处理对照伤口,在经miR-302处理样本(n=6/6)中发现大量 (高达≥40至1000倍)的CD34+成体干细胞丛集(由绿色萤光抗体标记的 CD34+成体干细胞)。此等结果指示miR-302可用以诱导CD34+成体干细胞增殖及分化,以便增强组织修补及更新,对由人类退行性疾病(HDD)造成的病变产生极有益的治疗作用。
图6展示经诱导CD34+成体干细胞活体外增殖及分化的结果。在皮肤细胞分离且进一步连续稀释以采集单个细胞集落之后,使用抗CD34抗体进行萤光免疫细胞化学染色来鉴别出CD34+成体干细胞(顶图)。此等经分离 CD34+成体干细胞可进一步于确定的含有miR-302及鉴别的定义因子(诸如 bFGF/FGF2、LIF,及一些其他视情况选用的伤口愈合相关因子)的培养条件中进行重复地活体外培养及扩增(左下图)。由此获得的经扩增CD34+成体干细胞(称作经诱导CD34+成体干细胞)可进一步分化成皮肤及神经外胚层谱系中的若干不同组织细胞类型(右下图)。(n=25,p<0.001)。
图7展示经诱导CD34+成体干细胞活体内移植至NOD-SCID小鼠(n=3) 的结果。每一只小鼠经由尾部静脉注射植入有5×105个经诱导CD34+成体干细胞。全部经诱导CD34+成体干细胞用由pLVX-EF1alpha-HcRed-N1慢病毒载体转染递送的红色萤光蛋白(RFP)标记。移植后大致3周,全部主要器官及组织经单独地收集并制成组织切片载玻片,且随后用于IHC染色及显微镜检查以活体内鉴别经植入诱导CD34+成体干细胞增殖囊及经诱导CD34+成体干细胞分化的组织细胞(全部以红色标记)。尽管本文展示三个主要的分化组织类型,但最新结果中发现的经诱导CD34+成体干细胞分化的组织细胞类型包括但不限于骨髓、大脑、心脏、肺、脾脏、甲状腺、肾脏及肝脏,其中大多数衍生自外胚层或中胚层但很少衍生自内胚层谱系。
具体实施方式
实例:
在以下实验揭示内容中,以下缩写适用:M(体积摩尔); mM(毫摩尔);μm(微摩尔);mol(摩尔);pmol(皮摩尔);gm(克); mg(毫克);μg(微克);ng(奈克);L(公升);ml(毫升);μl(微升);℃(摄氏度);RNA(核糖核酸);DNA(去氧核糖核酸);dNTP(三磷酸去氧核糖核苷酸);PBS(磷酸盐缓冲盐水);NaCl(氯化钠);HEPES (N-2-羟基乙基哌嗪-N-2-乙磺酸);HBS(HEPES缓冲生理盐水);SDS(十二烷基硫酸钠);Tris-HCl(参-羟基甲胺基甲烷-盐酸盐);ATCC(美国菌种保藏中心(American Type Culture Collection),Rockville,MD); hESC(人类胚胎干细胞);及iPSC(诱导多潜能性干细胞)。
1.CD34+成体干细胞活体外分离、培养及增殖
起始CD34+成体干细胞可遵循我们方案(Lin等人,2011) 获自毛囊,或使用Aasen的方案(Nat.Protocols 5,371-382,2010)以酶促方式解离皮肤细胞,或简单地获自经肝素处理末梢血球的血沉棕黄层部分。组织样本必须保持新鲜且根据细胞密度立即由4mg/mL胶原蛋白酶I及 0.25%TrypLE的混合物处理15至45min,并由含有胰蛋白酶抑制剂的HBSS 冲洗两次且随后转移至新的含有0.3mL无饲养层MSC增殖SFM培养基(成体干细胞培养基;IrvineScientific,CA)的灭菌微管中。此后,由在37℃下于微管培养箱中振荡1min将细胞进一步分离且随后将总共0.3mL细胞悬浮液转移至含有1mL补充有经调配miR-302/pre-miR-302、LIF及 bFGF/FGF2或其他视情况选用的定义因子的无饲养层MSC增殖SFM培养基的35mm基质胶(Matrigel)涂覆培养皿中。在成体干细胞培养基中, miR-302/pre-miR-302、LIF、bFGF/FGF2及其他视情况选用的定义因子的使用浓度各别地介于0.001微克/毫升至500微克/毫升(0.001至500μg/mL);最佳地,miR-302/pre-miR-302的使用浓度介于10至200微克/毫升(10至 200μg/mL),LIF、bFGF/FGF2及/或其他视情况选用的定义因子的使用浓度各别地介于2至20奈克/毫升(2至20ng/mL)。成体干细胞培养基及全部补充剂必须每3至4天经更换。CD34+成体干细胞增长至许多囊样增殖集落且可在约50%至60%汇合时由将该等细胞暴露于TrypLE 1min且随后在含有胰蛋白酶抑制剂的HBSS中冲洗两次来进行单独地收集并进一步继代。为更多的成体干细胞增殖,将脱离CD34+成体干细胞以1:5至1:500稀释重新接种于补充有经调配pre-miR-302、LIF、bFGF/FGF2及/或其他视情况选用的定义因子的新制成体干细胞培养基中。
2.MicroRNA及pre-miRNA分离及制备
天然miR-302及pre-miR-302可遵循Lin SL的方案(Lin SL, 2018)自人胚胎干细胞(hESCs)或诱导的多能干细胞(iPSC)或两者的胞质液中提取。为收集胞质液,遵循制造商的建议(Millipore,Billerica, MA),由在4℃下以17,500g超速离心30min来裂解ESC或iPSC且由使悬浮液穿过0.01微米超滤管柱(30kDa/100个核苷酸-截留值(cutoff); AmiconUltra-0.5 30K)来进一步过滤。大致0.8至1mL的ESC或iPSC胞质液可各别地由10亿至12亿ESC或iPSC回收。为提取miR-302及 pre-miR-302,ESC或iPSC胞质液由0.001微米奈米过滤器管柱(3kDa/10 个核苷酸-截留值;Amicon Ultra-0.5 3K)进一步纯化且将流通(flow-through)部分回收,而全部小RNA经收集于奈米过滤器上且随后将其溶解于双重高压灭菌处理的DEPC处理ddH2O(pH 5.5至5.6)中以使用高效液相层析(HPLC)进一步纯化。由此获得的小RNA的大小介于约10至110个核苷酸(或3至30kDa),包括pre-miRNA/miRNA及几个tRNA。使用miRNA 微阵列分析,我们已确认超过90%的经分离小RNA为pre-miR-302及 miR-302,其为ESC及iPSC中最充足及稳定的小RNA。替代地,合成性 miR-302-模拟siRNA及/或shRNA可用于替代天然miRNA/pre-miRNA。此外,细菌性胜任细胞可用于替代ESC及iPSC以进行miR-302/pre-miR-302生产及提取。
3.miRNA微阵列及RT-qPCR分析
首先用2%至3%低熔点琼脂糖凝胶电泳及UV 260nm/280nm 的光谱仪(Bio-Rad,Hercules,CA)评估经分离小RNA的纯度及量。随后,由LC Sciences(San Diego,CA)使用大致10μg来自每一样本分离的小RNA来各别地执行微阵列分析。各微阵列晶片与经Cy3或Cy5染料标记的单一样本进行杂交。遵循制造商的方案执行背景减除、资料标准化及统计计算。对于双样品分析,进行p值计算且产生大于3倍的差异表现转录物的列表(黄色-红色信号)。对于RT-qPCR,遵循制造商的说明书,我们使用针对hsa-miR-302a的TaqMan引子集合及相关实时PCT试剂盒(Real-Time PCR kit,Life Technologies,Grand Island,NY)。用ABI7300即时PCR 系统(Applied Biosystems,Life Technologies)侦测信号。
4.免疫染色分析
如先前报导对组织样品进行包埋、切片及免疫染色(Lin等人,2008及2010)。初级抗体包括绿色萤光染料标记的抗CD34(Santa Cruz 及Sigma)。替代地,萤光染料标记的山羊抗兔或马抗小鼠抗体用作二级抗体(Invitrogen-Molecular Probes,Carlsbad,CA)。在具有Metamorph 成像程式(Nikon)的萤光80i微观定量系统下以100×或200×放大率检查及分析阳性结果。
5.亚硫酸氢盐DNA定序
使用DNA分离试剂盒(Roche)自约2,000,000个细胞分离基因体DNA且遵循制造商的建议,另外用亚硫酸氢盐(CpGenome DNA修饰试剂盒,Chemicon,Temecula,CA)处理1μg经分离DNA。亚硫酸氢盐处理将所有未甲基化胞嘧啶转化为尿嘧啶,而甲基化胞嘧啶仍保持为胞嘧啶。对于亚硫酸氢盐DNA定序,我们由以下PCR引子扩增Oct4基因的启动子区: 5'-GAGGCTGGAG CAGAAGGATT GCTTTGG-3'(SEQ.ID.NO.12)及5'-CCCTCCTGAC CCATCACCTCCACCACC-3'(SEQ.ID.NO.13)。对于PCR,亚硫酸氢盐修饰的DNA(50ng)与引子(总共100pmol)在1×PCR缓冲液中混合,加热至 94℃后维持2分钟,且紧接着在冰上冷却。随后,如下进行25个PCR循环: 94℃维持1分钟及70℃维持3分钟,使用增殖高保真(Expand HighFidelity) PCR试剂盒(Roche)。具有正确大小的PCR产物由3%琼脂糖凝胶电泳进一步分级分离,由凝胶提取过滤器(Qiagen)纯化,且接着用于DNA定序。此后,由将经转化的DNA序列与未经转化的DNA序列中的不变胞嘧啶比较来产生DNA甲基化位点的详细图谱。
6.流式细胞量测术
将细胞以胰蛋白酶处理,集结且由在-20℃下再悬浮于含1 ml预冷70%甲醇的PBS中1小时而固定。细胞经集结且用1ml PBS洗涤一次且接着再次颗粒化且在37℃下再悬浮于1ml含1mg/ml碘化丙锭、0.5 μg/ml RNase的PBS中30分钟。此后,在BD流式细胞仪(FACSCalibur) (San Jose,CA)上分析约15,000个细胞。由绘制脉冲宽度相较于脉冲面积且在单细胞上闸控而排除细胞二重峰。使用软件套装流式细胞分析软件 (Flowjo),使用华生实用(Watson Pragmatic)算法分析收集的资料。
7.皮肤伤口愈合模型及CD34+成体干细胞活体内增殖
长白猪(Landrace)是大多数中东欧国家中发现的白色垂耳猪品种。提供用于建立皮肤伤口模型的雄性长白猪且以由专门分配的人员及合格的兽医进行ATIT监视来照护。在其监督下,根据中国台湾地区关于动物福利的相关规定,向此等动物提供充足的照护。此等猪的年龄平均为3个月且各自重量在18至23kg之间。在研究结束时使全部动物安乐死。
使用舒泰(Zoletil)50(6mg/kg)将动物麻醉且随后对其背部进行刮毛。使用灭菌的手术刮刀产生六(6)个全层正方形伤口(各自为2cm×2cm或4cm2),每只动物的右侧及左侧上各有3个伤口。每个伤口接受用0.5mL各别地含有以下的抗生素软膏进行局部处理:(A)iPSC 裂解物(5mg/mL)、(B)经调配miR-302前驱物(1mg/mL)、(C1)空白或(C2)miR-434siRNA(1mg/mL)。在第0天、第1天、第2天、第3 天、第4天、第5天、第7天、第9天、第11天、第14天及第17天施用该等处理。在第0天、第1天、第2天、第3天、第4天、第5天、第7天、第9天、第11天、第14天、第17天及第20天用索尼摄影机(Sony DSC-H9) 拍摄每个伤口的照片。使用专业图像分析软件(Image Pro Plus)7.0成像软体测定每个伤口在每个时间点的面积。根据下式计算每个处理时间点的伤口愈合或闭合百分比:(第0天伤口面积-第N天伤口面积)/第0天伤口面积×100。另外,自每个伤口收集组织样本且在用于制备用于H&E染色的组织学切片的前将其浸没于10%(v/v)福马林溶液中。
8.统计分析
全部资料显示为平均值及标准差(SD)。各测试组的均值由微软电子表格(Microsoft Excel)的AVERAGE进行计算。SD是由STDEV进行。由单因子变异数分析(One-WayANOVA)进行资料的统计分析。使用杜凯及邓尼特事后测试(Tukey and Dunnett's t posthoc)以鉴别各组中资料差异的显著性。p<0.05视为显著(SPSS v12.0,Claritas Inc)。
参考文献:
1.Aasen等人,(2010)Isolation and cultivation of human keratinocytesfrom skin or plucked hair for the generation of induced pluripotent stemcells.Nature Protocols 5,371-382。
2.Chen SKJ及Lin SL.(2013)Recent patents on microRNA-inducedpluripotent stem cell generation.Recent Patents on Regenerative Medicine 3:5-16。
3.Lin SL,Chang D,Chang-Lin S,Lin CH,Wu DTS,Chen DT及 Ying SY.(2008)Mir-302reprograms human skin cancer cells into a pluripotent ES-cell-likestate.RNA 14,2115-2124。
4.Lin SL及Ying SY.(2008)Role of mir-302microRNA family in stem cellpluripotency and renewal.Ying SY.(编)Current Perspectives inMicroRNAs.Springer Publishers press,New York,第 167-185页。
5.Lin SL,Chang D,Ying SY,Leu D及Wu DTS.(2010)MicroRNA miR-302inhibitsthe tumorigenecity of human pluripotent stem cells by coordinate suppressionof CDK2 and CDK4/6cell cycle pathways. Cancer Res.70,9473-9482。
6.Lin SL,Chang D,Lin CH,Ying SY,Leu D及Wu DTS.(2011) Regulation ofsomatic cell reprogramming through inducible mir-302 expression.Nucleic AcidsRes.39,1054-1065。
7.Lin SL及Ying SY.(2013)Mechanism and method for generating tumor-free iPS cells using intronic microRNA miR-302induction. Methods MolBiol.936,295-312。
8.Lin SL.(2018)Identification and Isolation of Novel Sugar-Like RNAProtecting Materials:Glycylglycerins from Pluripotent Stem Cells.Methods MolBiol.1733,305-316。
9.Simonsson S及Gurdon J.(2004)DNA demethylation is necessary for theepigenetic reprogramming of somatic cell nuclei. Nat Cell Biol.6,984-990。
10.Takahashi等人(2006)Induction of pluripotent stem cells from mouseembryonic and adult fibroblast cultures by defined factors. Cell 126,663-676。
11.Wang等人(2008)Embryonic stem cell-specific microRNAs regulate theG1-S transition and promote rapid proliferation.Nat. Genet.40,1478-1483。
12.Wernig等人(2007)In vitro reprogramming of fibroblasts into apluripotent ES-cell-like state.Nature 448,318-324。
13.Xu RH,Peck RM,Li DS,Feng X,Ludwig T及Thomson JA.(2005) Basic FGFand suppression of BMP signaling sustain undifferentiated proliferation ofhuman ES cells.Nat Methods.2,185-190。
14.Ying QL,Nichols J,Chambers I及Smith A.(2003)BMP induction of Idproteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT.Cell 115, 281-292。
15.Ying SY,Fang W及Lin SL.(2018)The miR-302-mediated induction ofpluripotent stem cells(iPSCs):Multiple synergistic reprogrammingmechanisms.Methods Mol.Biol.1733,283-304。
16.Yu等人(2007).Induced pluripotent stem cell lines derived fromhuman somatic cells.Science 318,1917-1920。
17.Lin的欧洲专利第EP 2198025号。
18.Lin的美国专利第9,387,251号。
19.Lin的美国专利第9,394,538号。
20.Lin的美国专利第9,422,559号。
21.Lin的美国专利第9,567,591号。
22.Lin的美国专利第9,879,263号。
23.Lin的美国专利申请案第12/318,806号。
24.Lin的美国专利申请案第13/572,263号。
(1) 一般信息:
(iii) 序列数: 13
(2) 针对SEQ ID NO:1的信息:
(i) 序列特征:
(A) 长度: 69 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 发夹型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然" 或 ?合成?
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:1:
CCACCACUUA AACGUGGAUG UACUUGCUUU GAAACUAAAG AAGUAAGUGC UUCCAUGUUUUGGUGAUGG 69
(3) 针对SEQ ID NO:2的信息:
(i) 序列特征:
(A) 长度: 73 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 发夹型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然" 或 ?合成?
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:2:
GCUCCCUUCA ACUUUAACAU GGAAGUGCUU UCUGUGACUU UAAAAGUAAGU GCUUCCAUGUUUUAGUAGG AGU 73
(4) 针对SEQ ID NO:3的信息:
(i) 序列特征:
(A) 长度: 68 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 发夹型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然" 或 ?合成?
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:3:
CCUUUGCUUU AACAUGGGGG UACCUGCUGU GUGAAACAAA AGUAAGUGCU UCCAUGUUUCAGUGGAGG 68
(5) 针对SEQ ID NO:4的信息:
(i) 序列特征:
(A) 长度: 68 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 发夹型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然" 或 ?合成?
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:4:
CCUCUACUUU AACAUGGAGG CACUUGCUGU GACAUGACAA AAAUAAGUGC UUCCAUGUUUGAGUGUGG 68
(6) 针对SEQ ID NO:5的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "合成"
(iii) 假拟: 否
(iv) 反义: 是
(xi) 序列说明: SEQ ID NO:5:
UCACCAAAAC AUGGAAGCAC UUA 23
(7) 针对SEQ ID NO:6的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然"
(iii) 假拟: 否
(iv) 反义: 是
(xi) 序列说明: SEQ ID NO:6:
ACUUAAACGU GGAUGUACUU GCU 23
(8) 针对SEQ ID NO:7的信息:
(i) 序列特征:
(A) 长度: 17 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然" 或 ?合成?
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:7:
UAAGUGCUUC CAUGUUU 17
(9) 针对SEQ ID NO:8的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然"
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:8:
UAAGUGCUUC CAUGUUUUGG UGA 23
(10) 针对SEQ ID NO:9的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然"
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:9:
UAAGUGCUUC CAUGUUUUAG UAG 23
(11) 针对SEQ ID NO:10的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然"
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:11:
UAAGUGCUUC CAUGUUUCAG UGG 23
(12) 针对SEQ ID NO:10的信息:
(i) 序列特征:
(A) 长度: 23 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: RNA
(A) 说明: /说明 = "天然"
(iii) 假拟: 否
(iv) 反义: 否
(xi) 序列说明: SEQ ID NO:11:
UAAGUGCUUC CAUGUUUGAG UGU 23
(13) 针对SEQ ID NO:12的信息:
(i) 序列特征:
(A) 长度: 27 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: 其他核酸
(A) 说明: /说明 = "合成"
(iii) 假拟: 是
(iv) 反义: 是
(xi) 序列说明: SEQ ID NO:12:
GAGGCTGGAG CAGAAGGATT GCTTTGG 27
(14) 针对SEQ ID NO:13的信息:
(i) 序列特征:
(A) 长度: 27 碱基对
(B) 类型: 核酸
(C) 链型: 单链
(D) 拓扑结构: 线型
(ii) 分子类型: 其他核酸
(A) 说明: /说明 = "合成"
(iii) 假拟: 是
(iv) 反义: 是
(xi) 序列说明: SEQ ID NO:13:
CCCTCCTGAC CCATCACCTC CACCACC 27
- 活体外诱导成体干细胞增殖及分化
- 丁酸类化合物在促进组织内源性干细胞活化、增殖和分化中的应用
