用于抑制有害损伤的方法和组合物
文献发布时间:2023-06-19 11:14:36
发明领域
本发明总体上涉及用于抑制有害损伤(noxious insult),诸如缺血和/或再灌注,对器官的影响的方法和组合物,更具体地,涉及例如通过将锌或其药学上可接受的盐经血管内施用至有相应需要的受试者用于抑制有害损伤对器官的影响的方法和组合物。
发明背景
对器官的有害损伤,无论它们在性质上是急性的(例如,缺血、缺血再灌注(ischaemia-reperfusion)、药物毒性、休克、中风、败血症、创伤、感染、炎症)还是慢性的(例如,高血压、糖尿病、心力衰竭、狼疮、感染、炎症),都可能具有广泛的不良后果,范围从减弱的器官功能到完全的器官衰竭。在不同类型的有害损伤中,缺血和缺血再灌注被认为是特别有问题的,特别是在其中需要暂时血管阻塞以防止过度失血的外科手术中,或者在其中暂时去除血流的移植中。
通常,缺血的特征为由于阻塞而导致对器官的血液供应不充足,无论是通过导致供应器官的血管的变窄(例如动脉变窄)的生理过程或病理生理过程造成的,还是在外科手术(例如动脉夹闭(arterial clamping))期间造成的。血流的减少导致对器官的供氧减少,触发影响器官的结构和/或功能的一系列复杂生物事件。
在许多情况下,在缺血之后是还被称为再灌注的血流恢复。缺血再灌注可以导致过量活性氧物质(ROS)和活性氮物质(RNS)的产生,引起氧化应激,该氧化应激导致一系列不良生物事件,诸如线粒体氧化磷酸化的变化、ATP的消耗、炎症、增加的细胞内钙以及蛋白激酶、磷酸酶、蛋白酶、脂肪酶和核酸酶的激活。这些又导致细胞的功能和/或完整性的损失。独立研究已经示出,由缺血再灌注诱导的炎症响应(inflammatory response)是组织和器官损伤的主要原因。
对缺血再灌注损伤(ischaemia-reperfusion injury)的典型短期响应包括对血管稳态机制的破坏,包括血管收缩、血栓形成和增加的血管通透性,以及最终导致纤维化的炎症响应的激活。对缺血的长期病理生理响应根据所涉及的器官和缺血事件的严重程度而不同。例如,脑中的缺血已经与抑郁、癫痫发作、急性坏死和延迟性神经退化(delayedneurodegeneration)有关。还已知的是,持续时间长的缺血,其中闭塞发生持续多于几分钟,可以导致细胞死亡和永久性器官损伤。
缺血再灌注损伤也是确定缺氧、中风、心脏病发作和器官移植之后的器官损伤程度中的关键因素。例如,在器官移植中,缺血再灌注损伤是在启动级联响应中的主要贡献因素,该级联响应导致延迟的移植物功能和免疫排斥的事件(episodes)。这些事件继而被广泛地认为是移植物生存时长的单一最关键因素,并且观察到在延迟的移植物功能发生率和移植物半衰期(graft half-life)之间的强相关性。虽然在延长不具有急性排斥的尸体移植物(cadaver graft)的生存时间中已经取得了进展,但是在延长具有延迟的移植物功能的事件的尸体移植物的生存时间中很少取得进展或没有进展。
已经研究了若干种不同的方法来治疗或预防诸如缺血再灌注损伤的有害损伤对器官的影响。例如,在器官移植中,这些包括施用剂诸如环孢菌素和曲美他嗪(trimetazidine)、莫罗单抗-CD3(muromonab-CD3)(OKT3单克隆抗体)、霉酚酸酯、他克莫司或诱导疗法。然而,这些策略至今未能提高罹患延迟的移植物功能的事件的尸体移植物接受者的生存率。
已经被用于保护器官免受有害损伤的影响的其他策略包括递送抗血小板剂(例如阿司匹林、阿昔单抗)、抗凝血剂(例如华法林(warfarin)、组织纤溶酶原激活物(tissueplasminogen activator,tPA))、抗炎剂(例如阿司匹林)、利尿剂(例如呋塞米(furosemide))、血管扩张药(例如硝化甘油、ACE抑制剂)和抗高血压药物(例如阿替洛尔(atenolol))。虽然这些药物减少了动脉阻塞中涉及的致病因素,但它们看起来没有提供免受缺血性损伤的保护。此外,不是所有患者均从这样的治疗中受益,部分地是由于包括药物不敏感性、药物毒性、药物相互作用和其他风险因素(例如出血)的因素。除了基于药物的策略之外,还已经采用了通过血管成形术、动脉支架术、冠状动脉旁路术和利用溶栓药物(例如tPA)的治疗来恢复血流,以试图减少与缺血性损伤相关的不良影响(adverse effects)。虽然这些治疗可以改善患者预后,但仍可能发生器官损害,包括血管破裂和进一步缺血损伤的急性风险,由导致另外的缺血性事件的闭塞血管的再狭窄或再闭塞引起的延迟性风险。
寻找有效的策略来治疗和/或预防有害损伤对器官的影响仍然是一个挑战,这至少部分地归因于有害损伤的性质和可变性,其涉及调节性和炎性机制的复杂相互作用。因此,仍然存在对于抑制有害损伤对器官的影响的方法的迫切需求。
发明概述
在第一方面,本发明提供了一种抑制有害损伤对受试者的器官的影响的方法,该方法包括将锌或其药学上可接受的盐施用至有相应需要的受试者,其中锌或其药学上可接受的盐以足以减少或抑制有害损伤的影响的量经血管内被施用至受试者。
在第二方面,提供了锌或其药学上可接受的盐,用于在抑制有害损伤对受试者的器官的影响中使用,其中锌或其药学上可接受的盐以足以抑制有害损伤的影响的量经血管内被施用至有相应需要的受试者。
在第三方面,提供了锌或其药学上可接受的盐在制备用于抑制有害损伤对受试者的器官的影响的药物中的用途,其中锌或其药学上可接受的盐被配制成以足以抑制有害损伤的影响的量血管内施用至有相应需要的受试者。
附图简述
图1.在缺血之前24小时和4小时经静脉内接受氯化锌(ZnCl
图2.在缺血之前24小时和4小时经静脉内接受ZnCl
图3.在缺血之前24小时和4小时经静脉内接受ZnCl
图4.在缺血之前24小时和4小时经静脉内接受ZnCl
图5示出了ZnCl
图6.在源自ZnCl
图7.用ZnCl
图8.(A)暴露于氯化钴(CoCl
图9.绵羊中肾缺血再灌注损伤之后的血清肌酐水平和血清尿素水平。使绵羊经历单侧肾切除术(uninephrectomy)和60分钟的肾缺血,然后是再灌注。在Zn治疗之前(基线)、在缺血之前(第0天)和再灌注后持续7天测量血清肌酐(A;μmol/L)和血清尿素(B;mmol/L)。仅在60min缺血之前24小时或4小时用单剂的0.5mg/kg ZnCl
图10.绵羊中肾缺血再灌注损伤之后的血清肌酐水平和血清尿素水平。使绵羊经历单侧肾切除术和60分钟的肾缺血,然后是再灌注。仅在60min缺血之前24小时或4小时用单剂的0.5mg/kg ZnCl
图11.在延长的心肌缺血再灌注损伤之后的绵羊左心室环(left ventriclering)的横截面。相对于处于风险的心肌的区域(淡色(pale),非伊文思蓝染色的,A)的代表性数码照片(氯化三苯基四氮唑(TTC)染色,B)。当与未处理的绵羊相比时,白色区域的不存在表明通过锌预调节对心肌缺血再灌注损伤的保护。
发明详述
遍及本说明书,除非上下文另外要求,否则词语“包括(comprise)”或变形,诸如“包括(comprises)”或“包括(comprising)”,将被理解为意味着包含所声明的要素或整数或者要素或整数的组,但不排除任何其他的要素或整数或要素或者整数的组。
在本说明书中对任何在先的出版物(或来源于其的信息)或对任何已知的事物的提及不是并且不应当被视为承认或确认或以任何形式暗示该在先的出版物(或来源于其的信息)或已知的事物构成本说明书涉及的所致力于的领域中的公知常识的一部分。
本说明书中提及的所有出版物均通过引用以其整体被并入本文。
必须注意,如在本说明书中所使用的,除非上下文另外清楚地指出,否则单数形式“一(a)”、“一(an)”和“该(the)”包括复数方面。因此,例如,“剂”包括单一剂,以及两种或更多种剂;提及的“组合物”包括单一组合物,以及两种或更多种组合物;等等。
基于以下令人惊讶的发现来断言本发明:锌的血管内施用能够保护器官,例如肾和心,免受有害损伤诸如缺血再灌注损伤的不良影响。因此,在第一方面,本发明提供了一种抑制有害损伤对受试者的器官的影响的方法,该方法包括将锌或其药学上可接受的盐施用至有相应需要的受试者,其中锌或其药学上可接受的盐以足以抑制有害损伤的影响的量经血管内被施用至受试者。
有害损伤
如本文使用的术语“有害损伤(noxious insult)”意指对器官有害的或造成伤害的(injurious)损伤。将理解的是,根据损伤的性质,有害损伤的影响可以以多种方式将自身表现出来。例如,有害损伤的影响可以将其自身表现为器官的结构变化(例如,解剖学和/或组织学变化),其说明性实例包括炎性细胞浸润的出现、细胞肥大、细胞死亡(例如,坏死、程序性细胞死亡)和细胞外基质沉积(即,疤痕形成)。在实施方案中,有害损伤的影响将其自身表现为程序性细胞死亡(凋亡)或细胞坏死。凋亡或程序性细胞死亡是用于去除衰老的、受损的或异常的细胞的生理机制。凋亡通常由内切核酸酶引发,并且其特征是DNA片段化成多于一个180-200碱基对(multiples of180-200base pairs)。凋亡细胞被巨噬细胞或邻近细胞摄取,通常是在不释放蛋白水解酶或毒性氧物质的情况下和在不存在炎症的情况下。相比之下,坏死是影响细胞的群体并且导致局灶性组织破坏(focal tissuedestruction)、炎症和通常严重的全身性后果的病理过程。
可选择地,或者此外,有害损伤的影响可以将其自身表现为器官功能的改变。本领域技术人员将理解,功能改变的性质和/或程度取决于受影响的器官以及有害损伤的性质和/或严重程度。例如,对肾的有害损伤可以将其自身表现为血清肌酐的增加、血清尿素的增加、肌酐清除的变化,或其组合。确定器官功能变化的方法是本领域技术人员所熟悉的。在另一种实施方案中,有害损伤对器官的影响可以通过已知与有害损伤相关的生物标志物的表达的变化来确定。说明性实例是在缺血性损伤之后增加的中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin)(NGAL)、肾损伤分子-1(KIM-1)和N-乙酰基氨基葡萄糖苷酶(NAG)。
有害损伤是本领域技术人员所熟悉的,其说明性实例包括缺血、缺血再灌注损伤和对比剂诱导的损伤(例如,导致对比剂诱导的肾病)。在本文公开的实施方案中,有害损伤是缺血。如本文别处所指示的,缺血是用于描述通常是由于血管阻塞而导致的不充足的对器官或组织的血液供应的术语,无论是通过导致供应器官或组织的血管的变窄(例如动脉变窄)的生理过程或病理生理过程造成的,还是在外科手术期间(例如动脉夹闭,或在出血或心功能不全的情况下的灌注不足)造成的。血流的减少导致减少的对器官或组织的供氧,触发影响器官或组织的结构和/或功能的一系列复杂的生物事件。缺血可以由多种致病事件中的任何一种引起,其说明性实例包括缺氧、中风、器官衰竭(例如,心脏病发作、肾衰竭)和器官移植。
在一些情况下,在缺血之后是血流的恢复,或“再灌注”。最初的缺血性损伤和随后的再灌注的组合通常被称为“缺血再灌注”。不受理论或特定应用模式的限制,由缺血再灌注引起的对器官或组织的损伤至少部分地归因于过量活性氧物质(ROS)和活性氮物质(RNS)的产生,引起氧化应激,该氧化应激导致一系列不良生物事件,诸如线粒体氧化磷酸化的变化、ATP的消耗、增加的细胞内钙以及蛋白激酶、磷酸酶、蛋白酶、脂肪酶和核酸酶的激活,这导致细胞的功能和/或完整性的损失。在本文公开的实施方案中,有害损伤是缺血再灌注。
缺血再灌注损伤可以导致微血管功能障碍,其表现为,例如,受损的内皮依赖性微动脉扩张、增强的流体过滤、毛细血管中的白细胞积累和毛细血管后微静脉中的血浆蛋白外渗。独立研究已经发现,在再灌注之后的最初时间段期间,微循环中被激活的内皮细胞产生较多的氧自由基,但产生较少的氧化氮。在内皮细胞中超氧化物和氧化氮之间的不平衡可以导致炎性介质(例如血小板激活因子、肿瘤坏死因子)的产生和释放,以及介导白细胞-内皮细胞粘附的粘附分子的增强的生物合成。由于再灌注而释放的炎性介质看起来也激活了未暴露于初始缺血损伤的远端器官中的内皮细胞。这种对缺血再灌注损伤的远距离响应可以导致白细胞依赖性微血管损伤,这是多器官功能障碍的特征。
术语“缺血”用于描述某种程度上受缺血或缺血再灌注影响的器官、细胞、组织或样品。
在本文公开的实施方案中,有害损伤是热缺血(warm ischaemia)。热缺血是通常用于描述在生理温度(例如,约36.5℃)流向器官的血流的阻塞的术语。在另一种实施方案中,有害损伤是冷缺血(cold ischaemia)。冷缺血是通常用于描述当器官或组织的温度已经降低(例如冷却)至低于生理温度时的缺血事件的术语。这可以发生在组织或器官仍然在体内时,或者发生在组织或器官从体内取出之后,例如,如果器官或组织待移植到另一个受试者。降低器官或组织的温度,还被称为低温保存,是基于这样的原理:冷却器官或组织抑制器官内的酶促过程,并且从而在存在减少的血液供应的情况下减少细胞损伤的程度。先前的研究已经表明,对于每10℃的温度降低,新陈代谢减少2-3倍。这减慢了三磷酸腺苷(ATP)的消耗,并且还抑制了降解过程(磷脂水解)。然而,在低温条件下,代谢率仍然保持在约10%,并且因此,随着时间的推移,缺氧条件仍然可以导致显著的损伤(冷缺血性损伤)。
应当注意的是,暴露于有害损伤的任何器官都可以受益于本文描述的方法,其说明性实例包括肾、心、肝和脑。在实施方案中,受试者的器官选自由以下组成的组:肾、肝、心和脑。在另外的实施方案中,受试者的器官选自由以下组成的组:肾和心。在又另一种实施方案中,受试者的器官是肾。在又另一种实施方案中,受试者的器官是心。
在本文公开的实施方案中,有害损伤是肾缺血(即,对肾的缺血损伤)或肾缺血再灌注。
在本文公开的另一种实施方案中,有害损伤是由外科手术造成的。将器官置于缺血性损伤的风险中的外科手术的实例是本领域技术人员已知的。在一些情况下,外科手术需要主动闭塞(active occlusion)向器官或组织供应血液的血管系统,以最小化或避免手术期间的失血。需要主动血管闭塞的外科手术的类型是本领域技术人员已知的,其说明性实例包括在部分肾切除术期间的肿瘤切除和用于移植的器官收获(organ harvesting)。在本文公开的实施方案中,缺血在肾肿瘤(例如肾细胞癌)的切除期间出现。例如,肾肿瘤的切除通常需要经由开放式或腹腔镜手术的部分肾切除术,其中肾门被夹闭以防止过度出血,并且允许足够的时间用于精确的肿瘤切除、肾盂肾盏缝合修复(pelvicalyceal suturerepair)和用于确保实质止血。在本文公开的实施方案中,有害损伤在肾移植期间是针对供体肾的。这可以发生在,例如,对供体肾的血液供应被阻塞、中断或以其他方式被限制时,例如在尸体供体死亡时的血流的停止,在供体肾从供体(活体或尸体)中被取出用于随后的移植之前原位(例如,通过肾动脉的夹闭)闭塞对供体肾的血液供应,在从供体中取出供体肾之后停止对供体肾的血流,或其组合。
在另一种实施方案中,有害损伤是对比剂诱导的毒性。对比剂已经示出作用于肾内不同的解剖学部位,并且经由多种机制施加不良影响,包括对肾近端小管细胞的直接细胞毒性作用、通过活性氧物质的增强的细胞损伤以及对肾血流增加的阻力。它们还已经示出加重肾血管收缩,特别是在外髓质的较深部分中,这可以恶化先前存在的异常血管病理生物学。
如本文结合有害损伤的影响使用的术语“抑制”指的是至少部分地可归因于有害损伤的对受试者的器官的损伤的任何减小、降低、减弱、减轻或逆转,无论任何这样的抑制是瞬时的、部分的还是完全的。至少部分地可归因于有害损伤的对器官的损伤的程度可以通过本领域技术人员已知的方法确定。这样的方法可能取决于待评估的器官的类型。作为说明性实例,由于诸如缺血再灌注的有害损伤而对肾的损伤可以通过肾功能的变化来评估,所述肾功能的变化可以表现为受试者中血清肌酐和/或血清尿素的浓度的变化。在另一个说明性实例中,对受试者中脑组织的损伤可以通过认知功能的变化来评估。在又另一个说明性实例中,由于有害损伤导致的对器官的损伤可以通过器官的组织学变化来评估,诸如组织坏死和/或细胞凋亡的存在。用于评估器官的组织学变化的方法是本领域技术人员所熟悉的,其说明性实例包括免疫细胞化学(例如对细胞凋亡的标志物染色)和使用组织学染色(例如伊文思蓝、苏木精和伊红),如本文别处描述的。
锌
如本文别处指示的,本发明人已经惊奇地发现,将锌血管内施用到受试者保护受试者的器官,诸如受试者的肾,免受有害损伤的不良影响,诸如缺血或缺血再灌注。应当理解,根据本发明,可以将任何形式的锌或其药学上可接受的盐施用至受试者,只要该形式适于将锌或其药学上可接受的盐递送至有需要的器官。
合适的形式的锌或其药学上可接受的盐是本领域技术人员已知的。说明性实例包括锌的有机盐和无机盐,例如源自无机酸(盐酸、硫酸、磷酸等)、有机酸(例如乙酸、苹果酸、富马酸等)的锌盐和组合盐(例如碳酸盐/氢氧化物盐、铵盐、螯合物等)。本文公开的方法还预期锌的多种组合,包括其有机盐和无机盐。
如本文使用的术语“无机锌”指的是二价阳离子Zn
如本文使用的术语“有机锌”指的是有机锌络合物以及锌蛋白盐(zincproteinate)、与有机分子和有机化合物的锌螯合物和锌盐,以及锌氨基酸络合物。合适的形式的有机锌是本领域技术人员已知的,其说明性实例包括组氨酸锌、甲硫氨酸锌(ZnMet)、赖氨酸锌(ZnLys)络合物、乙酸锌(Zn(O
在本文公开的实施方案中,锌以氯化锌的形式施用。
在一种实施方案中,锌或其药学上可接受的盐作为合适的溶液被施用至受试者。溶液可以由锌或其药学上可接受的盐以及用于典型血管内施用的标准液体载体诸如盐水溶液或血浆来形成。
优选地,锌或其药学上可接受的盐以以下的形式被施用:所述形式允许控制施用的剂量,以便提供足以抑制有害损伤的影响的、在本文中还被称为“治疗有效量”的锌的量,同时避免通常与过量锌相关的任何不良影响(即锌毒性)。
澳大利亚国家科学院(National Academy of Sciences,NAS)估计男性的锌推荐膳食容许量(recommended dietary allowance,RDA)为11mg/天,这相当于对于平均成年男性(70kg)0.16mg/kg体重/天。对于女性,已经估计RDA为8mg/天,或对于平均成年女性(60kg)为0.13mg/kg体重。对于婴儿(2mg/天-3mg/天)和儿童(5mg/天-9mg/天)已经推荐较低的锌摄入。虽然RDA旨在为大多数人群提供足够的营养状况的水平,但对于在怀孕和哺乳期间的女性,推荐另外的膳食水平的锌:对于孕妇,已经设定了11mg/天-12mg/天的RDA,并且对于哺乳期女性为12mg/天-13mg/天。
应当注意的是,锌的膳食(口服)施用在吸收、分布、代谢和清除中有很大的差异。例如,在血浆中,三分之二的锌与白蛋白结合,白蛋白代表锌的代谢活性池(metabolicallyactive pool)。该血浆锌的池通常被称为松散结合的锌,因为白蛋白具有将结合的锌让给组织的能力。锌的排泄很大程度上由胰腺促进并且进入粪便(75%),所述粪便包含未被吸收的锌以及胆和胰腺分泌物。其余25%的锌通过肾清除(即,通过尿)而被消除。已经示出锌的粪便排泄随着锌的摄入增加而增加,而在具有正常肾功能的受试者中,锌的肾清除相对稳定(在具有降低的肾功能的患者中肾清除可以增加10倍)。次要的消除途径是唾液分泌、脱发和出汗。由于锌不被储存,在吸收和清除之间的平衡(稳态)对维持广泛的锌依赖性功能至关重要。因此,现有的锌的膳食摄入不能对抑制有害损伤对肾的影响所需的锌的治疗有效量提供足够的控制。
通过膳食摄入对锌的治疗有效量的不充分控制还意味着存在由高于RDA的锌的积累产生的不可接受的锌毒性风险。例如,在成年人中,25mg/天-35mg/天的锌的补充剂量看起来被良好地耐受,尽管摄入高达50mg锌/天看起来影响铜的代谢。澳大利亚国家健康和医学研究委员会(National Health and Medical Research Council,NHMRC)已经将锌的RDA的上限设定为40mg/天。US环境保护局(US EPA)基于从关于口服补锌对铜和铁状态的影响的临床研究中报告的最低观察到的不良影响水平(lowest observed adverse effectlevel,LOAEL),已经设定了0.3mg/kg/天的锌的口服参考剂量(RfD)。RfD是对一生中可能没有明显的不良健康影响风险的人类群体(包括易感的亚组)的每日口服暴露的估计,对应于70kg男性21mg锌以及60kg女性18mg锌,并且在某些情况下高于由WHO推荐的推荐可接受每日摄入。在另一方面,美国食品和营养委员会(US Food and Nutrition Board)已经为大于19岁的成年人设定了40mg/天的可耐受最高摄入水平(tolerable upper intake level,UL)。UL是另一种形式的毒性风险评估值,旨在保护97%-98%的群体。
如上文概括的,RDA、RfD和UL值之间存在明显的冲突,这主要反映了在将锌状态与人类健康的正常状态相关联的能力以及在检测轻度至中度锌缺乏和毒性终点方面的很大不确定性。无论如何,RDA和RfD的比较表明以下的事实:锌的安全剂量和不安全剂量之间几乎没有边界。不安全的锌剂量可以导致急性或慢性的锌毒性。急性锌毒性的症状包括腹痛、恶心和呕吐。其他报告的作用包括嗜睡、贫血和头晕。在人类中,膳食锌的急性毒性作用已经示出在约200mg或更大的剂量时发生。ESOD(红细胞超氧化物歧化酶)活性,铜状态的量度,也示出在用50mg/天或更多补充12天之后降低。50mg/天的膳食锌补充剂持续多达10周已经导致血细胞比容(haematocrit)和血清铁蛋白的降低。大于100mg/天的剂量已经导致改变的HDL:LDL胆固醇比率。在已经服用26.6mg/天-40mg/天的非处方锌补充剂至少2年的个体中报告了与长期锌摄入相关的铜缺乏和铁粒幼细胞贫血(sideroblastic anaemia)。
在50mg/天和高于50mg/天的补充剂量时,锌影响铁和铜的摄取。因此,长期使用高剂量的锌(慢性锌毒性)可以导致铜的二次缺乏,其症状包括低铜血症(hypocupraemia)、受损的铁动员、贫血、白细胞减少、中性粒细胞减少、减少的超氧化物歧化酶(SOD)(特别是红细胞SOD(ESOD))、减少的铜蓝蛋白、减少的细胞色素C氧化酶、增加的血浆胆固醇、增加的LDL:HDL胆固醇、降低的葡萄糖清除、减少的甲硫氨酸和亮氨酸脑啡肽、异常的心脏功能以及胰酶、淀粉酶和脂肪酶的受损。还表明了过量的锌导致动脉粥样硬化。
锌毒性的其他症状包括肾毒性(例如未伴有肾衰竭和轻度蛋白尿的镜下血尿;退化性肾病变(regressive kidney lesion)、重度弥漫性肾病、肾小球和近曲小管中的上皮细胞损伤、升高的血浆肌酐和尿素水平、肾小管扩张伴有蛋白质管型(proteinaceouscast)和血铁黄素蛋白沉积物)、神经毒性(例如嗜睡、头晕目眩、蹒跚(staggering)、清楚书写的困难、焦虑、抑郁、嗜睡(somnolence)、昏迷、神经元细胞和胶质细胞死亡)、肝毒性(例如瞬时增加的肝酶活性,伴有重度胃肠腐蚀)、心血管毒性(例如房性过早搏动、继发于血管内容量的高血压、低血容量性休克(脉搏超过120次/分钟)和高血压)、致癌性和遗传毒性。早期报告示出,由大量硫酸锌(≥30,000mg)的口服摄入产生的锌过剂量可以导致死亡。约2000mg/天-4000mg/天的较小剂量的葡萄糖酸锌已经导致贫血(与锌诱导的铜缺乏一致)、严重肾病、恶心、呕吐、脱水、电解质失衡、头晕、嗜睡和不协调(incoordination)、上腹痛和腹痛。
已经在大鼠和小鼠中确定了若干锌化合物的LD
如上文概括的,目前锌的膳食摄入受害于对治疗可用量的不充分控制,这至少部分地归因于吸收、代谢和清除的差异,其速率可能因个体不同而异。也已经描述了锌的皮下施用,主要是在动物模型中。然而,尽管与口服施用相比,皮下施用提供了对锌的治疗可用量的一定控制,但是其也受害于对锌的治疗可用量的不充分控制,因为通常难以考虑从皮下贮库(subcutaneous depot)吸收的速率的差异。通过膳食(口服)或皮下施用对锌的治疗可用量的不充分控制给受试者带来不可接受的风险,这些风险与锌的不足量(即,治疗有效量的缺乏)或锌的过量(即,锌毒性)有关。
本发明人已经示出,经血管内(例如,经静脉内和/或经动脉内)施用至相关器官的锌提供了对锌的治疗有效量的更精确控制(即,用于抑制有害损伤的影响),并且因此可以被用于避免或最小化锌毒性的不良影响中的至少一些。此外,本文首次示出,在一些情况下,较高剂量的锌不能保护肾免受有害损伤的影响,并且在其他情况下,可能加重有害损伤的不良影响。因此,在优选的实施方案中,根据本文公开的方法施用至受试者的锌的量优选地被控制,以便提供有效抑制有害损伤的影响的量(即,治疗有效量),同时避免与过量锌相关的不良影响。
锌或其药学上可接受的盐可以通过本领域技术人员已知的任何方式经血管内施用。合适的血管内施用的模式是本领域技术人员已知的,其说明性实例包括静脉内施用和/或动脉内施用。在实施方案中,方法包括将锌或其药学上可接受的盐经静脉内施用至受试者。在另一种实施方案中,方法包括将锌或其药学上可接受的盐经动脉内施用至受试者。在本文公开的实施方案中,锌或其药学上可接受的盐通过输注经血管内施用,诸如通过直接输注(例如,灌注)到感兴趣的器官的血管系统中,诸如肾血管系统(例如,肾动脉)中。在另一种实施方案中,锌或其药学上可接受的盐通过间接施用经血管内施用,例如经由外周静脉或中央静脉施用。施用可以在腹腔镜下(laparoscopically)、或在开放式外科手术期间并且在缺血性损伤之前进行。在本文公开的实施方案中,锌或其药学上可接受的盐经由灌注施用至器官。在本文公开的另一种实施方案中,锌或其药学上可接受的盐经由外周静脉和/或中央静脉施用。
锌的治疗有效量根据可能影响锌生物利用度的因素而变化,诸如受试者的年龄、体重和健康状态(例如,预先存在的疾病或状况,诸如急性或慢性的肾损伤、糖尿病和高血压),例如考虑到吸收、代谢和清除的速率。
已经发现,以大于或等于1mg/kg体重的量经血管内施用的锌看起来没有抑制缺血再灌注损伤对肾的不良影响。例如,根据由血清肌酐水平和血清尿素水平所确定的,以大于或等于1mg/kg体重的量施用的锌没有改善缺血再灌注损伤之后的肾功能。此外,以甚至更高的量(2.5mg/kg体重或10mg/kg体重)施用的锌使缺血再灌注损伤之后的肾功能恶化。因此,本发明人惊奇地发现,在一些情况下,对于可以经血管内(例如,经由灌注)施用的锌的范围可能存在上限,该上限提供治疗有效量以抑制有害损伤对肾的影响。
在本文公开的实施方案中,锌或其药学上可接受的盐以小于1.0mg/kg体重的量经血管内施用。在本文公开的另一种实施方案中,锌或其药学上可接受的盐以选自由以下组成的组的量经血管内施用:约0.1mg/kg体重至约0.9mg/kg体重、优选地约0.1mg/kg体重至约0.8mg/kg体重、优选地约0.1mg/kg体重至约0.7mg/kg体重、优选地约0.2mg/kg体重至约0.9mg/kg体重、优选地约0.2mg/kg体重至约0.8mg/kg体重、优选地约0.2mg/kg体重至约0.7mg/kg体重、优选地约0.3mg/kg体重至约0.9mg/kg体重、优选地约0.3mg/kg体重至约0.8mg/kg体重,或优选地约0.3mg/kg体重至约0.7mg/kg体重。在本文公开的另一种实施方案中,锌或其药学上可接受的盐以约0.5mg/kg体重的量经血管内施用。
应当理解,如本文描述的,代表在受试者中提供治疗有效量的锌的剂量范围的上限的锌或其药学上可接受的盐的量不是确定的,而是可能取决于诸如但不限于受试者的年龄、体重、总体健康状态和需要保护免受有害损伤的器官的因素。上限可以是本领域技术人员容易确定的近似值,高于该上限,锌或其药学上可接受的盐提供很少治疗效果或不提供治疗效果(或可能恶化有害损伤的影响)。例如,可以通过将一定范围的剂量施用至健康受试者(对照)的队列和其经历对其需要血管闭塞的肾的外科手术的受试者的队列来进行初步研究(pilot study)。然后可以进行分析,以确定对由血管闭塞和/或随后的再灌注引起的有害损伤的影响存在很少抑制或不存在抑制(或有害损伤的影响的恶化)的剂量。这可以通过测量肾功能或受有害损伤影响的其他参数(例如,凋亡细胞的数量;或诸如以下的因子的表达:缺氧诱导因子1-α、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子-1(KIM-1)、N-乙酰基氨基葡萄糖苷酶(NAG)、NephroCheck(其检测胰岛素样生长因子结合蛋白7;IGFBP7的存在)和尿中金属蛋白酶的组织抑制物(例如,TIMP-2)(与急性肾损伤相关)来确定。
如本文别处指示的,本发明人已经示出,经血管内施用的锌保护器官,诸如肾和心,免受随后的有害损伤诸如缺血再灌注的不良影响。因此,本领域技术人员将理解,锌或其药学上可接受的盐在有害损伤之前被施用,无论有害损伤是否是预期的。例如,在一些情况下,在受试者待经历对肾的外科手术时,诸如需要夹闭肾动脉以防止过度出血时,预期有害损伤。在这种情况下,锌或其药学上可接受的盐在由肾血管系统的夹闭引起的缺血性损伤之前被施用。因此,在实施方案中,该方法包括将锌或其药学上可接受的盐施用至有相应需要的受试者,其中锌或其药学上可接受的盐以足以抑制有害损伤的影响的量经血管内施用至受试者,并且其中锌或其药学上可接受的盐在有害损伤之前施用至受试者。考虑到诸如以下的因素,在将锌或其药学上可接受的盐施用至受试者和有害损伤的开始之间的时间段会变化:待施用的锌的浓度和受试者的年龄、体重和健康。该时间段应当被选择以确保在有害损伤的开始时仍存在治疗有效量的锌,以抑制有害损伤的不良影响,如本文描述的。该时间段可以由本领域技术人员确定。在一些实施方案中,锌或其药学上可接受的盐在有害损伤之前36小时内被施用至受试者,优选地在有害损伤之前1小时内、优选地2小时内、优选地3小时内、优选地4小时内、优选地5小时内、优选地6小时内、优选地7小时内、优选地8小时内、优选地9小时内、优选地10小时内、优选地11小时内、优选地12小时内、优选地13小时内、优选地14小时内、优选地15小时内、优选地16小时内、优选地17小时内、优选地18小时内、优选地19小时内、优选地20小时内、优选地21小时内、优选地22小时内、优选地23小时内、优选地24小时内或优选地在24小时的时候。在本文公开的另一种实施方案中,锌或其药学上可接受的盐在有害损伤之前4小时内被施用至受试者。
在一些情况下,将理解的是,需要多于一剂以获得治疗有效量的锌或其药学上可接受的盐。剂的数目可以由本领域技术人员容易地确定,例如,通过对关于剂是否足以抑制有害损伤的不良影响做出的观察,如本文描述的。将理解的是,在需要或期望多于一剂的情况下,剂的数目取决于诸如锌或其药学上可接受的盐在待施用的制剂中的浓度的因素。例如,与其中单剂可能足以在有相应需要的受试者中获得治疗有效量的锌的、包含较大浓度的锌的制剂相比,对于相对小的浓度的锌,可能需要较大数目的剂。多于一剂方案的每一剂之间的时间段可以变化;例如,1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时和/或24小时。因此,在实施方案中,本文公开的方法包括将至少两剂的锌或其药学上可接受的盐经血管内施用至有相应需要的受试者。通过“至少两剂”,意指2剂、3剂、4剂、5剂、6剂、7剂、8剂、9剂、10剂、11剂,依此类推。因此,在实施方案中,本文公开的方法包括将至少2剂、优选地至少3剂、优选地至少4剂、优选地至少5剂、优选地至少6剂、优选地至少7剂、优选地至少8剂、优选地至少9剂并且更优选地至少10剂的锌或其药学上可接受的盐施用至有相应需要的受试者。在实施方案中,多于一剂方案的每一剂之间的时间段是约1小时,优选地约2小时、优选地约3小时、优选地约4小时、优选地约5小时、优选地约6小时、优选地约7小时、优选地约8小时、优选地约9小时、优选地约10小时、优选地约11小时、优选地约12小时、优选地约13小时、优选地约14小时、优选地约15小时、优选地约16小时、优选地约17小时、优选地约18小时、优选地约19小时、优选地约20小时、优选地约21小时、优选地约22小时、优选地约23小时并且更优选地约24小时。在某些实施方案中,锌或其药学上可接受的盐作为在有害损伤之前约36小时内、优选地约24小时内被施用的分开的两剂施用至受试者。在本文公开的实施方案中,锌或其药学上可接受的盐作为在有害损伤之前约24小时时和约4小时时被施用的分开的两剂施用至受试者。
已经出乎意料地发现,通过施用至少两个分开剂量的锌或其药学上可接受的盐,可以在抑制有害损伤对器官的影响方面获得重要的优势。然而,在一些情况下,对于实现该益处所需的剂量的数目可能存在上限。也就是说,超过某数目的剂量,就不能获得另外的益处。因此,在一些实施方案中,没有必要经由多于一剂方案施用锌或其药学上可接受的盐,因为这可能冒着过剂量的风险。不希望受任何特定理论或作用模式的约束,假设锌或其药学上可接受的盐的第一次施用“引发”器官对第二剂或随后的剂的锌或其药学上可接受的盐的改善的或最佳的响应。
在本文公开的实施方案中,该方法包括将2剂至5剂的锌或其药学上可接受的盐施用至受试者。在另一种实施方案中,本文公开的方法包括在有害损伤之前36小时时间段内将2剂至5剂的锌或其药学上可接受的盐施用至受试者。
在某些实施方案中,本文公开的方法包括在有害损伤之前36小时时间段内的分开的2剂、3剂或4剂的锌或其药学上可接受的盐。合适地,在先前描述的任何时间段内存在两次分开的施用。
在其他实施方案中,在有害损伤之前36小时时间段内,锌或其药学上可接受的盐的剂在有害损伤之前30小时、28小时、26小时或约24小时时间段内施用。
在优选的实施方案中,在有害损伤之前36小时至12小时之间将第一剂的锌或其药学上可接受的盐施用至受试者,并且在有害损伤之前1小时至10小时之间施用第二剂。
在某些实施方案中,在有害损伤之前30小时至18小时之间施用第一剂,并且在有害损伤之前2小时至6小时之间施用第二剂。
可以在有害损伤之前28小时至20小时之间施用第一剂,并且在有害损伤之前3小时至5小时之间施用第二剂,诸如第一剂在有害损伤之前约24小时,并且第二剂在有害损伤之前约4小时。
因此,在另一种实施方案中,提供了抑制有害损伤对受试者的器官的影响的方法,该方法包括将锌或其药学上可接受的盐施用至有相应需要的受试者,其中锌或其药学上可接受的盐以足以抑制有害损伤的影响的量经血管内被施用至受试者,并且其中锌或其药学上可接受的盐在有害损伤之前36小时内以分开的至少两剂但小于5剂施用。在实施方案中,方法包括将锌或其药学上可接受的盐经静脉内施用至受试者。在另一种实施方案中,方法包括将锌或其药学上可接受的盐经动脉内施用至受试者。
如先前所描述的,剂的数目、给药的时间、给药之间的时间以及每一剂中提供的量可以变化。
在某些实施方案中,施用分开的两剂。例如,可以在有害损伤之前36小时至12小时之间将第一剂的锌或其药学上可接受的盐施用至受试者,并且可以在有害损伤之前1小时至10小时之间施用第二剂。
每一剂的锌可以以选自由约0.1mg/kg体重至约0.9mg/kg体重组成的组的量施用。
在某些实施方案中,本发明包括在分配所述治疗之前选择需要治疗的患者用于抑制有害损伤对器官诸如肾的影响的步骤。该选择可以包括鉴定由于医疗/治疗干预而将要经历缺血性事件的患者的步骤。
如本文使用的措辞“药学上可接受的”指的是当施用至受试者诸如例如人类时不产生不良反应、过敏反应或其他不利反应(untoward reaction)的分子形式和组合物。
在某些实施方案中,锌或其药学上可接受的盐与“药学上可接受的载体”一起配制。如本文使用的措辞“药学上可接受的载体”意指用于将锌递送至受试者的组合物或媒介物,诸如液体、稀释剂、赋形剂或溶剂。在与锌或其药学上可接受的盐相容的意义上,每种载体应当是“可接受的”,同时也是相对惰性的;也就是说,对受试者不是有害的。合适的载体是本领域技术人员已知的,其说明性实例包括溶剂、分散介质、抗氧化剂、防腐剂(例如抗菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、稳定剂、赋形剂或其组合。锌或其药学上可接受的盐还可以与一种或更多种其他活性剂或活性成分一起配制。
如本文别处指出的,措辞“治疗有效量”指的是锌或其药学上可接受的盐的量,该量有效减轻或抑制有害损伤对器官诸如肾的影响。通过进行临床试验或在实验动物诸如绵羊中的代谢研究以确定提供期望的结果的最佳剂量范围,可以容易地确定治疗有效量。在临床环境中使用之前,在动物模型中进行验证性研究可能是有益的,该动物模型通常是广泛接受的、待治疗特定疾病的动物模型。用于在某些实施方案中使用的典型动物模型是啮齿动物、鼠科动物和绵羊模型,它们的使用是经济的,并且是因为获得的结果指示了临床价值(即在人类受试者中)。
受试者
如本文使用的术语“受试者”指的是可以受益于本文公开的方法的动物,特别是哺乳动物,并且更特别地灵长类动物,包括低等灵长类动物以及还更特别地,人类。受试者,无论是人类还是非人类动物或胚胎,均可以被称为个体、受试者、动物、患者、宿主或接受者。本发明具有人类应用和兽医学应用两者。为了方便起见,“动物”特别地包括家养和家畜动物(domestic and livestock animal),诸如狗、猫、牛、马、绵羊、猪、骆驼、山羊和驴。关于马,这些包括用于赛马业(racing industry)的马以及用于娱乐或畜牧业的马。实验室测试动物的实例包括小鼠、大鼠、兔、豚鼠和仓鼠。兔和啮齿动物,诸如大鼠和小鼠,提供了方便的测试系统或动物模型,灵长类和低等灵长类也是如此。在本文公开的实施方案中,受试者是人类。
在本文公开的另一种实施方案中,受试者患有肾癌。
在本文公开的另一种实施方案中,受试者患有心肌梗死或处于心肌梗死的风险中。
在第二方面,提供了用于在抑制有害损伤对受试者的器官的影响中使用的锌或其药学上可接受的盐,其中锌或其药学上可接受的盐以足以抑制有害损伤的影响的量经血管内施用至有相应需要的受试者。
在第三方面,提供了锌或其药学上可接受的盐在制备用于抑制有害损伤对受试者的器官的影响的药物中的用途,其中锌或其药学上可接受的盐被配制成以足以抑制有害损伤的影响的量血管内施用至有相应需要的受试者。
第二方面和第三方面的用途可以根据对于第一方面描述的那些实施方案来实现。
本文描述了本发明的优选的实施方案,包括本发明人已知用于实施本发明的最佳方式。在阅读前述描述后,那些优选的实施方案的变化形式对于本领域普通技术人员可以变得明显。预期的是,技术人员将视需要利用这样的变化形式,并且对于将以不同于本文具体描述的方式被实施的发明,被认为在本发明的范围和精神内。因此,本发明包括被适用法律许可的随附的权利要求书中陈述的主题的所有修改形式和等同形式。此外,除非本文另外指示或另外与上下文明显矛盾,否则上文描述的要素以其所有可能的变化形式的任何组合被包含在本发明内。
现在将通过以下的实施例来描述本发明,但本发明绝不限于以下的实施例。
实施例
实施例1:静脉内锌施用抑制绵羊肾中的缺血再灌注损伤
材料与方法
A.锌施用
医药级氯化锌(ZnCl
对照(n=4)接受单侧肾切除术,并且在外科手术之前24小时和4小时施用盐水。
另一组绵羊(n=1)在外科手术之前1小时接受6.6mg/kg体重的基于黄酮类化合物的抗氧化剂(3',4'二羟基黄酮醇)。
B.麻醉
在外科手术之前用静脉内硫喷妥钠(sodium thiopentone)(15mg/kg)对绵羊进行麻醉,用于气管插管(翻边管(cuffed tube)尺寸10)。借助于氧/空气/异氟醚(1.5%-2.0%)进行麻醉的维持。改变吸入氧分数(fractional inspired oxygen)以将PaO
C.外科手术和样品分析
在全身麻醉之后,去除右肾。将流量探头(flow probe)(4mm)植入左肾,并且使用血管夹将向肾脏供应血液的肾门(动脉和静脉)夹闭60分钟。在60分钟缺血之后,将血管夹从左肾取下,并且恢复血液供应。然后逆转全身麻醉,并且允许绵羊恢复。测量肾血流,在1周时间段内每天从绵羊中获取血液样品,并且确定尿素和肌酐的水平。将血液样品收集到肝素锂管中(Microtainer,Becton-Dickinson)。将血液样品离心,并且将等分试样储存在-20℃,直至由Clinical Trials Department,Austin Pathology,Heidelberg,Australia进行肌酐和尿素的分析。血清样品中的肌酐和尿素在全自动Roche Cobas 8000c702分析仪上测量。用于肌酐确定的动力学比色测定基于Jaffé法。尿素的动力学比色测定基于通过尿素酶催化将尿素水解为铵,然后是铵在谷氨酸脱氢酶和辅酶NADH的存在下与2-酮戊二酸的反应。NADH浓度的下降速率与样本中的尿素浓度成正比,并且通过光度测定来测量。
结果
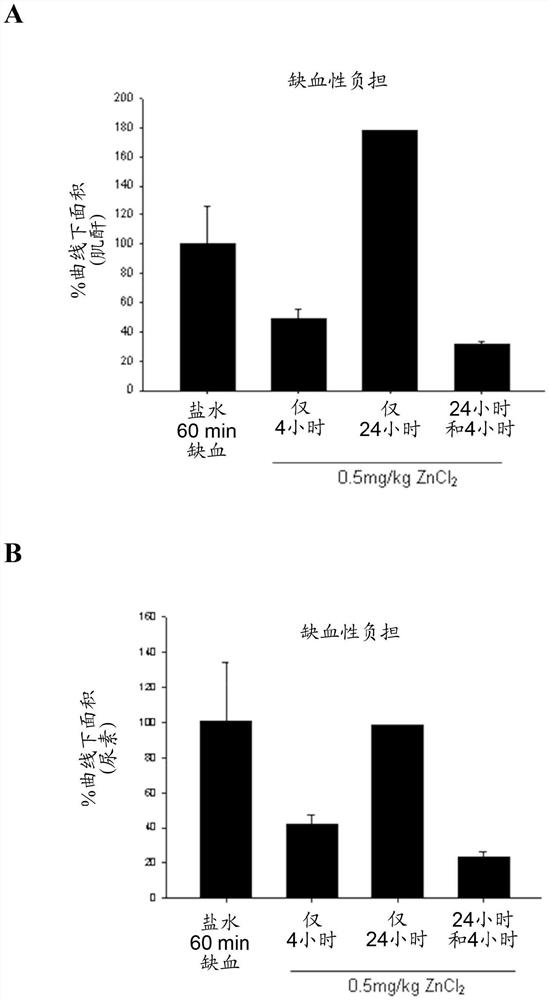
0.1mg/kg体重和0.5mg/kg体重的ZnCl
与对照动物相比时,在0.5mg/kg锌的情况下,缺血性负担降低了近70%,如通过血清肌酐和血清尿素的AUC(曲线下面积)值所证明的(图3;**p<0.05)。
当与对照比时,1.0mg/kg体重、2.5mg/kg体重和10.0mg/kg体重的ZnCl
缺血再灌注损伤的抑制的程度大于归因于抗氧化剂的抑制的程度,如通过血清肌酐水平的降低所证明的(图4A和图4B)。与抗氧化剂处理的动物中仅50%降低相比时,在0.5mg/kg锌的情况下,缺血性负担降低了近70%,如通过血清肌酐和血清尿素的AUC(曲线下面积)值所证明的(图4B和图4C;**p<0.05)。
实施例2:锌预调节经由缺氧诱导因子1-α(HIF-1α)的上调部分地保护肾免受缺血再灌注损伤
A.人类研究
在从癌部分分离之后,将正常人类肾中的段动脉切开,用50μM ZnCl
B.体外研究
Zn刺激的HK-2细胞中的HIF1α。用50μM ZnCl
Zn刺激的ACHN细胞中的HIF1α。用50μM ZnCl
结果
氯化锌预调节增强了人类肾组织中HIF-1α蛋白表达(参见图6)。氯化锌还在暴露后至少4小时增强了永生化人类近端肾小管细胞(HK2;图7)中和人类肾癌细胞(ACHN;图8A和图8B)中的HIF-1α蛋白表达。
HIF-1α调节细胞对缺氧的响应,并且已经示出其上调诱导参与对降低的氧利用度的适应的若干基因的表达。HIF-1α是异二聚体蛋白,包括氧调节的α亚基和组成型表达的β亚基。α亚基在由脯氨酰羟化酶(PHD)使两个脯氨酸残基羟基化之后在常氧(normoxia)期间被降解,主要是通过蛋白酶体依赖的途径。在缺氧期间,PHD被抑制,并且HIF-1α亚基积聚,其中它与HIF-1β二聚化,以驱动HIF靶基因的表达,HIF靶基因诸如参与血管生成和组织修复的那些基因(例如血管内皮生长因子(VEGF)基因、促红细胞生成素(EPO)基因、脯氨酰羟化酶(PHD)基因)。
Elisa Conde和她的同事的研究(PlosOne,2012年3月,Vol.7(3):e33258)发现,HIF-1α在缺血期间在大鼠肾的近端小管细胞中稳定,并且在再灌注晚期意外地稳定,此时氧张力是正常的。此外,体外干扰HIF-1α表达促进了细胞死亡,并且体内干扰加重了缺血再灌注损伤后的组织损伤和肾功能障碍。作者还报告,HIF-1α仅在表现出正常肾结构的移植后人类活组织检查的近端小管中表达,与急性小管坏死具有显著的负相关性。这些数据与当前的数据一致,其示出,锌预调节增强了大鼠肾中的HIF-1α蛋白表达,并且锌刺激人类肾小管肾细胞(图7)中和人类肾癌细胞(图8)中的HIF-1α表达。不受理论或特定应用模式的限制,这些数据表明锌预调节保护肾免受缺血再灌注损伤,至少部分地经由HIF-1α的上调。此外,锌刺激在ACHN细胞和HK2细胞两者中的HIF-2α,但不刺激HIF-3α。用ZnCl
实施例3:用锌的多次给药的效果
由于0.5mg/kg已经被确定为抑制肾缺血再灌注损伤的有效剂量,因此重复上文的给药实验以研究多次给药的效果。使绵羊经历单侧肾切除术和60min肾缺血,然后是再灌注。在Zn预处理之前(基线)、在缺血之前(第0天)和再灌注后持续7天测量血清肌酐水平和血清尿素水平。仅在60min缺血之前24小时或4小时用单剂的0.5mg/kg ZnCl
与对照动物(图10)和单独的24小时和4小时给药相比,缺血性负荷在缺血之前24小时和然后4小时给药0.5mg/kg锌的情况下显著降低,如通过血清肌酐和血清尿素的AUC(曲线下面积)值所证明的。
实施例4:锌预调节保护心肌组织免受缺血再灌注损伤
在成年绵羊(30kg-50kg)中进行心肌缺血再灌注。在心肌缺血之前24小时和4小时用双剂的0.5mg/kg ZnCl
图11示出了来自本研究的TCC染色前和TCC染色后的两组绵羊心脏切片的照片。第一张照片(图11A)示出了在任何TCC染色之前用伊文思蓝染色的横向环。它突出了处于缺血风险的区域,并且代表了在实验中被夹闭的血管系统血管所供应的范围。第二张照片(图11B)示出了与TCC缓冲液接触后的横向环,由此梗死组织变成白色。从图11B中明显的是,几乎观察不到白色染色,表明由于锌预调节,来自缺血或缺血再灌注的损伤的显著减少。当梗死面积表示为处于风险的心肌的面积的百分比时(如先前在Thomas等人,2011,EuropeanJournal of Pharmacology 658;160-167中描述的),在对照(未经锌处理的)动物中的梗死面积是心肌面积的80%±3%,而锌处理的动物在处于风险的心肌区域中不具有梗死的组织学标志。
- 用于抑制有害损伤的方法和组合物
- 用于抑制肿瘤性损伤的化合物的鉴定方法和含所述化合物的药物组合物
