抗体-寡核苷酸缀合物
文献发布时间:2023-06-19 11:14:36
本申请要求2018年6月12日提交的第62/648,131号美国临时申请的权益,该美国临时申请通过引用整体并入本文。
背景技术
成功开发治疗性RNA分子的主要障碍是内体逃逸问题——向细胞中的内化通过内体和溶酶体进行,而RNA作为带电荷的亲水性大分子无法逃脱内体或溶酶体。内体-溶酶体内化和外源RNA的筛选是哺乳动物细胞的进化特征,其抑制病毒进入细胞。各项研究已经指出了内体逃逸在开发RNA治疗剂中的困难:“siRNA递送,例如将RNAi治疗剂有效递送至肿瘤中,面临一些挑战……然后从内体逃逸到细胞质中。”Tatiparti等人,Nanomaterials(Basel).2017年4月;7(4):77。“内体逃逸是siRNA递送所要克服的关键生物学障碍。”Ma,DNanoscale.2014年6月21日;6(12):6415-25。“胞吞途径是细胞和任何生物剂如DNA、siRNA和蛋白质的主要摄取机制。这些物质被捕获在内体中……因此,实现有效的基于生物学的治疗的限制步骤是促进内体逃逸并确保治疗剂的胞质递送。”Varkouhi等人,J ControlRelease.2011年5月10日;151(3):220-8。
由于无法实现内体逃逸,因此先前通过抗体-寡核苷酸缀合物产生递送治疗性RNA的努力已经失败。例如,先前开发抗体-RNA缀合物的努力得出以下结论,“所有内化ARC均以靶向方式将siRNA递送至细胞中,因此沉默所面临的挑战似乎在于不仅将siRNA递送至细胞中,而且还离开内体区室,到达生产性细胞内位置以参与RISC。继续阐明ARC递送机制可能会阐明修饰缀合物以促进内体释出并进入RISC的方法。”Cuellar等人,Nucleic AcidsRes.2015年1月30日;43(2):1189–1203。因此,在本领域中仍然需要改进治疗性RNA分子的递送。
TM4SF1是在内皮细胞、间充质干细胞和肿瘤细胞中表达的蛋白质,它通过将蛋白质转运到细胞核来支持血管生成。先前的研究表明,抗TM4SF1抗体沿微管网络穿过胞质溶胶,并在体外培养的内皮细胞和体内的生血管内皮细胞中到达细胞核。参见Scuito等人,Biochem Biophys Res Commun.2015年9月25日;465(3):338-43。
发明内容
本发明人设想,不受任何特定理论所束缚,抗TM4SF1抗体寡核苷酸可能能够避免内体逃逸的问题,或者用更易处理的胞质释放或细胞核逃逸代替内体逃逸限制,于是,基于TM4SF1的非溶酶体内化,使用抗TM4SF1抗体-寡核苷酸缀合物将能够在治疗上重要的肿瘤细胞和生血管内皮细胞等细胞类型中有效递送寡核苷酸,从而避免对内体逃逸的需求。
一个实施方案提供了一种抗体-RNA缀合物,其包含与RNA分子缀合的抗TM4SF1抗体或其抗原结合片段。在一些实施方案中,所述RNA能够与编码凋亡抑制剂的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够与编码p53抑制剂的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够与编码免疫检查点蛋白的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够与编码参与灭活DNA修复的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够与编码参与抑制唾液酸生成的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够与编码参与无义介导的衰变的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA能够促进共刺激信号。在一些实施方案中,所述RNA分子能够抑制白细胞外渗。在一些实施方案中,所述RNA分子能够抑制对细胞分裂至关重要的分子。在一些实施方案中,所述RNA分子能够促进血管生成。在一些实施方案中,所述RNA分子能够抑制血管生成。在一些实施方案中,所述RNA分子包含具有三核苷酸重复序列的siRNA。在一些实施方案中,所述siRNA是基于CAG/CUG三核苷酸重复序列的siRNA。在一些实施方案中,所述RNA分子包含siRNA、反义RNA、miRNA、反义miRNA、antagomir(抗miRNA)、shRNA或mRNA。在一些实施方案中,所述RNA分子包含siRNA。在一些实施方案中,所述siRNA能够与编码凋亡抑制剂的多核苷酸特异性杂交。在一些实施方案中,所述siRNA能够与编码BCL-X
一个实施方案提供了一种缀合物,其包含抗TM4SF1抗体或其抗原结合片段和与该抗TM4SF1抗体或其抗原结合片段共价连接的siRNA。在一些实施方案中,所述抗TM4SF1抗体或其抗原结合片段包含选自SEQ ID No:6-8、12-15、18-20、24-26、30-32、36-38、42-44、48-50、54-56、60-62、66-68、72-74、78-80、84-86和94-99的一个或多个CDR。在一些实施方案中,所述抗TM4SF1抗体或其抗原结合片段包含重链和轻链,所述重链包含选自SEQ ID NO:1、3、15、27、39、51、63、75和92的序列,并且所述轻链包含选自SEQ ID NO:2、10、21、33、45、57、69、81和93的序列。在一些实施方案中,所述抗TM4SF1抗体或其抗原结合片段是Fab’片段。在一些实施方案中,所述siRNA能够靶向凋亡抑制剂、p53抑制剂、免疫检查点蛋白、参与灭活DNA修复的蛋白质、参与抑制唾液酸生成的蛋白质、参与无义介导的衰变的蛋白质。在一些实施方案中,所述siRNA能够促进共刺激信号、抑制白细胞外渗、抑制对细胞分裂至关重要的分子、抑制或促进血管生成。
一个实施方案提供了一种抗体片段-RNA缀合物,其包含与RNA分子缀合的抗TM4SF1Fab’片段,其中所述RNA分子包含反义RNA、miRNA、反义miRNA、antagomir(抗miRNA)、shRNA或mRNA。在一些实施方案中,所述RNA包含siRNA。在一些实施方案中,所述抗体片段-RNA缀合物通过包括以下步骤的过程产生:(i)生成马来酰亚胺修饰的或(2-吡啶基二硫基)戊酸酯修饰的siRNA,(ii)用半胱胺还原抗TM4SF1Fab’片段以生成包含两个巯基的工程化抗TM4SF1Fab’片段;以及(iii)将所述马来酰亚胺修饰的或(2-吡啶基二硫基)戊酸酯修饰的siRNA与所述工程化抗TM4SF1Fab’片段一起孵育,以产生抗体片段-RNA缀合物。
一个实施方案提供了一种组合物,其包含与抗体-药物缀合物组合的本文所述的抗体-RNA缀合物、根据本公开的缀合物或根据本公开的抗体片段-RNA缀合物。在一些实施方案中,所述抗体-药物缀合物包含用于治疗癌症的细胞毒性有效负载。在一些实施方案中,所述抗体-药物缀合物包含抗TM4SF1抗体或其抗原结合片段。在一些实施方案中,所述细胞毒性有效负载包括V-ATP酶抑制剂、促凋亡剂、Bcl2抑制剂、MCL1抑制剂、HSP90抑制剂、IAP抑制剂、mTor抑制剂、微管稳定剂、微管去稳定剂、auristatin、多拉司他汀、美登木素生物碱、MetAP(甲硫氨酸氨肽酶)、蛋白质核输出抑制剂CRM1、DPPIV抑制剂、蛋白酶体抑制剂、线粒体中的磷酰基转移反应的抑制剂、蛋白质合成抑制剂、激酶抑制剂、CDK2抑制剂、CDK9抑制剂、驱动蛋白抑制剂、HDAC抑制剂、DNA损伤剂、DNA烷化剂、DNA嵌入剂、DNA小沟结合剂、DHFR抑制剂、核酸或CRISPR酶。在一些实施方案中,所述有效负载包括美登木素生物碱、加利车霉素、吡咯并苯并二氮杂
一个实施方案提供了一种合成抗TM4SF1抗体-siRNA缀合物的方法,其包括:将siRNA与抗TM4SF1或其抗原结合片段缀合。在一些实施方案中,所述方法包括在所述抗TM4SF1抗体或其抗原结合片段的重链中引入半胱氨酸残基,以生成工程化抗TM4SF1抗体或其抗原结合片段。在一些实施方案中,所述方法包括通过添加3’-胺来修饰所述siRNA,以生成化学稳定化的3’胺标记的siRNA。在一些实施方案中,所述方法包括使所述化学稳定化的3’胺标记的siRNA与NHS连接体反应,以生成巯基反应性siRNA-连接体加合物。在一些实施方案中,所述方法包括使所述巯基反应性siRNA-连接体加合物与所述工程化抗TM4SF1抗体或其抗原结合片段上的巯基反应,从而生成所述抗体-siRNA缀合物。在一些实施方案中,所述方法进一步包括使用色谱程序纯化所述抗TM4SF1抗体-siRNA缀合物。在一些实施方案中,所述NHS连接体包括可还原的或不可还原的NHS连接体。在一些实施方案中,所述可还原的连接体包含N-琥珀酰亚胺基-4-(2-吡啶基二硫基)丁酸酯(SPDB)。在一些实施方案中,所述不可还原的连接体包含琥珀酰亚胺基-4-[N-马来酰亚胺基甲基]环己烷-1-甲酸酯(SMCC)。在一些实施方案中,所述色谱程序包括大小排阻色谱法。
一个实施方案提供了一种缀合物,其包含与寡核苷酸缀合的抗TM4SF1抗体或其抗原结合片段。在一些实施方案中,所述寡核苷酸包含DNA分子。在一些实施方案中,所述寡核苷酸包括反义寡核苷酸。在一些实施方案中,所述寡核苷酸包含修饰的DNA、三螺旋DNA、超螺旋DNA、Z-DNA或其任意组合。一个实施方案提供了一种治疗癌症的方法,其包括向受试者施用治疗有效量的根据本公开的缀合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的缀合物或包含根据本公开的缀合物的组合物。
一个实施方案提供了一种治疗癌症的方法,其包括向受试者施用治疗有效量的根据本公开的抗体-RNA缀合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体-RNA缀合物联合根据本公开的组合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体-RNA缀合物联合根据本公开的组合物,或者进一步联合另外的疗法。在一些实施方案中,所述另外的疗法包括化学疗法、放射疗法、使用额外的病毒的溶瘤病毒疗法、使用免疫调节剂的治疗、CAR T细胞疗法、抗癌剂或其任意组合。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体-RNA缀合物联合根据本公开的组合物,或者进一步联合另外的疗法,其中所述抗体-RNA缀合物、组合物或另外的疗法或其任意组合以液体剂型、固体剂型、可吸入剂型、鼻内剂型、脂质体制剂、包含纳米颗粒的剂型、包含微粒的剂型、聚合物剂型或其任意组合施用。
一个实施方案提供了一种治疗癌症的方法,其包括向受试者施用治疗有效量的根据本公开的缀合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的缀合物联合根据本公开的组合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的缀合物联合根据本公开的组合物,或者进一步联合另外的疗法。在一些实施方案中,所述另外的疗法包括化学疗法、放射疗法、使用额外的病毒的溶瘤病毒疗法、使用免疫调节剂的治疗、CAR T细胞疗法、抗癌剂或其任意组合。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的缀合物联合根据本公开的组合物,或者进一步联合另外的疗法,其中所述缀合物、组合物或另外的疗法或其任意组合以液体剂型、固体剂型、可吸入剂型、鼻内剂型、脂质体制剂、包含纳米颗粒的剂型、包含微粒的剂型、聚合物剂型或其任意组合施用。
一个实施方案提供了一种治疗癌症的方法,其包括向受试者施用治疗有效量的根据本公开的抗体片段RNA缀合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体片段-RNA缀合物联合根据本公开的组合物。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体片段-RNA缀合物联合根据本公开的组合物,或者进一步联合另外的疗法。在一些实施方案中,所述另外的疗法包括化学疗法、放射疗法、使用额外的病毒的溶瘤病毒疗法、使用免疫调节剂的治疗、CAR T细胞疗法、抗癌剂或其任意组合。在一些实施方案中,所述方法包括向所述受试者施用治疗有效量的根据本公开的抗体片段-RNA缀合物联合根据本公开的组合物,或者进一步联合另外的疗法,其中所述缀合物、组合物或另外的疗法或其任意组合以液体剂型、固体剂型、可吸入剂型、鼻内剂型、脂质体制剂、包含纳米颗粒的剂型、包含微粒的剂型、聚合物剂型或其任意组合施用。在一些实施方案中,所述癌症包括黑素瘤、肝细胞癌、乳腺癌、肺癌、腹膜癌、前列腺癌、膀胱癌、卵巢癌、白血病、淋巴瘤、肾癌、胰腺癌、上皮癌、胃癌、结肠癌、十二指肠癌、胰腺腺癌、间皮瘤、多形性胶质母细胞瘤、星形细胞瘤、多发性骨髓瘤、前列腺癌、肝细胞癌、胆管肉瘤、胰腺腺癌、头颈部鳞状细胞癌、结直肠癌、肠型胃腺癌、宫颈鳞状细胞癌、骨肉瘤、上皮性卵巢癌、急性淋巴母细胞淋巴瘤、骨髓增生性赘生物或肉瘤。
本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
本公开的新颖特征在所附权利要求书中具体阐述。通过参考以下对利用本公开的原理的说明性实施方案加以阐述的详细描述以及附图,将会对本公开的特征和优点获得更好的理解,在这些附图中:
图1显示了缀合抗TM4SF1抗体和siRNA的示例性方法。
图2显示了工程化抗体的示例性图示。
图3显示了在如本文所述的抗体寡核苷酸缀合物上进行制备的示例性流程图。
图4显示了裸寡核苷酸(Hu S)的代表性LC-MS(液相色谱-质谱法)结果。
图5显示了连接体寡核苷酸缀合物的代表性LC-MS结果。
图6显示了连接体寡核苷酸缀合物的代表性LC-MS结果。
图7显示了用本文所述的示例性抗体寡核苷酸缀合物进行的分析型SEC(大小排阻色谱法)的代表性结果。
图8显示了含有BCL2L1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在220nm处)。
图9显示了含有BCL2L1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在260nm处)。
图10显示了含有BCL2L1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在647nm处)。
图11显示了含有MCL1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在220nm处)。
图12显示了含有MCL1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在260nm处)。
图13显示了含有MCL11siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在647nm处)。
图14显示了含有CTsiRNA(对照siRNA)的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在220nm处)。
图15显示了含有CTsiRNA(对照siRNA)的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在260nm处)。
图16显示了含有CTsiRNA(对照siRNA)的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在647nm处)。
图17显示了含有TM4SF1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在220nm处)。
图18显示了含有TM4SF1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在260nm处)。
图19显示了含有TM4SF1siRNA的如本文所述的示例性抗体寡核苷酸缀合物的吸收光谱(在647nm处)。
图20A-20D提供了各种抗体和缀合物的HPLC色谱图。图20A显示了包含N297C突变的人AGX-A07裸抗体的HPLC色谱图;图20B显示了裸SPDP-TM4SF1-Husi的HPLC色谱图;图20C显示了包含N297C-S-S-TM4SF-1-Husi的人AGX-A07的粗缀合物;图20D显示了示例性的纯化ARC。
图21显示了利用试剂SPDP将抗体缀合至连接体寡核苷酸缀合物的示例性“方案”。
图22显示了如本文所述的抗体-RNA缀合物(ARC)的可能的作用机理。
图23A-23E显示了使用对照siRNA(图23A)、BCL2L1siRNA(图23B)、MCL1siRNA(图23C)、稳定化的BCL2L1siRNA(图23D)和稳定化的MCL1siRNA(图23E),在人脐静脉内皮细胞(HUVEC)中进行的敲减试验的结果。
图24显示了siRNA在癌细胞系和HUVEC中的代表性敲减数据。
图25显示了暴露于如本文所述的示例性ARC的细胞的代表性图像。
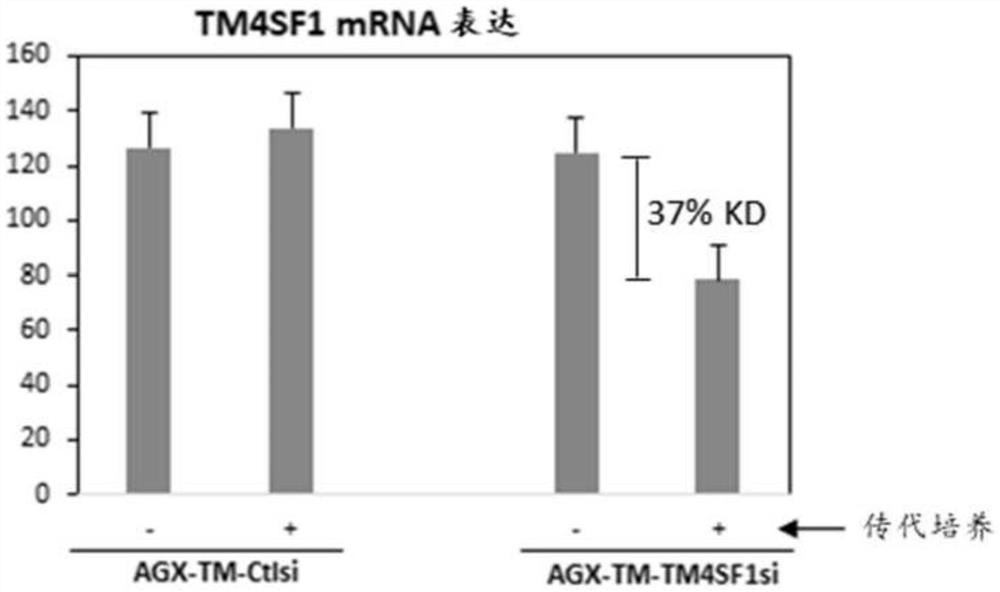
图26显示了在用本文所述的示例性ARC进行敲减后,TM4SF1的mRNA表达水平。
图27显示了如本文所述的示例性ARC在癌细胞系和HUVEC中的代表性敲减数据。
图28A-28D显示了使用如本文所述的示例性ARC,在HUVEC中的敲减研究的结果。图28A显示了暴露于示例性ARC的细胞的代表性图像;图28B显示了暴露于示例性ARC后,BBCL2L1mRNA的mRNA表达水平;图28C显示了BCL2L1蛋白表达水平(Western印迹);图28D显示了代表性的免疫染色结果。
图29A-29B显示了使用如本文所述的示例性ARC,在A549细胞中的敲减研究的结果。图29A显示了暴露于示例性ARC的细胞的代表性图像;图29B显示了暴露于示例性ARC后,BCL2L1mRNA的mRNA表达水平。
图30A-30B显示了使用如本文所述的示例性ARC,在MiaPaca2细胞中的敲减研究的结果。图30A显示了暴露于示例性ARC的细胞的代表性图像;图30B显示了暴露于示例性ARC后,BCL2L1mRNA的mRNA表达水平。
图31A-31B显示了使用如本文所述的示例性ARC,在SKOV3细胞中的敲减研究的结果。图31A显示了暴露于示例性ARC的细胞的代表性图像;图31B显示了暴露于示例性ARC后,BCL2L1mRNA的mRNA表达水平。
图32A-32B显示了使用如本文所述的示例性ARC,在HUVEC中的敲减研究的结果。图32A显示了暴露于示例性ARC的细胞的代表性图像;图32B显示了暴露于示例性ARC后,MCL1mRNA的mRNA表达水平。
具体实施方式
I.定义
除非在本文中另有定义,否则与本公开关联使用的科学和技术术语具有本领域普通技术人员通常所理解的含义。术语的含义和范围应当是清楚的,然而,如果存在任何潜在歧义,则本文提供的定义优先于任何词典或外部定义。此外,除非上下文另有要求,否则单数术语将包括复数,并且复数术语将包括单数。在本申请中,除非另有说明,否则“或”的使用意指“和/或”。此外,术语“包括”以及其他形式如“包含”和“含有”的使用不是限制性的。
通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质和核酸化学和杂交关联使用的命名及其技术是本领域公知且常用的。除非另有规定,否则本公开的方法和技术通常根据本领域公知的以及如本说明书通篇引用和论述的各种通用的和更具体的参考文献中描述的常规方法来进行。酶反应和纯化技术按照制造商的说明书进行,以本领域通常实现的方式进行,或如本文所述进行。与本文所述的分析化学、合成有机化学以及医学和药物化学关联使用的命名及其实验室程序和技术是本领域公知且常用的。标准技术用于化学合成、化学分析、药物制备、配制和递送以及治疗患者。
为了可以更容易地理解本公开内容,所选术语如下定义。如本文所用的术语“跨膜-4L六家族成员-1”或“TM4SF1”是指跨膜4超家族/四跨膜蛋白家族的多肽,该多肽在肿瘤血管结构内皮细胞(EC)、肿瘤细胞(TC)、发育中的视网膜血管结构的EC以及血管生成性血管上高度表达。TM4SF1具有两个被四个跨膜域(M1、M2、M3和M4)隔开的胞外环(ECL1和ECL2)、N末端和C末端以及胞内环(ICL)。ECL2含有两个N-糖基化位点。人TM4SF1(hTM4SF1)的氨基酸序列以SEQ ID NO:90描述(也参见NCBI参考序列号NP_055035.1)。
如本文所用的术语“抗体”意指包含至少一个与特定抗原(例如TM4SF1)特异性结合或相互作用的互补决定区(CDR)的任何抗原结合分子。术语“抗体”包括包含四条多肽链,即通过二硫键相互连接的两条重(H)链和两条轻(L)链的免疫球蛋白分子,及其多聚体(例如IgM)。每条重链包含重链可变区(在本文中缩写为HCVR或VH)和重链恒定区。重链恒定区包含CH1、CH2和CH3这三个结构域。每条轻链包含轻链可变区(在本文中缩写为LCVR或VL)和轻链恒定区。轻链恒定区包含一个结构域(CL1)。VH和VL区可进一步细分为超变区,被称为互补决定区(CDR),其中散布有更保守的区域,被称为框架区(FR)。每个VH和VL由三个CDR和四个FR组成,从氨基末端到羧基末端按以下顺序排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4。在本公开的不同实施方案中,抗TMS4F1抗体(或其抗原结合部分)的FR可与人种系序列相同,或者可被天然地或人工地修饰。可以基于对两个或更多个CDR的并排分析来确定氨基酸共有序列。
术语“完整抗体”是指包含四条多肽链,即通过二硫键相互连接的两条重(H)链和两条轻(L)链的抗体。在一个实施方案中,所述抗TM4SF1抗体是完整抗体。在一个实施方案中,该完整抗体是完整的人IgG1、IgG2或IgG4同种型。在某些实施方案中,该抗TM4SF1抗体或其抗原结合片段是人IgG1、IgG2或IgG4同种型。
如本文所用的,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”或“抗体片段”等包括特异性结合抗原以形成复合物的任何天然存在的、可以酶法获得的、合成的或遗传工程化的多肽或糖蛋白。例如,抗体的抗原结合片段可使用任何合适的标准技术从完整抗体分子衍生,所述技术例如是蛋白水解消化,或涉及操作和表达编码抗体可变域和可选的恒定域的DNA的重组遗传工程技术。这样的DNA是已知的,并且/或者易于从例如商业来源、DNA文库(包括例如噬菌体-抗体文库)获得,或者可以合成获得。可对DNA进行测序,并且以化学方式或通过使用分子生物学技术进行操作,例如用以将一个或多个可变域和/或恒定域排列成合适的构型,或者用以引入密码子,创建半胱氨酸残基,修饰、添加或删除氨基酸,等等。
抗原结合片段的非限制性实例可包括:(i)Fab片段;(ii)F(ab’)2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;和(vii)由模拟抗体的高变区的氨基酸残基组成的最小识别单元(例如,分离的互补决定区(CDR),如CDR3肽),或受约束的FR3-CDR3-FR4肽。
如本文所用的术语抗体或其片段的“可变区”或“可变域”是指抗体分子的轻链和重链的部分,其包括互补决定区(CDR;即CDR-1、CDR-2和CDR-3)和框架区(FR)的氨基酸序列。VH是指重链的可变域。VL是指轻链的可变域。根据本公开中使用的方法,分配给CDR和FR的氨基酸位置可根据Kabat(Sequences of Proteins of Immunological Interest(National Institutes of Health,Bethesda,Md.,1987和1991))来确定。抗体或抗原结合片段的氨基酸编号也按照Kabat的编号。
如本文所用的术语“互补决定区”或“CDR”是指抗体可变序列内的互补决定区。在重链和轻链的每个可变区中存在三个CDR,对于每个可变区,这些CDR被指定为CDR1、CDR2和CDR3。如本文所用的术语“CDR集”是指存在于单一可变区中的能够结合抗原的一组三个CDR。这些CDR的精确边界已根据不同系统以不同方式限定。由Kabat(Kabat等人,Sequencesof Proteins of Immunological Interest(National Institutes of Health,Bethesda,Md.(1987)和(1991)))描述的系统不仅提供适用于抗体的任何可变区的明确残基编号系统,而且还提供界定三个CDR的确切残基边界。这些CDR可被称为Kabat CDR。Chothia和同事(Chothia等人,J.Mol.Biol.196:901-917(1987)和Chothia等人,Nature 342:877-883(1989))发现,Kabat CDR内的某些子部分尽管在氨基酸序列水平上具有极大多样性,但却采用几乎相同的肽骨架构象。这些子部分被指定为L1、L2和L3或H1、H2和H3,其中“L”和“H”分别表示轻链区域和重链区域。这些区域可被称为Chothia CDR,它们具有与Kabat CDR重叠的边界。界定与Kabat CDR重叠的CDR的其他边界已由Padlan(FASEB J.9:133-139(1995))和MacCallum(J Mol Biol 262(5):732-45(1996))描述。其他CDR边界界定可能不严格遵循以上系统之一,但仍然与Kabat CDR重叠,尽管鉴于特定残基或残基组乃至整个CDR不显著影响抗原结合的预测或实验发现,它们可以是缩短的或延长的。本文所用的方法可利用根据这些系统中的任何系统所确定的CDR,但优选实施方案使用Kabat或Chothia确定的CDR。
如本文所用的术语“框架区”(在下文中称为FR)是指除CDR残基以外的那些可变域残基。每个可变域一般具有四个FR,被标识为FR1、FR2、FR3和FR4。抗体或其功能片段的可变区之间的共同结构特征是本领域公知的。编码特定抗体的DNA序列通常可按照公知方法来获得,所述方法例如是在此引入作为参考的的Kabat等人,1987Sequence of Proteins ofImmunological Interest,U.S.Department of Health and Human Services,BethesdaMD中描述的那些方法。另外,用于从抗体克隆功能性可变区的一般方法可见于在此引入作为参考的Chaudhary,V.K.等人,1990Proc.Natl.Acad.Sci.USA 87:1066中。
本文的术语“Fc区”用来定义抗体重链的C末端区域,包括例如天然序列Fc区、重组Fc区和变异Fc区。尽管抗体重链的Fc区的边界可能变化,但人IgG重链Fc区常常被定义为从位置Cys226处的氨基酸残基或从Pro230伸展至其羧基末端。Fc区的C末端赖氨酸(根据EU编号系统的残基447)可以例如在抗体的产生或纯化期间,或通过重组工程改造编码抗体重链的核酸琮去除。因此,完整抗体的组合物可包含已去除所有K447残基的抗体群体,没有去除K447残基的抗体群体,以及具有含K447残基的抗体和不含K447残基的抗体的混合物的抗体群体。
如本文所用的术语“人源化抗体”是指与目的抗原(例如人TM4SF1)免疫特异性结合,并且包含基本上具有人抗体的氨基酸序列的框架(FR)区和基本上具有非人抗体的氨基酸序列的互补决定区(CDR)的抗体或其变体、衍生物、类似物或片段。非人(例如鼠)抗体的人源化形式是含有衍生自非人免疫球蛋白的最小序列的嵌合免疫球蛋白。通常,人源化抗体将包含基本上全部至少一个、通常两个可变域,其中全部或基本上全部CDR区对应于非人免疫球蛋白的CDR区,并且全部或基本上全部FR区是人免疫球蛋白序列的FR区。人源化抗体还可包含免疫球蛋白恒定区(Fc)的至少一部分,一般是具有人免疫球蛋白共有序列的免疫球蛋白恒定区的至少一部分。抗体人源化方法是本领域已知的。参见,例如,Riechmann等人,1988,Nature 332:323-7;Queen等人的美国专利:5,530,101;5,585,089;5,693,761;5,693,762;和6,180,370;EP239400;PCT公布WO 91/09967;美国专利5,225,539;EP592106;EP519596;Padlan,1991,Mol.Immunol.,28:489-498;Studnicka等人,1994,Prot.Eng.7:805-814;Roguska等人,1994,Proc.Natl.Acad.Sci.91:969-973;以及美国专利5,565,332,所述文献均通过引用整体并入本文。
如本文所用的术语“单克隆抗体”是指从基本上均质的抗体群体中获得的抗体,即,除了可能少量存在的可能的突变,例如天然发生的突变外,构成该群体的各个抗体是相同的。因此,修饰语“单克隆”将抗体的特性指示为不是离散抗体的混合物。在某些实施方案中,这样的单克隆抗体通常包括包含结合靶标的多肽序列的抗体,其中靶标结合性多肽序列通过包括从多个多肽序列中选择单一靶标结合性多肽序列的过程来获得。例如,选择过程可以是从多个克隆,例如从一系列杂交瘤克隆、噬菌体克隆或重组DNA克隆中选择独特的克隆。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品相反,单克隆抗体制品的每种单克隆抗体针对抗原上的单个表位。
如本文所用的术语“嵌合抗体”是指重链和/或轻链的一部分与来源于特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的其余部分与来源于另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源的抗体(免疫球蛋白),以及这类抗体的片段,只要它们展现所需的生物活性即可(美国专利4,816,567;和Morrison等人,Proc.Natl.Acad.Sci.USA 81:6851-6855(1984))。
如本文所用的术语“表位”是指与抗体分子的可变区中被称为互补位的特定抗原结合位点相互作用的抗原决定簇。单一抗原可具有超过一个表位。因此,不同抗体可与抗原上的不同区域结合,并且可具有不同的生物效应。表位可被定义为结构性的或功能性的。功能性表位通常是结构性表位的子集,并且具有直接贡献于相互作用的亲和力的那些残基。表位还可以是构象性的,即,由非线性氨基酸组成。在某些实施方案中,表位可包括作为诸如氨基酸、糖侧链、磷酰基或磺酰基等分子的化学活性表面组群的决定簇,并且在某些实施方案中,可具有特定的三维结构特性和/或特定的电荷特性。
“结合亲和力”通常是指分子(例如结合蛋白,如抗体)的单个结合位点与其结合配偶体(例如抗原)之间的非共价相互作用的总和的强度。结合分子X(例如抗TM4SF1抗体)对其结合配偶体Y(例如人TM4SF1)的亲和力通常可用解离常数(KD)表示。亲和力可通过本领域已知的常用方法来测量,所述方法包括本文所述的那些方法。低亲和力抗体通常缓慢结合抗原并倾向于容易解离,而高亲和力抗体通常更快结合抗原并倾向于更久地保持结合。多种测量结合亲和力的方法是本领域已知的,其中任何方法均可用于本公开。具体的说明性实施方案包括以下。在一个实施方案中,“KD”或“KD值”可通过本领域已知的测定,例如通过结合测定来测量。KD可在例如用目的抗体的Fab形式及其抗原进行的RIA中测量(Chen等人,1999,J.Mol Biol 293:865-81)。KD还可以通过以下方式测量:使用FACS,或使用例如BIACORE 2000或BIACORE 3000通过BIACORE进行的表面等离子体共振测定,或通过使用例如OCTET QK384系统进行的生物层干涉测量法。在某些实施方案中,抗TM4SF1抗体的KD使用采用HUVEC细胞进行的标准流式细胞术测定来确定。“结合速率”或“缔合速率”或“kon”和“解离速率”或“解离的速率”或“koff”还可使用例如BIACORE 2000或BIACORE 3000或OCTETQK384系统,通过以上所述的相同表面等离子体共振或生物层干涉测量技术来确定。
如本文所用的,术语“kon”旨在表示如本领域已知,抗体与抗原缔合以形成抗体/抗原复合物的结合速率常数。
如本文所用的,术语“koff”旨在表示如本领域已知,抗体从抗体/抗原复合物上解离的解离速率常数。
术语“抑制”当在本文中使用时是指部分(如1%、2%、5%、10%、20%、25%、50%、75%、90%、95%、99%)或完全(即100%)抑制。
术语“干扰RNA”或“RNAi”或“干扰RNA序列”是指当干扰RNA与靶基因在同一细胞中时能够降低或抑制靶基因表达(即,通过介导与干扰RNA的序列互补的mRNA的降解)的双链RNA(即双链体RNA)。因此,干扰RNA是指由两条互补链或一条单条自互补链形成的双链RNA。干扰RNA与靶基因可具有基本的或完全的同一性,或者可包含错配区域(即错配基序)。干扰RNA的序列可以对应于全长靶基因或其子序列。
如本文所用的术语“癌症”是指或描述哺乳动物中的生理状况,该状况的特征一般是不受调节的细胞生长。
如本文所用的术语“与高转移风险相关的癌症”是指与至少一种已知会增加患有癌症的受试者发生转移性癌症的风险的因素相关的癌症。与转移风险增加相关的因素的实例包括但不限于受试者在初始癌症诊断时具有的癌性淋巴结的数目、肿瘤的大小、组织学分级,以及在初始诊断时癌症的分期。
如本文所用的术语“血液性转移”是指癌细胞能够穿透血管壁,之后它们能够通过血流循环(循环肿瘤细胞)到身体中的其他部位和组织。
如本文所用的术语“淋巴性转移”是指癌细胞能够穿透淋巴管,并且排入血管中。
在本公开的背景下,如本文所用的术语“治疗”或“处理”意指逆转、减轻、预防应用这种术语的病症或病况或这种病症或病况的一种或多种症状或抑制其进展。如本文所用的术语“治疗癌症”意指抑制癌细胞的生长和/或增殖。在一个实施方案中,本文所述的组合物和方法用来治疗患有转移性癌症的受试者中的转移。
术语“预防癌症”或“癌症的预防”是指延迟、抑制或防止哺乳动物中癌症的发作,在该哺乳动物中,肿瘤生成或肿瘤发生的发作未经证实,但癌症倾向得到确认,无论是通过例如遗传筛查还是以其他方式确认。该术语还涵盖治疗具有恶化前状况的哺乳动物,以使恶化前状况向恶性肿瘤的进展停止,或导致恶化前状况的消退。恶化前状况的实例包括增生、发育不良和化生。在一些实施方案中,预防癌症针对处于癌症缓解期的受试者来使用。
多种癌症,包括恶性或良性和/或原发性或继发性癌症,可用本公开的方法治疗或预防。这类癌症的实例是本领域技术人员已知的,并且在标准教科书如Merck Manual ofDiagnosis and Therapy(由Merck出版)中列出。
如本文所用的术语“受试者”是指哺乳动物(例如人)。
如本文所用的术语“施用”是指向受试者给予一定剂量的抗体或其片段或组合物(例如药物组合物)的方法。施用方法可根据各种因素(例如,所施用的结合蛋白或药物组合物,以及所治疗的病况、疾病或病症的严重程度)而不同。
如本文所用的术语“有效量”是指本文提供的抗体或药物组合物的足以导致所需结果的量。
术语“约”和“大约”意指在给定值或范围的20%以内、15%以内、10%以内、9%以内、8%以内、7%以内、6%以内、5%以内、4%以内、3%以内、2%以内、1%以内或更小百分比内。
如在本文中可互换使用的术语“同一性”或“同源性”可以是两个或更多个核苷酸或氨基酸序列之间的“同一性”、“同源性”或“同源性百分比”的计算,其可以通过为了最佳比较目的而对序列进行比对来确定(例如,可以在第一序列的序列中引入空位)。然后可以比较相应位置处的核苷酸,并且两个序列之间的同一性百分比可以是序列共有的相同位置数目的函数(即,%同源性=相同位置的数目/位置的总数目x100)。例如,如果第一序列中的位置可以被与第二序列中的相应位置相同的核苷酸占据,则分子在该位置处是相同的。两个序列之间的同源性百分比可以是序列共有的相同位置的数目的函数,其中考虑为了两个序列的最佳比对而需要引入的空位的数目和每个空位的长度。在一些实施方案中,为了比较目的而比对的序列的长度可以是参考序列长度的至少约:30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或95%。
在一些实施方案中,提供了抗体-核酸缀合物(在本文中也称为抗体-寡核苷酸缀合物),其包含与本文所述的抗TM4SF1抗体缀合的核酸。该核酸可以是基本上任何希望转运至细胞内部或在某些实施方案中转运至细胞核的核酸。如本文所用的,术语“核酸”包括但不限于天然存在的或化学合成的DNA、RNA、反义寡核苷酸(ASO)、修饰的DNA、修饰的RNA或其任意组合。该核酸可以具有任何数目的碱基对,例如直至目的基因的全长。例如,该核酸可以是线性或环状的双链DNA分子,其长度为约100至10,000个碱基对,尽管可以使用更长或更短的核酸。该核酸可以是线性或环状的DNA或RNA,并且可以是单链或双链的。DNA包括cDNA、三重螺旋、超螺旋、Z-DNA和其他异常形式的DNA、多核苷酸类似物、反义DNA、包含编码诸如治疗性蛋白质等蛋白质的DNA的表达构建体、包含编码核酶或反义RNA的DNA的可转录构建体、病毒基因组片段如病毒DNA、质粒、粘粒、编码生物体基因组的一部分的DNA、基因片段等。在一些情况下,修饰的核酸是,例如,荧光染料修饰的核酸、生物素化的核酸或其组合。其他修饰的核酸包括,例如,2'-O-甲基修饰、2'-氟修饰、2'-甲氧基乙基(MOE)修饰。
所述核酸还可以是RNA。例如,反义RNA,催化RNA,催化RNA/蛋白质复合物(“核酶”),包含RNA的表达构建体——该RNA可以被直接翻译以生成蛋白质产物,或者可以被逆转录并且被转录或被转录并翻译以分别生成RNA或蛋白质产物,包含RNA的可转录构建体——其具有通过反转录生成DNA所必需的任何启动子/调节序列,病毒基因组片段如病毒RNA,编码蛋白质如治疗性蛋白质的RNA,等等。可以基于在递送至靶细胞或其细胞核的内部时核酸将表现出的已知、期望或预期的生物活性来选择核酸。可以通过通常用于制备或分离核酸的任何常规手段来制备或分离核酸。例如,DNA和RNA分子可以使用可商购获得的试剂和合成仪,通过例如Gait,1985,在OLIGONUCLEOTIDE SYNTHESIS:APRACTICAL APPROACH(IRL Press,Oxford)中描述的方法化学合成。也可以使用诸如SP65(可从PromegaCorporation(Madison,Wis.)获得)等质粒,通过体外转录方法,以高收率产生RNA分子。该核酸可以通过任何合适的手段纯化。例如,可以通过反相或离子交换HPLC、大小排阻色谱法或凝胶电泳来纯化核酸。当然,技术人员将认识到,纯化方法将部分取决于待纯化的DNA的大小。该核酸也可以使用已知的或以后开发的无数重组方法中的任何方法来制备。
具有修饰的核苷间连接的核酸也可以在本文所述的缀合物中使用。例如,可以使用表现出增加的核酸酶稳定性的含有修饰的核苷间连接的核酸。此类核酸包括,例如,包含一个或多个膦酸酯、硫代磷酸酯、二硫代磷酸酯、氨基磷酸酯、甲氧基乙基氨基磷酸酯、甲缩醛(formacetal)、硫代甲缩醛、二异丙基甲硅烷基、乙酰胺(acetamidate)、氨基甲酸酯、二亚甲基-硫化物(-CH2-S-CH2-)、二亚甲基-亚砜(-CH2-SO-CH2-)、二亚甲基-砜(-CH2-SO2-CH2-)、2′-O-烷基和2'-脱氧-2'-氟-硫代磷酸酯核苷间连接的核酸。
所述核酸可以是治疗剂,例如抑制mRNA翻译的反义DNA分子。或者,该核酸可以编码治疗剂,如转录或翻译产物,当由含核酸的组合物所递送至的靶细胞表达时,其对该细胞具有有利的治疗作用。治疗性转录产物的实例包括蛋白质(例如,抗体、酶、受体结合配体、伤口愈合蛋白、抗再狭窄蛋白、抗致癌蛋白以及转录或翻译调节蛋白)、反义RNA分子、核酶、病毒基因组片段等。该核酸同样可以编码可用作已经使用该组合物转化的细胞的标志物的产物。标志物的实例包括具有易于鉴定的光谱性质的蛋白质(例如,绿色荧光蛋白;GFP)和在细胞表面上表达的蛋白质(即,可以通过使靶细胞与特异性结合该蛋白质的试剂接触来检测)。
举例来说,所述核酸可以选自编码致癌蛋白的核酸和抗致癌反义寡核苷酸。致癌蛋白的实例包括由以下基因编码的蛋白质:abl、akt2、apc、bcl2-alpha、bcl2-beta、bcl3、bcr、brcal、brca2、cbl、ccndl、cdk4、crk-II、csflr/fins、dbl、dcc、dpc4/smad4、e-cad、e2fl/rbap、egfr/erbb-l、elk]、elk3、eph、erg、ets1、ets2、fer、fgr/src2、flil/ergb2、fos、fps/fes、fral、fra2、fyn、hck、hek、her2/erbb-2/neu、her3/erbb-3、her4/erbb-4、hrasl、hst2、hstfl、ink4a、ink4b、int2/fgf3、jun、junb、jund、kip2、kit、kras2a、kras2b、ck、lyn、mas、max、mcc、met、mlhl、mos、msh2、msh3、msh6、myb、myba、mybb、myc、mycl1、mycn、nfl、nf2、nras、p53、pdgfb、pim1、pms1、pms2、ptc、pten、raft、rbl、rel、ret、ros1、ski、src1、tall、tglbr2、thral、thrb、tiam1、trk、vav、vhl、waf1、wnt1、wnt2、wt1和yes1。抑制这些基因之一的表达的寡核苷酸可用作抗致癌反义寡核苷酸。
可以将本文所述的核酸重组工程化到多种已知的宿主载体系统中,所述宿主载体系统提供核酸的大规模复制,以用于制备本文所述的组合物。可以使用已知方法设计这些载体,以包含指导核酸在其所递送至的细胞中的转录、翻译或两者所必需的元件。可以利用技术人员已知的方法来构建具有与适当的转录/翻译控制信号可操作地连接的蛋白质编码序列的表达构建体。这些方法包括体外重组DNA技术和合成技术。例如,参见Sambrook等人,1989,MOLECULAR CLONING:ALABORATORY MANUAL,Cold Spring Harbor Laboratory(NewYork);Ausubel等人,1997,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons(New York)。
编码一种或多种目的蛋白质的核酸可以与多种不同的启动子/调节子序列可操作地关联。启动子/调节子序列可包括组成型或诱导型启动子,并且可以在合适的条件下用于指导目的基因的高水平或调节的表达。可以使用的启动子/调节区的具体实例包括巨细胞病毒启动子/调节区和与SV40早期基因或SV40晚期基因相关的启动子/调节区。优选地,在本发明中使用人巨细胞病毒(hCMV)启动子。然而,可以使用指导目的基因的高水平或调节的表达的基本上任何启动子/调节区。
本文所述的核酸可包含在一个或多个启动子的控制下在单个遗传构建体上组合的多个蛋白质编码区。两个或更多个蛋白质编码区可以在单个启动子的转录控制下,并且核酸的转录物可包含一个或多个在蛋白质编码区之间插入的内部核糖体进入位点。因此,可以采用不同基因和遗传构建体的几乎无限的组合。
II.包含靶向蛋白和RNA分子的缀合物
本公开的一个实施方案提供了一种缀合物,其包含靶向蛋白,如抗体或其抗原结合片段,和寡核苷酸。在一些实施方案中,该缀合物使得能够将RNA分子靶向递送至作用部位,例如将siRNA靶向递送至肿瘤,并且还改善了基于RNA的治疗效果,例如改善的siRNA介导的沉默。在一些实施方案中,该缀合物实现了显著水平的天然表达的基因的敲减。
在一些实施方案中,本公开提供了与先前的抗体-RNA缀合物(其中使用100nM至可达1000nM的浓度进行敲减)相比,在低至10nM的浓度下有效实现高敲减率的改进的抗体-寡核苷酸缀合物(例如,包含siRNA的改进的抗体-RNA缀合物)。参见,Cuellar等人,NucleicAcids Research,2015,Vol.43,No.2,1189-1203。此外,本公开提供的方法不需要工程改造细胞以表达高水平的靶标,来实现高敲减率,从而提供了对抗体-RNA缀合物的先前开发努力(其中仅在高抗原表达时观察到高沉默效率)的改进。参见,同上,1202页。在一些实例中,以恰好足以使抗体的靶抗原(如TM4SF1)饱和的剂量或浓度施用一次或两次本公开的抗体-寡核苷酸缀合物,如ARC,这允许更有效地递送更高量的RNA(例如,siRNA)。在一些实例中,较高的OAR(寡核苷酸与抗体之比)或重复内化可以用来增加敲减率。例如,如果抗原的内化速度比siRNA的处理更快,则siRNA的剂量可以在细胞内积累,并且添加更多量的可用抗原的缀合物(例如ARC)可以提高敲减水平。
在一些情况下,靶向蛋白以高特异性结合抗原的能力可以有利地改善siRNA分子向细胞内的传递,以诱导依赖于共价偶联和抗原表达的沉默。缀合物分子的其他优点包括但不限于:(i)由抗体-抗原受体介导的胞吞所介导的寡核苷酸如siRNA向细胞质的递送得到改善,(ii)缀合物能够诱导或增强肿瘤抗原或病原体抗原或抗原决定簇被抗原呈递细胞(APC树突细胞(DC))的摄取和交叉呈递;(ii)能够促进树突细胞(DC)的成熟;(iii)能够提供CD4+T细胞以帮助生成CD8+T记忆细胞和针对肿瘤或病原体的抗体;(iv)能够使靶向的肿瘤细胞对抗体依赖性细胞毒性(ADCC)和T细胞介导的死亡敏感。在一些实施方案中,缀合物分子可以用于肿瘤性疾病、感染性疾病、内皮-白细胞相互作用、心血管/血管生成适应症和其他疾病的靶向免疫治疗或免疫预防。
在一些实施方案中,所述寡核苷酸是RNA分子。基于RNA的治疗剂的最新进展扩大了多种人类疾病的治疗靶标的范围。若干种基于RNA的治疗剂目前正在针对从遗传病症到HIV感染再到各种癌症的疾病进行临床研究。这些新出现的药物,包括治疗性核酶、适体和小干扰RNA(siRNA),已开始显现出前所未有的RNA的多功能性。在一些实施方案中,所述RNA分子能够与编码凋亡抑制剂的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够与编码p53抑制剂的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够与编码免疫检查点蛋白的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够与编码参与灭活DNA修复的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够与编码参与抑制唾液酸生成的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够与编码参与无义介导的衰变的蛋白质的多核苷酸特异性杂交。在一些实施方案中,所述RNA分子能够促进共刺激信号。在一些实施方案中,所述RNA分子能够抑制白细胞外渗。在一些实施方案中,所述RNA分子能够抑制对细胞分裂至关重要的分子。在一些实施方案中,所述RNA分子能够促进血管生成。在一些实施方案中,所述RNA分子能够抑制血管生成。在一些实施方案中,所述RNA分子能够抑制癌基因,如ABL1、ABL2、AKT1、AKT2、ATF1、BCL11A、BCL2、BCL3、BCL6、BCR、BRAF、CARD11、CBLB、CBLC、CCND1、CCND2、CCND3、CDX2、CTNNB1、DDB2、DDIT3、DDX6、DEK、EGFR、ELK4、ERBB2、ETV4、ETV6、EVI1、EWSR1、FEV、FGFR1、FGFR1OP、FGFR2、FUS、GOLGA5、GOPC、HMGA1、HMGA2、HRAS、IRF4、JUN、KIT、KRAS、LCK、LMO2、MAF、MAFB、MAML2、MDM2、MET、MITF、MPL、MYB、MYC、MYCL1、MYCN、NCOA4、NFKB2、NRAS、NTRK1、NUP214、PAX8、PDGFB、PIK3CA、PIM1、PLAG1、PPARG、PTPN11、RAF1、REL、RET、ROS1、SMO、SS18、TCL1A、TET2、TFG、MLL、TLX1、TPR或USP6。
通常,基于RNA的治疗剂可根据其作用机理被分类为若干类别。这些类别的非限制性实例包括:mRNA翻译抑制剂(反义)、RNA干扰剂(RNAi)、催化活性RNA分子(核酶)和结合蛋白质及其他分子配体的RNA(适体)。因此,在本公开的一些实施方案中,所述缀合物的寡核苷酸包含作为治疗剂的RNA分子,如反义寡核苷酸、RNA干扰剂、催化活性RNA分子或结合蛋白质和其他分子配体的RNA(适体)。在一些实例中,RNA干扰剂包括短干扰RNA(siRNA)。在一些实例中,所述寡核苷酸包含微小RNA(miRNA)。在一些实例中,所述寡核苷酸是信使RNA(mRNA)。在一些实例中,所述寡核苷酸是短发夹RNA(shRNA)。在一些实例中,所述寡核苷酸是反义miRNA。在一些实例中,所述寡核苷酸是antagomir(抗miRNA)。在一些实施方案中,本公开的RNA分子是包含天然存在的核苷酸的RNA分子。在一些情况下,该RNA分子是修饰的RNA分子,其包含诸如以下的修饰:硫代磷酸酯骨架修饰、2’-O-甲基(2’-OMe)、2’-氟(2’-F)、2’-O-甲氧基乙基(2’-MOE)糖取代;2’-O,4’-C-亚甲基连接的双环核糖核苷酸,被称为锁定核酸(LNA);或L-RNA(天然RNA的对映异构体)寡核苷酸,也称为spiegelmers。不受任何具体理论的束缚,可以想到,在糖环的2'位置的修饰——包括2’-OMe、2’-F、2’-MOE和LNA——能够使寡核苷酸采用RNA样C3’-内型(N型)糖褶,这是能量最有利的RNA构象。
在一些实例中,提供了偶联至修饰的RNA分子的缀合物,并且该缀合物显示出若干有利的性质,例如,对核酸分解降解的抗性提高,RNA酶H介导的靶mRNA的切割以用于反义应用,血浆蛋白质阻碍肾脏清除寡核苷酸或包含寡核苷酸的缀合物的亲和力提高。在一些实施方案中,所述缀合物包含如上例示的包含化学取代或LNA修饰的经修饰的RNA分子,并且由于化学取代或LNA修饰而具有总体上改善的效力、稳定性、药代动力学和药效学性质。
本公开的一个实施方案提供了一种缀合物,其包含抗体或其抗原结合片段和RNAi剂,以形成抗体-RNAi剂缀合物。RNAi是用于沉默化基因表达的天然机制。在RNAi的过程中,胞内导入的双链(ds)RNA被切割成小干扰(si)RNA双链体(19-21个碱基对),后者并入被称为RNA诱导的沉默复合物(RISC)的蛋白质复合物中,RISC解开两条siRNA链,保留一条链以允许对mRNA的识别和序列特异性降解。(参见,例如,Sledz CA,Williams BR(2005)RNAinterference in biology and disease.Blood 106:787–794)。在一些实例中,RNAi剂,如规范双链siRNA,是抗体-RNAi剂缀合物的一部分。在另外其他的实例中,其他类别的siRNA,例如自退火siRNA,是抗体-RNAi剂缀合物的一部分。
在一些实施方案中,抗体-RNAi剂靶向与适应症如癌症有关的一个或多个途径。在一些实施方案中,该RNAi剂是siRNA。
干扰RNA包括“小干扰RNA”或“siRNA”,例如,长度约为15-60、15-50或15-40个(双链体)核苷酸,更通常长度约为15-30、15-25或19-25个(双链体)核苷酸,优选长度约为20-24、21-22或21-23个(双链体)核苷酸的干扰RNA(例如,双链siRNA的每个互补序列的长度为15-60、15-50、15-40、15-30、15-25或19-25个核苷酸,优选长度约为20-24、21-22或21-23个核苷酸,并且双链siRNA的长度约为15-60、15-50、15-40、15-30、15-25或19-25个碱基对,优选长度约为20-24、21-22或21-23个碱基对)。siRNA双链体可包含约1至约4个核苷酸或约2至约3个核苷酸的3'突出端和5'磷酸末端。siRNA的实例包括但不限于:由两个单独链分子装配而成的双链多核苷酸分子,其中一条链是有义链,另一条链是互补的反义链;由单链分子装配而成的双链多核苷酸分子,其中有义区和反义区通过基于核酸或非基于核酸的连接体连接;具有发夹二级结构的双链多核苷酸分子,其具有自互补的有义区和反义区;以及具有两个或更多个环结构以及包含自互补的有义区和反义区的茎的环状单链多核苷酸分子,其中该环状多核苷酸可以在体内或体外进行加工,以生成活性双链siRNA分子。
在一些实施方案中,siRNA是化学合成的。siRNA也可以通过用大肠杆菌RNA酶III或切酶切割更长的dsRNA(例如,长度大于约25个核苷酸的dsRNA)而生成。这些酶将dsRNA加工成生物活性siRNA(参见,例如,Yang等人,Proc.Natl.Acad.Sci.USA,99:9942-9947(2002);Calegari等人,Proc.Natl.Acad.Sci.USA,99:14236(2002);Byrom等人,AmbionTechNotes,10(1):4-6(2003);Kawasaki等人,Nucleic Acids Res.,31:981-987(2003);Knight等人,Science,293:2269-2271(2001);和Robertson等人,J.Biol.Chem.,243:82(1968))。在一些实施方案中,被切割以生成siRNA的dsRNA的长度为至少50个核苷酸至约100、200、300、400或500个核苷酸。dsRNA的长度可以长达1000、1500、2000、5000个核苷酸或更长。dsRNA可以编码整个基因转录物或部分基因转录物。在某些情况下,siRNA可由质粒编码(例如,转录为自动折叠成具有发夹环的双链体的序列)。
在一些实施方案中,本文所述的siRNA分子用来下调或沉默目的基因的翻译(即表达)。目的基因包括但不限于与病毒感染和存活相关的基因、与代谢性疾病和病症(例如,肝脏疾病和病症)相关的基因、与肿瘤发生和细胞转化相关的基因、血管生成基因、免疫调节基因诸如与炎症和自身免疫应答相关的基因、配体受体基因以及与神经变性病症相关的基因。
与病毒感染和存活相关的基因包括由病毒表达的基因,以便结合、进入细胞并在细胞中复制。特别令人感兴趣的是与慢性病毒性疾病相关的病毒序列。特别令人感兴趣的病毒序列包括以下病毒的序列:丝状病毒,如埃博拉病毒和马尔堡病毒;沙粒病毒,如拉沙病毒、胡宁病毒、Machupo病毒、Guanarito病毒和Sabia病毒;流感病毒,如甲型、乙型和丙型流感病毒。可被沉默化的示例性丝状病毒核酸序列包括但不限于编码结构蛋白(例如,VP30、VP35、核蛋白(NP)、聚合酶蛋白(L-pol))和膜相关蛋白(例如,VP40、糖蛋白(GP)、VP24)的核酸序列。埃博拉病毒的完整基因组序列例如在Gen bank登录号NC-002549、AY769362、NC-006432、NC-004161、AY729654、AY354458、AY142960、AB050936、AF522874、AF499101、AF272001和AF086833中示出。埃博拉病毒VP24序列例如在Genbank登录号U77385和AY058897中示出。埃博拉病毒L-pol序列例如在Genbank登录号X67110中示出。埃博拉病毒VP40序列例如在Genbank登录号AY058896中示出。埃博拉病毒NP序列例如在Genbank登录号AY058895中示出。埃博拉病毒GP序列例如在Genbank登录号AY058898中示出。另外的埃博拉病毒序列例如在Genbank登录号L11365和X61274中示出。马尔堡病毒的完整基因组序列例如在Genbank登录号NC-001608、AY430365、AY430366和AY358025中示出。马尔堡病毒GP序列例如在Genbank登录号AF005734、AF005733和AF005732中示出。马尔堡病毒VP35序列例如在Genbank登录号AF005731和AF005730中示出。另外的马尔堡病毒序列例如在Genbank登录号X64406、Z29337、AF005735和Z12132中示出。可被沉默化的示例性流感病毒核酸序列包括但不限于编码核蛋白(NP)、基质蛋白(M1和M2)、非结构蛋白(NS1和NS2)、RA聚合酶(PA、PB1、PB2)、神经氨酸酶(NA)和血凝素(HA)的核酸序列。甲型流感NP序列例如在Genbank登录号NC-004522、AY818138、AB166863、AB188817、AB189046、AB189054、AB189062、AY646169、AY646177、AY651486、AY651493、AY651494、AY651495、AY651496、AY651497、AY651498、AY651499、AY651500、AY651501、AY651502、AY651503、AY651504、AY651505、AY651506、AY651507、AY651509、AY651528、AY770996、AY790308、AY818138和AY818140中示出。甲型流感PA序列例如在Genbank登录号AY818132、AY790280、AY646171、AY818132、AY818133、AY646179、AY818134、AY551934、AY651613、AY651610、AY651620、AY651617、AY651600、AY651611、AY651606、AY651618、AY651608、AY651607、AY651605、AY651609、AY651615、AY651616、AY651640、AY651614、AY651612、AY651621、AY651619、AY770995和AY724786中示出。可被沉默化的示例性肝炎病毒核酸序列包括但不限于参与转录和翻译(例如,En1、En2、X、P)的核酸序列和编码结构蛋白(例如,核心蛋白,包括C和C相关蛋白、衣壳和包膜蛋白,包括S、M和/或L蛋白,或其片段)的核酸序列。可被沉默化的示例性丙型肝炎核酸序列包括但不限于丝氨酸蛋白酶(例如NS3/NS4)、解旋酶(例如NS3)、聚合酶(例如NS5B)和包膜蛋白(例如E1、E2和p7)。甲型肝炎核酸序列例如在Genbank登录号NC-001489中示出;乙型肝炎核酸序列例如在Genbank登录号NC-003977中示出;丙型肝炎核酸序列例如在Genbank登录号NC-004102中示出;丁型肝炎核酸序列例如在Genbank登录号NC-001653中示出;戊型肝炎核酸序列例如在Genbank登录号NC-001434中示出;庚型肝炎核酸序列例如在Genbank登录号NC-001710中示出。在一些实施方案中,可以通过与用来治疗病毒性疾病的常规药剂的给药联合使用,使用本公开的抗体-RNAi缀合物,对编码与病毒感染和存活相关的基因的序列进行沉默化。
与代谢性疾病和病症(例如,以肝脏为目标的病症以及肝脏疾病和病症)相关的基因包括,例如,在血脂异常(例如,肝X受体,如LXRα和LXRβ(Genback登录号NM-007121)、法尼醇X受体(FXR)(Genbank登录号NM-005123)、固醇调节元件结合蛋白(SREBP)、位点-1蛋白酶(S1P)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMG辅酶A还原酶)、载脂蛋白(ApoB)和载脂蛋白(ApoE))和糖尿病(例如葡萄糖6磷酸酶)中表达的基因。在一些实施方案中,与代谢性疾病和病症(例如,以肝脏为目标的疾病和病症以及肝脏疾病和病症)相关的基因包括在肝脏本身中表达的基因以及在其他器官和组织中表达的基因。编码与代谢性疾病和病症相关的基因的序列的沉默化可方便地与用来治疗该疾病或病症的常规药剂的给药联合使用。与肿瘤发生和细胞转化相关的基因序列的实例包括有丝分裂驱动蛋白,如Eg5;易位序列,如MLL融合基因、BCR-ABL、TEL-AML1、EWS-FLI1、TLS-FUS、PAX3-FKHR、BCL-2、AML1-ETO和AML1-MTG8;过表达的序列,如多药抗药性基因、细胞周期蛋白、β-连环蛋白、端粒酶基因、c-MYC、N-MYC、BCL-2、ERBB1和ERBB2;以及突变序列,如RAS。编码DNA修复酶的序列的沉默化可与化疗剂的给药联合使用。编码与肿瘤迁移相关的蛋白质的基因也是目的靶序列,例如整联蛋白、选择蛋白和金属蛋白酶。前述示例并非排他性的。可以包括有利于或促进肿瘤发生或细胞转化、肿瘤生长或肿瘤迁移的任何完整或部分基因序列作为模板序列。血管生成基因能够促进新血管的形成。特别令人感兴趣的是血管内皮生长因子(VEGF)或VEGFr。在一些实例中,抗血管生成基因能够抑制新血管形成。这些基因对于治疗其中血管生成在疾病的病理发展中起作用的那些癌症特别有用。抗血管生成基因的实例包括但不限于内皮抑制素、制管张素和VEGF-R2。
免疫调节物基因是调节一种或多种免疫应答的基因。免疫调节物基因的实例包括但不限于细胞因子,如生长因子(例如,TGF-α、TGF-β、EGF、FGF、IGF、NGF、PDGF、CGF、GM-CSF、SCF等)、白介素(例如,IL-2、IL-4、IL-12、IL-15、IL-18、IL-20等)、干扰素(例如,IFN-α、IFN-β、IFN-γ等)和TNF。Fas和Fas配体基因也是感兴趣的免疫调节物靶序列。本发明中也包括在造血和淋巴样细胞中编码次级信号分子的基因,例如,Tec家族激酶,如布鲁顿酪氨酸激酶(Btk)。
细胞受体配体包括能够与细胞表面受体(例如,胰岛素受体、EPO受体、G蛋白偶联受体、具有酪氨酸激酶活性的受体、细胞因子受体、生长因子受体等)结合以调节(例如,抑制、激活等)受体所参与的生理途径(例如,葡萄糖水平调节、血细胞发育、有丝分裂发生等)的配体。细胞受体配体的实例包括但不限于细胞因子、生长因子、白介素、干扰素、促红细胞生成素(EPO)、胰岛素、胰高血糖素、G蛋白偶联受体配体等。
基因组中的三核苷酸重复序列(TNR)扩展会导致多种变性疾病,如亨廷顿病(HD)中的CAG的三核苷酸扩展;Friedreich共济失调中的GAA;脆性X震颤共济失调综合征(FXTAS)中的CGG;和在脆性XE智力低下(FRAXE)中发现的CCG。从TNR区生成的RNA,包括小siRNA大小的重复片段。对于HD患者已经报道了HTT中重复序列的长度与癌症发病率之间呈负相关。我们现在表明,基于CAG TNR的siRNA通过靶向在其开放阅读框中包含长反向互补TNR的基因而对癌细胞具有毒性。在基于不同TNR的siRNA中,相关TNR的CAG/CUG家族中的六个成员对人和小鼠癌细胞的毒性最高。基于siCAG/CUG TNR的siRNA在体外在所有测试的癌细胞系中诱导细胞死亡,并在卵巢癌的临床前小鼠模型中减慢肿瘤生长,而对小鼠没有毒性的迹象。我们建议探索基于TNR的siRNA作为一种新型抗癌剂。编码三核苷酸重复序列(例如,CAG重复序列)扩展的模板可用于沉默由三核苷酸重复序列的扩展引起的神经变性病症如脊髓延髓肌萎缩和亨廷顿病中的致病序列。因此,在一些实施方案中,siRNA包含三核苷酸重复(TNR)序列,如CAG/CUG TNR序列。在一些实施方案中,包含CAG/CUG序列的siRNA具有约0.01nM至约10.0nM的IC50。在一些些实施方案中,抗体-siRNA缀合物包含CAG重复序列。在一些些实施方案中,抗体-siRNA缀合物包含CUG重复序列。在一些些实施方案中,抗体-siRNA缀合物包含CAG和CUG重复序列。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用包含三核苷酸序列的抗体-siRNA缀合物。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用包含CAG重复序列的抗体-siRNA缀合物。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用包含CUG重复序列的抗体-siRNA缀合物。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用包含CAG和CUG重复序列的抗体-siRNA缀合物。
除了其为了治疗目的而沉默任何上述基因的表达的应用外,本文所述的对于抗体-RNAi缀合物的siRNA还可用于研究和开发应用以及诊断、预防、预后、临床及其他医疗应用。作为非限制性实例,本公开的siRNA分子可以在靶点验证研究中使用,这些研究旨在测试目的基因是否具有作为治疗靶点的潜力。本公开的siRNA分子还可以在靶点鉴定研究中使用,这些研究旨在发现作为潜在治疗靶点的基因。
siRNA靶标的其他实例包括但不限于:MCL1、BCL-XL、MDM2、MDM4、PD-L1、CD47/IAP、UPF1、MLH1、CMAS、CDK4、CDK6、PLK1、PLK4、AURKB、AURKA、MADCAM1、ICAM1、VCAM1和TM4SF1。在一些实施方案中,该siRNA靶向TM4SF1、CAG/CUG、P-选择蛋白、E-选择蛋白、外周淋巴结地址素(PNAd)、ICAM-2、PECAM-1、JAM-A、JAM-B、JAM-C、半乳凝素-1、半乳凝素-3和半乳凝素-9、PD-L2、SNAI1、ZEB1、B7-H3、IDO、LSECtin、CEACAM-1、HMGB-1、CD112、CD155。在一些实施方案中,该siRNA靶向TM4SF1,并且包含例如SEQ ID NO:100所示的有义链序列。在一些实施方案中,该siRNA是CAG和CUG三核苷酸重复序列衍生的siRNA(siCAG/CUG),其包含例如SEQ IDNO:101所示的有义链序列。在一些实施方案中,该siRNA靶向CD47/IAP。在一些实施方案中,该siRNA靶向PLK1。在一些实施方案中,该siRNA靶向MCL1。在一些实施方案中,该siRNA靶向ICAM1。
诱导的髓样白血病细胞分化蛋白(MCL1)是由MCL1基因编码的蛋白质,其属于Bcl-2家族。在诸如乳腺癌的癌症中,MCL1表达经常升高。凋亡的逃逸促进了肿瘤的发展,并且还成为癌症治疗诱导的细胞死亡的障碍。线粒体依赖性凋亡由Bcl-2家族成员控制——这些蛋白质通过调节线粒体完整性来控制细胞命运。在凋亡过程中,促凋亡Bcl-2成员的上调超过抗凋亡Bcl-2功能,从而导致线粒体外膜透化和细胞死亡。抗凋亡Bcl-2蛋白如BCL-2、MCL-1或BCL-XL的水平异常升高可防止凋亡,从而促进癌症并允许对癌症治疗诱导的细胞死亡的抗性。因此,降低MCL-1或BCL-XL的表达或使其失活提供了一种治疗和/或延迟癌症进展的方法。相应地,本公开的一个实施方案提供了靶向MCL-1的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码MCL-1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低MCL-1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向MCL-1的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向BCL-XL的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码BCL-XL的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制和/或降低BCL-XL的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向BCL-XL的抗体-siRNA缀合物。
小鼠双微体2同系物(Mdm2)是由MDM2基因编码的人类致癌蛋白质。Mdm2已被鉴定为抑制肿瘤阻抑物p53蛋白的转录活性的p53反应性蛋白质(即,Mdm2是p53的拮抗剂)。Mdm2通过结合并阻断p53的N末端反式激活域来抑制p53。Mdm2的转录被p53激活。由于Mdm2的异常活性,许多癌症,如急性髓样白血病(AML)和某些实体瘤,具有p53功能障碍。阻断Mdm2与p53的相互作用会诱导癌细胞和/或过表达Mdm2的细胞的凋亡。因此,降低Mdm2的表达或使其失活提供了一种治疗和/或延迟癌症进展的方法。相应地,本公开的一个实施方案提供了靶向Mdm2的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向Mdm2。在一些实施方案中,该siRNA能够与编码Mdm2的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低Mdm2的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向Mdm2的抗体-siRNA缀合物。
小鼠双微体4同系物(Mdm4)是由MDM4基因编码的人类致癌蛋白质。与Mdm2类似,Mdm4已被鉴定为p53的抑制剂,并且与Mdm2具有结构相似性。Mdm4也通过与其转录激活域结合来抑制p53。另外,已经表明,Mdm4通过环指域与Mdm2相互作用并抑制后者的降解。Mdm4通过拮抗p53的促凋亡功能来促进癌细胞如黑素瘤细胞的存活。对Mdm4与p53的相互作用的抑制可恢复p53功能,从而导致癌细胞的凋亡和/或对靶向癌症的治疗剂的敏感性增加。因此,降低Mdm4的表达或使其失活提供了一种治疗和/或延迟癌症进展的方法。相应地,本公开的一个实施方案提供了靶向Mdm4的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码Mdm4的多核苷酸特异性杂交。在一些实施方案中,该siRNA靶向Mdm4。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低Mdm4的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向Mdm4的抗体-siRNA缀合物。
程序性死亡配体1(PD-L1)是由CD274基因编码的人类蛋白质。PD-L1在特定事件中抑制免疫系统方面起主要作用;例如,在癌症和自身免疫性疾病中。PD-L1与PD-1或B7-1结合,从而触发抑制信号,该抑制信号降低抗原特异性T细胞的增殖并减少抗炎性T细胞的凋亡。PD-1/PD-L1途径是癌细胞响应于内源性免疫抗肿瘤活性而发挥的适应性免疫抗性机制。PD-L1通常在肿瘤细胞中过表达。PD-L1与活化T细胞上的PD-1受体结合,从而导致对细胞毒性T细胞的抑制,否则这些细胞会靶向肿瘤细胞。对PD-1/PD-L1途径的抑制使天然细胞毒性T细胞能够靶向并消除癌细胞。因此,降低PD-L1的表达或使其失活提供了一种治疗和/或延迟癌症进展的方法。相应地,本公开的一个实施方案提供了靶向PD-L1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PD-L1。在一些实施方案中,该siRNA能够与编码PD-L1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PD-L1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PD-L1的抗体-siRNA缀合物。
除了PD-L1外,PD-L2是PD-1的另一种配体。对PD-1/PD-L2途径的抑制使肿瘤细胞能够逃避免疫。于是,本公开的一个实施方案提供了靶向PD-L2的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PD-L2。在一些实施方案中,该siRNA能够与编码PD-L2的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PD-L2的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PD-L2的抗体-siRNA缀合物。
分化簇47,也称为整联蛋白相关蛋白(CD47/IAP),是由CD47基因编码的人类跨膜蛋白。CD47是一种广泛表达的细胞膜受体,属于免疫球蛋白(Ig)超家族。CD47与多种生理过程有关,例如但不限于细胞迁移、细胞增殖、凋亡和细胞粘附。另外,CD47也通过连接在吞噬细胞(例如巨噬细胞)上表达的信号调节剂蛋白α(SIRP-α)而充当吞噬作用的抑制剂。CD47在抑制肿瘤生长和预防转移中起作用。例如,阻断CD47会中断CD47-SIRPα途径,该途径使癌细胞能够逃避天然巨噬细胞的吞噬作用。另外,CD47的连接诱导癌细胞凋亡。此外,靶向CD47改善了肿瘤微环境。相应地,本公开的一个实施方案提供了靶向CD47的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CD47。在一些实施方案中,该siRNA能够与编码CD47的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CD47的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CD47的抗体-siRNA缀合物。
Upframeshift 1(UPF1)是一种RNA解旋酶,在无义介导的mRNA衰变(NMD)(一种主动降解mRNA的细胞过程)中起重要作用。UPF1是在mRNA核输出和mRNA监视中均参与的剪接后多蛋白质复合物的一部分。本公开的一个实施方案提供了靶向UPF1的抗体-siRNA缀合物。在一些实施方案中,UPF1促进新抗原的呈递。在一些实施方案中,该siRNA靶向UPF1。在一些实施方案中,该siRNA能够与编码UPF1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低UPF1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向UPF1的抗体-siRNA缀合物。无义介导的mRNA衰变(NMD)是一种mRNA质量控制机制,其降解包含提前翻译终止密码子(PTC)的异常mRNA。NMD的必需蛋白质包括SMG-1(一种蛋白激酶)和UPF1(具有RNA解旋酶活性的SMG-1底物)。UPF1消除带有提前终止密码子的异常mRNA,并调节正常生理mRNA的稳态水平。UPF1敲减导致异常mRNA的存活,并将其翻译成在体内不存在的异常蛋白质。这些异常蛋白质可被B细胞视为异物。相应地,本公开的一个实施方案提供了靶向UPF1的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码UPF1的多核苷酸特异性杂交。在一些实施方案中,UPF1促进新抗原的呈递。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向UPF1的抗体-siRNA缀合物。
MutL(大肠杆菌)同系物1(结肠癌,非息肉病2型),也称为MLH1,是一种参与DNA复制后的错配修复过程的蛋白质。在一些实施方案中,对MLH1的瞬时敲减下调错配修复,从而产生新抗原并对PD-1敏感。相应地,本公开的一个实施方案提供了靶向MLH1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向MLH1。在一些实施方案中,该siRNA能够与编码MLH1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低MLH1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向MLH1的抗体-siRNA缀合物。
N-酰基神经氨酸胞苷酰转移酶(CMAS)是在人类中由CMAS基因编码的酶。CMAS将N-乙酰神经氨酸(NeuNAc)转化为胞苷5'-单磷酸N-乙酰神经氨酸(CMP-NeuNAc)。该过程对唾液酸化糖蛋白和糖脂的形成至关重要。这种修饰在细胞间通讯和免疫应答中起作用。CMAS的过表达导致唾液酸水平升高,继而保持与癌细胞致病性(如乳腺癌)相关的基因的表达富含转录特征。通过敲减CMAS减少细胞唾液酸化作用导致转录重编程和乳腺癌致病性降低。相应地,本公开的一个实施方案提供了靶向CMAS的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码CMAS的多核苷酸特异性杂交。在一些实施方案中,该siRNA靶向CMAS。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CMAS的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CMAS的抗体-siRNA缀合物。
细胞周期蛋白依赖性激酶4(CDK4)(也称为细胞分裂蛋白激酶4)和CDK6都是细胞周期蛋白依赖性激酶家族的一部分。CDK4和CDK6在哺乳动物细胞增殖中起重要作用。CDK4(INK4)-视网膜母细胞瘤(Rb)途径的细胞周期蛋白D-CDK4/CDK6抑制剂通过控制G1(DNA合成前)到S(DNA合成)细胞周期检查点来调节细胞增殖。在癌症中经常观察到细胞周期蛋白D-CDK4/CDK6-INK4-Rb途径的失调,其导致细胞周期进程和继续增长。CDK4和CDK6通过与D型细胞周期蛋白缔合并调节Rb的磷酸化状态来介导从G1到S期的过渡。未磷酸化的Rb结合并抑制E2家族(E2F)转录因子的功能;磷酸化后,Rb从E2F转录因子上解离,使它们能够参与DNA复制和细胞分裂。细胞周期蛋白CDK4和CDK6活性的增加(其促进Rb的磷酸化)可以通过若干机制来发生,包括D型细胞周期蛋白的过表达,CDK4和/或CDK6基因的突变或扩增,或细胞周期蛋白CDK4和CDK6负调节物如p16INK4A的缺失。最终,增加的CDK4和CDK6活性导致癌细胞生长。因此,抑制CDK4和/或CDK6为晚期癌症患者提供了一种新颖的治疗方法。相应地,本公开的一个实施方案提供了靶向CDK4的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CDK4。在一些实施方案中,该siRNA能够与编码CDK4的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CDK4的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CDK4的抗体-siRNA缀合物。本公开的又一个实施方案提供了靶向CDK6的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CDK6。在一些实施方案中,该siRNA能够与编码CDK6的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CDK6的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CDK6的抗体-siRNA缀合物。
丝氨酸/苏氨酸蛋白激酶(PLK1),也称为polo样激酶1或丝氨酸/苏氨酸蛋白激酶13(STPK13),和丝氨酸/苏氨酸蛋白激酶(PLK4),也称为polo样激酶4,都是作为丝氨酸/苏氨酸蛋白激酶polo家族的一部分的酶。PLK1在细胞周期的整个M期行使若干重要功能,包括调节中心体成熟和纺锤体装配,从染色体臂上去除粘结蛋白,使后期促进复合物/细胞周期体(APC/C)抑制剂失活,以及调节有丝分裂退出和胞质分裂。PLK1的失调促进癌转化并推动其进展。PLK1过表达可见于多种人类癌症中,并且与癌症的不良预后相关。对PLK1的抑制通过干扰有丝分裂的多个阶段而导致癌细胞死亡。因此,PLK1是癌症治疗的有吸引力的靶点。相应地,本公开的一个实施方案提供了靶向PLK1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PLK1。在一些实施方案中,该siRNA能够与编码PLK1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PLK1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PLK1的抗体-siRNA缀合物。
PLK4调节细胞周期过程中的中心粒复制;即,PLK4对于中心体的复制是必不可少的。PLK4的过表达导致有丝分裂保真度改变并触发肿瘤发生。因此,对PLK4的抑制针对癌症的抗肿瘤作用。本公开的又一个实施方案提供了靶向PLK4的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PLK4。在一些实施方案中,该siRNA能够与编码PLK4的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PLK4的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PLK4的抗体-siRNA缀合物。
Aurora B激酶(AURKB)和Aurora A激酶(AURKA)是作为Aurora激酶家族成员的蛋白质,其调节有丝分裂。Aurora激酶在染色体移动和分离过程中与微管缔合。Aurora激酶B定位于动粒附近的微管,特别是被称为K-纤维的特化微管,而Aurora激酶A定位于中心体。AURKB和AURKA在多种人类肿瘤中过表达。AURKB和AURKA的过表达诱导异常的细胞分裂,从而导致细胞中的中心体扩增和多核化。AURKB和AURKA抑制通过不同的机制诱导癌细胞凋亡。AURKA抑制诱导有丝分裂纺锤体装配中的缺陷,从而导致短暂的纺锤体检查点依赖性有丝分裂停滞。该细胞周期停滞不被维持,随后,通过诱导G1停滞及随后凋亡,或者通过p53非依赖性机制,AURKA抑制的细胞从有丝分裂中退出,从而导致凋亡。相反,对AURKB的抑制也干扰有丝分裂过程中的正常染色体排列,并超过有丝分裂纺锤体检查点,从而导致多倍性、胞质分裂失败和核内再复制,随后是细胞死亡。相应地,本公开的一个实施方案提供了靶向AURKB的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向AURKB。在一些实施方案中,该siRNA能够与编码AURKB的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低AURKB的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向AURKB的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向AURKA的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向AURKA。在一些实施方案中,该siRNA能够与编码AURKA的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低AURKA的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向AURKA的抗体-siRNA缀合物。
肿瘤组织与远端组织中的内皮细胞之间的细胞-细胞相互作用促进了癌症转移。两个主要的细胞粘附分子家族——选择蛋白和整联蛋白——参与转移。在血管内,循环肿瘤细胞最终与内皮相互作用,从而导致肿瘤细胞停滞和外渗。在白细胞募集到肿瘤微环境的过程中,免疫细胞首先经历“滚动(rolling)”,这由内皮P/E选择蛋白、外周淋巴结地址素(PNAd)和粘膜血管地址素细胞粘附分子1(MADCAM-1)以及白细胞L-选择蛋白、PSGL-1和E-选择蛋白配体之间的相互作用启动。除非发生牢固的粘附,否则该步骤是可逆的。牢固的粘附是通过内皮细胞间细胞粘附分子1/2(ICAM-1/2)、血管细胞粘附分子(VCAM-1)、MADCAM-1与白细胞α4β7整联蛋白、α4β1整联蛋白(VLA4)和αLβ2整联蛋白(LFA-1)的相互作用介导的。αMβ2整联蛋白(Mac-1)触发顶白细胞变平并沿内皮行进。变移是最后的步骤,其由与白细胞PECAM-1、LFA-1、VLA-4和Mac-1相互作用的内皮血小板内皮细胞粘附分子1(PECAM-1)和连接粘附分子A/B/C(JAM-A/B/C)调节。在炎症和/或白细胞向肿瘤微环境募集期间,肿瘤细胞-内皮接触形成与这些白细胞-内皮细胞相互作用平行发生。尽管肿瘤细胞粘附的机制肯定不同于白细胞向炎症部位的募集,但参与肿瘤细胞与内皮接触形成的细胞粘附分子是相同的。
选择蛋白和整联蛋白在诸如结肠癌、肺癌和黑素瘤等各种癌症类型的癌症进展中具有重要作用。选择蛋白介导的肿瘤细胞停滞和粘附有助于转移,而整联蛋白介导的肿瘤细胞与周围环境的相互作用进一步促进癌症进展。选择蛋白是参与血液循环内白细胞和血小板与内皮的粘附相互作用的血管细胞粘附分子。选择蛋白家族有三个成员:P-、E-和L-选择蛋白。P-选择蛋白存在于血小板(α-颗粒)和内皮细胞(Weibel-Palade体)的储存颗粒中,因此在激活后能够迅速转移到细胞表面上。相反,E-选择蛋白的内皮表达需要从头转录,从而在刺激后数小时导致在活化的内皮细胞表面上表达。L-选择蛋白在几乎所有白细胞亚群的细胞表面上组成型表达。L-选择蛋白介导白细胞在内皮上的快速滚动,P-和E-选择蛋白支持以较低速度滚动。选择蛋白与其碳水化合物配体的快速且可逆相互作用支持白细胞在内皮上的约束和滚动的初始步骤。
P-、L-或E-选择蛋白介导与血管结构内的肿瘤细胞的接触。例如,通过P-选择蛋白的表达形成血小板-肿瘤细胞血栓有助于逃避宿主反应,从而促进转移。此外,在某些组织如肝脏的转移定殖期间检测到E-选择蛋白表达。对E-选择蛋白表达的抑制导致转移的减弱。相应地,本公开的一个实施方案提供了靶向P-选择蛋白的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码P-选择蛋白的多核苷酸特异性杂交。在一些实施方案中,该siRNA靶向P-选择蛋白。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低P-选择蛋白的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向P-选择蛋白的抗体-siRNA缀合物。本公开的又一个实施方案提供了靶向E-选择蛋白的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向E-选择蛋白。在一些实施方案中,该siRNA能够与编码E-选择蛋白的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低E-选择蛋白的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向E-选择蛋白的抗体-siRNA缀合物。
除选择蛋白外,细胞粘附分子和整联蛋白在癌症转移中也起作用。血管整联蛋白与肿瘤微环境中ECM组分的结合有助于内皮细胞的侵袭和迁移。例如,在某些癌症如黑素瘤中,肿瘤细胞粘附和内皮变移需要血管内皮细胞粘附分子1(VCAM-1)与内皮上的整联蛋白α4β1(VLA-4)结合。β1整联蛋白的沉默,因而VLA-4和VCAM-1结合的丧失,强烈减少转移。相应地,本公开的一个实施方案提供了靶向VCAM-1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向VCAM-1。在一些实施方案中,该siRNA能够与编码VCAM-1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低VCAM-1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向VCAM-1的抗体-siRNA缀合物。此外,粘膜血管地址素细胞粘附分子1(MADCAM1),也称为地址素,是整联蛋白α4β7的配体并参与癌症转移。相应地,本公开的一个实施方案提供了靶向MADCAM1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向MADCAM1。在一些实施方案中,该siRNA能够与编码MADCAM1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低MADCAM1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向MADCAM1的抗体-siRNA缀合物。
本公开的一个实施方案提供了靶向ICAM-1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向ICAM-1。在一些实施方案中,该siRNA能够与编码ICAM-1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低ICAM-1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向ICAM-1的抗体-siRNA缀合物。本公开的又一个实施方案提供了靶向ICAM-2的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向ICAM-2。在一些实施方案中,该siRNA能够与编码ICAM-2的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低ICAM-2的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向ICAM-2的抗体-siRNA缀合物。
本公开的一个实施方案提供了靶向PNAd的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PNAd。在一些实施方案中,该siRNA能够与编码PNAd的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PNAd的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PNAd的抗体-siRNA缀合物。本公开的又一个实施方案提供了靶向PECAM-1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向PECAM-1。在一些实施方案中,该siRNA能够与编码PECAM-1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低PECAM-1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向PECAM-1的抗体-siRNA缀合物。
本公开的另一个实施方案提供了靶向JAM-A的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向JAM-A。在一些实施方案中,该siRNA能够与编码JAM-A的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低JAM-A的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向JAM-A的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向JAM-B的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向JAM-B。在一些实施方案中,该siRNA能够与编码JAM-B的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低JAM-B的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向JAM-B的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向JAM-C的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向JAM-C。在一些实施方案中,该siRNA能够与编码JAM-C的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低JAM-C的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向JAM-C的抗体-siRNA缀合物。
癌胚抗原相关细胞粘附分子1(胆汁糖蛋白)(CEACAM1),也称为CD66a(分化簇66a),是一种人类糖蛋白,是癌胚抗原(CEA)细胞粘附分子家族的成员。CEACAM1在癌细胞中表达,并且还促进癌症转移。相应地,本公开的一个实施方案提供了靶向CEACAM1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CEACAM1。在一些实施方案中,该siRNA能够与编码CEACAM1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CEACAM1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CEACAM1的抗体-siRNA缀合物。
共抑制受体,如CTLA-4、PD-1、Lag-3、Tim-3和TIGIT,在T细胞上表达。这些受体控制效应T细胞应答的适当收缩,并保证Treg细胞的适当功能。这些受体的靶向改善了对癌细胞的抗肿瘤T细胞应答。淋巴细胞活化基因-3(Lag-3)在活化的CD4+和CD8+T细胞以及部分自然杀伤(NK)细胞上上调。LSECtin是Lag-3的配体。肝和淋巴结窦内皮细胞C型凝集素(LSECtin)是细胞表面的C型凝集素,其显示细胞粘附功能并有助于癌症转移的不同步骤。相应地,本公开的一个实施方案提供了靶向LSECtin的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向LSECtin。在一些实施方案中,该siRNA能够与编码LSECtin的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低LSECtin的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向LSECtin的抗体-siRNA缀合物。
除了Lag-3外,Tim-3和TIGIT也在活化的CD4+和CD8+T细胞上瞬时上调。T细胞免疫球蛋白-3(Tim-3)在外周血单核细胞、巨噬细胞、T细胞和自然杀伤(NK)细胞上表达。Tim-3是一种抑制性受体,其对于抑制T细胞对肿瘤的应答至关重要。Tim-3也在内皮细胞上表达并促进转移。Tim-3配体,包括半乳凝素-9、高速泳动族盒1蛋白(HMGB1)和CEACAM1,在肿瘤细胞中上调。Tim-3和半乳凝素-9、HMGB1和CEACAM1途径被认为是T细胞介导的免疫应答的负调节物。换言之,肿瘤细胞中免疫抑制性Tim-3配体的上调导致肿瘤细胞逃避免疫监视,并使得肿瘤进展。相应地,本公开的一个实施方案提供了靶向半乳凝素-9的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向半乳凝素-9。在一些实施方案中,该siRNA能够与编码半乳凝素-9的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低半乳凝素-9的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制Tim-3-半乳凝素-9途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向半乳凝素-9的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向HMGB1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向HMGB1。在一些实施方案中,该siRNA能够与编码HMGB1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低HMGB1的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制Tim-3-HMGB1途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向HMGB1的抗体-siRNA缀合物。
具有Ig和基于酪氨酸的免疫受体抑制基序结构域的T细胞免疫受体(TIGIT)在大约三分之一的CD4+FoxP3+Treg细胞和NK细胞上表达,并在组织炎症部位的Treg细胞上高度上调。与Tim-3类似,TIGIT在产生癌症免疫的许多步骤中也发挥作用。TIGIT配体,包括CD155和CD112,在肿瘤细胞中过表达。单独抑制TIGIT配体(包括CD155和CD112),或将其与其他抑制性受体的抑制相组合,可以抑制肿瘤进展和/或转移。相应地,本公开的一个实施方案提供了靶向CD155的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CD155。在一些实施方案中,该siRNA能够与编码CD155的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CD155的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制TIGIT-CD155途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CD155的抗体-siRNA缀合物。本公开的另一个实施方案提供了靶向CD112的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向CD112。在一些实施方案中,该siRNA能够与编码CD112的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低CD112的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制TIGIT-CD112途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向CD112的抗体-siRNA缀合物。
与PD-1、Tim-3、TIGIT和Lag-3类似,B7H3也负调节T细胞功能,尽管是通过独特的分子机制。B7-H3是一种免疫检查点分子,其在多种实体癌中过表达,并且通常与患者预后不良和阴性临床结果相关。相应地,本公开的一个实施方案提供了靶向B7-H3的抗体-siRNA缀合物。在一些实施方案中,该siRNA能够与编码B7-H3的多核苷酸特异性杂交。在一些实施方案中,该siRNA靶向B7-H3。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低B7-H3的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制B7-H3途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向B7-H3的抗体-siRNA缀合物。
与PD-1、Tim-3、TIGIT、Lag-3和B7H3类似,吲哚胺2,3-双加氧酶-1(IDO)是参与产生支持肿瘤生长的免疫抑制性肿瘤微环境的检查点蛋白质。IDO在肿瘤细胞和肿瘤微环境周围的细胞中过表达。IDO通过抑制免疫系统的效应T细胞发挥其免疫调节作用。升高的IDO蛋白水平然后驱动介导免疫系统破坏病原体和肿瘤细胞的能力的效应T细胞的生长停滞和凋亡。通过减少效应T细胞的数目,IDO过表达阻止免疫系统有效破坏癌细胞。相应地,本公开的一个实施方案提供了靶向IDO的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向IDO。在一些实施方案中,该siRNA能够与编码IDO的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低IDO的表达。在一些实施方案中,该siRNA沉默、灭活、下调或抑制IDO途径。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向IDO的抗体-siRNA缀合物。
半乳凝素是与丰富且广泛分布于整个身体中的β-半乳糖苷糖特异性结合的一类蛋白质。半乳凝素-3、半乳凝素-1和半乳凝素-9与癌症相关。例如,半乳凝素-3在肿瘤发生中起作用,包括转化为恶性形式、转移和侵袭性增加。相应地,本公开的一个实施方案提供了靶向半乳凝素-3的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向半乳凝素-3。在一些实施方案中,该siRNA能够与编码半乳凝素-3的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低半乳凝素-3的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向半乳凝素-3的抗体-siRNA缀合物。此外,半乳凝素-1在癌症进展中过表达。半乳凝集素-1参与多种过程,如细胞粘附、移动和侵袭,肿瘤诱导的血管生成,以及凋亡。于是,本公开的一个实施方案提供了靶向半乳凝素-1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向半乳凝素-1。在一些实施方案中,该siRNA能够与编码半乳凝素-1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低半乳凝素-1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向半乳凝素-1的抗体-siRNA缀合物。
锌指蛋白SNAI1,也称为Snail,是作为转录因子家族的一部分的人类转录因子,其促进粘附分子E-钙粘着蛋白的抑制。SNAI1在浸润性肿瘤的上皮和内皮细胞中过表达。SNAI1的表达与转移、肿瘤复发和预后不良相关。相应地,本公开的一个实施方案提供了靶向SNAI1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向SNAI1。在一些实施方案中,该siRNA能够与编码SNAKI1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低SNAI1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向SNAI1的抗体-siRNA缀合物。
锌指E-盒结合同源盒1(ZEB1)是一种人类蛋白质,其有助于癌症侵袭性和转移发展。ZEB1充当上皮向间质转化(EMT)和癌症进展的驱动物,这是由于其在下调上皮基因如E-钙粘着蛋白和miR-200家族微小RNA中的关键作用。相应地,本公开的一个实施方案提供了靶向ZEB1的抗体-siRNA缀合物。在一些实施方案中,该siRNA靶向ZEB1。在一些实施方案中,该siRNA能够与编码ZEB1的多核苷酸特异性杂交。在一些实施方案中,该siRNA沉默、灭活、下调、抑制或降低ZEB1的表达。在一些实施方案中,治疗有需要的受试者中的癌症的方法包括施用靶向ZEB1的抗体-siRNA缀合物。
本公开的一个实施方案提供了一种缀合物,其包含抗体或其抗原结合片段和miRNA。微小RNA(miRNA)是在各种真核生物物种中高度保守的内源性小非编码RNA。MiRNA通过以序列特异性方式主要靶向3'非翻译区(UTR),从而抑制众多蛋白质编码转录物的细胞翻译和稳定性。miRNA对基因表达的这种选择性沉默有望对人类健康和疾病产生深远的影响。在人类中已知超过2500种miRNA。(参见,例如,miRBase:使用深度测序数据注释高置信度微小RNA。)miRNA基因主要被RNA聚合酶II转录为初级miRNA(pri-miRNA),后者被微处理器复合物(由Drosha和DGCR8(DiGeorge综合征关键区域8)组成)在细胞核中加工成前体miRNA(pre-mi RNA)。随后,通过核输出蛋白-5-Ran-GTP复合物将pre-miRNA输出到细胞质中,在细胞质中,切酶1切割pre-miRNA的发夹环,而TARBP2(TAR RNA结合蛋白2)则有助于将RNA双链体加载到Argonaute蛋白AG02上。反义链(成熟)被AGO2保留,有义链被降解,从而构成沉默复合物。非规范miRNA的生物发生也在进一步的研究中报道。(参见,例如,Regulation of microRNA biogenesis,Ha M,Kim VN Nat Rev Mol Cell Biol.2014年8月;15(8):509-24)。
可以转录编码miRNA的基因,从而产生称为pre-miRNA的miRNA前体。pre-miRNA可以是包含多个pre-miRNA的多顺反子RNA的一部分。pre-miRNA可形成具有茎和环的发夹。pre-miRNA的发夹结构可以被Drosha识别,Drosha是RNA酶III内切核酸酶。Drosha可以识别pre-miRNA中的末端环,并向茎中切割大约两个螺旋圈,以产生60-70nt的前体,被称为pre-miRNA。Drosha可以用RNA酶III内切核酸酶典型的交错切口切割pri-miRNA,产生具有5'磷酸和约2个核苷酸的3'突出端的pre-miRNA茎环。延伸超过Drosha切割位点的茎的大约一个螺旋圈(约10个核苷酸)对于有效加工可能是必不可少的。然后,pre-miRNA可以通过Ran-GTP和输出受体Ex-portin-5从细胞核主动转运到细胞质。Pre-miRNA可被切酶识别,后者也是RNA酶III内切核酸酶。切酶可识别pre-miRNA的双链茎。切酶还可以识别茎环基部的5'磷酸和3'突出端。切酶可以从茎环基部从末端环切下两个螺旋圈,从而留下额外的5'磷酸和约2个核苷酸的3'突出端。可能包含错配的所得siRNA样双链体包含成熟的miRNA和类似大小的片段,被称为miRNA*。miRNA和miRNA*可以衍生自pre-miRNA的相对臂和pre-miRNA。MiRNA*序列可以在克隆的miRNA的文库中发现,但频率通常低于miRNA。尽管miRNA*最初以双链形式存在,但miRNA最终可能以单链RNA的形式并入被称为RNA诱导的沉默复合物(RISC)的核糖核蛋白复合物中。各种蛋白质可以形成RISC,这可导致对miRNA/miRNA*双链体的特异性、靶基因结合位点、miRNA活性(阻抑或激活)以及miRNA/miRNA*双链体的哪条链被加载到RISC中的可变性。当将miRNA:miRNA*双链体的miRNA链加载到RISC中时,miRNA*可被去除并降解。加载到RISC中的miRNA:miRNA*双链体的链可以是其5'末端较不紧密配对的链。如果miRNA:miRNA*的两端具有大致相等的5'配对,则miRNA和miRNA*都可具有基因沉默活性。
RISC可以根据miRNA和mRNA之间的高水平互补性(尤其是通过miRNA的2-8位核苷酸)来鉴别靶核酸。多项研究已着眼于miRNA与其mRNA靶标之间的碱基配对要求,以实现有效的翻译抑制。在哺乳动物细胞中,miRNA的前8个核苷酸可能至关重要。但是,微小RNA的其他部分也可能参与mRNA结合。而且,在3’的足够的碱基配对可以补偿在5'的不足配对。分析整个基因组上的miRNA结合的计算研究提示了miRNA的5’的碱基2-7在靶标结合中的具体作用,但是也认识到通常被发现为“A”的第一个核苷酸的作用。mRNA中的靶位点可能在5’UTR、3’UTR或在编码区域中。令人感兴趣的是,多个mRNA可以通过识别相同或多个位点来调节相同的mRNA靶标。在大多数遗传鉴定的靶标中存在多个miRNA结合位点可能表明多个RISC的协同作用提供了最有效的翻译抑制。
MiRNA可以通过两种机制之一指导RISC下调基因表达:mRNA切割或翻译抑制。如果mRNA与miRNA具有一定程度的互补性,则miRNA可以指定mRNA的切割。当miRNA指导切割时,切口可能位于与miRNA的残基10和11配对的核苷酸之间。或者,如果miRNA不具有必要程度的与miRNA的互补性,则miRNA可以抑制翻译。翻译抑制在动物中可能更为普遍,因为动物在miRNA与结合位点之间的互补性程度可能较低。
应当指出,任何一对miRNA和miRNA*的5'和3'端可能存在可变性。该可变性可能是由于Drosha和切酶的酶促加工相对于切割位点的可变性。miRNA和miRNA*的5'和3'端的可变性也可能是由于pri-miRNA和pre-miRNA的茎结构中的错配。茎链的错配可能导致大量不同的发夹结构。茎结构的可变性也可导致Drosha和切酶切割产物的可变性。
在一些实施方案中,miRNA序列包含13-33、18-24或21-23个核苷酸。在一些实施方案中,miRNA包含5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个核苷酸。在一些实施方案中,成熟miRNA的序列包含pre-miRNA的13-33个核苷酸。在一些实施方案中,miRNA的序列包含pre-miRNA的最后13-33个核苷酸。
在一些实施方案中,所述RNA分子是抗miRNA,其能够例如通过与pri-miRNA、pre-miRNA、miRNA或miRNA*结合(例如,反义或RNA沉默)或通过与靶标结合位点结合来阻断miRNA或miRNA*的活性。抗miRNA可包含总共5-100或10-60个核苷酸。抗miRNA也可包含总共至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个核苷酸。抗miRNA的序列可包含(a)与miRNA的5'基本互补的至少5个核苷酸和与miRNA的5'端的靶位点的侧翼区基本相同的至少5-12个核苷酸,目的是与miRNA结合并抑制其活性;或(b)与miRNA的3'基本相同的至少5-12个核苷酸和与miRNA的3'端的靶位点的侧翼区基本互补的至少5个核苷酸,目的是抑制miRNA与靶标结合的能力。
所述核酸还可包含靶miRNA结合位点或其变体的序列。靶位点序列可包含总共5-100或10-60个核苷酸。靶位点序列还可包含总共至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62或63个核苷酸。在本公开的一些实施方案中,与癌症有关并且与抗TM4SF1抗体或其抗原结合片段缀合的示例性miRNA与其靶标一起在以下表1中列出。
在本公开的一些实施方案中,提供了包含抗体或其抗原结合片段和mRNA的缀合物。体外转录(IVT)mRNA最近作为潜在的传递遗传信息的新药类别已成为关注的焦点。可以通过结构上类似于天然mRNA的方式将此类合成的mRNA工程改造为瞬时表达蛋白质。基于mRNA的癌症免疫疗法和传染病疫苗已经进入临床开发。新出现的新方法包括体内传递IVTmRNA以替换或补充蛋白质,基于IVT mRNA的多能干细胞生成以及使用IVT mRNA编码的设计者核酸酶进行基因组工程。在一些实施方案中,包含mRNA的缀合物用于治疗或接种,如疫苗接种,在一些实施方案中用于治疗或预防(防止)癌症疾病。在一些实例中,疫苗接种是基于将编码抗原的mRNA形式的肿瘤抗原(或数种抗原)引入生物体中。在一些实施方案中,缀合物的mRNA被翻译成(肿瘤)抗原,表达出由修饰的mRNA编码的多肽或抗原性肽,其结果是刺激了针对该多肽或抗原性多肽的免疫应答。在一些实施方案中,在缀合物内使用mRNA引发编码这类癌症抗原的免疫应答。通过这种方式,癌症抗原在生物体中表达,其结果是激发了有效针对癌细胞的免疫应答。肿瘤抗原的非限制性实例尤其是707-AP、AFP、ART-4、BAGE、β-catenine/m、Bcr-abl、CAMEL、CAP-1、CASP-8、CDC27/m、CDK4/m、CEA、CT、Cyp-B、DAM、ELF2M、ETV6-AML1、G250、GAGE、GnT-V、Gp100、HAGE、HER-2/neu、HLA-A*0201-R170I、HPV-E7、HSP70-2M、HAST-2、hTERT(或hTRT)、iCE、KIAA0205、LAGE、LDLR/FUT、MAGE、MART-1/melan-A、MC1R、myosine/m、MUC1、MUM-1、-2、-3、NA88-A、NY-ESO-1、p190minor bcr-abl、Pml/RARα、PRAME、PSA、PSM、RAGE、RU1or RU2、SAGE、SART-1or SART-3、TEL/AML1、TPI/m、TRP-1、TRP-2、TRP-2/INT2和WT1。
在一些实施方案中,所述缀合物靶向示例性途径。在一些实施方案中,包含mRNA的缀合物是个性化的癌症疫苗。在一些实施方案中,缀合物的mRNA被翻译成至少一种患者特定的新抗原。在一些实施方案中,至少一种患者特定的新抗原存在于患者的特定肿瘤中。在一些实施方案中,通过分析肿瘤外显子组来鉴定至少一种患者特定的新抗原。在一些实施方案中,患者特定的新抗原激活患者的免疫系统,以便更好地靶向并消除肿瘤细胞。
在一些实施方案中,包含mRNA的缀合物是激活、加强和/或增强免疫系统的癌症疫苗。在一些实施方案中,包含mRNA的缀合物是增强T细胞的功能和/或存活的癌症疫苗。在一些实施方案中,包含mRNA的缀合物是增加体内T细胞数的癌症疫苗。在一些实施方案中,缀合物的mRNA被翻译成OX40配体(OX40L)。OX40L促进T细胞分裂和存活。在一些实施方案中,缀合物的RNA被翻译成IL-12。TL-12是由树突细胞、巨噬细胞和嗜中性粒细胞响应于抗原刺激而产生的细胞因子。IL-12是T细胞刺激因子,其刺激T细胞的生长和功能。IL-12还参与幼稚T细胞分化为Th1细胞。其他共刺激分子包括但不限于CD28、CD54、CD58、CD80、CD86、CD25、CD83和p55。在一些实施方案中,缀合物的mRNA被翻译成CD28。在一些实施方案中,缀合物的mRNA被翻译成CD58。在一些实施方案中,缀合物的mRNA被翻译成CD54。在一些实施方案中,缀合物的mRNA被翻译成CD80。在一些实施方案中,缀合物的mRNA被翻译成CD86。在一些实施方案中,缀合物的mRNA被翻译成CD25。在一些实施方案中,缀合物的mRNA被翻译成CD83。在一些实施方案中,缀合物的mRNA被翻译成p55。
在一些实施方案中,包含mRNA的缀合物用于细胞疗法或与细胞疗法联合使用。在一些实施方案中,包含mRNA的缀合物用于患者来源的免疫细胞,例如但不限于树突细胞的体外转染。在一些实施方案中,将经操作的患者来源的细胞回输给患者。在一些实施方案中,mRNA翻译成肿瘤相关抗原,并由患者来源的免疫细胞(例如,患者来源的树突细胞)表达。在一些实施方案中,将包含mRNA的缀合物施用于患者来源的细胞导致TAA衍生的肽呈现在患者来源的树突细胞上。在一些实施方案中,一旦将经操作的患者来源的细胞回输给患者,则将包含mRNA的缀合物施用于患者来源的细胞导致抗原特异性T细胞在体内的活化。在一些实施方案中,患者来源的免疫细胞是T细胞。在一些实施方案中,包含mRNA的缀合物在患者来源的T细胞的体外转染中使用。在一些实施方案中,在用包含mRNA的缀合物治疗后,患者来源的T细胞能够直接识别在肿瘤上表达的特异性抗原。在一些实施方案中,mRNA翻译成在患者来源的T细胞上的嵌合抗原受体(CAR)。在一些实施方案中,包含mRNA的缀合物与CAR-T细胞联合使用。
在一些情况下,本文提供的抗体-寡核苷酸缀合物(如抗体-RNA缀合物、抗体-DNA缀合物、抗体-反义寡核苷酸缀合物)能够实现至少约40%至约100%,例如至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或至少约100%的敲减率。
III.包含靶向蛋白和寡核苷酸的缀合物
在一些实施方案中,本公开提供了包含本文所述的反义寡核苷酸和抗TM4SF1抗体的缀合物。本文描述了在本公开的背景中有用的反义寡核苷酸的各种特征。应当注意,当描述反义寡核苷酸的功能性质时,如本文所述,这类性质也可以用来描述包含反义寡核苷酸和抗TM4SF1抗体的缀合物。因此,在某些实施方案中,对反义寡核苷酸的功能或结构性质的任何描述可用来描述本公开的反义缀合物,其包含本文所述的反义寡核苷酸和抗TM4SF1抗体。
在一些实例中,合适的反义寡核苷酸,包括包含反义寡核苷酸的缀合物,与DNA杂交。在一些实例中,合适的反义寡核苷酸,包括包含反义寡核苷酸的缀合物,与RNA杂交。在某些实施方案中,反义寡核苷酸(包括当作为缀合物的一部分存在时)与RNA转录物的3'UTR杂交,例如与3'UTR中的一个或多个CUG重复序列杂交。在某些实施方案中,反义寡核苷酸(包括当作为缀合物的一部分存在时)与转录物的编码序列杂交。在一些实施方案中,反义寡核苷酸选择性地结合转录物,例如转录物的3'UTR。在一些实施方案中,反义寡核苷酸选择性地结合具有扩展的CUG重复(>50个CUG重复)的转录物。
不受理论的束缚,反义分子(例如,反义寡核苷酸)与RNA分子(例如,CUG扩展的RNA分子)的特异性杂交可以改变RNA的加工或改变RNA与另一种蛋白质或核酸分子之间的物理和/或化学相互作用。例如,本公开的反义分子与CUG扩展的RNA的特异性杂交可改变RNA的降解,包括通过RNA酶H介导的降解,RNA的剪接模式,或者可防止蛋白质或核酸与RNA结合,或者可以释放与CUG扩展的RNA结合的核酸或蛋白质。
在一些实施方案中,反义分子靶向包括起始密码子(RNA中的AUG和DNA中的ATG)或终止密码子(RNA中的UAA、UAG和UGA以及DNA中的TAA、TAG和TGA)的区域。在一些实施方案中,反义分子靶向起始或终止密码子的50个核苷酸内的区域。在一些实施方案中,反义分子靶向包括DNA或RNA分子的开放阅读框(ORF)的一部分的区域,包括CUG扩展的DNA或RNA的ORF。该ORF包括起始密码子和终止密码子之间的RNA区域。在一些实施方案中,反义分子与DNA或RNA的编码区(即外显子)和/或DNA或RNA的非编码区(即内含子)结合。在一些实施方案中,反义分子结合剪接信号,如内含子-外显子连接。在前述任一项的某些实施方案中,反义寡核苷酸与野生型和/或CUG扩展的RNA杂交。
在一些实施方案中,反义分子靶向包括5'UTR或3'UTR的RNA区域。5'UTR包括未翻译的序列,可以包括例如调节序列(例如铁应答元件序列、内含子或核糖开关)、5'甲基鸟苷酸帽或其组合。3'UTR可包括诸如聚腺苷酸化信号、蛋白质的结合序列(例如SECIS元件或富含AU的元件)或miRNA的结合序列等序列。
在一些实施方案中,所述反义分子与RNA如CUG扩展的RNA杂交,使得反义分子阻止RNA与另一种蛋白质的结合。例如,反义分子可以与RNA杂交,使得该RNA不能与蛋白质结合。例如,反义分子可以与蛋白质竞争RNA分子上的相同结合位点,例如“YGCY”基序,其中“Y”是嘧啶(Goers,E S,2010,Nucl.Acids Res.,38(7):2467-84)。
在某些实施方案中,所述反义分子与携带过量(>50)的CUG或CCUG重复序列的RNA分子杂交。例如,反义分子可以与具有过量CUG或CCUG重复序列的CUG扩展的(例如,突变)RNA结合。在一些实施方案中,反义分子与CUG重复、CAG重复、CCUG、CCG或CGG重复中的一个或多个杂交。
本公开的反义寡核苷酸经由互补核苷或核苷酸碱基的一个或多个区域与RNA或DNA杂交。“互补”是两个核苷酸之间,例如腺嘌呤与胸腺嘧啶之间、腺嘌呤与尿嘧啶之间以及鸟嘌呤与胞嘧啶之间特异性配对的能力。然而,反义寡核苷酸不需要与其靶核酸的寡核苷酸100%互补才能与该靶DNA或RNA分子杂交。当反义化合物以干扰靶DNA分子的转录的程度与靶DNA分子结合时,它能够与靶DNA分子杂交。当反义化合物以改变RNA分子在细胞中的先前存在状态的程度与RNA分子结合时,它能够与靶RNA分子,例如突变RNA杂交。例如,当反义化合物与RNA分子以一定程度结合,使其引起RNA分子被诸如RNA酶H的酶降解,或改变(即诱导或抑制)RNA分子的剪接,或以防止蛋白质或核酸与RNA分子结合的方式与RNA分子相互作用,或以释放先前与RNA分子结合的蛋白质的方式与RNA分子相互作用时,该反义化合物能够与靶RNA分子,例如突变RNA杂交。
在一些实施方案中,反义分子(例如,反义缀合物的反义寡核苷酸部分)的长度为8-50个核苷酸。在其他实施方案中,反义分子的长度为12-35个核苷酸。在其他实施方案中,反义分子的长度为12-30个核苷酸。在其他实施方案中,反义分子的长度为14-25个核苷酸。在其他实施方案中,反义寡核苷酸包含14-30、14-25、14-20、14-18、14-17、15-30、15-25、15-20、15-18、16-30、16-25、16-20、16-18、17-30、17-25、17-20或17-18个核苷酸。在其他实施方案中,反义寡核苷酸包含14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39个核苷酸或由这些数目的核苷酸组成。在一些实施方案中,反义寡核苷酸包含在65℃下至少约0.2×SSC的严格杂交条件下与RNA转录物(编码或非编码区)杂交的核苷酸序列。
在一些实施方案中,本公开的反义寡核苷酸是核糖核酸(RNA)或脱氧核糖核酸(DNA)的寡聚物或聚合物或它们的模拟物,或任何前述的组合。反义寡核苷酸可包括由天然存在的核碱基、糖和共价核苷间(骨架)连接组成的寡核苷酸,以及具有非天然存在的核碱基、糖和共价核苷间(骨架)连接的寡核苷酸。在一些情况下使用反义分子的非天然存在的部分,因为这些部分可以赋予反义分子所需的性质,例如,增强的对核酸靶标的亲和力和提高的在核酸酶存在下的稳定性。
在一些情况下,本公开的核酸/反义寡核苷酸,修饰的核酸/修饰的反义寡核苷酸包含核苷或核苷酸。核苷是例如碱基-糖组合。在一些情况下,核苷的碱基部分是杂环碱基,例如嘌呤或嘧啶碱基。核苷酸是进一步包含与核苷的糖部分共价连接的磷酸基团的核苷。对于包含呋喃戊糖基糖的那些核苷,磷酸基团可以与该糖的2’、3’或5’羟基部分连接。在形成寡核苷酸时,磷酸基团将相邻的核苷彼此共价连接,以形成直链聚合化合物。进而,该直链聚合结构的各自末端可以进一步接合以形成环状结构。在寡核苷酸结构内,磷酸基团通常被称为形成寡核苷酸的核苷间骨架。RNA和DNA的正常连接或骨架是3'至5'磷酸二酯键。
在一些实施方案中,本公开的反义寡核苷酸包括含有修饰的骨架或非天然核苷间连接的寡核苷酸。在一些实施方案中,具有修饰的骨架的寡核苷酸包括在骨架中保留磷原子的那些寡核苷酸。在其他实施方案中,具有修饰的骨架的寡核苷酸包括在骨架中不具有磷原子的那些寡核苷酸。
在一些实施方案中,在其中不包含磷原子的修饰的寡核苷酸骨架具有由短链烷基或环烷基核苷间连接、混合的杂原子和烷基或环烷基核苷间连接或者一个或多个短链杂原子或杂环核苷间连接形成的多核苷酸骨架。这些包括具有以下部分的那些:吗啉代键(部分由核苷的糖部分形成);硅氧烷骨架;硫化物、亚砜和砜骨架;甲酰基和硫代甲酰基骨架;亚甲基甲酰基和硫代甲酰基骨架;核糖乙酰基骨架;含烯烃骨架;氨基磺酸骨架;亚甲基亚氨基和亚甲基肼基骨架;磺酸和磺酰胺骨架;酰胺骨架;以及具有混合的N、O、S和CH2组分部分的其他那些。
在本公开的一些实施方案中,核酸的寡核苷酸骨架,如反义寡核苷酸、RNA、DNA等的寡核苷酸骨架,例如包括硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯(包括3’-亚烷基膦酸酯、5’-亚烷基膦酸酯和手性膦酸酯)、次膦酸酯、氨基磷酸酯(包括3’-氨基氨基磷酸酯和氨基烷基氨基磷酸酯)、硫代氨基磷酸酯、硫代烷基膦酸酯、硫代烷基磷酸三酯、硒磷酸酯和硼烷磷酸酯,其具有正常的3’-5’键,其2’-5’连接的类似物,以及其中一个或多个核苷酸间键是3’至3’、5’至5’或2’至2’键的具有反向极性的那些。
在一些实施方案中,在修饰的寡核苷酸中,核苷酸单元的糖和核苷间连接即骨架都被新的基团代替。维持碱基单元以与适当的核酸靶化合物杂交。一种这样的寡聚化合物——已经显示出具有优异的杂交性质的寡核苷酸模拟物,被称为肽核酸(PNA)。在PNA化合物中,寡核苷酸的糖骨架被含有酰胺的骨架,特别是氨基乙基甘氨酸骨架代替。核苷酸被保留并且与骨架的酰胺部分的氮杂氮原子直接或间接地结合。
在本公开的一些实施方案中,提供了缀合物,其包含具有硫代磷酸酯骨架的寡核苷酸和具有杂原子骨架的寡核苷酸,如-CH2-NH-O-CH2-、-CH2-N(CH3)-O-CH2-[称为亚甲基(甲基亚氨基)或MMI骨架]、-CH2-O-N(CH3)-CH2-、-CH2-N(CH3)-N(CH3)-CH2-和-O-N(CH3)-CH2-CH2-[其中天然磷酸二酯骨架被表示为-O-P(=O)(OH)-O-CH2-]以及合适的酰胺骨架或吗啉代骨架结构。
修饰的寡核苷酸还可包含一个或多个取代的糖部分。在一些实施方案中,该寡核苷酸在2’位置包含以下之一:OH;F;O-、S-或N-烷基;O-、S-或N-烯基;O-、S-或N-炔基;或O-烷基-O-烷基,其中该烷基、烯基和炔基可以是取代或未取代的C1至C10烷基或C2至C10烯基和炔基。在一些实施方案中,该寡核苷酸包含O[(CH2)nO]mCH3、O(CH2)nOCH3、O(CH2)nNH2、O(CH2)nCH3、O(CH2)nONH2和O(CH2)nON((CH2)nCH3)2,其中n和m为1至约10。在其他实施方案中,寡核苷酸在2’位置包含以下之一:C1至C10低级烷基、取代的低级烷基、烯基、炔基、烷芳基、芳烷基、O-烷芳基或O-芳烷基、SH、SCH3、OCN、Cl、Br、CN、CF3、OCF3、SOCH3、SO2CH3、ONO2、NO2、N3、NH2、杂环烷基、杂环烷芳基、氨基烷基氨基、聚烷基氨基、取代的甲硅烷基、RNA切割基团、报告基团、嵌入剂、用于改善寡核苷酸的药代动力学性质的基团,或用于改善寡核苷酸的药效学性质的基团,以及具有类似性质的其他取代基。一些实施方案包括反义分子,该反义分子包含2’-二甲基氨基氧基乙氧基,即O(CH2)2ON(CH3)2基团,也称为2’-DMAOE,或2’-二甲基氨基乙氧基乙氧基(在本领域中也称为2′-O-二甲基氨基乙氧基乙基或2’-DMAEOE),即2’-O-CH2-O-CH2-N(CH2)2。
在一些实施方案中,本公开的反义寡核苷酸包括烷氧基烷氧基,例如2'-甲氧基乙氧基(2′-O-CH2CH2OCH3,也称为2′-O-(2-甲氧基乙基)或2'-MOE)(参见,例如,Martin等人,Helv.Chim.Acta,1995,78,486-504)。在一个实施方案中,本公开的反义寡核苷酸包括2'-MOE。在一些实施方案中,反义寡核苷酸包含1-10个MOE核苷酸。在其他实施方案中,反义寡核苷酸包含2-7个MOE核苷酸。在其他实施方案中,反义寡核苷酸包含3-6个MOE核苷酸。
在一些实施方案中,本公开的反义寡核苷酸包括具有受约束的呋喃糖环构象的核苷酸类似物,如锁定核酸(LNA)。在LNA中,2'-羟基与糖环的3'或4'碳原子连接,从而形成双环糖部分。在一些实施方案中,LNA中的连接是桥接2'氧原子与4'碳原子的亚甲基(-CH2-)n基团,其中n为1或2。在一些实施方案中,反义寡核苷酸包含1-10个LNA核苷酸。在其他实施方案中,反义分子包含2-7个LNA核苷酸。在其他实施方案中,反义分子包含3-6个LNA核苷酸。
在本公开的反义寡核苷酸的其他实施方案中,对反义分子的修饰包括2'-甲氧基(2′-O-CH3)、2'-氨基丙氧基(2′-OCH2CH2CH2NH2)、2'-烯丙基(2′-CH2-CH=CH2)、2′-O-烯丙基(2′-O-CH2-CH=CH2)和2'-氟(2'-F)。2’-修饰可位于阿拉伯糖(上)位置或核糖(下)位置。2’-阿拉伯糖修饰的一个实例是2’-F。还可以在寡核苷酸上的其他位置进行类似的修饰,特别是在3’末端核苷酸上或2’-5’连接的寡核苷酸中的糖的3’位置,以及5’末端核苷酸的5’位置。寡核苷酸还可以具有糖模拟物如环丁基部分以代替呋喃戊糖基糖。
本公开的反义寡核苷酸还可以包括核碱基(在本领域中通常被简称为“碱基”)修饰或取代。如本文所用的,“未修饰的”或“天然的”核碱基包括嘌呤碱基腺嘌呤(A)和鸟嘌呤(G),以及嘧啶碱基胸腺嘧啶(T)、胞嘧啶(C)和尿嘧啶(U)。修饰的核碱基包括其他合成的和天然的核碱基,如5-甲基胞嘧啶(5-me-C),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物,2-硫尿嘧啶、2-硫胸腺嘧啶和2-硫胞嘧啶,5-卤代尿嘧啶和胞嘧啶,5-丙炔基尿嘧啶和胞嘧啶以及嘧啶碱基的其他炔基衍生物,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫尿嘧啶,8-卤代、8-氨基、8-巯基、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤代特别是5-溴、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,2-F-腺嘌呤,2-氨基腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤和7-脱氮腺嘌呤,以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。其他修饰的核碱基可包括三环嘧啶,如吩噁嗪胞苷(1H-嘧啶并[5,4-b][1,4]苯并噁嗪-2(3H)-酮)、吩噻嗪胞苷(1H-嘧啶并[5,4-b][1,4]苯并噻嗪-2(3H)-酮);G夹,如取代的吩噁嗪胞苷(例如,9-(2-氨基乙氧基)-H-嘧啶并[5,4-b][1,4]苯并噁嗪-2(3H)-酮)、咔唑胞苷(2H-嘧啶并[4,5-b]吲哚-2-酮)、吡啶并吲哚胞苷(H-吡啶并[3’,2’:4,5]吡咯并[2,3-d]嘧啶-2-酮)。修饰的核碱基还可包括其中嘌呤或嘧啶碱基被其他杂环代替的那些部分,例如7-脱氮-腺嘌呤、7-脱氮鸟嘌呤、2-氨基吡啶和2-吡啶酮。在一些实例中,核碱基包括,例如,5-取代的嘧啶、6-氮杂嘧啶和N-2、N-6和O-6取代的嘌呤,包括2-氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。已显示5-甲基胞嘧啶取代将核酸双链体稳定性提高0.6-1.2℃。
在一些实施方案中,缀合DNA和ASO的方案类似于双链寡核苷酸,不同之处在于包含在序列内非3’/5’终止的核碱基。任何核碱基磷酸基团都可以用适合于用同官能或异官能连接体/间隔区官能化的缀合柄修饰。常见的稳定化作用可以是通过将磷酸基团磷酸化为硫代磷酸酯。硫醚可具有合适的功能性以安装末端缀合基团,如活化的酯、叠氮化物、炔或环加成基团。环状寡核苷酸可包括安装在环状寡核苷酸的环化点上的缀合柄。目的蛋白质的官能化和缀合可以与本文所述的其他连接体-寡核苷酸相同。
给定化合物中的所有位置不必均一地修饰,并且实际上,上述修饰中的一个以上可以并入单个化合物中,甚至在寡核苷酸内的单个核苷处。本公开还包括作为嵌合化合物的反义寡核苷酸。在本公开的上下文中,“嵌合”反义化合物或“嵌合体”是反义化合物,特别是寡核苷酸,其包含两个或更多个化学上不同的区域,每个区域由至少一个单体单元(即在寡核苷酸化合物的情况下为核苷酸)组成。这些寡核苷酸通常包含至少一个区域,其中寡核苷酸被修饰,以便赋予寡核苷酸对核酸酶降解的增加的抗性、增加的细胞摄取和/或增加的对靶核酸的结合亲和力。寡核苷酸的另外的区域可以充当能够切割RNA:DNA或RNA:RNA杂合体的酶的底物。举例来说,RNA酶H是切割RNA:DNA双链体的RNA链的细胞内切核酸酶。因此,RNA酶H的激活导致RNA靶标的切割,从而大大增强基因表达的寡核苷酸抑制的效率。因此,相比于与相同靶区域杂交的硫代磷酸酯脱氧寡核苷酸,当使用嵌合寡核苷酸时,通常可以用较短的寡核苷酸获得相当的结果。RNA靶标的切割可通过凝胶电泳常规地检测,并且如果必要,可通过本领域已知的相关核酸杂交技术来检测。
如上所述,本公开的嵌合反义寡核苷酸可以形成为两种或更多种寡核苷酸、修饰的寡核苷酸、寡核苷和/或寡核苷酸模拟物的复合结构。这样的化合物也被称为杂合体或gapmer。
在一些情况下,“gapmer”是寡聚化合物,通常是寡核苷酸,具有侧翼为非脱氧寡核苷酸区段的2'-脱氧寡核苷酸区域。中心区域被称为“缺口”。侧翼区段被称为“翼”。尽管不希望受到理论的束缚,但gapmer的缺口呈现出当与RNA靶标结合时可被RNA酶H识别的底物,而翼则不提供这样的底物,而是可以赋予其他性质,如有助于双链体稳定性或有利的药代动力学作用。每个翼可以是一个或多个非脱氧寡核苷酸单体(如果一个翼具有零个非脱氧寡核苷酸单体,则描述为“hemimer”)。在一个实施方案中,gapmer为十个脱氧核糖核苷酸的缺口,其侧翼为五个非脱氧核糖核苷酸翼。这被称为5-10-5gapmer。在其他实施方案中,gapmer是侧翼为三个非脱氧核糖核苷酸的八个脱氧核糖核苷酸的缺口。这被称为3-8-3gapmer。在其他实施方案中,gapmer是十个脱氧核糖核苷酸的缺口,侧翼为三个非脱氧核糖核苷酸的翼。这被称为3-10-3gapmer。其他构型是本领域技术人员容易认识到的,如3-7-3gapmer。
在一些实施方案中,上述gapmer包含LNA和MOE核苷酸。在一些实施方案中,gapmer包含1-10个LNA和/或MOE核苷酸。在一些实施方案中,gapmer包含2-7个LNA和/或MOE核苷酸。在其他实施方案中,gapmer包含3-6个MOE和/或LNA核苷酸。在一些实施方案中,核糖核苷酸的侧翼嵌段包含LNA和/或MOE核苷酸。
在一些实施方案中,上述gapmer诱导靶RNA核苷酸,例如突变DMPK RNA分子的RNA酶H降解。在其他实施方案中,gapmer借助于RNA酶H非依赖性途径诱导靶RNA核苷酸,例如突变DMPK RNA分子的降解。在一些实施方案中,gapmer阻止蛋白质与DNA或RNA序列例如突变RNA的结合。在一些实施方案中,gapmer诱导靶RNA分子,例如突变RNA的降解,并且还在空间上抑制蛋白质例如与DNA或RNA序列例如突变RNA的结合。
在一些实施方案中,反义寡核苷酸是与RNA分子中扩展的CUG重复序列结合的gapmer。在一些实施方案中,gapmer与突变RNA序列中的CUG重复序列结合。在一些实施方案中,反义寡核苷酸是在空间上阻断蛋白质或核酸与靶RNA或DNA序列结合的吗啉代分子。在一些实施方案中,吗啉代还触发靶RNA或DNA序列的降解。在一些实施方案中,吗啉代分子与突变RNA结合并阻止蛋白质与RNA分子的结合。在一些实施方案中,被阻止与RNA分子结合的蛋白质可自由结合其他RNA分子底物。在一些实施方案中,吗啉代分子包含20-30个核苷酸。在其他实施方案中,吗啉代分子包含23-27个核苷酸。在其他实施方案中,吗啉代分子包含25个核苷酸。在一些实施方案中,吗啉代与RNA分子中的CUG重复序列结合。在一些实施方案中,吗啉代与突变RNA序列中的CUG重复序列结合。
在一些实施方案中,本公开的反义寡核苷酸是包含2′-O-甲基(2'-OMe)和/或硫代磷酸酯修饰的分子,并且其特异性地触发RNA分子例如突变RNA的降解。在一些实施方案中,这些分子包括2′-O-甲基(2'-OMe)和硫代磷酸酯修饰。在一些实施方案中,这些分子通过RNA酶H介导的降解或除RNA酶H降解以外的其他方式诱导靶RNA序列例如突变RNA的降解。
对于所有上述情况,应当理解,某些反义寡核苷酸在与靶标杂交后促进RNA酶H介导的降解。然而,即使对于这类反义寡核苷酸,这样的能力也不意味着或暗示这是反义寡核苷酸起作用的唯一机理。
IV.作为靶向蛋白的TM4SF1结合蛋白
在一些实施方案中,所述缀合物包含TM4SF1结合蛋白作为靶向蛋白,抗TM4SF1抗体-RNA缀合物。TM4SF1是一种具有四跨膜蛋白拓扑结构而没有同源性的小质膜糖蛋白(NCBI参考序列号NP_055035.1)(Wright等人,Protein Sci.9:1594-1600,2000)。它在质膜上形成富含TM4SF1的结构域(TMED),在该结构域中,如同真正的四跨膜蛋白一样,它充当募集功能相关膜和胞质分子的分子促进剂(Shih等人,Cancer Res.69:3272-3277,2009;Zukauskas等人,Angiogenesis.14:345-354,2011),并且在癌细胞生长(Hellstrom等人,Cancer Res.46:391 7-3923,1986)、运动性(Chang等人,Int J Cancer.116:243-252,2005)和转移(Richman等人,Cancer Res.5916s-5920s,1995)中起重要作用。人TM4SF1蛋白的氨基酸序列(NCBI参考序列号NP_055035.1)在以下显示为SEQ ID NO:91。
MCYGKCARCI GHSLVGLALL CIAANILLYF PNGETKYASE NHLSRFVWFF SGIVGGGLLMLLPAFVFIGL EQDDCCGCCG HENCGKRCAM LSSVLAALIG IAGSGYCVIV AALGLAEGPLCLDSLGQWNYTFASTEGQYLLDTSTWSECTEPKHIVE WNVSLFSILLALG GIEFILCLIQVINGVLGGIC GFCCSHQQQY DC(SEQ ID NO:91)
在一些实施方案中,本公开的抗TM4SF1抗体及其抗原结合片段对TM4SF1的ECL2结构域具有特异性。人TM4SF1ECL2结构域的氨基酸序列是EGPLCLDSLGQWNYTFASTEGQYLLDTSTWSECTEPKHIVEWNVSLFS(SEQ ID NO:92)。
如以下表2中所述,本公开中包括包含TM4SF1特异性抗体的缀合物。表2中所述的抗体是单克隆鼠抗体8G4、AGX-A03、AGX-A04、AGX-A05、AGX-A07、AGX-A08、AGX-A09和AGX-A11,其中每一种可结合TM4SF1的ECL2区。
在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含IgG重链恒定区,该IgG重链恒定区包含SEQ ID NO:87或88所示的氨基酸序列,或与SEQ ID NO:73或74至少约60%、至少约65%、至少约70%、至少约75%、至少约、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列。
在另一个实施方案中,抗TM4SF1抗体或其抗原结合片段包含轻链恒定区,该轻链恒定区包含SEQ ID NO:89所示的氨基酸序列,或与SEQ ID NO:89至少约60%、至少约65%、至少约70%、至少约75%、至少约、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%相同或100%相同的序列。
在另一个实施方案中,抗TM4SF1抗体或其抗原结合片段包含重链可变域,该重链可变域包含SEQ ID NO:3、15、27、39、51、63、75或92所示的氨基酸序列,或与SEQ ID NO:3、15、27、39、51、63、75或92至少约60%、至少约65%、至少约70%、至少约75%、至少约、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%相同或100%相同的序列。
在另一个实施方案中,抗TM4SF1抗体或其抗原结合片段包含轻链可变域,该轻链可变域包含SEQ ID NO:9、21、33、45、57、69、81或93所示的氨基酸序列,或与SEQ ID NO:9、21、33、45、57、69、81或93至少约60%、至少约65%、至少约70%、至少约75%、至少约、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%相同或100%相同的序列。
在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含重链CDR1,该重链CDR1包含与SEQ ID NO:6、18、30、42、54、66、78或94至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含重链CDR2,该重链CDR2包含与SEQ ID NO:7、19、31、43、55、67、79或95至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含重链CDR3,该重链CDR3包含与SEQ ID NO:8、20、32、44、56、68、80或96至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。
在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含轻链CDR1,该轻链CDR1包含与SEQ ID NO:12、24、36、48、60、72、84或97至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含轻链CDR2,该轻链CDR2包含与SEQ ID NO:13、25、37、49、61、73、85或98至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。在一些实施方案中,抗TM4SF1抗体或其抗原结合片段包含轻链CDR3,该轻链CDR3包含与SEQ ID NO:14、26、38、50、62、74、86或99至少约80%到至少约85%、至少约85%到至少约90%、至少约90%到至少约91%、至少约91%到至少约92%、至少约92%到至少约93%、至少约93%到至少约94%、至少约94%到至少约95%、至少约95%到至少约96%、至少约96%到至少约97%、至少约97%到至少约98%、至少约98%到至少约99%或至少约99%到100%相同的氨基酸序列。
鼠单克隆抗体AGX-A03的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:6、7和8(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:12、13和14(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:6、7和8氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:12、13和14氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A03的CDR。此外,AGX-A03的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:3和9描述。
鼠单克隆抗TM4SF1抗体AGX-A04的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQ ID No:18、19和20(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:24、25和26(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:18、19和20氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:24、25和26氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A04的CDR。此外,AGX-A04的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:15和21描述。
鼠单克隆抗体AGX-A05的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:30、31和32(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:36、37和38(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:30、31和32氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:36、37和38氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A05的CDR。此外,AGX-A05的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:27和33描述。
鼠单克隆抗体AGX-A07的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:42、43和44(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:48、49和50(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:42、43和44氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:48、49和50氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A07的CDR。此外,AGX-A07的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:39和45描述。
鼠单克隆抗体AGX-A08的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:54、55和56(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:60、61和62(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:54、55和56氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:60、61和62氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A08的CDR。此外,AGX-A08的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:51和57描述。
鼠单克隆抗体AGX-A09的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:66、67和68(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:72、73和74(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:66、67和68氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:72、73和74氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A09的CDR。此外,AGX-A09的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:63和69描述。
鼠单克隆抗体AGX-A11的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQID No:78、79和80(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:84、85和86(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:78、79和80氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:84、85和862氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含AGX-A11的CDR。此外,AGX-A11的重链可变氨基酸序列和轻链可变氨基酸序列分别以SEQ ID NO:75和81描述。
单克隆抗体8G4的氨基酸序列在表2中描述。具体来说,重链CDR序列如SEQ ID No:94、95和96(CDR1、CDR2和CDR3)所示,而轻链CDR氨基酸序列如SEQ ID No:97、98和99(CDR1、CDR2和CDR3)所示。本公开中包括包含抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含含有如SEQ ID No:94、95和96氨基酸序列所示的CDR的重链可变区,和/或含有如SEQ ID No:97、98和99氨基酸序列所示的CDR的轻链可变区。本公开中包括包含人源化抗TM4SF1抗体或抗原结合片段的缀合物,所述抗TM4SF1抗体或抗原结合片段包含8G4的CDR。
在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:3所示的核酸序列编码的重链可变域,以及由SEQ ID NO:9所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:15所示的核酸序列编码的重链可变域,以及由SEQ ID NO:21所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:27所示的核酸序列编码的重链可变域,以及由SEQ ID NO:33所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:39所示的核酸序列编码的重链可变域,以及由SEQ ID NO:45所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:51所示的核酸序列编码的重链可变域,以及由SEQ ID NO:57所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:63所示的核酸序列编码的重链可变域,以及由SEQ ID NO:69所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:75所示的核酸序列编码的重链可变域,以及由SEQ ID NO:81所示的核酸序列编码的轻链可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含由SEQ ID NO:92所示的核酸序列编码的重链可变域,以及由SEQ ID NO:93所示的核酸序列编码的轻链可变域。
在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段具有与选自SEQ ID NO:3、SEQ ID NO:15、SEQ IDNO:27、SEQ ID NO:39、SEQ ID NO:51、SEQ ID NO:63或SEQ ID NO:75的氨基酸序列至少95%相同、至少96%相同、至少97%相同、至少98%相同、至少99%相同或100%相同的重链可变域序列;并且具有与选自SEQ ID NO:9、SEQ ID NO:21、SEQ ID NO:33、SEQ ID NO:45、SEQ ID NO:57、SEQ ID NO:69或SEQ ID NO:81的氨基酸序列至少95%相同、至少96%相同、至少97%相同、至少98%相同、至少99%相同、或100%相同的轻链可变域序列。
在一个实施方案中,本公开包括一种包含抗TM4SF1抗体的缀合物,该抗TM4SF1抗体是IgG,并且包含四条多肽链,包括两条各自包含重链可变域和重链恒定区CH1、CH2和CH3的重链,以及两条各自包含轻链可变域和轻链恒定区(CL)的轻链。在某些实施方案中,该抗体是人IgG1、IgG2或IgG4。在某些实施方案中,该抗体是人IgG1。在其他实施方案中,该抗体是IgG2。重链可变域序列和轻链可变域序列可含有如表2所示的CDR。
互补决定区(CDR)被称为轻链可变域与重链可变域两者中的高变区。可变域更高度保守的部分被称为框架(FR)。给定抗体的CDR和框架区(FR)可使用由Kabat等人(同上)、Lefranc等人(同上)和/或Honegger和Pluckthun(同上)描述的系统来鉴定。本领域技术人员还熟悉Kabat等人(1991,NIH Publication 91-3242,National Technical InformationService,Springfield,Va.)描述的编号系统。就此而言,Kabat等人定义了一种针对可变域序列,包括用于鉴定CDR的编号系统,该编号系统适用于任何抗体。
一个或多个CDR可共价地或非共价地并入分子中,以使其成为抗原结合蛋白。
抗原结合蛋白可并有CDR作为较大多肽链的一部分,可使CDR共价连接至另一多肽链,或者可非共价地并有CDR。CDR允许抗原结合蛋白与特定目的抗原特异性结合。特别是,已知CDR3在抗体或抗体片段的抗原结合中起重要作用。
在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含重链,该重链包含如SEQ ID NO:8、SEQ IDNO:20、SEQ ID NO:32、SEQ ID NO:44、SEQ ID NO:56、SEQ ID NO:68、SEQ ID NO:80或SEQID NO:96中任一个所示的CDR3结构域,并且包含含有与SEQ ID NO:3、SEQ ID NO:15、SEQID NO:27、SEQ ID NO:39、SEQ ID NO:51、SEQ ID NO:63、SEQ ID NO:75或SEQ ID NO:92中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的氨基酸序列的可变域。在一个实施方案中,本公开提供了一种抗TM4SF1抗体或其抗原结合片段,该抗TM4SF1抗体或其抗原结合片段包含轻链,该轻链包含如SEQ ID NO:14、SEQ ID NO:26、SEQ ID NO:38、SEQ ID NO:50、SEQ ID NO:62、SEQ ID NO:74、SEQ ID NO:86或SEQ ID NO:99中任一个所示的CDR3结构域,并且具有包含与SEQ ID NO:9、SEQ ID NO:21、SEQ ID NO:33、SEQ ID NO:45、SEQ ID NO:57、SEQ ID NO:69、SEQ ID NO:81或SEQ IDNO:93中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的氨基酸序列的轻链可变域。因此,在某些实施方案中,CDR3结构域保持不变,而可向重链和/或轻链的其余CDR和/或框架区中引入可变性,同时该抗体或其抗原结合片段保留结合TM4SF1的能力,并且保留亲本的功能特性,例如结合亲和力。
在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含重链,该重链包含如SEQ ID NO:7、SEQ IDNO:19、SEQ ID NO:31、SEQ ID NO:43、SEQ ID NO:55、SEQ ID NO:67、SEQ ID NO:79或SEQID NO:95中任一个所示的CDR2结构域,并且包含含有与SEQ ID NO:3、SEQ ID NO:15、SEQID NO:27、SEQ ID NO:39、SEQ ID NO:51、SEQ ID NO:63、SEQ ID NO:75或SEQ ID NO:92中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%或100%相同的氨基酸序列的可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含轻链,该轻链包含如SEQ ID NO:13、SEQ ID NO:25、SEQ ID NO:37、SEQ ID NO:49、SEQ ID NO:61、SEQ ID NO:73、SEQ ID NO:85或SEQ ID NO:98中任一个所示的CDR2结构域,并且具有包含与SEQ IDNO:9、SEQ ID NO:21、SEQ ID NO:33、SEQ ID NO:45、SEQ ID NO:57、SEQ ID NO:69、SEQ IDNO:81或SEQ ID NO:93中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的氨基酸序列的轻链可变域。因此,在某些实施方案中,CDR2结构域保持不变,而可向重链和/或轻链的其余CDR和/或框架区中引入可变性,同时该抗体或其抗原结合片段保留结合TM4SF1的能力,并且保留亲本的功能特性,例如结合亲和力。
在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含重链,该重链包含如SEQ ID NO:6、SEQ IDNO:18、SEQ ID NO:30、SEQ ID NO:42、SEQ ID NO:54、SEQ ID NO:66、SEQ ID NO:78或SEQID NO:94中任一个所示的CDR1结构域,并且包含含有与SEQ ID NO:3、SEQ ID NO:15、SEQID NO:27、SEQ ID NO:39、SEQ ID NO:51、SEQ ID NO:63、SEQ ID NO:75或SEQ ID NO:92中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%或100%相同的氨基酸序列的可变域。在一个实施方案中,本公开提供了一种包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段包含轻链,该轻链包含如SEQ ID NO:12、SEQ ID NO:24、SEQ ID NO:36、SEQ ID NO:48、SEQ ID NO:60、SEQ ID NO:72、SEQ ID NO:84或SEQ ID NO:97中任一个所示的CDR1结构域,并且具有包含与SEQ IDNO:9、SEQ ID NO:21、SEQ ID NO:33、SEQ ID NO:45、SEQ ID NO:57、SEQ ID NO:69、SEQ IDNO:81或SEQ ID NO:93中任一个所示的序列至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的氨基酸序列的轻链可变域。因此,在某些实施方案中,CDR1结构域保持不变,而可向重链和/或轻链的其余CDR和/或框架区中引入可变性,同时该抗体或其抗原结合片段保留结合TM4SF1的能力,并且保留亲本的功能特性,例如结合亲和力。
还可以对表2中所述的抗TM4SF1抗体和片段进行人源化。对非人抗体进行人源化的各种方法是本领域已知的。例如,人源化抗体可具有一个或多个从非人类来源引入其中的氨基酸残基。这些非人类氨基酸残基常常被称为“输入”残基,这些残基通常取自“输入”可变域。例如,可按照Jones等人,1986,Nature 321:522-25;Riechmann等人,1988,Nature332:323-27;以及Verhoeyen等人,1988,Science 239:1534-36的方法,通过用高变区序列代替人抗体的相应序列来进行人源化。
在一些情况下,通过CDR移植来构建人源化抗体,其中将亲本非人抗体(例如啮齿动物)的六个CDR的氨基酸序列移植到人抗体框架上。例如,Padlan等人确定CDR中仅有约三分之一的残基实际上接触抗原,并且将这些残基称为“特异性决定残基”或SDR(Padlan等人,1995,FASEB J.9:133-39)。在SDR移植技术中,仅将SDR残基移植到人抗体框架上(参见,例如,Kashmiri等人,2005,Methods 36:25-34)。
选择在制备人源化抗体中使用的人轻链可变域和重链可变域对于降低抗原性而言都可能是重要的。例如,根据所谓的“最佳匹配”方法,相对于已知人类可变域序列的整个文库来筛查非人(例如啮齿动物)抗体的可变域的序列。可将与啮齿动物序列最接近的人类序列选择为人源化抗体的人框架(Sims等人,1993,J.Immunol.151:2296-308;以及Chothia等人,1987,J.Mol.Biol.196:901-17)。另一种方法使用衍生自具有特定轻链或重链子组的所有人抗体的共有序列的特定框架。相同框架可用于若干不同人源化抗体(Carter等人,1992,Proc.Natl.Acad.Sci.USA 89:4285-89;以及Presta等人,1993,J.Immunol.151:2623-32)。在一些情况下,框架衍生自最丰富的人子类——VL6子组I(VL6I)和VH子组III(VHIII)的共有序列。在另一种方法中,使用人种系基因作为框架区的来源。
通常更理想的是,使抗体在保留它们对抗原的亲和力和其他有利生物性质的情况下人源化。为了实现这个目标,根据一种方法,通过使用亲本序列和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的过程来制备人源化抗体。三维免疫球蛋白模型通常是可获得的,并且为本领域技术人员所熟悉。可获得用来说明并展示所选候选免疫球蛋白序列可能的三维构象结构的计算机程序。这些程序包括例如WAM(Whitelegg和Rees,2000,Protein Eng.13:819-24)、Modeller(Sali和Blundell,1993,J.Mol.Biol.234:779-815)和Swiss PDB Viewer(Guex和Peitsch,1997,Electrophoresis 18:2714-23)。对这些展示的检查允许分析残基在候选免疫球蛋白序列的功能发挥中可能的作用,例如分析影响候选免疫球蛋白结合其抗原的能力的残基。以这种方式,可从接受序列和输入序列选择并组合FR残基,以便实现所需抗体特性,如增加的对靶抗原的亲和力。通常,高变区残基直接并最实质性地参与影响抗原结合。
可用于人源化的人框架区包括但不限于:使用“最佳匹配”方法选择的框架区(参见例如Sims等人,J.Immunol.151(1993)2296);衍生自具有轻链可变区或重链可变区特定子组的人抗体的共有序列的框架区(参见例如Carter等人,Proc.Natl.Acad.Sci.USA,89(1992)4285;以及Presta等人,J.Immunol.,151(1993)2623);人成熟(体细胞突变的)框架区或人种系框架区(参见例如Almagro和Fransson,Front.Biosci.13(2008)1619-1633);以及通过筛查FR文库获得的框架区(参见例如Baca等人,J.Biol.Chem.272(1997)10678-10684以及Rosok等人,J.Biol.Chem.271(1996)22611-22618)。
人源化抗体及其制备方法例如综述于Almagro和Fransson,Front.Biosci.13(2008)1619-1633中,并且还描述于例如Riechmann等人,Nature332(1988)323-329;Queen等人,Proc.Nat’l Acad.Sci.USA 86(1989)10029-10033;美国专利5,821,337、7,527,791、6,982,321和7,087,409;Kashmiri等人,Methods 36(2005)25-34(描述SDR(a-CDR)移植);Padlan,Mol.Immunol.28(1991)489-498(描述“表面重塑”);Dall’Acqua等人,Methods 36(2005)43-60(描述“FR改组”);以及Osbourn等人,Methods 36(2005)61-68和Klimka等人,Br.J.Cancer,83(2000)252-260(描述FR改组的“指导选择”方法)中。
在一个实施方案中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约1x10
在某些实施方案中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约5x10
在某些实施方案中,在使用HUVEC细胞的标准流式细胞术测定中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约1x10
在某些实施方案中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约1x10
在某些实施方案中,在使用HUVEC细胞的标准流式细胞术测定中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约5x10
在某些实施方案中,在使用过表达HEK293的细胞的标准流式细胞术测定中,所述缀合物的抗TM4SF1抗体或其抗原结合片段以约1x10
测定抗体或抗体片段的KD的方法可以是,例如,表面等离子体共振可用于测定抗体对抗原的KD(例如,在25℃下使用BIACORE 2000或BIACORE 3000(BIAcore,Inc.,Piscataway,N.J.),其中抗原或Fc受体以约10个响应单位(RU)固定在CM5芯片上)。在某些实施方案中,使用FACS或流式细胞术测定KD,由此使用表达TM4SF1的细胞如HEK293细胞或HUVEC细胞结合抗体或片段,并根据标准方法测量KD。使用流式细胞术测定抗体的亲和力例如描述于Geuijen等人(2005)JImmunol Methods.302(1-2):68-77中。在某些实施方案中,使用FACS测定抗体的亲和力。
在一个实施方案中,本公开提供了包含抗TM4SF1抗体或其抗原结合片段的缀合物,该抗TM4SF1抗体或其抗原结合片段具有含有保守性氨基酸置换的本文所述的CDR氨基酸序列,使得该抗TM4SF1抗体或其抗原结合片段包含与表2所示CDR氨基酸序列至少95%相同(或至少96%相同,或至少97%相同,或至少98%相同,或至少99%相同)的CDR的氨基酸序列。“保守性氨基酸置换”是其中某一氨基酸残基被具有化学性质(例如电荷或疏水性)类似的侧链(R基团)的另一氨基酸残基代替的置换。通常,保守性氨基酸置换基本上不改变蛋白质的功能性质。在两个或更多个氨基酸序列因保守性置换而彼此不同的情况下,序列同一性百分比或相似性程度可以向上调整,以校正该置换的保守性质。用于进行这种调整的手段是本领域技术人员公知的。参见,例如,Pearson(1994)Methods Mol.Biol.24:307-331,通过引用并入本文。具有化学性质类似的侧链的氨基酸的群组的实例包括(1)脂族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;(2)脂族-羟基侧链:丝氨酸和苏氨酸;(3)含有酰胺的侧链:天冬酰胺和谷氨酰胺;(4)芳族侧链:苯丙氨酸、酪氨酸和色氨酸;(5)碱性侧链:赖氨酸、精氨酸和组氨酸;(6)酸性侧链:天冬氨酸和谷氨酸,以及(7)含硫侧链是半胱氨酸和甲硫氨酸。
在一些实施方案中,本公开进一步提供了包含抗TM4SF1抗体或其抗原结合片段的缀合物,如在使用HUVEC细胞的标准流式细胞术测定中所确定的,该抗TM4SF1抗体或其抗原结合片段以约5x10
在本公开的另一方面,所述抗TM4SF1抗体或其抗原结合片段是人源化抗TM4SF1抗体或其抗原结合片段,如在使用HUVEC细胞的标准流式细胞术测定中所确定的,其以约5x10
在一个实施方案中,本公开的抗TM4SF1抗体或抗原结合片段与人TM4SF1的结合不依赖于人TM4SF1的ECL2环的糖基化,即抗体的结合不依赖于TM4SF1的在ECL2环(SEQ IDNO:77)内的糖基化。
所述缀合物的抗TM4SF1抗体或其抗原结合片段可以是任何同种型(例如但不限于IgG、IgM和IgE)中的任一种。在某些实施方案中,所述缀合物的抗体或其抗原结合片段是IgG同种型。在特定实施方案中,所述缀合物的抗体或其抗原结合片段是IgG1、IgG2或IgG4同种型。在某些实施方案中,该抗TM4SF1抗体或其抗原结合片段是人IgG1、人IgG2或人IgG4同种型。
在ADCC和/或CDC活性方面,IgG2是天然最低的(An等人,MAbs.2009年11月-12月;1(6):572–579)。因此,在某些实施方案中,有利地使用IgG2。然而,IgG2具有两个额外半胱氨酸(导致4个铰链间二硫键),这使其倾向于通过形成抗体间二硫键而聚集。在相关实施方案中,对IgG2半胱氨酸进行突变以减少聚集。
本公开提供了包含与TM4SF1结合的抗体片段的缀合物。在某些情况下,使用抗体片段而非完整抗体存在优势。片段的较小大小允许快速清除,并且可导致改进的细胞、组织或器官可及性。关于某些抗体片段的综述,参见Hudson等人,2003,Nature Med.9:129-34。
已开发了用于产生抗体片段的各种技术。在传统上,这些片段通过蛋白水解消化完整抗体而获得(参见例如Morimoto等人,1992,J.Biochem.Biophys.Methods 24:107-17;以及Brennan等人,1985,Science229:81-83)。然而,这些片段现在可以直接由重组宿主细胞产生。Fab、Fv和scFv抗体片段全部可在大肠杆菌或酵母细胞中表达并从大肠杆菌或酵母细胞分泌,由此允许轻松产生大量这些片段。可从以上讨论的抗体噬菌体文库中分离抗体片段。或者,可以直接从大肠杆菌中回收Fab’-SH片段,并且化学偶联以形成F(ab’)2片段。根据另一方法,可以直接从重组宿主细胞培养物中分离F(ab’)2片段。具有延长的体内半衰期的Fab和F(ab’)2片段包含补救受体结合表位残基。产生抗体片段的其他技术对熟练技术人员来说是显而易见的。在某些实施方案中,抗体是单链Fv片段(scFv)。Fv和scFv具有完整的结合位点,其没有恒定区;因此,它们可能适合在体内使用过程中减少的非特异性结合。可以构建单链Fv(scFv)融合蛋白,以在scFv的氨基或羧基末端产生效应蛋白的融合(参见,例如,Borrebaeck编,同上)。抗体片段还可以是“线性抗体”,例如,如以上引用的参考文献所述。这类线性抗体可以是单特异性的或多特异性的,如双特异性的。在某些实施方案中,抗原结合片段可选自Fab、Fab’、F(ab’)2、Fv和scFv。
例如,对人TM4SF1具有高亲和力的抗TM4SF1抗体(和片段)可使用本领域已知的筛选技术来鉴定。例如,单克隆抗体可使用首先由Kohler等人,1975,Nature 256:495-97描述的杂交瘤方法制备,或者可以通过重组DNA方法制备(参见,例如,美国专利4,816,567)。
在杂交瘤方法中,例如使用人TM4SF1的ECL2环或表达TM4SF1的细胞(由此在细胞表面上表达ECL2环)免疫小鼠或其他适当的宿主动物,如仓鼠,以引发产生或能够产生将与用于免疫的蛋白质特异性结合的抗体的淋巴细胞。或者,可在体外免疫淋巴细胞。在免疫后,分离淋巴细胞,然后使用合适的融合剂如聚乙二醇使淋巴细胞与骨髓瘤细胞系融合,以形成杂交瘤细胞。
接种由此制备的杂交瘤细胞,并使其在合适的培养基中生长,在某些实施方案中,该培养基含有一种或多种抑制未融合亲本骨髓瘤细胞生长或存活的物质(也被称为融合配偶体)。例如,如果亲本骨髓瘤细胞缺乏次黄嘌呤鸟嘌呤磷酸核糖基转移酶(HGPRT或HPRT),则用于杂交瘤的选择性培养基一般将包含次黄嘌呤、氨基蝶呤和胸苷(HAT培养基),它们阻止HGPRT缺陷型细胞的生长。
示例性融合配偶体骨髓瘤细胞是高效融合,支持由所选抗体生产细胞稳定高水平产生抗体,并且对针对未融合亲本细胞进行选择的选择性培养基敏感的细胞。示例性骨髓瘤细胞系是鼠骨髓瘤系,如SP-2和衍生物,例如可从美国典型培养物保藏中心(AmericanType Culture Collection,Manassas,Va.)获得的X63-Ag8-653细胞,以及来源于可从SalkInstitute Cell Distribution Center(San Diego,Calif.)获得的MOPC-21和MPC-11小鼠肿瘤的细胞系。还已经描述了用于产生人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系(Kozbor,1984,Immunol.133:3001-05;以及Brodeur等人,Monoclonal AntibodyProduction Techniques and Applications51-63(1987))。
测定杂交瘤细胞在其中生长的培养基中针对抗原的单克隆抗体的产生。通过免疫沉淀或通过体外结合测定如RIA或ELISA来测定由杂交瘤细胞产生的单克隆抗体的结合特异性。单克隆抗体的结合亲和力可以例如通过Munson等人,1980,Anal.Biochem.107:220-39中所述的Scatchard分析来测定。
一旦鉴定出产生具有所需特异性、亲和力和/或活性的抗体的杂交瘤细胞,即可通过有限稀释程序对克隆进行亚克隆,并且通过标准方法使其生长(Goding,同上)。用于该目的的合适的培养基包括例如DMEM或RPMI-1640培养基。另外,例如通过将细胞腹膜内注射到小鼠中,可使杂交瘤细胞在动物中体内生长为腹水肿瘤。
通过常规抗体纯化程序,例如亲和色谱法(例如使用蛋白A或蛋白G-琼脂糖)或离子交换色谱法、羟基磷灰石色谱法、凝胶电泳、透析等,从培养基、腹水或血清中适当地分离由亚克隆分泌的单克隆抗体。
使用常规程序(例如通过使用能够特异性结合编码鼠抗体的重链和轻链的基因的寡核苷酸探针),易于对编码单克隆抗体的DNA进行分离和测序。杂交瘤细胞可充当这类DNA的来源。一旦分离,即可将DNA置于表达载体中,然后将其转染到宿主细胞如大肠杆菌细胞、猿猴COS细胞、中国仓鼠卵巢(CHO)细胞或者否则不产生抗体蛋白质的骨髓瘤细胞中,以获得在重组宿主细胞中合成单克隆抗体。关于在细菌中重组表达编码抗体的DNA的综述文章包括Skerra等人,1993,Curr.Opinion in Immunol.5:256-62以及Pluckthun,1992,Immunol.Revs.130:151-88。
在进一步的实施方案中,单克隆抗体或抗体片段可从使用例如在Antibody PhageDisplay:Methods and Protocols(O’Brien和Aitken编,2002)中描述的技术产生的抗体噬菌体文库中分离。在原则上,通过筛查含有展示与噬菌体外壳蛋白融合的抗体可变区(Fv)的各种片段的噬菌体的噬菌体文库来选择合成抗体克隆。针对所需抗原筛查这类噬菌体文库。使表达能够结合所需抗原的Fv片段的克隆吸附于抗原,因此与文库中的非结合克隆分离。然后将结合克隆从抗原中洗脱下来,并且可通过额外的抗原吸附/洗脱循环来进一步富集。
可使可变域功能性地在噬菌体上展示为单链Fv(scFv)片段,其中VH和VL通过短柔性肽共价连接,或展示为Fab片段,其中VH和VL各自与恒定域融合并且非共价地相互作用,如例如Winter等人,1994,Ann.Rev.Immunol.12:433-55中所述。
VH和VL基因的组库(Repertoires)可通过PCR单独地克隆,并且在噬菌体文库中随机重组,然后可搜索噬菌体文库中的抗原结合克隆,如Winter等人(同上)所述。来自经免疫的来源的文库提供对免疫原具有高亲和力的抗体,而无需构建杂交瘤。或者,可以克隆天然组库以提供单一来源的针对广泛范围的非自身抗原以及自身抗原的人抗体,而不进行任何免疫,如Griffiths等人,1993,EMBO J 12:725-34所述。最后,还可以通过以下方式合成制备天然文库:从干细胞克隆未重排的V基因区段,以及使用含有随机序列的PCR引物来编码高变CDR3区域并实现体外重排,如例如Hoogenboom和Winter,1992,J.Mol.Biol.227:227-88所述。
对文库的筛查可通过本领域中已知的各种技术来实现。例如,可使用TM4SF1(例如ECL2环的可溶性形式或表达所述环的细胞)包被吸附板的各孔,在固定于吸附板或在细胞分选中使用的宿主细胞上表达,缀合至生物素以供用链霉亲和素包被的珠子捕集,或者在用于淘选展示文库的其他任何方法中使用。通过使用如Bass等人,1990,Proteins 8:309-14以及WO 92/09690所述的长时间洗涤和单价噬菌体展示,以及通过使用如Marks等人,1992,Biotechnol.10:779-83所述的低抗原包被密度,可以促进对具有缓慢解离动力学(例如良好结合亲和力)的抗体的选择。
抗TM4SF1抗体可通过以下方式获得:设计适于选择目的噬菌体克隆的抗原筛选程序,随后使用来自目的噬菌体克隆的VH和/或VL序列(例如Fv序列)或来自VH和VL序列的各种CDR序列以及Kabat等人(同上)所述的适当恒定区(例如Fc)序列来构建全长抗TM4SF1抗体克隆。
可使用本领域中已知以及本文所述的结合测定对抗TM4SF1抗体进行筛选,以确定抗体是否对TM4SF1的ECL2环具有治疗性亲和力。抗体抑制或降低转移性细胞活性的能力可使用本领域中的标准测定以及本文所述的测定来测量。临床前测定需要使用通常属于以下三种类型之一的动物转移模型:(i)通常通过用以产生肺转移的尾静脉注射,通过用以产生肝转移的门静脉或脾内注射,或通过用以产生骨转移和其他转移的左心室心脏注射,将转移性小鼠肿瘤细胞如B16F10黑素瘤TC注射至小鼠中;(ii)将转移性肿瘤细胞或完整肿瘤片段正位移植至小鼠中,所述方法常常需要稍后手术切除原发性肿瘤以预防与原发性肿瘤生长相关的发病;和(iii)自发性转移的遗传工程小鼠模型,其中最常见的是MMTV-Pyt(小鼠乳腺肿瘤病毒-多瘤病毒中T抗原)小鼠乳腺癌模型,该模型提供人类癌症转移的一种高度真实的小鼠模型;超过85%的半合子MMTV-PyMT雌性自发地发生可触知的乳腺肿瘤,所述肿瘤在8-16周龄时转移至肺。通过随TM4SF1免疫阻断程度而变化的,处死动物的肺中转移性结节的活体动物成像或直接计数来量化肺中的转移性负荷,以及实现例如肺转移降低至少50%的治疗水平,将指示例如治疗性抗体可以在本公开的方法中使用。此外,跨物种反应性测定在本领域中是已知的。可使用的测定的实例例如描述于Khanna和Hunter(Carcinogenesis.2005年3月;26(3):513-23)以及Saxena和Christofori(Mol Oncol.2013年4月;7(2):283-96)中,这些文献通过引用整体并入本文。
在本公开的一个实施方案中,抗TM4SF1抗体或其抗原结合片段含有降低或消除抗体或片段的ADCC和/或CDC效应功能的突变。如本文所用的术语“抗体依赖性细胞介导的细胞毒性(ADCC)”是指由细胞毒性效应细胞通过非吞噬过程杀伤抗体包被的靶细胞,该非吞噬过程的特征在于释放细胞毒性颗粒的内含物或表达诱导细胞死亡的分子。ADCC通过靶标结合的抗体(属于IgG或IgA或IgE类别)与某些Fc受体(FcR)的相互作用来触发,所述Fc受体是存在于效应细胞表面上的结合免疫球蛋白(Ig)的Fc区的糖蛋白。介导ADCC的效应细胞包括自然杀伤(NK)细胞、单核细胞、巨噬细胞、嗜中性白细胞、嗜酸性粒细胞和树突细胞。ADCC是一种快速效应机制,其功效依赖于许多参数(靶细胞表面上的抗原的密度和稳定性;抗体亲和力和FcR结合亲和力)。基于PBMC的ADCC测定和基于自然杀伤细胞的ADCC测定可用于检测ADCC。这些测定中的读出数据是终点驱动的(靶细胞裂解)。
“补体依赖性细胞毒性”或“CDC”是指在补体的存在下靶细胞的裂解。经典补体途径的激活由补体系统的第一组分(C1q)与(适当子类的)抗体的结合引发,所述抗体与其同源抗原结合。为了评估补体活化,可进行CDC测定(参见例如Gazzano-Santoro等人,1996,J.Immunol.Methods 202:163)。已经描述了具有改变的Fc区氨基酸序列(具有变异Fc区的多肽)以及增加或降低的C1q结合能力的多肽变体(参见例如美国专利6,194,551;WO 1999/51642;Idusogie等人,2000,J.Immunol.164:4178-84)。可以选择不具有或具有极低CDC活性的抗体(或片段)进行使用。
如本文所用的术语“效应功能”是指由IgG的Fc效应结构域(例如免疫球蛋白的Fc区)所导致的功能。这样的功能可通过例如Fc效应结构域与具有吞噬或溶解活性的免疫细胞上的Fc受体结合,或通过Fc效应结构域与补体系统的组分结合来实现。抗体效应功能的实例包括:C1q结合和补体依赖性细胞毒性(CDC);Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬(ADCP);细胞表面受体(例如B细胞受体)的下调;以及B细胞活化。
如本文所用的术语“降低”或“消除”是指能够导致优选20%或更大,更优选50%或更大,最优选75%、85%、90%、95%或更大的总体减低。降低或消除可指所治疗的病症(例如癌症)的症状,转移的存在与否或大小,或原发性肿瘤的大小。
如本文所用的术语“降低的ADCC/CDC功能”是指与对照(例如具有不包括突变的Fc区的抗体)相比,特定效应功能例如ADCC和/或CDC降低至少约5%、至少约10%、至少约15%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或更大。
因此,在某些实施方案中,相比于与本公开的抗体具有相同氨基酸序列,但不包含对Fc区进行的至少一个氨基酸残基的添加、置换或缺失的抗体(在本文中也称为“未修饰的抗体”),本公开的突变抗体具有降低的或消除的对负责促进效应功能的Fc配体的亲和力。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段包含含有至少两个降低或消除抗体或其抗原结合片段的ADCC和/或CDC效应功能的突变的Fc区。在其他实施方案中,抗TM4SF1抗体或其抗原结合片段包含含有至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个、至少十个或更多个降低或消除抗体或其抗原结合片段的ADCC和/或CDC效应功能的突变的Fc区。
在某些实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有一个或多个选自下组的突变的Fc区:E233P、L234V、L234A、L235A、G236Δ(缺失)、G237A、V263L、N297A、N297D、N297G、N297Q、K322A、A327G、P329A、P329G、P329R、A330S、P331A和P331S。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有L234A/L235A突变,具有或不具有G237A突变的Fc区。在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有L234A、L235A和G237A突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有A327G/A330S/P331S突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有E233P/L234V/L235A/ΔG236(缺失)突变的Fc区,所述突变提供降低的与FcγRI、FcγRIIA、FcγRIIIA的结合,以及降低的ADCC和CDC效应功能。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有N297x突变的Fc区,其中x=A、D、G、Q。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有A327G/A330S/P331S突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有K322A、P329A和P331A中一个或多个的突变的Fc区,所述突变提供降低的与C1q的结合。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有V263L突变的Fc区,所述突变提供增强的与FcγRIIB的结合和增强的ADCC。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有L234A/L235A、G237A或L235E突变的Fc区。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG1同种型,并且包含含有L234F、L235E或P331S突变的Fc区。
在某些实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG2同种型,并且包含含有一个或多个选自下组的突变的Fc区:V234A、G237A、P238S、H268A或H268Q、V309L、A330S和P331S。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG2同种型,并且包含含有A330S/P331S突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG2同种型,并且包含含有A330S/P331S、V234A/G237A/P238S/H268A/V309L/A330S/P331S或H268Q/V309L/A330S/P331S突变的Fc区。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有一个或多个选自下组的突变的Fc区:S228P、E233P、F234A、F234V、L235E、L235A、G236Δ(缺失)、N297A、N297D、N297G、N297Q、P329G、P329R。
在某些实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有S228P突变的Fc区,所述突变提供降低的Fab-臂交换和降低的聚集。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有S228P/L235E突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有S228P/E233P/F234V/L235A/ΔG236(缺失)突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有N297x突变的Fc区,其中x=A、D、G、Q。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有S228P/F234A/L235A突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有L235E突变的Fc区,所述突变提供降低的与FcγRI、FcγRIIA、FcγRIIIA的结合,以及降低的ADCC和CDC效应活性。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有S228P/F234A/L235A或E233P/L235A/G236Δ突变的Fc区。
在一个实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有至少S228P突变的Fc区。Angal等人(Mol Immunol.1993年1月;30(1):105-8)描述了对人IgG4重链的铰链序列的分析,以将在残基241(根据EU编号系统,并且现在对应于Kabat编号中的残基228)处是否存在丝氨酸确定为在一定比例的分泌型人IgG4中的铰链区中重链间二硫桥异质性的原因。Silva等人(J Biol Chem.2015年2月27日;290(9):5462-9)描述了人IgG4中阻止体内和体外IgG4Fab-臂交换的S228P突变。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4同种型,并且包含含有L235E或S228P突变的Fc区。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4或IgG1同种型,并且包含含有N297A、N297D或N297G突变的Fc区。
在其他实施方案中,抗TM4SF1抗体或其抗原结合片段是IgG4或IgG1同种型,并且包含含有P329G、P329R突变的Fc区。
在一个示例性实施方案中,任何IgG同种型的突变Fc区在位置234、235、236、237、297、318、320、322处包含一个或多个突变。
可进行体外和/或体内细胞毒性测定,以证实CDC和/或ADCC活性的降低或消除。例如,可以进行Fc受体(FcR)结合测定,以确保抗体缺乏FcγR结合(因此可能缺乏ADCC活性),但是保留FcRn结合能力。用于介导ADCC的主要细胞NK细胞仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。用来评估目的分子的ADCC活性的体外测定的非限制性实例描述于美国专利5,500,362(参见例如Hellstrom,I.等人,Proc.Nat’l Acad.Sci.USA83(1986)7059-7063)和Hellstrom,I.等人,Proc.Nat’l Acad.Sci.USA82(1985)1499-1502;美国专利5,821,337(参见Bruggemann,M.等人,J.Exp.Med.166(1987)1351-1361)中。或者,可采用非放射性测定方法,参见例如用于流式细胞术的ACTI.TM.非放射性细胞毒性测定(CellTechnology,Inc.Mountain View,Calif.);以及CytoTox 96.RTM.非放射性细胞毒性测定(Promega,Madison,Wis.)。可用于这类测定的效应细胞包括外周血单核细胞(PBMC)和自然杀伤(NK)细胞。备选地或另外地,可在体内,例如在诸如Clynes等人,Proc.Nat’lAcad.Sci.USA 95(1998)652-656中公开的动物模型中评估目的分子的ADCC活性。还可进行C1q结合测定,以证实抗体不能结合C1q,因此缺乏CDC活性。参见例如WO 2006/029879和WO 2005/100402中的C1q和C3c结合ELISA。为了评估补体活化,可进行CDC测定(参见例如Gazzano-Santoro等人,J.Immunol.Methods 202(1996)163;Cragg,M.S.等人,Blood 101(2003)1045-1052;以及Cragg,M.S.和Glennie,M.J.,Blood 103(2004)2738-2743)。还可使用本领域已知的方法进行FcRn结合和体内清除率/半衰期测定(参见例如Petkova,S.B.等人,Int’l.Immunol.18(12)(2006)1759-1769)。
在一个实施方案中,与未修饰的抗体相比,本公开的抗体或其抗原结合片段展现出降低的或消除的ADCC效应功能。在另一实施方案中,与未修饰的抗体相比,本公开的抗体或其抗原结合片段展现出至少减小至1/2或至少减小至1/3或至少减小至1/5或至少减小至1/10或至少减小至1/50或至少减小至1/100的降低的ADCC效应功能。在又一实施方案中,与未修饰的抗体相比,本公开的抗体展现出降低至少10%或至少20%或至少30%或至少40%或至少50%或至少60%或至少70%或至少80%或至少90%或至少100%的ADCC效应功能。在本公开的另一方面,由本公开的抗体或其抗原结合片段诱导的ADCC效应功能降低或下调是降低至对于由未修饰抗体导致的ADCC诱导所观察到的数值的0%、2.5%、5%、10%、20%、50%或75%。在某些实施方案中,ADCC活性的降低和/或消除可归因于本公开的抗体或其抗原结合片段对Fc配体和/或受体的亲和力降低。
V.连接体
缀合物的组分,靶向蛋白(例如,如本文所述的抗TM4SF1抗体或其抗原结合片段)和寡核苷酸(例如,RNA分子或DNA分子),可以是使用诸如遗传缀合、酶促缀合、化学缀合或其任意组合等多种方法的缀合物。在各种实例中,改变连接体的性质,例如连接体的长度或切割的位置(在连接体可切割的情况下)。
在一些实施方案中,可以使用涉及使用哺乳动物或细菌转谷氨酰胺酶的酶促位点特异性缀合方法将缀合物内的RNA或DNA分子缀合至靶向蛋白。微生物转谷氨酰胺酶(mTG)是现代研究和生物技术中的多功能工具。大量的相对纯的酶的可获得性、易用性以及钙和鸟嘌呤-5'-三磷酸(GTP)的调节缺乏使mTG成为食品工业和生物技术中使用的主要交联酶。当前,mTG在许多应用中用来将蛋白质和肽附接至小分子、聚合物、表面、DNA以及其他蛋白质上。参见,例如,Pavel Strp,Veracity of microbial transglutaminase,BioconjugateChem.25,5,855-862。
在一些实施方案中,缀合物内的RNA或DNA分子可以通过具有直接共价或非共价相互作用的连接体与靶向蛋白缀合。连接体可以是基于氨基酸或肽的连接体,或化学连接剂,如同双官能性和异双官能性交联剂,它们可从许多商业来源获得。可用于交联的区域可在本公开的结合蛋白(例如抗TM4SF1抗体)上发现。连接体可包含柔性臂,例如2、3、4、5、6、7、8、9、10、11、12、13、14或15个碳原子。示例性连接体包括不可切割的共价或非共价连接体。在一些实施方案中,可切割的连接体包括酸不稳定的连接体、蛋白酶敏感的连接体、光不稳定的连接体或含二硫键的连接体。在一些实施方案中,该连接体包括半胱氨酸连接体或非半胱氨酸连接体,如赖氨酸连接体。在一些实施方案中,抗体或抗体片段包含非天然氨基酸,其中抗体或抗体片段与寡核苷酸通过非天然氨基酸连接/缀合。在一些实施方案中,抗体或抗体片段包含天然氨基酸,其中抗体或抗体片段与寡核苷酸通过天然氨基酸连接/缀合。
在一些实施方案中,抗体或抗体片段包含非天然氨基酸,其中抗体或抗体片段与寡核苷酸通过非天然氨基酸连接/缀合。非天然氨基酸可插入到抗体或抗体片段中的两个天然存在的氨基酸之间。一个或多个非天然氨基酸可代替抗体或抗体片段中的一个或多个天然存在的氨基酸。一个或多个非天然氨基酸可在抗体或抗体片段的N末端并入。一个或多个非天然氨基酸可在抗体或抗体片段的C末端并入。非天然氨基酸可在抗体或抗体片段的结合区的远端并入。非天然氨基酸可在抗体或抗体片段的结合区的附近并入。非天然氨基酸可在抗体或抗体片段的结合区并入。
一个或多个非天然氨基酸可由密码子编码,该密码子不编码二十种天然氨基酸之一。一个或多个非天然氨基酸可由无义密码子(终止密码子)编码。该终止密码子可以是琥珀密码子。该琥珀密码子可包含UAG序列。该终止密码子可以是赭石密码子。该赭石密码子可包含UAA序列。该终止密码子可以是乳白密码子或棕土密码子。该乳白密码子或棕土密码子可包含UGA序列。一个或多个非天然氨基酸可由四碱基密码子编码。
一个或多个非天然氨基酸可以是对乙酰基苯丙氨酸(pAcF或pAcPhe)。一个或多个非天然氨基酸可以是硒代半胱氨酸。一个或多个非天然氨基酸可以是对氟苯丙氨酸(pFPhe)。一个或多个非天然氨基酸可选自对叠氮基苯丙氨酸(pAzF)、对叠氮基甲基苯丙氨酸(pAzCH2F)、对苯甲酰基苯丙氨酸(pBpF)、对炔丙基氧基苯丙氨酸(pPrF)、对碘苯丙氨酸(pIF)、对氰基苯丙氨酸(pCNF)、对羧基甲基苯丙氨酸(pCmF)、3-(2-萘基)丙氨酸(NapA)、对二羟硼基苯丙氨酸(pBoF)、邻硝基苯丙氨酸(oNiF)、(8-羟基喹啉-3-基)丙氨酸(HQA)、硒代半胱氨酸和(2,2'-联吡啶-5-基)丙氨酸(BipyA)。一个或多个非天然氨基酸可以是4-(6-甲基-s-四嗪-3-基)氨基苯丙氨酸。
一个或多个非天然氨基酸可以是β-氨基酸(β3和β2)、高氨基酸、脯氨酸和丙酮酸衍生物、3-取代的丙氨酸衍生物、甘氨酸衍生物、环取代的苯丙氨酸和酪氨酸衍生物、线形核心氨基酸、二氨酸、D-氨基酸、N-甲基氨基酸或其组合。
非天然氨基酸的其他实例包括但不限于,1)各种取代的酪氨酸和苯丙氨酸类似物,如邻甲基-L-酪氨酸、对氨基-L-苯丙氨酸、3-硝基-L-酪氨酸、对硝基-L-苯丙氨酸、间甲氧基-L-苯丙氨酸和对异丙基-L-苯丙氨酸;2)具有可光交联的芳基叠氮化物和二苯甲酮基团的氨基酸;3)具有独特化学反应性的氨基酸,包括乙酰基-L-苯丙氨酸和间乙酰基-L-苯丙氨酸、O-烯丙基-L-酪氨酸、O-(2-丙炔基)-L-酪氨酸、对乙基硫基羰基-L-苯丙氨酸和对-(3-氧代丁酰基)-L-苯丙氨酸;4)用于在X射线晶体学中定相的含重原子的氨基酸,包括对碘和对溴-L-苯丙氨酸;5)氧化还原活性的氨基酸二羟基-L-苯丙氨酸;6)糖基化的氨基酸,包括b-N-乙酰基葡糖胺-O-丝氨酸和a-N-乙酰基半乳糖胺-O-苏氨酸;7)具有萘基、丹酰和7-氨基香豆素侧链的荧光氨基酸;8)具有偶氮苯和硝基苄基Cys、Ser和Tyr侧链的可光裂解和可光异构化的氨基酸;9)磷酸酪氨酸模拟物对羧甲基-L-苯丙氨酸;10)谷氨酰胺同系物高谷氨酰胺;以及11)2-氨基辛酸。可对非天然氨基酸进行修饰以并入化学基团。可对非天然氨基酸进行修饰以并入酮基团。
一个或多个非天然氨基酸可包含至少一个肟、羰基、二羰基、羟胺基团或其组合。一个或多个非天然氨基酸可包含至少一个羰基、二羰基、烷氧基胺、肼、无环烯烃、五环炔烃、环辛炔、芳基/烷基叠氮、降冰片烯、环丙烯、反式环辛烯或四嗪官能团或其组合。
一个或多个非天然氨基酸可通过本领域已知的方法并入抗体或抗体片段中。基于细胞的或无细胞的系统可用来改变抗体或抗体片段的基因序列,从而产生具有一个或多个非天然氨基酸的抗体或抗体片段。营养缺陷型菌株可代替工程化的tRNA和合成酶而使用。一个或多个非天然氨基酸可通过一个或多个天然氨基酸的选择性反应而产生。该选择性反应可被一种或多种酶介导。在一个非限制性实例中,一个或多个半胱氨酸与甲酰基甘氨酸生成酶(FGE)的选择性反应可产生一个或多个甲酰基甘氨酸,如Rabuka等人,NatureProtocols 7:1052-1067(2012)所述。
一个或多个非天然氨基酸可参与化学反应以形成连接体。形成连接体的化学反应可以是生物正交反应。形成连接体的化学反应可以是点击化学。
另外的非天然氨基酸在Liu等人(Annu Rev Biochem,79:413-44,2010)、Wang等人(Angew Chem Int Ed,44:34-66,2005)和PCT申请PCT/US2012/039472、PCT/US2012/039468、PCT/US2007/088009、PCT/US2009/058668、PCT/US2007/089142、PCT/US2007/088011、PCT/US2007/001485、PCT/US2006/049397、PCT/US2006/047822和PCT/US2006/044682中公开,这些均通过引用整体并入本文。
一个或多个非天然氨基酸可代替抗体或抗体片段中的一个或多个氨基酸。一个或多个非天然氨基酸可代替抗体或抗体片段中的任何天然氨基酸。
一个或多个非天然氨基酸可并入抗体或抗体片段的轻链中。一个或多个非天然氨基酸可并入抗体或抗体片段的重链中。一个或多个非天然氨基酸可并入抗体或抗体片段的重链和轻链中。一个或多个非天然氨基酸可代替抗体或抗体片段的轻链中的氨基酸。一个或多个非天然氨基酸可代替抗体或抗体片段的重链中的氨基酸。一个或多个非天然氨基酸可代替抗体或抗体片段的重链和轻链中的氨基酸。
在一些实施方案中,抗体片段与治疗剂通过连接体连接/缀合。在一些实施方案中,连接体包含小分子片段、间隔区、非共价连接体或其组合。在一些实施方案中,该连接体包含一个或多个小分子片段。在一些实施方案中,该连接体包含间隔区。
在一些实施方案中,连接体包含一个或多个反应性部分。在一些实施方案中,连接体包含选自Michael受体部分、离去基团部分或能够与抗体片段和/或治疗剂形成共价键的部分的反应性部分。
在一些实施方案中,小分子片段包含反应性部分。在一些实施方案中,小分子片段包含选自Michael受体部分、离去基团部分或能够与半胱氨酸残基的巯基形成共价键的部分的反应性部分。
在一些实施方案中,Michael受体部分包含烯烃或炔烃部分。在一些实施方案中,小分子片段获自化合物文库。在一些实施方案中,化合物文库包括ChemBridge片段文库、Pyramid Platform Fragment-Based Drug Discovery、Maybridge片段文库、来自AnalytiCon的FRGx、来自AnCoreX的TCI-Frag、来自ASINEX的Bio Building Blocks、来自Charles River的BioFocus 3D、来自Emerald Bio的Life(FOL)的片段、Enamine FragmentLibrary、IOTA Diverse 1500、BIONET片段文库、Life Chemicals Fragments Collection、OTAVA片段文库、Prestwick片段文库、Selcia片段文库、基于TimTec片段的文库、来自Vitas-M Laboratory的Allium或Zenobia片段文库。
在一些实施方案中,小分子片段包含碳二亚胺、N-羟基琥珀酰亚胺(NHS)酯、亚氨基酯、五氟苯基酯、羟甲基膦、马来酰亚胺、卤代乙酰基、吡啶基二硫化物、硫代磺酸酯、乙烯基砜、酰肼、烷氧基胺、炔烃、叠氮化物或异氰酸酯基团。在一些实施方案中,小分子片段包含炔烃或叠氮基团。在一些实施方案中,小分子片段包含炔基。在一些实施方案中,小分子片段包含叠氮基团。
在一些实施方案中,小分子片段与间隔区共价相互作用。在一些实施方案中,间隔区包含酰胺部分、酯部分、醚部分、取代或未取代的C1-C6亚烷基部分、取代或未取代的C1-C6卤代亚烷基部分、取代或未取代的C1-C6杂亚烷基部分、取代或未取代的C3-C8环亚烷基部分、取代或未取代的C2-C7杂亚烷基部分、取代或未取代的亚芳基部分、取代或未取代的杂亚芳基部分或其任意组合。
在一些实施方案中,连接体包含MC(6-马来酰亚胺基己酰基)、MCC(马来酰亚胺基甲基环己烷-1-甲酸酯)、MP(马来酰亚胺基丙酰基)、val-cit(缬氨酸-瓜氨酸)、val-ala(缬氨酸-丙氨酸)、ala-phe(丙氨酸-苯丙氨酸)、PAB(对氨基苄氧羰基)、SPP(N-琥珀酰亚胺基4-(2-吡啶基硫基)戊酸酯)、SMCC(N-琥珀酰亚胺基4-(N-马来酰亚胺基甲基)环己烷-1甲酸酯)、SIAB(N-琥珀酰亚胺基(4-碘-乙酰基)氨基苯甲酸酯)。连接体的其他实例包括:BS3([双(磺基琥珀酰亚胺基)辛二酸酯];BS3是一种靶向可及的伯胺的同双官能性N-羟基琥珀酰亚胺酯)、NHS/EDC(N-羟基琥珀酰亚胺和N-乙基-(二甲基氨基丙基)碳二亚胺;NHS/EDC允许伯胺基团与羧基的缀合)、磺基-EMCS([N-e-马来酰亚胺基己酸]酰肼;磺基-EMCS是对巯基和氨基具有反应性的异双官能性反应性基团(马来酰亚胺和NHS酯))、酰肼(大多数蛋白质含有暴露的碳水化合物,并且酰肼是可用于使羧基连接至伯胺的试剂)以及SATA(N-琥珀酰亚胺基-S-乙酰基硫代乙酸酯;SATA对胺具有反应性,并且添加经保护的巯基)。为了形成共价键,可使用具有广泛多种活性羧基(例如酯)的化学反应性基团,其中羟基部分在对肽进行修饰所需的水平上是生理学上可接受的。特定试剂包括N-羟基琥珀酰亚胺(NHS)、N-羟基-磺基琥珀酰亚胺(磺基-NHS)、马来酰亚胺-苯甲酰基-琥珀酰亚胺(MBS)、γ-马来酰亚胺基-丁酰氧基琥珀酰亚胺酯(GMBS)、马来酰亚胺基丙酸(MPA)、马来酰亚胺基己酸(MHA)和马来酰亚胺基十一烷酸(MUA)。伯胺是NHS酯的主要靶标。存在于蛋白质的N末端上的可及的a-氨基和赖氨酸的ε-胺与NHS酯反应。当NHS酯缀合反应物与伯胺反应时形成酰胺键,从而释放N-羟基琥珀酰亚胺。这些含有琥珀酰亚胺的反应性基团在本文中被称为琥珀酰亚胺基。在本公开的某些实施方案中,蛋白质上的官能团将是巯基,并且化学反应性基团将是含有马来酰亚胺基的基团,如γ-马来酰亚胺-丁酰胺(GMBA或MPA)。这类含有马来酰亚胺的基团在本文中被称为马来酰亚胺基。当反应混合物的pH是6.5-7.4时,马来酰亚胺基对肽上的巯基最具选择性。在pH 7.0时,马来酰亚胺基与巯基(例如蛋白质如血清白蛋白或IgG上的巯基)的反应速率是与胺的反应速率和1000倍。因此,可形成马来酰亚胺基与巯基之间的稳定硫醚连接。
在其他实施方案中,连接体包括至少一个氨基酸(例如具有至少2、3、4、5、6、7、10、15、20、25、40或50个氨基酸的肽)。在某些实施方案中,该连接体是单一氨基酸(例如任何天然存在的氨基酸,如Cys或Lys)。在其他实施方案中,可使用肽,如富含甘氨酸的肽。在一些情况下,该连接体可以是单一氨基酸(例如任何氨基酸,如Gly或Cys或Lys)。合适的连接体的实例是琥珀酸、Lys、Glu和Asp,或二肽,如Gly-Lys。当连接体是琥珀酸时,其一个羧基可与氨基酸残基的氨基形成酰胺键,其另一个羧基例如可与肽或取代基的氨基形成酰胺键。当连接体是Lys、Glu或Asp时,其羧基可与氨基酸残基的氨基形成酰胺键,而其氨基例如可与取代基的羧基形成酰胺键。当Lys用作连接体时,可以在Lys的ε-氨基与取代基之间插入另一连接体。在一个特定实施方案中,所述另一连接体是琥珀酸,其例如与Lys的ε-氨基以及与存在于取代基中的氨基形成酰胺键。在一个实施方案中,所述另一连接体是Glu或Asp(例如,其与Lys的ε-氨基形成酰胺键,并且与存在于取代基中的羧基形成另一酰胺键),即,该取代基是NE酰化的赖氨酸残基。在一些实施方案中,连接体包含由赖氨酸组成的单氨基酸肽。在一些实施方案中,连接体包含LysLys二肽。在一些实施方案中,连接体包含*Lys和/或Lys*二肽。在一些实施方案中,连接体包含LysLys*和/或*LysLys、Lys*Lys三肽。在一些实施方案中,连接体包含LysLysLys三肽。
在一些实施方案中,靶向蛋白和RNA分子的缀合以产生带环分子的方式进行。在一些实施方案中,间隔区另外包括大环。在一些实施方案中,大环包括非共价大环。在一些实施方案中,大环包括共价大环。
在一些实施方案中,大环包括葫芦[X]脲,其中X为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20。在一些实施方案中,该大环包括葫芦[X]脲,其中X为5、6、7、8、9、10、11、12、13、14或15。在一些实施方案中,大环包括葫芦[X]脲,其中X是5、6、7或8。在一些实施方案中,该葫芦[X]脲具有以下所示的结构:
在一些实施方案中,x为5。在一些实施方案中,x为6。在一些实施方案中,x为7。在一些实施方案中,x为8。
在一些实施方案中,大环包括葫芦[X]脲(CB6)。在一些实施方案中,大环包括葫芦[X]脲(CB7)。在一些实施方案中,该葫芦[X]脲具有以下所示的结构:
在一些实施方案中,大环包括环糊精(CD)。在一些实施方案中,该环糊精具有以下所示的结构:
在一些实施方案中,大环包括β-环糊精(n=7)。在一些实施方案中,大环包括γ-环糊精(n=8)。在一些实施方案中,该β-环糊精具有以下所示的结构:
在一些实施方案中,大环包括多肽。在一些实施方案中,该多肽具有以下所示的结构:
其中
R
在一些实施方案中,大环包括环甘氨酸。在一些实施方案中,大环包括环环(甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基)。在一些实施方案中,大环包括环(甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基)。在一些实施方案中,该环(甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基甘氨酰基)具有以下所示的结构:
在一些实施方案中,大环包括冠醚。在一些实施方案中,该冠醚为15-冠-5、18-冠-6、二苯并-18-冠-6或二氮杂-18-冠-6。
在一些实施方案中,大环包括环烷烃。在一些实施方案中,该环烷烃是环十五烷、环十六烷、环十七烷或环十八烷。
在一些实施方案中,大环包括环双(百草枯-对亚苯基)(CBPQT
在一些实施方案中,连接基包含季氮。在某些实施方案中,连接体为:
在一些实施方案中,所述连接体为:
在一些实施方案中,通过将连接体的第一部分连接至抗体或其抗原结合片段,并将连接体的第二部分连接至寡核苷酸来产生缀合物。将连接体与抗体或其抗原结合片段或治疗剂缀合可包括在连接体与抗体、其抗原结合片段或治疗剂之间产生离子键、共价键、非共价键或其组合。将连接体与抗体或其抗原结合片段或寡核苷酸缀合可以如Roberts等人,Advanced Drug Delivery Reviews 54:459-476(2002)所述进行。该连接体可选自双官能团连接体、可切割的连接体、不可切割的连接体、乙二醇连接体、双官能乙二醇连接体、柔性连接体或非柔性连接体。连接体可包含选自环辛炔、环丙烯、芳基/烷基叠氮化物、反式-环辛烯、降冰片烯和四嗪的化学基团。在一些实施方案中,连接基的末端包含烷氧基胺。在一些实施方案中,连接体的末端包含叠氮基或环辛炔基团。在一些实施方案中,抗体或抗体片段或治疗剂可以通过选自环辛炔、环丙烯、芳基/烷基叠氮化物、顺式环辛烯、降冰片烯和四嗪的化学基团偶联至连接体。将抗体或抗体片段或寡核苷酸与连接体连接可包括进行一个或多个无铜反应。将抗体或抗体片段或寡核苷酸与连接体连接可包括进行一个或多个含铜反应。将抗体或抗体片段或寡核苷酸与连接体连接可包括一个或多个环加成。将抗体或抗体片段或寡核苷酸与连接体连接可包括一个或多个Huisgen-环加成。将抗体或抗体片段或寡核苷酸与连接体连接可包括一个或多个Diels Alder反应。将抗体或抗体片段或寡核苷酸与连接体连接可包括一个或多个Hetero Diels Alder反应。在一些实施方案中,连接体的末端包含离去基团。
在一些实施方案中,如本文所述,连接体的第一部分与含半胱氨酸的抗体或其抗原结合片段共价相互作用。在一些实施方案中,如本文所述,连接体的第一部分与含有半胱氨酸的TM4SF1抗体或其抗原结合片段共价相互作用。在一些实施方案中,本文所述的寡核苷酸与连接体的第二部分共价相互作用。在一些实施方案中,本文所述的寡核苷酸与连接体的第二部分非共价相互作用。
在一些实施方案中,涉及基于病毒蛋白p19的siRNA载体,该蛋白质已显示对siRNA具有高亲和力。参见,例如,Yang等人,Cytosolic delivery of siRNA by ultra-highaffinity dsRNA binding proteins,Nucleic Acids Res.2017Jul 27;45(13):7602–7614。在一些实例中,产生p19-siRNA复合物并将其融合至抗TM4SF1抗体或其抗原结合片段。在另外的实施方案中,通过抗体或其抗原结合片段内的Cys、Lys或精氨酸(Arginie)残基的统计或随机缀合方法。
VI.包含抗体或其抗原结合片段和siRNA的缀合物的合成
在一个实施方案中,通过抗体或抗原结合片段与RNA分子(例如siRNA)的共价缀合来开发包含抗体或其抗原结合片段(例如,抗TM4SF1抗体或其抗原结合片段)和寡核苷酸的缀合物。作为这种示例性过程的第一步,产生工程化抗TM4SF1抗体,其中在重链中引入了半胱氨酸残基(从而产生具有工程化半胱氨酸的抗TM4SF1HC)。在一些实例中,具有工程化半胱氨酸的抗TM4SF1抗体提供了至少两个离散的位置,用于与RNA分子如siRNA偶联。例如,一个siRNA分子可以与具有工程化半胱氨酸的抗TM4SF1的每条重链偶联。在缀合过程的单独步骤或后续步骤中,生成化学稳定化的siRNA(用siSTABLE化学法合成的),其用3′-胺修饰以供与具有靶向肽基脯氨酰异构酶B(PPIB,亲环蛋白B)的序列的过客链偶联。在一些实施方案中,该缀合进一步包括可还原的N-琥珀酰亚胺基-4-(2-吡啶基二硫基)丁酸酯(SPDB)或不可还原的琥珀酰胺基-4-[N-马来酰亚胺基甲基]环己烷-1-甲酸酯(SMCC)NHS(N-羟基琥珀酰亚胺)连接体。在一些实施方案中,使用具有工程化半胱氨酸的抗TM4SF1抗体,在包括至少两个主要步骤的多步骤过程中产生根据本公开的示例性缀合物分子:(i)胺标记的siRNA与NHS-连接体的反应以形成巯基反应性siRNA-连接体加合物,和(ii)使该加合物与具有工程化半胱氨酸的抗体上的巯基反应,以通过硫酯键共价连接siRNA。该过程在图1中示出。随后使用阴离子交换色谱法去除游离的siRNA,然后通过大小排阻色谱法去除未偶联的抗体,从而纯化示例性的缀合物分子。然后可以使用其他技术如凝胶电泳和电喷雾TOP质谱法来评估示例性缀合物分子的产率以及诸如每个抗体具有一个或两个连接的siRNA的单体缀合物的特性。包含巯基反应性连接体-有效负载的示例性工程抗体在图2中示出。
可以用于缀合的其他方法包括使用或基于化学或肽的连接体、化学或酶促缀合方法(例如,使用哺乳动物或细菌转谷氨酰胺酶)或其任意组合。上述任何连接体和/或方法均可用于偶联缀合物的抗体或其抗原结合片段和寡核苷酸。
使用适当的偶联方法,可能生成本公开的缀合物,其寡核苷酸与抗体或抗原结合片段之比(OAR)例如为约2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1或更高。例如在抗体-RNA缀合物(ARC)中增加的OAR(寡核苷酸与抗体或其抗原结合片段之比)增加了每个抗体的RNA(例如siRNA)。在一些实例中,在维持单体ARC设计的同时增加了每个抗体的RNA数。在一些实施方案中,该缀合物的抗体或抗原结合片段与寡核苷酸之比为1:1。这可以例如通过使用抗原结合片段或抗体的一部分例如半抗体、Fab或包含工程化半胱氨酸的其他片段来实现。在一些实例中,可以在分子识别的基础上,使用通过缀合方法与寡核苷酸缀合的完整抗体,将缀合物设计为抗体或抗原结合片段与寡核苷酸之比为1:1,该缀合方法使用多金属蛋白(例如六铑金属肽)以进行蛋白质的修饰。例如,基于多金属蛋白对抗体的Fc结构域恒定区的分子识别,可以使用位点特异性抗体官能化来缀合抗体和寡核苷酸。在一些实施方案中,多金属蛋白包含附接至与抗体的Fc结构域结合的蛋白的特定位点的三个铑络合物。结合后,多金属蛋白可以催化寡核苷酸与抗体的位点特异性缀合。使用多金属蛋白的优点可以是在缀合过程中,例如通过避免抗体内的工程化残基,使抗体的破坏最小化。
VII.药物组合物
本文公开了包含一种或多种本文公开的缀合物的药物组合物,该缀合物包含抗体或其抗原结合片段。该药物组合物可进一步包含一种或多种药学上可接受的盐、赋形剂或媒介物。用于本发明药物组合物中的药学上可接受的盐、赋形剂或媒介物包括载体、赋形剂、稀释剂、抗氧化剂、防腐剂、着色剂、调味剂和稀释剂、乳化剂、悬浮剂、溶剂、填充剂、膨胀剂、缓冲液、递送媒介物、张度剂、共溶剂、润湿剂、络合剂、缓冲剂、抗微生物剂和表面活性剂。
中性缓冲盐水或与血清白蛋白混合的盐水是示例性的合适的载体。所述药物组合物可以包含抗氧化剂,如抗坏血酸;低分子量多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖醇,如甘露糖醇或山梨糖醇;成盐平衡离子,如钠;和/或非离子型表面活性剂,如吐温、普朗尼克或聚乙二醇(PEG)。另外举例来说,合适的张度增强剂包括碱金属卤化物(优选氯化钠或氯化钾)、甘露醇、山梨醇等。合适的防腐剂包括苯扎氯铵、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸等。过氧化氢也可以用作防腐剂。合适的共溶剂包括甘油、丙二醇和PEG。合适的络合剂包括咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟基-丙基-β-环糊精。合适的表面活性剂或润湿剂包括失水山梨醇酯、聚山梨醇酯如聚山梨醇酯80、氨基丁三醇、卵磷脂、胆固醇、四丁酚醛(tyloxapal)等。缓冲液可以是常规缓冲液,如乙酸盐、硼酸盐、柠檬酸盐、磷酸盐、碳酸氢盐或Tris-HCl。乙酸盐缓冲液可以是大约pH 4-5.5,而Tris缓冲液可以是大约pH 7-8.5。另外的药剂在Remington's Pharmaceutical Sciences,第18版,A.R.Gennaro编,Mack Publishing Company,1990中阐述。
所述药物组合物可以是液体形式或是冻干或冷冻干燥形式,并且可包含一种或多种冻干保护剂、赋形剂、表面活性剂、高分子量结构添加剂和/或膨胀剂(参见,例如,美国专利6,685,940、6,566,329和6,372,716)。在一个实施方案中,包含冻干保护剂,其为非还原糖,如蔗糖、乳糖或海藻糖。通常包含的冻干保护剂的量使得经重建后,所得制剂将是等渗的,尽管高渗或略微低渗的制剂也可能是合适的。另外,冻干保护剂的量应足以防止蛋白质在冻干时不可接受的程度的降解和/或聚集。预冻干制剂中的糖(例如,蔗糖、乳糖、海藻糖)的示例性冻干保护剂浓度为大约10mM至大约400mM。在另一个实施方案中,包含表面活性剂,例如,非离子型表面活性剂和离子型表面活性剂,如聚山梨醇酯(例如,聚山梨醇酯20、聚山梨醇酯80);泊洛沙姆(例如,泊洛沙姆188);聚(乙二醇)苯基醚(例如,Triton);十二烷基硫酸钠(SDS);月桂基硫酸钠;辛基糖苷钠(sodium octyl glycoside);月桂基-、肉豆蔻基-、亚油基-或硬脂基-磺基甜菜碱;月桂基-、肉豆蔻基-、亚油基-或硬脂基-肌氨酸;亚油基-、肉豆蔻基-或鲸蜡基-甜菜碱;月桂酰胺基丙基-、椰油酰胺基丙基(cocamidopropyl)-、亚油酰胺基丙基-、肉豆蔻酰胺基丙基-、棕榈酰胺基丙基-或异硬脂酰胺基丙基-甜菜碱(例如,月桂酰胺基丙基);肉豆蔻酰胺基丙基-、棕榈酰胺基丙基-或异硬脂酰胺基丙基-二甲基胺;甲基椰油基牛磺酸钠或甲基油酰基(ofeyl)牛磺酸二钠;和MONAQUAT
组合物可以适合于肠胃外给药。示例性组合物适合于通过技术人员可用的任何途径注射或输注到动物中,该途径例如是关节内、皮下、静脉内、肌肉内、腹膜内、脑内(脑实质内)、脑室内、肌肉内、眼内、动脉内或病灶内途径。肠胃外制剂通常是无菌的、无热原的、等渗的水溶液,任选地含有药学上可接受的防腐剂。
非水性溶剂的实例为丙二醇、聚乙二醇、植物油如橄榄油和可注射有机酯如油酸乙酯。水性载体包括水、醇溶液/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外媒介物包括氯化钠溶液、林格氏(Ringers’)右旋糖、右旋糖和氯化钠、乳酸林格氏液或不挥发油。静脉内媒介物包括流体和营养补充剂、电解质补充剂,例如基于林格氏右旋糖的那些,等等。还可以存在防腐剂和其它添加剂,例如抗微生物剂、抗氧化剂、螯合剂、惰性气体等。总体上参见Remington's Pharmaceutical Science,第16版,Mack编,1980。
本文所述的药物组合物可以以提供产品的局部浓度(例如,团注、贮库型(depot)效果)和/或提高在特定局部环境中的稳定性或半衰期的方式配制用于控制递送或持续递送。该组合物可包含本文公开的抗体药物缀合物与以下成分的制剂:诸如聚乳酸、聚乙醇酸等聚合化合物的颗粒制品,以及诸如可生物降解的基质、可注射微球、微囊颗粒、微囊、可生物蚀解的颗粒珠、脂质体等试剂,和提供活性剂的控制释放或持续释放的可植入递送装置,其随后可以作为贮库型注射剂递送。用于配制此类持续递送或控制递送装置的技术是已知的,并且已经开发和使用了多种聚合物用于药物的控制释放和递送。这类聚合物一般是可生物降解的和生物相容的。聚合物水凝胶,包括通过对映体聚合物或多肽片段的复合而形成的聚合物水凝胶,以及具有温度或pH敏感性质的水凝胶,由于参与捕获生物活性蛋白剂(例如,包含超长CDR3的抗体)的温和和水性条件,可以是提供药物贮库型效果所期望的。参见,例如,WO93/15722中用于递送药物组合物的控制释放多孔聚合物微粒的描述。用于此目的的合适的材料包括聚交酯(参见,例如,美国专利3,773,919),聚-(a-羟基羧酸)的聚合物,如聚-D-(-)-3-羟基丁酸(EP 133,988A)、L-谷氨酸和γ乙基-L-谷氨酸酯的共聚物(Sidman等人,Biopolymers,22:547-556(1983))、聚(2-羟乙基-甲基丙烯酸酯)(Langer等人,J.Biomed.Mater.Res.,15:167-277(1981),和Langer,Chem.Tech.,12:98-105(1982))、乙烯乙酸乙烯酯或聚-D(-)-3-羟基丁酸。其他可生物降解的聚合物包括聚(内酯)、聚(缩醛)、聚(原酸酯)和聚(原碳酸酯)。持续释放组合物还可以包含脂质体,其可以通过本领域已知的若干种方法中的任一种(参见,例如,Eppstein等人,Proc.Natl.Acad.Sci.USA,82:3688-92(1985))制备。载体本身或其降解产物在靶组织内应当是无毒的,并且不应进一步加剧病情。这可以在目标病症的动物模型中,或者如果此类模型无法获得,则在正常动物中,通过常规筛查来确定。用于持续释放的重组蛋白的微囊化已经使用人生长激素(rhGH)、干扰素-(rhIFN-)、白介素-2和MN rgp120成功地进行。Johnson等人,Nat.Med.,2:795-799(1996);Yasuda,Biomed.Ther.,27:1221-1223(1993);Hora等人,Bio/Technology.8:755-758(1990);Cleland,"Design and Production of Single Immunization VaccinesUsing Polylactide Polyglycolide Microsphere Systems,"于Vaccine Design:TheSubunit and Adjuvant Approach,Powell和Newman编,(Plenum Press:New York,1995),pp.439-462;WO 97/03692、WO 96/40072、WO 96/07399;和美国专利5,654,010。由于其生物相容性和宽范围的可生物降解性质,使用聚-乳酸-共-乙醇酸(PLGA)聚合物开发这些蛋白质的持续释放制剂。PLGA的降解产物乳酸和乙醇酸可以在人体内快速清除。而且,该聚合物的可降解性可以取决于其分子量和组成。Lewis,"Controlled release of bioactiveagents from lactide/glycolide polymer,"于:M.Chasin和R.Langer(编),Biodegradable Polymers as Drug Delivery Systems(Marcel Dekker:New York,1990),pp.1-41。持续释放组合物的其它实例包括,例如,EP58,481A,美国专利3,887,699,EP 158,277A,加拿大专利1176565,U.Sidman等人,Biopolymers 22,547[1983],R.Langer等人,Chem.Tech.12,98[1982],Sinha等人,J.Control.Release 90,261[2003],Zhu等人,Nat.Biotechnol.18,24[2000],和Dai等人,Colloids Surf B Biointerfaces 41,117[2005]。
也考虑生物粘附性聚合物用于本公开的组合物中或与本公开的组合物一起使用。生物粘附性材料是能够附着到生物基底上保持延长的时间段的合成的和天然存在的材料。例如,卡波姆(Carbopol)和聚卡波非都是聚(丙烯酸)的合成交联衍生物。基于天然存在的物质的生物粘附性递送系统包括例如透明质酸,也称为乙酰透明质酸(hyaluronan)。透明质酸是由D-葡糖醛酸和N-乙酰基-葡糖胺的残基组成的天然存在的粘多糖。透明质酸见于脊椎动物的细胞外组织基质中,包括结缔组织中,以及滑液中和眼的玻璃体液和房水中。透明质酸的酯化衍生物已经用于生产用于递送的生物相容且可生物降解的微球(参见,例如,Cortivo等人,Biomaterials(1991)12:727-730;EP 517,565;WO 96/29998;Illum等人,J.Controlled Rel.(1994)29:133-141)。
可生物降解和不可生物降解的聚合基质均可用于递送本公开的组合物,并且这类聚合基质可包含天然或合成聚合物。可生物降解的基质是优选的。释放发生所经历的时间段取决于聚合物的选择。通常,经过数小时至3到12个月的时间段的释放是最理想的。可以用于形成可生物降解的递送系统的示例性合成聚合物包括:乳酸和乙醇酸的聚合物、聚酰胺、聚碳酸酯、聚亚烷基、聚亚烷基二醇、聚环氧烷、聚对苯二甲酸亚烷基酯、聚乙烯醇、聚乙烯基醚、聚乙烯基酯、聚乙烯基卤化物、聚乙烯吡咯烷酮、聚乙交酯、聚硅氧烷、聚酐、聚氨酯及其共聚物、聚(丁酸)、聚(戊酸)、烷基纤维素、羟烷基纤维素、纤维素醚、纤维素酯、硝基纤维素、丙烯酸酯和甲基丙烯酸酯的聚合物、甲基纤维素、乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羟丁基甲基纤维素、乙酸纤维素、丙酸纤维素、乙酸丁酸纤维素、乙酸邻苯二甲酸纤维素、羧乙基纤维素、三乙酸纤维素、硫酸纤维素钠盐、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸乙酯)、聚(甲基丙烯酸丁酯)、聚(甲基丙烯酸异丁酯)、聚(甲基丙烯酸己酯)、聚(甲基丙烯酸异癸酯)、聚(甲基丙烯酸月桂酯)、聚(甲基丙烯酸苯酯)、聚(丙烯酸甲酯)、聚(丙烯酸异丙酯)、聚(丙烯酸异丁酯)、聚(丙烯酸十八烷基酯)、聚乙烯、聚丙烯、聚(乙二醇)、聚(环氧乙烷)、聚(对苯二甲酸乙二醇酯)、聚(乙烯醇)、聚乙酸乙烯酯、聚氯乙烯、聚苯乙烯和聚乙烯吡咯烷酮。示例性天然聚合物包括藻酸盐和其他多糖,包括葡聚糖和纤维素、胶原、其化学衍生物(化学基团如烷基、亚烷基的取代、添加,羟基化,氧化,和本领域技术人员常规进行的其他修饰)、白蛋白和其他亲水性蛋白质、玉米醇溶蛋白和其他谷醇溶蛋白和疏水性蛋白质、其共聚物和混合物。通常,这些材料通过酶水解或在体内暴露于水,通过表面或本体溶蚀而降解。聚合物任选地为水凝胶的形式(参见,例如WO 04/009664,WO 05/087201,Sawhney等人,Macromolecules,1993,26,581-587),该水凝胶可以吸收高达其在水中的重量的大约90%,并进一步任选地与多价离子或其他聚合物交联。
递送系统还包括作为脂质的非聚合物体系,该脂质包括甾醇如胆固醇、胆固醇酯和脂肪酸或中性脂肪如甘油单酯、甘油二酯和甘油三酯;水凝胶释放体系;硅橡胶体系;肽基体系;蜡涂层;使用常规粘合剂和赋形剂的压缩片剂;部分融合的植入物;等等。具体的实例包括但不限于:(a)溶蚀体系,其中产物以某种形式包含在基质内,例如在美国专利4,452,775、4,675,189和5,736,152中描述的那些,和(b)扩散体系,其中产物以受控的速率从聚合物中透过,例如在美国专利3,854,480、5,133,974和5,407,686中所描述的。包含产物的脂质体可以通过已知的方法制备,例如(DE 3,218,121;Epstein等人,Proc.Natl.Acad.Sci.USA,82:3688-3692(1985);Hwang等人,Proc.Natl.Acad.Sci.USA,77:4030-4034(1980);EP 52,322;EP 36,676;EP 88,046;EP 143,949;EP 142,641;JP 83-118008;美国专利4,485,045和4,544,545;和EP 102,324)。
备选地或另外地,所述组合物可以通过向患区中植入本文公开的抗体药物缀合物已经吸附或包封于其上的膜、海绵或其他合适的物质而局部施用。当使用植入装置时,该装置可被植入到任何合适的组织或器官中,并且本文公开的抗体药物缀合物的递送可以经由团注或经由连续施用或经由采用连续输注的导管通过该装置直接进行。
包含本文公开的抗体药物缀合物的药物组合物可被配制用于吸入,例如作为干粉。也可以在液化推进剂中配制吸入溶液以供气雾剂递送。在又一种制剂中,溶液可以雾化。用于肺给药的其他药物组合物包括例如在WO 94/20069中描述的那些,该申请公开了化学修饰的蛋白质的肺递送。对于肺递送,颗粒大小应适合于递送至肺远侧。例如,颗粒大小可以是1μm至5μm;但是,可以使用更大的颗粒,例如,如果每个颗粒是相当多孔的话。
某些含有本文公开的抗体药物缀合物的制剂可以口服施用。以此方式施用的制剂可以用或不用在固体剂型如片剂和胶囊的配混中惯常使用的那些载体来配制。例如,可将胶囊设计成在胃肠道中的某点处释放制剂的活性部分,这时生物利用度最大化且系统前降解最小化。可以包括另外的试剂以促进选择性结合剂的吸收。还可以使用稀释剂、调味剂、低熔点蜡、植物油、润滑剂、悬浮剂、片剂崩解剂和粘合剂。
另一种制品可包含与适合制备片剂的无毒赋形剂混合的有效量的本文公开的抗体药物缀合物。通过将片剂溶解在无菌水或另外的适当媒介物中,可以以单位剂量形式制备溶液。合适的赋形剂包括但不限于惰性稀释剂,如碳酸钙、碳酸钠或碳酸氢钠、乳糖或磷酸钙;或粘合剂,如淀粉、明胶或阿拉伯胶;或润滑剂,如硬脂酸镁、硬脂酸或滑石。
基于本公开内容和配制技术的常识,取决于拟定的施用途径、递送形式和所需剂量,可以确定合适的和/或优选的药物制剂。无论施用方式如何,可以根据患者体重、体表面积或器官大小来计算有效剂量。对于涉及本文描述的各种制剂的治疗,用于确定其适当剂量的计算的进一步细化在本领域中常规进行,并且处于本领域中常规实施的任务的范围内。适当的剂量可以通过使用合适的剂量-响应数据来确定。
VIII.与抗体-药物缀合物的组合
在一些实施方案中提供了一种组合物,其包含与抗体-药物缀合物组合的本公开的缀合物。在一些实施方案中,该抗体-药物缀合物包含TM4SF1结合蛋白,如抗TM4SF1抗体或其抗原结合片段。TM4SF1结合蛋白可以如任何上述实施方案所述,并且所述ADC包含一种或多种药剂(例如1、2、3或4种或更多种药剂),如治疗剂,所述药剂在治疗与病理性血管生成相关的病症如癌症中,与TM4SF1结合蛋白以累加方式或以协同方式作用,例如杀伤或抑制肿瘤细胞(TC)和/或肿瘤血管结构内皮细胞(EC)。例如,该治疗剂可以是生物活性部分,如细胞毒性剂、化疗剂、蛋白质、肽、抗体、生长抑制剂、抗激素剂或其任意组合。
可以与ADC的TM4SF1结合蛋白直接或间接缀合的微管蛋白抑制剂的实例包括不限于聚合抑制剂(例如长春花碱、长春新碱、长春瑞滨、长春氟宁、念珠藻素52(cryptophycin52)、软海绵素(hallchondrin)、多拉司他汀、可结合微管蛋白的长春结构域的hemiasterlin;秋水仙碱、考布他汀、2-甲氧基-雌二醇、可结合微管蛋白的秋水仙碱结构域的E7010;解聚抑制剂,如紫杉醇、多西他赛、埃博霉素(epothilon)、可结合紫杉烷位点的盘皮海绵内酯(discodermolide))。
可以与ADC的TM4SF1结合蛋白直接或间接缀合的化疗剂的实例包括但不限于氨甲蝶呤、阿霉素(adriamicin)、长春花生物碱(长春新碱、长春花碱、依托泊苷)、多柔比星、美法仑、丝裂霉素C、苯丁酸氮芥、柔红霉素或其他嵌入剂;酶及其片段,如核分解酶、抗生素、以及毒素,如细菌、真菌、植物或动物来源的小分子毒素或酶活性毒素,包括它们的片段和/或变体。可使用的酶活性毒素及其片段包括白喉(diphtheria)A链、白喉毒素的非结合性活性片段、外毒素(exotoxin)A链(来自铜绿假单胞菌(Pseudomonas aeruginosa))、篦麻毒素(ricin)A链、相思豆毒蛋白(abrin)A链、蒴莲根毒素(modeccin)A链、α-帚曲霉素(alpha-sarcin)、油桐(Aleurites fordii)蛋白、石竹素(dianthin)蛋白、美商陆(Phytolacaamericana)蛋白(PAPI、PAPII和PAP-S)、苦瓜(momordica charantia)抑制剂、麻疯树毒蛋白(curcin)、巴豆毒蛋白(crotin)、肥皂草(sapaonaria officinalis)抑制剂、白树毒素(gelonin)、mitogellin、局限曲菌素(restrictocin)、酚霉素(phenomycin)、伊诺霉素(enomycin)和单端孢霉烯(tricothecene)。
另外,多种放射性核素可用于与ADC的TM4SF1结合蛋白缀合。实例包括At211、I131、I125、Y90、Re186、Sm153、Bi212、P32和Lu的放射性同位素。或者,本公开的TM4SF1结合蛋白可缀合至一个或较小的分子毒素,如加利车霉素(calicheamicin)、美登木素生物碱(maytansinoid)、多拉司他汀(dolastatin)、aurostatin、单端孢霉烯和CC1065,并且本文还涉及这些毒素的具有毒素活性的衍生物。在各个实例中,可与ADC的TM4SF1结合蛋白缀合的其他治疗剂包括BCNU、链佐星(streptozoicin)、长春新碱和5-氟尿嘧啶等。
在一些实施方案中,用于缀合的诊断剂是标记物,如荧光标记、发色标记或放射性标记。因此,标记物可用于检测目的,并且可以是荧光化合物、酶、辅基、发光物质、生物发光物质或放射性物质。例如,放射性标记可包含用于闪烁照相研究的放射性原子,例如Tc99m或I123,或用于核磁共振(NMR)成像(也被称为磁共振成像,MRI)的自旋标记,如碘-123、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。
一种或多种药剂(例如治疗剂和/或诊断剂)可以与ADC的TM4SF1结合蛋白直接缀合(例如通过直接共价或非共价相互作用的方式),以使药剂直接地与该蛋白质缀合。药剂可以例如通过直接肽键而直接缀合至本公开的结合蛋白。在其他情况下,直接缀合是通过直接非共价相互作用,如ADC的TM4SF1结合蛋白与特异性结合该TM4SF1结合蛋白的药剂(例如抗体药剂)之间的相互作用。
IX.多核苷酸
在一些实施方案中,还提供了编码如本文所述的TM4SF1结合蛋白如抗TM4SF1抗体或其抗原结合片段的多核苷酸。在一些实施方案中,该多核苷酸分子以DNA构建体的形式提供。在其他实施方案中,该多核苷酸分子以信使RNA转录物的形式提供。
在一些实例中,本公开的抗TM4SF1抗体包含由SEQ ID NO:4、16、28、40、52、64或76中任一个所示的核酸序列编码的重链可变域。在一些实例中,本公开的抗TM4SF1抗体包含由SEQ ID NO:10、22、34、46、58、70或82中任一个所示的核酸序列编码的轻链可变域。
在一些实施方案中,提供了针对在宿主细胞,例如细菌如大肠杆菌或真核细胞如CHO细胞中表达进行密码子优化的核酸序列。在一些实例中,核酸序列针对在CHO细胞中表达进行密码子优化。在一些实例中,本公开的抗TM4SF1抗体包含由SEQ ID NO:5、17、29、41、53、65或77中任一个所示的密码子优化的核酸序列编码的重链可变域。在一些实例中,本公开的抗TM4SF1抗体包含由SEQ ID NO:11、23、35、47、59、71或83中任一个所示的密码子优化的核酸序列编码的轻链可变域。在某些情况下,SEQ ID NO:5、17、29、41、53、65或77中任一个的核酸序列是针对在CHO细胞中表达进行密码子优化的核酸序列。在某些情况下,SEQ IDNO:11、23、35、47、59、71或83中任一个的核酸序列是针对在CHO细胞中表达进行密码子优化的核酸序列。
多核苷酸分子通过已知方法构建,诸如通过将编码结合蛋白的基因并入遗传构建体中,连接至合适的启动子以及可选的合适的转录终止子,并且在细菌或其他适当表达系统如CHO细胞中表达该遗传构建体。根据所采用的载体系统和宿主,可使用任何数目的合适的转录和翻译元件,包括组成型和诱导型启动子。选择启动子使其驱动多核苷酸在相应宿主细胞中的表达。
在一些实施方案中,将本文所述的多核苷酸插入载体中,优选表达载体中,这代表进一步的实施方案。该重组载体可根据已知方法来构建。特别感兴趣的载体包括质粒、噬菌粒、噬菌体衍生物、病毒(virii)(例如,逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒、慢病毒等)和粘粒。
可利用多种表达载体/宿主系统,以包含并表达编码所述TM4SF1结合蛋白的多肽的多核苷酸。表达载体的实例是用于在大肠杆菌中表达的pSKK(Le Gall等人,J ImmunolMethods.(2004)285(1):111-27),或用于在哺乳动物细胞中表达的pcDNA5(Invitrogen)。
因此,在一些实施方案中,如本文所述的TM4SF1结合蛋白通过以下步骤产生:将编码如上所述蛋白质的载体引入宿主细胞中,并在允许蛋白质结构域表达的条件下培养所述宿主细胞,可将其分离并任选地进一步纯化。
X.治疗方法
本公开进一步提供了一种抑制内皮细胞(EC)所特有的细胞-细胞相互作用的方法,所述相互作用例如是但不限于EC-EC、EC-间充质干细胞、EC-成纤维细胞、EC-平滑肌细胞、EC-肿瘤细胞、EC-白细胞、EC-脂肪细胞和EC-神经元细胞相互作用。在某些实施方案中,本公开的抗TM4SF1抗体-寡核苷酸缀合物可用于治疗具有特征在于异常EC-细胞相互作用的病理学的任何人类疾病或病症。在某些实施方案中,该EC-细胞相互作用是EC-白细胞相互作用,其中使用对EC-白细胞相互作用的抑制来预防炎症。在一些实施方案中,该EC-细胞间相互作用是EC-肿瘤细胞相互作用,其中使用对EC-肿瘤细胞相互作用的抑制来预防、治疗和/或减缓癌症的进展。
在其他实施方案中,本公开提出了一种治疗或预防受试者的疾病或病症的方法,其中该疾病或病症的特征在于异常内皮细胞(EC)-细胞相互作用,所述方法包括施用如本文所述的抗体或其抗原结合片段。在某些实施方案中,该EC-细胞相互作用包括EC-间充质干细胞、EC-成纤维细胞、EC-平滑肌细胞、EC-肿瘤细胞、EC-白细胞、EC-脂肪细胞和EC-神经元细胞相互作用中的一种或多种。在示例性实施方案中,该疾病是炎性疾病或病症,并且本公开的抗体和片段用于抑制EC-白细胞相互作用。在另一示例性实施方案中,该疾病或病症选自炎性疾病或癌症。白细胞向血管内皮的粘附是炎性过程的标志。因此,在一个实施方案中,本公开的包含与RNA分子缀合的抗TM4SF1抗体或其抗原结合片段的抗体-RNA缀合物用来治疗其中抑制白细胞向内皮细胞的附着或抑制白细胞跨内皮的变移有助于治疗的炎性疾病(参见例如Rychly等人,Curr Pharm Des.2006;12(29):3799-806,该文献通过引用整体并入本文)。实例包括但不限于脓毒症、炎性肠病、银屑病或多发性硬化。
每年,仅在美国就有约50万患者死于癌症。肿瘤转移导致这些死亡中的约90%。没有阻断转移的疗法是已知的。本公开提供了包含与RNA分子缀合的抗TM4SF1抗体及其抗原结合片段的抗体-RNA缀合物,所述缀合物可基于对由新颖靶标TM4SF1介导的肿瘤细胞(TC)-内皮细胞(EC)相互作用的免疫阻断来治疗癌症并抑制转移性细胞。
如上所述,TM4SF1是一种四跨膜蛋白样细胞表面小糖蛋白,最初作为在TC侵袭和转移中具有作用的TC抗原被发现。TM4SF1由TC和EC选择性表达。在小鼠与人中,TM4SF1均以低水平在对正常组织进行供给的血管EC上表达。已经表明,TM4SF1以约10-20倍高的水平在内衬于对许多人类癌症进行供给的血管的血管EC上表达,并且以等同的高水平在培养的EC上表达。富含TM4SF1的微域(TMED)募集细胞表面蛋白,如整联蛋白,以帮助形成nanopodia,即从细胞表面延伸并且介导细胞-细胞相互作用的薄膜通道。因此,在某些情况下,本文所述的抗TM4SF1抗体和片段干扰nanopodia介导的相互作用,并且抑制TC外渗所必需的TC与EC的相互作用。
可将本文所述的TM4SF1结合蛋白、抗体-寡核苷酸缀合物或药物组合物中的任何一种配制用于治疗患有与病理性血管生成相关的病症(例如,癌症,如乳腺癌、卵巢癌、肾癌、结直肠癌、肝癌、胃癌、黑素瘤、多发性骨髓瘤、白血病、淋巴瘤、前列腺癌、结肠癌、神经母细胞瘤、神经胶质瘤、胶质母细胞瘤、肉瘤、间皮瘤、视网膜母细胞瘤、甲状腺癌、胰腺癌、类癌、头颈癌、胃癌、尿路上皮癌、睾丸癌、子宫内膜癌、宫颈癌、皮肤癌、膀胱癌、垂体癌、嗜铬细胞瘤、食管癌和肺癌;肥胖症;黄斑变性;糖尿病视网膜病;银屑病;类风湿性关节炎;细胞免疫;和酒渣鼻)的受试者(例如,人)。在一些实施方案中,该淋巴瘤是B细胞淋巴瘤或伯基特淋巴瘤。在一些实施方案中,该皮肤癌是Merkel细胞皮肤癌或Merkel细胞癌。在一些实施方案中,该肺癌是非小细胞肺癌或肺腺癌。在一些实施方案中,该肉瘤是小儿横纹肌肉瘤、软组织肉瘤、骨肉瘤、多形肉瘤、平滑肌肉瘤、脂肪肉瘤、尤因肉瘤或滑膜肉瘤。
TM4SF1在大多数上皮TC的表面上高度表达,并且还在内衬于肿瘤血管的EC上以及在培养的EC上高度表达。它在正常血管EC的表面上以约1/10-1/20低的水平表达。在小鼠模型中,肿瘤向肺的转移与EC和TC两者上的TM4SF1表达相关。转移需要TC初始附着至血管EC上,它们随后跨越EC迁移进入肺或其他转移部位。以下实施例显示,在一些情况下,本公开的抗TM4SF1抗体或抗体-寡核苷酸缀合物在培养中干扰TC-EC相互作用,并且还可在体内抑制肿瘤转移。
因此,本公开的抗体和片段以及包含它们的抗体-寡核苷酸缀合物可用于阻断转移中的一个或两个最早步骤(参见图1),即,TC向血管EC的附着和/或TC跨越EC的变移,由此预防高危癌症患者中的转移或大大减少转移的数目。
本公开还提供了一种用于预防转移的方法。人类肿瘤通常在生长的早期阶段使TC脱落到血液和淋巴中;因此,对原发性肿瘤的早期治疗不能提供转移尚未发生的保证。因此,TM4SF1的免疫阻断可用于治疗或预防血液性转移或者治疗或预防淋巴性转移。
在一些实施方案中,本公开的方法涉及抑制受试者中的转移性细胞。在一个实施方案中,受试者患有癌症,例如与转移相关的癌症或已转移的癌症。在其他实施方案中,受试者已针对癌症进行了治疗,并且处于缓解期或部分缓解期,其中施用本文所述的抗TM4SF1抗体或片段的益处是它们起到预防转移以及维持缓解或部分缓解的作用。
在某些实施方案中,本公开提供了一种治疗具有发生转移的较大风险的个体的方法,其中施用本文所述的抗TM4SF1抗体-寡核苷酸缀合物(如抗TM4SF1抗体-RNA缀合物)和片段可用于抑制转移或延迟转移的发作。
本公开中包括一种通过向有需要的受试者施用抗TM4SF1抗体-寡核苷酸缀合物(如抗TM4SF1抗体-RNA缀合物)来阻断肿瘤转移,特别是向肺的转移的方法。在一些实例中,抗TM4SF1抗体是人抗TM4SF1抗体,在本文中也称为抗hTM4SF1抗体。在某些实施方案中,所述方法包括向有需要的受试者施用有效量的抗TM4SF1抗体-寡核苷酸缀合物(如抗TM4SF1抗体-RNA缀合物),其中所述有效量的所述抗体阻止肿瘤细胞(TC)附着于血管内皮细胞(EC)以及跨血管内皮细胞(EC)迁移。
在某些实施方案中,向患有癌症或处于转移风险下的受试者施用本公开的缀合物,如抗TM4SF1抗体-RNA缀合物,以使剂量和频率维持长期TM4SF1免疫阻断。给药方案将通过以足以使在受试者的正常血管EC上表达的TM4SF1饱和的量向受试者施用缀合物,如抗TM4SF1抗体-RNA缀合物,来最大程度地抑制TM4SF1介导的转移。
在某些实施方案中,与RNA分子缀合的缀合物如抗TM4SF1抗体-RNA缀合物或其抗原结合片段的有效施用量是足以在一周时实现循环抗体浓度>1μg/ml的量。
在某些实施方案中,与RNA分子缀合的缀合物如抗TM4SF1抗体-RNA缀合物或其抗原结合片段的有效施用量是足以持续约1个月连续维持抗体的血清浓度等于或高于1μg/ml的量。
在一个实施方案中,本公开提供了一种治疗或预防人害受试者中的转移的方法,该方法包括向受试者施用有效量的与RNA分子缀合的抗TM4SF1抗体缀合物或其抗原结合片段,其中该抗体-RNA缀合物或其抗原结合片段的所述有效量包括1至80mg/kg的量的所述抗体缀合物或其抗原结合片段。
本公开进一步提供了一种治疗或预防人类受试者中的感染性疾病的方法,该方法包括向受试者施用有效量的本公开的缀合物,如抗TM4SF1抗体-mRNA缀合物。在一些实施方案中,该抗TM4SF1抗体-mRNA缀合物是预防感染性疾病的预防性疫苗。在一些实施方案中,该抗TM4SF1抗体-mRNA缀合物的mRNA翻译成病毒蛋白质,以模拟天然的病毒感染并引发免疫应答。在一些实施方案中,该抗TM4SF1抗体-mRNA缀合物的mRNA翻译成巨细胞病毒(CMV)蛋白、人变性肺病毒(HMPV)蛋白、副流感病毒3(PIV3)蛋白、流感病毒蛋白、寨卡病毒蛋白或基孔肯雅病毒(CHIKV)蛋白。在一些实施方案中,该流感蛋白是血凝素10(H10)蛋白或H7蛋白。在一些实施方案中,该感染性疾病是CMV、HPMV、PIV3、流感、寨卡病毒或基孔肯雅病毒。
在一个实施方案中,本公开进一步提供了一种治疗或预防人类受试者中的心血管疾病的方法,其包括向受试者施用有效量的本公开的缀合物,如抗TM4SF1抗体-mRNA缀合物。在一些实施方案中,抗TM4SF1抗体-mRNA缀合物的mRNA翻译成血管内皮生长因子(VEGF)。在一些实施方案中,编码VEGF的抗TM4SF1抗体-mRNA导致血管生成并改善血液供应。
在某些实施方案中,本公开进一步提供了一种治疗或预防人类受试者中的囊性纤维化的方法,其包括向受试者施用有效量的抗TM4SF1抗体-mRNA缀合物。在一些实施方案中,抗TM4SF1抗体-mRNA缀合物的mRNA翻译成囊性纤维化跨膜传导调节物(CFTR)蛋白。在囊性纤维化中,由于导致异常折叠并导致快速降解的突变,CFTR蛋白缺乏。在一些实施方案中,抗TM4SF1抗体-mRNA缀合物提供CFTR蛋白的功能性表达。
用于治疗性使用本公开的缀合物如本公开的抗体-RNA缀合物的施用模式可以是将抗体递送至宿主的任何适当途径,如肠胃外施用,例如真皮内、肌肉内、腹膜内、静脉内或皮下、经肺、经粘膜(口服、鼻内、阴道内、经直肠),使用呈片剂、胶囊、溶液、粉剂、凝胶、颗粒形式的制剂;以及容纳于注射器、植入装置、渗透泵、药筒、微型泵中;或为熟练技术人员所了解以及本领域中已知的其他手段。部位特异性施用可通过例如关节内、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、大肠内、宫颈管内、胃内、肝内、心脏内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸内、子宫内、血管内、膀胱内、病变内、经阴道、经直肠、经颊、舌下、鼻内或经皮递送来实现。
在一些实施方案中,本公开的缀合物,如本公开的抗体-RNA缀合物,可通过任何合适的途径向受试者施用,例如通过静脉内(i.v.)输注或团注以肠胃外方式、以肌肉内方式或以皮下方式或以腹膜内方式。静脉内输注可以经例如15、30、60、90、120、180或240分钟,或1、2、3、4、5、6、7、8、9、10、11或12小时来给予。在一些实施方案中,给予受试者的剂量是约0.005mg至约100mg/kg,例如约0.05mg至约30mg/kg或约5mg至约25mg/kg,或约4mg/kg、约8mg/kg、约16mg/kg或约24mg/kg,或例如约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9或10mg/kg。在某些实施方案中,给予受试者的剂量是例如约15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90或100mg/kg。在一些情况下,给予受试者的本公开的抗体-RNA缀合物的剂量可以是通过静脉内给药的约0.1mg/kg至10mg/kg。在一些情况下,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约0.1mg/kg至10mg/kg。在一些情况下,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过静脉内给药的约0.1mg/kg。在一些情况下,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约0.1mg/kg。在一些实施方案中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过静脉内给药的约0.3mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约0.3mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过静脉内给药的约1.0mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约1.0mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过静脉内给药的约3.0mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约3.0mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量可以是通过静脉内给药的约10.0mg/kg。在一些实例中,给予受试者的本公开的缀合物如本公开的抗体-RNA缀合物的剂量是通过皮下给药的约10.0mg/kg。
在某些实施方案中,给予本公开的缀合物,如本公开的抗体-RNA缀合物的固定单位剂量,例如50、100、200、500或1000mg,或者剂量可基于患者的表面积,例如500、400、300、250、200或100mg/m2。在一些情况下,施用1至8次剂量(例如1、2、3、4、5、6、7或8次)以治疗患者,但可给予9、10、11、12、13、14、15、16、17、18、19、20次或更多次剂量。
在一些实施方案中,在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更久之后,重复施用本文所述的本公开的缀合物,如本公开的抗体-RNA缀合物。如同长期给药一样,重复治疗过程也是可能的。重复给药以相同剂量或以不同剂量进行。在一些实例中,本文所述的本公开的缀合物如本公开的抗体-RNA缀合物通过静脉内输注以8mg/kg或以16mg/kg在每周间隔下施用8周,随后以8mg/kg或以16mg/kg每两周进行施用,再持续16周,随后以8mg/kg或以16mg/kg每四周进行施用。或者,在一些实施方案中,本文所述的本公开的缀合物如本公开的抗体-RNA缀合物以0.1mg/kg至约10mg/kg在每周间隔下施用17周。例如,在一些情况下,在启动治疗之后,在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40天中的至少一天,或替代地,在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周中的至少一周,或以其任意组合,使用每24、12、8、6、4或2小时一次的单剂量或分剂量,或以其任意组合,以每天约0.1-100mg/kg,如0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg的量,以每日剂量提供本公开的抗体。在一些实施方案中,预防性施用本文所述的本公开的缀合物如本公开的抗体-RNA缀合物,以降低发生炎性疾病如RA、银屑病关节炎或银屑病的风险,延迟炎性疾病如RA、银屑病关节炎或银屑病的进展中的事件的发生。在一些实例中,本公开的缀合物如本公开的抗体-RNA缀合物被冻干以进行储存,并且在使用之前在合适的载体中重建。在一些情况下,本公开的缀合物如本公开的抗体-RNA缀合物以无菌冷冻液体形式提供于具有塞子和伴有翻转型盖子的铝密封件的玻璃小瓶中。在一些实例中,每个小瓶含有3.3mL50mg/mL的抗体-RNA缀合物在10mM组氨酸、8.5%(w/v)蔗糖和0.04%(w/v)聚山梨醇酯80的制剂(pH 5.8)中的溶液(包括10%过量灌装)。在一些实例中,小瓶不含防腐剂,并且用于单次使用。小瓶可冷冻并避光保存。为了制备用于静脉内施用的抗体-RNA缀合物,在一些实例中,本公开的缀合物如抗体-RNA缀合物制剂在用无菌稀释剂稀释之前用0.22微米过滤器过滤。在一些实例中,使用管线内0.22微米过滤器,经至少30分钟的时期,通过静脉内输注来施用多达约100mL的体积的稀释的本公开的缀合物,如稀释的抗体-RNA缀合物。或者,在一些实施方案中,以1或2次皮下注射约3.3mL的50mg/mL抗体-RNA缀合物的方式施用本公开的缀合物,如抗体-RNA缀合物。皮下注射部位可以例如在腹部区域内。
XI.药物组合物
本公开的TM4SF1结合蛋白(例如,抗TM4SF1抗体或其抗原结合片段)和本公开的抗体-寡核苷酸缀合物(如抗TM4SF1抗体-RNA或DNA缀合物)或编码它们的多核苷酸中的任何一种可以包含在组合物(例如药物组合物)中。本公开的药物组合物可以进一步包含药学上可接受的载体、赋形剂或稀释剂。
如本文所用的术语“药物组合物”是指含有与药学上可接受的载体一起配制的本文所述的TM4SF1结合蛋白,并且在政府监管机构批准下作为用于治疗哺乳动物疾病的治疗方案的一部分制造或销售的组合物。例如,可以将药物组合物配制成以单位剂型(例如,片剂、胶囊、囊片、软胶囊(gel cap)或糖浆)口服给药;局部给药(例如,作为乳膏、凝胶、洗剂或软膏);静脉内给药(例如,作为无颗粒栓子的无菌溶液并在适合静脉内使用的溶剂系统中);或本文所述的其他任何制剂。
如本文所用的术语“药学上可接受的载体”是指对于所治疗的哺乳动物(例如人)在生理学上可接受,同时维持与其一起施用的蛋白质的治疗性质的载体。一种示例性的药学上可接受的载体为生理盐水。其他生理学上可接受的载体及其制剂是本领域技术人员已知的,并且例如在通过引用并入本文的Remington’s Pharmaceutical Sciences(第18版,A.Gennaro,1990,Mack Publishing Company,Easton,PA)中描述。
在一些实施方案中,含有如本文所述的含TM4SF1结合蛋白的缀合物的药物组合物被制备成溶液,在甘油、液体聚乙二醇中的分散体,及其在油中的任何组合,固体剂型、可吸入剂型、鼻内剂型、脂质体制剂、包含纳米颗粒的剂型、包含微粒的剂型、聚合物剂型,或它们的任意组合。
在一些实例中,药学上可接受的赋形剂是Handbook of PharmaceuticalExcipients,American Pharmaceutical Association(1986)中描述的赋形剂。合适的赋形剂的非限制性实例包括缓冲剂、防腐剂、稳定剂、粘合剂、压实剂、润滑剂、螯合剂、分散增强剂、崩解剂、调味剂、甜味剂、着色剂。
在一些实施方案中,赋形剂是缓冲剂。合适的缓冲剂的非限制性实例包括柠檬酸钠、碳酸镁、碳酸氢镁、碳酸钙和碳酸氢钙。在一些实施方案中,作为缓冲剂,碳酸氢钠、碳酸氢钾、氢氧化镁、乳酸镁、葡糖酸镁、氢氧化铝、柠檬酸钠、酒石酸钠、乙酸钠、碳酸钠、多磷酸钠、多磷酸钾、焦磷酸钠、焦磷酸钾、磷酸氢二钠、磷酸氢二钾、磷酸三钠、磷酸三钾、偏磷酸钾、氧化镁、氢氧化镁、碳酸镁、硅酸镁、乙酸钙、甘油磷酸钙、氯化钙、氢氧化钙和其他钙盐或其组合在本公开的药物组合物中使用。
在一些实施方案中,赋形剂包括防腐剂。合适的防腐剂的非限制性实例包括抗氧化剂,如α-生育酚和抗坏血酸盐,以及抗微生物剂,如对羟基苯甲酸酯、氯丁醇和苯酚。在一些实例中,抗氧化剂进一步包括但不限于EDTA、柠檬酸、抗坏血酸、丁羟甲苯(BHT)、丁羟茴醚(BHA)、亚硫酸钠、对氨基苯甲酸、谷胱甘肽、没食子酸丙酯、半胱氨酸、甲硫氨酸、乙醇和N-乙酰半胱氨酸。在一些情况下,防腐剂包括有效霉素A、TL-3、原钒酸钠、氟化钠、N-a-甲苯磺酰基-Phe-氯甲基酮、N-a-甲苯磺酰基-Lys-氯甲基酮、抑肽酶、苯甲基磺酰氟、氟磷酸二异丙酯、激酶抑制剂、磷酸酶抑制剂、胱天蛋白酶抑制剂、粒酶抑制剂、细胞粘附抑制剂、细胞分裂抑制剂、细胞周期抑制剂、脂质信号传导抑制剂、蛋白酶抑制剂、还原剂、烷化剂、抗微生物剂、氧化酶抑制剂或其他抑制剂。
在一些实施方案中,如本文所述的药物组合物包含粘合剂作为赋形剂。合适的粘合剂的非限制性实例包括淀粉、预胶化淀粉、明胶、聚乙烯吡咯烷酮、纤维素、甲基纤维素、羧甲基纤维素钠、乙基纤维素、聚丙烯酰胺、聚乙烯基噁唑烷酮、聚乙烯醇、C12-C18脂肪酸醇、聚乙二醇、多元醇、糖类、寡糖及其组合。在一些实例中,在药物制剂中使用的粘合剂选自淀粉,如马铃薯淀粉、玉米淀粉、小麦淀粉;糖,如蔗糖、葡萄糖、右旋糖、乳糖、麦芽糖糊精;天然树胶和合成树胶;明胶;纤维素衍生物,如微晶纤维素、羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羧甲基纤维素、甲基纤维素、乙基纤维素;聚乙烯吡咯烷酮(聚维酮);聚乙二醇(PEG);蜡类;碳酸钙;磷酸钙;醇类,如山梨醇、木糖醇、甘露醇,以及水,或其任意组合。
在一些实施方案中,如本文所述的药物组合物包含润滑剂作为赋形剂。合适的润滑剂的非限制性实例包括硬脂酸镁、硬脂酸钙、硬脂酸锌、氢化植物油、sterotex、聚氧乙烯单硬脂酸酯、滑石、聚乙二醇、苯甲酸钠、十二烷基硫酸钠、十二烷基硫酸镁和轻质矿物油。在一些实施方案中,在药物制剂中使用的润滑剂选自金属硬脂酸盐(如硬脂酸镁、硬脂酸钙、硬脂酸铝)、脂肪酸酯(如硬脂酰富马酸钠)、脂肪酸(如硬脂酸)、脂肪醇、山萮酸甘油酯、矿物油、石蜡、氢化植物油、亮氨酸、聚乙二醇(PEG)、金属十二烷基硫酸盐(如十二烷基硫酸钠、十二烷基硫酸镁)、氯化钠、苯甲酸钠、乙酸钠和滑石,或它们的组合。
在一些实施方案中,药物制剂包含分散增强剂作为赋形剂。在一些实例中,合适的分散剂的非限制性实例包括淀粉、海藻酸、聚乙烯吡咯烷酮、瓜尔胶、高岭土、膨润土、纯化木纤维素、羟基乙酸淀粉钠、同晶硅酸盐(isoamorphous silicate)和微晶纤维素作为高HLB乳化剂表面活性剂。
在一些实施方案中,如本文所述的药物组合物包含崩解剂作为赋形剂。在一些实施方案中,崩解剂是非泡腾崩解剂。合适的非泡腾崩解剂的非限制性实例包括淀粉如玉米淀粉、马铃薯淀粉、其预胶化和改性淀粉、甜味剂、粘土如膨润土、微晶纤维素、藻酸盐、羟基乙酸淀粉钠、树胶如琼脂、瓜尔胶、刺槐豆胶、刺梧桐胶、果胶和黄蓍胶。在一些实施方案中,崩解剂是泡腾崩解剂。合适的泡腾崩解剂的非限制性实例包括碳酸氢钠与柠檬酸的组合,以及碳酸氢钠与酒石酸的组合。
在一些实施方案中,赋形剂包括调味剂。在一些实例中,掺入外层的调味剂选自合成调味油和调味芳香剂;天然油;植物、叶、花和果实的提取物;及其组合。在一些实施方案中,调味剂可选自肉桂油;冬青油;薄荷油;三叶草油;干草油;茴香油;桉;香草;柑橘油,如柠檬油、橙油、葡萄油和葡萄柚油;以及水果香精,包括苹果、桃、梨、草莓、覆盆子、樱桃、李子、菠萝和杏的香精。
在一些实施方案中,赋形剂包括甜味剂。合适的甜味剂的非限制性实例包括葡萄糖(玉米糖浆)、右旋糖、转化糖、果糖及其混合物(当不用作载体时);糖精及其各种盐,如钠盐;二肽甜味剂,如阿斯巴甜;二氢查尔酮化合物、甘草甜素;甜叶菊(Stevia Rebaudiana)(甜菊甙);蔗糖的氯衍生物如三氯蔗糖;以及糖醇如山梨醇、甘露醇、木糖醇等。
在一些情况下,如本文所述的药物组合物包含着色剂。合适的着色剂的非限制性实例可包括食品、药物和化妆品着色剂(FD&C),药物和化妆品着色剂(D&C),以及外用药物和化妆品着色剂(Ext.D&C)。着色剂可用作染料或其相应的色淀。
在一些情况下,如本文所述的药物组合物包含螯合剂。在一些情况下,螯合剂是杀真菌螯合剂。实例包括但不限于:乙二胺-N,N,N',N'-四乙酸(EDTA);EDTA的二钠、三钠、四钠、二钾、三钾、二锂和二铵盐;EDTA的钡、钙、钴、铜、镝、铕、铁、铟、镧、镁、锰、镍、钐、锶或锌螯合物;反式-1,2-环己烷-N,N,N',N'-四乙酸一水合物;N,N-双(2-羟乙基)甘氨酸;1,3-二氨基-2-羟基丙烷-N,N,N',N'-四乙酸;1,3-二氨基丙烷-N,N,N',N'-四乙酸;乙二胺-N,N'-二乙酸;乙二胺-N,N'-二丙酸二盐酸盐;乙二胺-N,N'-双(亚甲基膦酸)半水合物;N-(2-羟乙基)乙二胺-N,N',N'-三乙酸;乙二胺-N,N,N',N'-四(亚甲基膦酸);O,O'-双(2-氨基乙基)乙二醇-N,N,N',N'-四乙酸;N,N-双(2-羟基苄基)乙二胺-N,N-二乙酸;1,6-六亚甲基二胺-N,N,N',N'-四乙酸;N-(2-羟乙基)亚氨基二乙酸;亚氨基二乙酸;1,2-二氨基丙烷-N,N,N',N'-四乙酸;次氮基三乙酸;次氮基三丙酸;次氮基三(亚甲基磷酸)的三钠盐;7,19,30-三氧杂-1,4,10,13,16,22,27,33-八氮杂双环[11,11,11]三十五烷六氢溴化物;或三乙烯四胺-N,N,N',N",N'",N'"-六乙酸。
还涉及组合产品,其包含本文公开的抗TM4SF1抗体和一种或多种其他抗微生物剂或抗真菌剂,例如,多烯如两性霉素B、两性霉素B脂质复合物(ABCD)、脂质体两性霉素B(L-AMB)和脂质体制霉菌素、唑类和三唑类如伏立康唑、氟康唑、酮康唑、伊曲康唑、泊沙康唑等;葡聚糖合酶抑制剂如卡泊芬净、米卡芬净(FK463)和V-棘白菌素(LY303366);灰黄霉素;烯丙胺类如特比萘芬;氟胞嘧啶或其他抗真菌剂,包括本文所述的那些。另外,预期肽可以与局部抗真菌剂如环吡酮胺、卤普罗近、托萘酯、十一烯酸酯、局部制霉菌素、阿莫罗芬、布替萘芬、萘替芬、特比萘芬和其他局部药剂组合。在一些情况下,药物组合物包含额外的药剂。在一些情况下,额外的药剂以治疗有效量存在于药物组合物中。
在普通的储存和使用条件下,如本文所述的药物组合物包含防腐剂以防止微生物的生长。在某些实例中,如本文所述的药物组合物不包含防腐剂。适合注射使用的药物形式包括无菌的水溶液或分散液和用于临时制备无菌可注射溶液或分散液的无菌粉末。药物组合物包含载体,该载体是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)和/或植物油,或其任意组合。例如,通过使用包衣,如卵磷脂,在分散体的情况下通过维持所需要的颗粒大小,以及通过使用表面活性剂,来保持适当的流动性。通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来阻止微生物的作用。在许多情况下,包含等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收剂,例如单硬脂酸铝和明胶,可以引起可注射组合物的延长吸收。
例如,对于在水溶液中的肠胃外施用,如有必要,将液体剂型适当地缓冲,并且用足够的盐水或葡萄糖使液体稀释剂等渗。液体剂型特别适用于静脉内、肌肉内、皮下、瘤内和腹膜内施用。在这方面,根据本公开内容,可采用的无菌水性介质是本领域技术人员已知的。例如,在某些情况下,将一个剂量溶解于1mL至20mL的等渗NaCl溶液中,并且添加至100mL至1000mL的流体(例如,碳酸氢钠缓冲盐水)中,或在建议的输注部位处注射。
在某些实施方案中,通过将所需量的免疫治疗剂与以上列举的各种其他成分(如果需要)一起并入合适的溶剂中,然后过滤除菌,来制备无菌可注射溶液。通常,通过将各种灭菌的活性成分掺入无菌媒介物中来制备分散体,该无菌媒介物含有基础分散介质和来自上文列举的那些成分中的所需其他成分。在一些情况下,本文公开的组合物被配制成中性或盐形式。药学上可接受的盐包括,例如,酸加成盐(通过蛋白质的游离氨基形成),并且该盐是用无机酸例如盐酸或磷酸,或有机酸如乙酸、草酸、酒石酸、扁桃酸等形成的。在一些情况下,通过游离羧基形成的盐衍生自无机碱,例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁,以及有机碱,如异丙胺、三甲胺、组氨酸、普鲁卡因等。在一些实施方案中,在配制后,药物组合物以与剂量制剂相容的方式和治疗有效的量施用。
在某些实施方案中,本公开的药物组合物包含有效量的如本文公开的抗TM4SF1抗体与药学上可接受的载体的组合。如本文所用的,“药学上可接受的”包括不干扰活性成分的生物活性的有效性并且/或者对其所施用至的患者无毒的任何载体。合适的药物载体的非限制性实例包括磷酸盐缓冲盐水溶液、水、乳液如油/水乳液、各种类型的润湿剂和无菌溶液。药学上相容的载体的其他非限制性实例可包括凝胶、生物可吸收的基质材料、含有免疫治疗剂的植入元件,或其他任何合适的媒介物、递送或分配工具或材料。这样的载体例如通过常规方法配制,并且以有效量施用于受试者。
XII.联合疗法
在某些实施方案中,本公开的方法包括在一种或多种另外的疗法之前、之后或与其联合地施用如本文公开的缀合物。所述另外的疗法的实例可包括但不限于化学疗法、放射疗法、抗癌剂或其任意组合。相对于所述缀合物的施用,所述另外的疗法可以同时或顺序地施用。在某些实施方案中,本公开的方法包括在一种或多种抗癌剂或癌症疗法之前、之后或与其联合地施用如本文公开的缀合物。抗癌剂包括但不限于化疗剂、放疗剂、细胞因子、免疫检查点抑制剂、抗血管生成剂、凋亡诱导剂、抗癌抗体和/或抗细胞周期蛋白依赖性激酶剂。在某些实施方案中,癌症疗法包括化学疗法、生物疗法、放射疗法、免疫疗法、激素疗法、抗血管疗法、冷冻疗法、毒素疗法和/或手术或其组合。在某些实施方案中,本公开的方法包括在一种或多种另外的免疫调节剂之前、之后或与其联合地施用如本文公开的缀合物。在一些实例中,免疫调节剂包括能够抑制与肿瘤或癌症相关的抗病毒免疫的任何化合物、分子或物质。所述另外的免疫调节剂的非限制性实例包括抗CD33抗体或其可变区、抗CD11b抗体或其可变区、COX2抑制剂(例如,塞来昔布)、细胞因子如IL-12、GM-CSF、IL-2、IFN3和1FNy,以及趋化因子如MIP-1、MCP-1和IL-8。
在某些实例中,在所述另外的疗法是放射疗法的情况下,示例性的剂量是5,000Rad(50Gy)至100,000Rad(1000Gy),或50,000Rad(500Gy),或所述范围内的其他合适的剂量。或者,放射剂量是约30至60Gy、约40至约50Gy、约40至48Gy或约44Gy,或所述范围内的其他合适的剂量,其中该剂量例如通过如上所述的剂量学研究来确定。如本文所用的“Gy”可指等于100Rad的辐射的特定吸收剂量的单位。Gy是“戈瑞(Gray)”的缩写。
在某些实例中,在所述另外的疗法是化学疗法的情况下,示例性的化疗剂包括但不限于烷化剂(例如,氮芥衍生物、乙烯亚胺、烷基磺酸酯、肼和三嗪、亚硝基脲和金属盐)、植物生物碱(例如,长春花生物碱、紫杉烷、鬼臼毒素和喜树碱类似物)、抗肿瘤抗生素(例如,蒽环类、色霉素类等)、抗代谢物(例如,叶酸拮抗剂、嘧啶拮抗剂、嘌呤拮抗剂和腺苷脱氨酶抑制剂)、拓扑异构酶I抑制剂、拓扑异构酶II抑制剂和各种其他抗肿瘤药(例如,核糖核苷酸还原酶抑制剂、肾上腺皮质类固醇抑制剂、酶、抗微管剂和类视黄醇)。示例性的化疗剂可以包括但不限于阿那曲唑
示例性的烷化剂包括但不限于氮芥、乙烯亚胺衍生物、烷基磺酸酯、亚硝基脲和三氮烯(triazenes):尿嘧啶氮芥(Aminouracil
示例性的蒽环类可包括但不限于多柔比星(
示例性的长春花生物碱包括但不限于酒石酸长春瑞滨
示例性的蛋白酶体抑制剂可以是但不限于硼替佐米
如本文所用的“与……组合”意指缀合物和另外的疗法作为治疗方案或计划的一部分施用于受试者。在某些实施方案中,联合使用并不要求在施用前将缀合物与另外的疗法物理组合,也不要求其在同一时间范围内施用。例如,非限制性地,所述缀合物和一种或多种药剂同时施用于所治疗的受试者,或者在同一时间施用或以任何顺序或在不同的时间点顺序施用。
实施例
提供以下实施例是为了说明,而非限制所请求保护的公开内容。
实施例1.抗TM4SF1抗体-抗TM4SF1siRNA缀合物在患有实体瘤的受试者中的抗血管生成和抗转移潜力
进行了1期开放标签剂量递增研究。该研究旨在评价本公开的示例性抗体-RNA偶联物的安全性和药代动力学,该偶联物由抗TM4SF1抗体和TM4SF1靶向的siRNA组成,并确定在患有晚期实体瘤的受试者中推荐的2期剂量(作为单一疗法或与标准疗法联合)。该研究的纳入标准包括患有不适合手术切除或其他批准的治疗选择的晚期实体瘤的受试者。此外,参与者必须按照《实体肿瘤反应评价标准》(RECIST)1.1版中的规定,具有可测量的病变或可通过评估肿瘤抗原来评估的病变。此外,参与者必须具有充分的骨髓、肾、肝和心脏功能。该研究的一些排除标准包括:参与者在第一剂包含抗-TM4SF1抗体-TM4SF1-靶向siRNA的示例性缀合物之前21天内,接受了抗癌治疗或任何研究性治疗;不受控制的转移至中枢神经系统(CNS);未解决的不良事件;以及对任何基于auristatin和/或含IgG的药物的主要免疫反应史。
持续24个月,每28天通过静脉内输注约100μg/kg剂量,向一组30名患有实体瘤并符合研究纳入标准的参与者施用示例性抗TM4SF1抗体-RNA缀合物,其中RNA是靶向TM4SF1的siRNA。在每名参与者中测量抗TM4SF1抗体-RNA缀合物的终末消除半衰期。另外,还确定了抗TM4SF1抗体-siRNA缀合物的最大观察血浆浓度(Cmax)。此外,记录了发生不良事件的参与者的人数。还测量了抗TM4SF1抗体-RNA缀合物从时间零到最后可测量浓度的曲线下面积(AUC)AUC(0-t)。此外,在所有参与者中都测量了客观反应率(ORR)、无进展生存期(PFS)和总体反应持续时间(DOR)。ORR被定义为达到完全反应(CR)或部分反应(PR)的参与者的比例。PFS被定义为从抗TM4SF1抗体-siRNA缀合物的第一次给药日期到疾病进展或死亡的时间,以先到者为准。DOR被定义为从参与者的初始CR或PR到疾病进展时间的时间。
实施例2.抗TM4SF1抗体-抗LSECtin siRNA缀合物在体外抑制黑素瘤细胞增殖
使用包含抗TM4SF1抗体和靶向LSECtin的siRNA的示例性抗体-RNA缀合物,进行了体外研究以评价肿瘤细胞抑制潜力。B16细胞是来自已建立的黑素瘤细胞系的细胞,在补充有10%热灭活的FBS和100U/mL青霉素的DMEM中培养。将细胞在含有5%CO
在实验之前,将B16细胞接种到24孔板中,并在补充有10%FBS的DMEM培养基中生长至汇合。测试了两种不同量的抗体-RNA偶联物。将1和5微克(μg)的抗TM4SF1抗体-抗LSECtin siRNA缀合物添加到完全培养基中的细胞中,并使其在细胞上孵育72小时,然后进行沉默分析。对于阳性对照,将IgG抗体与已知可实现高水平敲减(例如>70%)的siRNA分子缀合。对于阴性对照,将IgG抗体与非特异性siRNA缀合。与抗TM4SF1抗体-抗LSECtin siRNA缀合物孵育72小时后,评估LSECtin基因的RNA水平。沉默分析结果表明LSECtin成功敲减。另外,在与抗TM4SF1抗体-抗LSECtin siRNA缀合物一起孵育后,进行细胞增殖测定以评估B16细胞增殖速率。在两种条件(即1和5μg的抗TM4SF1抗体-抗LSECtin siRNA缀合物)下均观察到细胞死亡。在阴性或阳性对照中均未观察到细胞死亡。
实施例3.抗TM4SF1抗体-抗VCAM-1siRNA缀合物在乳腺癌中的抗转移潜力体内研究
进行体内研究以评估包含抗TM4SF1抗体和靶向VCAM-1的siRNA的抗体-RNA缀合物的抗转移潜力。在体外,通过细胞因子刺激,可以在许多乳腺癌上皮细胞中诱导VCAM-1表达,其上调与临床晚期乳腺癌直接相关。NMuMG乳腺上皮细胞中的VCAM-1过表达控制上皮和间充质过渡(EMT)程序,从而在体外导致细胞运动速率增加以及对多柔比星和顺铂的化学抗性增加。
为了进一步证实这些体外结果是否可转化为体内模型,以三种不同剂量:10μg/kg、500μg/kg和30mg/kg,向B6重症联合免疫缺陷(SCID)小鼠的两侧胁腹皮下注射用eGFPshRNA阳性对照细胞和抗TM4SF1抗体-抗VCAM-1siRNA缀合物稳定转染的人乳腺腺癌细胞(即MDA-MB-231细胞)。两个月后,在注射了对照载体和抗TM4SF1抗体-抗VCAM-1siRNA缀合物转染的细胞的小鼠中发现了明显的总体肿瘤增大,然后人道地处死小鼠并进行尸检。如预期的那样,与对照组相比,VCAM-1敲减的MDA-MB-231细胞的体内致瘤性降低了2-3倍。同时,Western印迹分析证实抗TM4SF1抗体-抗VCAM-1siRNA缀合物有效抑制了MDA-MB-231异种移植肿瘤样品中的VCAM-1表达。
此外,为了确定最小有效剂量和最大耐受剂量,进行了第二项实验,该实验包括向SCID小鼠的两侧胁腹皮下注射人乳腺腺癌细胞(即MDA-MB-231细胞)以诱导肿瘤生长。一旦在小鼠中发现明显的总体肿瘤增大,就以三种不同的剂量向三组接受抗体-RNA缀合物的小鼠施用抗TM4SF1抗体-抗VCAM-1siRNA缀合物:10μg/kg、500μg/kg和30mg/kg。两个月后,将小鼠人道地处死并进行尸检。与对照组相比,10μg/kg和500μg/kg组的体内致瘤性降低。因此,发现最小有效剂量为10μg/kg,而最大耐受剂量为500μg/kg。注射了30mg/kg剂量的抗TM4SF1抗体-抗VCAM-1siRNA缀合物的小鼠仅在注射后存活1个月。
协同进行的内源性VCAM-1表达的敲减和TM4SF1的靶向降低了肿瘤细胞增殖,抑制了TGFβ1或IL-6介导的肿瘤细胞的细胞迁移,并提高了体内的化学敏感性。此外,已经证明,在SCID异种移植小鼠模型中,内源性VCAM-1表达的敲减和MDA-MB-231细胞中TM4SF1的靶向减少了肿瘤形成。
实施例4.本公开的示例性抗体-寡核苷酸缀合物的制备和表征
用于缀合的半胱氨酸工程化抗TM4SF1抗体的制备:根据以下方案,制备用于与寡核苷酸缀合的半胱氨酸工程化抗TM4SF1单克隆抗体(具有工程化半胱氨酸的抗TM4SF1抗体):使用50KDa分子量截断值(MWCO)旋转柱,将约145μg至1mg裸半胱氨酸工程化抗TM4SF1抗体缓冲液交换到10-1000mM磷酸盐缓冲盐水(PBS)7.4-8.0中(对缓冲液交换进行三轮离心)。制备新鲜稀释的5mM三(2-羧乙基)膦(TCEP)-HCl pH 7(将来自安瓿0.5N储备液的5mMTCEP等分试样冷冻,直至需要)。将约10当量的TCEP加入到抗体溶液中以完全还原抗TM4SF1抗体的4个铰链二硫键和两个工程化的半胱氨酸残基。将混合物在热混合器中以300rpm在摇板中于37℃孵育2小时。将完全还原的抗体冷却至约4℃,然后使用50k MWCO离心柱(以14K rpm,4℃)缓冲液交换到含有5mM EDTA的100mM PBS 8.0中三次。缓冲液交换后,加入25mM储备溶液在PBS 8.0中的25当量-50当量脱氢抗坏血酸。进行分析型大小排阻色谱法(分析型-SEC),以检查完全还原的抗体是否完整且未片段化为轻链和重链。将抗体再氧化一段时间(在4℃下约3小时到约18小时)。再次通过分析型SEC检查完全再氧化的抗体。比较了还原后的mAh和裸mAb的分析型SEC结果。预期具有工程化半胱氨酸的经还原和再氧化的抗TM4SF1抗体应右移约大于0.5分钟至约0.9分钟的RT(保留时间)。
具有工程化半胱氨酸的经还原和再氧化的抗体(分子量较小)与裸mAb之间保留时间的差异表明半胱氨酸脱帽为游离硫醇。在这个阶段,认为完全还原并再氧化的抗-Tm4SF1mAb准备好进行缀合,或者备选地或另外地,如果不立即使用所制备的抗体,则在4℃冰箱中储存。
用于缀合的非工程化抗TM4SF1抗体的制备:根据以下方案,制备用于与寡核苷酸缀合的抗TM4SF1单克隆抗体(抗Tm4SF1mAb):使用50KDa分子量截断值(MWCO)旋转柱,将约145μg至1mg裸非半胱氨酸工程化抗TM4SF1抗体缓冲液交换到10-1000mM PBS 7.4-8.0中(对缓冲液交换进行三轮离心)。制备新鲜稀释的5mM三(2-羧乙基)膦(TCEP)-HCl pH 7(将来自Sigma安瓿0.5N储备液的5mM TCEP等分试样冷冻,直至需要)。将约10当量的TCEP加入到抗体溶液中以部分还原抗TM4SF1抗体的2个铰链二硫键。将混合物在热混合器中以300rpm在摇板中于37℃孵育约2小时。将还原的抗体冷却至约4℃。进行分析型大小排阻色谱法(分析型-SEC),以检查还原的抗体是否完整且未片段化为轻链和重链。比较了还原后的mAb和裸mAb(未经过还原)的分析型SEC结果。可以预期,相对于裸mAb,还原的mAb应该显示右移。在这个阶段,认为还原后的抗-Tm4SF1mAb准备好进行缀合,或者备选地或另外地,如果不立即使用所制备的抗体,则在4℃冰箱中储存。
寡核苷酸有效负载与可切割的连接体的缀合:在水或50mM磷酸盐缓冲盐水中以1mM的浓度以20nmol规模将在3’或5’链具有伯胺缀合柄的寡核苷酸等分。如果寡核苷酸是固体,则将其以1nmol/1μL的浓度稀释。如果将寡核苷酸溶解在缓冲液中,则使用Amicon 3K分子量截断值过滤器交换到pH约为7.2-8 0的50-100mM PBS中。向寡核苷酸添加50当量的NHS活化的二硫化物(具有S-吡啶基),并在室温下反应3小时,或在4℃下反应过夜。然后使用G-45Sephadex柱或PD-10柱将粗缀合物(20μL至100μL体积)纯化至100%纯水中。将洗脱的级分冻干成固体过夜。通过重建到50mM-100mM PBS中来制备具有约1mM至约10mM的缀合物浓度的储备溶液。使用NanoDrop在260nM处对浓度进行定量。
寡核苷酸有效负载与不可切割的连接体的缀合:在水或50mM磷酸盐缓冲盐水中以1mM的浓度以20nmol规模将在3’或5’链具有伯胺缀合柄的寡核苷酸等分。制备了马来酰亚胺或溴乙酰胺异官能连接体的100mM DMSO储备液,该连接体具有带有N-羟基琥珀酰亚胺或四氟苯基活化基团的活化羧酸。将约50当量至约100当量的连接体加入到在约pH 7.4的PBS中的含伯胺的寡核苷酸中,并在室温下反应1-2小时。使用用纯水平衡的PD-10柱纯化粗连接体-寡核苷酸缀合物。例如,PD-10柱可以用5倍体积(约25ml)的纯水平衡,粗混合物的加载量小于或等于约2.5ml,然后用3.5ml水洗脱。将连接体-有效负载缀合物冻干过夜以产生固体,然后将其在pH约7.4的PBS中稀释并根据需要使用。
示例性连接体-寡核苷酸缀合物的表征:关于天然寡核苷酸和连接体-寡核苷酸缀合物的质谱数据在Agilent 6545XT Q-ToF LCMS上以阴性模式获得。将每种粗品或纯化的样品冻干成粉末。将大约10-12μg重新悬浮在80μL的水中,以产生浓度约为10μM的储备溶液。通过用20μL的水稀释20μL的储备溶液,在塑料小瓶中制成5μM的样品。所有注射液均为5μL体积。梯度法显示在下表中,图4、图5和图6分别显示了裸寡核苷酸(Hu S)、连接体寡核苷酸缀合物(使用不可切割的MCC连接体缀合)和连接体寡核苷酸缀合物(使用可切割的连接体“SPDD或二硫键或SS”缀合)的LC-MS结果。
表2:示例性ARC的LC-MS(液相色谱-质谱法)表征的示例性实验条件
准备缀合的连接体-寡核苷酸有效负载与抗TM4SF1抗体的缀合(例如如上所述生成的带有工程化半胱氨酸的完全还原的抗体):将约1.5-2.5摩尔过量的寡核苷酸连接体有效负载(例如,如上所述制备的MCC-寡核苷酸)添加到还原的mAb中,并使用50kDa MWCO旋转柱进行缓冲液交换。在室温下将连接体-寡核苷酸有效负载和mAb缀合约2-4小时(或者可以使反应在4℃下进行过夜)。通过分析型SEC监测缀合物,以确认在280nM(来自mAb)和260nM(来自连接体-寡核苷酸有效负载)处的吸光度重叠。通过Agilent 2.7micron,4.6mm至300mm SEC柱,在15分钟时间内以0.35mL/min的流速进行半制备型SEC。或者,可以使用7.8mm内径的柱,加载量约为1mg至3mg。从半制备型SEC运行中收集级分,并使用50kDa MWCO旋转柱在pH约为7-4的PBS中浓缩(3轮离心)。使用分析型SEC来检查所需终产品的特性,然后通过280nm处的吸光度以及280nm与260nm处吸光度之比(A260/A280)进行NanoDrop定量,在一些情况下(取决于使用的染料),在547nm处测量吸光度。概述在该实施例中描述的过程的流程图如图3所示。
基于转谷氨酰胺酶的连接体-寡核苷酸与抗体的缀合:通过50kDa MWCO过滤器将天然TM4SF-1抗体缓冲液交换到25mM TRIS,150mM NaCl,pH约8.5中,至至少50μM的终浓度。将约1.5-10当量的含有亲核胺的寡核苷酸加入到抗体中。酰基受体可以是任何非硫杂原子。最后,以pH约为8.5的20μM TRIS储备溶液的形式添加催化当量至化学计量当量的微生物转谷氨酰胺酶(在本文中也称为‘mTGase’或‘TG’:Ajinomoto Activa T1)(或从白色粉末形式的mTGase为80mg/ml)。将粗制的缀合混合物在热混合器中于37℃加热1小时,然后将热混合器升温至4℃并搅动,并通过SEC-HPLC进行监测。粗反应通过PD-10、50k MWCO Amicon、蛋白-A或SEC-HPLC技术纯化。mTGase的去除对于确保通过分析型SEC或SDS-Gel确认最终回收的所需产物/缀合物的去除至关重要。图7显示了使用ARC(使用基于转谷氨酰胺酶的缀合制备)进行的分析型SEC的结果。
使用分析型SEC表征了使用基于mTGase的缀合制备的ARC,结果在图8-10中示出(每张图显示了未缀合的mAb和通过MCC连接体与BCL2L1siRNA缀合的mAb的比较,在220nm(图8)、260nm(图9)或647nm(图10)处进行吸光度测量)。使用分析型SEC表征了使用基于mTGase的缀合制备的其他ARC,结果在图11-13中示出(每张图显示了未缀合的mAb和通过MCC连接体与MCLsiRNA缀合的mAb的比较,在220nm(图11)、260nm(图12)或647nm(图13)处进行吸光度测量值)。使用分析型SEC表征了使用基于mTGase的缀合制备的其他ARC,结果在图14-16中示出(每张图显示了未缀合的mAb和通过MCC连接体与CTsiRNA缀合的mAb的比较,在220nm(图14)、260nm(图15)或647nm(图16)处进行吸光度测量)。使用分析型SEC表征了使用基于mTGase的缀合制备的其他ARC,结果在图17-19中示出(每张图显示了未缀合的mAb和通过MCC连接体与TM4SF1siRNA缀合的mAb的比较,在220nm(图17)、260nm(图18)或647nm(图19)处进行吸光度测量)。
示例性抗体寡核苷酸缀合物(特别是抗体-RNA缀合物,在本文中也称为ARC)的纯化:示例性ARC(含有在3'端具有NH2-胺连接体/间隔区和在5'端具有Dy547染料的双链siRNA;示例性siRNA序列以SEQ ID No.102-273提供)使用来自Agilent的Bio-Inert1260HPLC进行纯化。来自Corning的pH约7.4的磷酸盐缓冲盐水(PBS)在引入系统之前,先通过0.22微米过滤器进行三次过滤。流动相通过Agilent Advance Bio SEC 300埃27微米孔径7.8mm x 150mm柱以约1mL/min运行每次运行约7.5分钟。使用基于时间的级分收集来收获ARC,以最大化从未缀合的反应储备液的回收和分离。收集后,通过在50kDa MWCO旋转柱中离心浓缩ARC。为确保无菌,ARC通过0.22微米过滤器过滤。
用分光光度法测量ARC浓度。在280nm处测量吸光度。对于寡核苷酸,通过测量在260nm和547nm(如果寡核苷酸上存在DyLight 547染料)处的吸光度来确定浓度。siRNA的上样通过280nm处更大的峰来确认,然后在547nm重叠波长处确认。
通过制备型SEC-HPLC,或通过使ARC通过100kDa MWCO Amicon旋转柱(7轮离心),然后使用50kDa MWCO Amicon旋转柱在pH约7.4的PBS中浓缩,分离出所需产物ARC。
各种抗体和缀合物的HPLC色谱图在图20A-20D中提供。图20A显示了包含N297C突变的人AGX-A07裸抗体的HPLC色谱图;图20B显示了裸SPDP-TM4SF1-Husi的HPLC色谱图;图20C显示了包含N297C-S-S-TM4SF-1-Husi的人AGX-A07的粗缀合物;图20D显示了示例性的纯化ARC。利用试剂SPDP将抗体缀合至连接体寡核苷酸缀合物的示例性方案在图21中示出(图中的ThiomAb
实施例5:本公开的示例性ARC的生物学性质
如本文所述,在敲减试验中研究了几种示例性ARC。简言之,培养细胞并在约3小时后加入ARC(包含表5中所列的测试siRNA序列的对照siRNA序列;包含稳定修饰的siRNA由
将细胞在补充有蛋白酶/磷酸酶抑制剂(Halt Protease and PhosphataseCocktail,Thermofisher)的放射免疫沉淀试验缓冲液(RIPA,Thermofisher)中均化。加入SDS缓冲液,然后通过煮沸5分钟使其变性。通过SDS-聚丙烯酰胺凝胶电泳分离蛋白质,并将其转移至硝酸纤维素膜(Thermofisher)上。将膜用含有0.1%吐温20的Tris缓冲盐溶液中的1%BSA封闭,然后用在封闭溶液中稀释的第一抗体进行处理。抗BCL2L1购自CellSignaling Technologies。使免疫复合物与缀合至近红外染料(Li-Cor 924-32211)的适当第二抗体反应,并在Li-Cor CLX上可视化。图22示出了ARC的可能的作用机理。
图23A-23E显示了使用靶向siRNA的BCL2L1和MCL1在HUVEC细胞中的敲减。与对照(图23A)相比:(i)超过95%的HUVEC细胞在BCL2L1敲减后72小时死亡(图23B);(ii)稳定化的BCL2L1siRNA观察到类似的敲减活性(图23C);(iii)MCL1观察到约90%的细胞死亡(图23D);(iv)MCL1siRNA稳定作用强烈影响MCL1siRNA活性,仅显示约40%的细胞死亡(图23E)。
在诸如A549(非小细胞肺癌细胞系)、MiaPaea2(胰腺癌细胞系)和SKOV3(卵巢癌细胞系)等癌细胞系中进一步研究了使用MCL1、BCL2L1和TM4SF1siRNA的敲除。图24提供了来自在体外培养的人细胞以及内皮细胞(HUVEC)中的siRNA敲减研究的数据。对于TM4SF1siRNA:在所有四种细胞类型中,敲除都超过90%。siRNA稳定作用并不影响敲减活性。对于BCL2L1siRNA:HUVEC中的敲减超过90%,但在肿瘤细胞系中较弱(平均70-80%)。siRNA稳定作用不影响敲减活性。在MCL1siRNA的情况下:在HUVEC中的敲减超过80%,但在肿瘤细胞系中较弱(平均55-66%)。siRNA稳定作用影响敲减活性(平均敲减为34%至48%)。对于每种细胞类型,Ctl表示对照siRNA。-表示没有任何修饰的siRNA;染料表示在5'有义链上具有Cy5或Dy547染料缀合的siRNA;染料稳定表示同时具有染料结合和稳定修饰的siRNA。图24中的n.a.=无法获得数据或无法进行实验。
图25显示了在HUVEC中使用含有通过稳定连接体与TM4SF1si RNA缀合的抗TM4SF1抗体(AGX-A07)的ARC进行的敲减试验的结果。对于本研究,将ARC直接添加到培养基中,然后在细胞传代培养时将其移除。传代培养后24小时,染料强度下降,表明TM4SF1siRNA已被RISC处理。mRNA表达(在图26中)显示出示例性TM4SF1ARC的TM4SF1敲减约为37%。对照siRNA ARC没有观察到敲减。图27提供了使用包含AGX-A07和TM4SF1siRNA的ARC(AGX-TM-siRNA)进行的敲减试验的定量数据。
在HUVEC中,用包含AGX-A07和BCL2L1siRNA的ARC进行了类似的敲减研究,结果在图28A-28D中示出。将ARC直接添加到培养基中,并在传代细胞时将其移除。传代培养后24小时,siRNA信号下降,表明BCL2L1siRNA正在被RISC处理。mRNA表达显示出约29.4%的BCL2L1敲减(图28B)。Western印迹分析显示BCL2L1的敲减约为15.7%(图28C)。免疫染色支持mRNA和蛋白质结果,显示阳性染色信号下降(图28D)。还在A549细胞(结果显示在图29A-29b中)(mRNA表达显示约14.4%的BCL2L1敲减,且siRNA信号在传代培养后24小时下降表明siRNA正在被RISC处理);MiaPaca2细胞(结果显示在图30A-30B中)(传代培养后24小时siRNA信号下降表明siRNA正在被RISC处理,并且mRNA表达在MiaPaca2中未显示BCL2L1敲减);SKOV3细胞(结果显示在图31A-31B中)(传代培养24小时后siRNA信号下降表明siRNA正在被RISC处理,并且mRNA表达显示出约5.29%的BCL2L1敲减)中测试了包含BCL2L1siRNA的ARC。
在具有包含AGX-A07和MCL1siRNA的ARC的HUVEC细胞中进行了敲减研究,结果显示在图32A-32B中。将ARC直接添加到培养基中,并在传代细胞时将其移除。传代培养后24小时,siRNA信号下降,表明MCL1siRNA正在被RISC处理。mRNA表达显示出约10.4%的MCL1敲减。推测稳定化的MCL1导致原始MCL1siRNA活性损失50%的事实可能影响敲减效率。
表3.抗体序列描述
表4:siRNA序列
表5:siRNA序列
虽然本文已经示出并描述了本公开的优选实施方案,但对于本领域技术人员明显的是,这些实施方案仅以示例的方式提供。在不脱离本公开内容的情况下,本领域技术人员将会想到许多变化、改变和替换。应当理解,在实施本公开时可以采用本文所述本公开的实施方案的各种替代方案。旨在以所附权利要求书限定本公开的范围,并且由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 抗体-寡核苷酸缀合物
- 双链寡核苷酸、含双链寡核苷酸的组合物与缀合物及制备方法和用途
