骨骼重建和骨外科植入物
文献发布时间:2023-06-19 12:04:09
本申请是是中国申请号为201480073304.9(对应于PCT国际申请号PCT/US2014/069411)、申请日为2014年12月9日、发明名称为“骨骼重建和骨外科植入物”的发明专利申请的分案申请。
与相关申请的交叉引用
本申请要求2013年12月9日提交的题为“颅骨和颅后骨骼和软组织的重建”(CRANIUM AND POSTCRANIAL BONE AND SOFT TISSUE RECONSTRUCTION)的美国临时专利申请系列号61/913,608、 2014年3月11日提交的题为“颅骨和颅后骨骼和软组织的重建”(CRANIUM AND POSTCRANIAL BONE AND SOFT TISSUE RECONSTRUCTION)的美国临时专利申请系列号61/951,221、2014 年4月10日提交的题为“颅骨和颅后骨骼和软组织的重建”(CRANIUM AND POSTCRANIAL BONE AND SOFT TISSUE RECONSTRUCTION)的美国临时专利申请系列号61/977,984以及2014 年7月10日提交的题为“颅骨和颅后骨骼和软组织的重建”(CRANIUM AND POSTCRANIAL BONE AND SOFT TISSUE RECONSTRUCTION)的美国临时专利申请系列号62/022,899的利益,每个所述临时申请的公开内容通过参考并入本文。
技术领域
本公开涉及骨外科的各个不同方面,包括骨骼和组织重建、患者特异性和大规模定制的骨外科植入物、性别和种族特异性的骨外科植入物、切割引导器、创伤防护板、骨移植物切割和放置引导器、患者特异性仪器、惯性测量单元用于运动学和病理学的解剖跟踪的用途以及惯性测量单元在骨外科手术期间用于导航的用途。
发明概述
本发明的第一方面提供了一种一种外科导航系统,所述系统包含:通讯连接到主处理器的信号接收器,所述主处理器被编程以利用序贯蒙特卡罗算法来计算安装到外科工具的惯性测量单元的三维位置的变化,所述处理器被通讯连接到储存有多个外科工具中的每个工具独有的工具数据的第一存储器和储存有足以构建解剖学特点的三维模型的模型数据的第二存储器,所述主处理器被通讯连接到显示器,所述显示器提供关于所述外科工具相对于所述解剖学特点的三维位置的视觉反馈。
在所述第一方面的更详细的实施方式中,所述外科导航系统还包含参比惯性测量单元,其通讯连接到第一机载处理器和第一无线传输器以将数据传输到所述主处理器,所述参比惯性测量单元被配置为附连到所述解剖学特点,在那里所述第一机载处理器指导从所述参比惯性测量单元向所述第一无线传输器的数据传输,其中安装到所述外科工具的惯性测量单元包含实用惯性测量单元,其被通讯连接到第二机载处理器和第二无线传输器,所述第二机载处理器被配置为安装到所述多个外科工具之一,并且其中所述主处理器被通讯连接到主接收器,所述主接收器被配置为接收来自于所述第一无线传输器的数据和来自于所述第二无线传输器的数据。在又一个更详细的实施方式中,所述第二机载处理器通过所述第二无线传输器指导安装有所述实用惯性测量单元的外科工具的身份的通讯。在另一个详细实施方式中,所述惯性测量单元包括至少3个加速计和3个磁强计,所述至少3个加速计中的每一个相对于3个轴为总共不少于9个加速计数据流输出数据,至少3个磁强计中的每一个相对于3个轴为总共不少于9个磁强计数据流输出数据,所述主处理器利用所述9个加速计数据流和所述9个磁强计数据流来计算安装到所述外科工具的惯性测量单元的三维位置的变化。在又一个详细实施方式中,储存在所述第二存储器中的模型数据包括所述解剖学特点的三维虚拟模型,储存在所述第一存储器中的工具数据包括所述多个外科工具的三维虚拟模型,所述显示器显示所述解剖学特点的三维虚拟模型,所述显示器显示所述外科工具的三维虚拟模型,所述主处理器有效地利用来自于所述参比惯性测量单元的数据来重新定位所述解剖学特点的三维虚拟模型,并且所述主处理器有效地利用来自于所述实用惯性测量单元的数据来重新定位所述外科工具的三维虚拟模型。在更详细的实施方式中,所述主处理器有效地利用来自于所述惯性测量单元的数据来实时地相对于所述解剖学特点的三维虚拟模型重新定位所述外科工具的三维虚拟模型。在更详细的实施方式中,所述序贯蒙特卡罗算法包括冯·米塞斯-费雪密度算法组件。在另一个更详细的实施方式中,储存在所述第一存储器中的工具数据包括位置数据,其指示了所述外科工具的末端效应器与所述外科装置上用于所述惯性测量单元的安装位置之间的相对距离,并且所述外科工具包括扩孔器、定位杯、冲击器、钻孔器、锯和切割引导器中的至少一者。在又一个更详细的实施方式中,所述惯性测量单元包括至少3个磁强计,并且所述显示器被连接到所述外科工具或所述主处理器中的至少一者。
本发明的第二方面提供了一种用于包括磁强计和加速计的惯性测量单元的校准系统,所述系统包含:(a)初始平台,其可沿着第一轴相对于中间平台旋转重新定位;(b)最终平台,其可沿着第二轴相对于所述中间平台旋转重新定位,所述第二轴垂直于所述第一轴,所述最终平台包括止动件,其被配置为安装到惯性测量单元;以及(c)处理器和相关软件,其被配置为通讯连接到所述惯性测量单元,所述软件有效地利用当所述初始平台相对于所述中间平台旋转时和当所述最终平台相对于所述中间平台旋转时从与所述惯性测量单元相关的磁强计输出的数据并记录类似于椭球的数据集,所述软件有效地将球体拟合于所述数据集并产生磁强计校正计算以说明局部磁场中的扭曲,由此使从所述磁强计输出的未来数据规格化。
在所述第二方面的更详细的实施方式中,所述初始平台是静止的。在又一个更详细的实施方式中,所述初始平台至少部分地容纳马达,所述马达被配置为引起所述中间平台相对于所述初始平台旋转。在另一个详细实施方式中,所述软件有效地利用当所述惯性测量单元处于第一静止位置时从与所述惯性测量单元相关的加速计输出的第一数据集并有效地利用在与所述第一静止位置不同的第二静止位置处从所述加速计输出的第二数据集来产生加速计校正计算,以使从所述加速计输出的未来数据规格化。在又一个详细实施方式中,所述第一静止位置对应于所述初始平台相对于所述中间平台处于第一固定位置处并且所述最终平台相对于所述中间平台处于第二固定位置处,并且所述第二静止位置对应于所述初始平台相对于所述中间平台处于第三固定位置处和所述最终平台相对于所述中间平台处于第四固定位置处中的至少一者。在更详细的实施方式中,所述最终平台包括多个止动件,其中每个所述多个止动件被配置为安装到多个惯性测量单元中的至少一个。
本发明的第三方面提供了一种校准包含磁强计的惯性测量单元的方法,所述方法包括:(a)将包括第一惯性测量单元的第一惯性测量单元围绕第一旋转轴和第二旋转轴旋转,所述第一旋转轴垂直于所述第二旋转轴,同时从所述第一磁强计接收原始局部磁场数据;(b)对所述原始局部磁场数据进行统一计算,以计算局部磁场中的扭曲;以及(c)通过说明所述局部磁场中计算的扭曲,将从所述磁强计接收到的原始局部磁场数据规格化,以提供精炼的局部磁场数据。
在所述第三方面的更详细的实施方式中,所述第一惯性测量单元包括第一加速计,所述方法还包括:(i)将所述第一惯性测量单元在第一三维位置中保持静止,同时从所述第一加速计接收原始加速计数据;(ii)将所述第一惯性测量单元在第二三维位置保持静止,同时从所述第一加速计接收原始加速计数据,所述第二三维位置不同于所述第一三维位置;以及(iii)将从所述第一加速计接收到的数据规格化,以反映出当所述第一加速计静止时的零加速。在又一个更详细的实施方式中,所述第一惯性测量单元包括第二加速计,所述方法还包括:(i)当所述第一加速计保持静止时,将所述第二惯性测量单元在第三三维位置中保持静止,同时从所述第二加速计接收原始加速计数据; (ii)当所述第一加速计保持静止时,将所述第二惯性测量单元在第四三维位置中保持静止,同时从所述第二加速计接收原始加速计数据,所述第四三维位置不同于所述第三三维位置;以及(iii)将从所述第二加速计接收到的数据规格化,以反映出当所述第二加速计静止时的零加速。在另一个详细实施方式中,所述原始局部磁场数据在三维上表示椭球,并且所述精炼的局部磁场数据在三维上表示球体。在又一个详细实施方式中,所述统一计算包括将球体拟合于所述原始局部磁场数据,并且将所述原始局部磁场数据规格化包括从所述原始局部磁场数据中减去所述计算的扭曲以提供精炼的局部磁场数据。在更详细的实施方式中,所述方法还包括具有其自己的第一加速计的第二惯性测量单元。在更详细的实施方式中,所述第二惯性测量单元具有它自己的第一加速计。
本发明的第四方面提供了一种用于在连接到惯性测量单元时鉴定外科工具的方法,所述方法包括:(a)将惯性测量单元安装到多个外科工具之一,每个所述多个外科工具具有独特接口;以及(b)读取所述独特接口以将信号传输到通讯连接到所述惯性测量单元的处理器,从而对读取所述独特接口做出响应鉴定所述多个外科工具之一。
在所述第四方面的更详细的实施方式中,所述惯性测量单元被操作性连接到多个开关,所述独特接口占用所述多个开关中的至少一个,并且读取所述独特接口的步骤包括通过所述处理器确定所述多个开关中的哪些已被所述独特接口占用。在又一个更详细的实施方式中,所述处理器被连接到所述惯性测量单元,并且所述处理器和惯性测量单元被容纳在共同外壳中。在另一个详细实施方式中,所述处理器远离所述惯性测量单元,并且所述处理器和惯性测量单元不被容纳在共同外壳中。
本发明的第五方面提供了一种一种进行外科导航的方法,所述方法包括:(a)利用多个惯性测量单元产生加速度数据和磁测数据;(b) 在外科操作位置附近校准所述多个惯性测量单元;(c)配准组成所述多个惯性测量单元的第一和第二惯性测量单元的相对位置,其中配准相对位置包括将所述第一惯性测量单元安装到以特定位置和取向独一无二地啮合患者解剖结构的配准工具,并且其中配准所述相对位置包括将所述第二惯性测量单元安装到所述患者;(d)在配准后将所述第一惯性测量单元附连到外科工具;(e)将所述外科工具和所述第一惯性测量单元重新定位到与所述患者解剖结构相关的外科位点;以及(f) 当至少一个所述解剖结构不可见或所述外科工具的操作末端不可见时,提供关于所述外科工具的位置和取向中的至少一者的视觉反馈。
本发明的第六方面提供了一种进行外科导航的方法,所述方法包括:(a)利用多个惯性测量单元产生加速度数据和磁测数据;(b) 在外科操作位置附近校准所述多个惯性测量单元;(c)配准组成所述多个惯性测量单元的第一和第二惯性测量单元的相对位置,其中配准相对位置包括将所述第一惯性测量单元安装到以特定位置和取向独一无二地啮合患者解剖结构的配准工具,并且其中配准所述相对位置包括将所述第二惯性测量单元安装到所述患者;(d)在配准后将所述第一惯性测量单元附连到外科工具;(e)将所述外科工具和所述第一惯性测量单元重新定位到与所述患者解剖结构相关的外科位点;以及(f) 针对预定外科计划提供关于所述外科工具的位置和取向的视觉反馈,其中所述预定外科计划鉴定所述外科工具可能占据的容许位置范围和容许取向范围中的至少一者。
本发明的第七方面提供了一种为特定骨骼产生创伤防护板的方法,所述方法包括:(a)访问包含特定骨骼的多个三维骨骼模型的数据库;(b)为每个所述多个三维骨骼模型评估包含纵向轮廓和横截面轮廓中的至少一者的特点,其中所述纵向轮廓沿着所述多个三维骨骼模型的主维度获取;(c)在所述评估的特点的基础上对所述多个三维骨骼模型进行聚类以产生多个簇,其中所述多个簇在数量上少于所述多个三维骨骼模型的10%;以及(d)为每个所述多个簇产生创伤防护板。
在所述第七方面的更详细的实施方式中,为每个所述多个簇产生创伤防护板包括选择固定位置以避开软组织与所述特定骨骼的附连处。在又一个更详细的实施方式中,所述多个三维骨骼模型包括至少一个共性,其中所述共性包含性别、种族、年龄范围和身高范围中的至少一者。在另一个详细实施方式中,为每个所述多个簇产生创伤防护板包括并入该特定簇的平均纵向轮廓和平均横截面轮廓中的至少一者。
本发明的第八方面是提供一种为特定骨骼产生患者特异性创伤防护板的方法,所述方法包括:(a)为已损伤或退化的特定骨骼获得患者特异性图像数据;(b)使用所述患者特异性图像数据来分析所述特定骨骼缺失的那些部分和所述特定骨骼存在的那些部分中的至少一者;(c)以统一状态产生所述特定骨骼的患者特异性虚拟骨骼模型,其包括在所述患者特异性图像数据中不可见的骨骼;(d)评估所述患者特异性虚拟骨骼模型的轮廓;以及(e)使用所述患者特异性虚拟骨骼模型产生患者特异性创伤防护板。
本发明的第九方面是提供一种使用惯性测量单元运动学追踪患者解剖结构的运动的方法,所述方法包括:(a)将第一惯性测量单元安装到患者的第一目标解剖学特点的外部;(b)将第二惯性测量单元安装到患者的第二目标解剖学特点的外部;(c)使用所述第一惯性测量单元将所述患者的第一解剖学特点的位置与所述患者的第一目标解剖学特点的虚拟模型配准;(d)使用所述第二惯性测量单元将所述患者的第二解剖学特点的位置与所述患者的第二目标解剖学特点的虚拟模型配准;(e)使用所述第一惯性测量单元将所述患者的第一目标解剖学特点的位置与所述第一解剖学特点的虚拟模型进行动态关联;以及(f)使用所述第二惯性测量单元将所述患者的第二目标解剖学特点的位置与所述第二解剖学特点的虚拟模型进行动态关联。
附图简述
图1是从部分解剖结构产生大规模定制且患者特异性的模具的总体过程的示意图。
图2是示意图,详细描述了如何向统计图集添加新的解剖结构以便产生对应。
图3是对应于图2中的多分辨率3D配准的多分辨率3D配准算法概述。
图4是使用多尺度特点的特征点的多尺度配准。
图5是图3中概述的多分辨率配准的低层次分解。
图6是在对应产生后捕获群体变差的图形表述。
图7是使用部分的、变形的或破碎的解剖结构的完整骨骼重建过程的示意图。
图8是用于产生缺陷模板的缺陷分类过程的示意图。
图9是现有的用于髋臼缺陷的AAOS分类的图形实例。
图10是现有的Paprosky髋臼缺陷分类的图形实例。
图11是现有的Paprosky髋臼缺陷子分类的图形实例。
图12是示出了盆骨上不同缺陷的重建结果的表和相关的图,其是图7中描绘的完整骨骼重建的示例性应用和验证。
图13是骨盆上不同缺陷的重建的平均REM误差的距离图,其验证了图7中描绘的完整骨骼重建的准确性。
图14左侧是具有严重盆骨不连续的患者的三维模型表述。右侧是左侧示出的患者盆骨的三维模型的实例。
图15是重建的左侧模型和原始的患者模型的比较,以及右侧和左侧解剖结构。
图16是重建的模型与重建的盆骨模型的镜像图之间的距离图。
图17是具有完全盆骨不连续的患者和重建结果,其中RMS误差为1.8mm。
图18是部分颅骨的重建结果和重建误差的平均距离图。
图19是破碎股骨的重建结果。
图20是产生患者特异性重建植入物的过程的示意图。
图21是图20中描绘的植入物产生的过程的示意图。
图22是过程流程图,示出了从部分解剖结构重建患者完整解剖结构和为盆骨不连续产生患者特异性髋臼杯植入物的各个不同步骤。
图23是用于患者特异性髋臼植入物的患者特异性放置引导器的图形表述。
图24包含了对于大规模定制来说研究植入物的三个附连位点与髋臼杯取向之间的关系的图像。
图25包含的图像示出了符合本公开的髋臼笼的大规模定制的工序。
图26是使用模块化设计制造大规模生产的定制髋臼组件的方法的示意图。
图27是为重建手术产生患者特异性股骨柄的过程的示意图。
图28是用于产生大规模定制的植入物的过程的示意图。
图29是示意图,描绘了使用统计图集产生大规模定制和患者特异性的髋关节植入物两者的过程。
图30是示意图,描绘了使用统计图集产生大规模定制和患者特异性的髋关节植入物两者的过程。
图31是示意图,描绘了用于设计群体特异性股骨柄组件的过程的概况。
图32是示出了股骨近端标志所处位置的图形表述。
图33是股骨的3D模型,输出了在股骨中间的髓管腰部和沿着股骨长度的股骨腰部。
图34是示出了股骨近端轴所处位置的图形表述。
图35是示出了颈部中心计算所处位置的图形表述。
图36是用于定义股骨近端解剖轴的两个点的图形表述。
图37是3D股骨近端测量的图形表述。
图38示出了示例性的Dorr比率,其一般采取2D(来自于XR)。
图39是IM峡部处的B/A比率的图形表述。
图40是IM管测量的图形表述。
图41是轮廓和拟合的圆。
图42是为了获得IM管股骨半径比而采取的测量的图形表述。
图43描绘了两个股骨模型,其示出了半径比率变化的影响,其中左侧模型具有0.69的半径比率,右侧模型具有0.38的半径比率。
图44是男性和女性的BMD相对于RRFW的图,以及每个数据集 (男性、女性)的最佳直线拟合。
图45是对齐之前股骨近端的内侧轮廓、颈轴和头点的图形表述。
图46是解剖轴与Z方向对齐的图形表述。
图47是使用股骨颈枢轴点对齐的内侧轮廓的图形表述。
图48是使用模型之间的插值产生的不同模型的图形表述,以显示插值的平滑。
图49是骨骼密度的三维作图的图形和图片表述。
图50是X-射线图,示出了3个高度处的IM宽度以及近端轴、头部缢缩和股骨头。
图51是近端角度对头部缢缩的图。
图52是近端角度对头高度的图。
图53是头部缢缩对头高度的图。
图54是近端角度的直方图。
图55是描绘了女性和男性的头部缢缩和骨距直径的簇的图。
图56是描绘了女性和男性的头部缢缩和近端角度的簇的图。
图57是头部缢缩的直方图。
图58是IM尺寸的直方图。
图59是对股骨近端的女性测量值的图形表述。
图60是对股骨近端的男性测量值的图形表述。
图61是对大转子高度的女性测量值的图形表述。
图62是对大转子高度的男性测量值的图形表述。
图63是示出了男性与女性之间髓内管形状差异的图形表述和表格。
图64描绘了代表正常骨骼密度和品质的女性股骨和髓内管。
图65描绘了代表低于正常骨骼密度和品质的女性股骨和髓内管。
图66描绘了代表骨质疏松症的女性股骨和髓内管。
图67是包含插值的数据集和头部缢缩的直方图的图表。
图68是包含髓管尺寸数据集直方图的图表。
图69描绘了各个不同股骨组的内侧轮廓和头部中心分布。
图70是示出了特定尺寸股骨组的头部缢缩的图。
图71是反映出男性和女性的前倾角测量值的表格。
图72是描绘了如何测量前-后高度的图片。
图73是男性和女性的股骨相对于它的枢轴点的头高度比前-后头高度的图,其包括了通过每个数据集(男性、女性)的最佳线性拟合。
图74是男性和女性的股骨相对于它的解剖轴中点的头高度比前- 后头高度的图,其包括了通过每个数据集(男性、女性)的最佳线性拟合。
图75是按照本公开在性别和/或种族的基础上产生股骨柄植入物家族所使用的参数的图形描述,图75从聚类提取的用于股骨柄组件的大规模定制植入物的形状参数。
图76在组装和部件分解图两者中描绘了原始股骨柄。
图77在组装和部件分解图两者中描绘了修正的股骨柄。
图78是符合本公开的表面点和利用平面来分离髋臼杯几何形状的图形表述。
图79图示了按照本公开产生的多个虚拟3D髋臼杯解剖学模板。
图80图示了髋臼杯和股骨柄球的解剖形状,表现出多个髋臼杯半径。
图81是髋臼杯与股骨头之间的曲率匹配的二维描绘。
图82是用于对髋臼杯进行横截面分析的盆骨的作图轮廓的图形描绘。
图83是作为确定髋臼杯植入物取向的方法的符合本公开的横向髋臼韧带的自动检测的图形描绘。
图84是用于从患者的微型计算机断层扫描图提取孔形状和尺寸以匹配患者骨骼解剖结构的工序的图形描绘。
图85是按照本公开用于产生宠物特异性植入物和切割引导器的示例性过程图。
图86是按照本公开使用统计图集为宠物产生大规模定制的骨外科植入物的示例性过程图。
图87是按照本公开为植入物系统产生患者特异性切割和放置装置的示例性过程图。
图88是来自于图87的非刚性配准和按照本公开从X-射线产生患者特异性的三维盆骨和股骨近端模型的示例性过程图。
图89是用于按照本公开重建盆骨和股骨近端的图片和多个X-射线图。
图90是如图87中所描述的用于从MRI和CT扫描图自动分割盆骨和股骨近端的示例性过程图。
图91是如图87中概述的用于从MRI或CT扫描图自动分割复杂和破碎的解剖结构的示例性过程图。
图92是为用于髋置换手术的髋臼杯和股骨柄两者建立虚拟模板的示例性过程图。
图93是使用远端固定的股骨柄自动放置的示例性过程图,其是图 92中概述的通用过程的具体实例。
图94是使用压入配合和三点接触的股骨柄自动放置的示例性过程图,其是图92中概述的通用过程的具体实例。
图95是符合本公开的自动寻找盆骨标志的图形描绘。
图96是符合本公开的自动髋臼杯取向和放置的图形描绘。
图97包含了一系列X-射线图,并叠加有用于按照本公开进行髋臼杯和股骨柄放置评估的测量和计算数据。
图98是按照本公开评估髋臼杯和股骨柄放置以确保总体肢体长度恢复和取向的图形描绘。
图99是用于按照本公开评估和修改植入物放置和调整尺寸的预先设计的界面的屏幕截图。
图100包含了一系列工序图像,其描绘了将患者特异性工具用于股骨柄切除和放置的示例性过程。
图101包含了一系列工序图像,其描绘了将患者特异性引导器用于髋臼杯扩孔和放置的示例性过程。
图102描绘了髋臼的一系列3D虚拟图,其可用于产生符合本公开的患者特异性工具和锁机构。
图103是在髋置换手术期间使用惯性测量单元作为外科导航的一部分的示例性过程图。
图104是一系列工序图像,其示出了在髋置换手术期间使用惯性测量单元作为外科导航的一部分的示例性过程。
图105是一系列工序图像,其示出了在髋置换手术期间使用惯性测量单元作为特异性针对股骨的外科导航的一部分的示例性过程。
图106图示了在髋置换手术期间,用于校准在晚些时候的外科导航中使用的惯性测量单元的位置的示例性工具和过程。
图107是在外科手术期间准备使用和使用惯性测量单元以及在手术操作完成后使用惯性测量来评估手术结果的示例性过程流程图。
图108描绘了一系列图像,其示出了在外科手术期间作为便于外科导航的一部分安装到各种不同工具的惯性测量单元机箱/机壳。
图109描绘了示出惯性测量单元(IMU)机箱/机壳的一系列图像,校准IMU相对于患者解剖结构的位置的图片,示出了将IMU机箱用于对扩孔器进行外科导航的图片,并且最后示出了将IMU机箱用于对髋臼杯冲击器进行外科导航的图片。
图110描绘了画中画,其示出了伴随髋臼杯冲击器使用IMU机箱,以及示出了患者解剖结构(在这个案例中为盆骨)的模型的图形界面 (嵌入图),并且所述冲击器的远端用颜色编码以确认冲击器的取向与手术预先计划的取向相一致。
图111是按照本公开使用的IMU以及用于描述IMU的相对维度特征的参照尺的图片。
图112是按照本公开用于为给定群体产生创伤防护板和固定装置的示例性过程流程图。
图113是来自于平均骨骼的图像,示出了骨骼表面上局域化的点,其横跨统计图集中的骨骼群体局域化,以便确定骨骼或创伤防护板的形状。
图114是骨骼的图像,示出了防护板位点在整个群体上的推送,这里示出了单一实例。
图115是示出了在防护板位点推送后提取骨骼/创伤防护板中线曲线的图。
图116是为创伤防护板中线曲线计算3D曲率半径(参数)的结果的图示。
图117是示出了在防护板位点推送后如何计算创伤防护板的长度的图示。
图118是示出了在防护板位点推送后如何计算创伤防护板的中部宽度的图示。
图119是示出了在防护板位点推送后如何计算创伤防护板的横截面半径的图示。
图120示出了用于确定簇的最适数目的防护板尺寸数据的图。
图121包括用于产生簇的防护板尺寸数据的2D和3D图(在图111 中示出为“聚类”)。
图122描绘了大量图像,其反映出防护板尺寸的参数化(在图111 中示出为“参数化曲线”和“产生模型”)。
图123是示出了用于特定簇的接骨板/创伤防护板的示例性图像,其被拟合于来自于所述簇的骨骼模型之一,以评估与所述群体的顺应性/拟合。
图124是3D表面距离图,反映出了接骨板/创伤防护板表面的底侧与被选择用来评估板拟合的骨骼模型的表面之间的间隔。
图125示出了设计的防护板在尸体上的验证,以避免肌肉和韧带碰撞。
图126是示例性图,示出了符合本公开的示例性患者拟合的锁骨创伤系统的元件之间的相互作用。
图127是图126中描绘的预先计划的元件的示例性过程流程图。
图128是在图126中描绘的手术中引导的示例性过程流程图,在这种情况下是使用荧光检查。
图129锁骨的荧光检查图,旁边是来自于顶视图的锁骨图示,并带有部分周围的解剖结构。
图130是在图126中描绘的手术中引导的示例性过程流程图,在这种情况下是使用超声。
图131是与在多种运动期间获取的X-射线或荧光检查图像匹配的图形表述,以及示出了使用一个或多个惯性测量单元进行的肩运动学的手术后评估的图。
图132是锁骨及周围解剖结构的一对三维图示。
图133描绘了锁骨骨骼模型和沿着所述骨骼模型用于鉴定锁骨中线曲率的点的两个不同视图。
图134描绘了锁骨骨骼模型和肌肉附连到所述骨骼模型上的位置。
图135示出了给定群体中男性和女性平均锁骨模型的一系列表面图以及每个群体中形状差异的程度。
图136是锁骨的一对三维图示,其将轮廓差异与肌肉附连位点相关联。
图137是在男性和女性群体内获取的锁骨的一系列横截面,其示出了锁骨在各个不同肌肉附连位点处的轮廓差异。
图138是在男性和女性群体内获取的锁骨的一系列横截面,其示出了锁骨在沿着锁骨长度方向上的轮廓差异。
图139示出了对统计图集中的群体数据做出响应产生的左侧和右侧锁骨模型,反映了左侧和右侧锁骨之间的形态差异。
图140描绘了符合本公开的上方侧板所拟合的锁骨骨骼模型 (左)、板中线曲线(中)和示出了曲率半径的中线板曲率(右)。
图141是描绘了男性和女性锁骨群体的上方侧板簇的图,并且表 1包括了与其相关的数据。
图142描绘了符合本公开的前部中干7h板所拟合的锁骨骨骼模型 (左)、板中线曲线(中)和示出了单一曲率半径的中线板曲率(右)。
图143是描绘了男性和女性锁骨群体的前部中干7h板簇的图,并且表2包括了与其相关的数据。
图144描绘了符合本公开的上部中干板所拟合的锁骨骨骼模型 (左)、板中线曲线(中)和示出了不同曲率半径的中线板曲率(右)。
图145是描绘了男性和女性锁骨群体的上部中干板簇的图,并且表3包括了与其相关的数据。
图146描绘了符合本公开的前部侧板所拟合的锁骨骨骼模型(左)、板中线曲线(中)和示出了不同曲率半径的中线板曲率(右)。
图147是描绘了男性和女性锁骨群体的前部侧板簇的图,并且表 4包括了与其相关的数据。
图148描绘了符合本公开的前部中干长板所拟合的锁骨骨骼模型 (左)、板中线曲线(中)和示出了不同曲率半径的中线板曲率(右)。
图149是描绘了男性和女性锁骨群体的前部中干板簇的图,并且表5包括了与其相关的数据。
图150是按照本公开,用于为创伤重建手术产生定制的板放置引导器的示例性过程流程图。
图151是按照本公开,用于为使用骨移植物的重建手术产生定制的切割和放置引导器的示例性过程流程图。
图152是按照本公开,用于产生创伤防护板模板和放置工具的示例性过程流程图。
图153是按照本公开,用于产生髋修正笼模板和放置工具的示例性过程流程图。
图154是按照本公开,使用惯性测量单元进行身体解剖结构的软组织和运动追踪的示例性过程流程图。
图155包含符合本公开的运动学软件界面的一对屏幕截图,所述软件界面鉴定软组织在骨骼模型上的位置并追踪软组织畸形。
图156包含股骨、胫骨和腓骨的骨骼模型,其描绘了相应骨骼模型上附连有韧带(MCL、LCL)的点,其中所述点用颜色编码以识别具有较高或较低韧带附连可能性的点。
图157包含远端股骨的骨骼模型,其描绘了相应骨骼模型上附连有韧带(ACL、PCL)的点,其中所述点用颜色编码以识别具有较高或较低韧带附连可能性的点。
图158包含近端胫骨的骨骼模型,其描绘了相应骨骼模型上附连有韧带(ACL、PCL)的点,其中所述点用颜色编码以识别具有较高或较低韧带附连可能性的点。
图159描绘了符合本公开的包含韧带附着的膝关节的3D虚拟模型的前、后和两侧视图。
图160描绘了使用荧光检查图像为图159的完全组装的膝关节模型的运动学移动建模。
图161包括符合本公开的远端股骨骨骼模型和近端胫骨骨骼模型的图,其反映出解剖轴的实时追踪。
图162包括通过多种运动和重建螺旋轴获得的膝关节模型。
图163包括了膝关节骨骼模型,其描绘了冠状面中的解剖轴。
图164是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图165是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图166是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图167是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图168是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图169是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图170是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图171是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图172是按照本公开使用惯性测量单元记录运动数据以进行膝关节的临床检查的示例性图。
图173包括一系列照片,第一张示出了套上一对惯性测量单元 (IMU)包的患者,第二张示出了所述IMU包相对于单个IMU的相对尺寸,第三张示出了单个IMU相对于25美分硬币的相对尺寸。
图174是符合本公开的描绘了近端胫骨模型的用户界面的屏幕截图,所述近端胫骨模型在从惯性测量单元接收的输入的基础上动态更新,以便在患者的膝关节经历各种动作时提供关于负载分布的反馈。
图175是患者的后下背部的照片,示出了分开放置在L1和L5椎骨上方用于追踪在各种动作期间每个椎骨的相对运动的惯性测量单元 (IMU),以及显示了每个IMU能够输出指示横跨3个轴的动作的数据的辅助图。
图176包含了一系列照片,示出了当患者正通过各种动作移动时的患者和图175的IMU。
图177是表示按照本公开使用惯性测量单元数据确定至少两个物体的相对取向的过程的图示。
图178包含一对图,示出了在患者的侧向弯腰活动期间与椎骨(特别是L1、L5)相关的解剖轴的取向的绝对变化。其中“(A)”数据图代表健康患者,“(B)”数据图代表表现出脊柱退变的患者。
图179包含了一对图像,一张是近端胫骨的顶视图,第二张是近端胫骨的高架透视图,示出了带有用于规则化IMU以确保胫骨植入物组件的正确取向和位置的外科导航工具。
图180是符合本公开的示例性惯性测量单元校准装置的高架透视图。
图181示出了由在校准之前从惯性测量单元输出的数据产生的局部磁场图(等距前视图和顶视图)(顶部一系列3张图近似椭球)以及由在校准之后从惯性测量单元输出的数据产生的局部磁场图(等距前视图和顶视图)(底部一系列3张图近似球形)。
图182包含一系列图,其示出了与惯性测量单元相关的磁强计的示例性位置(A),从磁强计检测到的磁场如果被规则化以说明扭曲时应该反映出的情况(B),以及如果不进行规则化时磁强计上磁场中的局部扭曲的结果。
图183是不同外科工具的一系列投影,所述外科工具各自具有独特的顶表面,以便允许惯性测量单元处理器智能识别安装有IMU的外科工具。
图184是表示IMU机壳的轮廓图,并描绘了图185的投影之一与 IMU机壳的底部空腔之间的相互作用。
图185是作为肩关节置换手术的一部分使用符合本公开的惯性测量单元准备近端肱骨和植入肱骨组件的示例性过程流程图。
图186是作为肩关节置换手术的一部分使用符合本公开的惯性测量单元准备肩胛窝和植入肩胛盂杯的示例性过程流程图。
图187是作为反向肩关节置换手术的一部分使用符合本公开的惯性测量单元准备近端肱骨和植入肱骨组件的示例性过程流程图。
图188是作为反向肩关节置换手术的一部分使用符合本公开的惯性测量单元准备肩胛窝和植入肩胛盂球的示例性过程流程图。
详细描述
下面对本公开的示例性实施方式进行描述和说明,以涵盖骨外科的各个不同方面,包括骨骼和组织重建、患者特异性和大规模定制的骨外科植入物、性别和种族特异性骨外科植入物、切割引导器、创伤防护板、骨移植物切割和放置引导器和患者特异性仪器。当然,对于本领域普通技术人员来说,显然在下面讨论的实施方式在本质上是示例性的,并且可以被重构而不背离本发明的范围和精神。然而,为清楚和精确起见,下面讨论的示例性实施方式可以包括普通技术人员应该认识到的不必定落于本发明范围之内的任选的步骤、方法和特点。
参考图1-8,变形解剖结构或部分解剖结构的重建是卫生护理提供者面对的复杂难题之一。解剖结构的丢失可能是出生状况、肿瘤、疾病、人身伤害或以前手术的失败的结果。作为为各种不同病患提供治疗的一部分,卫生护理提供者可能发现重建解剖结构或构建解剖结构对促进各种不同病症的治疗来说是有利的,所述病症可以包括但不限于骨断裂/破碎、骨退化、骨外科植入物修正、关节退化和定制仪器设计。例如,现有技术的髋重建解决方案需要产生健康患者解剖结构的镜像,由于如图15-19中所示天然存在的不对称性,所述镜像可能不是健康解剖结构的准确反映。
本公开提供了用于骨骼和组织重建的系统和方法。为了进行这种重建,所述系统和相关方法利用了代表一个或多个人的解剖图像。对这些图像进行处理以产生模拟所讨论的正确解剖结构的虚拟三维(3D) 组织模型或一系列虚拟3D组织模型。随后,使用所述系统和相关方法产生用于重建手术的模具和/或其他装置(例如固定装置、移植装置、患者特异性植入物、患者特异性手术引导器)。
如图1中所示,示例性的系统流程的概述始于接收代表解剖结构的输入数据。该解剖结构可以包含在组织退化或由遗传引起的组织缺失情形中的部分解剖结构,或者该解剖结构可以包含由遗传或环境条件引起的变形解剖结构,或者该解剖结构可以包含由一个或多个解剖结构破碎引起的破碎组织。解剖结构输入数据包含所讨论的解剖结构的二维(2D)图像或三维(3D)表面表述,其可以例如采取表面模型或点云的形式。在使用2D图像的情形中,这些2D图像被用于构建所讨论的解剖结构的3D虚拟表面表述。本领域技术人员熟悉利用解剖结构的2D图像来构建3D表面表述。因此,为增加简便性,这一过程的详细解释已被省略。例如,解剖结构输入数据可以包含X-射线图像、计算机断层扫描(CT)图、磁共振图像(MRI)或任何其他成像数据中的一者或多者,所讨论的组织的3D表面表述可以从其产生。
参考图50和表I,在使用X-射线图像构建虚拟3D骨骼模型的情形中,已发现成像期间的骨骼旋转在正确构建模型中发挥重要作用。换句话说,如果人们在图像之间出现骨骼旋转的情况下尝试编纂X-射线图像,需要将所述X-射线图像规则化以说明这种骨骼旋转。
例如,在股骨近端的情形中,已发现6和15度的骨骼旋转引起从 X-射线图像提取的测量值的显著变化。例如,这些测量值包括但不限于近端角度、头部缢缩和髓内管宽度。正如在表I中反映出的,对于在零度(即通过初始X-射线建立的起始点)下进行X-射线成像的同一股骨来说,旋转6度和旋转15度表现出不同的近端角度、头部缢缩和髓内管宽度,正如使用像素计算的,其中每个像素大小约为0.29毫米。具体来说,近端角度随着旋转增加而增加,头部缢缩也是如此,但是髓内管宽度不是如此。在这个示例性表中,三个横向平面沿着纵轴间隔排列,其中每个平面对应于测量髓内管宽度的位置。正如在表I中反映出的,对于同一位置来说,髓内管的宽度随着旋转角度而变。因此,正如将在后文中更详细讨论的,当使用X-射线图像构建骨骼的3D虚拟模型时,在成像期间发生骨骼旋转的意义上,人们必须考虑旋转偏差。
然而,应该理解,前述内容是可以用于示例性系统和方法的解剖结构的示例性描述,因此绝不打算限制其他解剖结构依照本公开的方法用于本发明的系统。当在本文中使用时,组织包括骨骼、肌肉、韧带、肌腱以及在多细胞生物体中具有特定功能的任何其他确定种类的结构材料。因此,当在骨骼的情形中讨论所述示例性系统和方法时,本领域技术人员应该认识到所述系统和方法对其他组织的适用性。
再次参考图1,将输入到系统的解剖结构数据导向三个模块,其中两个涉及解剖结构数据的处理(完整骨骼重建模块、患者特异性模块),而第三个(异常数据库模块)将所述解剖结构数据作为数据库的一部分编入目录。第一个处理模块、即完整骨骼重建模块使用从统计图集模块接收的数据处理输入的解剖结构数据,以产生所讨论的骨骼的虚拟3D模型。该3D模型是所讨论的骨骼的完整、正常的重建。第二个处理模块、即患者特异性模块使用从完整骨骼重建模块接收的数据处理输入的解剖结构数据,以在一个或多个最终骨外科植入物之外还产生一个或多个模具、固定系统、移植物成形工具和渲染。渲染是指重建的解剖结构的可视化,用于有关预期手术结果的反馈。更具体来说,患者特异性模块适合于产生被设计成精确拟合患者特异性解剖结构的完全定制的装置,尽管患者的解剖结构严重偏离正常。此外,患者特异性模块利用来自于完整骨骼重建模块的虚拟3D重建的骨骼模型来自动鉴定解剖区域和用于装置设计参数的特点(例如拟合区域和/或形状)。通过这种方式,患者特异性数据被用于确定设计参数,以便输出仪器和任何植入物精确拟合患者的特定解剖结构。患者特异性模块的示例性用途将在后文中更详细讨论。为了更详细地理解所述系统的功能和过程,下面将从统计图集模块开始解释所述系统的模块。
如图1和2中所示,统计图集模块记录一个或多个解剖结构(例如骨骼)的虚拟3D模型,以捕获给定群体中固有的解剖学变化。在示例性形式中,统计图集记录一个或多个解剖结构的解剖学特点的数学表述,其被表示成平均表述和围绕所述平均表述的变差。通过将解剖学特点表示成数学表述,统计图集允许自动测量解剖结构,并且正如将在后文更详细讨论的,允许重建丢失的解剖结构。
为了在整个共有解剖结构中提取解剖学变差,将输入的解剖结构数据与通常被称为模板3D模型或解剖学3D模板模型的整个群体中的共同参比框架进行比较。这种模板3D模型在图形显示器上被直观地表示成3D模型,它可以旋转并以其他方式直观操作,但是包含所讨论的组织的整个统计图集中所有解剖结构的解剖学表面特点/表述的数学表述(即对于给定骨骼来说,所述骨骼的所有性质在从所述模板3D模型产生的统计图集的整个群体中共享)。模板3D模型可以是多个解剖学表述的组合或单个代表性事例,并且可以代表所述统计图集的最低熵状态。对于待添加到统计图集的每个解剖结构(即输入的解剖结构数据),产生解剖学3D模型,并使解剖学3D模型和模板3D模型两者经历规则化过程。
在所述规则化过程中,将所述解剖学3D模型相对于所述模板3D 模型的尺度进行规则化。规则化过程可以包括缩放解剖学3D模型和模板3D模型中的一者或两者以具有共同的单位尺度。在解剖学3D模型和模板3D模型规则化后,所述规则化的解剖学3D模型和模板3D模型被赋予尺度不变性,以便可以不依赖于尺度(在这种情况下意味着尺寸)使用形状特点。在规则化完成后,通过尺度空间映射和特点提取工序对两个3D模型进行处理。
尺度空间映射和特点提取本质上是多分辨率特点提取过程。具体来说,这一过程在多个特点尺度下提取形状特异性特点。首先,选择多个解剖学特点,其各自代表在不同尺度空间下存在的特点。随后,对于所选解剖学特点的每个尺度空间表述,提取模型特异性特点。这些提取到的特点被用于取出模板3D模型与解剖学3D模型之间的鲁棒的(对于噪音来说)配准参数。在该多分辨率特点提取过程之后,通过多分辨率3D配准过程处理提取到的数据。
参考图2-5,所述多分辨率3D配准过程使用尺度空间提取的特点在解剖学3D模型与模板3D模型之间进行仿射配准计算,以便配准所述两个模型。具体来说,将解剖学3D模型和模板3D模型通过刚性配准过程进行处理。如图5中所示,这个刚性配准过程有效地将解剖学 3D模型与模板3D模对齐,以确保两个模型在同一空间中并且没有姿态奇点。为了将所述3D模型对齐,将与每个模型相关的型心对齐。此外,将每个3D模型的主轴对齐以使两个3D模型的主要方向相同。最后,通过进行迭代最近点计算将3D模型之间的位姿差异最小化。
在刚性配准之后,使用相似性配准过程将3D模型配准。这一过程包括通过计算使模板3D模型和解剖学3D模型两者的正常尺度特点(即脊)最好地对齐的相似性变换,将模板3D模型和解剖学3D模型迭代地对齐。迭代相似性对齐算法是迭代最近点算法的变化形式。在每次迭代中,计算点对之间的旋转、平移和缩放比例直至会聚。使用用 Kd-tree计算的距离查询或一些其他的空间分割数据结构来评估两个点集之间的配对或对应。具体来说,利用两个模型的脊来进行计算匹配点对过程。在这个示例性描述中,脊是指3D模型上的单一主曲率沿着其曲率线具有极值的点。作为计算匹配点对过程的一部分,鉴定3D模型的脊上彼此匹配的点。接下来,对两个3D模型的脊进行相似性变换计算过程,在其中计算使两个模型的脊最好地对齐的旋转、平移和缩放比例。随后进行变换点过程,它有效地将计算出的旋转、平移和缩放比例应用于模板3D模型脊。随后,计算每个匹配的点集之间的均方根误差或距离误差,然后计算相对均方根误差或距离误差与以前过程相比的变化。如果相对均方根误差或距离误差的变化在预定阈值之内,则进行变换过程以将最终的旋转、平移和缩放比例应用于模板3D模型。
铰接式配准过程紧随相似性配准过程之后并接收来自于尺度空间特点过程的输入数据。在尺度空间特点过程中,在不同尺度空间下从模板3D模型和解剖学3D模型提取特点。每个尺度空间通过使用高斯平滑函数对原始解剖学3D模型进行卷积来确定。
铰接式配准过程的目的是将模板3D模型的“n”个尺度空间特点与在解剖学3D模型上计算的“m”个尺度空间特点匹配。在模板3D 模型和解剖学3D模型上检测到的特点的数目之间的差异是由解剖学变化性造成的。这种检测到的特点数目的差异可能引起模板3D模型与解剖学3D模型之间的许多关联。因此,进行双向的相互特点匹配以容纳这种变化性并实现所有相互特点之间的准确匹配。具体来说,在尺度空间中在模板3D模型上计算特点集。在这个示例性过程中,特点集是代表突出解剖结构(例如盆骨中的髋臼杯、腰椎中的棘突)的连通点集。同样地,在尺度空间中在解剖学3D模型上计算特点集。匹配特点对过程使用形状描述符(例如曲率、形状指数等)将在模板3D模型上计算的特点集匹配到解剖学3D模型上的特点集。这个过程的结果是模板3D模型与解剖学3D模型之间特点集的“n-m”映射。如有必要,进行重新分组过程以将匹配的特点集重新分组到单一特点集中(例如,如果检测到髋臼杯是两块,则这个过程将所述两块重新分组到单一特点集中)。然后,进行计算过程以计算模板3D模型和解剖学3D模型上匹配的特点集中每个点之间的对应。随后进行仿射计算变换过程,以便计算将模板3D模型上每个匹配的特点集变换成它在解剖学3D模型上的对应特点集的旋转、平移和剪切。随后,使用计算出的仿射变换参数(即旋转、平移和剪切)变换模板3D模型。最后,进行刚性对齐过程以对齐模板3D模型和解剖学3D模型上的每个匹配的特点集。
在铰接式配准过程和正常尺度特点过程后进行的非刚性配准过程,包括将模板3D模型上的所有表面顶点匹配到上解剖学3D模型的顶点,并计算初始对应。然后将该对应用于计算将模板3D模型上的每个顶点移动到解剖学3D模型上的匹配点的变形场。匹配在同一类别中的顶点(即尺度空间特点顶点、正常尺度特点顶点或非特点顶点)之间进行。在正常尺度特点过程的情形中,在原始尺度空间(脊)、意味着原始输入模型中计算模板3D模型和解剖学3D模型上的形状特点。
具体来说,作为非刚性配准过程的一部分,在模板3D模型(TMssf) 和解剖学3D模型(NMssf)上计算尺度空间特点。模板3D模型和解剖学3D模型上的每个特点集使用“k”邻近点来生长。对模板3D模型尺度空间特点使用对齐过程以匹配它在解剖学3D模型上的相应特点。考虑两个点云即参照(X)和移动(Y),目的是将两个点云反复对齐,以在最小相对均方根误差和最大角度阈值的约束下最小化总体误差测度。在正常尺度下使用迭代最近点进行重新对齐过程,以将模板3D模型上的特点集与解剖学3D模型上的匹配集对齐。在重新对齐后,计算模板3D模型上的每个特点集和解剖学3D模型上的匹配特点集中的点之间的点对应。解剖学3D模型上的匹配点应该具有接近于模板3D模型点的表面法线方向。输出被转发到计算变形场步骤。
与尺度空间特点计算过程并行地,对模板3D模型(TMnfp)和解剖学3D模型(NMnfp)的非特点点或模板3D模型表面上不属于尺度空间特点或正常尺度特点的剩余点集依照对应计算进行处理,以计算模板3D模型上的非特点点与解剖学3D模型上的非特点点之间的点对应。新模型上的匹配点应该具有接近于模板模型点的表面法线方向。输出被转发到计算变形场步骤。
此外,与尺度空间特点计算过程并行地,使用AICP将模板3D模型(TM nsf)上的正常尺度特点(即脊)与解剖学3D模型(NM nsf) 上的正常尺度特点(即脊)对齐。AICP是迭代最近点计算的变化形式,其中在每次迭代中,计算匹配的点集之间的平移、旋转和缩放比例。在对齐过程后,进行对应过程。
对来自于尺度空间特点计算过程、对应过程和对齐过程的输出进行变形过程,在其中计算变形场以将模板3D模型上的每个点移向它在解剖学3D模型上的匹配点。
对非刚性配准过程的输出进行松弛过程,以便将模板3D模型网格的顶点移动到更接近多分辨率配准步骤后解剖学3D模型的表面并平滑输出模型。具体来说,通过对应计算对正规空间中的模板3D模型 (TM ns)和正规空间中的解剖学3D模型(NM ns)进行处理,以使用法向约束的球形搜索算法计算模板3D模型上与解剖学3D模型最接近的顶点。这种计算使用两种模型的最接近的顶点,产生来自于模板 3D模型中的每个顶点和它在解剖学3D模型中的匹配顶点的对应矢量,这可能产生超过一个来自于解剖学3D模型的匹配点。使用模板3D模型上每个顶点的匹配点,在距所述点和匹配点的欧几里得距离的基础上计算解剖学3D模型上的匹配点的加权平均值。此时,使用加权平均值更新所述模板3D模型,以便使用计算出的加权平均距离移动模板 3D模型上的每个点。在计算加权过程后,对模板模型上的每个点进行松弛过程,以便发现解剖学3D模型表面上最接近的点并将其移动到该点。最后,对变形模板3D模型进行平滑化操作以除去噪音。然后对得到的配准的3D模型(即模板和解剖学3D模型)进行自由变形过程。
所述自由变形过程使用解剖学3D模型的表面来变形模板3D模型的表面。更具体来说,在加权点对点的基础上,使用模板3D模型表面和解剖学3D模型表面两者上相互匹配的点,将模板3D模型的表面反复移动。
参考图2和6,在所述自由变形过程后,对解剖学3D模型进行对应计算过程,以确定解剖学3D模型与变形的模板3D模型之间的偏差。这个对应计算过程细化来自于自由变形步骤的模板3D模型,以进行模板变形3D模型和变形解剖学3D模型上所选标志位置的最终匹配。通过这种方式,对应计算过程计算并记录3D模型之间尺寸和形状的变差,其被记录为围绕平均模型的偏差。这种对应计算过程的输出是规则化的解剖学3D模型和已被更新以考虑到解剖学3D模型中的变差的修正的模板3D模型的相加。换句话说,图2中概述的过程的输出是已被修改以具有与修正的模板3D模型相一致的性质(例如点对应)的规则化的解剖学3D模型,以便于完整解剖结构重建(例如完整骨骼重建)。
参考图1和7,将来自于统计图集模块和解剖结构数据的输入导向全解剖结构重建模块。例如,所讨论的解剖结构可以是骨骼或多个骨骼。然而,应该指出,使用本文中描述的示例性硬件、过程和技术可以重建骨骼之外的解剖结构。在示例性形式中,全解剖结构重建模块可以接收关于部分、变形或破碎盆骨的输入数据。输入解剖学数据包含所讨论的解剖结构的二维(2D)图像或三维(3D)表面表述,其可以例如采取表面模型或点云的形式。在使用2D图像的情形中,这些 2D图像被用于构建所讨论的解剖结构的3D表面表述。本领域技术人员熟悉使用解剖结构的2D图像来构建3D表面表述。因此,为简洁起见,这个过程的详细解释被省略。例如,输入解剖学数据可以包含X- 射线图像、计算机断层扫描(CT)扫描图、磁共振图像(MRI)或可以产生3D表面表述的任何其他成像数据中的一者或多者。正如将在后文更详细讨论的,该输入解剖学数据可以非限制性地用于:(1)鉴定最接近的统计图集3D骨骼模型的起点;(2)使用一组3D表面顶点进行配准;以及(3)重建输出的最终松弛步骤。
如图7中所示,使用所述输入解剖学数据(例如患者的骨骼模型) 来鉴定统计图集中最近似于所讨论的患者解剖结构的解剖学模型(例如骨骼模型)。这一步骤在图3中被描绘成发现图集中最接近的骨骼。为了首先鉴定统计图集中最近似于患者骨骼模型的骨骼模型,使用一个或多个相似性度量将患者骨骼模型与统计图集中的骨骼模型进行比较。最初相似性度量的结果是从统计图集选择作为“初始猜想”用于后续的配准步骤的骨骼模型。所述配准步骤使用所选的图集骨骼模型 (即初始猜想骨骼模型)配准患者骨骼模型,使得输出是与图集骨骼模型对齐的患者骨骼模型。在配准步骤之后,优化对齐的“初始猜想”的形状参数以使所述形状匹配患者的骨骼形状。
优化在这种情况下来自于统计图集的形状参数,以便使用非变形或现有骨骼的区域来最小化重建与患者骨骼模型之间的误差。改变形状参数值允许表述不同的解剖学形状。将这一过程在不同尺度空间下重复,直至实现重建形状的趋同(可能作为迭代之间的相对表面变化或容许的迭代的最大数目来度量)。
进行松弛步骤来变形所述优化的组织,以最好地匹配原始患者3D 组织模型。与示例性情况相一致,将从趋同步骤输出的来自于重建的盆骨模型的丢失解剖结构施加到患者特异性3D盆骨模型,由此产生患者的重建盆骨的患者特异性3D模型。更具体来说,将重建的盆骨模型上的表面点直接松弛(即变形)到患者特异性3D盆骨模型上,以使重建的形状最好地匹配到患者特异性形状。这个步骤的输出是完全重建的患者特异性3D组织模型,其代表了患者的正常/完整解剖结构应有的状况。
参考图1,将异常数据库用作数据输入并训练缺陷分类模块。具体来说,异常数据库含有异常解剖学特点特异性的数据,其包括解剖结构表面表述和相关的临床和人口统计数据。
参考图1和8,将代表正常/完整组织的完全重建的患者特异性3D 组织模型和来自于异常数据库的代表异常/不完整组织的输入解剖学数据(即3D表面表述或可以从其产生3D表面表述的数据)输入到缺陷分类模块。该来自于异常数据库的解剖学数据可以是组织退化情形中的部分解剖结构或由遗传造成的组织缺失,或者这种解剖结构可以是由遗传或环境条件(例如手术修正、疾病等)产生的变形的解剖结构,或者这种解剖结构可以是由一种或多种解剖结构破碎造成的破碎组织。例如,输入解剖学数据可以包含X-射线图像、计算机断层扫描(CT) 扫描图、磁共振图像(MRI)或可以从其产生3D表面表述的任何其他成像数据中的一者或多者。
所述缺陷分类模块从与所讨论的解剖结构的正常3D表述相偶联的异常数据库提取多个异常3D表面表述,以产生定量缺陷分类系统。该缺陷分类系统被用于产生每个缺陷类别或簇的“模板”。更广义来说,缺陷分类模块将解剖学缺陷分成由密切相关的缺陷(是指那些具有相似形状、临床、外观或其他特征的缺陷)构成的类别,以便于产生应对这些缺陷的卫生护理解决方案。该缺陷分类模块使用软件和硬件对缺陷进行自动分类,作为消除或减少术前数据与手术中观察者目测数据之间的差异的手段。传统上,获取术前放射照片作为定性分析解剖学重建的必要程度的手段,但是这产生充其量是随意的术前计划。目前,手术中观察者做出解剖结构缺陷程度的最终确定,并在许多情况下得出依赖于放射照片的术前计划是有缺陷的或不完整的结论。结果,该缺陷分类模块通过减小与缺陷分类相关的观察者间和观察者内变差并为分类新的缺陷病例提供定量度量,改进了现有的分类系统。
作为缺陷分类模块的一部分,所述模块可以作为输入获取一个或多个分类类型用作初始状态。例如,在盆骨的情形中,缺陷分类模块可以作为输入使用对应于美国骨外科医生学会(American Academy of Orthopaedic Surgeons(AAOS))D’Antonio等人的骨骼缺陷分类结构的缺陷特点。这一结构包括如下4种不同类型:(1)I型,对应于节断性骨缺损;(2)II型,对应于腔性骨缺损;(3)III型,对应于合并的节断性和腔性骨缺损;以及(4)IV型,对应于盆骨不连续。可选地,缺陷分类模块可以用在图10中为盆骨图示的Paprosky骨骼缺陷分类结构来编程。这种结构包括如下3种不同类别:(1)I型,对应于没有骨溶解的支持性轮圈;(2)II型,对应于具有完整的支持性柱和少于2厘米的上内或侧向迁移的扭曲的半球;以及(3)III型,对应于超过2厘米的上迁移和严重的坐骨溶解并伴有Kohler's线断裂或完整。此外,缺陷分类模块可以使用改良的Paprosky骨骼缺陷分类结构来编程。这种结构包括如下6种不同类别:(1)1型,对应于没有组件迁移的支持性轮圈;(2)2A型,对应于扭曲的半球,但上迁移少于3 厘米;(3)2B型,对应于具有小于1/3轮圈周长的更大的半球扭曲,并且圆顶仍具有支持性;(4)2C型,对应于完整的轮圈,向Kohler's 线内向迁移,并且圆顶仍具有支持性;(5)3A型,对应于超过3厘米的上迁移和严重的坐骨溶解并伴有完整的Kohler's线;以及(6)3B 型,对应于超过3厘米的上迁移和严重的坐骨溶解并伴有断裂的 Kohler's线,并且轮圈缺陷超过周长的一半。使用输出的分类类型和参数,缺陷分类模块将解剖学数据与重建的数据进行比较,以辨别解剖学数据最近似于何种分类类型,由此对应于得到的指派分类。
作为初始步骤,向统计图集添加的步骤包括在正常图集3D骨骼模型与异常3D骨骼模型之间产生对应。更具体来说,对3D骨骼模型进行比较以辨别正常3D模型中的不存在于异常3D模型中的骨骼。在示例性形式中,通过比较每个3D骨骼模型表面上的点并产生正常3D骨骼模型表面上不存在于异常3D骨骼模型上的离散点的列表,来鉴定丢失/异常骨骼。这个系统也可以记录并列出(即鉴定)所述两个模型之间共有的那些表面点,或者概括指出,除非被记录为不存在于异常3D 骨骼模型上的点,否则所有其他点都共同存在于两个骨骼模型中(即在正常和异常骨骼模型两者上)。因此,这个步骤的输出是带有统计图集对应的异常3D骨骼模型和来自于正常图集3D骨骼模型的特点 (点)的列表,所述列表指示该特点(点)在异常3D骨骼模型中是存在还是缺失。
在产生正常图集3D骨骼模型(从完整骨骼重建模块产生)与异常 3D骨骼模型(从输入的解剖学数据产生)之间的对应后,将来自于异常3D骨骼模型的丢失/异常区域定位在正常图集3D骨骼模型上。换句话说,将正常图集3D骨骼模型与异常3D骨骼模型进行比较以鉴定和记录在正常图集3D骨骼模型中存在的从异常3D骨骼模型丢失的骨骼。定位可以以多种方式进行,包括但不限于曲率比较、表面积比较和点云面积比较。最后,在示例性形式中,将丢失/异常骨骼作为鉴定丢失/ 异常区域的几何边界的一组边界点来定位。
使用所述边界点,缺陷分类模块使用输入的临床数据从丢失/异常区域提取特点。在示例性形式中,提取到的特点可以包括形状信息、体积信息或用于描述缺陷(即丢失或异常)区域的总体特征的任何其他信息。这些特点可以在现有的临床数据例如正在进行的缺陷分类数据或不必定与解剖学特点相关的患者临床信息(人口统计信息、疾病史等)的基础上精炼。这个步骤的输出是代表缺陷区域的数学描述符,其在后续步骤中被用于对相似的组织(例如骨骼)变形进行分组。
在统计分析的基础上对所述数学描述符进行聚类或分组。具体来说,对描述符进行统计分析并与来自于其他患者/尸体的其他描述符进行比较,以鉴定给定群体内独特的缺陷类别。显然,这种分类的前提在于来自于多个患者/尸体的多个描述符,这可以随着患者/尸体数目的增加而精炼离散的组的分类和鉴定。来自于这种统计分析的输出是一组缺陷类别,其被用于分类新输入的解剖学数据并确定模板的数目。
将缺陷分类模块的输出导向模板模块。在示例性形式中,所述模板模块包括对于由缺陷分类模块所鉴定的每个缺陷分类来说特异性的数据。例如,对于给定缺陷分类来说,每个模板包括缺陷骨骼的表面表述、缺陷的位置和与缺陷骨骼相关的测量值。该模板数据可以采取表面形状数据、点云表述、一个或多个曲率分布情况、维度数据和物理量数据的形式。来自于模板模块和统计图集的输出被大规模定制模块用于设计、试验并允许大规模定制的植入物、固定装置、仪器或模具的制造。大规模定制模块的示例性用途将在后文中更详细讨论。
参考图1和20,描述了用于为部分、变形和/或破碎解剖结构患者产生患者特异性骨外科植入物引导器和相关的患者特异性骨外科植入物的示例性过程和系统。出于示例讨论的目的,将描述用于具有部分解剖结构的患者的全髋关节置换术。然而,应该理解,所述示例性过程和系统适用于在存在不完整或变形解剖结构的情况下适合于患者特异性定制的任何骨外科植入物。例如,所述示例性过程和方法适用于在存在骨退化(部分解剖结构)、骨变形或破碎骨的情况下的肩置换和膝置换。因此,尽管在后文中讨论的是髋关节植入物,但本领域技术人员将会理解所述系统和过程对用于原始骨外科或骨外科修正手术的其他骨外科植入物、引导器、工具等的适用性。
盆骨不连续是最通常与全髋关节置换术(THA)相关的一种独特形式的骨丧失,其中骨溶解或髋臼破裂可以引起盆骨的上面变得与下部分开。骨丧失的量和严重性以及植入物的生物长入潜力,是可以影响特定患者的治疗选择的一些因素。在严重骨丧失和失去骨盆完整性的情况下,可以使用定制的三法兰杯。首次在1992年引入,这种植入物与现有的笼相比具有几个优点。它可以为盆骨不连续提供稳定性,消除对结构性植入和笼的手术中轮廓修整的需求,并促进所述构建物骨整合到周围的骨骼中。
不论背景如何,不论所讨论的是患者的部分、变形和/或破碎的解剖结构,用于产生患者特异性植入物和/或引导器的示例性系统和过程利用前述3D骨骼模型重建的示例性的系统和过程(参见图1-7及其前述的示例性讨论)来产生患者的重建解剖结构的三维模型。更具体来说,在涉及盆骨不连续的全髋关节置换术的情形中,所述示例性患者特异性系统利用患者盆骨数据产生患者完整盆骨的3D模型,其是体侧特异性的(右侧或左侧)。因此,为简洁起见,对将患者解剖结构数据用于部分解剖结构和产生患者解剖结构的3D重建模型的系统和过程的讨论被省略。因此,对用于为具有部分、变形和/或破碎解剖结构的患者产生患者特异性骨外科植入物引导器和相关的患者特异性骨外科植入物的过程和系统的描述,将在三维重建模型形成后描述。
具体参考图20-22和27,在产生盆骨和股骨的患者特异性重建3D 骨骼模型后,将不完整的患者特异性3D骨骼模型(对于盆骨和股骨来说)和重建的3D骨骼模型(对于盆骨和股骨来说)两者用于产生患者特异性骨外科植入物和用于植入物和/或其紧固件的患者特异性放置引导器。具体来说,提取缺陷形状步骤包括产生患者特异性3D模型与重建的3D模型之间的对应(盆骨模型之间的对应和股骨模型之间的对应,但不是一个股骨模型与一个盆骨模型之间的对于)。更具体来说,对3D模型进行比较以辨别重建的3D模型中的哪块骨骼不存在于患者特异性3D模型中。在示例性形式中,通过比较每个3D模型表面上的点并产生重建的3D模型表面上不存在于患者特异性3D模型上的离散点的列表,来鉴定丢失/异常骨骼。所述系统也可以记录并列出(即鉴定)在两个模型之间共同的那些表面点,或者概括地注明除非被记录为在患者特异性3D模型上不存在的点,否则其他点都共同存在于两个模型中(即在重建的和患者特异性3D模型两者上)。
参考图21,在产生重建的3D模型(从完整骨骼重建模块产生) 与患者特异性3D模型(从输入的解剖学数据产生)之间的对应后,将来自于患者特异性3D模型的丢失/异常区域定位在重建的3D模型上。换句话说,将重建的3D模型与患者特异性3D模型进行比较,以鉴定并记录从患者特异性3D模型丢失的存在于重建的3D模型中的骨骼。定位可以以多种方式进行,包括但不限于曲率比较、表面积比较和点云面积比较。最后,在示例性形式中,将丢失/异常骨骼定位,并且输出包含两个列表:(a)第一列表,其鉴定对应于重建的3D模型的在患者特异性3D模型中不存在或变形的骨骼的顶点;以及(b)第二列表,其鉴定对应于重建的3D模型的在患者特异性3D模型中也存在并且正常的骨骼的顶点
参考图21、22和27,在提取缺陷形状步骤后,进行植入物位点步骤。输入来自于提取缺陷形状步骤的两个顶点列表和来自于统计图集的正常骨骼(例如盆骨、股骨等)的3D模型(参见图1和2及其前述的示例性讨论)以辨别用于股骨或盆骨植入物的固定位置。更具体来说,自动选择固定位置(即植入物位点)以使每个固定位置都位于患者具有残骨之处。相反,固定位置不被选择在患者残骨的缺陷区域中。通过这种方式,固定位置的选择不依赖于最终的植入物设计/形状。固定位置的选择可以使用形状信息和统计图集位置自动进行。
如图21中所示,在植入物位点步骤后,下一步是产生患者特异性植入物参数。为了完成这一步骤,输入植入物参数化模板,其通过足以定义植入物的潜在形状的一组多个参数来定义所述植入物。例如,在盆骨重建以置换/增大缺失或退化的髋臼的情形中,植入物参数化模板包括用于替换髋臼杯的取向的角度参数和容纳股骨头的维度的深度参数。髋臼植入物的其他参数可以包括但不限于髋臼杯直径、朝向、法兰位置和形状、固定螺栓的位置和取向。在多孔植入物的情形中,应该包括孔隙的位置和结构特征。例如,在股骨重建以置换/增大缺失或退化的股骨的情形中,植入物参数化模板包括用于替换股骨头的取向的角度参数、颈部长度、头部缢缩、近端角度以及股骨外部和髁间通道的横截面分析。本领域技术人员将会理解,所选的用于定义植入物的潜在形状的参数将随着待置换或增补的解剖结构而变。因此,足以定义植入物的潜在形状的参数的穷举性名单是不现实的。然而,如图22中所示,可以利用重建的3D盆骨模型来获得髋臼杯的半径,鉴定包含髋臼杯周围上脊的盆骨,鉴定髋臼杯相对于残留盆骨的取向。此外,可以考虑到植入物位点对所述参数进行精炼,以使植入物最好/ 更好地拟合患者特异性解剖结构。
在最后确定足以定义植入物的潜在形状的所述一组多个参数后,进行植入物的设计。更具体来说,构建整个植入物表面模型的初始迭代。该整个植入物表面模型的初始迭代由患者特异性轮廓和为植入区域估算的轮廓的组合来定义。所述估算的轮廓从重建的3D骨骼模型、丢失的解剖学骨骼和从重建的3D骨骼模型提取的特点来确定。这些特点和植入物位点的位置可以自动确定,并被用于确定植入物总体形状,正如在图22中为髋臼杯植入物所描绘的。
再次参考图20,依照定制(即患者特异性)计划工序对整个植入物表面模型的初始迭代进行处理。该定制计划工序可以包括来自于外科医生和工程师的输入作为迭代审查和设计过程的一部分。具体来说,外科医生和/或工程师可以审查整个植入物表面模型和重建的3D骨骼模型,以确定是否需要对整个植入物表面模型做出改变。这种审查可以引起整个植入物表面模型的迭代,直至在工程师与外科医生之间达到一致。来自于这个步骤的输出是最终植入物的表面模型,其可以采取CAD文件、CNC机器码或快速制造指令的形式,以产生最终的植入物或实体模型。
参考图20、22和23,与患者特异性骨外科植入物的设计同时或之后,是患者特异性放置引导器的设计。在正如上面的示例性形式中讨论的髋臼杯植入物的情形中,可以设计并制造一种或多种外科外科器械,以协助放置患者特异性髋臼杯。在将患者特异性植入物设计成具有与残骨匹配的尺寸和形状后,可以利用和并入患者特异性植入物的轮廓和形状作为放置引导器的一部分。
在示例性形式中,髋臼放置引导器包含3个法兰,其被配置为接触髂骨、坐骨和耻骨表面,其中所述3个法兰通过环相互连接。此外,放置引导器的法兰可以具有与髋臼杯植入物一致的形状、尺寸和轮廓,使得放置引导器具有与为髋臼杯植入物所计划的一致的位置。换句话说,髋臼放置引导器被造型为患者解剖结构(髂骨、坐骨和耻骨的部分表面)的负形特征,就像髋臼杯植入物那样,使得放置引导器完美拟合在患者解剖结构上。但是植入物引导器与植入物的显著差异在于它包括一个或多个固定孔,所述固定孔被配置用于指导钻孔和/或放置紧固件。在示例性形式中,放置引导器包括在图像分析(例如微型CT) 的基础上确定了尺寸和取向的孔,以确保任何钻头或在将髋臼杯植入物固定于残留盆骨时使用的其他引导器(例如榫钉)的正确取向。孔的数目和取向随着残骨而变,残骨也影响髋臼杯植入物的形状。图23 描绘了在全髋关节置换手术中使用的患者特异性放置引导器的实例。在另一种情况下,引导器可以被制造成使其拟合在植入物中并且仅引导固定螺栓的方向。在这种形式中,引导器被造型为植入物的负形,使得它可以直接放置在植入物上。然而,患者特异性重建植入物的至少一部分尺寸、形状和轮廓的并入是留待以后处理的主题,不论患者特异性植入物将要偶联到的目标骨骼是哪块骨骼。
利用本文描述的示例性系统和方法可以提供大量信息,这些信息可以造成更高的骨外科放置准确性、更好的解剖学整合以及在手术前通过重建的三维模型计算真正的角度和平面取向的能力。
参考图26,描述了使用可大规模定制的组件产生定制的骨外科植入物的示例性过程和系统。出于示例性讨论的目的,将描述具有严重髋臼缺陷的患者的全髋关节置换手术。然而,应该理解,所述示例性过程和系统适用于在存在不完整解剖结构的情况下适合于大规模定制的任何骨外科植入物。
严重髋臼缺陷需要特殊的手术和植入物组件来修复。一种方法是定制的三法兰,其是完全定制的植入物,由髋臼杯和附连于髂骨、坐骨和耻骨的三个法兰构成。与所述示例性过程和系统相反,现有技术的三法兰植入物包含单个复杂组件,其制造繁琐并且需要为每个病例重新设计整个植入物(即完全患者特异性的)。所述示例性过程和系统产生一种定制的三法兰植入物,其除了完全定制的组件之外还以模块方式利用可大规模定制的组件,以允许定制装配和孔隙度。
进行符合所述示例性过程的预先计划步骤以确定三个法兰相对于髋臼杯的取向、法兰接触位置以及髋臼杯的取向和尺寸。该预先计划步骤按照紧接这一部分之前的“患者特异性植入物”讨论来进行。例如,依照植入物位点步骤并如在前一部分中讨论的使用其序文中的数据输入,确定植入物固定的具体位置。通过回忆,作为该植入物位点步骤的一部分,将来自于提取缺陷形状步骤的两个顶点列表和来自于统计图集的正常盆骨的3D模型(参见图1和2及其前述的示例性讨论) 输入,以辨别定制的三法兰的固定位置。更具体来说,将固定位置(即植入物位点)选择成各自位于患者具有残骨之处。换句话说,固定位置不被选择在患者的残留盆骨的缺陷区域中。通过这种方式,固定位置的选择不依赖于最终的植入物设计/形状。
在确定固定位置后,使用紧接这一部分之前的“患者特异性植入物”讨论来设计三法兰组件(即法兰)。所述法兰被设计成相对于置换髋臼杯取向,使得所述髋臼杯取向提供可接受的联结功能。此外,法兰的接触表面轮廓与患者的盆骨解剖结构匹配,因为三法兰的接触表面被造型成盆骨的骨表面的“负形”。图23的示例性过程利用在图 17中描绘的所述过程的最后步骤快速原型制造法兰(或使用常规的计算机数控(CNC)设备)。在法兰被制造后,可以进行进一步机械加工步骤以提供空腔,多孔材料可以在所述空腔内添加到三法兰。
三法兰系统的不必是定制组件的一个部分是髋臼杯组件。在这种示例性过程中,首先制造一批髋臼杯,并且它们提供了在其上建立三法兰系统的基础。这些“空”杯保留在库存中,以备在需要时使用。如果需要髋臼杯具有特定孔隙度,向髋臼杯添加允许将多孔材料压力配合到髋臼杯中的机械特点。或者,如果需要髋臼杯具有特定孔隙度,可以使用一种或多种多孔涂料涂布髋臼杯。
在空杯形成和如上讨论的任何孔隙度问题解决后,通过对髋臼杯进行机械加工以接受法兰,使髋臼杯具有患者特异性。具体来说,使用法兰的虚拟模型,系统软件为法兰构建虚拟锁机构,其被转变成机器码以便将锁机构机械加工在髋臼杯中。这些锁机构允许将髋臼杯紧固到法兰,使得当将法兰固定到患者的残骨时,髋臼杯相对于残留盆骨正确取向。这种机械加工可以使用常规CNC设备,以将锁机构形成在空杯中。
在制造作为空杯的一部分的锁机构之后,使用锁机构之间的接合将法兰固定到髋臼杯。使三法兰套件(即最终植入物)经历退火过程,以促进组件之间的强烈粘合。在三法兰植入物退火后,进行灭菌步骤,然后进行适当包装以确保三法兰植入物的无菌环境。
参考图28,描述了为具有部分、变形和/或破碎的解剖结构的患者产生大规模定制的骨外科植入物引导器和相关的大规模定制的骨外科植入物的示例性过程和系统。出于示例性讨论的目的,将描述用于需要初次关节置换的患者的全髋关节置换术。然而,应该了解,所述示例性过程和系统适用于在存在不完整解剖结构的情况下适合于大规模定制的任何骨外科植入物和引导器。例如,所述示例性过程和系统适用于其中存在骨退化(部分解剖结构)、骨变形或破碎骨的肩置换和膝置换。因此,尽管在后文中讨论的是髋关节植入物,但本领域技术人员应该理解所述系统和过程对用于初次骨外科或骨外科修正手术的其他骨外科植入物、引导器、工具等的适用性。
所述示例性过程利用来自于宏观视角和微观视角的输入数据。具体来说,宏观视角包括确定骨外科植入物和相应的解剖结构的总体几何形状。相反,微观视角包括估算松质骨的形状和结构及其孔隙度。
宏观视角包括与统计图集模块通讯的数据库,所述统计图集模块记录一个或多个解剖结构(例如骨骼)的虚拟的3D模型,以捕获给定群体中固有的解剖学变化性。在示例性形式中,统计图集记录一个或多个解剖结构的解剖学特点的数学表述,其被表示成给定解剖学群体的平均表述和围绕所述平均表述的变差。参考图2和前述统计图集以及人们如何向给定群体的统计图集添加解剖结构的讨论。将来自于统计图集的输出导向自动寻找标志模块和表面/形状分析模块。
自动寻找标志模块利用来自于统计图集的输入(例如可能含有特定标志的区域)和局部几何分析来计算统计图集内每种解剖结构实例的解剖学标志。这种计算对于每个标志是特异性的。例如,区域的近似形状是已知的,并且正在搜索的标志相对于局部形状特征的位置是已知。例如,远端股骨的内上髁点的定位,通过在统计图集中内上踝点的近似位置的基础上精炼所述搜索来实现。因此,已知内上髁点是该搜索窗口内最内侧的点,所以对于统计图集中定义的内上踝区内的每个骨骼模型进行最内侧点的搜索,其中搜索的输出被鉴定为内上髁点的标志。在为统计图集群体内的每个虚拟3D模型自动计算解剖标志后,将统计图集的虚拟3D模型与形状/表面分析输出一起导向特点提取模块。
形状/表面输出来自于形状/表面模块,所述模块也接收来自于统计图集的输入。在形状/表面模块的情形中,对统计图集群体内的虚拟3D 模型进行分析以获得未被自动寻找标志所涵盖的形状/表面特点。换句话说,也计算对应于解剖结构的总体3D形状、但不属于在前面的自动寻找标志步骤中定义的特点的特点。例如,为虚拟3D模型计算曲率数据。
将来自于表面/形状分析模块和自动寻找标志模块的输出导向特点提取模块。使用标志和形状特点的组合,为图集中的每个实例计算与植入物设计相关的数学描述符(即曲率、维度)。这些描述符作为输入用于聚类过程。
在统计分析的基础上将所述数学描述符聚类或分组。具体来说,对所述描述符进行统计分析并与来自于剩余解剖结构群体的其他描述符进行比较,以鉴定群体中具有相似特点的(解剖结构的)组。显然,这种聚类的前提在于横跨整个群体的来自于多个解剖结构的多个描述符。当向聚类呈递在初始聚类中不存在的新实例时,输出的簇被精炼以更好地代表新的群体。来自于这个统计分析的输出是覆盖所有或绝大多数解剖学群体的有限数目的植入物(包括植入物家族和尺寸)。
对于每一簇来说,参数化模块提取簇内的数学描述符。所述数学描述符形成用于最终植入物模型的参数(例如CAD设计参数)。将提取到的数学描述符送入植入物表面产生模块。这个模块负责将数学描述符转变成表面描述符,为每一簇产生解剖结构的3D虚拟模型。所述 3D虚拟模型在应力测试和植入物制造之前补充微观视角。
在微观视角上,对于给定群体的每个解剖结构来说,获得指示结构完整性的数据。在示例性形式中,对于骨骼来说该数据可以包含微型CT数据,其提供针对松质骨的结构信息。更具体来说,微型CT数据可以包含所讨论的骨骼的图像(整个群体的多个骨骼的多个微型CT 图像)。随后通过提取松质骨结构模块对这些图像进行分段,以便提取松质骨的三维几何结构并为群体内的每块骨骼产生虚拟3D模型。得到的3D虚拟模型被输入到孔眼尺寸和形状模块。正如在图84中图示的,所述3D虚拟模型包括孔尺寸和形状信息,其由孔眼尺寸和形状模块评估,以确定松质骨的孔眼尺寸和大小。这种评估可用于分析骨骼的髓内管中的孔尺寸和形状,以便可以将股骨植入物的干用涂料处理或以其他方式加工以表现出多孔外表,以促进股骨的残骨与股骨植入物之间的整合。来自于该模块的输出与从植入物表面产生模块输出的 3D虚拟模型相组合,被导向虚拟应力测试模块。
应力测试模块将来自于孔眼尺寸和形状模块的植入物孔隙度数据与来自于植入物表面产生模块的植入物形状数据合并,以确定最终植入物形状模型和性质。例如,所述形状和性质包括为最终植入物模型提供与所讨论的骨骼的松质骨孔隙度粗略匹配的多孔涂层。一旦并入了所述形状和性质后,最终植入物模型经历虚拟应力测试(有限元和机械分析)以验证模型的功能品质。在功能品质不可接受的情况下,对定义植入物形状和孔隙度的参数进行修改,直至获得可接受的性能。假设最终植入物模型满足应力测试的判据,则将最终植入物模型用于产生将虚拟模型转变成真实植入物所必需的机器指令(其可以通过本领域技术人员已知的制造过程进一步精炼)。在示例性形式中,所述机器指令可以包括快速制造机器指令,以通过快速成型过程(以正确捕获多孔结构)或传统制造和快速成型的组合来制造最终植入物。
参考图29-84,描述了用于产生性别和/或种族特异性植入物的示例性过程和系统。出于示例性讨论的目的,将描述需要初次关节置换的患者的全髋关节置换手术。然而,应该理解,所述示例性过程和系统适用于适合定制的任何骨外科植入物。例如,所述示例性过程和系统适用于肩置换和膝置换以及其他初次关节置换手术。因此,尽管在后文中讨论的是髋关节植入物,但本领域技术人员应该理解所述系统和过程对用于初次骨外科或骨外科修正手术的其他骨外科植入物、引导器、工具等的适用性。
髋关节由股骨的头和盆骨的髋臼构成。髋关节的解剖结构使其成为身体中最稳定的关节之一。稳定性由刚性的杵臼构造提供。股骨头在其关节部分是几乎球形的,形成了三分之二的球。数据显示,女性的股骨头直径小于男性。在正常髋部中,假定股骨头的中心与髋臼的中心完全一致,并且将这种假设用作大多数髋系统的设计基础。然而,天然髋臼的深度不足以覆盖所有天然股骨头。股骨头的几乎圆形的部分是类球形而不是球形,因为最上方部分略微变平。这种类球形状导致载荷以环状模式分布在上极周围。
股骨头的几何中心被关节的三个轴横贯:水平轴,竖直轴和前后轴。股骨头由连接骨干的股骨颈支撑。股骨颈的轴被倾斜设置并向内上侧和前侧延伸。在正平面中股骨颈相对于干的倾斜角是颈干角。在大多数成年人中,该角度在90至135度之间变化并且是重要的,因为它决定了髋关节外展肌的有效性、肢体长度和施加到髋关节上的力。
倾斜角大于125度被称为髋外翻,而倾斜角小于125度被称为髋内翻。倾斜角大于125度对应于肢体加长、髋关节外展肌有效性降低、股骨头上的载荷增加和股骨颈上的应力增加。在髋内翻的情形中,小于125度的倾斜角对应于肢体缩短、髋关节外展肌有效性提高、股骨头上的载荷减小和股骨颈上的应力减小。股骨颈与股骨髁突的横向轴形成锐角。这个角朝向内侧和前方,并被称为前倾角。在成年人中,该角平均约为7.5度。
髋臼位于髋的侧面髂骨、坐骨和耻骨汇合之处。这三块分开的骨骼联合形成髋臼,其中髂骨和坐骨各自贡献髋臼的约五分之二,耻骨贡献五分之一。髋臼是深度不足以覆盖所有股骨头的臼,并具有形成关节和不形成关节的两个部分。然而,髋臼关节盂唇加深所述臼以提高稳定性。与关节盂唇一起,髋臼覆盖略微超过50%的股骨头。只有髋臼的侧面衬有关节软骨,其在下方被深的髋臼凹口中断。髋臼腔的中心部分比关节软骨更深并且是非关节性的。该中心部分被称为髋臼窝,并且由薄板与盆骨的界面隔开。髋臼窝对于每位患者来说是独特的区域,并被用于产生患者特异性引导物用于髋臼杯组件的钻孔和放置。此外,解剖学特点的变化性进一步保证了对群体特异性植入物设计的需求。
与现有技术非骨水泥组件的使用相关的某些问题可以造成股骨管的尺寸、形状和取向的广泛变化。股骨柄的骨外科植入物设计的挑战之一是中间外侧和前后维度的大的变化性。近端与远端股骨管尺寸的比率也存在显著变化性。在正常人群中各种不同弧线、锥角、曲线、偏移的不同组合是令人吃惊的。但这不是唯一问题。
股骨形态的祖先差异和现代人群缺乏确定标准,使得设计适合的髋关节植入物系统有困难。例如,美国印第安人、美国黑人和美国白人之间存在前部曲率、扭转和横截面形状的显著差异。亚洲与西方人群之间股骨的差异存在于股骨的前弓中,在此处中国人与高加索人的股骨相比更前部弯曲和外部旋转,并具有更小的髓内管和更小的远端髁突。同样地,高加索人股骨与日本人股骨相比,就远端髁突长度维度而言更大。在美国黑人与白人之间,在股骨近端骨矿物质密度(BMD) 和髋轴长度上也存在种族差异。更高的BMD、更短的髋轴长度和更短的转子间宽度的组合效应,可以解释在美国黑人女性中与她们的白人对应者相比骨质疏松性骨折的较低发生率。同样地,发现老年亚洲人和美国黑人男性与白人和西班牙人男性相比具有更厚的皮质和更高的 BMD,这可能对这些种族组中更大的骨强度有贡献。总的来说,美国黑人具有比美国白人更厚的骨皮质、更窄的骨内直径和更大的BMD。
对于原始髋系统来说,合并股骨和盆骨的祖先(和种族)差异变得甚至更有挑战性。修正手术产生更大的复杂性。在这些正常的解剖和种族变化性之外,进行修正手术的外科医生面对的困难被下述因素进一步加重:(a)由原来放置的假体周围的骨流失引起的股骨管扭曲;以及(b)由组件和骨水泥的移除产生的医源性缺陷。
所有前述因素引起大量髋外科医生寻找改进非骨水泥股骨假体的设计的方式。在全髋置换(初次或修正)中,理想的是建立股骨球与髋臼杯之间的最适拟合。股骨柄颈应该具有十字形横截面以降低刚性。股骨柄的长度应该使股骨柄与股骨壁在2至3个股骨管内径范围内具有平行接触。股骨柄的近端三分之一被多孔包被或羟基磷灰石(HA) 包被。股骨柄是圆柱形的(即不是锥形的),以控制弯曲载荷并允许所有旋转和轴向载荷在近端传递。股骨头位置应该重现患者自己的头中心,除非它是异常的。
尝试满足这些目标的一种方式是为每位患者单独地制造股骨假体。换句话说,制造对特定患者来说特异性的假体而不是试图改造患者骨骼以拟合现成的假体。
对于患者特异性(或大规模定制)初次和修正髋置换来说存在一些共同的设计规则。这些设计规则包括:(1)股骨柄应该是无领的(除了在修正中之外)以允许载荷均匀分布到股骨;(2)股骨柄应该具有改良的偏菱形横截面以最大化拟合/填充,但应该维持旋转稳定性;(3) 如有必要股骨柄应该弯曲以顺从患者骨骼;(4)股骨柄应该沿着曲线路径插入,在假体与骨骼之间没有间隙;(5)股骨柄颈应该具有十字形横截面以降低刚性;(6)股骨柄的长度应该使股骨柄与股骨壁在2 至3个股骨管内径范围内具有平行接触;(7)股骨柄的近端三分之一被多孔包被或羟基磷灰石(HA)包被;(8)股骨柄是圆柱形的(即不是锥形的),以控制弯曲载荷并允许所有旋转和轴向载荷在近端传递; (9)股骨柄的股骨头位置应该重现患者自己的头中心,除非它是异常的。
下面是将患者群体的性别和/或种族考虑在内,为需要初次关节置换的患者产生大规模定制的骨外科植入物的示例性过程和系统。出于示例性讨论的目的,描述了用于具有部分解剖结构的患者的全髋关节置换手术。然而,应该理解,所述示例性过程和系统适用于在存在不完整解剖结构的情况下适合于大规模定制的任何骨外科植入物。例如,所述示例性过程和系统适用于存在骨骼退化(部分解剖结构)、骨变形或破碎骨的肩置换和膝置换。因此,尽管在后文中讨论的是髋关节植入物的股骨组件,但本领域技术人员将会理解所述系统和过程对用于原始骨外科或骨外科修正手术的其他骨外科植入物、引导器、工具等的适用性。
参考图29,描绘了使用统计图集来产生大规模定制的和患者特异性的髋关节植入物两者的总体过程流程。首先,所述过程包括统计图集,其包含待分析的一块或几块骨骼的几个实例。在髋关节植入物的示例性情形中,统计图集包括盆骨和股骨的骨骼模型的几个实例。至少对髋臼组件(即髋臼)和近端股骨组件(即股骨头)进行关节表面几何分析。具体来说,所述关节表面几何分析包括对来自于给定人群的统计图集的每块骨骼进行标志、测量值和形状特点的计算。此外,所述关节表面几何分析包括产生代表所述计算的定量值例如统计值。从这些计算,对所述计算的分布进行作图并在所述分布的基础上解析。例如,对于钟形分布来说,可以观察到约百分之九十(90%)的人群被分组,使得非患者特异性植入物(例如大规模定制的植入物)可以被设计并充分拟合这种分组,从而与患者特异性植入物相比降低患者的花费。对于剩余的百分之十(10%)的人群来说,患者特异性植入物可能是更好的方法。
在大规模定制的植入物的情形中,可以利用统计图集来定量评估多少不同的组(即不同的植入物)才能够涵盖绝大多数的给定人群。这些定量评估可以产生指示基本植入物设计的通用参数的数据簇,所述基本植入物设计尽管不是患者特异性的,但比现成的可选方案更加特异。
在患者特异性植入物的情形中,可以利用统计图集来定量评估正常骨骼体现的数据以及患者骨骼与正常骨骼之间的差异。更具体来说,统计图集可以包括与平均或模板骨骼模型相关的曲率数据。然后可以使用这种模板骨骼模型来外推患者的正确骨骼的形式并制造植入物和用于执行植入手术的外科器械。
图30图示概述了统计图集在设计大规模定制的和患者特异性髋关节植入物中的用途。在植入物框的情形中,再次参考图20和21以及这些图的相关讨论。同样地,在设计者框的情形中,再次参考图20 和定制计划界面的相关讨论。最后,在患者特异性引导物框的情形中,再次参考图22和该图的相关讨论。
如图31中所示,描绘了可用于设计和制造性别和/或种族特异性髋关节植入物的示例性过程的流程图。具体来说,所述过程包括利用含有各种不同股骨近端(即包括股骨头的股骨)样本的统计图集,所述样本已通过相关数据被鉴定为来自于男性或女性或骨骼所属的人的种族。此外,统计图集模块记录一个或多个解剖结构(例如骨骼)的虚拟3D模型,以捕获给定性别和/或种族的人群中固有的解剖学变化性。在示例性形式中,所述图集记录一个或多个解剖结构的解剖学特点的数学表述,其被表示成可能具有共同性别和/或种族(或被分组成具有存在解剖学共性的多个种族之一)的给定解剖学群体的平均表述和围绕所述平均表述的变差。参考图2和前述统计图集以及对于给定群体来说人们如何向统计图集添加解剖结构的讨论。来自于所述统计图集的输出被导向自动寻找标志模块和表面/形状分析模块。
参考图31-43,所述自动寻找标志模块利用来自于统计图集的输入 (例如可能含有特定标志的区域)和局部几何分析来计算统计图集内每个解剖结构实例的解剖学标志。例如,为股骨的每个3D虚拟模型计算各种不同的股骨近端标志,其包括但不限于:(1)股骨头中心,其是近似球形的股骨头的中心点;(2)大转子点,其是大转子上距离通过颈干点垂直于解剖学颈中心线的平面最近的点;(3)截骨术点,其是离小转子末端15毫米(离小转子点约30毫米)的点;(4)颈干点,其是头球上切面包围最小股骨颈横截面的点;(5)股骨腰部,其是沿着股骨干具有最小直径的横截面;(6)髓内管腰部,其是沿着髓内管具有最小直径的横截面;(7)股骨颈枢轴点,其是股骨解剖轴上与股骨头中心和股骨解剖轴的远端形成等于股骨颈角的角的点;以及(8) 小转子点,其是小转子区上最向外突出的点。作为另一个实例,使用所述鉴定到的解剖标志为股骨的每个3D虚拟模型计算各种不同的股骨近端轴,其包括但不限于:(a)股骨颈解剖轴,其与连接股骨头中心与股骨颈中心的直线共轴;(b)股骨颈轴,其与连接股骨头中心点和股骨颈枢轴点的直线共轴;以及(c)股骨解剖轴,其与连接位于总股骨长度从股骨的近端开始距离23%和40%处的两个点的直线共轴。作为又一个实例,使用鉴定到的解剖标志和轴为股骨的每个3D虚拟模型计算各种不同的股骨近端测量值,其包括但不限于:(i)近端角度,其是股骨解剖轴与股骨颈解剖轴之间的3D角;(ii)头部缢缩,其是股骨解剖轴与股骨头中心之间的水平距离;(iii)头高度,其是小转子点(参考前面)与股骨头中心之间的竖直距离;(iv)大转子至头中心距离,其是头中心与大转子点(参考前面)之间的距离;(v)颈部长度,其是头中心与颈枢轴点(参考前面)之间的距离;(vi)头部半径,其是拟合于股骨头的球的半径;(vii)颈部直径,其是在与股骨颈解剖轴成法向并通过颈中心点(参考前面)的平面处拟合于颈横截面的圆的直径;(viii)股骨颈前倾经股骨上髁角,其是经股骨上髁轴与股骨颈轴之间的角;(ix)股骨颈前倾后髁角,其是后髁轴与股骨颈轴之间的角;(x)LPFA,其是机械轴与指向大转子的矢量之间的角;(xi) 股骨距面积指数,其由方程(Z-X)/Z定义,其中Z是在小转子中点下方 10厘米处的股骨面积,X是在小转子中点下方10厘米处的髓内管面积; (xii)髓腔股骨距面积比率,其是在小转子中间高度下方3厘米处的髓内管面积与小转子中点下方10厘米处的髓内管面积之间的比率; (xiii)XYR面积,其是小转子中点下方3厘米处的髓内管面积与小转子中点下方10厘米处的髓内管面积之间的比率;(xiv)短轴/长轴比率,其是在髓内管上最狭窄点处拟合于髓内管横截面的椭圆的短轴与长轴之间的比率;以及(xv)股骨半径与髓内管半径比率,其是在与股骨解剖轴成法向的平面内最佳拟合于股骨外周和髓内管的圆周的圆的圆半径的比率(该比率反映出皮质骨的厚度,以及因此在骨质疏松症的情况下反映出皮质骨损失)。
参考图31和45-47,使用来自于自动寻找标志模块的输出,对给定人群评估股骨柄的参数。具体来说,不论所述人群是在种族、性别还是两者的组合的基础上分组,对内侧轮廓、颈部角和头部缢缩进行评估。
在内侧轮廓的情形中,对于所述人群中的每块股骨来说,该相对于髓内管的轮廓通过将髓内管与通过股骨枢轴点延伸并具有垂直于股骨解剖轴和颈轴两者的法向轴的平面相交(矢量叉积)来产生。在为所述人群中的每块股骨产生轮廓后,使用髓内管尺寸将所述人群细分成组。在细分时,轮廓可能在平面外,因此进行对齐过程以将所有轮廓相对于共同平面(例如X-Z平面)对齐。所述对齐过程包括将与股骨颈轴和解剖轴两者成法向的轴与Y轴对齐,然后将解剖轴与Z轴对齐。通过这种方式,将所有轮廓相对于特定点平移,以使轮廓具有共同的坐标系。
在所述轮廓具有共同坐标系后,利用股骨颈点来验证所述轮廓的点在平面内。具体来说,股骨颈点反映出真实解剖结构并保证轮廓上的点在平面内的一致点。通过验证所述轮廓的点在平面内,可以显著减小人群的股骨之间的对齐变化性,这便于将所述轮廓用于头部缢缩和植入角设计。
参考图48,所述统计图集也可用于在正常与骨质疏松的骨骼之间插值。在设计股骨柄并确定其尺寸时,一个关键的考虑是髓内管维度。对于股骨来说,在正常骨骼的情况下,与表现出骨质疏松症的股骨相比髓内管明显更窄。这种更窄的髓内管维度至少部分是骨厚度(与股骨的主导轴横向测量)减小的结果,这相应地引起定义髓内腔的股骨内表面后退。在这种方法中,通过在健康和严重骨质疏松的骨厚度之间插值并产生具有所述厚度的虚拟3D模型,来产生合成人群。因此,这个数据集含有对应于骨质疏松症的不同阶段的骨骼。这个数据集现在可以作为输入用于植入物干设计。
在示例性形式中,统计图集包括大量正常的非骨质疏松的骨骼和骨质疏松的骨骼,在这种情况下所述骨骼是股骨。按照本文中描述的用于将骨骼添加到统计图集的过程,对图集的每个这些正常股骨进行定量并表示为3D虚拟模型。同样地,按照本文中描述的用于将骨骼添加到统计图集的过程,对图集的每个骨质疏松的骨骼进行定量并表示为3D虚拟模型。作为正常和骨质疏松的骨骼的3D模型的一部分,记录沿着股骨纵向长度的髓内管维度。使用图集的点对应,在图集骨骼上将髓内管鉴定为跨越骨骼总长度的靠近小转子的固定百分率(例如 5%)和靠近远端皮质点的第二固定百分率(例如2%)。此外,骨骼外表面上落于这些近端和远端边界之内的点被用于确定骨骼厚度,所述骨骼厚度被定义为从外部点到IM管上最近的点的距离。
在股骨近端的情形中,图51-62证实了在任何种族人群中存在性别差异。如图59和60中所示,女性股骨近端的统计图集的模板3D模型当与男性股骨近端的统计图集的模板3D模型相比时表现出统计显著的测量值。具体来说,女性比男性的头部缢缩小约9.3%。在当前的植入物中,头部缢缩随干尺寸增加,这在正常女性的情况下是可接受的。但是当在骨质疏松症和骨质减少的情况下估算头部缢缩时出现问题,在所述骨质疏松症和骨质减少中骨损失引起髓内管尺寸增加,这意味着更大的干尺寸和更大的偏移。同样地,女性比男性的颈部直径和头部半径小约11.2%。并且女性比男性的颈部长度小约9.5%。此外,女性比男性的近端角度小约0.2%。最后,女性比男性的股骨头高度小约13.3%。因此,性别骨骼数据证实,简单地缩放通用股骨植入物(即性别中性的)不能说明骨骼的几何差异,因此需要基于性别的股骨植入物。
参考图63-68,不仅股骨近端的维度跨过性别线广泛变化,而且股骨沿着髓内管长度的横截面形状也是如此。具体来说,横跨男性和女性股骨的统计图集中的给定群体,男性具有比女性更接近于圆形的髓内管横截面。更具体来说,女性具有比男性更偏心8.98%的髓内管横截面。正如将在后文中更详细讨论的,这种性别特异性数据构成特点提取数据的一部分,其被作图以得到簇,从所述簇提取数目和总体形状参数,以得到性别特异性股骨植入物。
如图72-74中所示,所述统计图集包括对应于在给定股骨群体(通过性别分组)中关于前后(AP)方向上的头中心偏移的测量值的计算。在示例性形式中,AP方向由前部垂直指向机械轴和后踝轴两者的矢量来确定。测量股骨头中心与两个参比点之间的偏移,其中第一参比点是解剖轴的中点,第二参比点是股骨颈枢轴点。概括来说,在男性和女性股骨之间,相对于颈枢轴点和解剖轴的AP头高度不表现出显著差异。同样地,这种性别特异性数据构成特点提取数据的一部分,其被作图以得到簇,从所述簇提取数目和总体形状参数,以得到性别特异性股骨植入物。
再次参考图28和31,统计图集群体内头中心偏移、髓内管的横截面形状数据和股骨的内侧轮廓数据构成提取的特点数据的一部分,其被作图以辨别给定群体内存在的簇的数目(假设统计图集包括关于与每块骨骼相关的种族的数据,则一个簇是性别特异性的,第二个簇是性别特异性的),以便设计与图28的流程图和相关讨论相符的性别和/或种族特异性的大规模定制的植入物。鉴定到的性别和/或种族特异性的簇被用于提取设计大规模定制的股骨植入物所必需的参数。
参考图76,描绘了符合本公开的示例性的大规模定制的股骨组件。具体来说,所述大规模定制的股骨组件包括4个基本元件,其包括球、颈、近端干和远端干。每个基本元件包括可互换的接口,以允许球、颈和干与其他可互换元件的互换。通过这种方式,如果需要较大的股骨球,将只更换股骨球。同样地,如果需要较大的颈偏移,将颈元件更换为提供必要偏移的不同的颈元件,同时如果适合,保留其他3个元件。通过这种方式,股骨组件可以在一定限度内定制以拟合患者,而不必牺牲在使用通用植入物时否则将放弃的拟合或运动学。因此,所有股骨元件可以被更换为其他大规模定制的元件以更好地适合于患者的解剖结构。
在这个示例性实施方式中,颈被构造成围绕近端干的轴旋转,使得可以在手术中调整颈相对于近端干的旋转取向。具体来说,术前测量值可以确立颈相对于近端干的计划旋转位置。然而,手术中的考虑因素例如体内运动测试可以使外科医生改变术前旋转取向,以提供改进的运动学或避免特定碰撞。例如,颈包括圆柱形螺栓,其具有嵌入的具有网纹表面的周边槽。该圆柱形螺栓被接纳在近端干的轴向圆柱形通道中。除了这个圆柱形通道,第二个通道与所述圆柱形通道交叉并被造型成接纳具有半圆形槽的板,所述槽也具有网纹并且被构造成啮合所述嵌入的周边槽的网纹表面。紧固到近端干的一对螺钉推动板以与圆柱形螺栓啮合,使得最终圆柱形螺栓相对于近端干的旋转运动不再可能。因此,当到达这种固定啮合时,可以将螺钉松开以允许圆柱形螺栓与近端干之间的旋转运动,正如在手术中做出旋转调整所必需的。
颈与球之间的啮合可以是常规的,而近端干与远端干之间的啮合是非常规的。具体来说,近端干包括远端柄,其带有螺纹并用于通过螺纹接纳在延伸到远端干中的带螺纹的孔中。因此,通过相对于远端干旋转近端干,使得柄的螺纹啮合远端干孔的螺纹,将近端干固定到远端干。当近端干紧靠远端干时,停止近端干相对于远端干的旋转。然而,如果在近端干与远端干之间必需旋转调整,可以利用垫圈来提供对应于正确旋转调整的间隔区。作为进一步的实例,如果需要较大的旋转调整,垫圈的厚度较大,而较薄的垫圈将相应地提供较小的旋转调整。
每个基本元件可以以预定的可选方案制造,所述可选方案考虑到了给定性别和/或种族内的尺寸和轮廓变化性。通过这种方式,可以将基本元件的可选方案混合并匹配,以使患者特异性植入物比大规模定制的股骨组件在形状上更接近患者的解剖结构,但用于产生患者特异性股骨植入物的成本和过程仅为几分之一。
图77描绘了符合本公开的另一种可选的示例性大规模定制股骨组件。具体来说,所述大规模定制的股骨组件包含5个基本元件,其包括球、颈、近端干、中间干和远端干。每个基本元件包括可互换的接口,允许球、颈和干与其他可互换元件互换。本领域技术人员将会理解,通过增加大规模定制的股骨组件的元件数目,类似于堆叠患者天然股骨的片段以重现该骨骼,人们可以使用大规模定制的元件越来越多地接近患者特异性植入物的拟合。
类似于股骨近端在性别和种族之间的解剖学差异,图78-83证实了在统计图集内的总盆骨群体中存在性别和种族差异。再次参考图28,使用在性别和种族中的至少一者的基础上分组的统计图集数据(即盆骨群体),设计并制造了一系列大规模定制的髋臼杯植入物。如图78 中图示的,使分组的图集数据经历自动寻找标志过程和表面/形状分析过程,以分离髋臼杯的几何形状。此外,如图82和83中图示的,定标(用于髋臼韧带的位置)和轮廓分析(用于评估髋臼杯的轮廓)过程导致特点提取,从其最终产生解剖学髋臼杯植入物表面,如图79中所示。这个分析显示,髋臼杯和股骨头不是由单一曲率半径而是由几个半径构成的,如图80和81中所示。
参考图85,用于设计和制造动物特异性(即对于动物来说患者特异性)植入物和相关仪器的示例性系统和方法类似于前面针对图20所描绘和解释的过程,将该过程在此处并入。作为前置部分,获取动物解剖结构的图像并自动分割以得到虚拟3D骨骼模型。尽管图示为CT 扫描图像,但应该理解可以使用CT之外的其他成像形式,例如但不限于MRI、超声和X-射线。按照前面的示例性公开内容,将受影响的解剖结构的虚拟3D骨骼模型载入到统计图集中。随后,使用来自于统计图集的输入重建骨骼并产生重建的虚拟3D骨骼模型。在重建的虚拟 3D骨骼模型的表面上计算骨骼标志以允许确定正确的植入物尺寸。然后将受影响的骨骼的几何形状作图并转变成参数形式,然后将其用于产生模拟残留解剖学几何形状的动物特异性植入物。除了动物特异性植入物之外,制造动物特异性仪器并将其用于动物残骨的制备和动物特异性植入物的放置。
参考图86,用于设计和制造大规模定制的动物植入物的示例性系统和方法类似于前面针对图28所描绘和解释的过程,将该过程在此处并入。作为前置部分,使来自于与所讨论的骨骼相关的统计图集的3D 动物骨骼模型经历自动寻找标志和表面/形状分析。自动寻找标志过程使用储存在图集中的信息(例如可能含有特定标志的区域)和局部几何分析,为每个3D动物骨骼模型自动计算解剖学标志。对于统计图集中的每块所讨论的骨骼来说,形状/表面分析直接提取3D虚拟动物骨骼模型的特点和表面几何形状。随后,使用标志和形状特点的组合对每个3D动物骨骼模型进行特点提取过程,以计算与植入物设计相关的特点。将这些特点作为输入用于聚类过程,其中使用预定的聚类方法将动物骨骼群体分成具有相似特点的组。得到的每个簇代表那些用于定义单个动物植入物的形状和尺寸的实例。随后对每个簇中心(植入物尺寸)进行参数化过程,以便为总体植入物模型提取参数(例如计算机辅助设计(CAD)参数)。随后,使用提取到的参数,为每个簇产生总体植入物表面和尺寸。取决于动物患者所落入的簇,从必要的组选择大规模定制的植入物并植入。
参考图87-102,描述了用于整合多维医学成像、计算机辅助设计 (CAD)和计算机图形特点,用于设计患者特异性切割引导器的示例性过程和系统。出于仅仅示例性解释的目的,在全髋关节置换手术的背景中描述患者特异性切割引导器。然而,本领域技术人员将会认识到,所述示例性过程和系统适用于可以利用切割引导器的任何外科操作。
如图87中所示,示例性系统流程的概述始于接收代表解剖结构的输入数据。输入的解剖学数据包含所讨论的解剖结构的二维(2D)图像或三维(3D)表面表述,其可以例如采取表面模型或点云的形式。在使用2D图像的情形中,这些2D图像被用于构建所讨论的解剖结构的3D表面表述。本领域技术人员熟悉利用解剖结构的2D图像来构建 3D表面表述。因此,为简洁起见省略了这个过程的详细解释。例如,输入的解剖学数据可以包含X-射线(从至少两个角度获取)、计算机断层扫描(CT)扫描图、磁共振图像(MRI)或可以从其产生3D表面表述的任何其他成像数据中的一者或多者。在示例性形式中,所述解剖结构包含盆骨和股骨。
然而,应该理解,下面是可以与示例性系统一起使用的解剖结构的示例性描述,并且绝不打算限制其他解剖结构与本系统一起使用。当在本文中使用时,组织包括骨骼、肌肉、韧带、肌腱和在多细胞生物体中具有特定功能的任何其他确定种类的结构性材料。因此,当所述示例性系统和方法在涉及髋关节的骨骼的背景中讨论时,本领域技术人员将会认识到所述系统和方法对其他组织的适用性。
取决于输入数据的类型,系统的股骨和盆骨输入解剖结构数据被导向两个模块之一。在X-射线数据的情况下,将2D X-射线图像输入到非刚性模块以便提取3D骨骼轮廓。如果输入数据采取CT扫描图或MRI图像的形式,这些扫描图/图像被导向自动分段模块,在那里所述扫描图/图像被自动分段以提取3D骨骼轮廓(和3D软骨轮廓)。
参考图88,非刚性模块使用在至少两个不同角度获取的多个X- 射线图像进行一个或多个预处理步骤。这些步骤可以包括下列一者或多者:噪音降低和图像增强。对得到的预处理过的X-射线图像进行校准步骤,以便配准所述X-射线图像。优选地,X-射线图像在存在固定位置校准装置的情况下获取,以便相对于该固定位置校准装置配准X- 射线图像。但是当X-射线图像中不存在固定位置校准装置时,图像仍然可以使用在多个图像中共同检测到的特点来校准。从这个校准过程输出的是解剖结构相对于成像器的位置,其在图88中用“位姿”指称来鉴定。
对得到的预处理过的X-射线图像进行特点提取步骤。这个特点提取步骤包含利用预处理过的X-射线图像进行图像特点的一个或多个计算。例如,这些计算可以包括梯度特点、轮廓、纹理分量或任何其他图像来源的特点。在这个示例性过程中,特点提取步骤输出源自于X- 射线图像的在图88中用“轮廓”指称表示的解剖结构的轮廓(例如骨骼形状)以及用“纹理”指称表示的图像特点。勾画轮廓的解剖结构和图像特点数据两者被导向非刚性配准步骤。
非刚性配准步骤将来自于特点提取步骤和校准步骤的输出配准到来自于统计图集的所讨论的解剖结构的3D模板模型。例如,对来自于包含一部分统计图集的解剖学数据库的非线性主元做出响应产生3D 模板模型。在非刚性配准步骤期间,3D模板模型的形状参数(非线性主元)得到优化,以匹配从位姿、轮廓和纹理数据得到的X-射线图像的形状参数。来自于非刚性配准步骤的输出是3D患者特异性骨骼模型,其类似于对于CT扫描图或MRI图像来说从自动分段模块输出的 3D患者特异性骨骼模型,被导向虚拟模板制作模块。
参考图91,自动分段过程始于获取例如CT扫描图或MRI图像,并进行自动分段工序。具体参考图90,自动分段工序包括将扫描图/图像相对于所讨论的解剖结构的基本或起始3D模型对齐。在将扫描图/ 图像与基本3D模型对齐后,通过初始变形过程对扫描图/图像进行处理,以计算法向矢量,确定剖面点的位置,线性插入强度值,使用 Savitsky-Golay滤镜过滤得到的剖面,产生剖面的梯度,使用高斯加权剖面方程对剖面进行加权,确定最大剖面,并使用这些最大剖面变形所述基本3D模型。将得到的变形3D模型投影到所讨论的解剖结构的来自于统计图集的模板3D模型上。使用模板3D模型的参数,在二次变形过程中将所述变形3D模型进一步变形,以类拟模板3D模型独有的特点。在后一个变形过程后,将变形3D模型与扫描图/图像进行比较以辨别是否存在显著差异。
在变形3D模型与扫描图/图像之间存在显著差异的情形中,再次对变形3D模型和扫描图/图像进行初始变形过程,然后进行二次变形过程。继续该回路过程直至变形3D模型对于变形3D模型与扫描图/ 图像之间的差异来说在预定的公差范围内。
在已确定变形3D模型相对于前一次迭代表现出低于显著的差异或已实现最大数量的迭代后,将变形3D模型的表面边缘平滑化,然后进行更高分辨率的网格重划分步骤,以使表面进一步平滑,产生平滑的3D模型。使该平滑的3D模型经历初始变形工序(与前述表面平滑化之前的初始变形过程一致),以产生3D分段骨骼模型。
再次参考图91,对3D分段骨骼模型进行处理以产生轮廓。具体来说,计算3D分段骨骼模型和扫描图/图像的交集,这在每个图像/扫描图平面处产生二元轮廓。
也对3D分段骨骼模型进行处理以产生患者特异性的骨骼外观的统计3D模型。具体来说,在轮廓内和轮廓外存在的图像信息的基础上对骨骼的外观和任何解剖学异常进行建模。
随后由分段系统的使用者审查所述骨骼轮廓。该使用者可以是分段专家或分段系统的偶然使用者,其关注3D模型的不与分段区相关联的一个或多个区域。这种关联性的缺乏在丢失区域或明显不正确的区域的情况下可能存在。再鉴定到一个或多个错误区后,使用者可以选择模型上指示存在错误区的区域中心的“种子点”,或者手动勾画丢失区的轮廓。系统的软件使用来自于CT或MRI的解剖结构的初始扫描图/图像,使用种子点来添加或减除所述种子点局部的轮廓。例如,使用者可以选择骨赘应该存在的区域,并且软件将扫描图/图像与3D 模型上的所述区域进行比较,以便将骨赘添加到分段工序。对3D模型做出的任何变化最终由使用者审查并核实或撤销。这种审查和修正工序可以根据需要重复多次,以应对扫描图/图像与3D模型之间的解剖学差异。当使用者对3D模型满意时,可以对得到的模型进行手动操作以根据需要除去模型的桥和润色区域,然后输出到虚拟模板制作模块。
如图87和92中所示,虚拟模板制作模块接收来自于自动分段模块和非刚性配准模块中的任一者或两者的3D患者特异性模型。在髋关节的情形中,3D患者特异性模型包括盆骨和股骨,两者都被输入到自动寻找标志过程。该自动寻找标志步骤使用来自于统计图集和局部几何结构搜索中存在的相似解剖结构,计算股骨和盆骨3D模型上与植入物放置相关的解剖学标志。
在如图93中所示使用远端固定进行股骨柄的自动放置的情形中,自动寻找标志包括确定股骨和植入物上的轴。对于股骨来说,计算解剖学股骨轴(AFA),随后计算近端解剖轴(PAA)。然后计算近端颈角(PNA),其被定义为AFA与PNA之间的角。对于股骨植入物来说,植入物轴是沿着植入物干的长度,并且植入物颈轴是沿着植入物颈的长度。与股骨的PNA类似,植入物角被定义为植入物轴与植入物颈轴之间的角。然后选择具有最接近于PNA的植入物角的植入物。然后将植入物拟合角(IFA)定义为近端解剖轴与以所选植入物角从股骨头中心画出的矢量之间的交叉。
当如图93中所示使用远端固定和计算的解剖学标志使用股骨柄的自动放置时,植入物尺寸确定步骤为股骨组件确定/估算适合的植入物尺寸。通过将植入物的宽度与髓内管的宽度进行比较并选择具有与髓内管最相近的宽度的植入物,来选择植入物尺寸。随后,系统前移到植入物放置步骤。
在用于远端固定股骨柄的植入物放置步骤中,在外科医生优选的手术技术和以前计算的解剖学标志的基础上,为所有相关的植入组件确定/选择初始植入物位置。产生切除术平面以模拟股骨近端骨切开术,并评估植入物的拟合。通过分析对齐的植入物和股骨髓内管在沿着植入物轴的各种不同高度处的横截面来进行拟合评估。通过将植入物轴与解剖学股骨轴对齐,然后平移植入物以使植入物的颈处于股骨近端颈的大概位置中,将植入物与股骨对齐。然后将植入物围绕解剖学股骨轴旋转以获得所需的前倾。
作为该植入物放置步骤的一部分,使用迭代计划,其包括使用对于植入物放置来说初始的“据理推测”作为运动模拟的一部分,以评估“据理推测”的放置。在示例性形式中,运动模拟使用估算或测量的关节运动学,使植入物(在所选植入物的放置的基础上)通过一定范围的运动。因此,可以使用运动模拟来确定碰撞位置并估算植入物在植入后产生的运动范围。在运动模拟产生不令人满意的数据(例如不令人满意的运动范围、不令人满意的自然运动模拟等)时,可以使用另一个用于植入物放置的位置,然后进行运动学分析,以进一步精炼植入物的放置,直至达到令人满意的结果。在为所有相关的植入组件确定/选择植入物位置后,模板数据前进到夹具产生模块。
在如图94中所示使用压合和三点接触进行股骨柄的自动放置的情形中,自动寻找标志包括确定股骨和植入物上的轴。对于股骨来说,计算解剖学股骨轴(AFA),随后计算近端解剖轴(PAA)。然后计算近端颈角(PNA),其被定义为AFA与PNA之间的角。对于股骨植入物来说,植入物轴是沿着植入物干的长度,并且植入物颈轴是沿着植入物颈的长度。与股骨的PNA类似,植入物角被定义为植入物轴与植入物颈轴之间的角。然后选择具有最接近于PNA的植入物角的植入物。然后将植入物拟合角(IFA)定义为近端解剖轴与以所选植入物角从股骨头中心画出的矢量之间的交叉。
当如图94中所示使用压合、三点接触和计算的解剖学标志使用股骨柄的自动放置时,植入物尺寸确定步骤为盆骨和股骨组件确定/估算适合的植入物尺寸。通过将植入物轴与解剖学股骨轴对齐而将植入物与股骨对齐,来选择植入物尺寸。然后旋转植入物以将它的颈轴与股骨颈轴对齐。然后将植入物平移到处于股骨近端内解剖学正确的位置中。随后,系统前移到植入物放置步骤。
在用于压合股骨柄的植入物放置步骤中,在外科医生优选的手术技术和以前计算的解剖学标志的基础上,为所有相关的植入组件确定/ 选择初始植入物位置。产生切除术平面以模拟股骨近端骨切开术,并评估植入物的拟合。通过分析植入物和股骨髓内管的轮廓来进行拟合评估。所述轮廓如下产生:使髓内管与法向于解剖轴和股骨颈轴两者并通过解剖轴与股骨颈轴的交叉点的平面相交,产生轮廓。当产生植入物和髓内管轮廓时,只有在同一位置处宽度小于髓内管宽度的植入物被保持,产生许多可能正确的植入物尺寸。通过两种降低植入物与髓内管之间的距离均方差的策略来缩减可能尺寸的组。第一种策略最小化植入物的内侧和外侧两者与髓内管之间的距离的均方差(MSE) 或其他数学误差测度。第二种策略最小化植入物的外侧与髓内管之间的距离的MSE。
作为该植入物放置步骤的一部分,使用迭代计划,其包括使用对于植入物放置来说初始的“据理推测”作为运动模拟的一部分,以评估“据理推测”的放置。在示例性形式中,运动模拟使用估算或测量的关节运动学,使植入物(在所选植入物的放置的基础上)通过一定范围的运动。因此,可以使用运动模拟来确定碰撞位置并估算植入物在植入后产生的运动范围。在运动模拟产生不令人满意的数据(例如不令人满意的运动范围、不令人满意的自然运动模拟等)时,可以使用另一个用于植入物放置的位置,然后进行运动学分析,以进一步精炼植入物的放置,直至达到令人满意的结果。在为所有相关的植入组件确定/选择植入物位置后,模板数据前进到夹具产生模块。
再次参考图87,夹具产生模块产生患者特异性引导器模型。更具体来说,从模板数据和相关的计划参数了解到患者特异性植入物相对于患者残骨的形状和放置。因此,使用患者特异性3D骨骼模型,虚拟模板制作模块计算植入物相对于患者残骨的位置,并因此为夹具产生模块提供关于打算保留多少患者残骨的信息。与这个骨骼保留数据相一致,夹具产生模块利用骨骼保留数据指派一个或多个骨锯将患者当前的骨骼缩减到按计划接受植入物所必需的残骨。使用所需骨锯,夹具产生模块产生切割引导器/夹具的虚拟3D模型,所述切割引导器/夹具具有被构造成在单一位置和取向中与患者骨骼配合的形状。换句话说,切割夹具的3D模型被产生为患者残骨的解剖学表面的“负形”,使得真实切割引导器精确匹配患者的解剖结构。通过这种方式,消除了与切割夹具的定位有关的任何猜测。在夹具产生模块产生切割夹具的虚拟3D模型后,模块输出快速原型机、CNC机或类似装置所必需的机器码,以制造真实切割引导器。例如,用于股骨头和颈切开的示例性切割夹具包含中空槽,其形成相关的引导器以将刀片限制在一定的移动范围内并将刀片维持在预定的取向,这重现了来自于手术计划和模板制作模块的虚拟切割。还使用夹具产生模块产生用于股骨柄的放置夹具。
参考图100,在切开股骨头和颈之后,进行髓内扩孔,然后进行股骨柄插入。为了准备股骨以备股骨植入物的插入,需要沿着与股骨植入物的取向相一致的取向进行髓内管扩孔。如果扩孔偏离,股骨植入物的取向可能受损。为了解决这一顾虑,夹具产生模块产生虚拟引导器,其是患者的残留或切开骨骼的解剖学表面的“负形”,以便快速原型机、CNC机或类似装置可以制造精确匹配患者解剖结构的切割引导器。例如,扩孔夹具可以包括轴向引导器,扩孔器可以沿着它纵向来回移动。使用该扩孔夹具,进行扩孔操作的外科医生确保以正确取向扩孔。
髓内管可以接纳股骨柄。同样地,为了从旋转观点和角度观点两者确保股骨柄正确放置在髓内管中,夹具产生模块产生股骨柄放置引导器。例如,股骨柄放置引导器是患者的残留或切开骨骼的解剖学表面的“负形”,同时也是股骨柄顶部的“负形”。通过这种方式,放置引导器在股骨干(股骨柄的与股骨球相连的部分)上滑动,并在同时包括与患者的残留或切开骨骼配合的独特形状,使得股骨柄相对于患者股骨只可能采取单一取向,由此确保股骨柄与术前计划相一致的正确植入。然而,应该指出,尽管在初次髋关节植入物的背景中描述了示例性夹具,但本领域技术人员应该理解,上述示例性过程和系统不限于初次髋关节植入物或限于髋关节植入物或修正手术程序。相反,所述过程和系统适用于任何髋关节植入物以及涉及身体的其他区域包括但不限于膝、踝、肩、脊柱、头和肘的手术程序。
如图101中所示,在髋臼的情形中,夹具产生模块可以产生制造扩孔和用于髋臼杯的髋臼植入物放置引导器的指令。具体来说,从模板数据和相关的计划参数,已知患者特异性髋臼植入物相对于患者残留盆骨的形状和放置。因此,使用患者特异性3D髋臼模型,虚拟模板制作模块计算髋臼杯植入物相对于患者残骨的尺寸和位置,因此为夹具产生模块提供关于打算保留多少患者残留盆骨和所需的植入物取向的信息。与这个骨骼保留数据相一致,夹具产生模块利用骨骼保留数据指派一个或多个骨锯/扩孔器将患者当前的盆骨缩减到按计划接受髋臼植入物所必需的残骨。使用所需骨锯,夹具产生模块产生切割引导器/夹具的虚拟3D模型,所述切割引导器/夹具具有被构造成通过仅仅一个取向与患者盆骨的两个部分配合的形状。换句话说,切割夹具的 3D模型被产生为患者盆骨的解剖学表面的“负形”,使得实际的扩孔引导器精确匹配患者的解剖结构。通过这种方式,消除了与扩孔夹具的定位有关的任何猜测。在夹具产生模块产生扩孔夹具的虚拟3D模型后,模块输出快速原型机、CNC机或类似装置所必需的机器码,以制造实际的扩孔夹具。例如,用于髋臼扩孔的示例性髋臼组件夹具包含4 零件结构,其中第一零件被构造成接纳在天然髋臼中并暂时安装到第二零件,直至使用第一零件作为放置引导器将第二零件固定到盆骨。在第二零件被紧固到盆骨之后,可以将第一零件取下。随后,第三零件包括圆柱形或部分圆柱形组件,其独一无二地与第二零件配合,以确保扩孔器可以相对于第三零件纵向来回移动,但是它的取向使用第一和第三零件的组合来固定。在扩孔后,将扩孔器取下并将第三零件从第一零件取下。使用第四零件将髋臼杯植入物安装到扩孔的髋臼。具体来说,第四零件的形状仅仅在单一取向上独一无二地啮合第一零件,并在同时被造型成接纳在髋臼杯植入物内部。在髋臼杯植入物定位后,将第一和第四零件两者取出。还应该指出,为了在盆骨中钻出一个或多个孔以安放髋臼植入物,可以产生另外的夹具,其中每个钻孔夹具被相继安装到第一零件,以便验证钻头的取向。
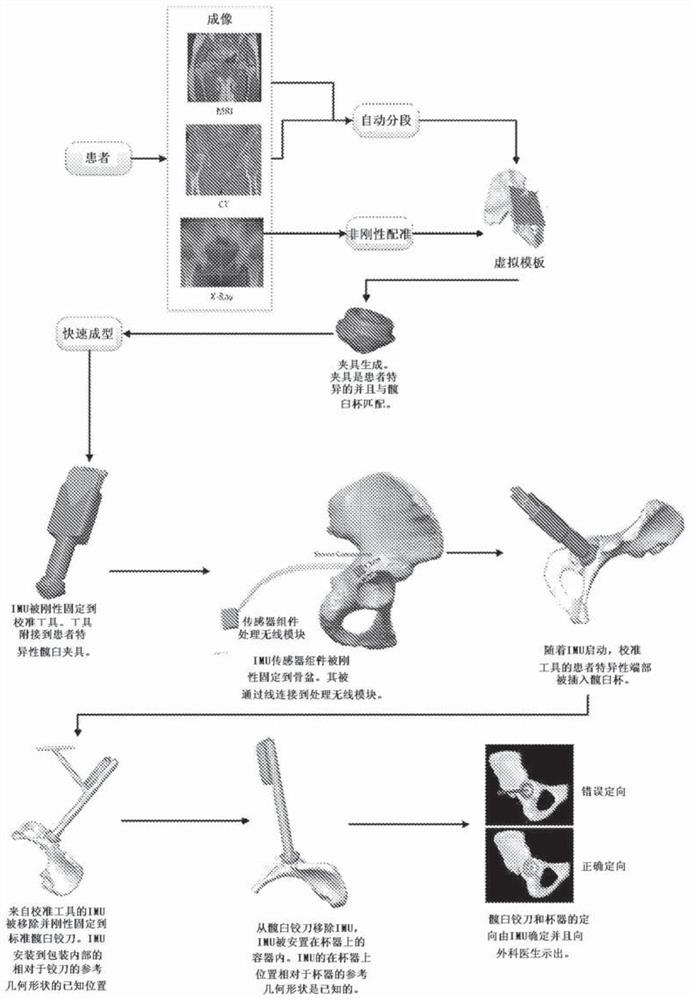
参考图103-111,描绘了在外科手术期间使用一个或多个惯性测量单元(IMU)以便于外科导航正确放置骨外科工具和骨外科植入物的可选示例性系统和过程。该第一可选示例性实施方式在进行全髋关节置换手术的背景中描述。然而,下文中描述的方法、系统和过程适用于外科工具和植入物的引导对其有用的任何其他外科操作。
正如示意描绘的,利用患者图像(X-射线、CT、MRI等)并进行分段或配准以获得患者解剖结构的虚拟模板的初始步骤以及适合的植入物尺寸、形状和放置,与以前参考图87、88、90-92所描述的类似。多少有些差异的是在虚拟模板制作模块下游使用的模块和过程。
在虚拟模板制作模块下游是初始化模型产生模块。该模块接收模板数据和相关的计划参数(即患者特异性髋臼植入物的形状和相对于患者残留盆骨的放置以及患者特异性股骨植入物的形状和相对于患者残留股骨的放置是已知的)。使用该患者特异性信息,初始化模型产生模块制造用于患者原始髋臼杯的初始化装置的3D虚拟模型和用于股骨植入物的初始化装置的3D虚拟模型。换句话说,作为患者髋臼的解剖学表面的“负形”产生髋臼初始化装置的3D模型,使得实际的初始化装置精确匹配患者的髋臼。同样地,作为患者残留股骨和股骨植入物的解剖学表面的“负形”产生股骨柄初始化装置的3D模型,使得实际的初始化装置仅在单一位置和单一取向上精确匹配患者的残留股骨和股骨植入物。除了产生这些初始化装置之外,初始化模型产生模块还产生快速原型机、CNC机或制造实际的髋臼初始化装置和股骨初始化装置的类似装置所必需的机器码。实际的髋臼初始化装置和股骨初始化装置被制造并安装到(或同时成型或集成到)或集成到被配置为具有至少一个IMU 1002的外科导航工具。
能够报告取向和平移数据的IMU 1002被合并到(例如安装到)外科工具以协助外科导航,其包括定位外科设备和植入物装置。这些IMU 1002被通讯连接(有线或无线)到软件系统,所述软件系统接收来自于IMU的指示相对速度和时间并允许软件计算IMU的当前位置和取向的输出数据,或者IMU 1002计算并发送将在后文中更详细讨论的外科器械的位置和取向、与IMU相关联的外科器械的位置和取向。在这个示例性描述中,每个IMU 1002包括3个陀螺仪、3个加速计和3个霍尔效应磁强计(成套的3个三轴陀螺仪、加速计、磁强计),其可以集成在单一电路板中或者一个或多个传感器(例如陀螺仪、加速计、磁强计)构成单独的板,以便输出与互相垂直的3个方向(例如X、Y、 Z方向)有关的数据。通过这种方式,每个IMU1002有效地从3个陀螺仪、3个加速计和3个霍尔效应磁强计产生21个电压或数值输出。在示例性形式中,每个IMU 1002包括传感器板和处理板,其中传感器板包括由3个加速计、3个陀螺仪传感器和3个磁强计构成的集成的感应模块(LSM9DS,ST-Microelectronics)和两个由3个加速计和3个磁强计构成的集成的感应模块(LSM303,ST-Microelectronics)。具体来说,IMU 1002各自包括角动量传感器,其测量至少3个轴上空间的旋转变化:俯仰轴(上下),偏荡轴(左右)和翻滚轴(顺时针或反时针旋转)。更具体来说,每个包含磁强计的集成的感应模块被放置在电路板上的不同位置处,其中每个磁强计被指派输出与施加的磁场成正比的电压,并且也探测三维坐标系内的3个方向中的每个方向上的空间点处磁场的极性方向。例如,第一磁强计输出在第一位置处与施加的磁场成正比的电压和在X方向、Y方向和Z方向上磁场的极性方向,而第二磁强计输出在第二位置处与施加的磁场成正比的电压和在X方向、Y方向和Z方向上磁场的极性方向,并且第三磁强计输出在第三位置处与施加的磁场成正比的电压和在X方向、Y方向和Z方向上磁场的极性方向。通过使用这三组磁强计,除了检测局部磁场波动之外还可以确定IMU的航向取向。每个磁强计使用磁场作为参比并确定与磁北的取向偏离。然而,局部磁场可以被铁或磁性材料扭曲,通常被称为硬或软铁扭曲。软铁扭曲的实例是具有低的磁导率的材料例如碳钢、不锈钢等。硬铁扭曲由永磁体引起。这些扭曲产生不均匀的场(参见图184),其影响用于处理磁强计输出和解析航向取向的算法的准确性。因此,正如在后文中更详细讨论的,利用校准算法来校准磁强计以恢复在检测到的磁场中的均匀性。每个IMU 1002可以由可更换或可充电储能装置供电,例如但不限于CR2032纽扣电池和 200mAh可充电锂离子电池。
IMU 1002中集成的感应模块可以包括可配置的信号调制电路和模拟数字转换器(ADC),其为传感器产生数字输出。IMU 1002可以使用具有电压输出的传感器,其中可以是补偿放大器的信号调制电路被配置为将传感器输出调制到多通道24位模拟-数字转换器(ADC) (ADS 1258,Texas Instrument)的输入范围。IMU 1002还包括集成处理模块,其包括微控制器和无线传输模块(CC2541,Texas Instrument)。或者,IMU 1002可以使用单独的低功率微控制器(MSP430F2274,Texas Instrument)作为处理器和紧凑型无线传输模块(A2500R24A,Anaren) 用于通讯。所述处理器可以作为每个IMU 1002的一部分被集成,或与每个IMU分开但与其通讯连接。该处理器可以是兼容蓝牙的,并提供针对陀螺仪、加速计和磁强计的有线或无线通讯,以及提供处理器与信号接收器之间的有线或无线通讯。
每个IMU 1002被通讯连接到信号接收器,所述信号接收器使用预定的装置标识号处理从多个IMU接收到的数据。数据速率对于单一 IMU来说约为100Hz,并且在更多的IMU联接共享网络时减少。信号接收器的软件实时接收来自于IMU 1002的信号,并在接收到的IMU数据的基础上连续计算IMU的当前位置。具体来说,将从IMU输出的加速度测量值针对时间积分,以计算IMU在3个轴中的每个轴上的当前速度。将为每个轴计算的速度对时间积分,以计算当前位置。但是,为了获得有用的位置数据,必须建立参照构架,其包括校准每个IMU。
本公开包括用于校准在外科导航中使用的一个或多个IMU的新系统和方法。在外科导航中利用IMU作为支持性辅助的现有专利参考文献苦于由大量原因造成的不可操作性。在这些原因中包括IMU相对于金属外科器械的放置以及缺少IMU校准。更具体来说,在IMU并入有磁强计的情形中,对于外科器械和相关骨外科组件的手术追踪来说,磁强计的现场校准是势在必行的。
参考图180,根据本公开,使用新的校准工具1000校准一个或多个可能并入有磁强计的IMU 1002。在示例性形式中,校准工具1000 包括静止底座1006,其中容纳有控制器1008、马达1012、传动装置 1016、驱动轴1020和电源1024。驱动轴1020被安装到传动装置1016 的一部分,马达1012也是如此,使得所述马达有效地驱动所述传动装置并旋转所述驱动轴。具体来说,马达1012包含具有单一驱动轴的电动马达,传动装置1016的传动齿轮被安装到所述驱动轴。该传动齿轮啮合安装到驱动轴1020的第二齿轮,使得马达1012的旋转运动被转变成驱动轴1020的旋转运动。
在这种示例性配置中,静止底座1006包括圆形的外部,其部分定义了中空的内部,以容纳马达1012、传动装置1016、控制器1008、电源1024和一部分驱动轴1020。例如,中央竖直轴通过静止底座1006 延伸,其与驱动轴1020的中轴共轴。这种共轴对齐减少了作为驱动轴 1020相对于静止底座1006旋转的结果而发生的振动。驱动轴1020的旋转有效地使外部台1030相对于静止底座1006旋转。
在示例性形式中,环形支承板1034介于静止底座1006的顶部与外部台1030的底部之间。静止底座1006和支承板1034两者都包括相应的允许驱动轴1020的一部分通过的轴向开口。驱动轴1020的靠近外部台1030的末端被安装到滑动环1038,其进一步被安装到外部台。通过这种方式,驱动轴1020相对于静止底座1006的旋转引起外部台 1030围绕中央竖直轴旋转。正如将在后文中更详细讨论的,IMU 1002 部分地通过将IMU围绕中央竖直轴旋转来校准。
在这里示例性实施方式中,外部台1030包括整块U形剖面,其具有相应的对置的叉形附件1042。每个附件1042被安装到滚柱轴承组合件1046,所述组合件被接纳并被枢轴安装到中轴1050。每个中轴1050 同时被安装到内部平台1054的相对侧面,所述内部平台坐落在叉形附件1042之间。内部平台1054包括整块U形剖面,其拟合在相应的对置的叉形附件1042内,并包括具有多个多个直立突出物1058的底座。正如将在后文中更详细描述的,直立突出物1058各自被配置为啮合与每个IMU 1002相关的相应凹口,以固定IMU相对于校准工具1000的一部分的位置。每个中轴1050沿着中央轴纵向对齐并被安装到内部平台1054,使得中轴的旋转与内部平台1054相对于外部台1030的旋转相对应。
为了使内部平台1054相对于外部台1030旋转,校准工具包括安装到中轴1050之一的滑轮1060。具体来说,中轴1050中的一个比另一个更长,以便容纳滑轮1060的安装和滑轮利用同时还啮合电动马达 1068的传动皮带1064的相应旋转。在这个示例性实施方式,电动马达 1068的从动轴被安装到它自身的滑轮1072,所述滑轮啮合传动皮带 1064,以在电动马达被供电时最终旋转滑轮1060并相应地使内部平台 1054相对于外部台1030旋转(围绕中轴1050的纵向对齐的中央轴)。电动马达1068被安装到马达架1076,其从外部台1030的底侧在一个叉形附件1042下方伸出。正如将在后文中更详细讨论的,IMU 1002 部分地通过将内部平台1054相对于外部台1030旋转来校准,这种旋转因此使IMU相对于与中央竖直轴垂直的纵向中央轴旋转。本领域技术人员应该理解,可以引入第三旋转轴以使IMU围绕与纵向中央轴和纵向竖直轴两者垂直的轴旋转。使用校准工具1000校准一个或多个 IMU 1002的示例性校准工序将在后文中描述。
在示例性形式中,IMU 1002优选地在接近最终在外科导航中使用的地点处校准。这可能是在手术室中,更具体来说,在患者所在或所躺的患者病床附近。IMU的校准是地点特异性的,使得在远离目标应用的地点处校准IMU可能引起校正地点和使用地区(即手术地区)处磁场的有意义的差异。因此,优选地在使用地区附近校准IMU 1002。
使用新的校准工具1000,将每个IMU 1002安装到内部平台1054 的直立突出物1058之一。例如,将每个IMU 1002安装到具有造型外周的机壳,所述外周勾画出开放的底部的轮廓。IMU 1002机壳的造型外周被配置为描画直立突出物1058的周边轮廓,使得IMU机壳可以卡扣配合在相应的直立突出物上,以便在校准工序期间维持IMU机壳与内部平台1054的啮合。例如,IMU机壳可以具有椭圆形、三角形、矩形或啮合相应的直立突出物1058得其他有边外周。作为示例性讨论和说明,IMU机壳具有轮廓为恒定的竖直横截面的矩形开口,所述横截面略微大于直立突出物1058的矩形横截面。在示例性形式中,校准工具1000包括4个直立突出物1058,以允许同时校准4个IMU 1002。但是应该指出,作为内部平台1054的一部分可以包含多于或少于4个直立突出物1058,以便同时为一个或多个IMU提供校准。
校准工序的目的是为了建立针对加速计的零点(即意味着在静止位置处,加速计提供与零加速度相一致的数据),和对局部磁场进行作图并规则化磁强计的输出以说明检测到的磁场的定向方差和扭曲的量。为了校准IMU 1002的加速计,内部平台1054相对于外部台1030 保持静止,后者也相对于静止底座1006保持静止。使内部平台1054 相对于外部台1030处于第一固定静止位置,此时从所有加速计获取多个读数。然后将内部台相对于外部台1030移动到第二固定静止位置,并从所有加速计获取第二组多个读数。在加速计特异性的基础上记录在所述多个固定位置处来自于加速计的输出,并将其用于为适用加速计建立零加速度读数。除了建立针对加速计的零点之外,校准工序还对局部磁场进行作图并规则化磁强计的输出以说明检测到的磁场的定向方差和扭曲的量。
为了对每个磁强计进行局部磁场作图(假设每个IMU 1002的多个磁强计位于不同位置处),除了将外部台1030围绕驱动轴1020并围绕中央竖直轴相对于静止底座1006旋转之外,将内部平台1054围绕中轴1050并围绕中央轴相对于外部台1030旋转。记录当内部平台1054 围绕彼此垂直的两个轴旋转时来自于每个磁强计的输出数据。每个磁强计围绕两个垂直轴的重新定位产生被每个磁强计感应到的三维局部磁场的点云或图。图(校准图1-3)基于从同时在两个轴上旋转的磁强计接收的数据,描绘了从等距的前视图和顶视图作图的示例性局部磁场。正如在局部磁场图中所反映的,局部图体现为椭球。这种椭球形状是通常被称为硬铁和软铁扭曲的由铁或磁性材料的存在引起的局部磁场扭曲的结果。软铁扭曲的实例是具有低的磁导率的材料例如碳钢、不锈钢等。硬铁扭曲由诸如永磁体的材料引起。
推测如果没有局部磁场扭曲,局部磁场图将是球形。因此,校准工序通过校准工具1000或IMU的手动操作有效地收集足够的数据点以描述不同取向上的局部磁场。校准算法计算校正因数以将扭曲的椭圆形局部磁场作图成均匀的球形场。
参考图184,在校准完成后,使用作为IMU 1002的一部分相对于彼此放置在不同位置中的多个磁强计检测局部磁场。不存在任何磁场扭曲的情况下,每个磁强计应该提供指示完全相同方向例如北极的数据。但是局部磁场的扭曲例如铁或磁性材料(例如外科器械)的存在,导致磁强计对于北极的方向提供不同数据。换句话说,如果来自于磁强计的输出不一致地反映北极,则扭曲已经发生,并且IMU 1002可能暂时不能使用所述磁强计数据进行追踪算法。它也可以警告用户已经检测到扭曲。
参考图185和186,接纳IMU 1002的示例性外科工具包括每个器械独有的电开关模式或格栅。更具体来说,每个外科工具包括突出部,其顶表面主要是平坦的,除了一个或多个圆柱形空腔之外。在示例性形式中,每个IMU 1002包括定义了底部开口的机壳,所述开口被配置为接纳所述外科工具的突出部。在这个底部开口中有4个开关,其各自包括偏圆柱形按钮,使得当所述按钮被压下时,开关关闭并且将相应信号发送到IMU 1002处理器。相反,当按钮未被压下时,开关保持开放,并且没有开关关闭的相应信号被送往IMU 1002处理器。通过这种方式,处理器确定哪些开关打开和哪些开关关闭,并使用这一信息来鉴定IMU1002被安装到哪个外科工具。
作为鉴定外科工具的一部分,取决于突出部的顶表面的拓扑结构, 0至4个开关可能被压下。正如图示的,外科工具的突出部被接纳在IMU 1002机壳底部开口中,使得突出部的顶表面被推到开关附近。应该指出,所述突出部和IMU 1002机壳中的底部开口被构造成使得所述突出部仅在单一旋转取向上被接纳在底部开口内,从而限制了突出部与开关之间错误对齐的机会,所述错误对齐否则可能造成外科工具的错误识别。
具体来说,如图185中所示,校准适配器外科工具包括位于突出部的右前角(与削掉的角相对)附近的单一圆柱形空腔,以便提供独特的构造。因此,当校准适配器外科工具的突出部被接纳在IMU 1002 机壳的底部开口内时,只有2&2开关格栅中最靠近IMU 1002机壳的右前角的单一开关被激活,这告知IMU 1002处理器IMU 1002被安装到所述校准适配器外科工具。相反,在第二种独特构造中,患者解剖学作图(PAM)配准工具适配器外科工具包括位于突出部的右前和右后角附近的两个圆柱形空腔。因此,PAM适配器外科工具的突出部被接纳在IMU 1002机壳的底部开口内,只有2&2开关格栅中最靠近IMU 1002机壳的右侧的两个开关被激活,这告知IMU 1002处理器IMU 1002 被安装到所述PAM适配器外科工具。此外,扩孔器适配器外科工具包括位于突出部前侧附近(即左前和右前角附近)的两个圆柱形空腔。因此,当扩孔器适配器外科工具的突出部被接纳在IMU 1002机壳的底部开口内时,只有2&2开关格栅中最靠近IMU 1002机壳的前侧的两个开关被激活,这告知IMU 1002处理器IMU 1002被安装到所述扩孔器适配器外科工具。最后,冲击器适配器外科工具包括位于突出部的前侧和右侧附近(即左前和右前角以及右后角附近)的3个圆柱形空腔。因此,当冲击器适配器外科工具的突出部被接纳在IMU 1002机壳的底部开口内时,只有2&2开关格栅中最靠近IMU 1002机壳的前侧和右侧的3个开关被激活,这告知IMU 1002处理器IMU 1002被安装到所述冲击器适配器外科工具。本领域技术人员将会理解,通过提供多个开关或电触点作为与外科工具相关的多个突出部、空腔或电触点相接的IMU 1002的部件可以提供变化,以便明确地鉴定所述IMU 1002 被安装到的外科工具。
鉴定IMU 1002被安装到的外科工具对于精确外科导航来说是重要的。具体来说,符合本公开的外科导航系统具有软件包,其已被预装有IMU 1002可能被安装到的每种外科工具的CAD模型或表面模型。在这样做时,软件包知道每个外科工具的相对维度例如但不限于X方向上的长度、Y方向上的宽度和Z方向上的高度,以及沿着外科工具的长度、宽度和高度这些维度如何变化。因此,当IMU 1002被安装到外科工具的已知位置中时,来自于IMU1002的位置和取向信息(通过陀螺仪、加速计和磁强计)可以被转换成外科工具的位置和取向信息。因此,通过在3D空间中追踪IMU 1002,软件包能够在3D空间中追踪 IMU 1002被安装到的外科工具并将所述位置和取向中继到用户例如外科医生或外科医生助手。
在示例性形式中,软件包包括视觉显示器,其有效地将每个外科工具显示为3D模型。当IMU 1002被安装到外科工具时,IMU 1002 处理器将数据发送到软件包,其允许软件包鉴定IMU 1002被安装到哪个外科工具。在做出这种鉴定之后,软件包显示以与源自于IMU的取向信息相一致的取向被安装到IMU 1002的外科工具的3D模型。除了通过操作外科工具的3D虚拟模型实时提供取向信息之外,软件包还通过使用被安装到参比物(即患者的骨骼)的第二参比IMU 1002提供关于外科工具的位置的实时数据。但是在软件包能够提供有意义的位置信息之前,需要将IMU 1002(安装到外科工具的IMU#1和安装到参比物(即骨骼)的IMU#2)相对于彼此配准。
在全髋关节置换手术的情形中,在示例性形式中,如图103-110 中所示,通过以预定取向啮合患者解剖结构,利用配准工具重新产生模板手术计划。当每个实用IMU 1002被安装到其配准工具(一个用于股骨,第二个用于盆骨)时,配准工具以预定取向(将患者解剖结构精确匹配到IMU“零点”的仅仅一个取向)被安装到相关骨骼。为了进行这种配准,将第二参比IMU精确地安装到所讨论的骨骼(一个IMU 被安装到盆骨,第二IMU被安装到股骨)。换句话说,一个实用IMU 被安装到髋臼配准工具,而第二参比IMU被精确安装到盆骨。在股骨的情形中,一个实用IMU被安装到股骨配准工具,而第二参比IMU被精确安装到股骨。作为配准过程的一部分,计算机的软件利用来自于两个IMU(实用和参比)的输出来计算当配准工具最终静止并位于其独特的位置和取向中时所述实用IMU的“零”位置。然后,可以将IMU1002从相关的配准工具取出并以预定方式安装到外科工具(扩孔器、锯、植入物放置引导器等),以确保外科工具的正确取向和放置。可以将IMU 1002相继安装到每个外科工具并从中取出,直至外科操作完成。
在这个示例性实施方式中,髋臼配准工具包括细长的杆,其具有被造型成仅在单一取向(包括旋转位置和角位置)上契合在患者的髋臼杯内的独特的突出部。配准工具的近端包括IMU 1002配准套以接纳 IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于配准工具和独特突出部刚性固定。与配准工具相一致,将第二参比IMU 1002 刚性固定到位置已知的盆骨。当所述配准工具的独特突出部在患者的髋臼杯内正确取向(并且锁在配准套内的IMU 1002和安装到盆骨的 IMU 1002被激活)时,锁定到配准套的IMU 1002相对于计划的植入物杯取向的取向(其在所述独特突出部在仅仅单一正确取向中被接纳在髋臼杯中时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中,并且软件记录每个IMU的位置。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将IMU 1002从配准套取出,以准备将IMU 1002安装到外科工具。
例如,将先前安装到髋臼配准工具的IMU 1002从所述工具中取出,并安装到位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到髋臼配准工具的)以相对于扩孔方向已知的取向刚性固定到髋臼杯扩孔器,使得髋臼杯扩孔器相对于盆骨的取向是已知的并通过两个IMU(安装到髋臼杯扩孔器的IMU 1002和安装到盆骨的IMU 1002)动态更新。
软件程序为外科医生提供图形用户界面,其显示患者盆骨的虚拟模型和所讨论的外科工具、在这种情况下是髋臼杯扩孔器的虚拟模型 (患者盆骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定髋臼杯扩孔器和其他外科工具来说,髋臼杯扩孔器或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新盆骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示扩孔器是否正确取向,并且如果未正确取向的话,需要将扩孔器重新定位到何种方向才能将扩孔器正确定向成与手术前计划相一致。在使用髋臼杯扩孔器完成表面重修后,将IMU 1002从髋臼杯扩孔器中取出,并以相对于髋臼杯插入器方向已知的取向刚性固定到所述插入器。然后使用髋臼杯插入器放置髋臼杯植入物,同时IMU继续提供加速度反馈,软件利用所述反馈来计算位置,以提供关于盆骨相对于髋臼杯插入器的位置的实时反馈。就在髋臼杯放置之前或之后在盆骨中钻孔而言,先前被安装到配准工具的IMU 1002可以被刚性固定到外科钻孔器,以确保钻孔器相对于盆骨的正确取向。类似的配准工具和成套IMU可以与软件系统一起使用,以协助股骨柄组件的放置。
在一个示例性实施方式中,股骨配准工具包括细长的杆,其具有被造型成在仅仅一个取向(包括旋转位置和角位置)上部分契合在患者的股骨颈上的远端形式。配准工具的近端包括IMU 1002配准套以接纳IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于所述配准工具和远端形式刚性固定。与配准工具相一致,将第二参比IMU 1002刚性固定到位置已知的股骨。当所述配准工具的远端形式相对于患者的股骨颈正确取向(并且锁在配准套内的IMU 1002和安装到股骨的IMU 1002被激活)时,锁定到配准套的IMU 1002相对于股骨取向的取向(其在所述远端形式在仅仅单一正确取向中被接纳在股骨颈上时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中,并且软件记录每个IMU的位置。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将IMU 1002从配准套取出,以准备将 IMU 1002安装到外科工具。
例如,将先前安装到股骨配准工具的IMU 1002从所述工具中取出,并安装到另一个位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到股骨配准工具的)刚性固定到已知位置中的外科锯,使得IMU 1002的移动相应地转变成外科锯的已知移动。考虑到另一个 IMU 1002被固定安装到已知位置中的股骨,所述IMU一起工作以向软件系统提供关于股骨和外科锯两者的位置变化的动态更新的信息(通过加速度数据)。
软件程序为外科医生提供图形用户界面,其显示患者股骨的虚拟模型和所讨论的外科工具、在这种情况下是外科锯的虚拟模型(患者股骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定外科锯和其他外科工具来说,外科锯或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新股骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示外科锯是否正确取向,并且如果未正确取向的话,需要将外科锯重新定位到何种方向才能将外科锯正确定向成做出与手术前计划相一致的骨骼切割。在做出必要的骨骼切割后,将IMU 1002从外科锯中取出并刚性固定到扩孔器(以正确扩充髓内管),然后以相对于插入器方向已知的取向安装到股骨柄插入器。然后使用股骨柄插入器将股骨柄植入物放置在扩充的髓内管中,同时IMU继续提供加速度反馈,软件利用所述反馈来实时计算股骨和股骨柄插入器的位置,并将该位置数据通过图形用户界面显示给外科医生。
在示例性形式中,在全肩关节置换手术的情形中,如图187和188 中所示,通过以预定取向啮合患者解剖结构,利用配准工具重新产生模板手术计划。当每个实用IMU 1002被安装到其配准工具(一个用于肱骨,第二个用于肩胛骨)时,配准工具以预定取向(将患者解剖结构精确匹配到IMU“零点”的仅仅一个取向)被安装到相关骨骼。为了进行这种配准,将第二参比IMU精确地安装到所讨论的骨骼(一个 IMU被安装到肱骨,第二IMU被安装到肩胛骨)。换句话说,一个实用IMU被安装到肱骨配准工具,而第二参比IMU被精确安装到肱骨。在肩胛骨的情形中,一个实用IMU被安装到肩胛骨配准工具,而第二参比IMU被精确安装到肩胛骨。作为配准过程的一部分,计算机的软件利用来自于两个IMU(实用和参比)的输出来计算当配准工具最终静止并位于其独特的位置和取向中时所述实用IMU的“零”位置。然后,可以将IMU 1002从相关的配准工具取出并以预定方式安装到外科工具(扩孔器、锯、植入物放置引导器等),以确保外科工具的正确取向和放置。可以将IMU 1002相继安装到每个外科工具并从中取出,直至外科操作完成。
在这个示例性实施方式中,如图188中所示,肩胛骨配准工具包括细长的杆,其具有被造型成仅在单一取向(包括旋转位置和角位置) 上契合在患者的肩胛盂内的独特的突出部。配准工具的近端包括IMU 1002配准套以接纳IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于配准工具和独特突出部刚性固定。与配准工具相一致,将第二参比IMU1002刚性固定到位置已知的肩胛骨。当所述配准工具的独特突出部在患者的肩胛盂内正确取向(并且锁在配准套内的IMU 1002和安装到肩胛骨的IMU 1002被激活)时,锁定到配准套的IMU 1002相对于计划的植入物肩胛盂取向的取向(其在所述独特突出部在仅仅单一正确取向中被接纳在肩胛盂中时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中,并且软件记录每个IMU的位置。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将IMU 1002从配准套取出,以准备将实用IMU 1002安装到其他外科工具。
例如,将先前安装到肩胛骨配准工具的IMU 1002从所述工具中取出,并安装到位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到肩胛骨配准工具的)以相对于扩孔方向已知的取向刚性固定到肩胛盂扩孔器,使得肩胛盂扩孔器相对于肩胛骨的取向是已知的并通过两个IMU(安装到肩胛盂扩孔器的IMU 1002和安装到肩胛骨的 IMU 1002)动态更新。
软件程序为外科医生提供图形用户界面,其显示患者肩胛骨的虚拟模型和所讨论的外科工具、在这种情况下是肩胛盂扩孔器的虚拟模型(患者肩胛骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定肩胛盂扩孔器和其他外科工具来说,肩胛盂扩孔器或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新肩胛骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示扩孔器是否正确取向,并且如果未正确取向的话,需要将扩孔器重新定位到何种方向才能将扩孔器正确定向成与手术前计划相一致。在使用肩胛盂扩孔器完成表面重修后,将实用IMU 1002从肩胛盂扩孔器中取出,并以相对于肩胛盂插入器方向已知的取向刚性固定到所述插入器。然后使用肩胛盂插入器放置肩胛盂植入物,同时IMU继续提供加速度反馈,软件利用所述反馈来计算位置,以提供关于肩胛骨相对于肩胛盂插入器的位置的实时反馈。就在肩胛盂放置之前或之后在肩胛骨中钻孔而言,先前被安装到配准工具的实用IMU 1002可以被刚性固定到外科钻孔器,以确保钻孔器相对于肩胛骨的正确取向。类似的配准工具和成套IMU可以与软件系统一起使用,以协助肱骨柄组件的放置。
在一个示例性实施方式中,肱骨配准工具包括细长的杆,其具有被造型成在仅仅一个取向(包括旋转位置和角位置)上部分契合在患者的肱骨颈上的远端形式。配准工具的近端包括IMU 1002配准套以接纳IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于所述配准工具和远端形式刚性固定。与配准工具相一致,将第二参比IMU 1002刚性固定到位置已知的肱骨。当所述配准工具相对于肱骨颈正确取向(并且锁在配准套内的IMU1002和安装到肱骨的IMU 1002被激活)时,锁定到配准套的IMU 1002相对于肱骨取向的取向(其在所述远端形式在仅仅单一正确取向中被接纳在肱骨颈上时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中,并且软件记录每个 IMU的位置。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将实用IMU 1002从配准套取出,以准备将IMU 1002安装到其他外科工具。
例如,将先前安装到肱骨配准工具的IMU 1002从所述工具中取出,并安装到另一个位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到肱骨配准工具的)刚性固定到已知位置中的外科锯,使得IMU 1002的移动相应地转变成外科锯的已知移动。考虑到参比 IMU 1002被固定安装到已知位置中的肱骨,所述IMU一起工作以向软件系统提供关于肱骨和外科锯两者的位置变化的动态更新的信息(通过加速度数据)。
软件程序为外科医生提供图形用户界面,其显示患者肱骨的虚拟模型和所讨论的外科工具、在这种情况下是外科锯的虚拟模型(患者肱骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定外科锯和其他外科工具来说,外科锯或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新肱骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示外科锯是否正确取向,并且如果未正确取向的话,需要将外科锯重新定位到何种方向才能将外科锯正确定向成做出与手术前计划相一致的骨骼切割。在做出必要的骨骼切割后,将实用IMU 1002从外科锯中取出并刚性固定到扩孔器(以正确扩充肱骨髓管),然后以相对于插入器方向已知的取向安装到肱骨柄插入器。然后使用肱骨柄插入器将肱骨柄植入物放置在扩充的髓管中,同时IMU继续提供加速度反馈,软件利用所述反馈来实时计算肱骨和肱骨柄插入器的位置,并将该位置数据通过图形用户界面显示给外科医生。
在示例性形式中,在反向肩关节置换手术的情形中,如图187和 188中所示,通过以预定取向啮合患者解剖结构,利用配准工具重新产生模板手术计划。当每个实用IMU1002被安装到其配准工具(一个用于肱骨,第二个用于肩胛骨)时,配准工具以预定取向(将患者解剖结构精确匹配到IMU“零点”的仅仅一个取向)被安装到相关骨骼。为了进行这种配准,将第二参比IMU精确地安装到所讨论的骨骼(一个IMU被安装到肱骨,第二IMU被安装到肩胛骨)。换句话说,一个实用IMU被安装到肱骨配准工具,而第二参比IMU被精确安装到肱骨。在肩胛骨的情形中,一个实用IMU被安装到肩胛骨配准工具,而第二参比IMU被精确安装到肩胛骨。作为配准过程的一部分,计算机的软件利用来自于两个IMU(实用和参比)的输出来计算当配准工具最终静止并位于其独特的位置和取向中时所述实用IMU的“零”位置。然后,可以将IMU 1002从相关的配准工具取出并以预定方式安装到外科工具(扩孔器、锯、插入器、钻孔器引导物、钻孔器等),以确保外科工具的正确取向和放置。可以将IMU 1002相继安装到每个外科工具并从中取出,直至外科操作完成。
在这个示例性实施方式中,如图188中所示,肩胛骨配准工具包括细长的杆,其具有被造型成仅在单一取向(包括旋转位置和角位置) 上契合在患者的肩胛盂内的独特的突出部。配准工具的近端包括IMU 1002配准套以接纳IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于配准工具和独特突出部刚性固定。与配准工具相一致,将第二参比IMU1002刚性固定到位置已知的肩胛骨。当所述配准工具的独特突出部在患者的肩胛盂内正确取向(并且锁在配准套内的IMU 1002和安装到肩胛骨的IMU 1002被激活)时,锁定到配准套的IMU 1002相对于计划的植入物肩胛盂取向的取向(其在所述独特突出部在仅仅单一正确取向中被接纳在肩胛盂中时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中,并且软件记录每个IMU的位置。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将IMU 1002从配准套取出,以准备将实用IMU 1002安装到其他外科工具。
例如,将先前安装到肩胛骨配准工具的IMU 1002从所述工具中取出,并安装到位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到肩胛骨配准工具的)以相对于扩孔方向已知的取向刚性固定到肩胛盂扩孔器,使得肩胛盂扩孔器相对于肩胛骨的取向是已知的并通过两个IMU(安装到肩胛盂扩孔器的IMU 1002和安装到肩胛骨的 IMU 1002)动态更新。
软件程序为外科医生提供图形用户界面,其显示患者肩胛骨的虚拟模型和所讨论的外科工具、在这种情况下是肩胛盂扩孔器的虚拟模型(患者肩胛骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定肩胛盂扩孔器和其他外科工具来说,肩胛盂扩孔器或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新肩胛骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示扩孔器是否正确取向,并且如果未正确取向的话,需要将扩孔器重新定位到何种方向才能将扩孔器正确定向成与手术前计划相一致。在使用肩胛盂扩孔器完成表面重修后,将实用IMU 1002从肩胛盂扩孔器中取出,并以已知的取向和位置刚性固定到钻孔器板。然后使用钻孔器板在肩胛骨中钻孔,同时IMU继续提供加速度反馈,软件利用所述反馈来计算位置,以提供关于肩胛骨相对于钻孔器板的位置的实时反馈,然后定位肩胛盂基板并安装肩胛盂组件球。尽管不需要,但当通过钻孔器板钻孔时,可以将实用IMU 1002刚性固定到外科钻孔器,以确保钻孔器相对于钻孔器板的正确取向。类似的配准工具和成套IMU可以与软件系统一起使用,以协助肱骨柄组件的放置。
在一个示例性实施方式中,肱骨配准工具包括细长的杆,其具有被造型成在仅仅单一取向(包括旋转位置和角位置)上部分契合在患者的肱骨颈上的远端形式。配准工具的近端包括IMU 1002配准套以接纳IMU 1002,使得当IMU 1002被锁在套中时,IMU 1002相对于所述配准工具和远端形式刚性固定。与配准工具相一致,将第二参比IMU 1002刚性固定到位置已知的肱骨。当所述配准工具相对于肱骨颈正确取向(并且锁在配准套内的IMU1002和安装到肱骨的IMU 1002被激活)时,锁定到配准套的IMU 1002相对于肱骨取向的取向(其在所述远端形式在仅仅单一正确取向中被接纳在肱骨颈上时设定)是已知的。操作人员向软件系统指示IMU处于正确位置中并且是静止的,并且软件记录每个IMU的位置为实用IMU的“零点”。将配准工具(带有锁定在套中的IMU 1002)从解剖结构中取出,然后将实用IMU 1002从配准套取出,以准备将IMU 1002安装到其他外科工具。
例如,将先前安装到肱骨配准工具的IMU 1002从所述工具中取出,并安装到另一个位置已知的外科工具。在示例性形式中,将IMU 1002(先前安装到肱骨配准工具的)刚性固定到已知位置中的肱骨切除砧,使得IMU 1002的移动相应地转变成切除砧的已知移动。考虑到参比IMU 1002被固定安装到已知位置中的肱骨,所述IMU一起工作以向软件系统提供关于肱骨和切除砧两者的位置变化的动态更新的信息(通过加速度数据)。
软件程序为外科医生提供图形用户界面,其显示患者肱骨的虚拟模型和所讨论的外科工具、在这种情况下是肱骨切除砧的虚拟模型(患者肱骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定切除砧和其他外科工具来说,切除砧或其他外科工具的虚拟模型先前已被装载到系统中),并通过所述图形用户界面实时更新肱骨和外科工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示切除砧是否正确取向,并且如果未正确取向的话,需要将切除砧重新定位到何种方向才能将切除砧正确定向成做出与手术前计划相一致的骨骼切割。此外或可选地,可以将实用IMU 1002安装到用于钻出一个或多个各自插入有参比销针的孔的钻孔器板。在这种情况下,如果使用一个或多个参比销针将外科切除砧正确定位和取向,则切除砧可能不必伴有IMU。在任何情况下,在做出必要的骨骼切割后,将实用IMU 1002从外科工具中取出并刚性固定到扩孔器(以正确扩充肱骨髓管),然后以相对于插入器已知的取向安装到肱骨柄插入器。然后使用肱骨柄插入器将肱骨柄植入物放置在扩充的髓管中,同时IMU 继续提供加速度反馈,软件利用所述反馈来实时计算肱骨和肱骨柄插入器的位置,并将该位置数据通过图形用户界面显示给外科医生。
除了组件放置之外,可以使用安装到盆骨和股骨的IMU来追踪组件旋转以试验组件的潜在侵害,以防止手术后并发症并提高患者总体满意度。
根据上述使用IMU 1002的公开内容,下面是用于从每个IMU的陀螺仪、加速计和磁强计产生三维位置数据的数学模型和算法的示例性讨论。在示例性形式中,每个IMU处理器被编程以利用带有冯·米塞斯-费雪密度算法的序贯蒙特卡罗方法(SMC),在来自于IMU的陀螺仪、加速计和磁强计的输入的基础上计算IMU 1002的位置变化。所述 IMU数据流由在X、Y、Z三个轴上的1组陀螺仪数据(G1)、X、Y、 Z轴上的3组加速计数据(A1-A3)和X、Y、Z三个轴上的3组磁强计数据(M1-M3)构成。IMU 1002的取向追踪可以使用来自于每个传感器的1组数据(即G1、A1、M1)来实现。
使用G1、A1和M1作为实例,并假设所有的传感器原始数据都已被转变和处理:
在时间和状态=1时:
1)正如由下面鉴定的算法1所表示的,算法首先产生以预定的冯·米塞斯-费雪密度分散系数围绕中间位置的一组N个粒子。每个粒子以四元数形式表示围绕X、Y和Z轴的取向。换句话说,所述粒子包含从同一概率密度空间抽取的一组独立且恒等分布的随机变量。在取向追踪应用中,所述粒子是观察到的取向的统计上受约束的变化性。但是应该指出,准确的统计量(分散系数)不必是“已知的”,因为当算法收集更多样本时算法优化其性质。优选地使用更高的变化性作为初始猜想并允许算法对它进行精炼。
在从G1、A1和M1接收到所述第一数据集后,计算IMU的当前取向的估算值。这通过首先了解从A1测量的倾斜来实现。如下面鉴定的算法2中的步骤2和3所示,为了数学校正(去旋转)磁强计读数,需要倾斜信息。随后,将A1和M1数据用于通过基于高斯牛顿优化方法的算法2来估算IMU的初始取向。算法2的目标是迭代地确定取向 (q
接下来,按照下列方程将所述在中间位置中的一组N个粒子(q
然后,使用下列方程,在G1的基础上及时向前估算所有粒子:
其中ω是在时间t时测量的角速率,并且Δt是取样时长。
换句话说,如果G1指示围绕X轴的角速度,则所有粒子将在牛顿运动方程的基础上围绕X轴旋转。
当前状态下的取向预期通过使用如下鉴定的算法3对粒子估算值(q
在时间和状态=2时,接收第二数据集。使用与段落[0380]中所述相同的方法(算法2),计算最晚的取向估算值,然后将它与来自于以前状态的所有粒子估算值(q
δ
δ
w
接下来,评估粒子的质量以取消并重新取样具有非常低的权重的粒子。这可以通过使用确定性的、剩余的或辅助性重新取样计划来进行。由于算法有利于更接近观测数据的粒子,因此随着时间粒子组将开始失去多样性。粒子将变得高度集中并且不再带有任何统计学意义。在那时,替换一小部分粒子以增加多样性。这通过首先评估粒子的当前分散系数来进行。如果分散系数表明高度集中,则在预定分散系数的基础上在中间位置产生一组新的粒子以代替一部分当前粒子。将新的粒子从中间位置旋转到当前取向预期值。这概述在下面的方程中:
此外,由于这种SMC方法的算法是时间依赖性的,因此接收到的信号的延迟或与IMU数据流暂时失去联系可以对估算造成不利影响。如果与IMU数据流的联系未被密切监测,则粒子组可以发散并使滤波器不稳定。这种SMC方法的算法在每次迭代后追踪粒子组的性质以防止过度发散。
最后,在来自于G1的新数据的基础上及时向前估算粒子,并再次计算当前的取向状态。每次从G1、A1和M1接收到新数据时都重新使用上述过程和算法。
参考图112-125,描述了用于在预定人群中产生接骨板(即创伤防护板)的示例性过程和系统。本领域技术人员认识到,骨骼在骨折后能够经历再生以修复自身。取决于骨折的严重性和位置,使用的现有技术的创伤防护板通常需要在手术室中进行弯曲或其他修改,以顺应不规则的骨骼形状并实现骨碎片之间的最大接触。然而,过度弯曲降低创伤防护板的使用寿命,这可能造成接骨板故障和/或创伤防护板螺钉固定松开。本过程和系统提供了更准确的创伤防护板形状以减少或消除在手术中塑造板的轮廓的必要性,由此增加板的使用寿命并增加发生任何接骨板螺钉固定松开之前的时间。
上面对产生创伤防护板的示例性解释适用于可以应用创伤防护板的任何和所有骨骼。为简洁起见,所述示例性解释描述了产生用于肱骨的创伤防护板的系统和过程。但是应该理解,所述过程和系统同等地适用于身体的其他骨骼和相应的创伤防护板的制造,并且绝不限于肱骨创伤防护板。
作为用于产生创伤防护板的示例性过程和系统的一部分,产生骨骼统计图集和/或将其用于所讨论的骨骼。作为解释,所讨论的骨骼包含肱骨。本领域技术人员熟悉统计图集以及在一个或多个骨骼的情况下如何构建统计图集。因此,为了进一步简洁,省略了构建骨骼统计图集的详细讨论。然而,对于示例性系统和过程的骨骼统计图集而言可能的独特之处,时在性别、年龄、种族、变形和/或部分构建的基础上分类骨骼统计图集内的肱骨。通过这种方式,可以为一个或多个上述类别大规模定制一种或多种创伤防护板,其中所述一个或多个类别建立特定的骨骼群体。
在示例性形式中,骨骼统计图集包括可以采取各种不同形式的解剖学数据。例如,骨骼统计图集可以包括二维或三维图像以及关于可以从其获取测量值的骨骼参数的信息。示例性的图集输入数据可以采取X-射线图像、CT扫描图像、MRI图像、激光扫描图像、超声图像、分段骨、物理测量数据和可以从其产生骨骼模型的任何其他信息的形式。该输入数据被访问统计图集数据的软件用于构建三维骨骼模型(或访问已被产生并作为统计图集的一部分保存的三维骨骼模型),所述软件被运行以从所述模型产生三维的平均骨骼模型或模板骨骼模型。
使用模板骨骼模型,所述软件可以自动指派或允许手动指派模板骨骼模型的外表面上的点。作为解释,在平均肱骨模型的情形中,软件用户通过在肱骨模型的外表面上大致勾画创伤防护板的形状,为最终的创伤防护板建立总体边界形状。创伤防护板的总体边界形状也可以通过由用户指派肱骨模型的外表面上对应于外部边界的一系列点来获得。一旦确立外部边界或边界点,软件可以自动指派或允许手动指派肱骨模型的外表面上在已确立的边界之内的点。例如,软件提供了填充百分率操作,用户可以在其上指派创伤防护板的边界内由一系列点所指派的百分率,每个所述点对应于肱骨模型外部上的独特位置。此外,软件提供手动点指派特点,用户可以在其上指派肱骨模型的外表面上在边界之内的一个或多个点。应该指出,在使用手动点指派的情形中,用户不必建立边界作为指派肱骨模型外部上的点的前期步骤。相反,当点的手动指派完成后,通过所指派的最外侧点建立边界。
在指派模板骨骼模型的外表面上的点之后,将定位的点传播到整个所讨论的骨骼群体。具体来说,由软件通过统计图集的点对应将定位的点自动施加到给定群体中的每个三维骨骼模型。例如,给定的骨骼群体可以是性别和种族特异性的,以包含来自于高加索女性的肱骨。使用所述群体的每个骨骼模型的传播的点,软件使用三维填充过程填充边界内的点之间的空隙,为每块骨骼产生创伤防护板的三维渲染。随后,软件通过细化过程计算每个创伤防护板的三维渲染的纵向中线。
每个三维创伤防护板渲染的中线包含沿着其长度具有各种不同曲率的三维中线。软件提取所述三维中线,并使用最小二乘拟合来确定协同地最优近似三维中线的主要曲率的曲率半径的优选数目。在肱骨的情形中,已确定三个曲率半径准确地近似中线曲率。但是该数目可能随着骨骼群体和创伤防护板的边界而变。在这里也可以包括其他特点,例如在沿着板长度的一个或多个位置处的横截面曲率,需要避开的肌肉、神经和其他软组织的位置,或与确定板尺寸或形状相关的任何其他特点。例如,所述用于中线的三个曲率半径代表在近端肱骨中创伤防护板中的弯曲,肱骨干与肱骨头之间的过渡,以及肱骨干的曲率。记录每个曲率半径,并将四维特点矢量应用于曲率半径数据,以将半径聚类成最优拟合所述群体的组。在示例性形式中,所述簇数据可以指示为了正确拟合所述群体,需要多个创伤防护板。一旦将曲率半径数据聚类后,可以最终确定创伤防护板的维度。
在与板设计相关的特点提取后,软件确定拟合所述群体的簇的最佳数目。必须指出,在某些情况下有两个或更多的簇提供了局部极小值,如图120中所概述的。为了确定提供可接受的误差容许度以及每个家族中合理的板数目的最适选择,软件为每个簇中的板产生三维表面模型。然后通过将那些板放置在群体上并计算板与骨骼表面之间的错配,来进行自动评估。这一分析的结果允许软件挑取将被用于该特定群体的板的最适数目。然后将最终的板模型参数化,并以避开肌肉和软组织位置并使固定最大化的方式将螺钉位置置于每块板上。螺钉的宽度由整个群体中每个螺钉高度处骨骼的横截面分析来确定。
使用尸体研究验证了肱骨的该过程和方法。具体来说,从高加索白人女性获取尸体肱骨的CT扫描图。这些CT扫描图被软件用来为每块肱骨产生单独的三维模型。应该指出,在该验证研究期间使用的CT 扫描图和三维模型都不是用于产生肱骨创伤防护板的统计图集和相关群体的一部分。因此,CT扫描图或三维模型包含了用于验证所设计的肱骨创伤防护板的新数据和模型。在三维验证模型产生后,将每个模型分类到特定的簇(所述簇得自于从设计群体设计肱骨创伤防护板)。在验证模型被分类到的簇的基础上,将为该簇设计的肱骨创伤防护板拟合到适合的验证三维肱骨骨骼模型,并计算显示出验证三维肱骨骨骼模型的外表面与肱骨创伤防护板的底侧表面之间的任何间隔的测量值。图124描绘了拟合到验证三维肱骨骨骼模型上的创伤防护板的距离作图,示出了骨骼与创伤防护板之间距离最大的区域。可以看出,创伤防护板的大部分与骨骼间隔极小,而符合性较低的区域仅显示出0.06至0.09厘米范围内的间隔。因此,该尸体研究的结论确定了按照上述示例性过程使用上述系统设计的创伤防护板具有非凡的轮廓匹配,其当在手术中应用时,避免了外科医生不得不弯曲或手动重塑接骨板的惯例。
参考图131-138,在这个过程的另一个示例性情形中,为锁骨产生创伤防护板。在这里,统计图集从大量锁骨产生,其充分捕捉了例如高加索人群内的变化性。应该指出,统计图集可以包括来自于大量种族、来自于大量患者年龄和来自于各种不同地理区域的锁骨。示例性的公开内容恰巧在高加索人群数据集的情形中,尽管本领域技术人员将会理解,所描述的系统和方法不仅限于高加索人群统计图集。图132 图示了通用锁骨解剖结构。
在示例性形式中,锁骨的统计图集还定义了与每个锁骨的肌肉附连位点相关的位置,如图134中所示。此外,沿着整个骨骼以10%的增量(参见图138)以及在肌肉附连位点处和锁骨腰部处(参见图137) 提取横截面轮廓。计算每个横截面轮廓的最大和最小维度。此外,通过分析横跨数据集中所有锁骨表面的同源点之间的大小和方向差异,检查整个三维表面的不对称性。结果验证了关于锁骨不对称性的现有研究,即左锁骨比右锁骨长,但右锁骨比左锁骨厚。然而,在男性与女性之间不对称性的模式有差异,如图139中所示。
另外,如图133中所示,锁骨中线不像现有的锁骨创伤防护板设计的情况一样遵循对称的“S”形状。因此,本公开证实了目前的锁骨创伤防护板未能模拟锁骨的解剖学曲率。就图135和136而言,男性锁骨在所有维度上以及肌肉和韧带附连位点轮廓上明显不对称(p<.05),而女性的不对称性更加可变。然而,在两种性别中,在后中干上没有肌肉附连的区域明显不对称。
从横跨统计图集提取的锁骨特点进行聚类(按照本申请中的先前描述的聚类方法,其通过参考并入本文)以确定不同的相似性分组(即群体),从所述分组将每个不同的组与特定锁骨创伤防护板相关联,以最佳拟合所述群体。另外,为每个创伤防护板群体确定螺栓固定位置和长度,以最适地避开软组织(肌肉附连部)并防止另外的骨折或作为螺栓过长或过短的结果而发生板松动。使用所述过程,设计了对应于大规模定制的锁骨创伤防护板的几个锁骨创伤防护板家族,如图 140-149中所示。
参考图126,图示了患者特异性创伤防护板的过程以包括各个不同的组成部分。在这些组成部分中包括手术前外科计划、预先确定轮廓的患者特异性创伤防护板的产生、放置和紧固患者特异性创伤防护板的手术中引导以及任选的患者特异性创伤防护板的手术后评估。这些组成部分以及每个组成部分所涉及的示例性过程和结构的更详细讨论,在下文中轮流讨论。
参考图126-130,图示了手术前外科计划组成部分的示例性过程流程。为所讨论的解剖结构获得解剖学数据的初始输入。仅仅出于示例性说明的目的,将锁骨作为折断或变形的解剖结构进行描述,并将锁骨创伤防护板作为患者特异性创伤防护板进行描述。将解剖学数据输入到被配置以选择或产生患者特异性锁骨创伤防护板的软件包,其中所述解剖学数据包含锁骨的二维(2D)图像或三维(3D)表面表述,其可以例如采取表面模型或点云的形式。在使用2D图像的情形中,使用这些2D图像来构建折断的锁骨的3D虚拟表面表述。本领域技术人员熟悉利用解剖结构的2D图像来构建3D表面表述。因此,为简便起见省略了这一过程的详细解释。例如,输入的解剖学数据可以包含X- 射线图像、计算机断层扫描(CT)扫描图、磁共振图像(MRI)或可以从其产生所讨论的组织的3D表面表述的任何其他成像数据中的一者或多者。来自于该解剖学数据输入的输出是折断的锁骨组成部分的 3D虚拟表面表述。
然后评估折断的锁骨组成部分的3D虚拟表面表述以鉴定骨折的位置和形状,或者在骨骼组成部分完全折断并分离的情况下,鉴定骨骼组件相对于彼此的位置和形状。
在骨骼组成部分完全折断并分离的情况下,所述方法和相关的软件执行骨骼还原过程,这可以允许手动重新定位折断的锁骨的3D虚拟表面表述以构建拼凑的锁骨。在这种情况下,用户重新定位并重新定向折断的锁骨的3D虚拟表面表述,以产生类似于从包含所述3D虚拟表面表述的组成部分组装的锁骨的3D拼凑锁骨模型。或者,所述方法和相关软件可以任选地使用锁骨的3D模板模型提供折断的锁骨的3D 虚拟表面表述的自动重新定位和重建,以构建拼凑的锁骨模型。更具体来说,所述软件首先从包含所述3D虚拟表面表述的每个断骨组件 (即骨折的边缘)的3D虚拟表面表述检测一个或多个骨折位点,并从每个骨折位点提取轮廓。然后软件将提取到的轮廓与3D模板锁骨模型的轮廓进行比较,以便为每个骨折位点以成对方式匹配这些轮廓并定位匹配的骨骼组件/块。然后将匹配的组件/块分组在一起。在匹配的组件/块分组之后,软件将分组的块匹配到3D模板锁骨模型,以鉴定所有骨骼组件/块相对于所述3D模板锁骨模型的正确位置。然后将匹配的组件/块还原成类似于所述3D模板锁骨模型的3D拼凑锁骨模型,其正如后文中讨论的被软件用来构建3D重建锁骨模型。
再次参考图7和127,在还原后,使用3D拼凑锁骨来鉴定统计图集中最接近地类似于所讨论的患者的3D拼凑锁骨模型的解剖学模型 (例如完整骨骼模型)。这一步骤在图3中被描绘成发现图集中最接近的骨骼。为了首先鉴定统计图集中最接近地类似于所述3D拼凑锁骨模型的骨骼模型,使用一种或多种相似性度量将所述3D拼凑锁骨模型与统计图集中的骨骼模型进行比较。最初的相似性度量的结果是从统计图集中选择作为“初始猜想”用于后续配准步骤的骨骼模型。所述配准步骤使用所选的图集骨骼模型(即初始猜想骨骼模型)配准3D拼凑锁骨模型,使得输出是与图集骨骼模型对齐的患者特异性重建骨骼模型。在配准步骤之后,优化对齐的“初始猜想”的形状参数以使所述形状匹配3D拼凑锁骨模型。
优化在这种情况下来自于统计图集的形状参数,以便使用非骨折区域来最小化重建的患者特异性骨骼模型与3D拼凑锁骨模型之间的误差。改变形状参数值允许表述不同的解剖学形状。重复这一过程,直至实现重建形状的趋同(可能作为迭代之间的相对表面变化或容许的迭代的最大数目来度量)。
进行松弛步骤来变形所述优化的骨骼,以最好地匹配所述3D拼凑锁骨模型。与示例性情况相一致,将从趋同步骤输出的来自于3D拼凑锁骨模型的丢失解剖结构施加到变形的3D锁骨模型,由此产生患者的重建锁骨的患者特异性3D模型。更具体来说,将3D拼凑锁骨模型上的表面点直接松弛(即变形)到患者特异性3D锁骨模型上,以使重建的形状最好地匹配到患者特异性形状。这个步骤的输出是完全重建的患者特异性3D锁骨模型,其代表了患者锁骨的正常/完整解剖结构应有的状况。
在全解剖结构重建后,系统软件开始计划还原次序过程。在这个计划还原次序过程中,软件允许手动或自动确定哪些锁骨组成部分(即折断的锁骨块)将彼此重新装配和安装以及以何种次序进行。在这样做时,软件在存储器中记录从骨骼组成部分逐渐组装锁骨的3D模型。因此,假设锁骨断裂成6个组成部分,软件将记录示出了待组装的第一和第二断骨组成部分的组装的第一3D模型,然后是示出了待组装的第一、第二和第三断骨组成部分的组装的第二3D模型,以此类推,直至获得反映出所有6个断骨组成部分的组装位置和取向,从而类似于所述3D拼凑锁骨模型的最终3D模型。
使用还原次序确定,软件允许使用所述3D拼凑锁骨手动或自动选择多个锁骨创伤防护板模板之一。更具体来说,所述锁骨创伤防护板模板包含锁骨创伤防护板的一系列3D虚拟表面表述,其已被通用造型成匹配从统计学骨骼图集获得的与给定群体相关的尺寸和形状参数。换句话说,所述统计学骨骼图集包括已在尺寸、种族、年龄、性别和指示骨骼形状的任何其他标志物中的一者或多者的基础上分类的多个正常的全解剖结构锁骨的表面模型。获得模板接骨板的程序的示例性讨论已在前文中针对图112-125进行过描述,并通过参考并入此处。在自动选择模式中,软件将多个锁骨创伤防护板模板的维度和轮廓与3D 拼凑锁骨进行比较,以辨别哪些模板最紧密地顺应于3D拼凑锁骨(即相对于骨骼解剖结构的轮廓和形状相似性)。
使用最紧密地顺应于所述3D拼凑锁骨的锁骨创伤防护板模板,软件允许手动或自动鉴定通过创伤防护板的固定位点位置,以及确定待使用的固定装置(例如外科螺栓)的方向和长度。在自动固定位点鉴定模式中,软件考虑肌肉和附连位置以及神经位置,以避免将任何固定孔置于神经通路或肌肉附连位点中。另外,软件允许手动或自动选择与创伤防护板一起使用的固定紧固件。通过这种方式,软件可以将锁骨断裂组件的尺寸和形状、通过创伤防护板延伸的紧固件孔的位置和取向以及紧固件(例如螺栓)的几何形状考虑在内自动选择紧固件,以便提高固定强度并尝试避免锁骨完整性的不必要的损害。
在选择锁骨创伤防护板模板、固定孔位置和固定紧固件之后,软件进行虚拟接骨板放置。这包括将锁骨创伤防护板模板放置在3D拼凑锁骨上并将锁骨创伤防护板模板手动或自动变形以匹配3D拼凑锁骨的外部表面轮廓,由此产生具有一定尺寸、长度和轮廓维度的虚拟3D 患者特异性锁骨创伤防护板。软件记录所述患者特异性锁骨创伤防护板维度,并将这些虚拟维度转变成机器码,其允许产生可以快速制造的实体患者特异性锁骨创伤防护板。
使用所述患者特异性锁骨创伤防护板维度,软件还接收关于折断的锁骨区域内患者软组织、血管和神经的放置和位置的解剖学数据,以构建切割计划。切割计划是手术前的,并建议了制造一个或多个切口的手术方法,其增加折断的锁骨组成部分的可接近性,并在同时减少手术程序的侵入性,从而潜在地减少恢复时间和附属的手术后创伤。图134示出了具有表面着色的3D拼凑锁骨,所述表面着色指示了肌肉附连到患者锁骨的位置。因此,沿着3D拼凑锁骨纵向延伸的画出的圆圈对应于固定紧固件的位置,所述紧固件被定向到基本上不含肌肉附连部的位置。
在构建切割计划后,外科医生检查所述计划以在批准计划之前做出任何修改。在批准切割计划后,可以将所述计划输出到手术中外科知道系统。同样地,可以利用切割计划来构建手术前的实际锁骨模型,用于估计彼此安装以模拟患者正常锁骨的重建锁骨组件的形状。然后可以使用这个实际锁骨模型来试验对锁骨创伤防护板的拟合,并在手术前由外科医生通过可能合乎需要的弯曲来制造任何轮廓修改。或者,实际锁骨模型可以包含处于松开形式的锁骨组件,以便必需将一个或多个创伤防护板安装到它才能将锁骨组件保持在一起,从而允许外科医生离体试验创伤防护板的拟合并且也离体做出对创伤防护板的任何修改。
参考图128和129,示例性的患者特异性锁骨创伤防护板可以在手术中使用荧光检查法来放置。尽管示例性技术针对将患者特异性锁骨创伤防护板附着到患者锁骨或锁骨组成部分来描述,但应该理解,所述示例性过程同样适用于将非患者特异性创伤防护板附着到锁骨,并且更广义来说适用于将任何创伤防护板附着到任何骨骼或断骨组成部分。
图128描绘了过程流程图,其描绘了作为用于在手术中使用荧光检查法放置患者特异性创伤防护板的创伤防护板放置系统的一部分而涉及的各种不同步骤,其包括利用预先计划的数据以及放置基准标志物以确立患者位置配准。更具体来说,将预先计划的数据装载到创伤防护板放置系统的软件包中,并且可以包括患者的骨骼几何形状和组织几何形状、每个创伤防护板的位置、用于将创伤防护板固定到所讨论的骨骼或骨骼组成部分的固定装置的类型和位置,以及与手术场所和技术有关的任何其他相关信息。用于荧光检查法的基准标志物包括但不限于光学、电磁学、IMU标志物(尽管在图128的过程流程中提到的是光学标志物,其被放置在相对于患者上的解剖学标志已知的位置处)。使用基准标志物和患者的已知解剖学位置和维度,创伤防护板放置系统将患者相对于手术前坐标系配准。随后,在空间中追踪所述基准标志物,以便向外科医生提供来自于创伤防护板放置系统的与手术前计划相一致的指示一个或多个切口相对于固定的患者参照框的位置的反馈。可以作为创伤防护板放置系统的一部分使用的示例性反馈系统包括但不限于投影在患者表面上勾画出每个切口的位置和长度的直观显示。
在锁骨包含分开的骨骼组成部分的折断锁骨的情形中,创伤防护板放置系统还能够直观显示多个锁骨组件上的识别标记,以指示骨骼组件的组装次序。在示例性形式中,所述直观显示包括显示在每个骨骼组件上的可见的彩色数字。所述彩色数字随着骨骼组件相对于彼此的取向和位置改变颜色。在示例性形式中,第一骨骼组件用投影到外表面上的显示数字“1”来识别。取决于骨骼的取向和位置,显示数字“1”可以是红色、黄色或绿色。红色数字指示取向和位置不正确。在移动后,如果外科医生为了实现与手术前计划相一致的放置而正在向正确方向移动骨骼组件,则所述标记变成黄色。在继续移动后,当达到正确位置时,所述数字变成绿色。为每个锁骨组件重复这种重新定位过程。
为了向外科医生提供这种关于断骨组件的位置和取向的直观反馈,创伤防护板放置系统使用荧光检查法在3D空间中追踪骨骼组件,以分辨骨骼的位置和取向是否与手术前计划相一致。在骨骼组件追踪之前,使用手术前数据将骨骼组件配准,以便通过投影的显示向外科医生提供关于骨骼组件的正确位置和取向的实时更新的信息。当每个骨骼片段被追踪并最终安装到锁骨创伤防护板时,系统使用荧光检查图像验证创伤防护板放置的进展,以证实板的取向和位置以及固定装置(例如螺栓)和骨骼组件的取向和位置。最后,当通过一个或多个锁骨创伤防护板将骨骼组件彼此偶联时,系统显示最终的标记,其向外科医生指明手术以满足手术前计划的目的并且可以结束。
图130描绘了作为用于在手术中使用超声代替荧光检查法来放置患者特异性创伤防护板的创伤防护板放置系统的一部分所涉及的各个不同步骤的过程流程图。前面针对图128的解释与图130的解释相同,其通过参考并入此处,区别在于系统使用超声代替荧光检查法来追踪骨骼组件、创伤防护板和固定装置。因此,为简便起见省略了冗余的解释。
参考图150,描述了用于产生患者特异性的创伤防护板放置引导器的示例性过程和系统。本领域技术人员认识到,骨骼可以在一个或多个位置处折断,产生彼此分开的骨碎片。作为修复骨骼的重建手术的一部分,使用一个或多个创伤防护板将这些碎片以固定取向夹持。重建外科医生试图使用先天知识而不是患者特异性解剖学事实将骨骼接回到一起。因此,在患者骨骼解剖结构与正常结构的差异程度上,骨碎片极其扭曲,或者骨碎片的数目大,外科医生将诉诸于使用现有技术的创伤防护板,并使骨碎片匹配板的形状而不是与之相反。该过程和系统通过产生创伤防护板放置引导器和定制的创伤防护板将创伤防护板匹配到骨骼以复制原始的骨骼形状和取向,改进了现有技术的创伤防护板。
所述示例性系统始于接收代表骨折解剖结构的输入数据。仅仅出于解释的目的,骨折的解剖结构包含人类颅骨。应该指出,上述过程和系统同等地适用于其他解剖结构/骨骼,包括但不限于手臂、腿和躯干中的骨骼。在示例性形式中,解剖结构数据输入可以采取X-射线图像、CT扫描图、MRI或可以代表骨骼尺寸和形状的任何其他成像数据的形式。
将输入的解剖结构数据用于构建骨折解剖结构的三维虚拟模型。例如,输入的解剖结构数据包含骨折颅骨的计算机断层扫描图,其被软件处理以将该扫描图分段并产生三维模型。本领域技术人员熟悉如何利用计算机断层扫描图来构建三维虚拟模型。因此,为了进一步简洁起见,省略了所述过程的这一方面的详细描述。
在产生骨折颅骨的三维虚拟模型之后,软件将颅骨的三维虚拟模型与来自于统计图集的数据进行比较,以确定三维虚拟模型中颅骨骨折的区域。具体来说,软件利用从输入的解剖结构的表面模型提取的特点(例如:表面粗糙度,曲率,形状指数,曲度,邻域连通度)来提取骨折位点的区域。然后提取那些骨折位点的大概轮廓并匹配在一起以找出匹配的骨折位点。也将骨折片段与图集匹配以指示放置匹配的骨折位点以便重建正常解剖结构的最佳位置。
在软件产生骨折的颅骨的重建的三维虚拟模型以后,可以将支撑物手动和/或自动放置在重建的三维虚拟颅骨模型的外部上。支撑物的自动放置是程控逻辑的结果,以最大化骨碎片的稳定性同时最小化支撑物的数目。当在本文中使用时,术语支撑物及其复数形式是指用于使骨碎片相对于彼此稳定的任何支持物。在某些情况下,当利用手动支撑物放置特点时,外科医生或其他专业用户的实践经验可以补充或取代所述逻辑。在任何情况下,将一系列支撑物编程在软件中,这允许软件或软件用户为不同应用选择不同的支撑物。同时,支撑物的长度可以在骨折和骨碎片的维度的基础上手动或自动操控。
在将支撑物分派并放置在重建的三维虚拟颅骨模型上之后,由软件记录每个支撑物的维度和轮廓。这一记录包括制造每个支撑物所必需的信息,或者至少包括有助于允许外科医生或其他专业人员获取现有的支撑物并使其顺应放置引导器的信息。在模制现有支撑物的情形中,软件提取重建的三维虚拟颅骨模型的轮廓以产生计算机辅助设计 (CAD)指令,用于产生一个或多个指示重建的三维颅骨模型的实体模型。将这些CAD指令送往快速原型机,其产生所述一个或多个指示重建的三维颅骨模型的实体模型。通过作为实体模型再造正确的解剖学表面,在植入并紧固到患者的颅骨之前,可以将每个支撑物在目标位置处施加到实体模型并手动顺应。
在任何支撑物的位置和长度的基础上,软件也提取重建的三维虚拟颅骨模型的轮廓,为一个或多个患者特异性支撑物放置引导器产生轮廓数据。具体来说,可以为每个支撑物产生放置引导器。通过这种方式,放置引导器包括在单一方向上与患者颅骨的轮廓匹配的表面轮廓。假如支撑物在重建颅骨的虚拟模型上的位置是已知的,相邻的颅骨外表面的轮廓也是已知的,则软件将二者合并以产生虚拟的患者特异性放置引导器。将该虚拟引导器以CAD指令的形式输出到快速原型机用于制造。
在这个示例性实施方式中,制造的患者特异性放置引导器包含细长的柄,其被构造成被外科医生抓握。从所述细长柄的末端延伸出大块的C形轮廓板。轮廓板的下侧为凹面,以匹配颅骨在支撑物应该被放置的位置处的凸面拓扑结构。尽管不需要,但轮廓板的末端(或另一部分)可以被紧固到支撑物,或者轮廓板可以简单地提供工作窗口,在所述窗口内将支撑物与颅骨对齐并最终紧固到颅骨。在将支撑物附着于颅骨后,可以将轮廓板取下。
参考图151,变形、断裂或部分的解剖结构的重建是卫生护理提供者面对的复杂问题。异常的解剖结构可能是出生状况、肿瘤、疾病、人身伤害的结果。作为为各种不同病患提供治疗的一部分,卫生护理提供者可能发现重建解剖结构或构建解剖结构对便于各种不同病症的治疗来说是有利的,所述病症可以包括但不限于骨断裂/破碎、骨退化、骨外科植入物修正、骨外科初始植入和疾病。
本公开提供了使用骨移植物进行骨骼和组织重建的系统和方法。为了执行这种重建,所述系统和相关方法利用患者当前的解剖结构图像构建两个虚拟3D模型:(a)代表当前异常解剖结构的第一3D模型;以及(2)代表患者的重建解剖结构的第二3D模型。必须参考前面“全解剖结构重建”一段中对使用患者图像(X-射线图像、CT扫描图、 MRI图像等)以获得患者的异常解剖结构和重建的解剖结构的虚拟模型的详细解释。该系统和方法在“全解剖结构重建”一段中描述的系统的基础上建立,以与构建可以获取骨移植物的一个或多个骨骼(即供体骨骼)的3D虚拟模型相结合利用两个3D虚拟模型。正如将在后文中更详细描述的,对患者的重建和异常的解剖结构的3D虚拟模型进行分析,以产生重建所需的骨移植物的3D虚拟模型。将这个3D虚拟移植物模型与供体骨骼的3D虚拟模型进行比较,以访问供体骨骼上可以切下骨移植物的一个或多个位点。在确定切除位置之后,设计并制造用于收集移植的骨骼并将移植的骨骼固定到重建位点的切割引导器和移植物放置引导器。
作为示例性解释,将在面部重建的情形中描述该系统和方法,其中供体骨骼包含腓骨。本领域技术人员应该认识到,该系统和方法适用于利用一个或多个骨移植物的任何重建手术程序。此外,尽管讨论面部重建和腓骨作为骨骼供体,但本领域技术人员应该理解,所述示例性系统和方法可以用于腓骨之外的供体骨骼。
作为讨论所述示例性系统和方法用于使用骨移植物的重建手术计划和手术程序的前置步骤,假设已按照前面“全解剖结构重建”一段中描述的过程对患者的异常解剖结构进行成像并产生患者的异常和重建的解剖结构的虚拟3D模型。因此,为简洁起见,已省略利用患者图像来产生患者的异常和重建的解剖结构两者的虚拟3D模型的详细讨论。
在患者的异常和重建的解剖结构的虚拟3D模型已被产生后,软件对解剖结构进行比较并突出差异的区域。具体来说,虚拟3D模型之间共有的区域表示将被保留的骨骼,而差异的区域指示用于重建的一个或多个位点。软件从患者的重建解剖结构的虚拟3D模型提取那些不共有的区域,并分离这些区域作为目标骨移植物的分开的3D虚拟模型。外科医生或其他术前计划人员可以观察虚拟3D骨移植物模型并对可以最好地切下骨移植物的一块或多块骨骼使用他的判断。
不论最初选择作为移植物候选者的可能的骨骼使用何种逻辑,所讨论的骨骼都使用常规方式(X-射线、CT、MRI等)进行成像。使用在前面“全解剖结构重建”一段中描述的过程,对每个成像的骨骼进行分段,并产生成像骨骼的虚拟3D模型。将该3D供体骨骼模型与虚拟3D骨移植物模型进行比较,以分离共有的区域。具体来说,软件将 3D供体骨骼模型的表面轮廓与虚拟3D骨移植物模型的表面轮廓进行比较,以鉴定共同或具有相似曲率的区域。假设没有共同或相似的区域,可以通过分析另一个可能的供体骨骼重新开始所述过程。相反,如果在供体骨骼中存在共同或具有相似曲率的一个或多个区域,则在 3D供体骨骼模型上突出这些区域。具体来说,突出的区域模拟虚拟3D 骨移植物模型的形状。如果所述共同的区域被判断为适合于切下骨移植物,则软件虚拟地切下所述骨移植物作为虚拟的3D模型,并将骨移植物(其具有对于供体骨骼来说特异/独有的轮廓)应用到患者的异常解剖结构的虚拟3D模型,以验证潜在的拟合和作为重建的一部分可能需要切下的患者异常解剖结构的任何区域。在被切下的骨骼的虚拟3D 模型向患者异常解剖结构的虚拟3D模型的应用产生不太令人满意的重建的情形中,所述过程可以在骨骼选择点处重新开始,或者被重新开始以切下骨骼的不同区域。但是,假设被切下的骨骼的虚拟3D模型向患者异常解剖结构的虚拟3D模型的应用产生适合的拟合,则系统前移到设计夹具以便于切下骨移植物并将骨移植物安装到患者的残骨。
在该示例性实施方式中,系统产生并输出快速原型机、CNC机或类似装置所必需的机器码,以制造骨移植物切割引导器和骨移植物放置引导器。为了产生制造骨移植物切割引导器和骨移植物放置引导器所必需的输出,系统将被切下的骨骼的虚拟3D模型用于患者异常解剖结构的虚拟3D模型。
具体来说,被切下的骨骼的虚拟3D模型定义了虚拟3D切割引导器的边界。此外,在这个示例性情形中,打算切下一部分腓骨以提供骨移植物。为了确保腓骨的适合部分被切下,虚拟3D切割引导器包括窗口,切割装置(锯、切割钻等)在所述窗口内来回移动以产生轮廓适合的骨移植物。虚拟3D切割引导器不仅需要被造型成产生适合的骨移植物轮廓,而且它需要被造型成确保切割引导器在患者供体骨骼上的放置是特殊的。更具体来说,切割引导器在供体骨骼上的放置需要同时确保被切下的骨骼包括正确的轮廓形状并且也表现出正确的轮廓。通过这种方式,将虚拟3D切割引导器的底面设计成是供体骨骼的将要安装切割引导器的表面的“负形”。用于将切割引导器固定到供体骨骼的示例性的安装技术包括但不限于螺钉、榫钉和销针。为了容纳一种或多种这些安装技术或其他安装技术,虚拟3D切割引导器也被设计成除了手术切割器在其中来回移动的窗口之外还包括一个或多个贯通孔。在虚拟3D切割引导器的设计完成后,系统产生并输出快速原型机、CNC机或类似装置所必需的机器码以制造骨移植物切割引导器,随后制造真实的切割引导器。
除了切割引导器之外,软件还设计一个或多个骨移植物放置引导器。骨移植物放置引导器是患者特异性的,并且顺应于患者的解剖结构(供体骨骼和供体骨骼固定到的残骨两者)以确保骨移植物相对于残骨的正确放置。在示例性形式中,构造了用于下颌骨重建手术的骨移植物放置引导器。为了设计所述骨移植物放置引导器,软件利用被切下的骨骼的虚拟3D模型,将其施加到患者异常解剖结构的虚拟3D 模型以构建混成模型。使用该混成模型,鉴定骨移植物与相邻残骨相接(并且有希望通过骨骼生长来联结)的接合处。在这些接合处,取决于各种不同因素例如外科医生的偏好性,系统鉴定骨移植物板位置以及对于每块板来说一个或多个引导器,以便于将板正确放置并固定到骨移植物和残骨。
参考图152,以流程图的形式图示了用于创伤防护板模板制作的示例性系统和方法。该系统和方法包括计算机和相关软件,进行计算以确定一组模板创伤防护板内的最佳拟合,以便减少将来为了拟合创伤防护板以匹配患者的骨骼几何形状可能必需的形状改变。在示例性形式中,系统包括构建作为统一骨骼的患者断骨的3D模型,然后针对所述3D模型形成模板创伤防护板,以在植入之前最终定下创伤防护板的形状。通过这种方式,最终的创伤防护板形状是患者特异性的并允许更接近地拟合于患者解剖结构,消除创伤防护板的放置位置的不明确性,并缩短手术时间。所述系统可以容易地部署在日常临床环境或外科医生的办公室中。
再次参考图152,系统的初始输入是描绘断骨的多种医学图像中的任一种。例如,这些医学图像可以是X-射线、超声、CT和MRI中的一者或多者。断骨的图像由操作人员进行分析,以从多个可能的被编程的骨骼中选择折断的骨骼。使用骨骼选择,所述软件利用医学图像数据来形成断骨组件的3D模型(正如前面针对图127及其相关描述所描述的,其通过参考并入此处)。然后使用来自于统计图集的骨骼数据将这些3D骨骼模型还原(即重新装配以形成拼凑的骨骼,其将 3D骨骼模型定向和定位成如同当骨骼统一并且未折断时彼此相连的情形),以形成3D拼凑骨骼模型。同样地,也将来自于统计图集的骨骼数据与所述3D拼凑骨骼模型组合使用以在完整的未断折骨骼模型上变形所述3D拼凑骨骼模型,产生所讨论的患者骨骼的完整的3D骨骼模型(未断折的),其被称为重建的骨骼模型。
通过软件分析这个重建的骨骼模型以提取沿着主维度的纵向曲线 (即中线曲线),同时软件还提取垂直于主维度获取的横截面曲线,以便提取创伤防护板设计参数。从这些设计参数,软件计算在多个模板创伤防护板中哪个最接近类似于设计参数。这些设计参数可以包括创伤防护板的长度、创伤防护板的纵向曲率、垂直于所述纵向曲率的横向曲率、横向长度和骨骼紧固件的使对肌肉附连位点和神经位置的干扰降至最低的固定位置,并在同时确保创伤防护板向断骨的正确安装和固留。
所述重建的骨骼模型也被用于产生实体3D骨骼模型。在示例性形式中,所述软件被编程以将虚拟的重建骨骼模型作为机器码输出,从而允许以添加法或减除法快速制造3D骨骼模型的原型。出于本公开的目的,添加法包括3D打印,其中从起始空白画布通过添加材料以形成骨骼模型的分立的层或薄片来产生模型,所述层或薄片一旦通过打印后续的层彼此堆叠后,形成最终的骨骼模型。相反,减除法包括从固体材料块开始,并使用机器码(例如CNC码)机械加工掉材料以获得固体骨骼模型。本领域技术人员将会理解,可以使用多种方法中的任一种来制造实体骨骼模型。取决于所选的方法,对软件进行编程以将 3D虚拟模型转变成机器码,以便于3D骨骼模型的快速原型制造和构建。
在3D骨骼模型构建之后,可以在软件对被最接近地造型成顺应于患者断骨的创伤防护板的选择的基础上,构建、机械加工或选择模板创伤防护板。一旦完成后,将所述模板创伤防护板拟合于3D骨骼模型,并通过手动弯曲以使创伤防护板顺应于所述3D骨骼模型来进一步精炼。在创伤防护板与骨骼模型之间获得足够的顺应性之后,创伤防护板可以被认为是患者特异性的,并且在灭菌后随时准备好用于植入到患者中。
参考图153,以流程图的形式图示了用于髋笼模板制作和放置引导器的示例性系统和方法。该系统和方法包括计算机和相关软件,进行计算以确定一组模板髋笼内的最佳拟合,以便减少将来为了拟合拟合以匹配患者的骨骼几何形状可能必需的形状改变。在示例性形式中,系统包括构建患者髋部(如果骨折或退化的话,作为统一的骨骼)的3D模型,然后针对所述3D模型形成模板髋笼,以在植入之前最终定下髋笼的形状。通过这种方式,最终的髋笼形状和附连位点是患者特异性的并允许更接近地拟合于患者解剖结构,消除髋笼的放置位置的不明确性,并缩短手术时间。所述系统可以容易地部署在日常临床环境或外科医生的办公室中。
再次参考图153,系统的初始输入是描绘患者髋部(全部或部分盆骨)的多种医学图像中的任一种。例如,这些医学图像可以是X-射线、超声、CT和MRI中的一者或多者。髋骨的图像被软件用来构建患者髋部的3D虚拟骨骼模型(正如前面针对图1和7及其相关描述所描述的,其通过参考并入此处)。然后通过软件对这个3D骨骼模型进行自动标志寻找。
所述软件利用来自于统计图集的输入(例如可能含有特异性标志的区域)和局部几何分析,与统计图集中的那些髋骨模型进行比较来计算3D骨骼模型的解剖学标志。这种计算对于每个标志来说是特异性的。例如,所述区域的近似形状是已知的,正在搜索的标志相对于局部形状特征的位置是已知的。例如,定位髋臼的前盂唇沟槽点的上缘,通过在统计图集中的前盂唇沟槽点的上缘的近似位置的基础上对搜索进行精炼来实现。对于所讨论的每个标志,重复这一过程。
在为3D骨骼模型自动计算解剖学标志后,通过软件对骨骼模型进行分析以计算在多个模板髋笼中哪一个最接近拟合所述解剖学标志。除了计算过个髋笼中哪一个最接近拟合患者髋部的解剖学标志之外,软件还计算髋笼将被安装到患者解剖结构的位置。再次参考相关讨论通过参考并入此处的图20和21,软件有效地确定髋笼将被安装到患者解剖结构的位置,并产生虚拟3D引导器,其可被用于输出足以为修正的髋笼构建实体3D放置引导器的机器码。
患者髋部的骨骼模型也被用于产生实体3D骨骼模型。在示例性形式中,软件被编程以将虚拟3D骨骼模型作为机器码输出,从而允许以添加法或减除法快速制造实体3D骨骼模型的原型。出于本公开的目的,添加法包括3D打印,其中从起始空白画布通过添加材料以形成骨骼模型的分立的层或薄片来产生模型,所述层或薄片一旦通过打印后续的层彼此堆叠后,形成最终的骨骼模型。相反,减除法包括从固体材料块开始,并使用机器码(例如CNC码)机械加工掉材料以获得固体骨骼模型。本领域技术人员将会理解,可以使用多种方法中的任一种来制造实体骨骼模型。取决于所选的方法,对软件进行编程以将3D 虚拟模型转变成机器码,以便于3D骨骼模型的快速原型制造和构建。
在3D骨骼模型构建之后,可以在软件对被最接近地造型成顺应于患者髋部的髋笼的选择的基础上,构建、机械加工或选择髋笼。一旦完成后,将所述模板髋笼拟合于3D骨骼模型,并通过手动弯曲以使髋笼顺应于所述3D骨骼模型来进一步精炼。在髋笼与骨骼模型之间获得足够的顺应性之后,髋笼可以被认为是患者特异性的,并且在灭菌后随时准备好用于植入到患者中。
参考图154,描绘了使用利用计算机和相关软件的IMU进行骨骼和软组织的运动学追踪的示例性系统和方法。例如,这种运动学追踪可以提供关于患者运动学的有用信息,用于手术前外科计划。出于示例性解释的目的,本系统和方法将在追踪骨骼运动并从整合了骨骼和软组织的3D虚拟模型获得产生的软组织运动的背景中进行描述。本领域技术人员应该认识到,本系统和方法适用于任何骨骼、软组织或运动学追踪尝试。此外,尽管骨骼和软组织的运动学追踪在膝关节或脊椎的情形中进行讨论,但本领域技术人员应该理解,所述示例性的系统和方法适用于除了膝关节之外的关节和椎骨之外的骨骼。
作为讨论用于骨骼和软组织运动学追踪的示例性系统和方法的前言步骤,假设患者的解剖结构(待追踪的)已被成像(包括但不限于X-射线、CT、MRI和超声),并且已依照通过参考并入此处的前面的“全解剖结构重建”部分中描述的方法产生了患者解剖结构的虚拟3D 模型。因此,为增加简便性,利用患者图像产生患者解剖结构的虚拟 3D模型的详细讨论已被省略。
如果在所述成像方法的基础上可以获得软组织(例如韧带、肌腱等)的图像,则在将骨骼分段以形成患者解剖结构的虚拟3D模型时,这些图像也被软件包含并分段。如果不能从所述成像方法获得软组织图像,则将骨骼的3D虚拟模型移向患者特异性软组织添加过程。具体来说,可以利用统计图集来估算软组织相对于3D骨骼模型的每个骨骼形状的位置。
使3D骨骼模型(不论软组织是否是所述模型的一部分)经历由软件执行的自动寻找标志的过程。如前文中所讨论的,所述自动寻找标志过程利用来自于统计图集的输入(例如可能含有特定标志的区域) 和局部几何学分析,为统计图集内解剖结构的每种情况计算解剖学标志。在3D骨骼模型中不存在软组织的情形中,利用通过软件为3D骨骼模型计算的解剖学标志来提供软组织最可能的位置以及所述软组织最可能的大小,这两者被并入到所述3D骨骼模型中,以产生准患者特异性的3D骨骼和软组织模型。在任一情况下,所述解剖学标志和所述 3D骨骼和软组织模型可以使用软件的用户界面(即软件界面)观察和操作。
所述软件界面被通讯连接到视觉显示器,其向用户提供关于患者骨骼和软组织的相对动态位置的信息,所述信息包含虚拟骨骼和软组织模型。为了提供这种当患者的骨骼和软组织被重新定位时被实时更新的动态视觉信息,软件界面也被通讯连接到任何数目的IMU 1002。这些IMU被刚性固定到对应于所述虚拟3D模型的骨骼的一个或多个骨骼,并追踪所述骨骼的相对旋转。例如,所述骨骼在膝关节的情形中可以包含胫骨和股骨,或者在脊椎的情形中可以包含一个或多个椎骨(例如L1和L5椎骨)。为了追踪骨骼的平移,将附加的追踪传感器(例如超宽带)与每个IMU相连(或合并作为单一装置的一部分),以便将每个IMU的位置针对它所安装到的相应骨骼配准。通过这种方式,通过在3D空间中动态追踪所述追踪传感器并了解追踪传感器相对于IMU的位置以及安装到相应骨骼的每个IMU的位置,系统首先能够将追踪传感器的动态移动与所讨论的骨骼的动态位置相关联。为了从 IMU获得有意义的数据,需要将患者骨骼针对虚拟3D骨骼和软组织模型配准。为了实现这一点,将患者的关节或骨骼在对应于虚拟3D骨骼模型的位置的预定位置中保持静止。例如,可以将患者的股骨和胫骨摆正,使得小腿与大腿在一条线上,此时所述3D虚拟骨骼模型也体现出股骨和胫骨纵向对齐的位置。同样地,可以将患者的股骨和胫骨取向成彼此垂直并保持在这个位置中,此时所述3D虚拟骨骼和软组织模型被取向成使股骨与胫骨彼此垂直。使用UWB追踪传感器,将骨骼相对于彼此的位置针对虚拟3D骨骼和软组织模型配准,IMU也是如此。应该指出,根据上面的公开内容,在配准之前使用前文中公开的校准工具1000将IMU校准。
例如,在所述3D虚拟骨骼和软组织模型包括股骨、胫骨和膝关节的相关软组织的膝关节的情形中,所述3D虚拟模型可以呈现股骨和胫骨沿着共同轴延伸的位置(即共同轴位姿)。为了将患者与这种共同轴位姿配准,使患者配备IMU和追踪传感器(刚性固定到胫骨和股骨) 并采取引起股骨和胫骨沿着共同轴对齐的直腿位置。保持这种位置直至软件界面确认IMU和传感器的位置相对不变,并且软件界面的用户指示正采取配准位姿。可以对其他位姿重复这一过程,以便将所述3D 虚拟模型与IMU和追踪传感器配准。本领域技术人员将会理解,配准的精确性一般将随着配准位姿数目的增加而提高。
参考图175和176,在3D虚拟模型包括脊椎的某些椎骨的脊椎的情形中,在患者平躺在工作台上或直立的情况下所述3D虚拟模型可以呈现椎骨沿着共同轴延伸的位置(即共同轴位姿)。为了将患者与这种共同轴位姿配准,使患者配备如图175中所示刚性固定到相对于L1 和L5椎骨的位置中的IMU 1002和其他追踪传感器,并采取与3D虚拟模型的中间直立脊椎位置相关的中间直立脊椎位置。保持这种位置直至软件界面确认IMU和传感器的位置相对不变,并且软件界面的用户指示正采取配准位姿。可以对其他位姿重复这一过程,以便将所述 3D虚拟模型与IMU和追踪传感器配准。本领域技术人员将会理解,配准的精确性一般将随着配准位姿数目的增加而提高。
在配准后,可以将患者解剖结构在3D空间中移动并使用IMU和追踪传感器动态追踪,以便通过3D虚拟模型的移动将骨骼和软组织的移动图形显示在视觉显示器上(在脊椎的情形中参见图176)。当患者移动时,软件从IMU和/或追踪传感器读取输出并处理这些输出,以将所述输出转变成正描绘在视觉显示器上的3D模型的动态图形变化(同时保持例如韧带长度、关节位姿和关节表面接触区域的追踪)。如图 177中所示,当利用两个或更多IMU来追踪患者解剖结构(例如骨骼) 时,正如上文中讨论的,软件界面确定第一IMU相对于第二IMU的相对取向,因为每个IMU处理器被编程成在来自于IMU的陀螺仪、加速计和磁强计的输入的基础上,利用带有von Mises-Fisher密度算法的序贯蒙特卡罗方法(SMC)来计算IMU1002的位置变化。前面的SMC 方法的讨论通过参考并入此处。
具有健康和病态腰椎的患者的运动情况显著不同,使得对于病理患者来说离面运动更高。具体来说,健康和病理患者可以使用IMU,通过使患者进行三种活动——轴向旋转(AR)、横向弯曲(LB)和屈伸(FE)来区分。对于每种提出的运动来说,系数如下计算:
其中A
图155和174描绘了操作偶联到软件界面的示例性视觉显示(即用户界面)。正如在图155中的示例性形式中所描绘的,股骨远端被显示成与胫骨近端相接(并且也显示在虚影近端腓骨中)。所述视觉显示反映出软件界面的动态更新,以实时显示当患者的小腿相对于大腿重新定位时相应骨骼的位置正在如何变化。在图174的情形中,软件还能根据运动学数据计算近端胫骨上的预测载荷分布。换句话说,在膝关节的情形中,软件追踪远端股骨和近端胫骨的移动,并记录通过膝关节的多种运动,胫骨表面的某些部分被远端股骨接触的频率。在股骨和胫骨的区域之间的接触频率的基础上,软件有效地产生反映出接触分布的颜色梯度,使得深红色区域被接触得最频繁,而蓝色区域被接触得最少,红色与蓝色之间的渐变梯度(包括橙色、黄色、绿色和acqua)指示最高与最低频率之间的接触区域。作为另一个实例,软件界面还突出软组织畸形的位置以及通过这些运动追踪解剖学轴,例如在图160-162中示出的。
例如,如图156-158所示,软件利用储存在骨骼统计图集中的软组织附连位点的位置粗略估计所述附连位点,并在追踪的骨骼(在这种情况下是股骨和胫骨)的运动学移动的基础上,并入软组织数据作为虚拟模型的一部分。更具体来说,软件界面被通讯连接到运动学数据库和解剖学数据库(例如骨骼统计图集)。来自于这两个以前已被关联(将骨骼相对于彼此的运动学移动与软组织附连位点的位置相关联)的数据库的数据,允许软件同时显示解剖学数据和运动学数据。因此,如图159中所示,软件可以被操作以包括韧带构建或重建特点,以便可以显示与骨骼偶联的韧带。同样地,软件界面追踪并记录骨骼和韧带模型的运动,以便如图160中所示,显示在时间流逝的意义上当患者的骨骼通过多种运动而移动时,韧带如何动态地伸展。这些运动数据与荧光检查法相比提供了更清楚的图像,并且也避免了使患者经历有害辐射。
参考图164-172,动态移动的3D虚拟骨骼和软组织模型的视觉表述特别适用于进行诊断和手术前计划的临床医生。例如,临床医生可以对膝关节进行各种不同试验例如抽屉试验,以观察骨骼和软组织在多种运动中的移动。这种运动学追踪信息可以被输入到例如手术计划界面中,以限制可能违反从运动学数据获得的韧带长度的切口计划。运动学数据也可用于各种膝关节试验的实时定量(例如Oxford膝关节评分)或用于使用统计模式识别或机器学习技术产生新的可定量的膝关节评分系统。总的来说,当可替选方案例如荧光检查法可能成本更高并且对患者健康更有害时,临床医生试验可用于更准确的手术前和手术后评估。
参考图173,描绘了示例性的IMU套。所述套被固定安装到一对棘轮带。所述棘轮带被配置为包围所讨论的解剖结构例如股骨远端并系紧,以抑制所述套相对于所讨论的解剖结构的显著重新定位。所述套还包括IMU包孔,其尺寸可以接纳IMU包。当将IMU包至于孔内时,所述孔的尺寸不允许当可复位锁啮合IMU包的相反末端时IMU包相对于所述套显著移动。通过这种方式,可以通过操纵所述锁将IMU 包固定到所述套或从所述套取出。
在示例性形式中,所述IMU包除了电源开关之外,还包括至少一个IMU 1002和相关电源、IMU处理器和无线传输器。通过这种方式, IMU包是独立自给的物件,它能够在用于追踪患者骨骼时偶联到所述套,然后从所述套取出。在重复使用和灭菌的情形中,IMU套可以重复使用或是一次性的,而IMU包打算重复使用。然而,在某些情况下,将IMU包一次性使用可能更经济。
除了手术前和手术后评估之外,本系统和方法可能可用于手术中评估。对于患者特异性切口计划来说,从所述计划和患者骨骼数据产生定制的切割引导器。
参考图179,描绘了使用一个或多个惯性测量单元(IMU)以便于外科导航从而在全膝关节置换(TKA)手术期间准确定位胫骨组件的可替选的示例性系统和方法。利用患者图像(X-射线、CT、MRI等) 和进行分段或配准以获得患者解剖结构的虚拟模板和适合的植入物尺寸、形状和放置的初始步骤,与前面参考图87、88、90-92所描述的相同。略微有些区别的是在虚拟模板制作模块下游使用的模块和过程。
在虚拟模板制作模块下游是初始化模型产生模块。与前面讨论的夹具产生模块相似,这个模块也接收模板数据和相关的计划参数(即患者特异性胫骨植入物的形状和相对于患者残留胫骨的放置是已知的,患者特异性股骨植入物得形状和相对于患者残留股骨的放置也是已知的)。使用这个患者特异性信息,初始化模型产生模块制造用于患者的本源远端股骨的初始化装置的3D虚拟模型和用于近端胫骨的初始化装置的3D虚拟模型。换句话说,股骨初始化装置的3D模型被产生成患者远端股骨的特定解剖学表面的“负形”,使得实际的初始化装置精确匹配患者的远端股骨。同样地,胫骨初始化装置的3D模型被产生成患者近端胫骨的解剖学表面的“负形”,使得实际的初始化装置仅在单一位置和单一取向下精确匹配患者的残留胫骨。除了产生这些初始化装置之外,初始化模型产生模块还产生快速原型机、CNC 机或类似装置所必需的机器码,以制造实际的股骨初始化装置和胫骨初始化装置。实际的股骨初始化装置和胫骨初始化装置被制造并安装到(或同时形成或集成到)或集成到被配置为具有至少一个IMU 1002 的外科导航工具。
每个IMU 1002能够报告取向和平移数据,并与一个或多个外科工具组合(例如安装到它们)来协助外科导航以在TKA手术期间放置股骨组件和胫骨组件。每个IMU 1002被通讯偶联(有线或无线)到软件系统,所述软件系统接收来自于IMU的指示相对速度和时间并允许软件计算IMU的当前位置和取向的输出数据,或者IMU 1002计算并发送将在后文中更详细讨论的外科器械的位置和取向、与IMU相关联的外科器械的位置和取向。在这个示例性描述中,每个IMU 1002包括3 个陀螺仪、3个加速计和3个霍尔效应磁强计(成套的3个三轴陀螺仪、加速计、磁强计),其可以集成在单一电路板中或者包含一个或多个传感器(例如陀螺仪、加速计、磁强计)的单独的板,以便输出与互相垂直的3个方向(例如X、Y、Z方向)有关的数据。通过这种方式,每个IMU 1002有效地从3个陀螺仪、3个加速计和3个霍尔效应磁强计产生21个电压或数值输出。在示例性形式中,每个IMU 1002包括传感器板和处理板,其中传感器板包括由3个加速计、3个陀螺仪传感器和3个磁强计构成的集成的感应模块(LSM9DS,ST-Microelectronics) 和两个由3个加速计和3个磁强计构成的集成的感应模块(LSM303, ST-Microelectronics)。具体来说,IMU 1002各自包括角动量传感器,其测量至少3个轴上空间的旋转变化:俯仰轴(上下),偏荡轴(左右)和翻滚轴(顺时针或反时针旋转)。更具体来说,每个包含磁强计的集成的感应模块被放置在电路板上的不同位置处,其中每个磁强计被指派输出与施加的磁场成正比的电压,并且也探测三维坐标系内的3个方向中的每个方向上的空间点处磁场的极性方向。例如,第一磁强计输出在第一位置处与施加的磁场成正比的电压和在X方向、Y 方向和Z方向上磁场的极性方向,而第二磁强计输出在第二位置处与施加的磁场成正比的电压和在X方向、Y方向和Z方向上磁场的极性方向,并且第三磁强计输出在第三位置处与施加的磁场成正比的电压和在X方向、Y方向和Z方向上磁场的极性方向。通过使用这三组磁强计,除了检测局部磁场波动之外还可以确定IMU的航向取向。每个磁强计使用磁场作为参比并确定与磁北的取向偏离。然而,局部磁场可以被铁或磁性材料扭曲,通常被称为硬或软铁扭曲。软铁扭曲的实例是具有低的磁导率的材料例如碳钢、不锈钢等。硬铁扭曲由永磁体引起。这些扭曲产生不均匀的场(参见图校准1-3),其影响用于处理磁强计输出和解析航向取向的算法的准确性。因此,正如在后文中更详细讨论的,利用校准算法来校准磁强计以恢复在检测到的磁场中的均匀性。每个IMU 1002可以由可更换或可充电储能装置供电,例如但不限于CR2032纽扣电池和200mAh可充电锂离子电池。
IMU 1002中集成的感应模块可以包括可配置的信号调制电路和模拟数字转换器(ADC),其为传感器产生数字输出。IMU 1002可以使用具有电压输出的传感器,其中可以是补偿放大器的信号调制电路被配置为将传感器输出调制到多通道24位模拟-数字转换器(ADC) (ADS 1258,Texas Instrument)的输入范围。IMU 1002还包括集成处理模块,其包括微控制器和无线传输模块(CC2541,Texas Instrument)。或者,IMU 1002可以使用单独的低功率微控制器(MSP430F2274,Texas Instrument)作为处理器和紧凑型无线传输模块(A2500R24A,Anaren) 用于通讯。所述处理器可以作为每个IMU 1002的一部分被集成,或与每个IMU分开但与其通讯连接。该处理器可以是兼容蓝牙的,并提供针对陀螺仪、加速计和磁强计的有线或无线通讯,以及提供处理器与信号接收器之间的有线或无线通讯。
每个IMU 1002被通讯连接到信号接收器,所述信号接收器使用预定的装置标识号处理从多个IMU接收到的数据。数据速率对于单一 IMU来说约为100Hz,并且在更多的IMU加入共享网络时减少。信号接收器的软件实时接收来自于IMU 1002的信号,并在接收到的IMU数据的基础上连续计算IMU的当前位置。具体来说,将从IMU输出的加速度测量值针对时间积分,以计算IMU在3个轴中的每个轴上的当前速度。将为每个轴计算的速度对时间积分,以计算当前位置。但是,为了获得有用的位置数据,必须建立参照构架,其包括校准每个IMU。
在将IMU 1002用于外科导航之前,按照前面在本文中讨论并因此通过参考并入此处的校准公开内容将IMU校准。此外,每个IMU处理器被编程,以利用带有von Mises-Fisher密度算法的序贯蒙特卡罗方法 (SMC),在来自于IMU的陀螺仪、加速计和磁强计的输入的基础上计算IMU 1002的位置变化。
如图179中所示,在校准后,可以将IMU 1002与所讨论的解剖结构配准。在本例中,将IMU配准到近端胫骨和远端股骨。为了将IMU 1002配准到近端胫骨,将第一IMU安装到近端胫骨定位工具,其具有仅在单一位置和取向上与一部分近端胫骨的外部匹配的内表面。一旦以该独特的位置和取向定位后,将近端胫骨定位工具安装到近端胫骨,在示例性形式中使用外科螺栓来进行。将第二IMU固定安装到旋转导航工具,其被放置在切开的近端胫骨顶上。当所述旋转导航工具被正确取向并旋转定位在患者的切开的近端胫骨上时,第二IMU1002相对于第一IMU的取向是已知的。操作人员向软件系统指明第一IMU处于其正确位置中,然后软件使用来自于两个IMU的输出来建立第二IMU 的位置。将第二IMU的这个位置与以前确定的外科计划进行比较,以确定旋转导航工具的取向和旋转对齐相对于所述外科计划是正确的。果真如此的话,利用旋转导航工具在近端胫骨中钻出一个或多个孔,用于晚些时候TKA的永久性胫骨组件的对齐。如果旋转对齐是错误的,软件和视觉显示器向外科医生提供反馈,以便于导航工具针对近端胫骨的正确外科导航。
在示例性形式中,软件程序为外科医生提供图形用户界面,其显示患者近端胫骨的虚拟模型和旋转导航工具的虚拟模型(患者胫骨的虚拟模型已按照虚拟模板制作步骤完成,并且对于可以利用的特定旋转导航工具来说,旋转导航工具的虚拟模型先前已被装载在系统中),并通过所述图形用户界面实时更新胫骨和旋转导航工具的取向,向外科医生提供位置和取向信息。不使用图形用户界面,本系统可以包括具有指示灯的外科装置,所述指示灯为外科医生指示旋转导航工具是否正确取向,并且如果未正确取向的话,需要将旋转导航工具重新定位到何种方向才能将所述导航工具正确定向成与手术前计划相一致。在旋转导航工具的取向和位置实现后,外科医生可以在股骨近端中钻出一个或多个孔,以准备植入TKA的近端胫骨组件。类似的旋转导航工具和一组IMU可以与类似的配准过程并与软件系统一起使用,以协助在TKA期间远端股骨组件的放置。
本领域技术人员熟悉常规的下颌骨接骨板,因此为简洁起见,省略了下颌骨接骨板的总体设计的详细讨论。本系统和方法所实现的与常规的系统和方法不同,是应对残骨和骨移植物两者的形状的患者特异性接骨板和放置引导器的形成。具体来说,对于(自动或手动)鉴定到的每个接骨板位置,系统设计虚拟3D接骨板和相关的放置引导器。将每个虚拟3D接骨板和引导器模型针对混成3D模型(包括在重建位置中的骨移植物和患者残骨)叠加,以确保每个虚拟3D接骨板和引导器模型的底面是下方骨骼的负形,无论所述下方骨骼是骨移植物还是残骨。通过这种方式,虚拟3D接骨板和引导器模型一起工作,以确保接骨板的正确放置和接骨板、骨移植物与残骨之间的相应啮合。用于将接骨板固定到骨移植物和残骨的示例性安装技术可以包括但不限于螺钉、榫钉和销针。为了容纳一个或多个这些安装技术或其他安装技术,每个虚拟3D接骨板和放置引导器包括一个或多个贯通孔。在每个虚拟3D接骨板和引导器的设计完成后,系统产生并输出快速原型机、CNC机或类似装置所必需的机器码以制造每个3D接骨板和引导器,随后制造真实的接骨板和引导器。
遵照上面的描述和发明概述,本领域普通技术人员应该显然看出,尽管本文中描述的方法和装置构成本发明的示例性实施方式,但本文包含的发明不限于仅仅这一个实施方式,并且可以对这些实施方式做出改变而不背离由权利要求书定义的本发明的范围。此外应该理解,本发明由权利要求书定义,并且不打算将描述本文中提出的示例性实施方式的任何限制或要素并入到任何权利要求书要素的解释之中,除非这样的限制或要素被明确陈述。同样地,应该理解,为了落于任何权利要求项的范围之内,不必满足本文公开的发明的任何或所有鉴定到的优点或目的,这是因为本发明由权利要求书定义,并且还因为可能存在本发明的固有和/或无法预见的优点,尽管它们可能尚未在本文中明确讨论。
- 骨骼重建和骨外科植入物
- 骨骼重建和骨外科植入物
