具有抗氧化活性的肽和包含其的组合物
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及具有抗氧化活性的生物相容性肽材料,特别是涉及具有自由基清除活性以及具有促进作为抗氧化剂转录因子的Nrf2的表达和促进作为抗氧化酶的SOD2的表达的功能的肽,以及包含该肽的组合物。
背景技术
通常,当细胞大量暴露于由生物过程和外部因素(例如污染物、有毒物质、紫外线、病原体的入侵)产生的内在因素(例如呼吸和体内能量代谢)引起的应激时,细胞会产生有害的氧,例如活性氧(ROS)或自由基。
正常细胞通过新陈代谢过程用抗氧化酶去除有害的氧。然而,连续或严重的应激导致有害氧在细胞中的积累,而不是将其去除,从而引起炎症反应或细胞损伤,进而引起各种疾病的发作。
此外,有害氧可能会导致细胞内的DNA损伤、蛋白质变性、酶失活等,并且脂质过氧化物扩散到细胞中或在血流中移动会促进新自由基的产生,从而促进动脉硬化、癌症、心肌梗塞、中风、心脏病、类风湿性关节炎、慢性神经退行性疾病,如肌萎缩性侧索硬化或帕金森氏病(PD)、糖尿病、肝炎、肾炎、特应性疾病、自身免疫性疾病、炎症反应、衰老以及各种组织中的类似现象(Alam,M.N等人,Saudi Pharm.J.2013;Curr.Opin.Neurol.,9(4):260-264,1996)。
此外,已知细胞中的这种应激是皱纹形成或与皮肤相关的疾病如特应性皮炎、痤疮或皮肤癌的主要原因,因为其破坏细胞、切割皮肤真皮层的结缔组织或引起交联。
为此,人体的抗氧化系统可以去除连续产生的自由基并治愈受损的细胞。例如,谷胱甘肽(GSH)结合了三个氨基酸(L-谷氨酸、L-半胱氨酸和L-甘氨酸)。谷胱甘肽是由谷氨酰胺半胱氨酸连接酶(GCL)和谷胱甘肽合成酶(GSS)合成的。已知谷胱甘肽通过利用抗氧化酶例如谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)、谷胱甘肽S-转移酶(GST)和醌氧化还原酶(NADPH:醌氧化还原酶1(NQO1))的活性反复进行氧化还原,从而表现出抗氧化功效或去除有毒物质。(Mates,JM等人,Clinical biochemistry.1999;Vrankovic,J.等人,Turkish Journal of Biology.2012)。
此外,抗氧化应激的主要体内生物防御机制是基于细胞中存在的Nrf2(核因子红系2相关因子2)-ARE(抗氧化反应元件)信号传导途径,而Nrf2-ARE信号传导途径则促进了谷胱甘肽和抗氧化酶的合成。Nrf2是一种转录因子,已知其在氧化应激的情况下通过合成抗氧化酶例如GPx、GR、GST、超氧化物歧化酶(SOD)、过氧化氢酶、NQO1和血红素加氧酶-1(HO-1)来去除活性氧,或通过调节合成谷胱甘肽抗氧化剂的酶例如GCL和GS的表达来增加细胞中谷胱甘肽的含量。结果,活性氧被去除或转化为非侵蚀性物质(Lee,J.M.等人,J.Biochem.Mol.Biol.2004)。
另外,Nrf2增加了细胞抵抗各种组织中自由基的能力。因此,当在各种组织中促进Nrf2的表达时,基于抗氧化可以期望获得细胞保护作用(Baird,L.等人,Arch.Toxicol.2011)。
有效维持人体抗氧化防御机制的最重要因素是使SOD酶的产生和反应速率正常化,SOD酶主要中和作为最强活性氧的超氧阴离子自由基。然而,随着年龄的增长,人体内SOD酶的产生和反应速率降低,因此食用补充其的食物很重要。在抗氧化酶中,SOD在细胞内抗氧化防御系统中起着重要的作用,它减少通常在细胞能量代谢过程中产生的自由基。在哺乳动物中,SOD2也称为“线粒体Mn-SOD”。
然而,人类的生物抗氧化系统的正常功能由于代谢综合征或成人疾病而逐渐丧失,这些代谢综合征或成人疾病是由各种因素引起的,包括环境应激,例如污染或紫外线辐射或生物应激、衰老和与衰老相关的疾病,例如退化性疾病、经济增长、饮食变化等。在这种情况下,需要施用抗氧化剂,即能够通过激活Nrf2电子因子而能够除去活性氧的物质,以便提供抗氧化剂以防止抗氧化系统发生故障。响应于抗氧化剂施用的这一要求,已经以各种方式做出了施用抗氧化剂或抗氧化食品和药物以由此预防或治疗上述疾病或延缓衰老的努力。迄今为止,尚未开发出能够满足这些要求的抗氧化剂。
在这种背景下,由于反复努力寻找具有抗氧化作用而不会引起任何副作用的食品成分,本发明人基于通过促进转录因子Nrf2的表达来去除活性氧的功能、通过促进抗氧化酶SOD2的表达去除活性氧的功能以及通过促进Nrf2和SOD2两者的表达去除活性氧的功能而鉴定出具有强抗氧化作用的肽。基于该发现,完成了本发明。
发明内容
技术问题
因此,为了解决上述问题而完成了本发明,并且本发明的一个目的是提供一种不具有自身免疫性、在生物恢复后无害地降解并且显示出优异的抗氧化活性从而提高自由基清除能力、促进Nrf2和SOD2的表达并增强抗氧化活性的肽。具有抗氧化活性的肽可以用作与对细胞的氧化损伤有关的疾病的治疗剂,其通过有效作用于生物组织或其细胞而具有抗氧化应激的抗氧化活性。
本发明的另一个目的是提供一种抗氧化组合物及其制备方法,该抗氧化组合物包含具有抗氧化活性并且具有由通式1或通式2表示的氨基酸序列的至少一种肽。
本发明的另一个目的是提供一种药物组合物或用于人类以外的动物的药物组合物,以预防、治疗或减轻对含有该肽作为活性成分的细胞的氧化损伤。
本发明的另一个目的是提供一种预防或治疗对细胞的氧化损伤的方法,包括对人或不同于人的动物口服施用该肽。
本发明的另一个目的是提供该肽在制备用于预防或治疗对细胞的氧化损伤的药物或兽药中的新用途。
技术方案
根据本发明的一个方面,上述和其他目的可以通过提供一种抗氧化组合物来实现,该抗氧化组合物包含具有抗氧化活性并且具有由通式1或通式2表示的氨基酸序列的肽:
[通式1]
γ-Glu-Xaa
[通式2]
γ-Glu-Xaa
其中
Xaa
Xaa
Xaa
所述肽可以包括选自以下的至少一种肽:γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-ASP、γ-GLU-GLU、γ-GLU-PHE、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-ORN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-ARG、γ-GLU-THR、γ-GLU-VAL、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-VAL-ol、γ-GLU-GLN-GLU、γ-GLU-GLU-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-GLN-GLN、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-GLY、γ-GLU-VAL-ALA、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-HIS、γ-GLU-VAL-LYS、γ-GLU-VAL-MET、γ-GLU-VAL-ASN、γ-GLU-VAL-ORN、γ-GLU-VAL-PRO、γ-GLU-VAL-ARG、γ-GLU-VAL-VAL、γ-GLU-CYS(S-Me)-GLY、γ-GLU-Abu-GLY和γ-GLU-LEU-GLY。
所述肽可以包括选自以下的至少一种二肽:γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-ASN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-THR、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR和γ-GLU-VAL-ol。
所述肽可以包括选自以下的至少一种二肽:γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-GLN、γ-GLU-TRP和γ-GLU-TYR。
所述肽可以包括选自以下的至少一种三肽:γ-GLU-GLN-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG。
所述肽可以包括选自以下的至少一种:γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-GLY、γ-GLU-ILE、γ-GLU-GLN、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-GLN-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG。
所述肽可以包括选自以下的至少一种:γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-GLN-GLU、γ-GLU-THR-GLY和γ-GLU-MAL-CYS。
根据本发明的另一方面,提供了一种用于制备抗氧化组合物的方法,该方法包括:
a)将酶添加到酵母悬浮液中并进行水解;和
b)从水解后获得的酵母水解物中回收分子量为500Da或小于500Da的肽级分。
步骤a)可以包括:a-1)添加相对于酵母悬浮液的固体含量为0.5重量%至1.5重量%的碱性内切蛋白酶(Alcalase),并进行初级水解3小时至5小时;
a-2)添加相对于初级水解产物的固体含量为0.5重量%至1.5重量%的复合风味蛋白酶(Flavourzyme),并进行二级水解5小时至15小时;和
a-3)添加相对于二级水解产物的固体含量为0.1重量%至0.5重量%的碱性内切蛋白酶和复合风味蛋白酶,并进行二级水解20小时至30小时。
根据本发明的另一方面,提供用于治疗对细胞的氧化损伤的药物组合物、食品组合物、饲料组合物和化妆品组合物,所述组合物包含选自通式1和通式2所示的氨基酸序列的至少一种肽作为活性成分。
自由基或活性氧(ROS)的产生可能导致细胞的氧化损伤。
根据本发明的另一方面,提供了选自以上由通式1和通式2表示的氨基酸序列的至少一种肽在制备用于预防或治疗对细胞的氧化损伤的药物中的用途。
根据本发明的另一方面,提供了一种治疗细胞的氧化损伤的方法,该方法包括对人或非人动物口服施用选自以上通式1和通式2所示的氨基酸序列的至少一种肽。
自由基或活性氧(ROS)的产生可能导致细胞的氧化损伤。
有益效果
本发明涉及具有优异的抗氧化活性的功能性肽,并且以具有优异的生物相容性和抗氧化活性的肽的形式提供,该肽显著优于常规GSH的肽,从而克服了现有技术低抗氧化活性的局限性。本发明的肽有效地促进由氧化应激引起的自由基引起的对生物组织或细胞的损伤的恢复,或促进抗氧化活性。因此,具有抗氧化活性的这种肽可通过有效地作用于由氧化应激引起的细胞损伤而用于预防和恢复细胞损伤。
附图说明
图1a是显示DPPH清除能力的图,图1b显示各酵母水解物(A4、AF10、AF24)的还原能力,其中对照是未经酶处理的酵母水解物,A2是用碱性内切蛋白酶裂解2小时的酵母水解物,A4是用碱性内切蛋白酶裂解4小时的酵母水解物,AF10是用碱性内切蛋白酶裂解4小时,然后用复合风味蛋白酶裂解10小时的酵母水解物,AF24是用碱性内切蛋白酶裂解4小时,然后用复合风味蛋白酶裂解10小时,再进一步用复合风味蛋白酶裂解24小时的酵母水解物。
图2a是表示清除DPPH的能力的图,图2b是表示各酵母水解物级分(制备例1至4)的还原能力的图,其中对照是未经酶处理的酵母水解物,10kDa或大于10kDa是制备例1的酵母水解物的级分,10kDa至5kDa是制备例2的酵母水解物的级分,5kDa至1kDa是制备例3的酵母水解物的级分,1kDa或小于1kDa是制备例4的酵母水解物的级分。
图3是示出了基于选自实验例2的1kDa或小于1kDa的酵母水解物的滤液的分子量分布而确定的根据分子量的二级级分(I、II和III)的图,其中使用高效液相色谱法(HPLC)筛选具有抗氧化活性的肽。
图4a至图4d是显示从酵母水解物中具有最佳抗氧化活性的二级级分II中鉴定出的代表性肽的MS/MS谱和预测结构的图,其中,A为γ-Glu-Cys-Gly(GSH),B为γ-Glu-Val-Gly,C为γ-Glu-Cys,D为γ-Glu-Val。
图5a至图5c是显示用于检测从酵母水解物鉴定的100种肽中的Nrf2mRNA表达水平的实时PCR结果的图。
图6是显示用于检测从酵母水解物中鉴定出的100种肽中的SOD2 mRNA表达水平的实时PCR结果的图。
最佳实施方式
在下文中,将详细描述本发明。
代表性氨基酸及其缩写如下:丙氨酸(Ala,A)、异亮氨酸(Ile,I)、亮氨酸(Leu,L)、蛋氨酸(Met,M)、苯丙氨酸(Phe,F)、脯氨酸(Pro,P)、色氨酸(Trp,W)、缬氨酸(Val,V)、天冬酰胺(Asn,N)、半胱氨酸(Cys,C)、谷氨酰胺(Gln,Q)、甘氨酸(Gly,G)、丝氨酸(Ser,S)、苏氨酸(Thr,T)、酪氨酸(Try,Y)、天冬氨酸(Asp,D)、谷氨酸(Glu,E)、精氨酸(Arg,R)、组氨酸(His,H)和赖氨酸(Lys,K)。
此外,经修饰的氨基酸及其缩写如下:缬氨酸酰胺(V-NH2)、缬氨醇(2-氨基-3-甲基-1-丁醇)(V-ol)、鸟氨酸(ORN)、蛋氨酸亚砜(M(O))、巯基的氢被甲基取代的半胱氨酸(C(S-Me))、巯基的氢被甲基取代且具有亚砜结构的半胱氨酸(S-Me)(O2)和2-氨基丁酸(Abu)。特别地,上式中的(O2)表示亚砜结构。
在本发明中,肽是指氨基酸残基之间通过肽键相互键合而形成的线性分子。
可以根据本领域已知的化学合成方法,特别是固相合成技术来制备本发明的肽(Merrifield,J.Amer.Chem.Soc.85:2149-54(1963);Stewart等人,Solid Phase PeptideSynthesis,2nd.ed.,Pierce Chem.Co.:Rockford,111(1984))。
如本文所用,术语“抗氧化活性”是指当由于环境应激或生物应激例如细胞内代谢或紫外线而暴露于氧化应激时,抑制由高反应性自由基或活性氧引起的细胞氧化的性质,包括去除自由基或活性氧以减少由此导致的对细胞的损害的性质。
如本文所用,术语“抗氧化组合物”是指相对于组合物的总重量,包含抗氧化肽的组合物的量为20重量%至50重量%,优选为30重量%至40重量%,该组合物还可以包含药学上可接受的载体、赋形剂或稀释剂,这对于本领域技术人员而言是显而易见的。
一方面,本发明涉及一种抗氧化组合物,其包含选自以下通式1和通式2所示的氨基酸序列的至少一种肽:
[通式1]
γ-Glu-Xaa
[通式2]
γ-Glu-Xaa
其中
Xaa
Xaa
Xaa
在本发明中,提供了通式以说明本发明的肽结构,并且对本领域技术人员而言显而易见的是,其修饰肽也落入本发明的范围内。
在一个实施方案中,本发明的肽的N末端或C末端可以被羟基(-OH)或氨基(-NH
通过一系列酶解步骤获得酵母水解物,通过初级和二级分离和纯化从酵母水解物中分离肽,然后比较肽之间的促进Nrf2和SOD2 mRNA表达的效果,从而获得根据本发明的具有抗氧化活性的肽。该肽具有比天然GSH肽更高的Nrf2-mRNA和SOD2-mRNA促进活性,尽管具有短序列(由2个至3个氨基酸残基组成),但仍显示出显著优异的抗氧化作用(清除DPPH的能力、还原能力、Nrf2-mRNA的表达促进能力和SOD2-mRNA的表达促进能力),因此可用于需要抗氧化活性的各个领域。
因此,根据本发明的具有抗氧化活性的肽可以以组合物的形式提供,该组合物用于除去活性氧并预防或治疗由氧化应激导致的自由基引起的对细胞、组织或器官的氧化损伤。另外,抗氧化组合物可以作为饲料、饲料添加剂或食品添加剂提供,其具有预防或治疗由活性氧引起的细胞损伤的作用。
通过将氨基酸残基顺序地结合至L-谷氨酸的γ链,根据本发明的具有由通式1或通式2表示的氨基酸序列的肽具有2个至3个氨基酸的短序列。
具体地,具有通式1或通式2表示的氨基酸序列的肽可以具有抗氧化活性并且包括选自以下的至少一种:γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-ASP、γ-GLU-GLU、γ-GLU-PHE、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-ORN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-ARG、γ-GLU-THR、γ-GLU-VAL、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-VAL-ol、γ-GLU-GLN-GLU、γ-GLU-ALA-GLY、γ-GLU-GLU-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-GLN-GLN、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-GLY、γ-GLU-VAL-ALA、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-HIS、γ-GLU-VAL-LYS、γ-GLU-VAL-MET、γ-GLU-VAL-ASN、γ-GLU-VAL-ORN、γ-GLU-VAL-PRO、γ-GLU-VAL-ARG、γ-GLU-VAL-VAL、γ-GLU-CYS(S-Me)-GLY、γ-GLU-Abu-GLY和γ-GLU-LEU-GLY。
在一个实施方案中,所述肽优选是通式1的肽,其中Xaa
具体地,通式1的肽可以包括选自以下的至少一种二肽:γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-ASN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-THR、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR和γ-GLU-VAL-ol,并且具有抗氧化作用以及促进Nrf2 mRNA和SOD2 mRNA表达的作用,并且尽管其序列比具有抗氧化作用的常规GSH短,但具有相当或更高的作用,因此在合成、制备和储存中仍然更加有用。
更优选地,所述肽是通式1的肽,其中Xaa
在一个实施方案中,在通式2的肽中,Xaa
在一个实施方案中,与GSH相比,具有显著提高的促进Nrf2和SOD2两者表达的效果的肽,更优选地,其特征在于通式1中的Xaa
最优选地,在通式1中,Xaa
具体地,所述肽可以包括选自以下的至少一种肽:γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-GLN-GLU、γ-GLU-THR-GLY和γ-GLU-VAL-CYS。该肽具有抗氧化作用(还原能力、清除DPPH的能力和Nrf2mRNA的活性),以及将Nrf2 mRNA和SOD2 mRNA的表达水平提高至与阳性对照GSH相比的约2倍至3倍的作用。
同时,γ-GLU-HIS具有将Nrf2和SOD2 mRNA表达水平提高至与GSH相比的2倍到8倍的显著效果。
本发明的抗氧化组合物可以用作药物组合物、保健食品组合物、饲料、饲料添加剂、化妆品组合物或用于人类以外的动物的药物组合物。
如本文所用,术语“抗氧化活性”是指抑制由于暴露于细胞内新陈代谢引起的环境应激或生物应激或由于外部因素(例如紫外线)引起的氧化应激而引起的高反应性自由基或活性氧引起的细胞氧化的特性,包括清除自由基或活性氧的活性,以减少由此对细胞造成的损害。通过体外实验证实了与之相关的作用。
抗氧化组合物是相对于组合物的总重量,组合物包含抗氧化肽的量为20重量%至50重量%,优选为30重量%至40重量%,该组合物还可以包含药学上可接受的载体、赋形剂或稀释剂,这对于本领域技术人员而言是显而易见的。
在另一方面,本发明涉及一种用于制备包含肽级分的抗氧化组合物的方法,该方法包括:
a)将酶添加到酵母悬浮液中并进行水解;和
b)从水解后获得的酵母水解物中回收分子量为500Da或小于500Da的肽级分。
步骤a)优选包括:a-1)添加相对于酵母悬浮液的固体含量为0.5重量%至1.5重量%的碱性内切蛋白酶,并进行初级水解3小时至5小时;
a-2)添加相对于初级水解产物的固体含量为0.5重量%至1.5重量%的复合风味蛋白酶,并进行二级水解5小时至15小时;和
a-3)添加相对于二级水解产物的固体含量为0.1重量%至0.5重量%的碱性内切蛋白酶和复合风味蛋白酶,并进行二级水解20小时至30小时。当通过上述方法制备酵母水解物时,可以获得包含大量具有优异的抗氧化作用的肽级分。
水解优选在40℃至70℃的温度下进行。当在低于40℃的温度下进行水解时,水解不能很好地进行,并且不能充分诱导抵抗物理应激的抗氧化剂代谢物的分泌,因此不能获得足够的肽。当温度范围超过70℃时,可能发生细胞凋亡的问题。
水解过程中的pH优选为6至7。
在步骤b)中,具体地,将水解后获得的酵母水解物基于分子量分级,以回收分子量为500Da或小于500Da的肽级分。
该方法还可以包括,在步骤(b)之前,从酵母水解物中除去残余物,并且可以通过已知的从混合物中除去固体的方法,例如离心和过滤,进行残余物的除去。优选地,该方法是离心。
在步骤(b)之前,本发明的方法还可以包括使酵母水解物中所含的酶失活。失活是在除去残留物之前和/或之后进行的,并且优选在步骤(b)之前通过使酵母水解物中所含的酶失活,通过离心除去残留物并分离上清液来进行。失活优选通过热处理进行,并且可以通过将水解产物在100℃至120℃的温度下保持10分钟至30分钟来进行。
在步骤(b)中,得到分子量为500Da或小于500Da的肽级分,并且可以通过基于分子量的物质分离的已知方法,例如透析、电泳、各种柱色谱法等来获得该级分。去除不需要的物质的色谱法可以是离子交换色谱法、凝胶渗透色谱法、HPLC、反相HPLC、亲和柱色谱法、超滤或其组合。优选地,获得本发明的级分的方法可以是通过使用透析膜通过透析除去落在目标分子量范围之外的物质的方法来进行的。
所得级分的分子量为1000Da或小于1000Da,优选分子量为100Da至700Da。更优选地,级分的分子量可以为500Da或小于500Da。
另外,相对于所得级分的总重量,具有抗氧化活性的肽可以以70重量%至85重量%的量存在。
在另一方面,本发明涉及用于治疗对细胞的氧化损伤的药物组合物,所述药物组合物含有选自以上由通式1和通式2表示的氨基酸序列的至少一种肽作为活性成分。
在另一方面,本发明涉及药物组合物或用于施用至不同于人的动物以预防、治疗或减轻对细胞的氧化损伤的药物组合物,所述药物组合物含有选自以上由通式1和通式2表示的氨基酸序列的至少一种肽作为活性成分。
在另一方面,本发明涉及一种预防或治疗对细胞的氧化损伤的方法,该方法包括对人或不同于人的动物口服施用选自以上通式1和通式2所示的氨基酸序列的至少一种肽。
在另一方面,本发明涉及选自以上由通式1和通式2表示的氨基酸序列的至少一种肽在制备用于预防或治疗对细胞的氧化损伤的药物或兽药中的新用途。
如本文所用,术语“对细胞的氧化性损伤”是指由于暴露于环境应激或细胞内代谢引起的生物应激或由于外部因素例如紫外线引起的氧化应激而产生的高反应性自由基或活性氧导致的细胞损伤。
如本文所用,术语“含有作为活性成分”是指含有足以实现改善、治疗或预防对细胞的氧化损伤的功效或活性的量的本发明的肽。
如本文所用,术语“预防”可以表示通过将根据本发明的组合物施用于对象来抑制或延迟对细胞的氧化损伤的发作的任何作用。如本文所用,术语“治疗”可以表示通过对怀疑遭受细胞氧化损伤的对象施用根据本发明的组合物来改善或减轻由细胞氧化损伤导致的症状的任何作用。
通过本发明可以预防或治疗的由对细胞的氧化性损伤引起的疾病的类型不受限制,并且优选是与对细胞的损伤有关的疾病,对细胞的损伤是由内部或外部因素如细胞内代谢或外部因素如紫外线引起的,由于暴露于氧化应激时产生的高反应性自由基或活性氧而引起的。
与对细胞的氧化损伤有关的疾病包括选自以下的至少一种:多发性硬化症的神经退行性疾病、阿尔茨海默氏病、帕金森氏病、肌萎缩性侧索硬化症和肌营养不良症;眼部疾病,例如视网膜病变、黄斑变性和白内障;缺血性疾病,例如心肌梗塞和脑梗塞;选自关节炎、血管炎、肾小球肾炎和红斑狼疮的炎性疾病;和动脉粥样硬化。
在本发明中,发现选自上述通式1和通式2表示的氨基酸序列中的至少一种肽促进并提高Nrf2 mRNA和SOD2 mRNA的表达,这是针对通过tBHP(直接作用的氧化应激诱导剂)处理而遭受氧化应激的细胞的抗氧化防御机制。另外,该肽可以通过tBHP还原,显著增加细胞存活力。即,发现添加的本发明的药物组合物增加了抗氧化剂的酶活性,这表明该药物组合物诱导抗氧化剂基本上是酶的表达,从而能够进行细胞适应。
选自通式1和通式2表示的氨基酸序列的至少一种肽具有增加细胞抗氧化活性、抑制由于内部或外部因素引起的氧化应激引起的细胞损伤并且在施用剂量下无细胞毒性和稳定的显著优点。
除作为活性成分的肽外,“药物”、“用于动物的药物组合物(兽药组合物)”或“用于动物的药物(兽药)”还可以包含通常用于制备药物组合物的合适的添加剂、载体、赋形剂或稀释剂。基于组合物的总重量,根据本发明的药学上可接受的添加剂、载体、赋形剂或稀释剂可以以0.1重量份至90重量份的量存在,但不限于此。
可用于本发明的添加剂可以是淀粉、糊化淀粉、微晶纤维素、聚维酮、胶体二氧化硅、磷酸氢钙、乳糖、甘露醇、乳脂糖、阿拉伯胶、预胶化淀粉、玉米淀粉、粉末纤维素、羟丙基纤维素、opary、淀粉羟乙酸钠、巴西棕榈蜡、合成硅酸铝、硬脂酸、硬脂酸镁、硬脂酸铝、硬脂酸钙、白糖、葡萄糖、山梨糖醇、滑石粉等。
术语“载体”是指有助于将化合物递送到细胞或组织中的化合物。术语“稀释剂”是指稳定目标化合物的生物活性状态并在水中溶解以稀释该化合物的化合物。
载体、赋形剂或稀释剂没有特别限制,可以是例如乳糖、葡萄糖、糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、甲基羟基苯甲酸酯、丙基羟基苯甲酸酯、滑石粉、硬脂酸镁、矿物油等。
药物、兽药组合物或兽药的用量可能因患者或需要治疗的动物的年龄、性别和体重而异,并且将会因需要治疗的对象的状况、要治疗的疾病的特定种类或类型、施用途径和所用治疗剂的性质而不同。
在实际临床施用中,本发明的药物组合物可以以各种口服和肠胃外制剂中的任何一种施用。可以使用稀释剂或赋形剂例如填充剂、增量剂、黏合剂、润湿剂、崩解剂和表面活性剂来制备制剂。用于口服的固体制剂可以包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,并且可以通过将肽与至少一种赋形剂例如淀粉、碳酸钙、蔗糖、乳糖或明胶混合来制备。除了简单的赋形剂外,还可以使用润滑剂,例如硬脂酸镁和滑石粉。用于口服施用的液体制剂包括混悬剂、口服液和溶液、乳剂、糖浆剂等。除了通常使用的简单稀释剂水和液体石蜡外,液体制剂还可以包含各种赋形剂,例如润湿剂、甜味剂、香料和防腐剂。肠胃外施用的制剂可以包括无菌水溶液剂、非水溶剂、混悬剂、乳剂、冻干制剂和栓剂。作为非水溶剂和混悬剂,可以使用丙二醇、聚乙二醇、植物油如橄榄油和可注射酯如油酸乙酯。作为栓剂的基质,可以使用Witepsol、聚乙二醇、吐温61、可可脂、月桂酸酯、甘油明胶等。
本发明的药物组合物可以根据所需方法口服或胃肠外施用,肠胃外施用优选皮肤外用、腹膜内注射、直肠注射、皮下注射、静脉内注射、肌肉内注射或胸腔内注射。
本发明药物组合物的剂量根据患者的体重、年龄、性别、健康状况、饮食、施用时间、施用方法、排泄率和疾病严重程度而变化,基于本发明的肽的量,每日剂量是0.0001mg/kg至100mg/kg,优选0.001mg/kg至10mg/kg,并且药物组合物可以每天施用1次至6次。
本发明的药物组合物可以单独使用或与外科手术、放射疗法、激素疗法、化学疗法和使用生物反应调节剂的方法结合使用。
施用本发明药物组合物的方法没有特别限制,并且可以是任何侵入性或非侵入性施用方法,包括口服施用、注射等,并且可以是栓剂施用或透皮施用。活性成分可以常规药物制剂的形式与适合于诸如口服施用和注射之类的施用方法的固体或液体药物载体一起施用。这种制剂的实例包括固体制剂,例如片剂、颗粒剂、散剂和胶囊剂;液体制剂,例如溶液剂、混悬剂和乳剂;以及冻干制剂。这些制剂可以通过常规的制剂方法来制备。另外,本发明的药物组合物可以任选地包含任何药学上或生理学上可接受的固体或液体载体、添加剂等。
载体的实例包括葡萄糖、乳糖、蔗糖、淀粉、甘露醇、糊精、脂肪酸甘油酯、聚乙二醇、羟乙基淀粉、乙二醇、聚氧乙烯脱水山梨糖醇脂肪酸酯、明胶、白蛋白、氨基酸、水、生理盐水等。此外,如果需要,可以将常规的添加剂例如稳定剂、润湿剂、乳化剂、黏合剂和等渗剂适当地添加到本发明的药物组合物中。
治疗方法包括对人或除人类以外的动物,特别是哺乳动物口服或肠胃外施用组合物,例如,将组合物口服施用至需要治疗的对象,其中细胞损伤是由内部或外部氧化应激引起的,或其中细胞损伤是由其他因素引起的。
可以参考药物组合物、药物、兽药组合物或兽药的剂量、施用方法和施用次数来确定治疗的剂量、施用方法和施用。
在另一方面,本发明涉及抗氧化食品组合物,其包含选自以上由通式1和通式2表示的氨基酸序列的至少一种肽作为活性成分。
可以使用该肽以胶囊、片剂、粉末、颗粒、液体、丸、薄片、糊剂、糖浆、凝胶、果冻或棒的制剂形式制备食品组合物。或者,可以通过将食品组合物添加到饮料、茶、香料、口香糖、糖果等的食物材料中来制备通常的食品。食品在食用时对健康有特定影响,但与一般药物不同,由于使用食品作为原料,因而没有长期服用药物时可能发生的副作用,这是有优势的。
该食品组合物非常有用,因为它可以每天食用。尽管不能相对于目标食品的类型一致地定义肽的量,但是可以添加到这种食品组合物中的肽的量通常为目标食品的0.01重量%至50重量%,优选为0.1重量%至20重量%,而不会改变食物的原始味道。另外,以胶囊、片剂、粉末、颗粒、液体、丸、薄片、糊剂、糖浆、凝胶、果冻或棒的形式提供的食品通常以0.1重量%至100重量%、优选地0.5重量%至80重量%的量添加。
该食品组合物可以包含以上由通式1或通式2表示的至少一种肽作为活性成分,以及通常用于食物生产的成分,例如蛋白质、碳水化合物、脂肪、营养物、调味料和调味剂。碳水化合物的实例包括:单糖,例如葡萄糖和果糖;二糖,如麦芽糖、蔗糖和寡糖;多糖,例如普通糖,例如糊精和环糊精,以及糖醇,例如木糖醇、山梨糖醇和赤藓糖醇。
作为调味剂,可以使用天然调味剂(甜蛋白、甜叶菊提取物(例如莱鲍迪甙A和甘草甜素)和合成调味剂(例如糖精和阿斯巴甜)。例如,当以饮料和饮品形式生产本发明的食品组合物时,除本发明的肽外,它还可以包含柠檬酸、液体果糖、糖、葡萄糖、乙酸、苹果酸、果汁、各种植物提取物等。
本发明的食品组合物包括人类食品、饮料以及动物饲料和饲料添加剂。
此外,在含有通过本发明获得的通式1或通式2表示的至少一种肽作为活性成分的动物饲料添加剂中,该肽包括多糖,并且以粉末形式生产,以生产动物饲料添加剂,动物饲料添加剂额外添加到动物饲料中。此时,动物饲料可以选自动物饲料粉、小牛代乳粉和仔猪饲料,相对于1kg饲料,基于干重的肽含量为1g至2g(约0.1%)。
本发明的食品和保健食品组合物可以单独或与其他食品或食品成分组合地包含本发明的肽,并且可以根据常规方法适当地使用。
在另一方面,本发明涉及抗氧化化妆品组合物,其包含选自通式1和通式2所示的氨基酸序列的至少一种肽作为活性成分。
抗氧化化妆品组合物的制剂可以选自皮肤外用药膏、乳膏、柔软乳液、滋养乳液、包装、香精、生发水、洗发水、冲洗剂、护发素、焗油膏、凝胶、护肤乳液、皮肤柔软剂、皮肤爽肤水、化妆水、乳液、牛奶乳液、水乳液、营养乳液、按摩霜、营养霜、眼霜、保湿霜、护手霜、面膜、粉底、营养精华、防晒霜、肥皂、清洁泡沫、清洁乳、清洁霜、润肤露和身体清洁剂,但不限于此。每种制剂的组合物可以包含制备制剂所必需和适当的各种基质和添加剂,并且本领域技术人员可以容易地选择这些组分的类型和量。
当本发明的制剂是糊剂、乳膏或凝胶剂时,可以使用动物纤维、植物纤维、蜡、石蜡、淀粉、黄芪胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、二氧化硅、滑石粉或锌酸作为载体成分。
当本发明的制剂是粉末或喷雾剂时,乳糖、滑石粉、二氧化硅、氢氧化铝、硅酸钙或聚酰胺粉末可用作载体组分。特别地,当制剂为喷雾剂形式时,还可以包含推进剂,例如氯氟烃、丙烷/丁烷或二甲醚。
当本发明的制剂是溶液或乳液、溶剂、溶解剂或乳化剂时,诸如水、乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇油、甘油脂族酯、聚乙二醇或脱水山梨糖醇的脂肪酸酯等用作载体组分。
当本发明的制剂为混悬剂时,液体稀释剂例如水、乙醇或丙二醇,悬浮剂如乙氧基化异硬脂醇、聚氧乙烯山梨醇酯和聚氧乙烯山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂、黄芪胶等可以用作载体组分。
当本发明的制剂为含表面活性剂的清洁剂的形式时,脂族醇硫酸盐、脂族醇醚硫酸盐、磺基琥珀酸单酯、羟乙磺酸盐、咪唑啉
具体实施方式
在下文中,将参考优选实施例更详细地描述本发明。然而,对于本领域技术人员显而易见的是,提供以下实施例仅用于举例说明本发明,而不应解释为限制本发明的范围。
1、酵母水解物的制备
将酵母(酿酒酵母)细胞的pH值调节至7.0,并加热至60℃,并添加相对于固体含量为1%的量的内肽酶(碱性内切蛋白酶),然后酶解2小时或4小时(“A2”或“A4”样品)。与固体含量相比,向用碱性内切蛋白酶裂解的样品(A4)中添加1%的外肽酶(复合风味蛋白酶)后,进行酶解10小时(“AF10”样品)。总共裂解10小时后,在55℃下向其中加入相对于固体含量的0.125%的碱性内切蛋白酶和复合风味蛋白酶,随后进行酶解24小时(“AF24”样品)。将裂解的上清液在85℃下灭活30分钟,并且通过超滤过程分离分子量小于10kDa的肽。本文所用的碱性内切蛋白酶和复合风味蛋白酶购自Novozymes。
测量每种酵母水解物(A4、AF10、AF24)的抗氧化功效(DPPH)和还原能力。
2、DPPH(2,2-二苯基-1-苦基-酰肼基-水合物)测定方法
使用Choi Chang-seop等人(2003)和Shekhar等人(2014)的方法测量了由于酵母水解物的DPPH清除能力而产生的抗氧化活性。将溶解于蒸馏水中的20μl样品(1μg/ml至5000μg/ml)添加到180μl含DPPH(0.111mM)的乙醇溶液中。使所得混合物在25℃下反应30分钟,并在517nm处测量吸光度。用抗坏血酸绘制标准曲线,计算DPPH清除能力(%),并用[((不加样品时的吸光度-样品的吸光度)/不加样品的吸光度]×100来表示。
3、还原能力测定法
酵母水解物的还原能力是使用Oyaizu(1986)的方法测量的。具体地,将溶解在蒸馏水中的样品(1μg/ml至5000μg/ml,60μl)与磷酸盐缓冲液(150μl,0.2M,pH 6.6)和铁氰化钾(K
4、结论
图1a是显示DPPH清除能力的图,图1b显示各酵母水解物(A4、AF10和AF24)的还原能力(b),其中对照是未经酶处理的酵母水解物,A2是用碱性内切蛋白酶裂解2小时的酵母水解物,A4是用碱性内切蛋白酶裂解4小时的酵母水解物,AF10是用碱性内切蛋白酶裂解4小时,然后用复合风味蛋白酶裂解10小时的酵母水解物,AF24是用碱性内切蛋白酶裂解4小时,然后用复合风味蛋白酶裂解10小时,再进一步用复合风味蛋白酶裂解24小时的酵母水解物。
如图1a和1b所示,发现依次用碱性内切蛋白酶和复合风味蛋白酶处理并在多个阶段裂解的AF24样品表现出最佳的DPPH清除能力和还原能力。即,可以看出,相同的酵母水解物的DPPH清除能力(图1a)和还原能力(图1b)可以根据酶和时间而不同。因此,在本发明中,AF24样品用于筛选具有抗氧化作用的肽。
为了从AF24样品中分离和选择具有优异抗氧化活性、在酵母水解物中具有最佳抗氧化活性的肽,从AF24酵母水解物基于其分子量(大小)制备级分,并测量和比较其氧化效力(DPPH)和还原能力。
1、酵母水解物级分的制备
具体地,将AF24酵母水解物通过尺寸为10kDa、5kDa和1kDa的超滤膜过滤,在105℃下从各级分的滤液中除去水分48小时,测定干重,得到下表1所示的含量。从表1可以看出,酵母水解物的大部分级分是大小为1kDa或小于1kDa的物质。
表1
2、基于分子量(大小)的酵母水解物级分的抗氧化活性实验
使用与实验例1中测量DPPH清除能力和还原能力的相同方法,测量各酵母水解物的级分的DPPH清除能力和还原能力(制备例1至4)。
图2a是表示清除DPPH的能力的图,图2b是表示各酵母水解物级分(制备例1至4)的还原能力(b)的图,其中对照是未经酶处理的酵母水解物,10kDa或大于10kDa是制备例1的酵母水解物的级分,10kDa至5kDa是制备例2的酵母水解物的级分,5kDa至1kDa是制备例3的酵母水解物的级分,1kDa或小于1kDa是制备例4的酵母水解物的级分。
从图2a和图2b可以看出,5kDa或小于5kDa的级分显示出6%或大于6%的DPPH清除能力,1kDa或小于1kDa的级分(制备例4)显示出最高的抗氧化活性,特别是高出3倍至8倍的抗氧化活性。可以看出,类似于DPPH清除能力,1kDa或小于1kDa的级分(制备例4)也表现出显著优异的还原能力(抗氧化活性),特别是高出4倍或大于4倍的还原能力(抗氧化活性)。因此,在本发明中,选择1kDa或小于1kDa的酵母水解物滤液来筛选具有抗氧化作用的肽。
将1kDa或小于1kDa的酵母水解物滤液根据分子量进行二次分离后,测量抗氧化活性以选择最终样品以筛选具有抗氧化活性的肽。
1、HPLC分析
测定在实验例2中选择的1kDa或小于1kDa的酵母水解物滤液的分子量分布,并基于该分子量分布进行二次分离。为此,使用高效液相色谱(HPLC,Agilent 1200系列)和GPC方法系统软件检测1kDa或小于1kDa的酵母水解物滤液的分子量分布。其HPLC条件示于下表2中。
具体地,在将10μl的1kDa或小于1kDa的酵母水解物滤液注入Agilent PLaquagel-OH 20柱中之后,以每分钟1ml的流速进行HPCL共20分钟。这里使用的流动相是水、乙腈和三氟乙酸的比例为50∶50∶0.1的混合物,并且在220nm的波长下检测到了样品。
表2
2、结论
图3是示出基于实验例2中选择的1kDa或小于1kDa的酵母水解物滤液的分子量分布根据分子量而获得的二级级分(I、II和III)的图,其中使用高效液相色谱法(HPLC)进行检测以筛选具有抗氧化活性的肽。
如图3所示,实验例2中选择的1kDa或小于1kDa的酵母水解物滤液的总分子量为1kDa(1000道尔顿)或小于1kDa。发现酵母水解物滤液中含有15.1%的分子量为500道尔顿或大于500道尔顿的肽(二级组分I)、81.9%的分子量为500道尔顿或小于500道尔顿的肽(二级组分II)和3.0%的氨基酸(二级组分III)。因此,最终选择具有最大抗氧化活性的二级级分II来筛选具有抗氧化活性的肽,并从二级级分II中鉴定出肽。
实验例4:从二级级分II中鉴定出100种具有抗氧化活性的肽
为了从最终选择的二级级分II中筛选抗氧化功能性肽,鉴定了存在于二级级分II中的肽,并在它们之间进行了抗氧化活性的比较。
1、肽鉴定
使用质谱仪LC MS/MS系统(Waters,USA)分析肽的氨基酸序列,其条件和方法示于下表3中。
具体而言,将5μl最终选择的二级级分II注入LC MS/MS系统,并使用BEH C4色谱柱进行分离。以0.2ml/min的流速注入作为流动相的100%溶剂A1分钟,然后在9分钟内将溶剂A从100%调整为99%。然后,在0.5分钟内将溶剂A从99%减少至0%,并且在最后4.5分钟内再次将溶剂A调节至100%。使用电喷雾电离以正模式在50m/z到1200m/z的范围内进行质谱分析。其工作系数如下:离子源温度:120℃;离子源温度:120℃;去溶剂温度:400℃;使用MassLynx 4.1软件(Waters,USA)进行样品分析。
表3
2、结论
图4a至图4d是显示从酵母水解物中具有最佳抗氧化活性的二级级分II中鉴定出的代表性肽的MS/MS谱和预测结构的图,其中,A为γ-Glu-Cys-Gly(GSH),B为γ-Glu-Val-Gly,C为γ-Glu-Cys,D为γ-Glu-Val。
如图4a至4d所示,结果表明,从酵母水解物中获得的具有最佳抗氧化活性的二级级分II中鉴定出总共100种肽。
1、100种肽的合成
使用固相合成技术制备鉴定出的100种肽,并使用LC-MS/MS质谱仪系统(Waters,USA)进行分析。然后,为了准确地确定每个合成的肽是否具有与每个鉴定和设计的肽相同的结构,基于肽指示剂材料的单同位素值(1.0ppm或小于1.0ppm),以XIC模式提取分子量,发现在MS/MS相上对应的两个或多于两个产物离子。所有样品和指示剂均以全扫描和阳性模式进行测量。
2、100种肽的抗氧化活性(Nrf2 mRNA表达水平)分析
在本发明中,比较了100种肽之间的抗氧化活性,并通过PCR测量了Nrf2mRNA表达的变化,以选择最终的肽。
(1)细胞培养和100种肽的处理
将HEK293细胞(肾脏细胞)系以6.6×10
(2)RNA提取
使用TRIzol(Thermo Fisher Scientific)从(1)中用100种肽处理过的细胞中提取RNA。使用GoScript
(3)cDNA的合成与PCR
使用Maxime
表4
3、结论
图5a至图5c是显示用于检测从酵母水解物鉴定的100种肽中的Nrf2mRNA表达水平的实时PCR结果的图。图5a至5c显示了对照,仅用tBHP(直接作用的氧化应激诱导剂)作为阴性对照的处理,用tBHP然后GSH肽作为阳性对照的处理以及与之相对应的100种肽的名称(参见表5和表6)。
鉴定了实验例4中获得的总共100种肽。比较肽之间的Nrf2 mRNA表达量。结果,总共选择了具有增加的Nrf2 mRNA量的48个肽,定量测量了其Nrf2 mRNA表达水平,结果显示在图5a至5c中,并且48种选择的肽和剩余的未选择的肽的化学式和结构式在下表5和表6中显示。表5显示了48种选择的肽的序列。表6显示了未选择的肽的序列。
表5
表6
在表6中,α-GLU是谷氨酸,β-GLU是β-谷氨酸,Nle是正亮氨酸,Nva是正缬氨酸,tL或tLEU是叔亮氨酸,βA或βALA是β-丙氨酸。另外,由γ-GLU表示的序列是指氨基酸残基顺序地键合到L-谷氨酸的γ链上。
即,从酵母水解物中鉴定出总共100种肽,但是检测到总共48种具有促进Nrf2mRNA表达的抗氧化活性的肽。
用tBHP作为氧化剂处理的正常细胞的生长受到氧化应激的抑制。当用具有抗氧化作用的肽处理经tBHP处理的细胞时,由tBHP引起的细胞的氧化和生长抑制降低。
如图5a至图5c所示,48种肽(γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-ASP、γ-GLU-GLU、γ-GLU-PHE、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-ORN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-ARG、γ-GLU-THR、γ-GLU-VAL、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-VAL-ol、γ-GLU-GLN-GLU、γ-GLU-ALA-GLY、γ-GLU-GLU-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-GLN-GLN、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-GLY、γ-GLU-VAL-ALA、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-HIS、γ-GLU-VAL-LYS、γ-GLU-VAL-MET、γ-GLU-VAL-ASN、γ-GLU-VAL-ORN、γ-GLU-VAL-PRO、γ-GLU-VAL-ARG、γ-GLU-VAL-VAL、γ-GLU-CYS(S-Me)-GLY、γ-GLU-Abu-GLY和γ-GLU-LEU-GLY)可提高Nrf2 mRNA的表达。
另外,在48种肽中,具有提高Nrf2 mRNA表达以使其与阳性对照GSH相当或更好的二肽被鉴定为γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-ASP、γ-GLU-GLU、γ-GLU-PHE、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-ASN、γ-GLU-ORN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-ARG、γ-GLU-THR、γ-GLU-VAL、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR和γ-GLU-VAL-ol,尽管序列比GSH短,但仍显示出与GSH相当或更好的效果。
另外,在48种肽中,鉴定出与阳性对照GSH相比具有显著提高的Nrf2mRNA表达效果的三肽为γ-GLU-GLN-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG。更优选地,可以看出,与阳性对照GSH相比,相同浓度的γ-GLU-CYS(S-Me)(O2)或γ-GLU-HIS使Nrf2 mRNA的表达水平提高为四倍或大于四倍(Nrf2 mRNA的表达恢复到正常水平)。特别地,与γ-GLU-HIS相比,α-GLU-HIS和β-GLU-HIS没有作用。
确定了SOD2 mRNA作为另一种抗氧化因子的表达。以与上述实验例5相同的方式进行细胞系培养、RNA提取、cDNA合成和PCR实验。下面给出其详细描述。
1、实验例5中100种肽的抗氧化活性(SOD2 mRNA表达水平)分析
(1)细胞培养和100种肽的处理
将HEK293细胞(肾脏细胞)系以6.6×10
(2)RNA提取
使用TRIzol(Thermo Fisher Scientific)从(1)中用100种肽处理过的细胞中提取RNA。使用GoScript
(3)cDNA的合成与PCR
使用Maxime
表7
2、结论
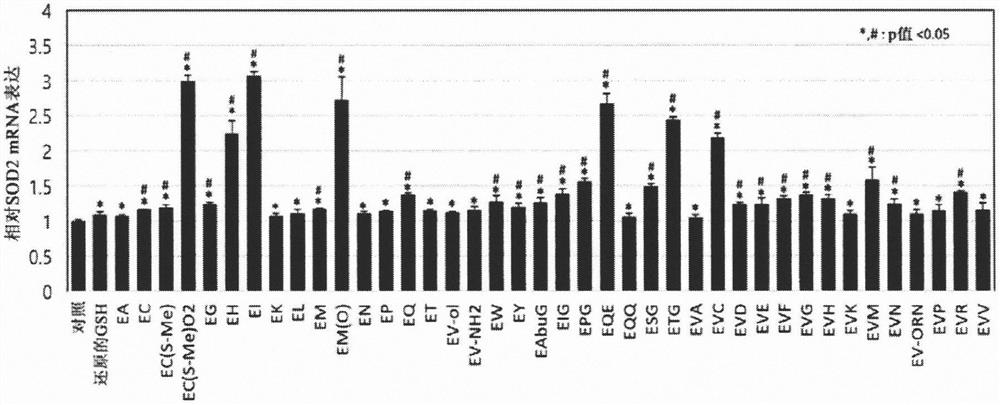
图6是显示用于检测从酵母水解物中鉴定出的100种肽中的SOD2 mRNA表达水平的实时PCR结果的图。图6显示了对照和先用tBHP再用GSH肽作为阳性对照的处理,48种肽的名称见表5。
如图6所示,测定了氧化应激诱导的相对SOD2 mRNA表达,并比较了各肽之间的抗氧化功效。对从酵母水解物中获得的总共100种肽进行了RT-PCR。结果确定以下39种肽具有增加的SOD2 mRNA表达:γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-GLN-GLU、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN、γ-GLU-VAL-ARG、γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-GLY、γ-GLU-ILE、γ-GLU-LYS、γ-GLU-LEU、γ-GLU-MET、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-THR、γ-GLU-VAL-NH2、γ-GLU-VAL-ol、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-Abu-GLY、γ-GLU-GLN-GLN、γ-GLU-VAL-ALA、γ-GLU-VAL-GLY、γ-GLU-VAL-HIS、γ-GLU-VAL-LYS、γ-GLU-VAL-ORN、γ-GLU-VAL-PRO和γ-GLU-VAL-VAL。除39种肽外,其他肽几乎没有增加SOD2 mRNA表达的作用。
对39种肽中SOD2 mRNA表达进行定量分析的结果是,确定具有与阳性对照GSH相当或更高的SOD2 mRNA表达水平的二肽为γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LYS、γ-GLU-LEU、γ-GLU-MET、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-THR、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR和γ-GLU-VAL-ol,尽管其序列比GSH短,但其表现出与GSH相当或更好的效果。
另外,与阳性对照GSH相比,具有显著优异的SOD2 mRNA表达的三肽被鉴定为γ-GLU-GLN-GLU、γ-GLU-Abu-GLY、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-GLY、γ-GLU-VAL-HIS、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG。
优选地,γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-MET(O)、γ-GLU-GLN-GLU、γ-GLU-THR-GLY和γ-GLU-VAL-CYS表现出将SOD2mRNA表达增加至正常水平的约2倍至3倍的显著更高的效果(SOD2 mRNA表达比正常水平(对照)高得多)。
总之,测试结果证明,将酵母(Saccharomyces cerevisiae)细胞加热至60℃并用碱性内切蛋白酶处理4小时以进行细胞裂解,向其中添加复合风味蛋白酶进行酶解10小时,并向其中添加碱性内切蛋白酶和复合风味蛋白酶进行酶解24小时,并收集上清液以制备酵母水解物。首先,通过超滤膜将分子量为1kDa或小于1kDa的级分从如此制备的酵母水解物中分离出来,然后,通过HPLC从其中分离出分子量([M+H]
对100种肽的抗氧化活性(Nrf2,SOD2 mRNA)进行分析的结果表明,共有48种肽(γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-ASP、γ-GLU-GLU、γ-GLU-PHE、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-MET(O)、γ-GLU-ASN、γ-GLU-ORN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-ARG、γ-GLU-THR、γ-GLU-VAL、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-VAL-ol、γ-GLU-GLN-GLU、γ-GLU-ALA-GLY、γ-GLU-GLU-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-GLN-GLN、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-GLY、γ-GLU-VAL-ALA、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-HIS、γ-GLU-VAL-LYS、γ-GLU-VAL-MET、γ-GLU-VAL-ASN、γ-GLU-VAL-ORN、γ-GLU-VAL-PRO、γ-GLU-VAL-ARG、γ-GLU-VAL-VAL、γ-GLU-CYS(S-Me)-GLY、γ-GLU-Abu-GLY和γ-GLU-LEU-GLY)具有抗氧化活性。
在具有比阳性对照GSH短的序列长度的二肽中,发现γ-GLU-ALA、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-LEU、γ-GLU-ASN、γ-GLU-PRO、γ-GLU-GLN、γ-GLU-THR、γ-GLU-VAL-NH2、γ-GLU-TRP、γ-GLU-TYR和γ-GLU-VAL-ol具有与GSH相当或更好的促进Nrf2和SOD2表达的显著优异的活性。其中,与GSH相比,具有促进Nrf2和SOD2表达的统计学显著活性的二肽被鉴定为γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-CYS(S-Me)(O2)、γ-GLU-GLY、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-GLN、γ-GLU-TRP和γ-GLU-TYR。
另外,已经发现,在具有与阳性对照GSH相同的序列长度的三肽中,与G SH相比,γ-GLU-GLN-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG具有统计学上显著的促进Nrf2和SOD2表达的活性。
即,总共鉴定出21种肽,它们比常规且公认的具有抗氧化作用的GSH具有更好的促进Nrf2表达和SOD2表达的作用,它们被确定为γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-CYS、γ-GLU-CYS(S-Me)、γ-GLU-GLY、γ-GLU-ILE、γ-GLU-GLN、γ-GLU-TRP、γ-GLU-TYR、γ-GLU-GLN-GLU、γ-GLU-ILE-GLY、γ-GLU-PRO-GLY、γ-GLU-SER-GLY、γ-GLU-THR-GLY、γ-GLU-VAL-CYS、γ-GLU-VAL-ASP、γ-GLU-VAL-GLU、γ-GLU-VAL-PHE、γ-GLU-VAL-MET、γ-GLU-VAL-ASN和γ-GLU-VAL-ARG。
发现其中的6种肽(γ-GLU-CYS(S-Me)(O2)、γ-GLU-HIS、γ-GLU-ILE、γ-GLU-GLN-GLU、γ-GLU-THR-GLY和γ-GLU-VAL-CYS)具有抗氧化作用(还原能力、清除DPPH的能力和Nrf2 mRNA活性可与GSH相当或优于GSH),并且具有促进SOD2 mRNA表达至阳性对照GSH的2倍至3倍高的作用,而γ-GLU-HIS显示具有促进Nrf2和SOD2 mRNA表达至GSH的2倍至8倍高的作用。
- 具有抗氧化活性的肽和包含其的组合物
- 牦牛乳乳清蛋白具有抗氧化活性的三肽及其应用和组合物
