长链非编码RNA Lnc-PLCB1在胃癌中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物医药和分子生物学技术领域,具体涉及长链非编码RNA Lnc-PLCB1在胃癌中的应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
胃癌是全球最常见的肿瘤之一。数据显示,在恶性肿瘤中,胃癌发病率居第六位,死亡率居第三位,且中东亚地区胃癌发病率居全球首位。由于缺乏特异性的早期症状和分子诊断标志物,大多数胃癌患者就诊时已是中晚期,且预后较差。因此探寻胃癌发生发展的分子机制,寻找有效的分子诊断标志物和治疗靶点具有重要意义。
胃癌是一种源自胃黏膜上皮的恶性肿瘤,胃癌的发生是多因素作用的结果,如饮食,遗传因素和环境因素等。其中幽门螺杆菌(Helicobacter pylori,Hp)的感染被认为是胃癌发生最重要的始动环境因素。自1983年Marshall和Warren在胃组织中首次发现和分离出幽门螺杆菌以来,越来越多的研究证实幽门螺杆菌在胃黏膜由慢性炎症向恶性转化的过程中发挥重要作用。幽门螺杆菌定植于胃粘膜上皮细胞,长期感染导致慢性非萎缩性胃炎,持续性炎症导致胃黏膜萎缩和肠化生,继而异型增生,最终发生恶性转化。研究表明,幽门螺杆菌可通过影响宿主细胞内基因表达异常和表观遗传学修饰异常从而激活癌症信号通路促进胃黏膜上皮细胞的恶性转变。然而,细胞恶性转化涉及众多基因、蛋白分子及非编码RNA等构成的调控网络,其具体机制尚未阐明。
表观转录组学指的是发生在RNA分子上的生物化学修饰,可以在不改变RNA分子序列信息的情况下改变其特性,并调控基因的表达。常见的RNA表观修饰包括m5C、m1A、ac4C、m6A等。N6-甲基腺苷(N6-methyladenosine,m6A)是最普遍的RNA表观修饰,在全基因组水平上发生在大约25%的转录本中,并富集在终止密码子周围、5’-和3’-非翻译区域以及长内外显子内。RNA m6A修饰可调节RNA的剪接、易位、稳定性和翻译。m6A由RNA甲基转移酶METTL3、METTL14和METTL16(写入者)催化,被去甲基酶FTO和ALKBH5(擦除者)去除,并与m6A结合蛋白如YTHDF1和IGF2BP1(读取者)相互作用。大量研究表明m6A调节蛋白可以参与促肿瘤进展。例如在胶质母细胞瘤干细胞中,敲除METTL3或METTL14可以减少m6A修饰,上调关键致癌基因如ADAM19、EPHA3和KLF4的表达,下调许多肿瘤抑制因子的表达,包括CDKN2A、BRCA2和TP53I11,从而增强胶质母细胞瘤干细胞的生长、自我更新和肿瘤发生。
长链非编码RNA是一类转录本长度大于200nt、没有明显蛋白质编码潜能的非编码RNA。根据LnRNA与其临近编码基因的关系,LncRNA 可以分为以下几类:(1)正义(snese)LncRNA;(2)反义(antisense)LncRNA;(3)双向(bidirectional)LncRNA;(4)内含子(intronic)LncRNA;(5)基因间(intergenic)LncRNA。LncRNA具有复杂的二级和三级结构,通过与RNA、DNA、蛋白质相互作用在表观遗传学修饰、转录和转录后等层面上实现对基因的表达调控。有研究表明,LncRNA可以被m6A修饰调节蛋白修饰,进而在癌症过程中发挥作用。如Wen Ni,Jianming Li等人的研究表明m6A阅读器YTHDF3可以促进m6A修饰的lncRNA GAS5的降解,进而影响结肠癌的进展。
然而,目前LncRNA m6A修饰在肿瘤中的研究较少,机制尚不明确,而LncRNA m6A修饰在幽门螺杆菌介导的胃黏膜恶性转化中的作用和调控机制仍是一个未知领域,目前尚无任何报道。
发明内容
针对上述现有技术的不足,发明人经长期的技术与实践探索,提供长链非编码RNALnc-PLCB1在胃癌中的应用。本发明使用幽门螺杆菌感染胃癌细胞后进行MeRIP-seq和RNA-seq,通过qPCR技术和MeRIP-PCR技术筛选出Lnc-PLCB1;随后我们构建了Lnc-PLCB1的过表达质粒并设计合成了特异性靶向Lnc-PLCB1的小干扰RNA,转染胃癌细胞,CCK8、克隆形成、EdU实验结果表明在胃癌细胞中过表达Lnc-PLCB1后可以明显抑制胃癌细胞的增殖能力,而下调Lnc-PLCB1之后又可以促进胃癌细胞的增殖能力;Transwell实验结果表明,在胃癌细胞中过表达Lnc-PLCB1之后可以抑制胃癌细胞的迁移能力,而下调Lnc-PLCB1之后可以促进胃癌细胞的迁移能力。因此认为Lnc-PLCB1具有抑制胃癌细胞增殖和转移的能力,可以用于制备胃癌的药物。基于上述研究成果,从而完成本发明。
为实现上述技术目的,本发明采用如下技术方案:
本发明的第一个方面,提供检测Lnc-PLCB1及其相关生物材料的物质在制备用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的产品中的应用。
其中,所述Lnc-PLCB1的序列如SEQ ID NO.1所示,Lnc-PLCB1相关生物材料包括但不限于转录因子IRF2、DDX21、CCND1和Slug。
所述预测胃癌的进展至少包括:
a1)对胃癌细胞增殖、迁移的预测评估;
a2)对胃癌生长情况的预测评估;
a3)对胃癌患者的总生存率的预测评估。
本发明的第二个方面,提供一种用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的产品,其包含基于高通量测序方法和/或基于定量PCR方法和/或基于探针杂交方法检测待测样品中Lnc-PLCB1及其相关生物材料的表达的物质。
本发明的第三个方面,提供一种用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的系统,所述系统包括:
b1)分析模块,所述分析模块包含用于确定受试者的待测样品中选自上述Lnc-PLCB1及其相关生物材料表达水平的检测物质,以及;
b2)评估模块,所述评估模块包含:根据b1)中确定的所述Lnc-PLCB1及其相关生物材料的表达水平判断所述受试者情况。
其中,所述受试者可以为胃癌患者或胃癌潜在风险人群;所述样品可以为受试者的胃(癌)细胞或胃(癌)组织。
本发明的第四个方面,提供Lnc-PLCB1作为靶点在制备或筛选胃癌药物中的用途。
所述筛选胃癌药物的方法包括:
c1)采用候选物质处理表达和/或含有Lnc-PLCB1的体系;设置不采用候选物质处理的平行对照;
c2)完成步骤c1)后,检测体系中Lnc-PLCB1的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述Lnc-PLCB1的表达量显著提高,所述候选物质可作为候选的胃癌药物。
本发明的第五个方面,提供促进Lnc-PLCB1表达和/或其活性提高的物质在如下d1)-d7)至少一种中的应用:
d1)抑制DDX21表达或制备抑制DDX21表达的产品;
d2)抑制CCND1表达或制备抑制抑制CCND1表达的产品;
d3)抑制Slug表达或制备抑制Slug表达的产品;
d4)抑制胃癌细胞增殖或制备抑制胃癌细胞增殖的产品;
d5)抑制胃癌细胞迁移或制备抑制胃癌细胞迁移的产品;
d6)抑制胃癌生长或制备抑制胃癌生长的产品;
d7)治疗胃癌或制备治疗胃癌的产品。
其中,促进Lnc-PLCB1表达和/或其活性提高的物质包括但不限于采用基于基因特异性Mimics技术上调Lnc-PLCB1表达和/或促进其活性的物质;如人工合成Lnc-PLCB1的短发夹RNA(short hairpin RNA,shRNA)或上调Lnc-PLCB1表达的启动子或者慢病毒;同时也包括化合物类促进剂。更具体的,本发明通过研究发现,转录因子IRF2直接与Lnc-PLCB1启动子区域结合,可以增强Lnc-PLCB1的启动子活性,促进Lnc-PLCB1的表达,因此促进Lnc-PLCB1表达和/或其活性提高的物质可以为转录因子IRF2或促进转录因子IRF2表达的物质。
本发明的第六个方面,提供一种治疗胃癌的方法,所述方法包括向受试者施用治疗有效量的上述促进Lnc-PLCB1表达和/或其活性提高的物质。
与现有技术方案相比,上述一个或多个技术方案具有如下有益效果:
上述技术方案首次筛选出一条在幽门螺杆菌感染后表达下调的长链非编码RNALnc-PLCB1。在胃癌细胞中上调或者过表达Lnc-PLCB1后发现Lnc-PLCB1能够显著抑制胃癌细胞的增殖和迁移能力。同时通过对Lnc-PLCB1的调控模式进行研究,发现转录因子IRF2可以通过促进Lnc-PLCB1转录进而促进其表达,同时IRF2本身表达水平也受到幽门螺杆菌感染的影响,因此幽门螺杆菌感染通过下调转录因子IRF2的表达水平进而下调Lnc-PLCB1。通过研究Lnc-PLCB1的下游靶点发现Lnc-PLCB1可以与DDX21蛋白特异性结合进而下调DDX21的蛋白水平。同时研究又表明DDX21在胃癌细胞中可以促进CCND1及Slug的表达,因此综上表明Lnc-PLCB1可以通过下调DDX21蛋白水平,进而下调CCND1及Slug的表达,进而抑制胃癌的发生发展。
上述技术方案对Lnc-PLCB1在胃癌中的临床价值、生物学功能及分子机制进行了深入探索,有望开发其作为胃癌诊断/治疗/预后标志物的应用,同时也为寻找胃癌临床诊断和预后评估的生物标志物及药物治疗靶点提供了新的视角,因此具有良好的实际应用之价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
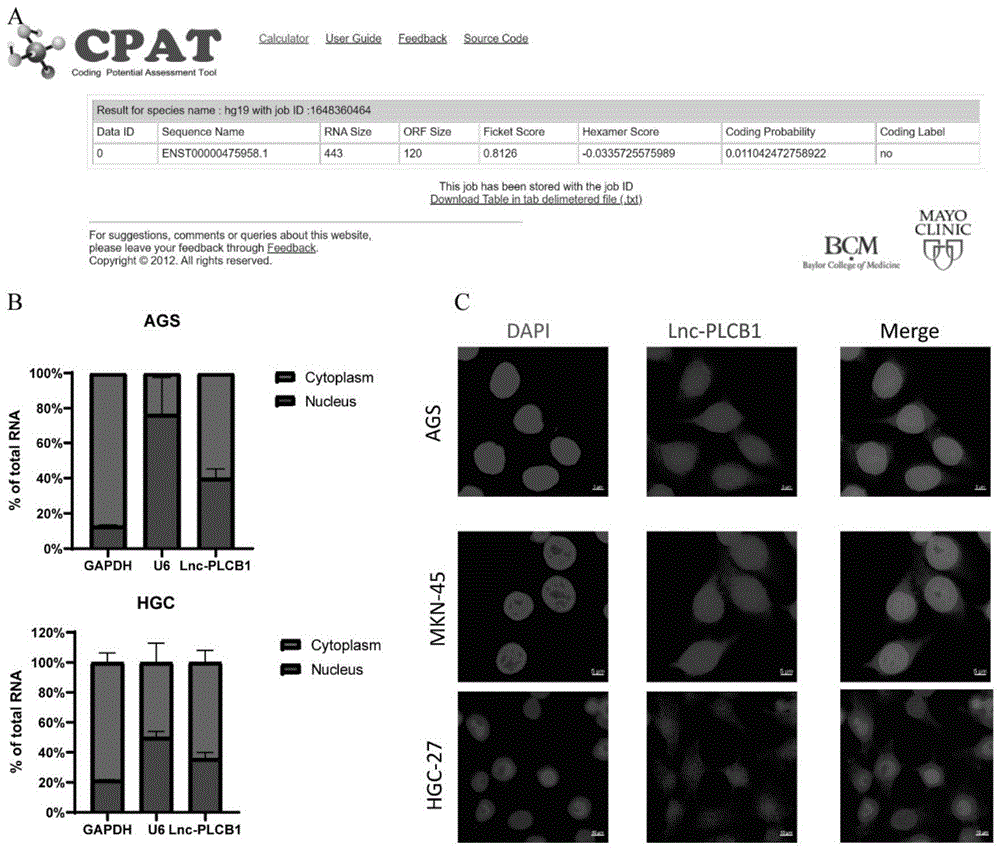
图1:Lnc-PLCB1编码能力预测及亚细胞定位。(A)CPAT(Coding PotentialAssessment Tool)结果显示Lnc-PLCB1不具备编码能力。(B)核质分离实验结果表明Lnc-PLCB1在细胞核和细胞质内均有分布;其中U6作为细胞核内参,GAPDH作为细胞质内参。(C)荧光原位杂交技术结果显示Lnc-PLCB1在细胞核和细胞质中均有分布。
图2:幽门螺杆菌感染可以下调Lnc-PLCB1的表达水平。(A)qPCR实验检测幽门螺杆菌Hp11637及Hp26695菌株以不同时间点及不同MOI浓度感染AGS细胞后Lnc-PLCB1表达水平的变化。(B)qPCR实验检测幽门螺杆菌Hp11637及Hp26695菌株以不同时间点及不同MOI浓度感染HGC-27细胞后Lnc-PLCB1表达水平的变化。
图3:CCK-8实验表明Lnc-PLCB1在体外可以抑制胃癌细胞的增殖能力。(A)qPCR检测胃癌细胞转染靶向Lnc-PLCB1小干扰48h后的干扰效果。(B)qPCR检测胃癌细胞转染Lnc-PLCB1过表达质粒48h后的过表达效果。(C)CCK-8实验检测下调Lnc-PLCB1表达水平后对胃癌细胞增殖能力的影响。(D)CCK-8实验检测过表达Lnc-PLCB1水平后对胃癌细胞增殖能力的影响。*为P≤0.05,**为P≤0.01,***为P≤0.001,****为P≤0.0001。
图4:EdU和克隆形成实验表明Lnc-PLCB1可以在体外抑制胃癌细胞的增殖能力。(A)EdU实验检测过表达Lnc-PLCB1后对胃癌细胞的增殖能力的影响。(B)克隆形成实验检测过表达或下调Lnc-PLCB1之后对胃癌细胞增殖能力的影响。*为P≤0.05,**为P≤0.01,***为P≤0.001,****为P≤0.0001。
图5:Lnc-PLCB1在体外可以抑制胃癌细胞的迁移能力。(A)Transwell实验检测过表达Lnc-PLCB1后对胃癌细胞的迁移能力的影响。(B)Transwell实验检测下调Lnc-PLCB1后对胃癌细胞迁移能力的影响。*为P≤0.05,**为P≤0.01,***为P≤0.001,****为P≤0.0001。
图6:下调Lnc-PLCB1在体内可以促进胃癌细胞的增殖和转移。(A)qPCR检测胃癌细胞中Lnc-PLCB1的敲低效果。(B)NC组和Lnc-PLCB1敲低组瘤体生长曲线。(C)照片示裸鼠处死后剥离出的NC组和Lnc-PLCB1敲低组的瘤体。(D)NC组和Lnc-PLCB1敲低组裸鼠瘤体的重量。(E)小动物活体成像显示NC组和Lnc-PLCB1组肿瘤转移情况。(E)小动物活体成像显示NC组和Lnc-PLCB1敲低组肺组织中的荧光强度。(F)照片示NC组和Lnc-PLCB1敲低组裸鼠处死后剥离出的肺组织的肿瘤转移灶数量。
图7:转录因子IRF2可以增强Lnc-PLCB1的启动子活性。(A)从-500/-300/-150到0的Lnc-PLCB1启动子片段示意图。该启动的片段被克隆到pGL3-basic载体中萤火虫荧光素酶报告基因的上游。(B)双荧光素酶实验检测不同Lnc-PLCB1启动子截断体的转录活性。(C)PROMO网站预测与Lnc-PLCB1核心启动子区域结合的转录因子。(D)qPCR实验检测胃癌细胞中幽门螺杆菌感染对转录因子IRF2及FOXA1 mRNA水平的影响。(E)qPCR实验检测转录因子IRF2以及FOXA1在胃癌细胞中的过表达效果。(F)双荧光素酶实验检测转录因子IRF2、FOXA1对Lnc-PLCB1核心启动子的转录激活能力的影响。
图8:IRF2直接与Lnc-PLCB1启动子区域结合促进其表达。(A)通过PROMO网站预测转录因子IRF2与Lnc-PLCB1核心启动子区域的结合为位点(左);IRF2与Lnc-PLCB1核心启动子区域结合位点突变示意图(右)。(B)双荧光素酶实验检测Lnc-PLCB1野生及突变启动子转录活性。(C)双荧光素酶实验检测转录因子IRF2对Lnc-PLCB1野生及突变启动子的转录激活能力;(D)ChIP-qPCR实验检测胃癌细胞IRF2与Lnc-PLCB1启动子的结合能力。
图9:幽门螺杆菌通过IRF2下调Lnc-PLCB1的表达。(A)Western blot实验检测在胃癌细胞中不同MOI浓度的幽门螺杆菌感染对IRF2蛋白水平的影响;
(B)qPCR实验检测IRF2对Lnc-PLCB1的表达水平的影响;(C)Kaplan–Meier生存分析评估胃癌患者中IRF2表达水平与总生存率之间的关系(左,GSE62254,n=280,P=0.022);TCGA数据库中胃癌组织(n=111)和癌旁正常组织(n=21)中DDX21差异表达分析(右);(D)qPCR实验检测胃癌细胞中IRF2过表达对幽门螺杆菌感染所诱导的Lnc-PLCB1水平的下调的补救效果;(E)Western blot实验检测IRF2与METTL14两者之间的调控关系。
图10:Lnc-PLCB1与DDX21蛋白特异性结合。(A)Lnc-PLCB1结合蛋白筛选流程图。(B)通过生物素标记的Lnc-PLCB1与HGC-27细胞的蛋白提取物孵育,对Lnc-PLCB1所结合的蛋白复合物进行SDS-PAGE和银染。(C)采用生物素标记的Lnc-PLCB1 RNA与HGC-27细胞提取物共同孵育,进行pull-down实验,回收的蛋白与相应抗体进行免疫印迹分析。(D)使用DDX21抗体进行RIP实验检测在HGC-27细胞中所富集到的Lnc-PLCB1。归一化数据显示为对照组的相对富集倍数。(E)荧光原为杂交实验和免疫荧光实验共染,共聚焦图像显示HGC-27、MKN-45细胞中Lnc-PLCB和DDX21的共定位情况。比例尺为5um。用蓝色4',6-二胺基-2-苯基吲哚(DAPI)染色细胞核。
图11:DDX21在体外可以促进胃癌细胞的增殖和迁移。(A)qPCR实验和WB实验检测胃癌细胞中转染靶向DDX21的siRNA 48h后的干扰效果。(B)CCK-8实验检测下调DDX21后对胃癌细胞增殖能力的影响。(C)Transwell实验检测下调DDX21后对胃癌细胞迁移能力的影响。(D)TCGA数据库中胃癌组织(n=375)和癌旁正常组织(n=32)中DDX21差异表达分析(左);Kaplan–Meier生存分析评估胃癌患者中DDX21表达水平与总生存率之间的关系(右,GSE224654,n=197,P=0.014)。
图12:Lnc-PLCB1通过DDX21抑制胃癌细胞的增殖和迁移能力。(A)克隆形成实验检测下调DDX21对Lnc-PLCB1下调的胃癌细胞增殖能力的补救效果;(B)Transwell实验检测下调DDX21对Lnc-PLCB1下调的胃癌细胞迁移能力的补救效果。
图13:Lnc-PLCB1可以下调DDX21的蛋白水平进而下调CCND1和Slug。(A)Westernblot检测胃癌细胞中Lnc-PLCB1对DDX21蛋白水平的影响;(B)qPCR实验检测Lnc-PLCB1对DDX21 mRNA水平的影响;(C)Western blot实验检测胃癌细胞中幽门螺杆菌感染对DDX21蛋白水平的影响;(D)qPCR实验检测胃癌细胞中DDX21对CCND1和Slug mRNA水平的影响(左);GEPIA网站数据显示DDX21与CCND1及Slug之间的表达关性(右)。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
如前所述,lncRNA可能在胶质瘤相关的异常可变剪接调控方面也发挥着重要作用,但是相关研究仍比较匮乏,特别是在PTBP1介导的异常剪接事件发生中,大多数lncRNA的功能和生物学效应仍未可知。
有鉴于此,本发明的一种典型具体实施方式中,提供检测Lnc-PLCB1及其相关生物材料的物质在制备用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的产品中的应用。
其中,所述Lnc-PLCB1的序列如下所示:CAGCAGAUCGGAAGCGAGUUGAAACUGCUUUAGAGGCUUGUAGUCUUCCAUCUUCAAGGGCAUUGAGAAUAUGGUGGUGAAGAAAAUGAAACUCAAGGUUUCAAGGACAAUAGAGUCUUCUGGGGAAACUAGCCAAUAAGCAUGCCAACAAAUGCGUCUGUAAACUGGGGGAAGUGCUAUAAAAAGAAAGACUGGAGAACUACUAUUGAGAAGAAGGGAAGCUCAUUCCAGAAAAAGAAAACAAUGCUCGCAAAUCCCUGAGGCUGGAAAUAAUUUCCCUACUGGAUUUAAGCAACUGAGAAAAGACCACCGCAUUCAAGCAUAAAGAGAAAACAUGAGAGAUGGAUUUGCAAAGACAUGCAAAGAAUUUUUUUCCUUUUGCAAUCACUUCUGAUUUUACCUUUUCUG
GAUAACCUCUGGUAAAAUAUAAUAAUCAAAAUAUU(SEQ ID NO.1);所述Lnc-PLCB1相关生物材料包括但不限于转录因子IRF2、DDX21、CCND1和Slug。
所述预测胃癌的进展至少包括:
a1)对胃癌细胞增殖、迁移的预测评估;
a2)对胃癌生长情况的预测评估;
a3)对胃癌患者的总生存率的预测评估。
具体的,所述胃癌可以是由幽门螺杆菌感染所致。
本发明又一具体实施方式中,提供一种用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的产品,其包含基于高通量测序方法和/或基于定量PCR方法和/或基于探针杂交方法检测待测样品中Lnc-PLCB1及其相关生物材料的表达的物质。
所述产品包括但不限于检测待测样本中所述Lnc-PLCB1表达水平的引物(如SEQID NO.2-3所示)、探针、芯片、试剂、试剂盒以及相关检测装置和设备。
所述待测样本可为人源样本,更具体的,所述待测样本至少包括受试者细胞和组织。
其中,所述细胞可以为胃(癌)细胞;所述组织可以为胃(癌)组织。
本发明又一具体实施方式中,提供一种用于筛查、(辅助)诊断、检测、监测或预测胃癌进展的系统,所述系统包括:
b1)分析模块,所述分析模块包含用于确定受试者的待测样品中选自上述Lnc-PLCB1及其相关生物材料表达水平的检测物质,以及;
b2)评估模块,所述评估模块包含:根据b1)中确定的所述Lnc-PLCB1及其相关生物材料的表达水平判断所述受试者情况。
其中,所述受试者可以为胃癌患者或胃癌潜在风险人群;所述样品可以为受试者的胃(癌)细胞或胃(癌)组织。
其中,所述Lnc-PLCB1的序列如SEQ ID NO.1所示;所述Lnc-PLCB1相关生物材料包括但不限于转录因子IRF2、DDX21、CCND1和Slug。
所述预测胃癌的进展至少包括:
a1)对胃癌细胞增殖、迁移的预测评估;
a2)对胃癌生长情况的预测评估;
a3)对胃癌患者的总生存率的预测评估。
具体的,所述胃癌可以是由幽门螺杆菌感染所致。
本发明又一具体实施方式中,提供Lnc-PLCB1作为靶点在制备或筛选胃癌药物中的用途。
其中,所述筛选胃癌药物的方法包括:
c1)采用候选物质处理表达和/或含有Lnc-PLCB1的体系;设置不采用候选物质处理的平行对照;
c2)完成步骤c1)后,检测体系中Lnc-PLCB1的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述Lnc-PLCB1的表达量显著提高,所述候选物质可作为候选的胃癌药物。
本发明的又一具体实施方式中,所述体系可为细胞体系、溶液体系、组织体系、器官体系或动物体系。
所述细胞体系中的细胞可以为胃(癌)细胞;
所述组织体系中的组织可以为胃(癌)组织;
所述器官体系中的器官可以为胃或患癌胃;
所述动物体系中的动物可以为哺乳动物,包括小鼠、大鼠、豚鼠、兔、猴、猩猩、人等。
本发明又一具体实施方式中,提供促进Lnc-PLCB1表达和/或其活性提高的物质在如下d1)-d7)至少一种中的应用:
d1)抑制DDX21表达或制备抑制DDX21表达的产品;
d2)抑制CCND1表达或制备抑制抑制CCND1表达的产品;
d3)抑制Slug表达或制备抑制Slug表达的产品;
d4)抑制胃癌细胞增殖或制备抑制胃癌细胞增殖的产品;
d5)抑制胃癌细胞迁移或制备抑制胃癌细胞迁移的产品;
d6)抑制胃癌生长或制备抑制胃癌生长的产品;
d7)治疗胃癌或制备治疗胃癌的产品。
其中,促进Lnc-PLCB1表达和/或其活性提高的物质包括但不限于采用基于基因特异性Mimics技术上调Lnc-PLCB1表达和/或促进其活性的物质;如人工合成Lnc-PLCB1的短发夹RNA(short hairpin RNA,shRNA)或上调Lnc-PLCB1表达的启动子或者慢病毒;同时也包括化合物类促进剂(如转录激动剂等)。更具体的,本发明通过研究发现,转录因子IRF2直接与Lnc-PLCB1启动子区域结合,可以增强Lnc-PLCB1的启动子活性,促进Lnc-PLCB1的表达,因此促进Lnc-PLCB1表达和/或其活性提高的物质可以为转录因子IRF2或促进转录因子IRF2表达的物质。
在具体应用时可以构建Lnc-PLCB1的过表达载体进行基因治疗,同时通过筛选出Lnc-PLCB1的核心启动子区域及促进其转录的转录因子,因此也可以通过设计其转录激动剂来达到治疗胃癌的目的。
本发明的又一具体实施方式中,上述产品可以为药物或者实验试剂,所述实验试剂可供基础研究使用。
当上述产品为药物时,所述药物还可包含一种或多种药学上或食品学上可接受的辅料。所用辅料可为固态或液态。固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸及栓剂。粉剂及片剂可包含约0.1%至约99.9%的活性成分。适当的固体辅料可以是碳酸镁、硬脂酸镁、滑石粉或者乳糖。片剂、粉剂、药丸及胶囊为适于口服用的固态剂型。液态形式的制剂包括溶液、悬浮液及乳液,其实施例为非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液。此外,还可制成注射用小水针、注射用冻干粉针、大输液或小输液。
本发明又一具体实施方式中,提供一种治疗胃癌的方法,所述方法包括向受试者施用治疗有效量的上述促进Lnc-PLCB1表达和/或其活性提高的物质。
所述受试者是指已经是治疗、观察或实验的对象的动物,可以是人和非人哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猴、猩猩等,最优选指人。所述“治疗有效量”是指包括本发明化合物在内的活性化合物或药剂的量,该量可引起研究者、兽医、医生或其他医疗人员所追求的组织系统、动物或人的生物学或医学响应,这包括减轻或部分减轻受治疗的疾病、综合征、病症或障碍的症状。
可以知晓的是,本发明所述活性成分的最佳给药剂量和间隔是由其性质和诸如给药的形式、路径和部位以及所治疗的特定哺乳动物等外部条件决定的,而这一最佳给药剂量可用常规的技术确定。
以下结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照销售公司所推荐的条件;在本发明没有特别限定,均可通过商业途径购买得到。
实施例
试验方法
1.细胞株及培养条件
AGS、HGC-27、MKN-45细胞均为胃癌细胞系,293T细胞为为人胚胎肾上皮细胞系,为购自中国科学院上海细胞生物研究所,引进后在本实验室长期培养。HGC-27、MKN-45细胞均使用RPMI1640+10%FBS培养,AGS细胞使用F12K+12%FBS培养,293T细胞使用DMEM+10%FBS进行培养。培养条件为37℃、5%CO2,95%空气,饱和湿度条件。
2.细胞的转染
2.1质粒转染
(1)转染前一天使用胰酶消化细胞,按照6-7x106/孔的量将细胞铺至6孔板中,于培养箱中培养24h。
(2)待细胞密度达到60-80%时对细胞进行转染。对于每个孔,使用200ul的jetPRIME缓冲液稀释2-2.5ug的质粒,吹打混匀然后瞬时离心;
(3)将4-5ul的jetPRIME试剂加到上一步的质粒/缓冲液混合液中(质粒:jetPRIME比例为1:2),吹打混匀,瞬时离心,室温孵育10min。
(4)将转染混合液加入到六孔板中,孵育24h后进行换液。
2.2siRNA转染
(1)转染前一天使用胰酶消化细胞,按照3-4x106/孔的量将细胞铺至6孔板中,于培养箱中培养24h。
(2)待细胞密度达到30-40%时对细胞进行转染。转染方法同质粒转染。
3.细胞总RNA提取
按照APARKeasy细胞RNA快速提取试剂盒(Sparkjade)的说明书进行操作,具体步骤如下:
(1)使用胰酶将细胞消化下来,1000rpm离心5min弃去上清,留下细胞沉淀。
(2)在处理好的样品管中加入500ul的Lysis Buffer,立即吹打混匀直至没有细胞团块,静置1min。
(3)将混合物加入到吸附柱中(吸附柱放入收集管中),12000rpm离心30秒,尽可能去掉滤液。
(4)向吸附柱中加入500ul Washing Buffer D2,12000rpm离心30s,尽可能去掉滤液。
(5)重复步骤4.
(6)将吸附柱放回空的收集管中,12000rpm离心2min,去掉漂洗液。
(7)取出吸附柱,放入到干净的无RNAse管中,根据预测的RNA量向吸附膜的中间部位加入30-50ul水,室温放置1min,10000rpm离心1min,获得的透明液体即为RNA溶液。
4.LncRNA逆转录
(1)基因组DNA的去除
在RNase-free离心管中配制如下混合液
用移液器轻轻吹打混匀。42℃2min。
(2)配置逆转录反应体系
在第1步的反应管中直接加入5×HiScript II Select qRT SuperMix II,用移液器轻轻吹打混匀。
(3)进行逆转录反应,50℃,15min;85℃,5s。产物可立即用于qPCR反应,或在-20℃保存。
5.Real-time PCR检测RNA表达
Lnc-PLCB1上游引物为:ATGCGTCTGTAAACTGGGGG,如SEQ ID NO.2所示;
Lnc-PLCB1下游引物为:TTCCAGCCTCAGGGATTTGC,如SEQ ID NO.3所示;
GAPDH上游引物为:GGCCTCCAAGGAGTAAGACC,如SEQ ID NO.4所示;
GAPDH下游引物为:AGGGGAGATTCAGTGTGGTG,如SEQ ID NO.5所示;
U6上游引物为:CTCGCTTCGGCAGCACA,如SEQ ID NO.6所示;
U6下游引物为:AACGCTTCACGAATTTGCGT,如SEQ ID NO.7所示;
IRF-2上游引物为:TCCTGAGTATGCGGTCCTGA,如SEQ ID NO.8所示;
IRF-2下游引物为:TCAGTCGTTTCGCTTTCTGC,如SEQ ID NO.9所示;
FOXA1上游引物为:GAAGACCGGCCAGCTAGAGG,如SEQ ID NO.10所示;
FOXA1下游引物为:TGTTGATGGAGAACGGGTGG,如SEQ ID NO.11所示;
DDX21上游引物为:AGTGGAGCAAAAAGCGGGAA,如SEQ ID NO.12所示;
DDX21下游引物为:AAATATGGGCCAGTGCTGCT如SEQ ID NO.13所示;
按照两步法PCR设定反应步骤。
反应结束,根据熔解曲线和Ct值,按照2-ΔΔCT计算得到目的基因在这一模板中的相对表达值后进行分析。
6.质粒提取
6.1质粒转化
(1)将50ul的感受态细胞至于1.5ml的EP管中,向其中加入100-1000ng质粒,轻轻吹打混匀,放置于冰上静置30min;
(2)42℃金属浴热激90s,随后放于冰上静置2min。
(3)向装有感受态的EP管中加入800ul不含有抗生素的LB液体培养基,37℃摇床上摇45min。
(4)取50-100ul菌液均匀地涂布于含有目的抗生素的LB平板上,放置于37℃培养12-16h。
(5)挑取单个菌落加入到10ml含有抗生素的LB液体培养基中,37℃摇床过夜;
(6)按照甘油:菌液=7:3的比例冻存菌液。
6.2使用试剂盒提取质粒
(1)取5-15ml过夜培养的菌液,加入离心管中,13,000rpm(~16,200×g)离心1分钟收集细菌,尽量吸弃全部上清。
(2)向留有菌体沉淀的离心管中加入500μl Buffer P1(请先检查是否已加入RNase A),使用移液器或涡旋振荡器充分混匀,悬浮细菌沉淀。
(3)向离心管中加入500μl Buffer P2,温和地上下颠倒混匀8-10次,使菌体充分裂解,室温放置3-5分钟。
(4)向离心管中加入500μl Buffer E3,立即上下颠倒混匀8-10次,此时出现白色絮状沉淀,室温放置5分钟。13,000rpm离心5分钟,吸取上清,将上清加入过滤柱(Endo-Remover FM)中,13,000rpm离心1分钟过滤,将收集管中的滤液转移到离心管中。
(5)向滤液中加入450μl异丙醇,上下颠倒混匀。
(6)柱平衡:向已装入收集管的吸附柱(Spin Columns DL)中加入200μl BufferPS,13,000rpm离心2分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(7)将步骤5中滤液与异丙醇的混合溶液转移到平衡好的吸附柱中。
(8)13,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(9)向吸附柱中加入750μl Buffer PW,13,000rpm离心1分钟,倒掉收集管中的废液。
(10)将吸附柱重新放回收集管中,13,000rpm离心1分钟。
(11)将吸附柱置于一个新的离心管(自备)中,向吸附膜的中间部位加入100-200μl Endo-Free Buffer EB,室温放置2-5分钟,13,000rpm离心2分钟。-20℃保存质粒。
7.CCK-8法检测细胞增殖活力
(1)将转染质粒或者小干扰的胃癌细胞消化下来,然后以2000-3000/孔的量铺
至96孔板中,每个分组铺5-6天,每天设置5个重复孔;
(2)24h后细胞贴壁后,每孔加10ul的CCK-8试剂,于37℃培养箱中孵育2h,
酶标仪检测450nm的吸光度,同时检测630nm的吸光度作为参比波长;
(3)按照步骤(2)的操作连续检测3-5天,需注意每天的孵育时间应该保持
一致。
8.Transwell检测细胞的迁移能力
(1)将转染质粒或者小干扰的胃癌细胞消化下来,按照每个小室4-6x10
铺至每个小室中,小室内使用无血清的培养基,下室使用含有20%血清的培养基,使细胞迁移55-60h;
(2)使用PBS清洗小室3次,然后使用多聚甲醛固定细胞20min;
(3)使用PBS清洗小室3次,使用0.5的结晶紫染色20min;
(4)使用PBS清洗小室,使用棉签小心去除上室细胞,与显微镜下拍照并对
细胞计数,检测细胞的迁移能力。
9.克隆形成实验检测细胞的增殖能力
(1)将转染质粒或者小干扰的细胞消化下来,以1000-2000/孔的细胞量铺至六
孔板中,每组设置3个重复孔;
(2)待细胞生长10-14天后,长成肉眼可见的克隆(至少约50个细胞)之后
对细胞进行染色;
(3)使用PBS清洗细胞三次,随后使用多聚甲醛固定20min;
(4)使用PBS清洗细胞三次,使用0.5%结晶紫燃料对细胞染色20min;
(5)使用PBS清洗细胞,随后对克隆进行计数,从而判断每组细胞的增殖能力。
10.幽门螺杆菌的培养
(1)取出冻存于-80℃的幽门螺杆菌菌液,解冻之后取200ul均匀地涂布于10%
蛋黄的平板上,待平板干涸后放置于微需氧(8%O
(2)48h后待幽门螺杆菌菌量较多时,用涂布棒将菌刮下来之后均匀地涂布到
新的平板上;
(3)新复苏的Hp传代1-2次后待菌状态良好且到对数期时将一部分菌进行冻存。
11.幽门螺杆菌感染胃癌细胞
(1)将1x10
细胞进行幽门螺杆菌感染;
(2)将生长状态较好的幽门螺杆菌刮至PBS中,使用酶标仪检测菌液的浓度,
根据不同的MOI计算所需要的菌液体积,进行感染细胞;
(3)于对应时间收取细胞提取RNA或者蛋白检测目标分子的变化。
12.Western blot
12.1细胞总蛋白提取
(1)取出细胞,弃去培养基,用PBS洗涤细胞两次。以六孔板100ul/孔的量加入细胞裂解液(RIPA lysis buffer:PMSF=100:1),将细胞刮下随后使用移液器将细胞裂解液移至1.5ml的EP管中,冰上裂解30min;
(2)4℃,13000rpm离心15min,吸取上清液至新的EP管中,记录体积,放置-80℃保存直至使用;12.2蛋白浓度的测定
使用NANODROP LITE测定蛋白浓度。
12.3SDS-PAGE凝胶电泳(聚丙烯酰胺凝胶电泳)
(1)按照配方配制分离胶和浓缩胶,待分离胶凝固后,再将浓缩胶并及时插梳子。
(2)根据所得的蛋白样品体积加入5×SDS-PAGE蛋白上样缓冲液,得到1×SDS-PAGE蛋白样品,100℃加热10分钟。
(3)根据所得的蛋白样品浓度计算200ng蛋白量的蛋白样品体积,将蛋白marker和蛋白样品分别加至分离胶。(4)浓缩胶80V恒压电泳,分离胶120V恒压电泳。溴酚蓝到达分离胶底端时停止电泳。
(5)根据蛋白marker指示蛋白位置,切取凝胶,放置甲醇活化的PVDF膜,转膜1h左右。转膜时产生大量的热,转膜装置需放置在冰水中。
(6)将PVDF膜放置在5%脱脂牛奶中,室温孵育1h,TBST缓冲液清洗PVDF膜3次,每次10min。
(7)将PVDF膜放于稀释的一抗中,4℃过夜,TBST缓冲液清洗PVDF膜3次,每次10min。
(8)将PVDF膜放入5%脱脂牛奶稀释的二抗中,室温摇床孵育60min,TBST缓冲液清洗PVDF膜3次,每次10min。。
(9)按照1:1的比例将化学发光液ECL试剂盒中A液和B液混匀。在化学发光成像仪中,化学发光液浸湿PVDF膜,曝光并保存图像。
13.细胞RNA核质分离
按照Thermo scientific NE-PER Nuclear and Cytoplasmic ExtractionReagents说明书进行操作,详细步骤如下:(1)贴壁细胞用胰蛋白酶消化搜集,500×g离心5分钟。
(2)用PBS悬浮液清洗细胞,将5×10
×g离心2-3分钟使细胞沉淀。
(3)将50ul冰冷的CER I加入到细胞沉淀中(表1)。使用表1所示的试剂量,
进行细胞质和核蛋白提取。
(4)剧烈震荡15s,以完全悬浮细胞沉淀。把试管放在冰上孵育10分钟。
(5)向管中添加冰冷的CER II,剧烈震荡5s。把试管放在冰上孵育1分钟。
(6)剧烈震荡5秒。16000×g,离心5分钟。
(7)立即将上清液(细胞质提取液)转移到干净的预冷冻管中,使用Sparkjade的APARKeasy细胞RNA快速提取试剂盒进行胞质RNA提取;
(8)将骤(6)中的不溶性颗粒(其中包含细胞核)溶解于Trizol中,按照Trizol
法说明书提取细胞核RNA;
(9)qPCR检测Lnc-PLCB1在细胞核和细胞质中的分布情况。
14.荧光原位杂交技术(FISH)
按照锐博生物Fluorescent In Situ Hybridization Kit说明书进行操作,详细步骤如下:
(1)提前一天将细胞爬片置于24孔板孔底,培养适量细胞(约6X 10
/孔)。实验前使细胞融合度达到60%-70%。
(2)使用PBS清洗细胞,随后使用4%多聚甲醛室温固定10min;
(3)1X PBS清洗细胞5min,共3次;随后每孔加入1mL预冷的通透液(含0.5%Triton X-100的PBS),4℃静置5min;
(4)弃去通透液后,加入PBS清洗细胞5min,共3次;
(5)每孔加入200uL预杂交液,37℃封闭30min;预杂交同时,将杂交液在37℃中预热;
(6)避光条件下,把2.5uL 20uM【lncRNA FISH Probe Mix储存液】加
入到100μl【杂交液】中;
(7)弃去每孔细胞中的【预杂交液】,加入100uL含有探针的【探针杂交液】,避光,37℃杂交过夜;
(8)避光,42℃,杂交洗液I(4X SSC,0.1% Tween-20)清洗每孔细胞3次,每次5min,以降低背景信号;
(9)避光,42℃,杂交洗液II(2X SSC)清洗细胞1次;
(10)避光,42℃,杂交洗液III(1X SSC)清洗细胞1次;
(11)避光,使用PBS清洗细胞,室温5min;
(12)避光,使用1X DAPI染色液染色10min,染色液用量以覆盖待杂交区域所有细胞为宜;
(13)避光,使用PBS清洗细胞3次,每次5min;
(14)避光条件下,从孔中小心取出细胞爬片,用封片剂将其固定于载玻片上,进行荧光检测。
15.T7体外转录
按照锐博生物RNAmax-T7生物素标记转录试剂盒说明书进行操作,详细步骤如下:
(1)通过PCR、凝胶回收获得纯化的线性化模板;
(2)按照下表配置体外转录反应体系:
用移液器轻轻吸打混匀反应体系(请勿剧烈震荡混匀),瞬时离心以确保溶液全部汇集在管底,置于热循环仪上37℃孵育反应2~4h;
(3)向上一步的反应体系中加入1μl DNase I(1U/μl),并用移液器混合均匀,瞬时离心使溶液全部汇集于管底,置于热循环仪上37℃孵育反应20min,以彻底消除体系中的DNA模板;
(4)按下表所述配制RNA产物的纯化体系:
轻轻混合均匀后加入预冷无水乙醇300μl,轻轻混合均匀后放置于-20℃冰箱中过夜沉淀;
(5)使用低温冷冻离心机在4℃、13000rpm条件下离心30min,离心后可明显看到RNA沉淀;
(6)弃去上清后加入1ml预冷70%乙醇,颠倒离心管洗涤沉淀;
(7)重复步骤(6);
(8)于低温冷冻离心机在4℃、13000rpm条件下离心10min,弃去上清后(尽量把剩余乙醇洗液全部去除)干燥晾干RNA沉淀至透明。
(9)加入30~50μl RNase Free Water或1X TE溶液溶解晾干后的RNA沉淀,室温放置5min直至RNA沉淀充分溶解,随后RNA溶液放置于-80℃直至使用。
16.银染实验
(1)固定:4℃过夜;DEPC水水洗5-10min,3次;
(2)致敏:30min;
(3)水洗:3次,每次10min;
(4)银染:20min;
(5)水洗:2次,每次1min。(快速水洗,30-60s/次;避光,时间不宜过长);
(6)显色:时间按照具体情况而定;待又条带出现时,倒掉显色液,加入终止液;
(7)终止:10min,倒掉终止液,水洗2-5min;
(8)保存:1%冰醋酸,4℃保存。
(9)使用化学发光成像系统进行拍摄。
17.双荧光素酶实验
按照翌圣生物双萤光素酶报告基因检测试剂盒说明书进行操作,详细步骤如下:
(1)按照1.5-1.75x10
养24h。
(2)待细胞密度达到50-70%的时候对细胞进行转染。
(3)转然后48h后,吸尽细胞培养液,按照200ul/孔的比例加入细胞裂解液,
轻轻旋转培养皿或者培养板使裂解液完全覆盖细胞;
(4)冰上孵育5min,充分裂解细胞。
(5)取20μL裂解液,加至培养板中,设置3个重复孔。
(6)分别使用对应的缓冲液将萤火虫萤光素酶底物(50×)和海肾萤光素酶底
物(50×)稀释至1×工作液并孵育至室温。
(7)使用多功能酶标仪检测吸光度。
18.统计分析
该研究所有实验至少进行了3次生物重复,所得数据使用Graphpad 8.0进行统计分析。分析两组间差异时一般采用Student's t检验,方差不同时采用Mann-Whitney U检验。三组及以上且单个变量的实验数据进行单因素方差分析,两个变量的实验数据进行双因素方差分析。统计数据为MEAN±SEM,p<0.05表明实验结果具有统计学意义。
试验结果
1、幽门螺杆菌感染可以下调Lnc-PLCB1的表达
研究表明,幽门螺杆菌感染可以调控LncRNA的表达,因此我们猜测幽门螺杆菌感染是否可以通过RNA修饰机制调控LncRNA的表达进而影响胃癌的发生发展。为了探究这一机制,我们用幽门螺杆菌Hp26695感染胃癌细胞AGS后进行MeRIP-seq以及RNA-seq分析,并通过qRT-PCR做进一步验证,最终筛选出长链非编码RNA--Lnc-PLCB1。我们通过CPAT(Coding Potential Assessment Tool)网站对Lnc-PLCB1的编码能力进行了预测,结果显示Lnc-PLCB1不具备编码能力(图1A)。为了确定Lnc-PLCB1的亚细胞定位,我们进行FISH实验以及RNA核质分离实验,结果表明Lnc-PLCB1在细胞核和细胞质中均有分布(图1B-C)。为了探究幽门螺杆菌不同浓度以及不同感染时间对Lnc-PLCB1表达水平的影响,我们使用幽门螺杆菌Hp26695和Hp11637菌株分别感染胃癌细胞AGS和HGC-27不同的时间以及不同的MOI,通过qRT-PCR检测Lnc-PLCB1的表达变化,结果表明不同的幽门螺杆菌感染时间以及不同的MOI均可以下调Lnc-PLCB1的表达水平(图2A-B)。
2、Lnc-PLCB1在体外可以抑制胃癌细胞的增殖和迁移
为了进一步确定Lnc-PLCB1在胃癌中的功能,我们构建了Lnc-PLCB1过表达质粒,同时也设计并合成了特异性靶向Lnc-PLCB1的siRNA,分别转染胃癌细胞48h后qRT-PCR检测干扰和过表达效果,结果显示在胃癌细胞中可以成功敲低和过表达Lnc-PLCB1(图3A-B)。为了探究Lnc-PLCB1在体外对胃癌细胞增殖能力的影响,进行CCK-8实验,结果表明在胃癌细胞中敲低Lnc-PLCB1可以促进胃癌细胞的增殖能力(图3C),而过表达Lnc-PLCB1可以抑制胃癌细胞的增殖能力(图3D)。为了进一步探究Lnc-PLCB1在体外对胃癌细胞增殖能力的影响,进行EdU和克隆形成实验。EdU结果表明,在胃癌细胞中过表达Lnc-PLCB1可以显著降低代表增殖的绿色荧光细胞的比例(图4A)。克隆形成实验表明在胃癌细胞中过表达Lnc-PLCB1可以抑制细胞克隆的形成,而敲低Lnc-PLCB1可以促进胃癌细胞克隆的形成(图4B)。以上结果都表明Lnc-PLCB1在体外可以抑制胃癌细胞的增殖能力。
为了探究Lnc-PLCB1在体外对胃癌细胞的迁移能力的影响,我们对胃癌细胞转染Lnc-PLCB1过表达质粒以及特异性靶向Lnc-PLCB1的siRNA,转染48h后进行Transwell实验。结果表明,在胃癌细胞中过表达Lnc-PLCB1可以抑制胃癌细胞的迁移(图5A),而敲低Lnc-PLCB1以后可以促进胃癌细胞的迁移(图5B)。
3、敲低Lnc-PLCB1可以在体内促进胃癌细胞的增殖和转移
为了探究Lnc-PLCB1在体内是否具有与体外相同的功能,我们构建了稳定敲低Lnc-PLCB1的MKN-45细胞系及其对照细胞系。对MKN-45细胞感染Lnc-PLCB1敲低的慢病毒以及对照慢病毒,随后使用嘌呤霉素对感染病毒的细胞进行筛选,筛选3-4次后通过qRT-PCR实验检测细胞中Lnc-PLCB1的感染效果,发现Lnc-PLCB1的表达水平被明显下调(图6A)。随后使用含有嘌呤霉素的培养基继续对MKN-45细胞培养。以每侧腋窝5x10
为了探究Lnc-PLCB1在体内对胃癌细胞转移的影响,我们将稳定敲低Lnc-PLCB1的MKN-45细胞以及对照细胞按照1×10
4、幽门螺杆菌感染通过IRF2下调Lnc-PLCB1的表达
前面我们的研究表明幽门螺杆菌感染可以下调Lnc-PLCB1的表达,然而其具体机制还尚不清楚。为了探究幽门螺杆菌感染调控Lnc-PLCB1的具体机制,我们首先想要确定调控Lnc-PLCB1表达的核心启动子,通常调控一个基因表达的核心启动子区域位于转录起始位点前500bp内,因此我们通过UCSC网站获取了Lnc-PLCB1转录起始位点上游500bp的序列,随后我们设计了三种启动子截断体并将其插入到pGL3质粒上(图7A),分别命名为T-500、T-300、T-150,随后通过双荧光素酶实验检测这三种截断体的启动子活性,结果表明当删除掉-500~-300片段后可以部分降低启动子活性,而删除-150~0片段后可以完全丧失启动子活性,并且-150~0片段的启动子活性和-500~0片段的启动子活性同样强(图7B),因此我们认为核心启动子区域位于-150~0。随后为了进一步探究调控Lnc-PLCB1的转录因子,我们使用ALGGEN网站预测了与-150~0片段结合的转录因子及其结合位点(图7C),通过阅读文献我们发现转录因子IRF2和FOXA1在胃癌中扮演者抑癌角色,在功能上与Lnc-PLCB1较为符合,因此我们决定对这两个转录因子做进一步研究。为了探究幽门螺杆菌感染对转录因子IRF2和FOXA1表达水平的影响,我们使用幽门螺杆菌菌株Hp11637和Hp26695感染胃癌细胞HGC-27,通过qRT-PCR检测两种转录因子的表达变化,结果表明幽门螺杆菌感染均可以降低IRF2和FOXA1的表达(图7D)。为了确定哪一个转录因子可以激活Lnc-PLCB1核心启动子的转录,我们构建了转录因子IRF2和FOXA1的过表达质粒,转染胃癌细胞HGC-27,48h后通过qRT-PCR检测其过表达效果,结果表明两种质粒均可以在胃癌细胞系中稳定过表达(图7E)。为了检测两种转录因子对Lnc-PLCB1核心启动子区域的转录激活效果,我们分别将两种转录因子的过表达质粒与T-150共转染胃癌细胞系,结果显示只有转录因子IRF2可以在两种胃癌细胞系以及工具细胞293T中增强-150~0片段的转录活性(图7F),因此我们认为转录因子IRF2为Lnc-PLCB1上游转录因子。
ALGGEN网站预测结果表明Lnc-PLCB1核心启动子区域存在一个IRF2结合位点(图8A),为了探究该转录结合位点对Lnc-PLCB1转录调控的影响,我们将该结合位点进行突变,构建了启动子突变质粒(图8A),将pGL3空质粒、启动子突变质粒和野生型质粒分别转染胃癌细胞系和293T细胞系,通过双荧光素酶实验检测三种质粒的荧光素酶活性,结果表明相比于pGL3空质粒,野生型启动子质粒的双荧光素酶活性要明显升高,而突变型启动子质粒的双荧光素酶活性虽然相较于pGL3质粒明显升高,但是要远低于野生型质粒(图8B),这些结果表明IRF2与Lnc-PLCB1的启动子结合位点对Lnc-PLCB1的转录调控至关重要。为了进一步探究转录因子IRF2是否直接结合Lnc-PLCB1的启动子并促进其转录,我们将转录因子IRF2分别与野生型启动子和突变型启动子共同转染293T细胞系,双荧光素酶实验检测IRF2对两种启动子的转录激活能力,结果表明IRF2可以增强两种质粒的双荧光素酶活性,但是对野生型质粒的激活程度要大于突变型质粒(图8C)。为了探究IRF2与Lnc-PLCB1启动子的直接相互作用,我们使用靶向IRF2的抗体进行染色质免疫共沉淀实验,结果表明在胃癌细胞系HGC-27和MKN-45中,转录因子IRF2可以与Lnc-PLCB1的启动子直接相互作用(图8D)。
为了探究幽门螺杆菌感染对IRF2蛋白水平的影响,我们使用不同MOI的幽门螺杆菌感染胃癌细胞系,12h提取蛋白,通过Western blot实验检测蛋白水平的变化,发现幽门螺杆菌感染对IRF2蛋白水平的下调具有浓度依赖性,在MOI=100时最为明显(图9A)。随后为了探究IRF2对Lnc-PLCB1水平的调控,我们对胃癌细胞系转染IRF2过表达质粒,qRT-PCR检测Lnc-PLCB1 RNA水平的变化,结果表明IRF2可以提升Lnc-PLCB1的RNA水平(图9B)。为了研究幽门螺杆菌感染是否通过IRF2调控Lnc-PLCB1的表达,我们使用幽门螺杆菌感染胃癌细胞系并同时对胃癌细胞系转染IRF2过表达质粒进行补救实验,结果表明幽门螺杆菌感染可以下调Lnc-PLCB1的表达,而IRF2的过表达可以补救幽门螺杆菌对Lnc-PLCB1的下调效果(图9D)。随后我们对GSE62254数据集(n=280)所收录的胃癌患者进行Kaplan–Meier生存分析,结果表明IRF2的高表达预示着较好的生存率(图9C左);同时使用TCGA数据库中的数据对IRF2进行胃癌(n=111)和癌旁组织(n=21)差异表达分析,结果表明IRF2在胃癌组织中低表达(图9C右)。我们实验室先前的研究表明幽门螺杆菌可以通过IRF2和METTL14分别在转录层面和转录后层面调控Lnc-PLCB1的表达,因此我们想要探究IRF2和METTL14两者之间是否存在相互调控关系。我们分别对胃癌细胞转染IRF2和METTL14过表达质粒,通过Western blot实验检测两个分子对彼此蛋白水平的调控,结果表明两者在胃癌细胞中并不存在相互调控关系(图9E)。
5、Lnc-PLCB1通过结合DDX21蛋白发挥其抑癌作用
大量研究表明LncRNA可以通过其相互作用蛋白发挥其功能,因此我们猜测Lnc-PLCB1可能通过与蛋白结合而行使其抑癌功能。为了确定与Lnc-PLCB1特异性结合的蛋白,我们首先通过体外转录获得生物素标记的Lnc-PLCB1的正义链和反义链,然后分别将其与胃癌细胞系HGC-27的总细胞提取物进行孵育,通过RNA pull down拉下来与Lnc-PLCB1结合的蛋白,然后通过质谱实验确定所结合的具体蛋白(图10A)。SDS-PAGE偶联银染实验结果显示,Lnc-PLCB1正义链和反义链结合蛋白存在差异条带(图10B),我们对差异条带进行质谱分析,随后根据蛋白的功能以及分子量大小筛选出三个候选蛋白:DDX21,FUBP1,ARHGDIA。为了进一步确定与Lnc-PLCB1特异性结合的蛋白,我们对RNA pull down实验所拉下来的蛋白进行Western blot实验,结果表明Lnc-PLCB1正义链仅与DDX21蛋白存在特异性结合,而Lnc-PLCB1反义链与DDX21蛋白结合能力明显弱于正义链(图10C)。为了进一步确定Lnc-PLCB1与DDX21蛋白两者之间的结合关系,我们使用DDX21特异性抗体进行RNA免疫共沉淀实验,结果表明在胃癌细胞中,DDX21可以与Lnc-PLCB1相互作用(图10D)。为了检测Lnc-PLCB1与DDX21两者在胃癌细胞中的共定位情况,我们使用特异性靶向Lnc-PLCB1的探针以及特异性靶向DDX21的抗体进行荧光原位杂交和免疫荧光共染实验,随后通过共聚焦显微镜对结果进行扫描拍摄,结果表明Lnc-PLCB1与DDX21两者在胃癌细胞中共定位(图10E)。以上结果表明Lnc-PLCB1与DDX21特异性相互作用。
为了确定DDX21在胃癌中的功能,我们首先合成了特异性靶向DDX21的siRNA,转染胃癌细胞48h后通过qRT-PCR实验以及Western blot实验检测DDX21的干扰效果,结果DDX21的RNA水平以及蛋白水平均被明显下调(图11A)。为了探究DDX21对胃癌细胞增殖能力的影响,我们对胃癌细胞HGC-27和MKN-45细胞转染靶向DDX21的siRNA,48h后进行CCK-8实验,结果表明下调DDX21可以抑制胃癌细胞的增殖能力(图11B);为了探究DDX21对胃癌细胞迁移能力的影响,我们进行Transwell实验,结果表明下调DDX21可以明显抑制胃癌细胞的迁移能力(图11C)。随后我们通过TCGA数据库对DDX21在胃癌(n=375)和癌旁正常组织(n=32)中的表达水平进行了分析,结果表明DDX21在胃癌组织中高表达(图11D左);同时我们对GSE224654数据集(n=197)所收录的胃癌患者进行Kaplan–Meier生存分析以评估DDX21表达水平与胃癌患者总生存率之间的关系,结果表明DDX21的高表达预示着较低的生存率(图11D右)。为了进一步探究Lnc-PLCB1是否通过DDX21发挥其抑癌作用,我们进行补救功能试验,我们在胃癌细胞系MKN-45中同时转染特异性靶向Lnc-PLCB1和DDX21的小干扰,进行克隆形成实验以及Transwell实验,结果表明在胃癌细胞中下调Lnc-PLCB1可以促进胃癌细胞的增殖以及迁移能力,而同时下调DDX21的表达可以抑制下调Lnc-PLCB1对胃癌细胞增殖以及迁移能力的促进效果(图12A和图12B)。
6、Lnc-PLCB1可以下调DDX21的蛋白水平进而下调CCND1和Slug
前面我们的研究表明Lnc-PLCB1可以结合DDX21蛋白并且通过其发挥抑癌作用,接下来我们想进一步探究Lnc-PLCB1是如何通过DDX21蛋白行使功能。首先我们检测了Lnc-PLCB1对DDX21蛋白水平的影响,Western blot实验结果表明,在胃癌细胞系中下调Lnc-PLCB1后可以上调DDX21的蛋白水平,而过表达Lnc-PLCB1后可以下调DDX21的蛋白水平(图13A)。随后我们又检测了Lnc-PLCB1对DDX21 mRNA水平的影响,qRT-PCR实验结果表明Lnc-PLCB1并不影响DDX21的RNA水平(图13B)。由于Lnc-PLCB1的水平受到幽门螺杆菌感染的调控,为了探究幽门螺杆菌感染对DDX21蛋白水平的影响,我们使用幽门螺杆菌菌株Hp11637和Hp26695感染胃癌细胞系,12h后提取蛋白通过Western blot实验检测DDX21蛋白水平的变化,结果表明幽门螺杆菌感染可以上调DDX21的蛋白水平(图13C)。
有研究表明DDX21可以作为转录因子调控下游分子的变化,为了进一步探究受DDX21调控的下游分子,我们在胃癌细胞中敲低DDX21的水平,随后通过qRT-PCR检测下游分子的变化。我们检测了DDX21对增殖相关分子(如CCND1、CDK1、CEP55等)以及上皮间质转化相关分子(如Slug、Vimentin、Twist等)表达水平的影响,结果表明下调DDX21的表达可以稳定下调CCND1和Slug的表达(图13D)。同时我们使用GEPIA网站数据分析了DDX21与CCND1及Slug在胃癌中的表达情况,结果表明在胃癌中DDX21与两者的表达水平分别呈正相关(图13D)。以上结果表明Lnc-PLCB1可以下调DDX21的蛋白表达进而下调CCND1和Slug的水平。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 长链非编码RNA LINC02481在抑制胃癌细胞增殖和促进胃癌细胞凋亡中的应用
- 长链非编码RNA LINC02481在抑制胃癌细胞增殖和促进胃癌细胞凋亡中的应用
