一种猪流行性腹泻亚单位疫苗及其制备方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及疫苗制剂技术领域,具体涉及一种猪流行性腹泻亚单位疫苗及其制备方法和应用。
背景技术
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于冠状病毒科冠状病毒Alphacoronavirus属,是猪流行性腹泻(Porcine epidemic diarrhea,PED)的病原体。该疾病具有发病快、传染性强、死亡率高的特点,并以急性水样腹泻、呕吐和脱水为主要症状。目前,PEDV在全球养猪业中仍普遍存在,严重影响畜牧业健康发展,使得PEDV等冠状病毒的致病机制及其防控成为研究人员关注的重点。
接种疫苗是目前防控PED的主要手段之一。目前市面上售卖的猪流行性腹泻疫苗主要都是传统的PEDV灭活疫苗和弱毒疫苗。PEDV灭活疫苗是通过加热或者化学试剂使PEDV活病毒失活并配合佐剂使用的一种疫苗。灭活疫苗安全性更高且易于产业化。但是,在病毒灭活过程中,抗原的免疫原性可能会有一定损伤,灭活疫苗存在免疫持续期短、需要多次免疫等局限,通常需要多次免疫。与灭活疫苗相比,减毒疫苗免疫原性更强,通常单次免疫就可产生足够的免疫保护。但是,减毒疫苗最大的危害是存在退化为野生型毒株的风险,因此限制了减毒疫苗的适用性。
发明内容
本发明的目的在于提供一种猪流行性腹泻亚单位疫苗及其制备方法和应用,以解决上述现有技术存在的问题,本发明提供的疫苗具有安全性高、免疫原性好、批次间稳定、生产成本低等优点,能够用于防治猪流行性腹泻。
为实现上述目的,本发明提供了如下方案:
本发明提供一种重组猪流行性腹泻病毒亚单位疫苗,所述亚单位疫苗包括如下任一项所示的组合:
(1)S蛋白和药学上可接受的免疫佐剂;
(2)S1蛋白和药学上可接受的免疫佐剂;
(3)COEs三聚体和药学上可接受的免疫佐剂。
进一步地,所述S蛋白的氨基酸序列如SEQ ID NO.1所示;所述S1蛋白的氨基酸序列如SEQ ID NO.2所示;所述COEs三聚体的氨基酸序列如SEQ ID NO.3所示。
进一步地,所述免疫佐剂为M401佐剂,所述S蛋白、所述S1蛋白和所述COEs三聚体分别按照体积比1:1与所述M401佐剂混合制备亚单位疫苗;所述S蛋白、所述S1蛋白和所述COEs三聚体的浓度均为100μg/mL。
进一步地,所述免疫佐剂为M103佐剂,所述S蛋白、所述S1蛋白和所述COEs三聚体分别按照质量比1:1与所述M103佐剂混合制备亚单位疫苗;所述S蛋白、所述S1蛋白和所述COEs三聚体的浓度均为100μg/mL。
本发明还提供了所述亚单位疫苗的制备方法,包括如下步骤:
(1)利用编码S蛋白、S1蛋白和COEs三聚体的基因构建重组表达载体;
(2)将所述重组表达载体转入真核细胞表达,分别获取S重组蛋白、S1重组蛋白以及COEs三聚体重组蛋白;
(3)将S重组蛋白、S1重组蛋白以及COEs三聚体重组蛋白分别与佐剂混合,室温搅拌获取亚单位疫苗。
进一步地,步骤(2)所述真核细胞为哺乳动物细胞。
本发明还提供了所述亚单位疫苗在制备治疗猪流行性腹泻的药物中的应用。
本发明公开了以下技术效果:
本发明通过将表达PEDV S蛋白、S1蛋白以及多个截短片段的功能表位(NTD、COE和B细胞表位)的基因串联蛋白,并进一步添加Fd结构域,构建真核表达质粒,通过真核表达系统高效表达重组蛋白,利用该真核表达系统表达的重组蛋白纯化工艺简便,产量高,便于大规模生产。
本发明利用HEK 293F悬浮表达系统得到的重组蛋白制备了亚单位疫苗,通过实验验证该疫苗具有安全性高、免疫原性好、批次间稳定、生产成本低,能够诱导小鼠和仔猪产生良好的免疫反应等优点,可以有效地预防或治疗猪流行性腹泻。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是重组质粒图谱;其中A是重组质粒pPEDV-COEs,B是重组质粒pPEDV-S,C是重组质粒pPEDV-S1;
图2是通过间接免疫荧光检测重组真核表达质粒pPEDV-S、pPEDV-S1和pPEDV-COEs在293T细胞中表达情况的结果;A是真核表达质粒pPEDV-S在293T细胞中表达情况,B是真核表达质粒pPEDV-S1在293T细胞中表达情况,C是真核表达质粒pPEDV-COEs在293T细胞中表达情况,D为pcDNA3.1对照;
图3是通过Western blot检测重组真核表达质粒pPEDV-S、pPEDV-S1和pPEDV-COEs在293T细胞中表达情况的结果图;其中M是蛋白质分子量标准;泳道1-4分别是PEDV S1、PEDV COEs、PEDV S和对照的培养基;泳道5-8分别是PEDV S1、PEDV COEs、PEDV S和对照的胞内裂解液;
图4是PEDV S蛋白纯化结果,a)为SDS-PAGE验证图,b)为NGC色谱图,M是蛋白质分子质量标准,泳道1为细胞破碎后原液,泳道2为流穿液,泳道3-4为20mM Binding Buffer第4ml和第5ml,泳道5-7为100mM Binding Buffer第4-6ml,泳道8-14为500mM ElutionBuffer第2-8ml;
图5是PEDV S1蛋白纯化结果,a)为SDS-PAGE验证图,b)为NGC色谱图,M是蛋白质分子质量标准,泳道1为细胞破碎后原液,泳道2为流穿液,泳道3-4为20mM Binding Buffer第4ml和第5ml,泳道5-7为100mM Binding Buffer第4-6ml,泳道8-14为500mM ElutionBuffer第2-8ml;
图6是PEDV COEs蛋白纯化结果,a)为SDS-PAGE验证图,b)为NGC色谱图,M是蛋白质分子质量标准,泳道1为细胞破碎后原液,泳道2为流穿液,泳道3-4为20mM Binding Buffer第4ml和第5ml,泳道5-7为100mM Binding Buffer第4-6ml,泳道8-14为500mM ElutionBuffer第2-8ml;
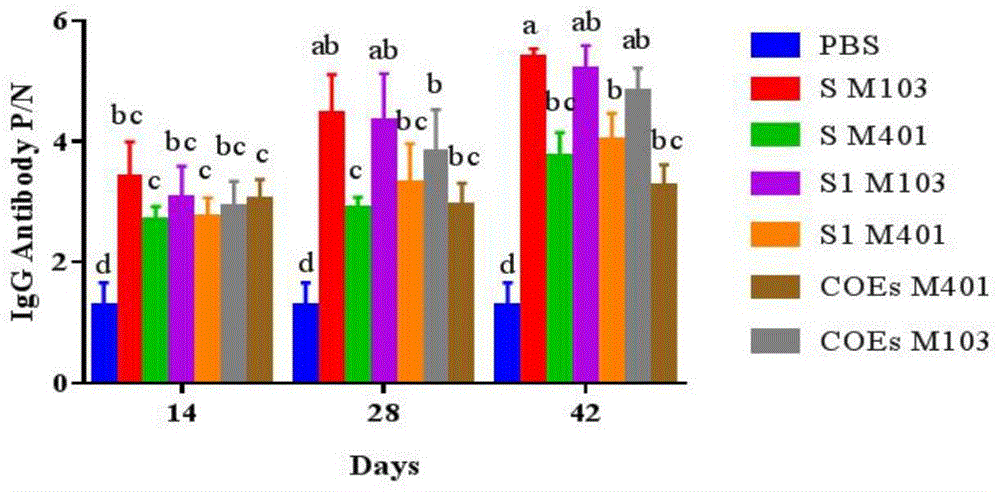
图7是用本发明实施例3的重组蛋白制备疫苗免疫后小鼠血清中IgG抗体检测结果;
图8是疫苗免疫后小鼠血清中和抗体效价检测结果;
图9是通过流式细胞术检测小鼠脾淋巴细胞CD3
图10是通过流式细胞术检测小鼠脾淋巴细胞CD3
图11是通过流式细胞术检测小鼠脾淋巴细胞CD3
图12是通过流式细胞术检测小鼠脾淋巴细胞CD3
图13是通过流式细胞术检测小鼠脾淋巴细胞B220
图14是通过流式细胞术检测小鼠脾淋巴细胞B220
图15是通过流式细胞术检测小鼠脾淋巴细胞CD3
图16是通过流式细胞术检测小鼠脾淋巴细胞CD3-CD49b
图17是通过CCK-8法检测小鼠脾淋巴细胞相对增值率的结果;
图18是小鼠细胞因子IFN-γELISA检测结果;
图19是小鼠细胞因子IL-4ELISA检测结果;
图20是用本发明实施例的重组蛋白制备疫苗免疫后仔猪血清中IgG抗体检测结果;
图21是疫苗免疫后仔猪血清中和抗体效价检测结果;
图22是通过CCK-8法检测仔猪PBMC相对增值率的结果;
图23是仔猪细胞因子IFN-γmRNA相对表达量的检测结果;
图24是仔猪细胞因子IL-4mRNA相对表达量的检测结果;
图25是仔猪细胞因子IFN-γELISA检测结果;
图26是仔猪细胞因子IL-4ELISA检测结果。
具体实施方式
现详细说明本发明的多种示例性实施方式,实施例中方法如无特殊说明均采用常规方法,使用试剂如无特殊说明,均为常规市售试剂或采用常规方法配置的试剂。该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
术语“猪流行性腹泻病毒S蛋白”是猪流行性腹泻病毒的主要结构蛋白之一,由1383个氨基酸组成。S蛋白是负责病毒附着、受体结合和进入的主要包膜糖蛋白,依据与其他冠状病毒S蛋白的同源性,也可以把猪流行性腹泻病毒S蛋白分为负责介导病毒和细胞表面受体附着的S1亚基(1~725aa)以及参与病毒和宿主细胞膜融合的S2亚基(726~1383aa)。
本发明的重组蛋白中S蛋白的截短片段优选选自S蛋白的S1亚基中具有唾液酸结合活性的N端结构域(NTD)、中和表位域(COE)以及S2亚基中的多个B细胞识别表位。
在下文的描述中,所涉及的方法如无特别说明,则均为本领域的常规方法。所涉及的原料如无特别说明,则均是能从公开商业途径获得的原料。
实施例1构建用于真核表达重组蛋白的重组质粒
本实施例以PEDVAH2012/12株S基因序列(GenBank:KU646831.1)为基础,通过南京金斯瑞生物科技有限公司合成如SEQ ID NO.4所示DNA序列的基因,记为S。该基因S中包含S蛋白全长基因(aa1-1383)以及T4噬菌体纤维蛋白折叠(Fd)三聚结构域片段。
将合成的基因通过常规的分子生物学手段克隆到质粒载体pcDNA3.1中,构建得到用于表达PEDV S三聚体重组蛋白的重组质粒pPEDV-S,图1A示出了重组质粒pPEDV-S的图谱。
以重组质粒pPEDV-S为基础,扩增负责病毒和宿主细胞受体结合的S1基因(aa1-730)、Fd三聚结构域和pcDNA3.1载体的融合片段,通过同源重组,构建表达PEDV S1三聚体重组蛋白的重组质粒pPEDV-S1,图1B示出了重组质粒pPEDV-S1的图谱。
以实验室保存的重组质粒pcDNA3.1-S1-Fc为基础,扩增PEDV S截短片段以及FD三聚结构域,S基因截短片段包括S1亚基中具有唾液酸结合活性的N末端结构域(NTD,aa19~233)、中和抗原核心区域(COE,aa499~638)以及S2亚基中的B细胞识别表位(aa747~774),这三个截短片段通过接头多肽(linker)依次串联。之后将扩增片段与质粒载体pcDNA3.1同源重组,构建得到用于表达PEDV COEs三聚体重组蛋白的重组质粒pPEDV-COEs,图1C示出了重组质粒pPEDV-COEs的图谱。
将重组质粒pPEDV-S、S1和COEs转化大肠杆菌Trans5α感受态细胞构建得到用于扩增重组质粒pPEDV-S、S1和COEs的重组大肠杆菌。将重组大肠杆菌接种到含有100μg/mL氨苄青霉素的LB液体培养基中,于37℃、200rpm的条件下在恒温振荡培养箱培养8h,用OmegaBio-Tek公司小提质粒试剂盒从培养物中提取并纯化重组质粒pPEDV-S、S1和COEs。
转染试剂Lipofectamine3000(购自Invitrogen公司)将纯化得到的重组质粒pPEDV-S、S1和COEs转染293T细胞,同时转染质粒载体pcDNA3.1作为阴性对照,通过Westernblot和间接免疫荧光方法检测PEDV S、S1和COEs蛋白的表达。
Westernblot具体步骤如下:
(1)pPEDV-S、S1、COEs和pcDNA3.1空载体质粒转染293T细胞后,48h时分别收取对应细胞和未处理293T细胞;
(2)24孔板中的细胞用PBS轻柔洗涤2-3遍;
(3)每孔加入含PMSF的RIPA裂解液100μL裂解细胞,室温裂解5min,5000rpm离心5min,收集上清;
(4)取40μL上清、细胞裂解液上清与10μL 5×Loading Buffer混合均匀后,100℃金属浴10min;
(5)根据蛋白大小,配置分离胶为10%、浓缩胶为5%的SDS-PAGE胶;
(6)SDS-PAGE电泳:浓缩胶使用90V电压电泳,分离胶使用120V电压电泳,溴酚蓝到达底部后,停止电泳;
(7)将滤纸和NC膜浸泡在转膜缓冲液中,将凝胶切开,使用三明治结构,依次按照滤纸、NC膜、凝胶、滤纸顺序放入半干法转印槽中进行转膜;
(8)转膜后将含有目的蛋白的NC膜浸入5%脱脂奶粉的封闭液中,置于摇床上60rpm,室温2h;
(9)加入PBST浸满NC膜,80rpm洗涤,洗涤三次,每次10min;
(10)使用PBS将His标签抗体按照1:10000稀释,置于摇床上60rpm孵育2h;
(11)加入PBST浸满NC膜,80rpm洗涤,洗涤三次,每次10min;
(12)使用PBS将HRP标记的羊抗鼠IgG抗体按照1:10000稀释,置于摇床上60rpm孵育1h;
(13)加入PBST浸满NC膜,80rpm洗涤,洗涤三次,每次10min;
(14)使用天能化学发光试剂1:1混合后均与覆盖于膜上,利用化学发光成像仪立即显色观察。
间接免疫荧光具体步骤如下:
(1)pPEDV-S、S1、COEs和pcDNA3.1空载体质粒转染293T细胞后,48h时分别弃培养基,使用PBS轻柔洗涤细胞2-3次,避免将细胞吹起;
(2)每孔加入500μL预冷的无水乙醇固定细胞,置于4℃冰箱固定30min;
(3)每孔加入1mLPBS清晰细胞,洗涤2-3次;
(4)使用PBS按照1:500稀释His标签抗体,每孔加入200μL,37℃孵育1h;
(5)每孔加入1mLPBS清晰细胞,洗涤2-3次;
(6)避光使用PBS按照1:500稀释FITC标记的羊抗鼠IgG抗体,每孔加入200μL,37℃避光孵育1h;
(7)每孔加入1mLPBS清晰细胞,洗涤2-3次;
(8)使用倒置荧光显微镜观察荧光情况。
结果如图2所示,转染重组质粒pPEDV-S、S1和COEs的培养孔表现出明显的特异性荧光反应,而转染质粒载体pcDNA3.1的对照孔没有表现出荧光反应,表明上述构建重组质粒pPEDV-S、S1和COEs能够成功地在293T细胞中成功表达目的蛋白;如图3所示,三种重组质粒均能在293T中表达,其中PEDV S和PEDV COEs蛋白表达在胞内,PEDV S1蛋白有一部分分泌到培养基中,大部分蛋白表达在胞内。
实施例2制备真核表达的重组蛋白
本实施例通过HEK 293F表达系统来制备大量的重组蛋白。本实施例所用的Sinofection转染试剂盒购自Sino Biological公司。
具体操作如下:
(1)按照活细胞密度0.3-0.4×10
(2)培养3-4天,取部分细胞悬液与4%胎盘蓝1:1混合,取10μL混合液加到细胞计数板中,使用自动细胞计数仪检测活细胞密度及存活率。活细胞密度达到3-5×10
(3)培养过夜的细胞,测细胞密度及存活率;活细胞密度须达到3.5-5.5×10
(4)每个处理组准备两个离心管,按照表2-7加入转染体系;
(5)A、B管分别轻柔混匀后,室温作用5min;
(6)混合A、B管,混匀后室温作用10min;
(7)每个细胞孔加入3mL对应的转染混合物;
(8)置于37℃、5%CO
(9)细胞培养2-4天,检测细胞存活率,根据摸索出的蛋白最佳表达时间收取蛋白,收样时细胞存活率不低于60%;
(10)2000rpm离心分离培养基和细胞,胞内蛋白收集细胞,用于后续纯化。
表1 293F细胞转染体系(培养体系为60mL)
接下来,采用HisTrap
(1)蛋白收集:转染后的细胞离心收集后,使用Binding Buffer重悬,利用高压破碎仪破碎细胞;破碎后蛋白溶液12000rpm离心3min,弃去细胞碎片,收集蛋白溶液;
(2)清洗:5CV的ddH
(3)柱平衡:5CV的Binding Buffer经0.22μm滤膜后过HisTrap
(4)上样:蛋白溶液经0.45μm滤膜后过HisTrap
(5)洗杂:5CV的Binding Buffer经0.22μm滤膜后过HisTrap
(6)洗杂:3CV的100mM Elution Buffer经0.22μm滤膜后过HisTrap
(7)洗脱:10CV的500mM Elution Buffer经0.22μm滤膜后过HisTrap
(8)清洗:10CV的Binding Buffer经0.22μm滤膜后过HisTrap
(9)清洗:10CV的ddH
(10)保存:10CV的20%乙醇经0.22μm滤膜后过HisTrap
(11)蛋白浓度测定:使用Bradford试剂盒检测蛋白浓度,5μL不同浓度的标准品及待测洗脱液样品与250μL G250染色液在96孔板中混合均匀,利用酶标仪检测波长570nm下的OD值;根据标准品蛋白浓度与标准品OD
(12)取40μL不同阶段的收集液与10μL 5×Loading Buffer混合煮沸,进行SDS-PAGE电泳和Western blot分析。Western blot方法同实施例1中的“Western blot具体步骤”;SDS-PAGE在电泳后,切下凝胶,使用G250染色液浸满凝胶,置于摇床上30rpm,室温孵育3h;换脱色液脱色,摇床30rpm脱色,勤换脱色液至条带清晰、背景透明为止;
(13)将含有目的蛋白的洗脱液经PD-10脱盐柱脱盐,脱盐柱平衡后,将2.5mL蛋白加入到脱盐柱中,流穿后加入3.5mL缓冲液,收集流出液;
(14)将脱盐后的蛋白溶液经超滤管浓缩,储存于-80℃。
结果如图4所示,表明使用HEK 293F真核表达系统能够成功表达出大量的重组蛋白,并且亲和层析初步纯化,捕获目的蛋白。
用Bradford试剂盒测得纯化后重组蛋白的浓度为0.79mg/mL。
实施例3免疫小鼠疫苗制备
分别使用市售的M401佐剂和M103佐剂与实施例2制备纯化的重组蛋白混合来制备亚单位疫苗。
将实施例2中纯化的重组蛋白与M103佐剂按质量比1:1混合制得S/M103、S1/M103和COEs/M103疫苗组合,于4℃保存备用。将M401佐剂按照1:1.5使用Tris-HCl缓冲液稀释,将实施例2中纯化的重组蛋白与稀释后M401佐剂按体积比1:1混合并室温低速搅拌30min,制得S/M401、S1/M401和COEs/M401疫苗组合,于4℃保存备用。
实施例4亚单位疫苗的小鼠免疫原性评价
取56只6-8周龄BALB/c雌性小鼠(购自扬州大学实验动物中心),随机分为7组,其中包括六组疫苗组和对照组,每组8只小鼠,免疫计划如表2所示。
表2动物实验免疫计划
每只小鼠免疫200μL,其中试验组含抗原20μg,共免疫3次,免疫间隔两周。分别于首免前和首免14d、28d对小鼠进行眼眶静脉丛采血,于首免后42d对小鼠进行眼球采血。将采集的全血静置于37℃1h,然后分离血清,标记清楚,保存于-20℃。
第42天测定抗体效价,适时进行全部小鼠眼球采血,分离血清,进行抗体IgG以及中和效价的测定;分离脾脏淋巴细胞,进行细胞增殖、CD3
1.ELISA检测免疫小鼠血清IgG抗体
利用间接ELISA法检测免疫前和首免后14d、28d、42d的血清,以PEDV S蛋白为抗原,具体步骤如下:
(1)利用Bradford试剂盒检测PEDV-S蛋白浓度,使用包被缓冲液稀释蛋白浓度至2ng/μL,100μL/孔加入到聚苯乙烯微量滴定板中,4℃过夜;
(2)第二天弃孔内液体,PBST每孔250μL,静置2min,洗涤3次,拍干;
(3)每孔加入200μL封闭液,37℃静置封闭2h;
(4)弃孔内液体,PBST每孔250μL,静置2min,洗涤3次,拍干;
(5)在血清稀释板中按照1:50稀释血清,100μL/孔加入到聚苯乙烯微量滴定板中,同时设置空白对照孔,37℃静置孵育1h;
(6)弃孔内液体,PBST每孔250μL,静置2min,洗涤3次,拍干;
(7)PBS按照1:5000稀释HRP标记的羊抗鼠IgG抗体,100μL/孔加入到聚苯乙烯微量滴定板中,37℃静置孵育1h;
(8)弃孔内液体,PBST每孔250μL,静置2min,洗涤3次,拍干;
(9)每孔避光加入100μL TMB显色液,室温避光孵育5-10min;
(10)每孔加入50μL终止液,使用酶标仪读取波长450nm的OD值;
(11)样品P/N值根据公式1计算:
P/N=(Sample OD
结果如图7所示,结果表明免疫六组疫苗组合的小鼠血清IgG抗体水平均明显高于PBS组及空白组,并且M103佐剂疫苗组的小鼠血清IgG抗体水平明显高于M401佐剂疫苗组,PEDV S蛋白疫苗组IgG抗体水平高于其余两抗原组,PEDV S/M103疫苗组合诱导小鼠产生的IgG抗体水平最高。
2.免疫小鼠血清中和实验
2.1病毒TCID
(1)长满的Vero细胞按照1:3传代密度铺板96孔板;
(2)24h后待细胞长满单层,进行病毒TCID
(3)用5μg/mL含胰酶的DMEM培养基稀释病毒,按照10倍比稀释,从10
(4)弃掉96孔板中的培养基,PBS每孔100μL,清洗3遍;
(5)弃净PBS后,每孔加入100μL稀释好的病毒液,每个稀释度重复8孔,对照孔加入100μL 5μg/mL含胰酶的DMEM培养基维持;
(6)每日观察病变并记录,一般观察5天左右,按照Reed-Muench两氏法或者Karber法计算结果。
2.2血清中和试验
小鼠所有血清均须检测,以一份血清为例,具体步骤如下:
(1)长满的Vero细胞按照1:3传代密度铺板96孔板;
(2)24h后待细胞长满单层,进行血清中和效价测定;
(3)小鼠血清56℃水浴灭活30min;
(4)DMEM培养基按照2倍比稀释血清,从2
(5)DMEM培养基稀释病毒至100TCID
(6)50μL稀释好的病毒液分别于50μL稀释好的血清混合均匀,每个血清稀释度重复两孔,37℃中和1h;病毒对照孔加入50μL稀释好的病毒液和50μLDMEM培养基;
(7)长满单层的细胞,弃掉96孔板中的培养基,PBS每孔100μL,清洗2遍;
(8)弃净PBS后,每孔加入100μL中和后的血清病毒混合液,每个稀释度重复2孔,细胞对照孔加入100μL DMEM培养基维持,37℃孵育2h;
(9)弃孔内液体,PBS每孔100μL,清洗2遍,含5μg/mL胰酶的DMEM培养基每孔100μL,清洗1遍;
(10)含5μg/mL胰酶的DMEM培养基每孔100μL维持;
(11)每日观察病变并记录,一般观察5天左右,按照Reed-Muench两氏法或者Karber法计算结果。
结果如图8所示,PEDV S/M103组显著高于其余各组,平均效价达到1:96,其次PEDVS1/M103组和PEDV COEs/M103组效价在1:32,M401佐剂组效价略低于1:32。三免后PEDV S/M103亚单位疫苗诱导的中和抗体效价最好,M103佐剂诱导中和抗体的效果优于M401佐剂。
3.脾淋巴细胞的制备
(1)首免42d后,所有小鼠脱颈处死,浸泡于中75%乙醇5-10min以消毒;
(2)于超净台中,解剖小鼠,小鼠侧卧于无菌平皿中,打开小鼠左侧背腹部皮肤,取出脾脏;脾脏浸泡于不含血清的RPMI-1640(即不完全1640)培养基中;
(3)取无菌50mL离心管,40μm细胞筛网置于离心管上,将脾脏置入细胞筛网上,加入少量不完全1640培养基,使用5mL无菌注射器活塞顶部研磨脾脏;
(4)加入3-4mL不完全1640培养基冲洗筛网和注射器活塞顶部;
(5)收集细胞悬液,1500rpm离心10min;
(6)弃上清,加入5mL红细胞裂解液,重悬细胞,37℃裂解5min,1500rpm离心10min;
(7)弃上清,加入5mL不完全1640培养基,重悬细胞,1500rpm离心10min;
(8)弃上清,加入1mL含有10%FBS和1%三抗的完全1640培养基,重悬细胞,将细胞悬液转移到1.5mL离心管中,获得脾脏淋巴细胞。
4.流式细胞术检测脾淋巴细胞亚型
(1)调整上述制备好的脾细胞密度为1×10
(2)弃上清,加入1mLPBS重悬细胞,1500rpm离心5min;
(3)根据流式荧光抗体浓度,用PBS稀释抗体;
(4)弃离心管中的上清,1份细胞使用300μL含有PE anti-mouse CD4、APC anti-mouse CD8a和FITC anti-mouse CD3e荧光抗体的PBS重悬,一份细胞使用300μL含有APCanti-mouse CD49b和FITC anti-mouse CD3e荧光抗体的PBS重悬,一份细胞使用300μL含有Percp-cy5.5 anti-mouse B220和FITC anti-mouse CD19荧光抗体的PBS重悬,4℃避光孵育30min;
(5)1500rpm离心5min,弃抗体,加入1mLPBS重悬细胞,洗涤两次,1500rpm离心5min;
(6)弃上清,用500μL PBS重悬细胞,使用BD Accuri
图9和图10示出了CD3
图11和图12示出了CD3
图13和图14示出了B220
图15和图16示出了CD3
5.CCK-8法检测小鼠脾淋巴细胞增殖
(1)将上述分离出来的脾细胞按照10
(2)待细胞贴壁后,每只小鼠脾细胞4个孔,其中三个孔每个孔加入ConA至终浓度为10μg/mL,剩余1孔不处理为对照;
(3)培养72h后,刺激组每孔轻柔吸出50μL,用于后续细胞因子检测;对照组每孔轻柔吸出50μL,弃掉;
(4)每孔加入10μL CCK-8试剂,于37℃孵育2-3h;使用酶标仪读取450nm的OD值;
(5)根据公式2计算脾淋巴细胞刺激指数(Stimulation index)。
淋巴细胞刺激指数=(A-C)/(B-C)×100%(公式2)
式中:A为刺激后的OD
结果如图17所示,首免后42天,所有实验组与PBS组相比,均有增殖。其中,PEDV S/M103组增殖最显著,显著高于PBS组(P<0.0001)、PEDV COEs/M401组(P<0.01)和PEDV S1/M401组(P<0.05)。M103佐剂组增殖指数均高于M401组,PEDV S蛋白组高于PEDV S1和COEs蛋白组。由此说明,PEDV S/M10亚单位疫苗诱导小鼠产生了细胞免疫应答,M103佐剂诱导细胞免疫的水平高于M401佐剂。
6.小鼠细胞因子的检测
将上述收集的培养基用于IL-4、IFN-γ细胞因子进行检测。
按照酶免小鼠IL-4酶联免疫分析试剂盒说明书对上清IL-4浓度进行检测。
按照酶免小鼠IFN-γ酶联免疫分析试剂盒说明书对上清IFN-γ浓度进行检测。
图18示出了IFN-γ的检测结果,首免42天后,各实验组IFN-γ分泌水平均显著高于PBS组(P<0.0001)。PEDV S1/M103组IFN-γ含量最高,浓度达788pg/mL,显著高于PEDVS/M401组(P<0.05)、PEDV S1/M401组(P<0.0001)、PEDV COEs/M401组(P<0.0001)和PEDVCOEs/M103组(P=0.01),与PEDV S/M103组无显著差异。所有抗原中,M103佐剂组均略高于M401组。由此说明,M103佐剂诱导分泌IFN-γ的水平优于M401佐剂,PEDV S/M103和PEDVS1/M103亚单位疫苗诱导分泌IFN-γ效果较好。
图19示出了IL-4的检测结果,首免42天后,各实验组IL-4分泌水平均显著高于PBS组(P<0.0001)。PEDV S1/M103组IL-4含量最高,浓度达163pg/mL,显著高于PEDV S1/M401组和PEDV COEs/M103组(P<0.05),其余实验组间无显著差异。PEDV S和COEs蛋白中,M401佐剂组略高于M103组。说明6种亚单位疫苗均可诱导IL-4的分泌,抗原和佐剂之间无显著差异。
本发明通过构建真核表达质粒,能够在包括293细胞系在内的哺乳动物细胞系中高效表达三种重组蛋白,利用重组蛋白制备的六种亚单位疫苗免疫小鼠后能够产生较高水平的抗体。血清中和实验结果表明本发明的亚单位疫苗能够有效地刺激产生中和抗体,可以起到较好的保护作用。脾脏淋巴细胞亚型比例及细胞因子的检测结果表明,本发明的六种亚单位疫苗可以有效诱导免疫小鼠产生细胞免疫应答,调节先天免疫。其中,PEDV S/M103组免疫效果优于其他组别。进一步采用PEDV S/M103免疫仔猪。
实施例5免疫仔猪疫苗制备
使用市售的M103佐剂与实施例2制备纯化的PEDV S重组蛋白混合来制备亚单位疫苗。
将实施例2中纯化的重组蛋白与M103佐剂按质量比1:1混合制得S/M103疫苗组合,于4℃保存备用。
实施例6亚单位疫苗的仔猪免疫原性评价
制备好的疫苗免疫3-5日龄的仔猪。将10头3-5日龄的仔猪随机分成2组,每组5头。其中,PBS对照组5头,试验组每组5头。具体免疫方案如表3所示:
表3 PEDV S蛋白免疫仔猪分组
每头仔猪免疫2mL,其中试验组含抗原200μg,共免疫2次,免疫间隔两周。分别于首免前和首免14d、28d、42d对仔猪进行前胸腔静脉丛采血。将采集的全血静置于37℃1h,然后分离血清,标记清楚,保存于-20℃。
第42天测定抗体效价,进行抗体IgG以及中和效价的测定;第24天对仔猪进行前胸腔静脉丛采血,并分离外周血单核细胞(PBMC),进行细胞增殖,对采集PBMC细胞培养上清进行IL-4和IFN-γ细胞因子测定,对刺激后的PBMC细胞进行IL-4和IFN-γ细胞因子的转录水平测定。
1.ELISA检测免疫仔猪血清IgG抗体
方法同实施例4中的“1.ELISA检测免疫小鼠血清IgG抗体”,二抗更换为HRP标记的羊抗猪抗体,按照1:10000稀释,其余相同。
结果如图20所示,免疫前和首免14d后的血清IgG水平与PBS组无差异,首免28d即二免14d较免疫前IgG抗体显著提高(P<0.01),首免42d即二免后28d较免疫前IgG抗体同样有所提高(P<0.05),较二免后14d稍有降低。说明,二免后PEDV S/M103亚单位疫苗可以诱导机体产生IgG抗体,随着时间增加,IgG抗体略降低。
2.免疫仔猪血清中和实验
方法同实施例4中的“2.免疫小鼠血清中和实验”
结果如图21所示,免疫前血清和PBS组均未产生中和抗体,首免14d仔猪血清中和抗体在1:8,首免后28d中和抗体效价达到1:32,首免42d仔猪血清中和抗体效价维持在1:32。说明,PEDV S/M103亚单位疫苗可以诱导仔猪的中和抗体,并且短期内不会迅速下降。
3.免疫仔猪外周血单核细胞(PBMC)的分离
首免24d后,对仔猪进行前胸腔静脉丛采血,全血收集于抗凝管中,按照猪外周血单核细胞分离液试剂盒说明书分离PBMC。
4.CCK-8法检测PBMC增殖
将上述分离的PBMC按照实施例4中的“5.CCK-8法检测小鼠脾淋巴细胞增殖”,使用CCK-8法检测细胞增殖。并且于72h后收集部分培养基上清用于后续细胞因子检测。
结果如图22所示,免疫PEDV S/M103组仔猪的PBMC增殖指数显著高于PBS组(P<0.01),说明PEDV S/M103疫苗可以诱导仔猪的细胞免疫应答。
5.仔猪细胞因子检测
5.1荧光定量检测细胞因子mRNA表达水平
(1)将步骤“3.免疫仔猪外周血单核细胞(PBMC)的分离”获得的PBMC细胞悬液稀释成10
(2)待细胞贴壁后,加入ConA蛋白刺激,终浓度10μg/mL,于37℃、5%CO
(3)弃培养基,收取细胞,根据Vazyme公司细胞/组织总RNA提取试剂盒提取RNA;
(4)28μLRNA加入7μL 5×
(5)qPCR分别检测GAPDH、IL-4和IFN-γ拷贝数;引物序列见表4,qPCR体系见表5,qPCR程序见表6;
(6)相对表达量根据公式3计算:
相对表达量=2
表4仔猪细胞因子荧光定量PCR引物序列
表5 qPCR扩增体系
表6 qPCR程序
结果如图23和图24。下图可以看到在免疫组的PBMC胞内都检测到IL-4和IFN-γ的高表达,IFN-γ的相对表达量是PBS组的9.6倍(P<0.0001),IL-4的相对表达量是PBS组的103.27倍(P<0.0001)。qRT-PCR结果表明PEDV S/M103亚单位疫苗可以刺激仔猪产生高水平的IL-4和IFN-γ。
5.2ELISA检测细胞因子分泌水平
检测步骤,按照酶免猪IL-4和IFN-γ酶联免疫分析试剂盒说明书操作。
结果如图23和图24。实验组分泌的IL-4浓度为83.86pg/mL(P<0.0001),分泌的IFN-γ浓度为64.59pg/mL(P<0.01),分泌水平均显著高于PBS组。ELISA结果同样证明PEDVS/M103亚单位疫苗可以刺激仔猪产生IL-4和IFN-γ。
本发明构建了PEDV S、PEDV S1和PEDV COEs三种不同结构的PEDV S真核表达质粒,通过HEK 293F悬浮真核表达系统表达并纯化获得三种重组蛋白,分别与M401佐剂和M103佐剂混合,制备亚单位疫苗。小鼠实验验证得出六种亚单位疫苗均可产生较高的免疫原性,其中PEDV S/M103组免疫效果优于其他组别。进一步采用PEDV S/M103免疫仔猪,发现该亚单位疫苗可刺激仔猪产生免疫应答,有效诱导中和抗体,为PEDV亚单位疫苗的研发奠定了基础。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 杆状病毒表达的猪瘟E2亚单位疫苗的制备方法及应用
- 猪伪狂犬病毒gD蛋白的制备方法及猪伪狂犬病毒亚单位疫苗和应用
- 一种猪流行性腹泻病毒的反转录聚合酶螺旋反应等温检测试剂及检测方法
- 一种猪流行性腹泻病毒的纯化方法
- 一种猪流行性腹泻重组杆状病毒基因工程亚单位疫苗及其制备方法与应用
- 一种猪流行性腹泻重组杆状病毒基因工程亚单位疫苗及其制备方法与应用
