一种用于加强慢病毒载体稳定性的保护剂及其用途
文献发布时间:2023-06-19 19:28:50
技术领域
本说明书涉及生物制剂保存技术领域,特别涉及一种加强慢病毒载体稳定性的保护剂及其用途。
背景技术
慢病毒载体是指以人类免疫缺陷病毒-1(HIV-1)来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而实现持久表达,此外,慢病毒载体对分裂和非分裂细胞均具有较强的感染能力,转移基因容量大,不易引发宿主的免疫反应等。近年来,慢病毒载体在RNAi的研究、基因治疗以及转基因动物等研究中扮演着越来越重要的角色。因此,慢病毒已成为基因治疗和体外基因修饰的主要载体。
尽管慢病毒载体的研究有了很大进展,但重组慢病毒制剂的稳定性还有待提高,难以达到体内应用的需要。例如超低温保存的时间过长或者在使用过程中反复冻融,重组慢病毒载体的活性滴度(一般以病毒滴度来表示)往往会迅速大幅下降,从而限制了它的正常使用。因此,亟需一种成分安全简单、能在较低温下长期保存慢病毒载体且不影响其活性的冻存保护试剂。
发明内容
本说明书实施例之一提供一种用于加强慢病毒载体稳定性的保护剂,所述保护剂包括:缓冲溶液,所述缓冲溶液为组氨酸(Histidine)缓冲液或4-羟乙基哌嗪乙磺酸(HEPES)缓冲液;稳定剂,所述稳定剂包括人血清白蛋白;以及无机盐;其中,所述保护剂不包含糖类。
在一些实施例中,所述稳定剂还包括胆固醇脂质。
在一些实施例中,所述保护剂中所述胆固醇脂质的体积百分比浓度为0.1-1%。
在一些实施例中,所述保护剂中所述胆固醇脂质的体积百分比浓度为0.4%。
在一些实施例中,所述人血清白蛋白为外源表达体系表达的重组人血清白蛋白;所述保护剂中所述人血清白蛋白的质量体积百分比浓度为1-5%。
在一些实施例中,所述无机盐包括氯化钠;所述保护剂中所述氯化钠的摩尔浓度为75-100mmol/L。
在一些实施例中,所述无机盐包括氯化镁;所述保护剂中所述氯化镁的摩尔浓度为1.5-3mmol/L。
在一些实施例中,所述保护剂中所述氯化镁的摩尔浓度为2mmol/L。
在一些实施例中,所述保护剂中的所述缓冲溶液为10-20mmol/L的组氨酸缓冲液。
在一些实施例中,所述保护剂中的所述缓冲溶液为20-50mmol/L的4-羟乙基哌嗪乙磺酸缓冲液。
在一些实施例中,所述保护剂的pH值为6.8-7.4。
在一些实施例中,所述保护剂的pH值为7.2。
在一些实施例中,与冻融0次相比,在冻融8次的情况下,保存于所述保护剂中的慢病毒载体的活性滴度下降0-10%;与4℃放置0天相比,在4℃放置7天的情况下,保存于所述保护剂中的慢病毒载体的活性滴度下降0-25%;与37℃放置0小时相比,在37℃放置48小时的情况下,保存于所述保护剂中的慢病毒载体的活性滴度下降0-50%。
本说明书实施例之一还提供了上述用于加强慢病毒载体稳定性的保护剂在慢病毒载体纯化和/或储存中的用途。
本说明书实施例之一还提供了一种慢病毒载体制剂,该慢病毒载体制剂包括慢病毒载体以及上述用于加强慢病毒载体稳定性的保护剂。
附图说明
本说明书将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,在这些实施例中,相同的编号表示相同的结构,其中:
图1为根据本说明书一些实施例所示的使用不同保护剂配制的病毒液的pH随温度变化的比较图。
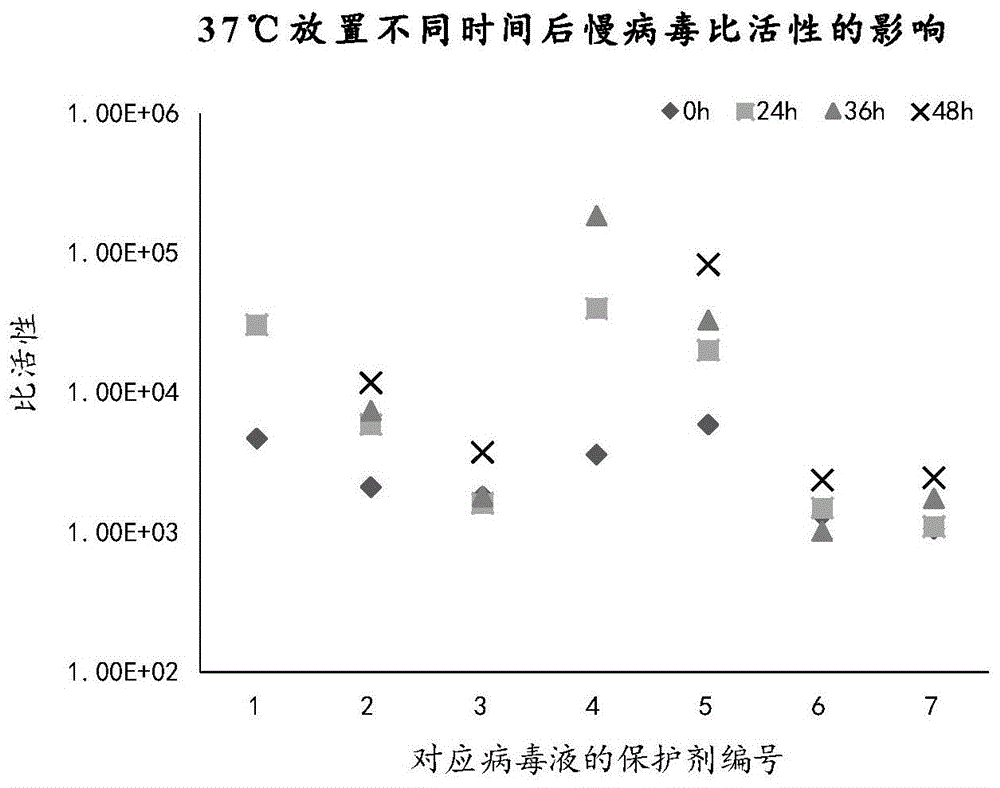
图2为根据本说明书一些实施例所示的使用不同保护剂配制的病毒液37℃放置不同时间后对慢病毒比活性的影响图。
图3为根据本说明书一些实施例所示的使用不同保护剂配制的病毒液在不同次数的冻融后对慢病毒比活性的影响图。
图4为根据本说明书一些实施例所示的使用不同保护剂配制的病毒液在4℃放置不同时间后对慢病毒比活性的影响图。
图5为根据本说明书一些实施例所示的使用保护剂3、6、7配制的病毒液在37℃放置不同时间后对慢病毒活性滴度的影响曲线图。
图6为根据本说明书一些实施例所示的使用保护剂3、6、7配制的病毒液在4℃放置不同时间后对慢病毒活性滴度的影响曲线图。
图7为根据本说明书一些实施例所示的使用保护剂3、6、7配制的病毒液在不同次数的冻融后对慢病毒活性滴度的影响曲线图。
图8为根据本说明书一些实施例所示的不同体积病毒液1和2感染T细胞后的流式散点图。其中,图8A至图8C分别为6.6μL、1.1μL和0.18μL病毒液2感染T细胞后的流式散点图;图8D至图8F分别为6.6μL、1.1μL和0.18μL病毒液1感染T细胞后的流式散点图。流式散点图中,纵坐标表示细胞颗粒数,数值单位M表示百万;横坐标表示FL1通道的荧光信号强度。
具体实施方式
为了更清楚地说明本说明书实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本说明书的一些示例或实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图将本说明书应用于其它类似情景。除非从语言环境中显而易见或另做说明,图中相同标号代表相同结构或操作。
如本说明书和权利要求书中所示,除非上下文明确提示例外情形,“一”、“一个”、“一种”和/或“该”等词并非特指单数,也可包括复数。一般说来,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其它的步骤或元素。
慢病毒载体的稳定性是制约其应用的重要问题。慢病毒载体的囊膜容易受到各种物理和化学因素影响导致失去活性从而降低载体的稳定性,这些因素包括温度、渗透压、pH、剪切力等。在生产方面,慢病毒载体生产制备流程包括转染、纯化、储存和转导靶细胞完成基因递送过程,这些过程中温度、渗透压、pH等影响因素的变化使得慢病毒载体容易失活,这可能导致载体的最终质量和有效性下降。尤其在慢病毒载体的纯化过程中,由于去除了维持慢病毒稳定性的成分,导致病毒载体变得越来越不稳定。因此,在整个纯化过程中也需要保持载体稳定性的慢病毒制剂组分。在储存方面,慢病毒载体需要储存在-70℃或更低的温度下以保持其感染性(Harper,Virology Ed.BIOS Scientific Publishers Limited,Oxford,UK,1993),而低温下蛋白质容易变性。在使用方面,慢病毒载体工作温度是37℃。一般而言,慢病毒在37℃溶液的半衰期不超过12小时,甚至有文献报道仅有6小时左右。因此,合适的慢病毒制剂组分既需要保证慢病毒在生产制备过程中以及低温下长时间保存的稳定性,也需要保证慢病毒经历多次冷冻/解冻循环后,以及处于工作温度下一段时间内仍具有感染性。
据本申请的一方面,提供了一种用于加强慢病毒载体稳定性的保护剂,包括缓冲溶液、稳定剂和无机盐,且保护剂不包含糖类。上述保护剂选取合适的组分,通过各组分的配合作用可使保存在其中的慢病毒载体在长时间低温储存、反复冻融后以及长时间处于工作温度条件下时均保持较高的活性滴度和转导效率,加强慢病毒载体的稳定性。
在一些实施例中,所述稳定剂可以包括人血清白蛋白。具体的,人血清白蛋白能亲和慢病毒载体的包膜糖蛋白,加强慢病毒的稳定性。人血清白蛋白可包括血源人血清白蛋白(HAS)和外源表达体系表达的重组人血清白蛋白(rHSA)。重组人血清白蛋白与血源人血清白蛋白具有相同的氨基酸组成及结构特征,其作用功能完全一致。与血源人血清白蛋白相比,重组人血清白蛋白更易得,避免了血液可能携带病毒污染的可能性;与动物源血清白蛋白相比,安全性更高,可满足临床使用的需求。在一些实施例中,所述人血清白蛋白可以为外源表达体系表达的重组人血清白蛋白。在一些实施例中,优选的,所述人血清白蛋白可以为转基因酵母表达的重组人血清白蛋白。
在一些实施例中,所述保护剂中所述人血清白蛋白的质量体积百分比浓度可以为1-5%。在一些实施例中,所述保护剂中所述人血清白蛋白的质量体积百分比浓度可以为1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述保护剂中所述人血清白蛋白的质量体积百分比浓度可以为2%。
在一些实施例中,所述稳定剂还包括胆固醇脂质。具体的,胆固醇脂质可以与人血清白蛋白协同作用于慢病毒载体的膜结构,并对膜结构形成保护,以降低温度、渗透压等因素对慢病毒载体活性的影响,从而加强慢病毒载体的稳定性。含人血清白蛋白和胆固醇脂质的保护剂可有效提高慢病毒载体的转导效率。在一些实施例中,所述保护剂中所述胆固醇脂质的体积百分比浓度可以为0.1-2%。例如,所述保护剂中所述胆固醇脂质的体积百分比浓度可以为0.1%、0.3%、0.5%、0.7%、0.9%、1.1%、1.3%、1.5%、1.7%、1.9%或2%。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述保护剂中所述胆固醇脂质的体积百分比浓度可以为0.4%。
慢病毒载体对pH极为敏感,例如常用的VSV-G包膜慢病毒载体,当pH低于7.0时,感染能力会逐步下降。因此,选取合适的缓冲溶液使保护剂维持在适宜pH范围内对加强慢病毒载体稳定性非常重要。
在一些实施例中,所述保护剂的pH值可以为6.8-7.4。例如,所述保护剂的pH值可以为6.8、6.9、7.0、7.1、7.2、7.3、7.4。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,为使保护剂构建的慢病毒保存环境更接近人体体液环境,优选的,所述保护剂的pH值可以为7.2-7.4。在一些实施例中,更优的,所述保护剂的pH值可以为7.2。
缓冲溶液可限制保护剂pH的变化。缓冲溶液的电离程度会随着温度的变化而变化,这意味着缓冲液的pH值会随着保护剂的冷却或加热而变化。因此,选择合适的缓冲液对于稳定慢病毒生物活性非常重要。在一些实施例中,所述缓冲溶液可以为组氨酸缓冲液或4-羟乙基哌嗪乙磺酸缓冲液。其中,组氨酸缓冲液是指包含组氨酸的缓冲液。组氨酸缓冲液的非限制性实施例包括但不限于组氨酸-盐酸缓冲液、组氨酸-乙酸缓冲液、组氨酸-磷酸缓冲液、组氨酸-硫酸缓冲液。在一些实施例中,优选的,所述组氨酸缓冲液可以为组氨酸-盐酸缓冲液。
在一些实施例中,所述缓冲溶液可以为组氨酸缓冲液,组氨酸缓冲液在所述保护剂中的终浓度可以为10-20mmol/L。例如,组氨酸缓冲液在所述保护剂中的终浓度可以为10mmol/L、12mmol/L、14mmol/L、16mmol/L、18mmol/L或20mmol/L。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述缓冲溶液可以为组氨酸缓冲液,组氨酸缓冲液在所述保护剂中的终浓度可以为10mmol/L。
在一些实施例中,所述缓冲溶液为4-羟乙基哌嗪乙磺酸缓冲液,4-羟乙基哌嗪乙磺酸缓冲液在所述保护剂中的终浓度可以为20-50mmol/L的。例如,4-羟乙基哌嗪乙磺酸缓冲液在所述保护剂中的终浓度可以为20mmol/L、22mmol/L、24mmol/L、26mmol/L、28mmol/L、30mmol/L、32mmol/L、34mmol/L、36mmol/L、38mmol/L、40mmol/L、42mmol/L、44mmol/L、46mmol/L、48mmol/L或50mmol/L。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述缓冲溶液为4-羟乙基哌嗪乙磺酸缓冲液,4-羟乙基哌嗪乙磺酸缓冲液在所述保护剂中的终浓度可以为20mmol/L的HEPES缓冲液。
保护剂中的无机盐可在调节保护剂渗透压、防止慢病毒载体聚集等方面发挥作用。在一些实施例中,所述无机盐可以包括氯化钠。在一些实施例中,所述保护剂中所述氯化钠的摩尔浓度可以为75-100mmol/L。例如,所述保护剂中所述氯化钠的摩尔浓度可以为75mmol/L、77.5mmol/L、80mmol/L、82.5mmol/L、85mmol/L、87.5mmol/L、90mmol/L、92.5mmol/L、95mmol/L、97.5mmol/L、100mmol/L。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述保护剂中所述氯化钠的摩尔浓度可以为75mmol/L。
在一些实施例中,所述无机盐可以包括氯化镁。在一些实施例中,所述保护剂中所述氯化镁的摩尔浓度可以为1.5-3mmol/L。例如,所述保护剂中所述氯化镁的摩尔浓度可以为1.5mmol/L、1.75mmol/L、2mmol/L、2.25mmol/L、2.5mmol/L、2.75mmol/L、3mmol/L。还包括以上述端值的组合为特征的任意范围,此处不再赘述。在一些实施例中,优选的,所述保护剂中所述氯化镁的摩尔浓度可以为2mmol/L。
具体的,含氯化镁和/或氯化钠的保护剂可使保护剂渗透压维持在接近人体体液渗透压的范围内,有利于长期保持病毒制剂,可避免因低渗透压造成病毒载体的崩解;另一方面,使渗透压维持在接近人体体液渗透压的范围内,有利于使保护剂直接应用于临床治疗。含氯化镁和/或氯化钠的保护剂可避免慢病毒载体聚集,病毒聚集可能会抑制慢病毒载体活性。
在一些实施例中,所述保护剂不包含选自单糖、二糖、低聚糖、多糖中的一种或多种的糖类。所排除的糖类的非限制性实施例包括但不限于葡萄糖、蔗糖、果糖、木糖、乳糖、半乳糖、麦芽糖、异麦芽糖、甘露糖、山梨糖、海藻糖、棉子糖等。在一些实施例中,所排除的糖类可选自葡萄糖、蔗糖、果糖、木糖、海藻糖、棉子糖中的一种或多种。
在一些实施例中,与冻融0次相比,在冻融8次的情况下,保存于所述保护剂中的慢病毒载体的活性滴度可以下降0-10%。例如,采用FCAS方法对保存于保护剂中的慢病毒载体进行活性滴度测定,其冻融8次后测定的活性滴度相比于其未进行冻融时(即冻融0次)测定的活性滴度可下降0%、0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%。还包括以上述端值的组合为特征的任意范围,此处不再赘述。
在一些实施例中,与4℃放置0天相比,在4℃放置7天的情况下,保存于所述保护剂中的慢病毒载体的活性滴度下降0-25%。例如,采用FCAS方法对保存于保护剂中的慢病毒载体进行活性滴度测定,其在4℃放置7天后测定的活性滴度相比于其在4℃放置0天测定的活性滴度可下降0%、1%、3%、5%、7%、9%、11%、13%、15%、17%、19%、21%、23%或25%。还包括以上述端值的组合为特征的任意范围,此处不再赘述。
在一些实施例中,与37℃放置0小时相比,在37℃放置48小时的情况下,保存于所述保护剂中的慢病毒载体的活性滴度下降0-50%。例如,采用FCAS方法对保存于保护剂中的慢病毒载体进行活性滴度测定,其在37℃放置7天后测定的活性滴度相比于其在37℃放置0天测定的活性滴度可下降0%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%。还包括以上述端值的组合为特征的任意范围,此处不再赘述。
根据本申请的另一方面,提供一种用于加强慢病毒载体稳定性的保护剂在慢病毒载体纯化和/或储存中的用途。在慢病毒的生产过程中的一个或多个步骤中,如转染、纯化、储存和转导靶细胞完成基因递送,加入上述用于加强慢病毒载体稳定性的保护剂能够维持慢病毒载体的稳定性。慢病毒载体需要储存在-70℃或更低的温度下以保持其感染性,而低温下蛋白质容易变性,在慢病毒载体中加入上述保护剂,能够使慢病毒载体防冻,并于-70℃低温条件下长期保存。
根据本申请的另一方面,提供一种慢病毒载体制剂,该慢病毒载体制剂包括慢病毒载体以及用于加强慢病毒载体稳定性的保护剂。该慢病毒载体制剂中的缓冲液和其他辅料均是药用级别,且化学组分明确,能够使慢病毒载体制剂作为基因治疗药物注射人体,如可满足皮内注射、皮下注射、肌肉注射、血管给药等临床治疗方式的要求。
在一些实施方案中,本申请中涉及的慢病毒载体可以是选自HIV-1、HIV-2、SIV、FIN、EIAV和VISNA的慢病毒载体。在一些实施方式中,慢病毒载体可以为HIV-1载体。所述慢病毒载体可以是一个载体表达系统。在一些实施例中,慢病毒载体表达系统可以包括含有慢病毒结构蛋白gag-pol基因的核酸载体,和含有env基因或其功能性替代物的核酸载体。env基因或其功能性替代物可以编码水泡性口炎病毒糖蛋白(VSV-G)或其衍生蛋白。在一些实施例中,慢病毒载体表达系统还可以包括含有辅助基因rev或其类似基因的核酸载体。在一些实施例中,慢病毒载体表达系统还可以包括含有异源核酸的核酸载体。
例如,慢病毒载体表达系统可包括含有gag-pol基因的核酸载体、含有env基因或其功能性替代物的核酸载体、含有rev基因或其类似基因的核酸载体和含有异源核酸的转移核酸载体。又例如,慢病毒载体表达系统可包括含有gag-pol-rev基因的核酸载体、含有env基因或其功能性替代物的核酸载体和含有异源核酸的转移核酸载体。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂公司购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1、慢病毒制备
采用四质粒包装体系瞬时转染无血清悬浮驯化的HEK293T细胞制备慢病毒。四质粒包装体系中,pMD2.G质粒(Addgene,货号12259)提供病毒包膜蛋白VSVG;pMDLg/pRRE质粒(Addgene,货号12251)提供病毒结构蛋白gag-pol;pRSV Rev质粒(Addgene,货号12253)提供病毒调节蛋白rev;pLJM1-EGFP(Addgene,货号19319)质粒为含标记基因(绿色荧光蛋白,eGFP)的转移质粒transfer。
1.1细胞接种。取HEK293T细胞(来源于ECACC)使用无血清培养基制备细胞悬液,细胞密度调整为4×10
1.2制备转染混合液。按四质粒VSVG:gag-pol:Rev:transfer=1:2:2:3.75的质量比配制混合转染质粒;取混合转染质粒和PEI转染试剂(1mg/mL)分别溶解于无血清培养基中,得到混合转染质粒稀释液和PEI转染试剂稀释液。将PEI转染试剂稀释液逐滴加入混合转染质粒稀释液中,转染质粒与PEI的质量比为1:2,混合均匀后室温孵育15min,制得转染混合液,转染混合液中PEI浓度为0.0375mg/mL。
1.3转染。将3mL转染混合液(10%生产体积)滴加入步骤1.1的细胞培养摇瓶中进行转染。培养48h后收集病毒上清液并用于病毒纯化。
1.4纯化。将病毒上清液收集在50mL超速离心管中,19400rpm,4℃,离心2h,弃上清,得到慢病毒沉淀。
实施例2、保护剂制备及稳定性检测
2.1保护剂制备
选用1×DPBS缓冲液(Gibco,货号14040133)作为保护剂1,保护剂1为对照组。按照如表1所示的配方制备保护剂2-7。其中,稳定剂方面,保护剂2、3和6含重组人血清白蛋白且不含糖类,保护剂7含重组人血清白蛋白和胆固醇脂质且不含糖类,保护剂4和5含糖类且不含重组人血清白蛋白和胆固醇脂质。
表1保护剂配方表
注:胆固醇脂质(250×,cholesterol lipid)购买自Thermo Fisher,货号12531018。
2.2制备慢病毒重悬液
取等量的慢病毒沉淀,分别重悬于等体积的保护剂1至保护剂7中,制得7组病毒液,依次编号1-7;每组包含16管病毒液,依次编号A-P,每管2mL。
2.3测定不同情况下病毒液的pH稳定性
对于7组病毒液:每组中的A号管病毒液于室温放置3h后测试pH值;每组中的B号管病毒液于4℃冰箱放置3h后测试pH值;每组中的C号管病毒液37℃水浴加热3h后测试pH值,每组中的D号管病毒液冻融(于-80℃冰箱放置90min,后置于室温融化40min)后于室温下测试pH值。
pH测试结果见图1。如图1所示,第1组病毒液为对照组,除第5组病毒液以外,其余各组病毒液的pH值随温度变化的幅度均较小,pH变化范围在6.8-7.4之内。在不同温度条件下以及冻融后室温条件下,使用保护剂2、保护剂3、保护剂4、保护剂6和保护剂7配制的病毒液均表现出较好的pH稳定性。
2.4测定37℃不同放置时间下慢病毒稳定性
2.4.1病毒液37℃放置
对于7组病毒液:每组中的E号管病毒液于37℃放置0h,检测滴度;每组中的F号管病毒液于37℃放置24h,检测滴度;每组中的G号管病毒液于37℃放置36h,检测滴度;每组中的H号管病毒液于37℃放置48h,检测滴度。各组的E号至H号管放置后同日同批次进行滴度检测。
2.4.2采用ELISA方法测定慢病毒的物理滴度
ELISA方法仅测定慢病毒的颗粒数,并没有测定慢病毒对靶细胞的实际感染能力,因此ELISA法测定的是慢病毒的物理滴度而非实际(生物)滴度。由于一个慢病毒颗粒(Lentiviral Particle,LP)中约有2000个P24蛋白分子,用以下公式可以计算慢病毒载体的颗粒数(LP):1ng P24=1.25×10
2.4.3采用FACS方法测定慢病毒的活性滴度
FACS方法可准确测定重组慢病毒的实际感染能力,所测滴度能准确反应病毒功能滴度的实际值。方法主要包括:将靶细胞HEK293T稀释至3×10
待测病毒样品的活性滴度(TU/mL)=[(样品阳性率-背景孔阳性率)×转导时细胞总数×稀释倍数]/接种病毒体积(mL)。
2.4.4慢病毒稳定性分析
由于本实施例预先将待测病毒液分装,然后再根据不同的处理条件取出相应病毒液进行检测,为了排除分装样品间浓度差异,因此本研究以慢病毒比活性(即,以物理滴度/功能滴度的所得值)变化来评价慢病毒稳定性。理论上,当慢病毒稳定性下降时其功能滴度会相应降低,而物理滴度则会维持不变,因此慢病毒比活性会相应增加。
本实施例中,病毒液37℃放置0h、24h、36h及48h后的慢病毒比活性变化情况见图2。如图2所示,与作为对照组的第1组病毒液相比,第4和5组病毒液的比活性变化幅度较大,第2组病毒液的比活性变化幅度基本与第1组病毒液持平,而第3、6及7组病毒液的比活性变化幅度均较小;37℃放置48h后,第3、6及7组病毒液的比活性低于其他组病毒液的比活性。对于在37℃工作温度下长时间放置而言,保护剂3、保护剂6、保护剂7具有较好的增强慢病毒稳定性的作用。
2.5测定反复冻融情况下慢病毒稳定性
2.5.1病毒液冻融
对于7组病毒液:每组中的I号管病毒液冻融0次,检测滴度;每组中的J号管病毒液冻融2次,检测滴度;每组中的K号管病毒液冻融5次,检测滴度;每组中的L号管病毒液冻融8次,检测滴度。各组的I号至L号管同日同批次进行滴度检测。需要说明的是,病毒液于-80℃冰箱放置90min,后置于室温融化40min,记为1次冻融。
2.5.2慢病毒稳定性分析
参照步骤2.4测定步骤2.5.1的7组病毒液的I号至L号管的物理滴度和活性滴度,并计算慢病毒的比活性。
本实施例中,病毒液冻融0次、2次、5次及8次后的比活性变化情况见图3。如图3所示,第2、3、6和7组病毒液的比活性变化幅度均较小;特别是第3、6和7组病毒液,冻融8次后,第3、6和7组病毒液的比活性低于第2组病毒液以及作为对照组的第1组病毒液。对于病毒液反复冻融的情况而言,保护剂3、保护剂6、保护剂7具有较好的增强慢病毒稳定性的作用。
需要说明的是,由于存在系统误差,导致第4组和第5组病毒液的I号至L号管未收集到可用的数据。
2.6测定4℃不同放置时间下慢病毒稳定性
2.6.1病毒液4℃放置
对于7组病毒液:每组中的M号管病毒液于4℃放置0天,检测滴度;每组中的N号管病毒液于4℃放置1天,检测滴度;每组中的O号管病毒液于4℃放置3天,检测滴度;每组中的P号管病毒液于4℃放置7天,检测滴度。各组的M号至P号管同日同批次进行滴度检测。
2.6.2慢病毒稳定性分析
参照步骤2.4测定步骤2.6.1的7组病毒液的M号至P号管的物理滴度和活性滴度,并计算慢病毒的比活性。
本实施例中,病毒液于4℃放置0天、1天、3天、7天后的比活性变化情况见图4。如图4所示,与作为对照组的第1组病毒液相比,第4组病毒液的比活性变化幅度与第1组病毒液基本持平,第5组病毒液的比活性变化幅度大于第1组病毒液,而第2、3、6和7组病毒液的比活性变化幅度均较小。对于病毒液4℃长时间放置的情况而言,保护剂2、保护剂3、保护剂6、保护剂7具有较好的增强慢病毒稳定性的作用。
2.7综合分析
综上,根据步骤2.3至2.7的检测及分析可知,第3、6和7组病毒液,一方面在不同温度情况下以及冻融情况下均表现出较好的pH稳定性,另一方面,在4℃长时间放置、37℃长时间放置以及反复冻融的情况下具有较好的慢病毒稳定性。第3、6和7组病毒液在增强慢病毒稳定性的整体效果上明显优于作为对照组的第1组病毒液,也优于第2、4和5组病毒液。
针对第3、6及7组病毒液,分别计算每组病毒液中37℃放置24h的F号管病毒液活性滴度、放置36h的G号管病毒液活性滴度、放置48h的H号管病毒液活性滴度与放置0h的E号管病毒液活性滴度的百分比比值,以分析37℃不同放置时间下慢病毒活性滴度的变化情况,结果见图5。
针对第3、6及7组病毒液,分别计算每组病毒液中于4℃放置1天的N号管病毒液活性滴度、于4℃放置3天的O号管病毒液活性滴度、于4℃放置7天的P号管病毒液活性滴度与于4℃放置0h的M号管病毒液活性滴度的百分比比值,以分析4℃不同放置时间下慢病毒活性滴度的变化情况,结果见图6。
针对第3、6及7组病毒液,分别计算每组病毒液中冻融2次的J号管、冻融5次的K号管、冻融8次的L号管病毒液活性滴度与冻融0次的I号管病毒液活性滴度的百分比比值,以分析反复冻融条件下慢病毒活性滴度的变化情况,结果见图7。
图5是使用保护剂3、6、7配制的病毒液在37℃放置不同时间后对慢病毒活性滴度的影响曲线图。如图5所示,第3、6和7组病毒液37℃放置24h、36h、48h的活性滴度为37℃放置0h的活性滴度的50%以上。特别是第6组和第7组病毒液,经过37℃长时间放置后,其活性滴度没有显著的下降。对于使用保护剂6重悬并制备的第6组病毒液而言,37℃放置24h和36h的活性滴度为37℃放置0h的活性滴度的80%以上;37℃放置48h的活性滴度为37℃放置0h的活性滴度的62.97%,活性滴度下降37.03%。对于使用保护剂7重悬并制备的第7组病毒液而言,37℃放置24h和36h的活性滴度为37℃放置0h的活性滴度的80%以上;37℃放置48h的活性滴度为37℃放置0h的活性滴度的60.31%,活性滴度下降39.69%。
图6是使用保护剂3、6、7配制的病毒液在4℃放置不同时间后对慢病毒活性滴度的影响曲线图。如图6所示,第3、6和7组病毒液4℃放置1天、3天、7天的活性滴度为4℃放置0天的75%以上。特别是第6组和第7组病毒液,经过4℃长时间放置后,其活性滴度没有显著的下降。对于使用保护剂6配制的第6组病毒液而言,4℃放置1天和3天的活性滴度为4℃放置0天的活性滴度的90%以上;4℃放置7天的活性滴度为4℃放置0天的活性滴度的87.86%,活性滴度下降12.14%。对于使用保护剂7配制的第7组病毒液而言,4℃放置1天和3天的活性滴度为4℃放置0天的活性滴度的95%以上;4℃放置7天的活性滴度为4℃放置0天的活性滴度的79.44%,活性滴度下降20.56%。
图7是使用保护剂3、6、7配制的病毒液在不同次数的冻融后对慢病毒活性滴度的影响曲线图。如图7所示,与冻融0次的活性滴度相比,第3、6和7组病毒液冻融2次、5次、8次的活性滴度下降0-7.5%,活性滴度均无显著的下降。
基于以上分析可知,在4℃长时间放置、37℃长时间放置以及反复冻融的情况下,使用保护剂3、6和7配制病毒液可使慢病毒保持较高的活性滴度,尤其是保护剂6和保护剂7。
实施例3、保护剂6和保护剂7对慢病毒转导T细胞的影响
CART细胞是通过慢病毒将外源基因递送的T细胞中,从而使T细胞能够特异性地识别和杀伤肿瘤细胞。为了评估慢病毒保护剂对慢病毒转导T细胞效率的影响,使用保存在保护剂6和保护剂7中的慢病毒(含标记基因eGFP,编码绿色荧光蛋白)分别感染人原代T细胞检测CART表达的阳性率。
基于PBMC T细胞感染慢病毒转导效率测试方法如下:
3.1使用等量的实施例1的慢病毒沉淀,和等量的实施例2步骤2.1的保护剂6、保护剂7分别制备病毒液;其中,病毒液1包含慢病毒和保护剂6,病毒液2包含慢病毒和保护剂7。
3.2在细胞培养板中,以1×10
3.3对于每种病毒液:以不同的体积(6.6μL、1.1μL和0.18μL)将病毒液加入步骤3.2的含细胞悬液的样品孔中,使慢病毒与人原代T细胞共培养72小时,然后通过离心、弃去上清液,收获慢病毒感染的细胞。
3.4将慢病毒感染的细胞重新悬浮在200μL DPBS中,使用未感染慢病毒的细胞做阴性对照,在流式细胞仪上进行分析。
结果如图8所示,其中图8A至图8C分别为6.6μL、1.1μL和0.18μL病毒液2感染T细胞后的流式散点图;图8D至图8F分别为6.6μL、1.1μL和0.18μL病毒液1感染T细胞后的流式散点图。对于保存在保护剂7中的慢病毒而言,不同体积(6.6μL、1.1μL和0.18μL)的病毒液感染T细胞后的阳性率分别为61.1%、35.8%和22.7%,高于保护剂6;且随着病毒液体积的增大,也即随着感染复数的增大,保存在保护剂7中的慢病毒在转导效率上的优势越明显。由此可知,保护剂7在保持慢病毒转导效率方面的效果优于保护剂6。
实施例4、保护剂的渗透压检测
按照实施例2步骤2.1的方法配制保护剂3、保护剂6和保护剂7。对保护剂3、6和7分别进行渗透压测试。保护剂3、6和7的渗透压分别为504mOsm/L、183mOsm/L、和425mOsm/L。保护剂3、6和7的渗透压均低于600mOsm/L。可满足皮内注射、皮下注射、肌肉注射、血管给药等临床治疗方式的要求。
本申请所披露的用于加强慢病毒载体稳定性的保护剂,可能带来的有益效果包括但不限于:(1)可在4℃长时间放置、37℃长时间放置以及反复冻融的情况下使慢病毒载体保持较高的滴度及转导效率,维持慢病毒载体的活性,增强慢病毒载体的稳定性;(2)成分安全简单,适于临床治疗的应用;(3)可用于慢病毒载体的直接冻存,无需进行冻干,可降低重组慢病毒制剂的生产成本。需要说明的是,不同实施例可能产生的有益效果不同,在不同的实施例里,可能产生的有益效果可以是以上任意一种或几种的组合,也可以是其他任何可能获得的有益效果。
本领域的技术人员应当理解,以上实施例仅为说明本发明,而不对本发明构成限制。凡在本发明的精神和原则内所作的任何修改、等同替换和变动等,均应包含在本发明的保护范围之内。
- 一种用于免疫治疗的腺病毒载体
- 一种用于提高囊泡稳定性的保护剂
- 一种用于血友病B基因治疗的腺病毒载体及其用途
