在癌细胞中具有增强复制的HSV载体
文献发布时间:2023-06-19 19:28:50
相关申请的引用
本申请基于35U.S.C.§119(e)要求于2016年4月29日提交的美国临时专利申请 第62/329,877号的优先权,该申请的全部内容以引用方式结合于本文。
技术领域
本专利申请总体上涉及HSV癌细胞中的增强复制。
背景技术
除了通过病毒直接杀死细胞之外,溶瘤性病毒(OV)已经成为一种通过溶瘤效 应特异性破坏癌细胞的治疗方案(therapeutic arsenal),其中溶瘤效应是一种特征在于 通过病毒裂解复制的过程实现癌细胞裂解的杀伤机制。在各种OV中,基于OV的1 型单纯疱疹病毒(“HSV-1”)是最先进的,例如,美国FDA已经批准了疱疹病毒系 OV(T-Vec)用于治疗黑素瘤。HSV载体的代表性实例包括美国专利第7,223,593号、 第7,537,924号、第7,063,835号、第7,063,851号、第7,118,755号、第8,277,818号 和第8,680,068号中所描述的那些。
本发明克服了目前的商业化溶瘤性病毒的缺点,并且进一步提供了另外的出乎意料的益处。
发明内容
简言之,本发明提供了在癌细胞中具有增强复制的HSV载体。在一种实施方式 中,所提供的HSV载体在影响病毒复制效率的病毒基因的调控区中包含NF-κB应答 元件。其他的权利要求涉及在影响病毒复制效率的病毒基因的调控区中包含 Oct3/4-SOX2应答元件的HSV载体。具有这些应答元件之一或二者的病毒基因包括 US11及编码ICP4、ICP27和ICP8的基因。
其他的权利要求涉及载体,其中,NF-κB应答元件包含GGGAATTTCC(SEQ ID NO:1)或其变体的1-15个串联序列,其中,该变体与该序列具有至少一个核苷酸差 异。串联序列可以完全相同,或者是相同和不同序列或全部不同序列的混合。其他权 利要求涉及载体,其中,OCT3/4-SOX2应答元件包含 CTACAGAGGTGCATATTAACAGAGCTTTTGTCCTGGAGA(SEQ IDNO:2)或其变 体,其中,该变体具有至少90%的相同核苷酸。
在其他权利要求中,HSV载体可以进一步包含编码用于癌症治疗的治疗性物质 的序列。该治疗性物质可以是IL12、IL15、OX40L、PDL-1阻断剂或PD-1阻断剂。 在2016年12月9日提交的美国专利申请第15/374,893号中描述了适合的阻断剂的 一个实例,将其全文结合于本文作为参考。
其他权利要求涉及治疗癌症的方法,所述方法包括向患有癌症或疑似患有癌症的患者施用本文中所述的HSV载体。在其他权利要求中,提供了处理癌症干细胞和治 疗难治性癌症的方法,所述方法包括向患有难治性癌症或具有癌症干细胞的癌症的患 者施用本文中所述的HSV载体。在其他权利要求中,癌症为结肠癌、肺癌、乳腺癌、 前列腺癌、脑癌或膀胱癌。
在发明内容部分中已经简要地介绍了某些概念,这些概念将在下文的具体实施方式部分中进一步详细描述。除非另外明确陈述,发明内容部分既不是意在确定本文要 求保护主题的关键或必须特征,也不是意在限制本文要求保护主题的范围。
以下描述中阐述了一种或多种实施方式的细节。结合一种示例性实施方式说明或描述的特征可以与其他实施方式的特征组合。因此,本文中所述的各种实施方式中任 一种能够与其他的实施方式组合提供。如果需要采用如本文中所述的各不同专利、申 请和出版物的概念来提供进一步的实施方式,则可以对实施方式的方面进行修改。根 据说明书、附图和权利要求书将使得其他特征、目的和优势变得显而易见。
附图说明
根据附图和各种实施方式的如下具体描述将使得本文披露内容的示例性特征、其性质和各种优势变得显而易见。参照附图描述了非限制性和非穷尽的实施方式,其中, 除非另外明确指出,在不同视图中相似的标识或标号代表相似的部分。附图中元件的 尺寸和相对位置不一定是按比例绘制的。例如,为了改善绘图清晰度会选择、放大和 定位各元件的形状。选择如所绘制的元件的特定形状以易于在附图中进行识别。下文 中参照附图描述了一种或多种实施方式,其中:
图1A-图1B是示例性oHSV载体的示意图。
图2是示出了在存在TNFα的情况下,在ICP4的调控区中携带NF-κB应答元件 的示例性oHSV-1载体的增强的病毒产生的图示。
图3A-图3B表示OS-ICP27的示意图和序列(SEQ ID NO:3)。
图4A-图4B表示NO-ICP27-145的示意图和序列(SEQ ID NO:4)。
图5A-图5B表示NO-ICP27-99的示意图和序列(SEQ ID NO:5)。
图6示出了病毒hVG161的经修饰的ICP34.5区(SEQ ID NO:6)的示意图。
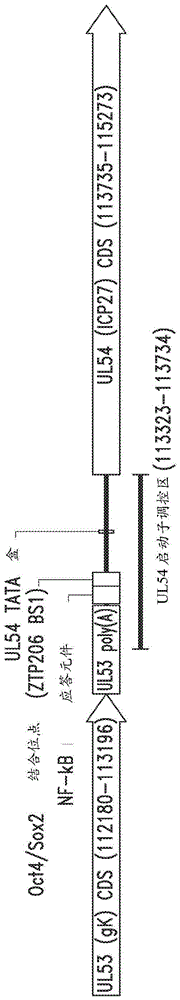
图7示出了病毒hVG161的经修饰的UL54启动子区(SEQ ID NO:7)的示意图。
图8示出了插入PD-L1阻断剂(SEQ ID NO:8)的hVG161病毒基因组的示意图。
图9示出了经修饰的TR区的hVG161(SEQ ID NO:9)的示意图。
图10A-图10K示出了在ICP27启动子/调控区中包含突变的病毒的测定结果。
图11A-图11C示出了ELISA和蛋白质印记数据for IL-12表达following hVG161感染of细胞.
图12A-图12C示出了在在细胞感染hVG161之后,IL-15表达的ELISA和蛋白 质印记数据。
图13A-图13C示出了在细胞感染hVG161之后,IgG4表达的ELISA和蛋白质印 记数据。
图14A-图14E示出了感染了VG161-PLBh和VG161-15h的细胞的结果。
图15A-图15D示出了各种构建体的r体外测定的结果。图15A-图15B示出了用 携带IL-12、IL-15和PD-L1阻断剂的IL-TF-Fc质粒进行细胞转染的结果。图15C-15D 示出了感染了各种突变病毒(包括hVG161)的细胞的结果。
图16A-图16E示出了在人肿瘤细胞系和Vero细胞系上针对hVG161和HSV-345 进行细胞活力测定的结果。
图17A-图17J示出了各种构建体的体外测定的结果。图17A-图17E示出了在上 针对mVG161和HSV-345进行细胞活力测定的结果;图17F-图17J示出了在CT26 小鼠肿瘤细胞感染mVG161或VG001之后的转基因表达的表征。
图18A-图18E示出了在各种细胞系感染hVG161或VG001之后的转基因表达的 体外表征的结果。
图19A-图19G示出了用于评价hVG161在体外杀死各种人癌细胞的能力的测定 结果。
图20A-图20G示出了mVG161和hVG161构建体的体内测定的结果。
图21A-图21C示出了不同病毒在三种不同的人细胞系上的生长曲线。
图22A-图22D示出了mVG161和HSV-345在小鼠肿瘤细胞系和Vero细胞系上 的生长曲线。
图23A-图23E示出了hVG161和HSV-345在人肿瘤细胞系和Vero细胞系上的生 长曲线。
图24A-图24D示出了NO-ICP27和HSV-345在各种细胞系上的生长曲线。
具体实施方式
通过参照本发明优选实施方式和其中包括的实施例的以下详细描述可以更容易地理解本发明。简言之,本文披露内容提供了利用HSV载体来治疗癌症的组合物和 方法,该HSV载体包含响应于NF-κB或Oct-3/4-SOX2或两种转录激活因子的序列。
在本发明的某些实施方式中,本文披露内容提供了向癌细胞(通常是体内)向需要癌症治疗的受试者提供的方法和组合物。如本文中使用的术语“癌症”是指任意种类 和来源的癌症,包括难治性癌症(例如,对于常规辐照和/或化疗抗性的癌症);癌症 干细胞、肿瘤形成细胞、血液癌症和转化的细胞。如本文中使用的术语“癌细胞”包括 癌细胞或肿瘤形成细胞、转化的细胞或易于变成癌细胞或肿瘤形成细胞的细胞。癌症 的代表性形式包括、癌瘤(carcinomas)、肉瘤、骨髓瘤、白血病、淋巴瘤以及上述 的混合类型。其他的实例包括,但不限于下文中详细讨论的那些。
一些癌细胞,尤其是癌症干细胞通常对于溶瘤性HSV-1病毒诱导的溶瘤效应具 有抗性。为了增加oHSV-1的治疗效果,可在其调控区中对调节病毒复制的病毒基因 进行修饰以插入NFkB应答元件或Oct3/4-SOX2应答元件或二者以使得该基因表达在 感染的细胞中尤其响应于NFkB的激活。由于NFkB通路在癌细胞癌症干细胞中经常 被上调,因此这种修饰将会增强oHSV的病毒产生和溶瘤活性以用于更有效的细胞杀 伤。
A.
Oct-3/4-SOX2复合物(也被称作Oct-3、Oct4和Pou5f1)和NF-κB在许多不同 的肿瘤中表达。Oct4和SOX2是在干细胞中表达的转录因子。这两种蛋白形成复合 物以结合至参与保持干细胞和多能细胞的基因的调控区。在癌症干细胞中,其保持一 种"干性(stemness)"状态。在许多实体恶性肿瘤种已经鉴别出了癌症干细胞。它们 是一小群具有干细胞特征的肿瘤细胞,其是癌症患者中复发的可能原因。NF-κB(核 因子-κB)是一组转录因子。在基本上所有未受刺激的有核细胞中,NFκB复合物结 合至NFκB(IκB)蛋白的抑制剂。当从该抑制剂脱离时,NF-κB转座至细胞核中并 且靶向于激活或增加基因转录的增强子元件的序列。NF-κB在许多癌症类型中被激 活,包括肝细胞癌、淋巴瘤、白血病、结肠癌、肺癌、乳腺癌、前列腺癌、脑癌和膀 胱癌。其也在癌症干细胞中被激活。
NFκB的应答元件包括十聚体结合序列。最常见的序列为GGGAATTTCC(SEQ ID NO:1),但变体也可以是靶标。通常,变体与最常见序列会具有一处或两处差异。
一些抑制的NFκB结合序列变体包括:
表1
NF-κB应答元件包含至少一个结合序列并且可以包含2个至多达15个串联排列 的结合序列。当存在多于一个序列时,该多于一个序列可以是相同的或不同的。例如, 包含五个结合序列的应答元件可以具有全部五个相同的序列,或者四个相同序列和一 个不同序列,或者三个相同序列和两个不同序列,或者两个相同序列和三个不同序列, 或者五个不同的序列。而且,该串联应答元件可以在元件之间具有核苷酸。可以存在 一个至大约十个另外的核苷酸。
Oct-3/4结合八聚体序列ATTTGCAT。Sox2结合至八聚体序列CTTTTGTC。已 经发现Oct4/Sox2异源二聚体结合至 CTACAGAGGTGCATATTAACAGAGCTTTTGTCC-TGGAGA[SEQ IDNo.2]或该序 列的变体。(Wang等人.J Biol Chem 282:12822,2007)。变体通常与该序列至少90% 相同,或至少95%相同,或至少98%相同。
Oct-3/4-Sox2应答元件包含给结合序列中的至少之一并且可以包含2个至多达15个串联排列的结合序列。当存在对于一个序列时候,该多于一个序列可以是相同的或 不同的。例如,包含五个结合序列的应答元件可以具有全部五个相同的序列,或者四 个相同序列和一个不同序列,或者三个相同序列和两个不同序列,或者两个相同序列 和三个不同序列,或者五个不同的序列。而且,该串联应答元件可以在元件之间具有 核苷酸。可以存在一个至大约十个另外的核苷酸。
在MOLECULAR AND CELLULAR BIOLOGY(2005年7月,p.6031–6046)中 可以找到用于结合Oct4/Sox2复合物的序列的一些可能变体,并且包括:
CTTTGTTATGCATCTSEQ ID NO.35
CATTGTGATGCATATSEQ ID NO.36
CATTGTAATGCAAAASEQ ID NO.37
CATTGTTATGCTAGTSEQ ID NO.38
CATTGTTATGATAAASEQ ID NO.39
CTTTGTTTGGATGCTAAT SEQ ID NO.40。
载体可以含有NF-κB和Oct-3/4-Sox 2应答元件的混合物。当每一种存在时,通 常该应答元件会呈串联排列,例如在实施例2的构建体中所见。该应答元件的顺序可 以在任一元件的5’位。也考虑可以存在多于一个NF-κB或多于一个Oct-3/4-Sox 2应 答元件或多于一个每一应答元件。在存在多种一个或多个元件的情况下,它们可以为 任何顺序。而且,在该应答元件可以在元件之间存在另外的核苷酸。
B.
溶瘤性病毒是一种会裂解癌细胞(溶瘤效应)的病毒,优选地以选择的方式。在 分化的细胞中选择性复制的病毒通常是溶瘤性的。
单纯疱疹病(HSV)1和2是疱疹病毒科的成员,其感染人类。HSV基因组含有 两个独特区,其被称作长独特(UL)区和短独特(US)区。这些区域中的每一个在 侧连上具有一对末端反向重复序列。存在大约75种已知的开放阅读框。该病毒基因 组被设计为开发用于例如癌症治疗中的溶瘤性病毒。HSV ICP34.5(也称作γ34.5)基 因的突变带来了HSV的肿瘤选择性复制。HSV含有ICP34.5的两个拷贝。已知突变 体使ICP34.5基因的一个或两个拷贝失活从而缺乏神经毒力,即,无致病性/非神经 毒性且是溶瘤性的。
适合的溶瘤性HSV可以来源于HSV-1或HSV-2,包括任何实验室菌株或临床分 离物。在一些实施方式中,oHSV可以是或者可以来源于实验室病毒株HSV-1病毒株 17、HSV-1病毒株F或HSV-2病毒株HG52之一。在其他实施方式中,其可以是或 者来源于非实验室病毒株JS-1。下表2中是其他适合的HSV-1病毒。
表2
在一些实施方式中,oHSV具有的一个或两个γ34.5基因经过修饰,以使得其不 能表达功能性ICP34.5蛋白。该基因可以通过一个或多个核苷酸插入、缺失、取代等 来进行修饰。该变化可以在编码序列、非编码序列(例如,启动子)或二者中。在一 些实施方式中,γ34.5基因的两个拷贝均发生突变。
oHSV可以具有另外的突变,其可以包括失能突变(disabling突变)(例如,缺 失、取代、插入),其会影响病毒的毒力或者其复制的能力。例如,可以在ICP6、ICPO、 ICP4、ICP27、ICP47、ICP 24、ICP56中的任一个或多个中进行突变。优选地,在这 些基因之一中的突变(如果适合的话,可选地在该基因的两个拷贝中)导致HSV不 能(或该能力下降)表达相应的功能性多肽。在一些实施方式中,用在靶细胞中选择 性活化的或可诱导的启动子替代病毒基因的启动子。
oHSV也可以具有非HSV来源的基因和核苷酸序列。oHSV基因组中可以具有例 如,编码前药的序列、编码细胞因子或其他免疫刺激因子的序列、肿瘤特异性启动子、 诱导型启动子、增强子、与宿主细胞同源的序列、以及其他的序列。示例性序列编码 IL12、IL15、OX40L、PDL-1阻断剂或PD-1阻断剂。
可以对编码US11、ICP4、ICP27和ICP的病毒基因的调控区进行修饰以包含针 对NF-κB或Oct-3/4-SOX2或者NF-κB和Oct-3/4-SOX2二者的应答元件(RS1编码 ICP4;US11编码US11;UL54编码ICP27;UL29编码ICP8)。HSV-1载体能够具有 含有一种或两种应答元件的一种病毒基因。可替代地,该载体能够具有多于一种含有 一种或两种应答元件的病毒基因。通常,该应答元件将会位于病毒基因增强子区中。 该应答元件能够代替病毒增强子或者除病毒增强子之外还含有该应答元件。该病毒启 动子可以被替代,通常用肿瘤特异性启动子,例如survivin启动子来代替该病毒启动 子。其他的肿瘤特异性启动子是本领域已知的。也可以对其他基因元件进行修饰。例 如,可以用外源性UTR来替代病毒基因的5’UTR。
C.
提供了可用于预防、治疗或减轻癌症影响的治疗性组合物。更具体地,一些治疗性组合物包含如本文中所述的溶瘤病毒。在优选的实施方式中,该治疗性组合物能够 包含如本文中所述的溶瘤病毒。
在某些实施方式中,该组合物进一步包含药学可接受的载体。短语“药学可接受的载体”意指包括不会干扰溶瘤病毒的生物学活性并且对于接受施用的受试者无毒性 的任意载体、稀释剂或赋形剂(总体上参见,Remington:The Science and Practice ofPharmacy,Lippincott Williams&Wilkins;第21版(2005年5月1日)以及The UnitedStates PharmacopEI A:The National Formulary(USP 40-NF 35和增刊))。
在本文中所述溶瘤病毒的情形下,适合的药物载体的非限制性实例包括磷酸盐缓冲盐水溶液、水、乳液(例如油/水乳液)、各种类型的润湿剂、无菌溶液,等等。另 外的药学可接受的载体包括,凝胶、可生物吸附基质材料、含有溶瘤病毒的植入元件, 或任何其他适合的溶媒、递送或分配装置或材料。这样的载体能够通过常规方法来配 制,并且能够以有效剂量向受试者施用。另外的可药用赋形剂包括,但不限于,水、 盐水、聚乙二醇、透明质酸和乙醇。此处还可以包括可药用盐,例如,无机酸的盐(例 如盐酸、氢溴酸盐、磷酸盐、硫酸盐等)和有机酸的盐(例如乙酸盐、丙酸盐、苯甲 酸盐等)。可用于向靶细胞递送oHSV的这样的可药用(药品级)载体、稀释剂和赋 形剂将优选地不会在接受该组合物的个体(受试者)中引起免疫应答(并且优选地以 无不当毒性施用)。
本文中提供的组合物能够以各种浓度提供。例如,能够以约10
在本发明的某些实施方式中,可以使用低于标准剂量的较低剂量。因此,在某些实施方式中能够向患者施用小于约10
组合物可以在适合于稳定货架期的温度下储存,并且包括室温(约20℃)、4℃、 -20℃、-80℃,以及液N2中。由于期望体内施用的组合物通常不具有防腐剂,因此 经常会储存在更冷的温度下。组合物可以干燥形式(例如,冻干的)或以液体形式储 存。
D.
除了本文中所述的组合物之外,还提供了利用这样的组合物来治疗或缓解癌症的各种方法,所述方法包括向受试者使用有效剂量或有效量本文所述HSV载体的步骤。
术语“有效剂量”和“有效量”是指足以有效治疗目标癌症的溶瘤病毒的量,例如,有效减少目标肿瘤尺寸或载荷的量,或者阻碍目标肿瘤细胞生长速率的量。更具体地, 这样的术语是指有效地以必要剂量和治疗期间实现期望结果的溶瘤病毒的量。例如, 在治疗癌症的情形中,本文所述组合物的有效量是诱导缓解、减少肿瘤负荷和/或防 止癌症的肿瘤散播或生长的量。有效量可以根据以下因素而不同,例如,受试者的疾 病状态、年龄、性别和体重,以及药物配方、施用途径等等,但本领域技术人员能够 常规地确定。
向诊断患有癌症或疑似患有癌症的受试者施用该治疗组合物。受试者可以是人或者非人动物。
该组合物可以用于治疗癌症,本文中使用的术语“治疗”或“处理”意指获得有益或期望结果(包括临床结果)的过程。有益或期望的临床结果能够包括,但不限于,一 种或多种症状或病症的缓解或改善、疾病严重程度的减轻、疾病的稳定状态(即,未 恶化)、防止疾病的传播、延迟或减慢疾病进展、缓解或减轻疾病状态、减少疾病复 发以及控制疾病(不论部分或全部)不论可检测或不可检测。术语“治疗”或“处理” 也意指,相比于未接受治疗/处理的期望存活的存活延长。
癌症的代表性形式包括,癌瘤(carcinomas)、白血病、淋巴瘤、骨髓瘤和肉瘤。 其他实例包括,但不限于,胆管癌、、脑癌(例如,胶质母细胞瘤)、乳腺癌、宫颈癌、 结肠直肠癌、CNS(例如,听神经瘤、星形细胞瘤、颅咽管瘤(craniopharyogioma)、 室管膜瘤、胶质母细胞瘤、血管母细胞瘤、髓母细胞瘤、脑膜瘤(menangioma)、神 经母细胞瘤、少突胶质瘤、松果体瘤和视网膜母细胞瘤)、子宫内膜内层癌、造血细 胞癌症(例如,白血病和淋巴瘤)、肾癌、喉癌、肺癌、肝癌、口腔癌、卵巢癌、胰 腺癌、前列腺癌、皮肤癌(例如,黑素瘤和鳞状细胞癌)和甲状腺。癌症可以包括实 体瘤(例如,肉瘤,例如纤维肉瘤、黏液肉瘤、脂肪肉瘤、软骨肉瘤和骨肉瘤)、已 扩散(例如,白血病),或这些的组合(例如,具有实体瘤和散播的或扩散癌细胞的 转移癌)。
也可以治疗良性肿瘤和不希望的细胞增殖的其他病症。
本文中所述的oHSV可通过例如,口服、局部、肠胃外、全身、静脉内、肌肉内、 眼内、鞘内、肿瘤内、皮下或透皮途径给予。在某些实施方式中,溶瘤病毒可以通过 插管、通过导管或通过直接注射来递送。施用的位点可以是肿瘤内或远离肿瘤的位点。 施用途径经常取决于所靶向的癌症。
溶瘤病毒的最佳或适合剂量方案是本领域技术人员容易确定的,由主治医师基于患者数据、患者观察和各种临床因素来确定,包括例如受试者的体重、体表面积、年 龄、性别和所施用的特定溶瘤病毒、施用时间和途径、待治疗的癌症类型、患者的总 体健康状况、以及该患者正在接受的其他药物治疗。根据某些实施方式,利用本文中 所述的溶瘤病毒对受试者进行治疗可以与其他类型的治疗联合,例如,利用化疗,例 如,化疗剂,例如依托泊甙、异环磷酰胺、阿霉素、长春新碱、强力霉素等等。
可将oHSV配制成用于临床应用的药物和药物组合物,并且可以与可药用载体、 稀释剂、赋形剂或辅料组合。该配方至少部分地取决于施用的途径。适合的配方可以 包括无菌培养基中的病毒和抑制剂。该配方可以是流体、凝胶、糊状或者固体形式。 可将配方提供给受试者或专业医疗机构。
优选地施用治疗有效量。其是充分显示出对受试者益处的量。所施用的实际量和施用的时程将至少不分地取决于癌症的性质、受试者的情况、递送位点以及其他因素。
在本发明的另外其他的实施方式中,溶瘤病毒能够瘤内施用,或者肿瘤手术切除后施用。
以下实施例是以举例说明的方式,而不是以限制的方式提供。
实施例
实施例1
病毒产生的增强
在本实施例中,在存在NF-κB的活化剂的情形下测量图1A中所示的生产。该病 毒在ICP4的调控区中具有NF-κB应答元件。在活化NF-κB的TNFα存在的情形下, 病毒产生显著增强(图2)。
实施例2
示例性构建体
在本实施例中,示出了各种及其序列。
OS-ICP27包含ZTP206 BS1(Oct4/Sox2结合位点)和替代UL53(糖蛋白K) 和UL54(ICP27)之间的天然基因间区域的survivin启动子(图3)。
NO-ICP27-145包含在UL53(糖蛋白K)poly(A)的下游和UL54(ICP27)TATA 盒的上游位置处插入到UL53(糖蛋白K)和UL54(ICP27)之间的基因间区域中的 NF-kB应答元件和Oct4/Sox2结合位点(ZTP206 BS1)(图4)。
NO-ICP27-99包含在UL53(糖蛋白K)poly(A)的下游和UL54(ICP27)TATA 盒的上游位置处插入到UL53(糖蛋白K)和UL54(ICP27)之间的基因间区域中的 NF-kB应答元件和Oct4/Sox2结合位点(ZTP206 BS1)(图5)。
hVG161包含经修饰的ICP34.5区(图6;SEQ ID NO.6),经修饰的UL54启动 子-调控区(图7;SEQ ID NO.7),插入到UL3和UL4之间的基因间区域中的PD-L1 阻断剂(图8;SEQ IDNo.8)以及携带编码IL-12、IL-15和IL-15受体α亚单元的 表达盒的经修饰的末端重复(TR)区(图9;SEQ ID NO.9)。这四种病毒还具有经 修饰的和部分缺失的ICP 34.5区。
除了mVG161携带IL-12的小鼠版和在hVG161携带人IL-12和人PD-L1阻断剂 的病毒基因组上相同位置中的小鼠PD-L1阻断剂之外,mVG161与hVG161的小鼠 版在功能上完全相同。
实施例3
后续实施例中使用的缩写
TF-Fc:融合至Fc的PD-L1封闭肽(TF)并且用于构建VG161。
IL-TF-Fc:携带IL-12、IL-15和PD-L1阻断剂的质粒。
HSV-345:ICP34.5-缺失的病毒。
OS-ICP27 2-11:ICP34.5-缺失的病毒,其具有插入到不用于构建VG161的ICP27(OS-ICP27)的启动子-调控区中的Oct4/Sox2结合位点和surviving启动子(OS)。
OS-ICP27 5-7:ICP34.5-缺失的病毒,其具有不用于构建VG161的OS-ICP27突 变。
NO-ICP27 1-4-4(也被称作NO-ICP27-145):ICP34.5-缺失的病毒,其具有在ICP27的转录起始位点的上游145bp位置处插入到ICP27(NO-ICP27)的启动子-调控区中 并且用于构建VG161的NF-kB应答元件和Oct4/Sox2结合位点(NO)。
NO-ICP27 5-2-2(也被称作NO-ICP27-99):ICP34.5-缺失的病毒,其具有在ICP27的转录起始位点的上游99bp位置处插入到ICP27(NO-ICP27)的启动子-调控区中 并且不用于构建VG161的NF-kB应答元件和Oct4/Sox2结合位点(NO)。
VG001(也被称作VG160):用于构建VG161的骨架病毒(携带异源启动子和 poly(A)的NO-ICP27 1-4-4突变体,poly(A)侧链具有在虽有用于插入IL-12/IL-15表达 盒的病毒基因组的缺失的末端重复区中的空的MCS)。
VG001-15h(也被称作VG161-15h):携带人IL-15的VG001。
VG001-1215h(也被称作VG161-1215h):携带人IL-12和人IL-15的VG001。
VG001-PLBh(也被称作VG161-PLBh):携带插入到UL3和UL4之间的基因间 区域中的人PD-L1阻断剂的VG001。
8-8-15RA1-PDL1b:携带人IL-15和人PD-L1阻断剂的VG001。
VG161-1215PLBm(也被称作mVG161):携带小鼠IL-12、人IL-15和小鼠PD-L1 阻断剂的VG001。
VG161-1215PLBh(也被称作hVG161或VG161):携带人IL-12、人IL-15和人 PD-L1阻断剂的VG001。
实施例4
在ICP27启动子/调控区中包含突变的示例性构建体的结果。
在本实施例中,使用在ICP27启动子-调控区中具有突变的病毒来感染细胞。
在图10A-图10G中,用所述的HSV-1突变体以MOI 0.01、0.1和1感染Vero、 LS174T、293FT、H460、U87wt和LNCaP细胞。在感染后72小时,利用MTT测定 对细胞活力进行定量分析。
在图10H-图10I中,用HSV-1突变体NO-ICP27 1-4-4和NO-ICP27 5-2-2在二者 均利用或不利用20ng/mL的TNFα诱导的情况下以MOI为1感染Vero、293FT、 LS174T、H460和LNCaP细胞。在感染后5小时收获感染的细胞,并且分别用抗-ICP27 和抗-肌动蛋白抗体探查细胞裂解液以检测ICP27和肌动蛋白的表达。对于蛋白质印 记,肌动蛋白用作上样内参(loading control)。对条带强度进行定量分析并且用于评 价归一化为肌动蛋白的ICP27的表达(图10H)。TNFα-介导的ICP27表达的诱导被 测量(图10I)为用TNFα处理后归一化的ICP27表达中的倍数变化。对TNFα的强 烈应答证实了,由于ICP27表达的更强上调,最终选择在VG161突变体病毒中包括 两种版本的NO-ICP27,而不包括NO-ICP27 1-4-4变体。
在图10J-图10K中,用HSV-1突变体NO-ICP27 1-4-4和NO-ICP27 5-2-2在二者 均利用或不利用20ng/mL的TNFα诱导的情况下以MOI为1感染Vero、U87和 LS174T细胞。在感染后24小时收获细胞,并使其经历一次冷冻/解冻循环以完成裂 解感染的细胞,之后在Vero细胞上进行滴定。图10J示出了原始滴定数据,而图10K 为来自图10J的数据的图示。在TNFα诱导之后,NO-ICP27突变体在Vero、U87和 LS174T细胞表现出增强复制。最终选择NO-ICP271-4-4突变体作为插入PD-L1阻断 剂和IL-12/IL-15表达盒以产生最终VG161突变体病毒的骨架。
实施例5
用hVG161感染细胞之后IL-12的表达
在本实施例中,示出了IL-12表达的蛋白质印记和ELISA数据。
图11A示出了VG161-1215PLBh病毒感染之后的蛋白质印记结果。用 VG161-1215PLB或VG001病毒(MOI=1)感染H460肿瘤细胞24小时。制备细胞 裂解液,在12%SDS-PAGE凝胶中上样,并将其转移至PVDF膜。用抗-人IL-12抗 体,之后用HRP-缀合的抗-小鼠IgG二抗对该膜进行印记分析,并且利用Bio-Rad ImageLab系统对图像进行检测和分析。
图11B-图11C示出了在VG161-1215PLBh病毒感染之后人IL-12的产生上调。 用VG161-1215PLB或VG001病毒(MOI=1)感染LS174T或H460肿瘤细胞48小 时。收获感染的细胞上清并将其结合至涂覆有抗-人IL-12捕获抗体的96-孔Immuno Maxisorp平底板。经由生物素化的抗-人IL-12抗体、亲和素-辣根过氧化物酶 (avidin-horseradish peroxidase,HRP)和3,3’,5,5’-四甲基联苯胺(TMB)底物来检 测结合。在450nm处经由读板器来收集吸附性测量值。基于人IL-12标准曲线来计 算所培养的上清中人IL-12的浓度。
实施例6
用hVG161感染细胞之后IL-15的表达
在本实施例中,示出了IL-15表达的蛋白质印记和ELISA数据。
图12A示出了VG161-1215PLBh病毒感染之后蛋白质印记结果。用 VG161-1215PLB或VG001病毒(MOI=1)感染H460肿瘤细胞24小时。制备细胞 裂解液,在12%SDS-PAGE凝胶中上样,并将其转移至PVDF膜。用抗-人IL-15抗 体,之后用HRP-缀合的抗-小鼠IgG二抗对该膜进行印记分析,并且利用Bio-Rad ImageLab系统对图像进行检测和分析。
图12B-图12C示出了在VG161-1215PLBh病毒感染之后人IL-15的产生上调。 用VG161-1215PLB或VG001病毒(MOI=1)感染LS174T或H460肿瘤细胞48小 时。收获感染的细胞上清并将其结合至涂覆有抗-人IL-15捕获抗体的96-孔Immuno Maxisorp平底板。经由生物素化的抗-人IL-15抗体、亲和素-辣根过氧化物酶(HRP) 和3,3’,5,5’-四甲基联苯胺(TMB)底物来检测结合。在450nm处经由读板器来收集 吸附性测量值。基于人IL-15标准曲线来计算所培养的上清中人IL-15的浓度。
实施例7
用hVG161感染细胞之后IgG4的表达
在本实施例中,示出了IgG4表达的蛋白质印记和ELISA数据。
图13A示出了VG161-1215PLBh病毒感染之后的蛋白质印记结果。用 VG161-1215PLB或VG001病毒(MOI=1)感染H460肿瘤细胞24小时。制备细胞 裂解液,在12%SDS-PAGE凝胶中上样,并将其转移至PVDF膜。用HRP-缀合的抗 -人IgG抗体对该膜进行印记分析,并且利用Bio-Rad ImageLab系统对图像进行检测 和分析。
图13B-图13C示出了在VG161-1215PLBh病毒感染之后人PD-L1阻断剂(融合 至人Fc结构域)的产生上调。用VG161-1215PLB或VG001病毒(MOI=1)感染 LS174T或H460肿瘤细胞48小时。收获感染的细胞上清并将其结合至涂覆有抗-人IgG4捕获抗体的96-孔ImmunoMaxisorp平底板。经由生物素化的抗-人IgG4抗体、 亲和素-辣根过氧化物酶(HRP)和3,3’,5,5’-四甲基联苯胺(TMB)底物来检测结合。 在450nm处经由读板器来收集吸附性测量值。基于人IgG4标准曲线来计算所培养 的上清中人IgG4的浓度。
实施例8
病毒VG161-pLBh和VG161-15h的体外效力
在本实施例中,将3×10
实施例9
各种构建体的体外效力
图15A-图15D示出了各种构建体的体外测定的结果。
图15A-图15B示出了用携带IL-12、IL-15和PD-L1阻断剂的IL-TF-Fc质粒进行 细胞转染的结果。在图15A-图15B中,用IL-TF-Fc质粒DNA转染不同的肿瘤细胞 系24小时,并且随后将人PBMC加入到培养物中。在通过LDH测定进行细胞毒性 的定量分析之后的24小时(图15A),以及在利用ELISA测定进行人IFNg产生的检 测之后48小时(图15B)收获细胞上清。
图15C-图15D示出了用包括hVG161的各种突变病毒感染细胞的结果。病毒编 码的IL12、IL15和PD-L1阻断剂协同地增强IFNg产生和细胞毒性。将H460肿瘤细 胞接种到96-孔板的每个孔中并在37℃培养过夜。第二天,用所述的病毒以MOI=1 感染接种的细胞24小时。随后将人PBMC加入到培养物中,并且共培养24小时以 通过LDH测定评价细胞毒性(图15C)或者共培养48小时通过ELISA评价人IFNg 产生ELISA(图15D)。对于细胞毒性测定,基于下式来计算细胞毒性百分比:[(实 际读数–最小释放)/(最大释放–最小释放)]×100%。收获自仅与培养基一起孵育的 肿瘤细胞的上清用作最小释放,而收获自与裂解缓冲液一起孵育的肿瘤细胞的上清用 作最大释放。
在图16A-16E中,用VG161-1212PLBh(VG161h)和HSV-345病毒以MOI为0、 0.04、0.2、1和5感染一组9种不同人肿瘤细胞系(+Vero细胞)。在感染后48小时, 利用MTT测定对细胞活力进行定量分析。
图17A-图17J示出了各种构建体的体外测定的结果。图17A-图17E示出了结果 在小鼠肿瘤细胞系和Vero细胞系上针对mVG161和HSV-345的细胞活力测定的结果; 图17F-图17J示出了CT26小鼠肿瘤细胞感染mVG161或VG001之后的转基因表达 表征的结果。
在图17A-图17E中,用VG161m和HSV-345病毒以MOI为0、0.04、0.2、1和 5感染一组6种不同的小鼠肿瘤细胞系(+Vero细胞)。在感染后48小时,利用MTT 测定对细胞活力进行定量分析。
在图17F-17J中,将3×10
在图18A-18E中,将3×10
在图19A-图19G中,在感染后72小时以及MOI范围0至5,在各种人癌细胞 (U87、MCF7、H460、LNCaP、LS174T、MDA和PC3)中评价VG161-1215PLBh (hVG161)病毒的抗肿瘤效果。通过MTT测定对细胞存活百分比进行定量分析。 在所有的测试人肿瘤细胞系中,VG161-1215PLBh病毒表现出强力细胞杀伤能力。
实施例11
VG161病毒构建体的体内效力
在图20A-图20B中,对鼠B-细胞淋巴肿瘤的BALB/c荷瘤小鼠A20进行五次瘤 内注射总共1×10
在图20C-图20D中,对CT26鼠结肠癌肿瘤荷瘤小鼠A20进行五次瘤内注射总 共5×10
在图20E-图20G中,评价了小鼠中异种移植人前列腺肿瘤的oHSV治疗。用 LNCaP人前列腺肿瘤细胞植入12只小鼠的右侧下腹部。在移植后35天,随机选择6 只动物为一组,五次瘤内注射总共5×10
实施例12
细胞系中的hVG161复制
图21-图24中的生长曲线合细胞毒性数据示出了hVG161病毒复制和亲代 HSV-345病毒。这些数据还示出了,相比于人细胞系,该病毒在小鼠肿瘤细胞系中也 不生长,但已知HSV-1在小鼠细胞中生长不良。
以下是本文披露的另外的示例性实施方式:
1)一种HSV载体,其在影响病毒复制效率的病毒基因的调控区中NF-κB应 答元件。
2)一种HSV载体,其在影响病毒复制效率的病毒基因的调控区中包含 Oct-3/4-SOX2应答元件。.
3)实施方式1或2的载体,其中,该病毒基因编码ICP4、ICP27、US11或 ICP8。在实施方式1和/或2的其他方面,该HSV载体为HSV-1载体。
4)实施方式1至3中任一项的载体,其中,该NF-κB应答元件包含表1中 GGGAATTTCC或变体的1-15个串联序列。
5)实施方式4的载体,其中,该串联序列完全相同,或者是相同和不同序列 或全部不同序列的混合。
6)实施方式4的载体,其中,该NF-κB应答元件具有序列 GGGAATTTCCGGGGACTTTCCGGGAATTTCCGGGGACTTTCCGGGAATTTCC。
7)实施方式2的载体,其中该OCT-3/4-SOX2复合应答元件包含SEQ ID NO: 2或其变体,其中,该变体具有至少90%的相同核苷酸。
8)实施方式1-7中任一项的的载体,进一步包含编码用于癌症治疗的治疗性 物质的序列。
9)实施方式8的HSV载体,其中,该治疗性物质IL12、IL15、OX40L、PDL-1 阻断剂和/或PD-1阻断剂。
10)一种治疗癌症的方法,包括向有需要的患者施用根据实施方式1-9中任一 项所述的HSV-1载体。
11)一种治疗癌症干细胞和难治性癌症的方法,包括向患有难治性癌症或者具 有癌症干细胞的癌症的患者施用根据实施方式1-9中任一项所述的HSV载体。
12)实施方式10-11的方法,其中,所述癌症为结肠癌、肺癌、乳腺癌、前列 腺癌、脑癌或膀胱癌。
根据前文所述能够理解,尽管本文中已经处于举例说明的方式描述了具体实施方式,但在不背离本发明的精神和范围的前提下可以做出各种修改。因此,本发明不受 所附权利要求书的限制。
本文说明书中所引用的和/或申请数据页中列出的所有的美国专利、美国专利申请公开、美国专利公开、外国专利、外国专利申请和非专利出版物以其全部内容结合 于本文作为参考。出于描述和披露的目的将这些文献结合于本文,例如可以与本发明 当前描述的内容相结合的出版物中所描述的材料和方法。上文所讨论的出版物及其全 文仅仅是出于在本申请的申请日之前披露的目的提供。本申请不应被解释为承认发明 人无权基于在先发明早于任何参考出版物。
本文中引用和提及的所有的专利、出版物、科学文章、网站以及其他文献和材料是本发明所属领域的技术人员可以理解的水平,并且每一篇这样的参考文献和材料均 以相同的程度结合于本文,如同以其全部内容单独引入作为参考或者以其全部内容并 入本文作为参考。申请人保留将本说明书的内容结合至来自任意这样的专利、出版物、 科学文章、网站、可获得的电子信息以及其他参考材料或文献的任何或全部材料和信 息的权利。
通常,在以下权利要求书中,所使用的术语不应被解释为将所述权利要求限制为本文说明书和权利要求书中披露的具体实施方式,而是应该解释为包括所有可能的实 施方式,以及等同于这样的权利要求书所涵盖范围的全部范围。因此,权利要求书不 受到披露内容的限制。
此外,本专利的书面说明部分包括所有权利要求。而且,包括原始权利要求以及来自任意或全部优先权文件的权利要求均以其全部内容以饮用方式结合于本文说明 书书面说明部分,并且申请人保留将本申请的该书面说明或任意其他部分结合至任意 和全部这些权利要求中的权利。因此,例如,本专利在任何情况下都不应被解释为据 称没有就权利要求的精确措辞在专利的书面描述部分中没有以同样的语言阐述的断 言为权利要求提供书面描述。
以下权利要求书中包含其他的非限制性实施方式。本专利不应被解释为限制为具体实例或非限制性实施方式或本文中具体描述和/或表述的方法。如果申请人在书面 答辩中没有具体地且无资格或无保留表达采用这样的陈述,则本专利在任何情况下都 不应被解释为通过任何审查员或专利商标局的任何其他官员或雇员做出的任何陈述 而受到限制。
参考文献
1.Goldsten DJ and Weller SK,Herpes simplex virus type 1-inducedribonucleotide reductase activity is dispensable for virus growth and DNAsynthesis:isolation and characterization of an ICP6 lacZ insertionmutant.J.Virol.62,196-205,1988
2.Mineta T,Rabkin SD,Yazaki T,Hunter WD and Martuza RL.Attenuatedmulti–mutated herpes simplex virus–1for the treatment of malignantgliomas.Nature medicine.1995;1(9):938-943.
3.Kooby DA,Carew JF,Halterman MW,Mack JE,Bertino JR,Blumgart LH,Federoff HJ and Fong Y.Oncolytic viral therapy for human colorectal cancerand liver metastases using a multi-mutated herpes simplex virus type-1(G207).The FASEB journal.1999; 13(11):1325-1334.
4.Todo T,Martuza RL,Rabkin SD and Johnson PA.Oncolytic herpes simplexvirus vector with enhanced MHC class I presentation and tumor cellkilling.Proceedings of the National Academy of Sciences.2001;98(11):6396-6401.
5.Mace A,Ganly I,Soutar DS and Brown SM.Potential for efficacy of theoncolytic Herpes simplex virus 1716 in patients with oral squamous cellcarcinoma.Head&neck. 2008;30(8):1045-1051.
6.Harrow S,Papanastassiou V,Harland J,Mabbs R,Petty R,Fraser M,HadleyD, Patterson J,Brown S and Rampling R.HSV1716 injection into the brainadjacent to tumour following surgical resection of high-grade glioma:safetydata and long-term survival.Gene therapy.2004;11(22):1648-1658.
7.Nakao A,Kasuya H,Sahin T,Nomura N,Kanzaki A,Misawa M,Shirota T,Yamada S,Fujii T and Sugimoto H.A phase I dose-escalation clinical trial ofintraoperative direct intratumoral injection of HF10 oncolytic virus in non-resectable patients with advanced pancreatic cancer.Cancer gene therapy.2011;18(3):167-175.
8.Fong Y,Kim T,Bhargava A,Schwartz L,Brown K,Brody L,Covey A,KarraschM, Getrajdman G and Mescheder A.A herpes oncolytic virus can be delivered viathe vasculature to produce biologic changes in human colorectalcancer.Molecular Therapy. 2009;17(2):389-394.
9.Andtbacka RH,Kaufman HL,Collichio F,Amatruda T,Senzer N,Chesney J,Delman KA,Spitler LE,Puzanov I and Agarwala SS.Talimogene laherparepvecimproves durable response rate in patients with advanced melanoma.Journal ofClinical Oncology. 2015:JCO.2014.2058.3377.
10.Gaston DC,Odom CI,Li L,Markert JM,Roth JC,Cassady KA,Whitley RJand Parker JN.Production of bioactive soluble interleukin-15 in complex withinterleukin-15 receptor alpha from a conditionally-replicating oncolytic HSV-1.PloS one.2013; 8(11):e81768.
11.Parker JN,Gillespie GY,Love CE,Randall S,Whitley RJ and MarkertJM. Engineered herpes simplex virus expressing IL-12 in the treatment ofexperimental murine brain tumors.Proceedings of the National Academy ofSciences.2000;97(5):2208-2213.
12.Passer BJ,Cheema T,Wu S,Wu C,Rabkin SD and Martuza RL.Combinationof vinblastine and oncolytic herpes simplex virus vector expressing IL-12therapy increases antitumor and antiangiogenic effects in prostate cancermodels.Cancer gene therapy. 2013;20(1):17-24.
13.Carew JF,Kooby DA,Halterman MW,Kim S-H,Federoff HJ and Fong Y.Anovel approach to cancer therapy using an oncolytic herpes virus to packageamplicons containing cytokine genes.Molecular Therapy.2001;4(3):250-256.
14.Kambara H,Okano H,Chiocca EA and Saeki Y.An oncolytic HSV-1 mutantexpressing ICP34.5 under control of a nestin promoter increases survival ofanimals even when symptomatic from a brain tumor.Cancer Research.2005;65(7):2832-2839.
15.Fukuhara H,Ino Y,Kuroda T,Martuza RL and Todo T.Triple Gene-Deleted Oncolytic Herpes Simplex Virus Vector Double-Armed with Interleukin18 and Soluble B7-1 Constructed by Bacterial Artificial Chromosome–MediatedSystem.Cancer research. 2005;65(23):10663-10668.
- 在癌细胞中具有增强复制的HSV载体
- 在癌细胞中具有增强复制的HSV载体
