一种花青苷检测方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及色素检测技术领域,具体涉及一种花青苷检测方法。
背景技术
花青苷是一类水溶性植物色素,广泛存在于植物的花、果实、茎、叶中,是植物的主要呈色物质,使它们呈现红、蓝、紫等不同的颜色。在自然条件下,很少会有游离的花青素单体存在,其常与一个或者若干单糖葡萄糖(glucose)、阿拉伯糖(arabinose)、木糖(xylose)、鼠李糖(rhamnose)、半乳糖(galactose)或者二糖槐二糖(sophorose)芸香糖(rutinose)亦或三糖如龙胆三糖(gentianose)等通过糖苷键形成花青苷。紫外-可见分光光度法操作相对简便,但无法测定出花青素的种类和准确含量;液质联用适合测定花青素含量较低的植物性样品,同时可用于鉴定一些未知结构的花色苷,然而含量较高的样品容易超出其线性范围。
发明内容
本发明的目的在于提供一种花青苷检测方法,通过本发明方法可以对花青苷的各个组分进行动态的定性定量的测定,揭示其各组分的花青素含量在发育阶段中的变化趋势,为大齿报春苣苔中花青素的研究提供技术支撑。
为实现上述目标,本研究采取的技术方案为:
一种花青苷检测方法,包括以下步骤:
(1)花青苷提取液的制备:采用超声提取法对不同发育时期的大齿报春苣苔花朵进行花青苷提取,获得不同发育时期的大齿报春苣苔花朵的花青苷提取液;
(2)氯化花青素标准品溶液的制备:将氯化锦葵素、氯化飞燕草素、氯化矢车菊素、氯化矮牵牛素、氯化芍药花素、氯化天竺葵素标准品,分别用盐酸甲醇溶液进行溶解,制备不同稀释浓度的标准品溶液;
(3)花青苷水解样品的制备:往步骤(1)得到的花青苷提取液中加入盐酸溶液,然后进行避光水浴处理,将水浴后的溶液加至离心管中,避光真空旋蒸后,用盐酸甲醇溶液重新溶解,得到浓缩水解样品;
(4)花青苷含量检测:采用高效液相色谱法分别对氯化花青素标准品溶液、花青苷水解样品进行检测,绘制相应标准品的标准曲线,并与未知样品进行分析比对,获得花青苷水解样品中花青苷的含量。
优选的,步骤(2)和(3)中,所述的盐酸甲醇溶液是含体积分数1%的3mol/L盐酸的甲醇溶液。
优选的,步骤(2)中,所述的标准品溶液的浓度分别为10μg/mL、20μg/mL、40μg/mL、80μg/mL。
优选的,步骤(3)中,所述的盐酸溶液是浓度为3mol/L的盐酸溶液,所述的盐酸溶液与花青苷提取液的混合体积比为6:1。
优选的,步骤(3)中,所述的避光水浴处理是在97℃避光水浴1h。
优选的,步骤(3)中,所述的避光真空旋蒸是避光真空旋蒸3.5h。
优选的,步骤(4)中,所述的高效液相色谱法的检测条件为:采用PDA检测器,赛默飞C18色谱柱,流速0.8ml/min,柱温40℃,样品盘4℃,在200~600nm内进行全波长扫描,选取花青苷的特殊吸收波长520nm进行单波长扫描,每个样品设置每次进样10ul,进样3次;流动相A:含体积分数1%甲酸的纯化水,流动相B:100%乙腈,洗脱程序如下:
优选的,步骤(1)中,所述的不同发育时期的大齿报春苣苔花朵是根据花朵的大小划分,共分5个发育阶段:小蕾期S1:0.5-0.9cm;大蕾期S2:0.9-1.7cm;初开期S3:1.7-2.5cm;全开期S4:花开当天;末花期S5:花开后五天。
优选的,步骤(1)中,所述的超声提取法具体步骤为:花朵采集后,立即冻存;将冻存后的花朵样品研磨成粉状,置于预冷的含提取液的离心管中,超声辅助闭光提取,提取过程中不断加冰降温,提取完毕后离心,取上清,共重复提取三次,合并三次提取的上清;将合并后的上清用滤膜过滤,即得到花青苷提取液。
优选的,所述的提取液为含体积分数1%的3mol/L盐酸的甲醇溶液;所述的花朵样品与提取液是按0.5g样品/3mL提取液的比例进行混合。
本发明具有如下有益效果:
本发明提供了一种花青苷检测方法,通过本发明方法可以对花青苷的各个组分进行动态的定性定量的测定,揭示其各组分的花青素含量在发育阶段中的变化趋势,为大齿报春苣苔中花青素的研究提供技术支撑。
附图说明
图1为大齿报春苣苔5个发育阶段的花青苷总量变化。
图2为6种氯化花色素标准品的保留时间。
图3为S1时期花青苷提取液水解前后对比图。(a)水解前;(b)水解后。
图4为S2~S5时期花青素色谱图。
图5为6种花青素在不同发育阶段中的含量变化。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
相关试验材料如下:
高效液相色谱仪:Alliance e2695主机、2998PDA检测器、Symmetry C18 250mm色谱柱(Waters,美国)。
真空离心浓缩仪Eppendorf Concentrator(Eppendorf,德国),超声清洗机5200-DT(宁波新芝生物科技有限公司),PH计PE-28standard(Mettler Toledo,瑞士),超纯水仪SenergyUV.Kit(广州皇河仪器科技有限公司),紫外可见分光光度计UC-6100(上海元析仪器有限公司)。
氯化锦葵素(Malvidin Chloride)、氯化飞燕草素(Delphinidin Chloride)、氯化矢车菊素(Cyanidin Chloride)购于西格玛奥德里奇公司,氯化矮牵牛素(PetunidinChloride)、氯化芍药花素(Peonidin Chloride)购于北京翰隆达科技发展有限公司,氯化天竺葵素(Pelargonidin Chloride)购于北京鸿跃创新科技有限公司。
实施例1:花青苷的提取
1、实验材料
以不同发育时期的大齿报春苣苔(Primulina juliae)新鲜花瓣为实验材料,于2017年8~10月采自华南植物园科研温室。
2、取样
根据花朵的大小划分花发育时期,共分5个发育阶段:小蕾期S1:0.5-0.9cm;大蕾期S2:0.9-1.7cm;初开期S3:1.7-2.5cm;全开期S4:花开当天;末花期S5:花开后五天。取样之后对各个时期样品进行拍照并应用比色卡比较色泽,之后立即用液氮冻存,并保存在-80℃的冰箱中。实验时每个时期取用0.5g用于花青苷的提取。每个时期准备3个生物学重复。
大齿报春苣苔5个发育阶段的花朵中,S1时期的花蕾整体长势较匀称,顶端呈紫色,中部呈淡绿色;S2时期的花蕾快速生长,顶端膨大,可以很明显的观察到顶端具有较深的紫色;S3时期的花蕾整体迅速膨大;S4时期的花朵盛开,呈深紫色,整个花朵的颜色主要在于顶端花瓣中,花瓣具有颜色更深的长度延伸到花筒内部的纹路,花筒整体呈白色,贴近花瓣的位置会有淡黄、淡红色的小块区域;S5时期的花瓣和S4时期相比,开放角度变大,颜色变浅,纹路略微变宽。
3、大齿报春苣苔花青苷提取
(1)准备:取3支10mL离心管,分别加入3mL的甲醇(含体积分数1%的3mol/L的盐酸)提取液,称重后置于-20℃冰箱中预冷。
(2)研磨:将花朵样品用液氮速冻,研磨成粉状,称取约0.5g样品于预冷的离心管中,擦干外壁水珠并称重。
(3)提取:超声(功率40KHZ)辅助闭光提取30min,提取过程中不断加冰降温。
(4)离心:8000rpm、4℃离心8min,取上清。
(5)重复提取2次,合并3次上清。
(6)将合并后的上清经过0.22μm的滤膜过滤后,定容至10mL棕色容量瓶中,得到花青苷提取液,用锡箔纸包好后保存至-40℃的冰箱中。
实施例2:pH示差法测定各个时期花青苷总量
(1)准备pH=1的KCl缓冲液。准确称量1.49g KCl用蒸馏水定容至100mL。准确称量1.7mL浓盐酸,用蒸馏水定容至100mL,配成0.2mol/L盐酸溶液,将KCl溶液与盐酸溶液按体积比25:67比例混合,用KCl溶液将pH调至1(±0.1)。
(2)准备pH=4.5的NaAc缓冲液。准确称量1.64g NaAc用蒸馏水定容至100mL,用事先配好的盐酸溶液将pH调至4.5(±0.1)。
(3)将实施例1制得的花青苷提取液分别与两种缓冲液以体积比1:4的比例混匀,以溶剂为空白对照,室温避光放置20~30min。
(4)加入光程1cm的500μL比色皿中,用紫外分光光度计测定520nm和700nm的吸光值。花青苷含量(mg/g)=ΔDVFM*1000/(εm),
其中ΔD=(A
通过紫外分光光度计,根据pH示差法共测定5个时期的花青苷含量的变化,结果发现在大齿报春苣苔花朵的发育过程中,总花青苷含量在S1时期含量最高,之后呈递减的趋势,在S3~S5时期趋势趋于平稳(图1)。
实施例3:花青苷的检测
1、氯化花青素标准品溶液的制备:将氯化锦葵素、氯化飞燕草素、氯化矢车菊素、氯化矮牵牛素、氯化芍药花素、氯化天竺葵素标准品,分别用甲醇溶液(含1%v/v 3mol/L盐酸)进行溶解,制成1mg/mL的母液,然后用甲醇溶液(含1%v/v 3mol/L盐酸)进行稀释,配制浓度分别为10μg/mL、20μg/mL、40μg/mL、80μg/mL的标准品溶液,备用进样。
2、花青苷水解样品的制备:
(1)以实施例1提取的不同发育阶段的花青苷提取液作为待测样品,从单个发育阶段的花青苷提取液中吸取500μL液体于10mL离心管中,加入3mL 3mol/L的盐酸溶液;
(2)将混合液体放置于97℃的水浴锅中,避光水浴1h;
(3)取出水浴后的液体分装到6支离心管中,前5支每个离心管滴加500μL处理液,将剩余所有的处理液滴加至最后一支离心管中,避光真空旋蒸3.5h;
(4)真空旋蒸结束后,在第1支离心管中加入50μL甲醇溶液(含1%v/v 3mol/L盐酸),吹打重溶后,吸出滴加至第2支离心管,以此类推,直到第6支离心管,之后重复之前的操作,将得到的浓缩水解样品移至内衬管中,备用进样。
3、花青苷含量检测:采用高效液相色谱法分别对氯化花青素标准品溶液、花青苷水解样品进行检测,绘制相应标准品的标准曲线,并与未知样品进行分析比对,获得花青苷水解样品中花青苷的含量,具体步骤:
(1)准备:开机自检,PDA检测器预热30min,A、B流动相超声20min,以洗脱程序的第一流动相比例平衡色谱柱45min之后,准备进样;
(2)设置洗脱程序:进样的洗脱程序如表1,其中流动相A:纯水(含1%v/v甲酸),流动相B:100%乙腈,洗脱程序如下:
表1高效液相色谱洗脱程序
(3)洗脱过程中其他条件为:赛默飞C18色谱柱,流速0.8mL/min,柱温40℃,样品盘4℃,在200~600nm内进行全波长扫描,选取花青苷的特殊吸收波长520nm进行单波长扫描。每个样品设置每次进样10μL,进样3次。
(4)制备标准曲线和数据分析。液相色谱峰图分析软件为Waters的Empower软件。作图分析软件为Origin9.1Pro。以氯化花青素标准品不同浓度为横坐标,不同浓度标准品所检测出的峰面积为纵坐标,建立标准曲线,并与未知样品进行分析比对。
4、结果:
(1)6种氯化花色素标准品的保留时间见图2。由图2可知,6种花青素的保留时间分别为飞燕草素(Dp)8.65min、矢车菊素(Cy)10.6min、矮牵牛素(Pt)11.8min、天竺葵素(Pg)13.8min、芍药花素(Pn)15.4min、锦葵素(Mv)16.3min,3min左右的峰形为溶剂峰。
(2)6种氯化花色素标准品的标准曲线方程见表2所示。
表2氯化花青素标准品标准曲线方程
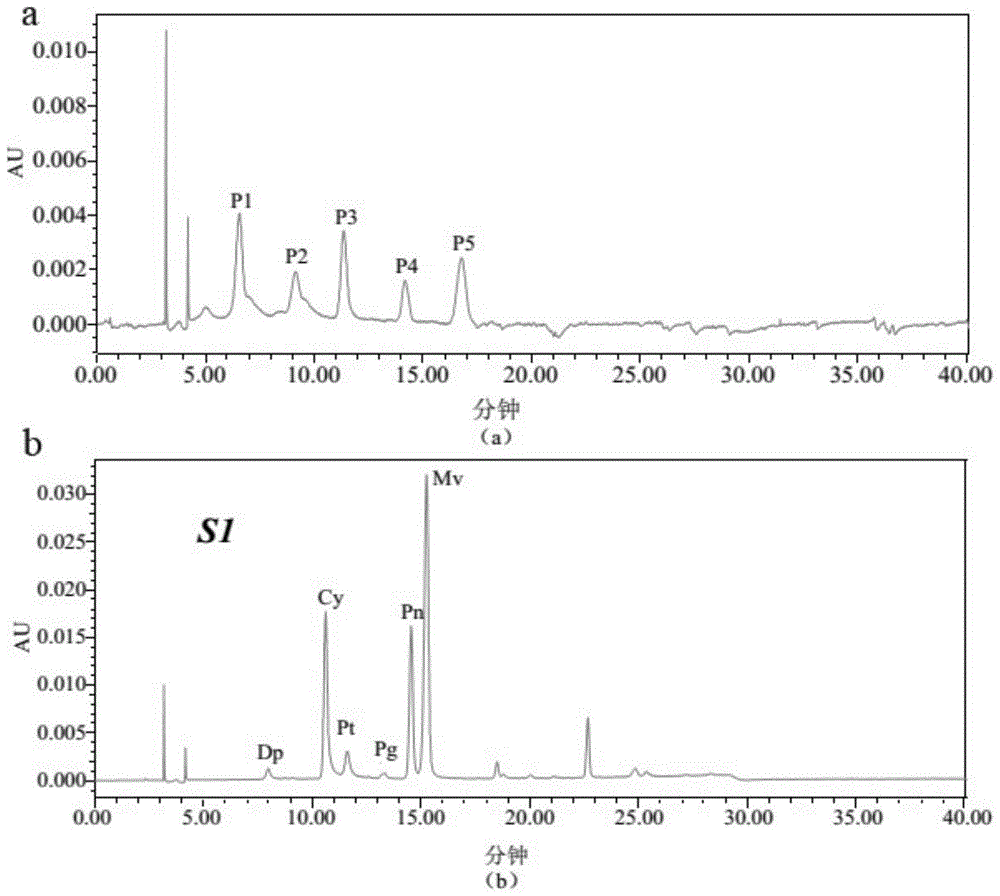
(3)花青苷提取液水解前后对比见图3。
在对总花青苷含量最高的S1时期的样品进行高温强酸处理后,和未经过处理的S1时期的样品通过液相色谱技术进行比较,发现经过高温强酸处理后的样品(图3b),其出峰的保留时间能够很好的对应氯化花青素标准品(图2),且其响应值显著高于未处理样品(图3a)。
S2~S5时期花青素色谱图见图4所示。由图4可知,经高温强酸处理后的S2~S5时期的样品同样具有较高的响应值,且出峰的保留时间也能够很好的对应氯化花青素标准品。
(4)6种花青素在不同发育阶段中的含量变化见图5。
由图5可知,在大齿报春苣苔的5个发育阶段中,6种花青素含量在S1时期即已达到最高峰,之后不断降低。其中矢车菊素的含量一直呈下降趋势;飞燕草素和天竺葵素在S3时期后,下降趋势趋于平稳;芍药花素、矮牵牛素和锦葵素则在S3时期之后出现过了小幅度上升趋势。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种柑橘花青苷积累形成红肉性状的分子检测方法
- 一种杨梅CAPS标记在检测杨梅花青苷相关MrMYB1等位基因中的应用
- 一种葡萄籽中原花青素含量的近红外检测方法
- 一种高效液相色谱检测橙皮苷的方法
- 一种脐橙皮中挥发油和黄酮苷类成分的提取及检测方法
- 一种山茶花中多种花青苷的含量检测方法
- 一种柑橘花青苷积累形成红肉性状的分子检测方法
