一种抗NKG2A单克隆抗体的注射制剂
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医药技术领域,特别涉及一种抗NKG2A单克隆抗体的注射制剂。
背景技术
随着生物医药技术的不断应用和发展,免疫疗法在癌症治疗领域取得了重大突破,这种免疫疗法的重点是利用患者体内的适应性免疫系统,最主要的是利用CD8+T对肿瘤细胞造成杀伤,但是越来越多的研究数据表明,很多癌症都能发展出多种策略来逃避CD8+T细胞的识别,因而需要开发针对癌症的新免疫治疗手段。
NKG2A是C型凝集素超家族的成员,它与CD94以异源二聚体的形式组成抑制性受体,表达于约一半的外周血NK细胞、部分CD8+αβT细胞、NKT细胞及γδT细胞上。非经典HLA-Ⅰ类分子(人类的HLA-E或者小鼠的Qa-1分子)是NKG2A-CD94的主要配体,其常常在肿瘤细胞上异常高表达。NKG2A-CD94受体与其配体的结合,能抑制NK细胞和T细胞的抑瘤作用,NKG2A的胞内部分含有酪氨酸抑制基序(ITIM),NKG2A-CD94受体与配体结合后,磷酸化的ITIM能聚集酪氨酸磷酸酶(SHP-1),而SHP-1能向NK细胞和T细胞传递抑制性信号。肿瘤浸润的NK细胞和T细胞上NKG2A的高表达和肿瘤细胞上HLA-E的高表达,都与较差的癌症预后正相关,目前,针对NKG2A这个靶标,仍没有药品上市,因此,NKG2A/HLA-E成为了新的肿瘤治疗的免疫检查点而备受关注。
在工艺研发过程中发现,抗NKG2A单克隆抗体与其他抗体不同的是稳定性较差,容易发生构想变化,如变性、聚集和沉淀等多种化学和物理降解,这将给与抗NKG2A单克隆抗体的安全性产生很大的影响,为此,本发明在对抗NKG2A单克隆抗体的工艺研发过程中,进行条件摸索,从而提供了一种能够保证抗NKG2A单克隆抗体的亲和力更高、药效更强且更为稳定的抗NKG2A单克隆抗体的注射制剂。
发明内容
为了能够保证抗NKG2A单克隆抗体在长期存放、运输或使用过程中的稳定性,本发明通过大量的实验条件摸索,提供了一种抗NKG2A单克隆抗体的注射制剂。
本发明具体技术方案如下:
本发明提供了一种抗NKG2A单克隆抗体的注射制剂,所述注射制剂包括以下含量的成分:
其中,所述注射制剂的pH值为5.5-6.5。
本发明提供的注射制剂中抗体蛋白浓度较高,通过将缓冲盐、蛋白保护剂和表面活性剂的协同配合为抗NKG2A单克隆抗体提供了适宜的储存环境,能够保证抗NKG2A单克隆抗体的药效和长期稳定性。
进一步的,所述抗NKG2A单克隆抗体包括重链可变区和轻链可变区,其中,所述重链可变区的氨基酸序列如SEQ ID No:14所示,所述轻链可变区的氨基酸序列如SEQ ID No:15所示。
进一步的,所述抗NKG2A单克隆抗体还包括重链恒定区和轻链恒定区,其中,所述重链恒定区的氨基酸序列如SEQ ID No:18所示,所述轻链恒定区的氨基酸序列如SEQ IDNo:20所示。
进一步的,所述抗NKG2A单克隆抗体的蛋白含量为120-150mg/ml。
进一步的,所述缓冲盐为柠檬酸盐缓冲液或磷酸盐缓冲液。
进一步的,所述缓冲盐的含量为20-30mM。
进一步的,所述注射制剂的pH值为6.0-6.5。
进一步的,所述蛋白保护剂包括山梨醇、甘露醇、海藻糖、蔗糖、精氨酸、甘氨酸、脯氨酸中的一种或多种组合。
进一步的,所述表面活性剂包括聚山梨酯20、聚山梨酯80、波洛沙姆中的一种或多种组合。
优选的,所述表面活性剂的含量为0.01%-0.02%(w/v)。
本发明的有益效果如下:本发明提供的抗NKG2A单克隆抗体可以通过作用于免疫细胞上的NKG2A抑制性受体,解除NKG2A信号通路对免疫细胞的抑制作用,增强NK细胞、T细胞等细胞活性,从而激活NK细胞等免疫细胞对肿瘤的杀伤,该单克隆抗体是促进抗肿瘤免疫的新型检查点抑制剂,主要用于制备治疗癌症或自身免疫疾病药物;此外,抗NKG2A单克隆抗体还可以和免疫调节药物或抗炎症因子药物联合用于治疗癌症或自身免疫疾病,尤其是当肿瘤细胞通过MHC-I的低表达而逃避CD8+T细胞的杀伤时,激活的免疫细胞无需MHC-I的配合就可以对肿瘤细胞进行杀伤,癌症包括但不限于结肠癌、头颈癌、非小细胞肺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、乳腺癌或黑色素瘤;自身免疫疾病包括但不限于系统性红斑狼疮、类风湿关节炎、多发性硬化症、皮肌炎、多肌炎、血管炎或干燥症;其次,本发明通过抗NKG2A单克隆抗体本身带来的理化性质筛选出适宜其长期保存的制剂成分,通过缓冲盐、蛋白保护剂、表面活性剂相互作用,协同配合,为抗NKG2A单克隆抗体提供了良好的存储环境,在贮存和运输过程中,能有效降低制剂中抗体的聚集物和降解物的生成速率,提高抗体的物理稳定性,确保活性的同时降低潜在的安全性风险;本发明提供的抗NKG2A单克隆抗体制剂,具有制备工艺简单,成本低廉,浓度更高,稳定性更好的注射水性药物组合物。
附图说明
图1为本发明实施例3提供的抗体生物筛选方法中pScFv-Disb-HS载体的质粒图谱;
图2为本发明实施例4中梯度稀释ELISA抗NKG2A噬菌体单克隆抗体的亲和力的比较图;
图3为本发明实施例6提供的抗NKG2A全抗体的表达质粒pTSE的图谱;
图4为本发明实施例7中鼠源抗体与NKG2A的结合能力比较图;
图5为本发明实施例8中抗NKG2A单克隆抗体MA-1与NKG2A、NKG2C、NKG2E的结合曲线图;
图6为本发明实施例13中人源化抗体分子与NKG2A的结合能力比较图;
图7为本发明实施例14中抗NKG2A单克隆抗体激活人PBMC杀伤HL-60的效果图;
图8为本发明实施例15单克隆抗体体内抑瘤模型图。
具体实施方式
下面结合以下实施例对本发明作进一步详细说明。
实施例1
本发明实施例1提供了一种抗NKG2A单克隆抗体的注射制剂,注射制剂包括以下含量的成分:
其中,注射制剂的pH值为5.5-6.5。
抗NKG2A单克隆抗体包括重链可变区和轻链可变区,其中,重链可变区的氨基酸序列如SEQ ID No:14所示,轻链可变区的氨基酸序列如SEQ ID No:15所示。
SEQ ID No:14
EVQLVESGGGLVKPGGSLRLSCAASGFTFSDYDMSWVRQAPGKGLEWVSTISSGGSYTYYPDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCTSPRQVGLRKAFDYWGQGTTVTVSS;
SEQ ID No:15
DVVMTQSPAFLSVTPGEKVTITCSASSSVSYMYWYQQKPDQAPKLLIKLTSNLASGVPSRFSGSGSGTDFTFTISSLEAEDAATYYCQQWSSNPFTFGQGTKLEIK。
实施例2
本发明实施例2提供了一种抗NKG2A单克隆抗体的注射制剂,注射制剂包括以下含量的成分:
其中,注射制剂的pH值为6.0-6.5。
抗NKG2A单克隆抗体包括重链可变区和轻链可变区,其中,重链可变区的氨基酸序列如SEQ ID No:14所示,轻链可变区的氨基酸序列如SEQ ID No:15所示。
缓冲盐为柠檬酸盐缓冲液或磷酸盐缓冲液;蛋白保护剂包括山梨醇、甘露醇、海藻糖、蔗糖、精氨酸、甘氨酸、脯氨酸中的一种或多种组合;表面活性剂包括聚山梨酯20、聚山梨酯80、波洛沙姆中的一种或多种组合。
实施例3抗原和对照抗体制备及噬菌体抗体库的构建与筛选
本发明通过用NKG2A抗原(NKG2A蛋白胞外段)免疫小鼠,优化免疫方法,创建噬菌体展示库并建立抗原位点筛选方法,具体噬菌体展示库的构建与筛选鉴定如下:
1、NKG2A抗原免疫小鼠:
实验动物:
种属品系:BALB/c,雌性,小鼠;
体重:18-20g;
实验动物提供商:北京华阜康生物科技股份有限公司。
2、免疫:对小鼠进行免疫,免疫抗原为人NKG2A(南京金斯瑞生物科技有限公司合成基因,本公司构建载体并表达纯化)。
3、噬菌体抗体库的构建与筛选
取效价较高的小鼠脾细胞,利用Trizol试剂(购买自Ambion,货号:15596026),提取小鼠脾细胞中的总RNA,RT-PCR获得cDNA,以cDNA为模板,采用简并引物(所用简并引物参考文献:Journal of Immunological Methods 233(2000)167-177)进行PCR扩增,从而获得免疫小鼠抗体重链可变区基因库(VH)及轻链可变区基因库(VL),轻重链分别双酶切,连接至同样分步骤酶切处理过的载体上,构建pScFv-Disb-HS-VH-VL基因库,PscFv-DisB-HS载体是采用一系列基因克隆的方法对载体pComb3载体(购自中国质粒载体菌株细胞株基因保藏中心)进行改造,使之用于噬菌体单链抗体库的构建和表达。改造后的载体命名pScFv-Disb-HS载体,获得其质粒图谱如图1所示,并以此载体为基础,构建小鼠免疫噬菌体抗体库。
4、噬菌体库的富集筛选
以huFc-NKG2A/CD94为抗原包被免疫管,抗原包被量为4μg/500μl/管,4℃包被过夜,再用4%脱脂奶粉/PBST分别封闭免疫管和免疫噬菌体抗体库,室温封闭1h。封闭后的免疫噬菌体抗体库加入免疫管中进行抗原抗体结合,噬菌体投入量约为10
将上述中和后的噬菌体感染10ml生长至对数期的TG1菌液,37℃培养箱中静置30min,取出部分菌液进行梯度稀释,涂布于2YTAG平板上,用于计算噬菌体产出量。剩余的菌液离心弃上清,将菌体沉淀重悬于少量培养基,吸出后涂布于2YTAG大平板,为下一轮筛选做准备。
将上述感染后涂板的菌体从大平板上刮下,接菌至2YTAG液体培养基,摇至对数期后加入M13KO7辅助噬菌体超感染,在28℃条件下,220rpm培养过夜制备噬菌体,PEG/NaCl沉降纯化噬菌体用于下一轮筛选。共进行三轮噬菌体库富集筛选。
5、噬菌体单链抗体阳性克隆的筛选
经过三轮筛选后,挑取分隔良好的单克隆菌落,接种于加有2YTAG液体培养基的96孔深孔板,在37℃条件下,220rpm的条件下培养至其对数生长期,每孔加入约10
将抗原huFc-NKG2A/CD94包被浓度为0.5μg/ml,一抗为100μl 1:3稀释的噬菌体上清,用封闭液作为阴性对照。HRP-anti-M13二抗孵育后用TMB底物显色,显色20min后在酶标仪中检测OD 450nm,读值>0.3的视为阳性克隆。
使用阳性克隆上清进行抗体特异性初筛:用上述ELISA法检测各噬菌体上清与不同抗原huFc-NKG2A/CD94,huFc-NKG2C/CD94或huFc-NKG2C/CD94的结合,选择上清与NKG2A结合时OD450nm读值高于与NKG2C/E结合时读值的三倍以上的单克隆分子进行后续筛选,此时,共筛选出1个单克隆分子,命名为抗NKG2A单克隆抗体MA-1。
抗NKG2A单克隆抗体MA-1,包括重链可变区和轻链可变区,重链可变区包括3个分别用HCDR1、HCDR2和HCDR3表示的重链互补决定区,轻链可变区包括3个分别用LCDR1、LCDR2和LCDR3表示的轻链互补决定区,重链互补决定区HCDR1的氨基酸序列如SEQ ID No:1所示;重链互补决定区HCDR2的氨基酸序列如SEQ ID No:2所示;重链互补决定区HCDR3的氨基酸序列如SEQ ID No:3所示;轻链互补决定区LCDR1的氨基酸序列如SEQ ID No:4所示;轻链互补决定区LCDR2的氨基酸序列如SEQ ID No:5所示;轻链互补决定区LCDR3的氨基酸序列如SEQ ID No:6所示,具体序列如下。
抗NKG2A单克隆抗体MA-1的重链可变区序列和轻链可变区序列如下:
具体的,SEQ ID No:7(MA-1的重链可变区的氨基酸序列):
EVKLEESGGGLVKPGGSLKLSCAASGFAFSDYDMSWVRQTPEKRLEWVATISSGGSYTYYPDSVKGRFTISRDNARNTLYLQMSSLRSEDTALYYCTSPRQVGLRKAFDYWGQGTTLTVSS;
SEQ ID No:8(MA-1的轻链可变区的氨基酸序列):
DIVVTQSPALMSASPGEKVTMTCSASSSVSYMYWYQQKPRSSPKSWIYLTSNLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPFTFGSGTKLEIKRAD。
实施例4梯度稀释ELISA比较抗NKG2A噬菌体单克隆抗体的亲和力
将实施例3中获得的鼠源抗体分子(MA-1)进行单克隆噬菌体的展示和纯化,然后进行噬菌体梯度稀释ELISA实验鉴定亲和力,具体方法如下:
用pH9.6的碳酸盐缓冲液包被NKG2A抗原,100ng/孔/100μL,在4℃温度条件下包被过夜,使用PBST洗涤三次,将实施例2中筛选得到的噬菌体单克隆抗体MA-1分别用PBST五倍梯度稀释,每孔加入100μl稀释后的样品,在室温下静置1小时。用PBST洗涤ELISA板,将PBST稀释后的HRP-anti-M13(购买自Bio-viewshine,货号:GE27-9421-01)单克隆抗体加入ELISA板中,在室温放置1h。TMB显色试剂盒显色,室温显色10分钟,用2M H
通过上述数据及如图2所示,实施例2筛选出的鼠源抗体分子MA-1能够与NKG2A结合,本发明提供的鼠源抗体分子MA-1与NKG2A均具有较高的亲和力。
实施例5
本发明实施例5在实施例3的基础上进一步限定了鼠源抗体分子还包括选自鼠的IgG1型、IgG2a型、IgG2b型或IgG3型的重链恒定区和鼠C
SEQ ID No:9(鼠C
ADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC;
SEQ ID No:10(鼠的IgG1型的重链恒定区氨基酸序列):
AKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSTWPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMDTDGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPG;
SEQ ID No:11(鼠的IgG2a型的重链恒定区氨基酸序列):
AKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVTSSTWPSQSITCNVAHPASSTKVDKKIEPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK;
SEQ ID No:12(鼠的IgG2b型的重链恒定区氨基酸序列):
AKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK;
SEQ ID No:13(鼠的IgG3型的重链恒定区氨基酸序列):
ATTTAPSVYPLVPGCSDTSGSSVTLGCLVKGYFPEPVTVKWNYGALSSGVRTVSSVLQSGFYSLSSLVTVPSSTWPSQTVICNVAHPASKTELIKRIEPRIPKPSTPPGSSCPPGNILGGPSVFIFPPKPKDALMISLTPKVTCVVVDVSEDDPDVHVSWFVDNKEVHTAWTQPREAQYNSTFRVVSALPIQHQDWMRGKEFKCKVNNKALPAPIERTISKPKGRAQTPQVYTIPPPREQMSKKKVSLTCLVTNFFSEAISVEWERNGELEQDYKNTPPILDSDGTYFLYSKLTVDTDSWLQGEIFTCSVVHEALHNHHTQKNLSRSPELELNETCAEAQDGELDGLWTTITIFISLFLLSVCYSASVTLFKVKWIFSSVVQVKQTAIPDYRNMIGQGA。
实施例6鼠源全抗分子制备
本发明实施例6在实施例3的基础上,将实施例3中筛选鉴定的单克隆抗体MA-1中提取质粒,将重链VH和轻链VL的编码基因分别克隆至装有小鼠IgG2a重链(氨基酸序列如SEQ ID No:11所示)和鼠C
瞬时转染HEK293E细胞(购自中国医学科学院基础医学研究所,货号为GNHu43),进行抗体表达,使用AKTA仪器通过protein A亲和柱纯化获得完整的单克隆抗体分子。
实施例7鼠源抗体与NKG2A的结合能力
用pH9.6的碳酸盐缓冲液包被NKG2A,100ng/孔/100μl,在4℃的温度条件下过夜包被。用300μl/孔PBST洗涤五次,再加入1%BSA-PBST在37℃温度条件下封闭1h,加入不同稀释浓度的MA-1鼠源抗体,全抗体的起始最高浓度是5μg/ml,分别经过3倍稀释后每个抗体均做12个梯度,在37℃温度条件下孵育1h。用300μl/孔PBST洗涤五次,再加入用1%BSA-PBST1:10000稀释的Anti-Mouse Fc-HRP,在37℃温度条件下孵育1h。TMB显色试剂盒显色,100μl/孔,室温显色8min,然后用2MH
通过图4可知,筛选出的鼠源抗体MA-1能够与NKG2A进行结合,且具有较高的亲和力。
实施例8鼠源抗NKG2A单克隆抗体与NKG2A、NKG2C、NKG2E的结合特异性实验
用ELISA法检测实施例6得到的单克隆抗体MA-1同huFc-NKG2A/CD94、huFc-NKG2C/CD94或huFc-NKG2E/CD94结合的EC50值,其中,NKG2C(NKG2C蛋白胞外段)和NKG2E(NKG2E蛋白胞外段)均与NKG2A序列一致性较高,且为NK细胞活化型受体:
将抗NKG2A单克隆抗体MA-1做梯度稀释作为一抗,抗鼠Ig-HRP作二抗,分别与NKG2A、NKG2C和NKG2E结合,ELISA检测后做剂量-读值曲线并做非线性回归曲线,计算各抗体分别与三个抗原结合的EC50值,抗NKG2A单克隆抗体MA-1与NKG2蛋白的结合曲线如图5所示。
通过图5所示,本发明筛选的抗NKG2A单克隆抗体MA-1能够与NKG2A特异结合而不与NKG2C和NKG2E等其他NKG2家族蛋白结合。
实施例9
本发明实施例9进一步的限定了单克隆抗体或其抗原结合片段为嵌合抗体分子,嵌合抗体分子包括鼠源抗体分子的重链可变区、鼠源抗体分子的轻链可变区和人源抗体恒定区。人源抗体恒定区包括选自人的IgG1型或IgG4型的重链恒定区和人C
SEQ ID No:18(人的IgG1型的重链恒定区氨基酸序列):
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK;
SEQ ID No:19(人的IgG4型的重链恒定区氨基酸序列):
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK;
SEQ ID No:20(人的C
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC。
实施例10嵌合抗体分子的制备
本发明实施例10在实施例9的基础上进一步优选的人源抗体恒定区包括人的IgG1型的重链恒定区(其氨基酸序列如SEQ ID No:18所示)和人C
具体的制备方法:
将筛选出来的理想的抗NKG2A单克隆抗体分子MA-1的重链可变区VH(SEQ ID No:7)和轻链可变区VL基因(SEQ ID No:8)保持鼠源序列不变,分别克隆至装有重链恒定区和轻链恒定区基因的载体pTSE(如图3所示)上,重链恒定区为人的IgG1型(氨基酸序列如SEQID NO:18所示),轻链恒定区为人的C
实施例11鼠源抗体分子MA-1进行人源化
首先使用实施例3中鼠源抗体分子MA-1的序列和人抗体种系数据库(v-base)比较,寻找同源性较高的人抗体轻、重链种系作为候选序列,然后将鼠源抗体分子MA-1的CDR的序列移植到人源候选序列上进行同源建模。然后通过三维结构模拟计算可能对于维持CDR环状结构起重要作用的关键框架氨基酸残基,从而设计人源化抗体的回复突变。将设计好的包含回复突变的人源化抗体的轻、重链可变区分别由南京金斯瑞生物科技有限公司优化合成,然后再连接到瞬时表达载体上,对人源化得到的轻重链组合分析,得到如下人源化抗体分子:HA-1,HA-2,上述筛选到的2个单克隆抗体序列如下::
具体的,SEQ ID No:14(HA-1的重链可变区的氨基酸序列):
EVQLVESGGGLVKPGGSLRLSCAASGFTFSDYDMSWVRQAPGKGLEWVSTISSGGSYTYYPDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCTSPRQVGLRKAFDYWGQGTTVTVSS;
SEQ ID No:16(HA-2的重链可变区的氨基酸序列):
EVQLVESGGGLVKPGGSLRLSCAASGFAFSDYDMSWVRQAPGKGLEWVATISSGGSYTYYPDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCTSPRQVGLRKAFDYWGQGTTVTVSS;
SEQ ID No:15(HA-1的轻链可变区的氨基酸序列):
DVVMTQSPAFLSVTPGEKVTITCSASSSVSYMYWYQQKPDQAPKLLIKLTSNLASGVPSRFSGSGSGTDFTFTISSLEAEDAATYYCQQWSSNPFTFGQGTKLEIK;
SEQ ID No:17(HA-2的轻链可变区的氨基酸序列):
DIVVTQSPAFLSVTPGEKVTITCSASSSVSYMYWYQQKPDQAPKLLIKLTSNLASGVPSRFSGSGSGTDFTFTISSLEAEDAATYYCQQWSSNPFTFGQGTKLEIK。
实施例12人源化全抗分子的制备
本发明实施例12在实施例11的基础上进一步的限定了人源化抗体分子还包括人源抗体恒定区,人源抗体恒定区包括选自人的IgG1型或IgG4型的重链恒定区和人C
上述人源抗体恒定区具体序列与实施例9相同。
将上述实施例11中人源化得到的2个人源化抗体分子的重链VH和轻链VL的编码基因分别克隆至装有重链恒定区和轻链恒定区基因的载体pTSE(如图3所示),每个人源化抗体分子选择IgG1型(氨基酸序列如SEQ ID No:19所示)的重链恒定区,选择人C
实施例13人源化全抗分子与NKG2A蛋白的结合实验
用pH9.6的碳酸盐缓冲液包被NKG2A抗原,200ng/孔/100μL,在4℃的温度条件下过夜包被。用300μL/孔PBST洗涤五次,再加入1%BSA-PBST在37℃温度条件下封闭1h,加入不同稀释浓度的人源化抗体HA-1、HA-2和实施例10中制备的嵌合抗体CA-1,3个抗体的起始最高浓度均是50μg/mL,分别经过3倍稀释后每个抗体均做10个梯度,在37℃温度条件下孵育1h。用300μL/孔PBST洗涤五次,再加入用1%BSA-PBST 1:5000稀释的Goat Anti HumanIgG-HRP(购买自北京中杉金桥生物技术有限公司,货号:ZB-2304),在37℃温度条件下孵育1h。TMB显色试剂盒显色,100μL/孔,室温显色5min,然后用2M H
通过图6可知,2个不同的人源化抗体分子均能与NKG2A进行结合,且2个人源化抗体分子的EC50值均与嵌合抗体CA-1较为接近,说明人源化后的抗体分子保留了鼠源亲本抗体MA-1与NKG2A的高结合能力。
实施例14抗NKG2A单克隆抗体体外杀伤效果检测
选择高表达HLA-E的HL-60肿瘤细胞作为靶细胞,选择人PBMC细胞作为效应细胞,调整靶细胞和效应细胞的密度,等体积混匀后使效靶比为50:1,加入96孔板中相应位置。对不同抗体进行样品稀释,加入板中,使其作用终浓度为50μg/ml。37℃CO
通过图7可以得出,本发明提供的抗NKG2A单克隆抗体HA-1和HA-2均能激活并促进人PBMC细胞对HL-60肿瘤细胞的杀伤效应。
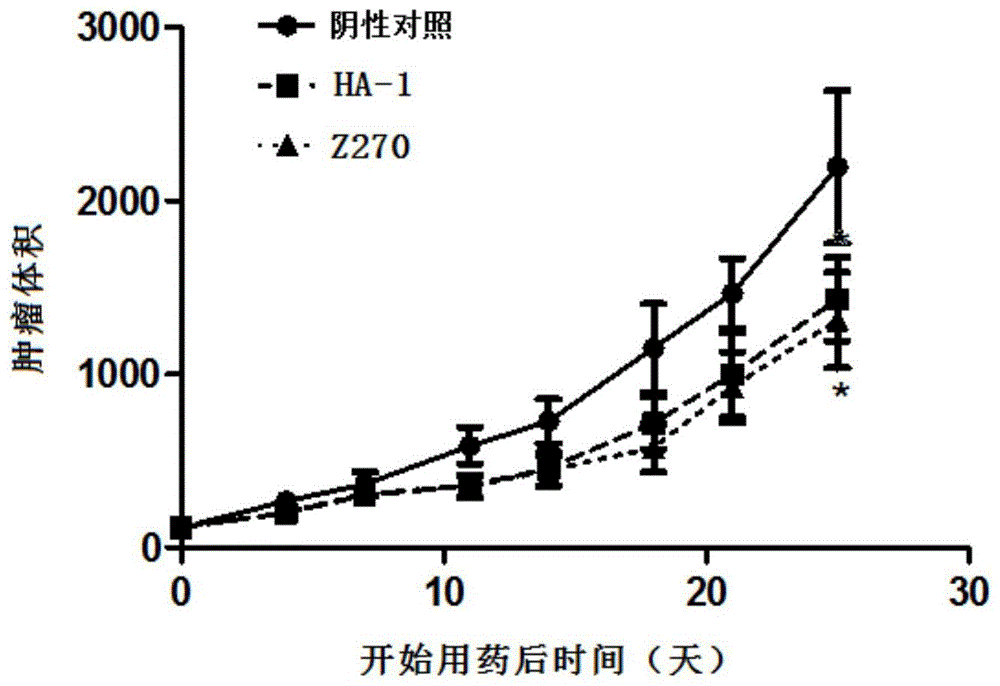
实施例15抗NKG2A单克隆抗体HA-1对小鼠体内MC38-NKG2A结直肠癌的抑制实验
1、实验动物:
种属品系:C57BL/6JGpt,小鼠;
周龄:6-8周;
实验动物提供商:百奥塞图(北京)医药科技股份有限公司。
2、细胞培养:
MC38肿瘤细胞(YK-CL-256-02)(购自:普如汀生物技术(北京)有限公司(Biovector NTCC Inc.),货号:NTCC-MC38)为原始细胞,构建MC38-NKG2A肿瘤细胞株。
每只小鼠右侧背部皮下接种稳转了MC38肿瘤细胞,成瘤后取18只肿瘤大小接近的小鼠随机分成三组,每组6只。腹腔注射本发明中提供的抗NKG2A单克隆抗体HA-1(10mg/kg),同时设置对照组注射等量的Z270对照组,对照抗体Z270及其人源化抗体huZ270的VH及VL序列(来自专利US8993319B2),阴性对照组注射等量的同型IgG,每周给药两次,每周测两次瘤体积并测体重。观察记录瘤生长情况,当有肿瘤体积超过3000mm
如图8所示,注射抗NKG2A单克隆抗体HA-1的肿瘤体积显著小于阴性对照组的肿瘤体积,注射抗NKG2A单克隆抗体HA-1的肿瘤体积与对照组抗体Z270的肿瘤体积较为接近。可见本发明中的抗NKG2A单克隆抗体HA-1能显著抑制肿瘤生长。
实施例16制剂缓冲液的筛选
抗体制剂制备方法:通过超滤管将上述得到的抗NKG2A单克隆抗体HA-1原液换液至目的缓冲盐中,并将换液浓缩后样品稀释至所需浓度,样品用0.22μm过滤器无菌过滤,分装至2ml西林瓶中,1ml/瓶。分装完毕后检测蛋白的热稳定性,同时进行40±2℃稳定性试验,以纯度和电荷异构体为关键指标,筛选合适的缓冲液pH及缓冲液种类。
分析检测方法:热稳定性:采用多功能蛋白质稳定性分析系统(Uncle)检测热变性温度(Tm)、聚集温度(Tagg);
纯度检测:采用分子排阻层析高效液相色谱法(SEC-HPLC)分析;
电荷异构体:采用阳离子交换色谱法测定电荷异构体主峰含量(CEX-HPLC)。
注射制剂pH范围筛选:在商业化蛋白制剂常用的pH范围展开筛选。通过多功能蛋白质稳定性分析系统(Uncle)考察蛋白构象稳定性(Tm)和胶体稳定性(Tagg),通过40±2℃加速稳定性考察蛋白纯度(SEC-HPLC)和电荷异构体(CEX-HPLC)主峰含量变化,筛选相对稳定的pH范围。
(1)筛选合适的缓冲液pH,具体如下:
热稳定性检测结果如下:
40±2℃加速稳定性考察结果
热稳定性结果显示,缓冲液pH4.5,蛋白的Tm和Tagg相对于其他缓冲液均较低,该蛋白在pH4.5条件下构象稳定性和胶体稳定性均较差。
加速稳定性的结果显示,40±2℃条件下放置2周,聚集体均不同程度增长,实验例1增长比例最多(增长6.1%),实验例5次之(增长2.4%);单体纯度均不同程度下降,实验例5下降比例最多(下降8.4%),实验例1次之(下降7.0%),其他处方均下降2%左右;降解峰均不同程度增长,实验例5增长比例最多(增长5%左右),其他处方均增长1%左右;各处方样品电荷异构体主峰均明显下降,实验例5下降比例最多(下降64.2%),实验例4次之,下降比例32%左右,实验例2和实验例3下降比例最少,均下降14%左右;pH、粒径、浓度均未发生明显变化。初步结果显示,在pH 5.5-6.5范围内,抗NKG2A单克隆抗体HA-1相对较稳定。
(2)制剂缓冲盐种类及缓冲盐摩尔浓度的筛选
选择缓冲能力在5.5-6.5左右的缓冲盐内展开缓冲盐种类及缓冲液摩尔浓度的筛选,本轮实验主要通过热稳定性(Tm、Tagg)考察蛋白构象稳定性和胶体稳定性,通过40±2℃加速稳定性试验,以蛋白纯度(SEC-HPLC)和电荷异构体(CEX-HPLC)为关键指标,筛选出有利于抗NKG2A单克隆抗体HA-1稳定储存的的制剂缓冲体系。
缓冲盐设计组成如下:
/>
热稳定性检测结果如下:
40±2℃加速稳定性考察结果
/>
热稳定性结果显示,在pH5.5-6.5范围内,在乙酸盐缓冲液、柠檬酸盐缓冲液、组氨酸盐缓冲液与磷酸盐缓冲液中,蛋白的Tm和Tagg均较高。
加速稳定性的结果显示,40℃条件下放置2周,各实验例纯度均不同程度下降,实验例9、实施例16单体纯度下降比例最少(下降1.6%),实验例13单体纯度下降比例最多(下降3.1%);随着pH增高,单体纯度下降比例逐渐增多,且实验例8~10单体纯度下降比例略小于其他实验例。40±2℃放置2周后,各实验例样品的主峰含量均有所下降,实验例9下降比例最少为12.0%,实验例6下降比例最多为17.7%,。综合各考察结果显示,在pH6.0-6.5条件下,蛋白在柠檬酸盐缓冲液体系和磷酸盐缓冲液体系均可以有效的维持抗NKG2A单克隆抗体HA-1的稳定特性,柠檬酸盐缓冲液体系优于磷酸盐缓冲液体系;20-30mM的缓冲液优于40mM的缓冲液浓度;pH6.0的缓冲液优于pH6.5,为此,缓冲盐优选为柠檬酸盐缓冲液或磷酸盐缓冲液,缓冲盐浓度优选为20-30mM,pH优选为6.0。
实施例17蛋白保护剂和表面活性剂的筛选。
本发明实施例17提供的制剂的制备方法与实施例16相同。
分析检测方法:热稳定性:多功能蛋白质稳定性分析系统检测热变性温度(Tm)、聚集温度(Tagg);纯度检测:采用分子排阻层析高效液相色谱法(SEC-HPLC)分析;电荷异构体:采用阳离子交换色谱法测定电荷异构体主峰含量(CEX-HPLC)。B22(第二维里系数):多功能蛋白质稳定性分析系统检测不同浓度条件下的静态散射光强。亚可见颗粒:采用微流成像法检测。
(1)蛋白保护剂的筛选
通过40±2℃加速稳定性实验,在上一轮缓冲盐筛选的基础上开展蛋白保护剂及表面活性剂的筛选。拟定缓冲液为20mM柠檬酸盐缓冲液,pH6.0,蛋白浓度为150mg/ml,制剂处方组成设计如下表所示:
40±2℃加速稳定性考察结果
加速稳定性的结果显示,40℃条件下放置4周,从纯度来看,各实验例样品聚集体均不同程度增长,其中实验例24增长最多,增长3%左右,实验例21、实验例22增长最少,增长0.5%左右;单体纯度均不同程度下降,其中实验例21、实验例22与实验例28下降最少,下降2%左右,实验例24纯度下降最多,下降4.8%;从电荷异构体来看,电荷异构体主峰含量下降14.3%-18.3%之间,其中实验例31主峰下降比例最少,下降14.3%,实验例25下降最多,下降18.3%。
从亚可见微粒来看,不同实验例之间总颗粒数目与大于25um颗粒数目均不同程度增长,实验例32-35中大于25um颗粒数目增长明显比其他实验例少,表面活性剂对蛋白起到保护作用。
综合各考察结果显示,本发明限定的蛋白保护剂包括山梨醇、甘露醇、海藻糖、蔗糖、精氨酸、甘氨酸、脯氨酸中的一种或多种组合能够对抗NKG2A单克隆抗体HA-1起到保护作用,此外,添加表面活性剂的实验例(实验例32、实验例33、实验例34)亚可见微粒表现较好(添加聚山梨酯20的样品相对更好),为此本发明优选为表面活性剂为聚山梨酯20。
(2)完整实验例的筛选
通过早期的制剂评估与筛选,选择柠檬酸盐缓冲液为制剂缓冲体系,以海藻糖为蛋白保护剂,以山梨醇为候选蛋白保护剂,以聚山梨酯20为表面活性剂,通过40±2℃的加速稳定性试验,对表面活性剂含量及候选实验例进行筛选。制剂实验例组成设计如下表所示:
40±2℃加速稳定性考察结果
通过Tagg试验结果可以看出,抗NKG2A单克隆抗体HA-1在柠檬酸盐缓冲液体系中Tm值与Tagg均较高;抗NKG2A单克隆抗体HA-1在柠檬酸盐缓冲液中的构象稳定性及胶体稳定性均较好;通过B
加速稳定性的结果显示,40±2℃条件下放置4周,在添加不同浓度的非离子型表面活性剂聚山梨酯20后,抗NKG2A单克隆抗体制剂均具有很好的稳定性。非离子型表面活性剂含量太低时≥25um的颗粒数目略多,抗体蛋白有聚集的倾向,而表面活性剂含量太高可能产生副作用,影响制剂输注的安全性。为此本发明限定的表面活性剂的含量为0.01%-0.02%(w/v),能够满足制剂的稳定性要求,进一步优选的,抗体制剂中表面活性剂含量为0.02%的聚山梨酯20。
实施例18抗NKG2A单克隆抗体实验例确认
本发明实施例18提供的制剂的制备方法与实施例16相同。
我们选择以柠檬酸盐缓冲液为缓冲体系,以海藻糖为蛋白保护剂,以0.02%的聚山梨酯20为表面活性剂,对实验例进行确认。
制剂实验例组成设计如下表所示:
分析检测方法:
热稳定性:多功能蛋白质稳定性分析系统检测热变性温度(Tm)、聚集温度(Tagg);纯度检测:采用分子排阻层析高效液相色谱法(SEC-HPLC)分析;电荷异构体:采用阳离子交换色谱法测定电荷异构体主峰含量(CEX-HPLC)。亚可见颗粒:采用微流成像法检测。处方确认试验包括加速试验(40±2℃)、冻融稳定性试验(-20℃)、振摇稳定性试验(25±2℃,120转/min)及光照稳定性试验(25±2℃,RH60%,4500±500lx)。
加速稳定性试验结果
加速稳定性的结果显示,40±2℃条件下放置4周,抗NKG2A单克隆抗体HA-1浓度为150mg/ml和120mg/ml时在纯度、电荷异构体、≥25um的亚可见微粒数目等方面均无明显差异;浓度为200mg/ml时纯度和电荷异构体略差,亚可见微粒无明显差异。为此,本发明优选的,制剂中抗NKG2A单克隆抗体HA-1浓度优选120mg/ml-150mg/ml。
冻融稳定性结果
由上表可以看出,抗NKG2A单克隆抗体HA-1在-20℃冻融5次后,各实验例的纯度、电荷异构体主峰含量及≥25um的亚可见微粒数目均无明显变化。
振摇稳定性试验结果:
由上表可以看出,抗NKG2A单克隆抗体HA-1在25±2℃条件下,120转/分钟,水平振摇7天后,各实验例的纯度、电荷异构体主峰含量及≥25um的亚可见微粒数目均无明显变化。
光照稳定性试验结果:
由上表可以看出,抗NKG2A单克隆抗体HA-1在25℃、光照强度4500±500lx条件下放置10天后,抗NKG2A单克隆抗体HA-1浓度为150mg/ml和120mg/ml时在纯度、电荷异构体及≥25um的亚可见微粒数目等方面均无明显差异;浓度为200mg/ml时纯度和电荷异构体略差,但不明显,亚可见微粒无明显差异。
由以上实验证明,抗NKG2A单克隆抗体HA-1浓度在120-200mg/ml范围内均很稳定,抗体浓度优选120mg/ml-150mg/ml。
经过40℃加速试验、冻融试验、振摇试验及光照试验,进一步验证了抗体蛋白浓度为120mg/ml-150mg/ml的抗NKG2A单克隆抗体HA-1,在20mM柠檬酸盐缓冲液,160mM海藻糖,0.02%(w/v)聚山梨酯20,pH6.0的制剂中具有很好的稳定性。
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围之内。
- 抗CD20的人源化单克隆抗体及其制剂
- 一种抗NKG2A单克隆抗体及其应用
- 一种抗LAG-3单克隆抗体的注射制剂
