一种鉴定烟草突变体的HRM方法
文献发布时间:2024-04-18 19:53:33
技术领域
本发明涉及烟草技术领域,特别涉及一种鉴定烟草突变体的HRM方法。
背景技术
鉴定基因突变体是研究基因功能的重要途径。甲基磺酸乙酯(ethyl methylsulfonate,EMS)是一类应用最广、效率最高的化学诱变剂,可以在基因组中高频率诱发突变。
常用的检测突变体的实验方法有以下几种:(1)聚丙烯酰胺凝胶电泳法:该方法将LICOR-TILLING技术相结合,对突变体DNA进行PCR扩增,PCR产物经变性、退火形成杂合链,再用能识别杂合位点的单碱基酶进行酶切,酶切产物经过双通道荧光聚丙烯酰胺凝胶电泳分析。该方法实验操作检测群体量大,成本低,但整体操作复杂,而且电泳结果不太稳定,同时存在假阴性,目前使用较少。(2)毛细管电泳检测法:该技术用全自动的毛细管电泳代替传统的凝胶电泳,也要对PCR产物进行酶切,因此对PCR产物的纯度要求较高,不纯的PCR产物会导致酶切过程中限制性内切酶的活性降低,使得PCR产物无法酶切而导致结果产生假阴性,检测效果降低。(3)高通量测序:该方法测序分析的突变位点结果准确,但缺点是该技术对延伸引物要求很高,且需要多次重复PCR的扩增、跑胶、纯化和测序,工作量大、周期长、成本高且容易导致人为突变,在生物群体大样本多位点检测中难以推广。
高分辨率熔解曲线技术(high resolution melting,HRM)是近年新兴起的一种检测突变体的新技术。其他检测技术相比,HRM技术不受样品DNA双链突变碱基位点与类型的局限,无需序列特异性探针,且闭管操作避免污染,具有灵敏度高、特异性强、速度快、通量高、操作简便等优点,在医学、农学中已经得到广泛的应用。
该技术原理是根据组成DNA片段的碱基不同导致熔解温度不同的物理性质,通过实时跟踪、收集升温过程中饱和荧光染料与PCR产物结合的信息,并对软件分析而形成各自的熔解曲线。温度低时,染料结合牢固,荧光信号强烈;升高温度DNA双链慢慢解开,荧光染料随之解离,荧光强度减弱;当温度达到Tm值即50%的双链DNA解旋为单链,荧光信号强度达到最低。通过实时检测核苷酸双链熔解过程荧光信号的积累,可以直观地看到双链熔解随温度变化曲线的差异而呈现出不同形态的熔解曲线峰图。因此,根据饱和染料的信号强度和熔解曲线的峰图形状差异可进行突变体的筛选。
发明内容
本发明所要解决的技术问题是提供一种鉴定烟草突变体的HRM方法,针对烟草突变群体,从扩增片段长度、染料种类和染料浓度、DNA模板浓度、引物浓度四个方面,探索建立一套适合烟草突变体筛选检测的高效、低成本的HRM反应体系,保证熔解曲线有更高的分辨率,对进一步研究相关基因的功能提供原始突变材料。
本发明所要解决的技术问题是通过以下技术方案来实现的:
一种鉴定烟草突变体的HRM反应体系的构建方法,针对烟草突变群体,从扩增片段长度、染料种类和染料浓度、DNA模板浓度、引物浓度四个方面研究是否能对单碱基差异的突变体进行分型,包括以下步骤:
(1)扩增片段长度:设置包含SNP位点的扩增子长度依次为201bp,283bp,430bp,506bp,599bp,763bp,801bp,839bp;
(2)引物浓度:设置为0.1μmol/L、0.3μmol/L、0.5μmol/L、0.7μmol/L、0.9μmol/L,所述引物浓度为0.3μmol/L~0.5μmol/L;
(3)DNA模板浓度:设置为20ng/μL、40ng/μL、80ng/μL、100ng/μL;
(4)染料的种类:分别使用非饱和染料(SYBR Green I)和饱和染料20×EvaGreenDye(Biotium,Hayward,USA),检测两种染料对HRM熔解曲线信号采集的影响;
(5)染料的浓度:染料添加用量依次为0.2μL、0.4μL、0.6μL、0.8μL。
优选地,所述烟草突变体为烟草热激蛋白基因dnaJ的单碱基突变体,所述突变体在基因编码区的166bp发生了C/T的突变,被命名为HD-41。
优选地,当扩增子片段为201bp-430bp时,可以通过高分辨率熔解曲线鉴定出单碱基差异;当扩增子长度大于500bp时,高分辨率熔解曲线不能准确对单碱基差异的突变体进行分型。
优选地,当引物浓度为0.1μmol/L时,高分辨率熔解曲线的信号采集差,分型不准确;当引物浓度为0.3μmol/L~0.5μmol/L时,扩增的熔解曲线平滑且荧光信号正常;当引物浓度在0.7μmol/L~0.9μmol/L时,PCR扩增过程中容易产生二聚体及非特异性扩增。
优选地,当DNA模板浓度为20ng/μL时,突变体的高分辨率熔解曲线不易分型,且随着模板浓度增加,突变体的分型结果明显。
优选地,使用非饱和染料SYBR Green I熔解曲线起峰慢,信号采集差,不能检测出单碱基差异突变体;饱和染料EvaGreen Dy获得高分辨熔解曲线平滑,可以对单碱基差异突变体进行分型。
优选地,当染料用量为0.2μL时,HRM熔解曲线信号采集弱,染料的用量增加到0.4μL,荧光信号采集增强,重复性好,达到HRM分型效果。
一种鉴定烟草突变体的HRM反应体系,每20μL反应体系中包括:DNA模板浓度为80~100ng/μL、Eva Green Dye染料0.4μL、0.3μmol/L的正向和反向引物,剩余ddH
一种鉴定烟草突变体的HRM反应体系在用于检测烟草中SNP位点的突变植株中的应用。
一种鉴定烟草突变体的HRM反应体系在提高目标基因的育种中的应用。
本发明上述技术方案,具有如下有益效果:
本发明优化后的HRM体系检测烟草突变体几乎不出现假阳性:传统的PCR扩增结合限制性内切酶的检测方法以电泳条带的“有无”来判断,往往存在比较高的假阳性。因为如果PCR的产物不进行纯化则会导致酶切过程中限制性内切酶的活性降低,使得PCR产物无法酶切而导致结果产生假阳性;如果PCR产物进行纯化会导致回收片段低,从而影响酶切结果而产生假阳性。本发明优化后的HRM体系,在检测上具有灵敏性和简便性,在添加饱和染料的PCR产物中直接进行高分辨率熔解曲线的采集,且PCR体系成分的存在不会影响荧光信号采集,因此优化后的HRM体系对烟草突变体中SNP位点的检测结果中几乎不出现假阳性。
本发明优化后的HRM体系在实际应用中,高通量、成本低:高分辨率熔解曲线分析方法一次性可以采集96个PCR产物样品的高分辨率熔解曲线,比传统的酶切电泳检测方法便捷;并且采用本发明的HRM体系进行烟草突变体中的突变位点检测可以节省传统位点测序的费用,其成本并不高于普通PCR,特别适用于大规模分子辅助育种的生产实践中。
附图说明
图1为不同长度的扩增子熔解曲线。
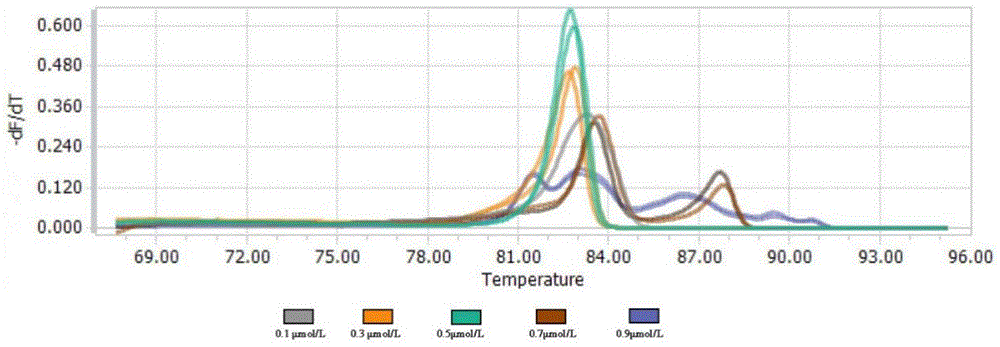
图2为不同引物浓度熔解曲线。
图3为不同模板浓度熔解曲线。
图4为不同染料的熔解曲线。
图5为不同浓度EvaGreen Dye的熔解曲线。
具体实施方式
现在来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
实施例1
一种鉴定烟草突变体的HRM的反应体系的构建方法,针对烟草突变群体,从扩增片段长度、染料种类和染料浓度、DNA模板浓度、引物浓度四个方面研究是否能对单碱基差异的突变体进行分型,建立一套适合烟草突变体筛选检测的高效、低成本的HRM反应体系,保证熔解曲线有更高的分辨率,对进一步研究相关基因的功能提供原始突变材料。
利用以烟草热激蛋白基因dnaJ的单碱基突变体为目标检测材料进行HRM最佳体系的探索,该突变体在基因编码区的166bp发生了C/T的突变,被命名为HD-41。
(1)扩增子片段长度筛选:
设置包含SNP位点的扩增子长度依次为201bp,283bp,430bp,506bp,599bp,763bp,801bp,839bp。
如图1所示,HRM体系检测的片段长度是影响突变体筛选成本的一个重要因素,较短的片段长度能保证更为准确的HRM分析,但覆盖全基因检测时筛选成本过高;而当扩增片段较长时则存在HRM分型差异不明显,突变位点不易检出等缺陷。在设置的片段长度范围内,当扩增子为201bp-430bp时,HRM方法可以明显鉴定出单碱基差异;当扩增子为506bp时,野生型红花大金元(HD)和突变材料HD-41的熔解曲线差异性开始减小,但两者之间的单碱基差异位点仍可以到区分;当扩增子增大至599bp-763bp时,HD-41和HD的熔解曲线完全重合,无法鉴定突变位点;扩增子大于800bp时,不但HD-41和HD熔解曲线完全重合,而且熔解曲线形成双峰,干扰HRM分型鉴定。
因此,烟草突变体的HRM鉴定片段长度以不大于500bp为宜。
(2)引物浓度优化:
设置为0.1μmol/L、0.3μmol/L、0.5μmol/L、0.7μmol/L、0.9μmol/L,所述引物浓度为0.3μmol/L~0.5μmol/L。
引物浓度会影响熔解曲线信号采集和引起扩增过程中的非特异性扩增,影响实验结果。设置不同的引物浓度可以检测HRM体系中最佳引物浓度。
如图2所示,当HRM反应体系中引物浓度为0.1μmol/L时,扩增效率较差,荧光信号提前降落,熔解温度跨度大;引物浓度为0.3μmol/L~0.5μmol/L时,扩增的熔解曲线平滑且荧光信号正常;引物浓度在0.7μmol/L~0.9μmol/L时,PCR扩增过程中容易产生二聚体及非特异性扩增,影响实验结果。
因此,烟草突变体筛选的HRM体系中,上下游引物的浓度为0.3μmol/L时较为适宜。
(3)DNA模板浓度优化:
设置为20ng/μL、40ng/μL、80ng/μL、100ng/μL。
如图3所示:HRM基因分型对模板DNA浓度比较敏感,而DNA模板量又取决于物种的基因组大小。当模板浓度为20ng/μL时,突变体HD-41和野生型红花大金元的熔解曲线相近,不易区分;当模板浓度>40ng/μL时,含有单碱基差异的HD-41和野生型红花大金元的熔解曲线可得到区分;当浓度达到80ng/μL~100ng/μL时,HD-41和HD熔解曲线的Tm值差异明显,分型更为可靠。
(4)染料类型和染料浓度对PCR扩增的影响:
分别使用非饱和染料(SYBR Green I)和饱和染料20×EvaGreen Dye(Biotium,Hayward,USA),检测两种染料对HRM熔解曲线信号采集的影响;
染料添加用量依次为0.2μL、0.4μL、0.6μL、0.8μL。
如图4所示,检验染料分为非饱和染料(SYBR Green I)和饱和染料20×EvaGreenDye(Biotium,Hayward,USA),利用EvaGreen Dye染料获得的扩增曲线效果好,标准曲线定量误差较小,HD和HD-41的熔解曲线可以分型(图4-A图);而非饱和染料SYBR Green I的非特异性扩增较多,效果较差,起峰时间较晚,峰值较低,溶解曲线重合,突变体无法检出(图4-B图)。
染料用量也是影响HRM检测效率一个重要因素,当染料用量为0.2μL时,由于染料添加量过低,HRM体系反应信号强度弱,荧光差异曲线平滑度差,重复性较差,突变位点检出的准确性低(图5-A、B);当染料用量>0.4μL时,荧光信号升高,重复性好,达到HRM分型的结果,且在0.4μL~0.8μL基于Tm值的分型结果相差不大(图5-C、D、E、F、G、H)。
因此,选用EvaGreen Dye饱和染料进行后续实验,反应体系中染料用量为0.4μL。
综上研究,在烟草M2代突变体筛选中,优化的HRM筛选体系(20μL):为DNA浓度为80~100ng/μL;Master Mix Eva Green Dye染料0.4μL;0.3μmol/L的正向和反向引物;剩余ddH
实施例2
本发明优化后的HRM体系在烟草突变体库进行验证表明,检测单碱基差异的突变体阳性率达到100%。
具体的,本发明实施例1优化后的针对烟草突变体的HRM体系,进行烟草基因AP24基因进行突变位点突变植株筛选。对AP24的全基因分段设计两对特异引物,在红花大金元M2代突变体库中进行HRM分析,最终检测到12个突变体,对所有突变体进行测序验证,发现HRM筛选出的突变体均为阳性,在12个突变体中有1个为提前终止突变,7个错义突变,其他4个为同义突变。突变类型以C→T为主,还包括G→A、T→G、T→A、C→A四种类型的碱基变异(结果见表1)。
表1突变材料的序列分析
结果表明,表明通过优化的HRM分型方法,可以准确快速的检测出烟草突变群体中含有突变位点的突变植株,对突变基因的诱变单株筛选有较大应用价值。该方法能够在饱和突变群体中快速获得目标基因的终止突变、关键氨基酸突变等多种类型突变,显著提高诱变群体筛选效率。对靶基因突变体通过连续回交再自交的方法纯合,成为育种中间材料或者直接培育成新品种。
因此,本发明所提供的优化的HRM体系在用于检测烟草中SNP位点的突变植株以及在生产实践中具有广阔的应用前景,利用此优化体系可以提高目标基因的育种效率。
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
- 一种超薄铝合金板材加工设备及其加工工艺
- 一种端子的加工设备及其加工工艺
- 一种螺杆加工工艺及加工设备
- 一种木纹液体耐磨纸的加工工艺和加工设备
- 一种木纹液体耐磨纸的加工工艺及加工设备
