用于皮下注射的包含人透明质酸酶PH20变体和药物的药物组合物
文献发布时间:2024-04-18 19:58:21
本申请是申请日为2020年3月24日、申请号为202080003052.8、发明名称为“用于皮下注射的包含人透明质酸酶PH20变体和药物的药物组合物”的发明专利申请的分案申请。
【技术领域】
本公开文本涉及一种药物组合物,其包含具有提高的酶活性和热稳定性的人透明质酸酶PH20变体和一种或多种药物;以及使用所述药物组合物治疗疾病的方法。
根据本公开文本的药物组合物可优选用于皮下注射。
【背景技术】
应以高剂量或多剂量给予的药物(特别是抗体药物等)通常经由静脉内注射来给予,并且这种注射需要约90分钟或更长时间,静脉内注射还伴随另外的准备程序,因此对于患者、医生和医务人员来说都不方便,并且会产生另外的成本。相比之下,皮下注射具有能够立即给予的优点,但是与静脉内注射相比,吸收率相对较低,并且当注射量为3-5mL或更多时,它可能因为吸收缓慢发生而在注射部位引起肿胀和疼痛。由于这个原因,皮下注射蛋白质治疗剂通常限于少量的2mL或更少的溶液注射。然而,在透明质酸酶与治疗药物一起皮下给予(或皮下注射)后,分布在细胞外基质中的透明质酸在透明质酸酶的作用下被水解,从而皮下区域的粘度降低并且物质的渗透性增加,因此高剂量或多剂量的药物可以容易地递送到体内。
人类中有六种类型的透明质酸酶基因:Hyal1、Hyal2、Hyal3、Hyal4、HyalPS1和PH20/SPAM1。Hyal1和Hyal2在大多数组织中表达,并且PH20/SPAM1(以下称为PH20)在精子细胞膜和顶体膜中表达。HyalPS1不表达,因为它是假基因。PH20是一种酶(EC 3.2.1.35),它切割N-乙酰氨基葡萄糖与葡萄糖醛酸(构成透明质酸的糖)之间的β-1,4键。人透明质酸酶PH20的最佳pH为5.5,但即使在7-8的pH下也展现出一定的活性,而其他的人透明质酸酶(包括Hyal1)的最佳pH为3-4,并且在7-8的pH下活性很弱。人的皮下区域的pH为约7.4,其大体上呈中性,因此在各种类型的透明质酸酶中,PH20被广泛应用于临床应用。PH20的临床应用的例子包括皮下注射抗体治疗剂,其在眼科手术中用作眼部松弛剂和麻醉添加剂;用于通过水解肿瘤细胞的细胞外基质中的透明质酸来增加抗癌治疗剂进入肿瘤细胞的通路;以及用于促进组织中过多存在的体液和血液的吸收。
同时,目前可商购的PH20是呈从牛或绵羊的睾丸提取的形式。其例子包括
牛睾丸透明质酸酶(BTH)是通过在翻译后修饰过程中从牛野生型PH20去除信号肽和C末端上的56个氨基酸而获得的。BTH也是一种糖蛋白,并且基于其包括氨基酸的总组成,具有5%的甘露糖含量和2.2%的葡萄糖胺含量(Borders和Raftery,1968)。当将动物来源的透明质酸酶以高剂量反复给予至人体时,可以产生中和抗体,并且除PH20外还含有的作为杂质的其他动物来源的生物材料可能引起过敏反应。特别地,由于担心疯牛病导致从牛提取的PH20的使用受到限制。为了克服这些问题,已经进行了关于重组人PH20蛋白的研究。
已经报道了重组人PH20蛋白在酵母(巴斯德毕赤酵母)、DS-2昆虫细胞、动物细胞等中表达(Chen等人,2016,Hofinger等人,2007)。在昆虫细胞和酵母中产生的重组PH20蛋白在翻译后修饰过程中的N-糖基化模式方面与人PH20不同。
在透明质酸酶中,已经鉴定出Hyal1(PDB ID:2PE4)(Chao等人,2007)和蜂毒透明质酸酶(PDB ID:1FCQ、1FCU、1FCV)的蛋白质结构。Hyal1由两个结构域构成,即催化结构域和EGF样结构域,并且催化结构域呈(β/α)
在人PH20的结构/功能关系研究中,发现PH20的C末端区域对于蛋白质表达和酶活性很重要,并且具体地,已经报道了用氨基酸477-483终止C末端对于酶的表达和活性很重要(Frost,2007)。全长PH20(氨基酸1-509)或具有在位置467处被截短的C末端的pH20变体的活性仅是具有在位置477至483中的一个位点处被截短的C末端的pH20变体的活性的10%或更小(Frost,2007)。Halozyme Therapeutics开发了rHuPH20(氨基酸36-482),它是一种重组蛋白,其中成熟PH20的C末端在Y482处被切割(Bookbinder等人,2006;Frost,2007)。
同时,尽管正在进行研究以开发使用人PH20的皮下注射形式的各种治疗药物,但是人PH20本身的低稳定性的问题仍未解决。
在此技术背景下,本公开文本的发明人证实了人PH20变体(包括野生型透明质酸酶PH20的氨基酸序列中的α-螺旋8区(S347至C381)和在α-螺旋7与α-螺旋8之间的接头区(A333至R346)中的一个或多个氨基酸残基取代,并且其中位于PH20的N末端和/或C末端处的一些氨基酸被切割)具有很高的酶活性和热稳定性,并且因此为此提交了专利申请(PCT/KR 2019/009215)。
本申请的发明人还证实,根据本公开文本的PH20变体可应用于药物组合物或配制品,所述药物组合物或配制品包含药物(例如抗体药物,特别是高剂量抗HER2抗体或免疫检查点抗体),并且因此根据本公开文本的药物组合物和配制品(包含PH20变体以及药物,诸如抗HER2抗体或免疫检查点抗体)可用于皮下注射,并且药物(诸如抗体药物)和PH20变体的活性非常稳定并且可以维持很长时间,从而完成本公开文本。
【发明内容】
【技术问题】
因此,本公开文本是针对上述问题进行的,并且本公开文本的一个目的是提供一种新型药物组合物,其包含具有提高的酶活性和热稳定性的PH20变体和药物,其中所述药物和所述PH20变体的热稳定性和活性可以维持很长时间;特别是可用于皮下注射的药物组合物。
本公开文本的另一个目的是提供一种治疗疾病的方法,所述方法包括向需要治疗的受试者给予根据本公开文本的药物组合物。
【技术解决方案】
根据本公开文本,上述和其他目的可以通过提供药物组合物来实现,所述药物组合物包含(a)药物和(b)PH20变体。
根据本公开文本的药物组合物中包含的PH20变体可以包含具有SEQ ID NO:1的氨基酸序列的野生型人PH20中的选自S343E、M345T、K349E、L353A、L354I、N356E和I361T的一个或多个氨基酸残基取代;并且可以进一步包含选自α-螺旋8区(S347至C381)和/或在α-螺旋7与α-螺旋8之间的接头区(A333至R346)的一个或多个区域中的一个或多个氨基酸残基取代,其中位于N末端和/或C末端的一些氨基酸残基被选择性地切割。
根据本公开文本的药物组合物可以进一步包含选自药学上可接受的添加剂,特别是缓冲液、稳定剂和表面活性剂的一种或多种。
根据本公开文本的药物组合物可以以用于皮下注射的注射配制品的形式使用。
【附图说明】
从以下结合附图的详细描述中,将更清楚地理解本公开文本的上述和其他目的、特征和其他优点,在所述附图中:
图1A示出了曲妥珠单抗在45℃的严苛条件下的稳定性测试中的尺寸排阻色谱法的色谱图,并且图1B示出了在45℃的严苛条件下的稳定性测试中根据配制品的曲妥珠单抗单体蛋白纯度的变化;
图2示出了测量包含曲妥珠单抗和新型PH20变体HP46的配制品的蛋白质聚集温度的结果;
图3A是曲妥珠单抗在45℃的严苛条件下的稳定性测试中弱阳离子交换(WCX)色谱图,图3B示出了在45℃的严苛条件下的稳定性测试中配制品中的酸性变体的相对量的变化(%),图3C示出了在45℃的严苛条件下在稳定性测试中配制品的主峰的相对量的变化(%),并且图3D示出了在45℃的严苛条件下的稳定性测试中配制品中的碱性变体的相对量的变化(%);
图4示出了在45℃的严苛条件下的稳定性测试中配制品5-7中曲妥珠单抗单体蛋白纯度的变化;
图5A示出了在45℃的严苛条件下的稳定性测试中配制品5-7中酸性变体的相对量的变化(%),图5B示出了在45℃的严苛条件下的稳定性测试中根据配制品5、6和7的主峰的相对量的变化(%),并且图5C示出了在45℃的严苛条件下的稳定性测试中根据配制品5、6和7的碱性变体的相对量的变化(%);
图6A示出了在40℃的严苛条件下的稳定性测试中在第0天和第1天测量赫赛汀皮下注射配制品(赫赛汀SC)、曲妥珠单抗+野生型PH20(HW2)和曲妥珠单抗+PH20变体HP46的残余酶活性的结果,并且图6B示出了在45℃的严苛条件下的稳定性测试中在第0天和第1天测量赫赛汀皮下注射配制品、曲妥珠单抗+野生型PH20(HW2)和曲妥珠单抗+PH20变体HP46的残余酶活性的结果;
图7示出了在40℃的严苛条件下持续14天的稳定性测试中配制品8-10的尺寸排阻色谱法分析结果;
图8A示出了使用DLS设备测量配制品8-10的蛋白质粒度变化的结果,并且图8B示出了测量蛋白质聚集温度的结果;
图9A示出了在40℃的严苛条件下的稳定性测试中配制品8的弱阳离子交换(WCX)色谱图,图9B示出了在40℃的严苛条件下的稳定性测试中配制品8-10中酸性变体的相对量的变化(%),图9C示出了在40℃的严苛条件下的稳定性测试中配制品8-10的主峰的相对量的变化(%),并且图9D示出了在40℃的严苛条件下的稳定性测试中配制品8-10中碱性变体的相对量的变化(%);
图10示出了在40℃的严苛条件下的稳定性测试中配制品8-10的相对酶活性的变化(%);
图11示出了在40℃的严苛条件下的稳定性测试中配制品11-13的曲妥珠单抗单体纯度的变化;
图12A示出了在40℃的严苛条件下的稳定性测试中配制品11的弱阳离子交换(WCX)色谱图,图12B示出了在40℃的严苛条件下的稳定性测试中配制品11-13中酸性变体的相对量的变化(%),图12C示出了在40℃的严苛条件下的稳定性测试中配制品11-13的主峰的相对量的变化(%),并且图12D示出了在40℃的严苛条件下的稳定性测试中配制品11-13中碱性变体的相对量的变化(%);
图13示出了在40℃的严苛条件下的稳定性测试中配制品11-13的相对酶活性的变化(%);
图14示出了在40℃的严苛条件下的稳定性测试中配制品14-16的利妥昔单抗单体纯度的变化;
图15示出了在40℃的严苛条件下在稳定性测试中配制品14-16的相对酶活性的变化;
图16示出了在40℃的严苛条件下的稳定性测试中配制品17和18的相对酶活性的变化;
图17示出了在40℃下配制品19-22的尺寸排阻色谱法分析的结果;
图18示出了在40℃的严苛条件下在稳定性测试中配制品19-22的相对酶活性的变化;
图19示出了由重组人PH20和HP46的pH变化引起的酶活性变化;并且
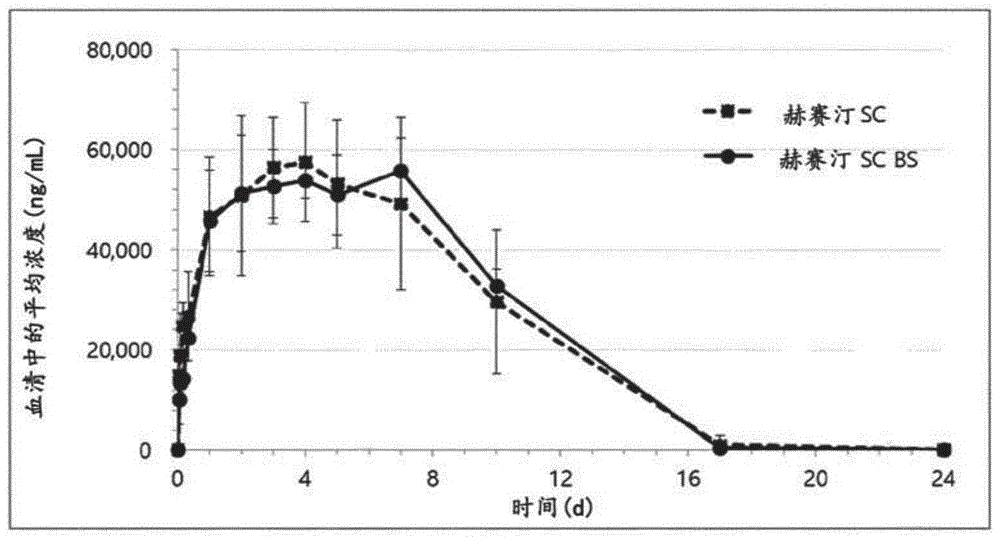
图20示出了在9周龄的Sprague-Dawley大鼠中赫赛汀皮下注射产品(赫赛汀SC)和赫赛汀皮下注射生物仿制药候选物(曲妥珠单抗+HP46;赫赛汀SC BS)的药代动力学的实验结果,其中将赫赛汀和赫赛汀生物仿制药候选物各自以18mg/kg注射,并且皮下注射配制品含有100单位的rHuPH20和100单位的HP46(在pH 5.3下)。
【具体实施方式】
除非另有定义,否则本文使用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。通常,本文使用的术语是本领域熟知的且常用的。
本公开文本的实施方案涉及一种包含(a)药物和(b)PH20变体的药物组合物,并且根据本公开文本的药物组合物可以用于疾病的预防或治疗,并且优选地用于皮下注射。
根据本公开文本的药物组合物中包含的人PH20变体具有如下区域中的一些氨基酸残基取代,所述区域对应于在野生型PH20(具有SEQ ID NO:1的氨基酸序列)、优选成熟野生型PH20(具有由SEQ ID NO:1的氨基酸序列中的L36至S490组成的序列)的氨基酸序列中的α-螺旋区和/或其接头区、优选α-螺旋8区(S347至C381)和/或在α-螺旋7与α-螺旋8之间的接头区(A333至R346)、更优选在T341至N363中的氨基酸区域、以及最优选T341至I361、L342至I361、S343至I361、I344至I361、M345至I361或M345至N363,。
在本公开文本中,“成熟野生型PH20”是指包含以下氨基酸残基的蛋白质:SEQ IDNO:1的氨基酸残基L36至S490,其缺少形成信号肽的M1至T35;和在具有SEQ ID NO:1的序列的野生型PH20的氨基酸序列中的A491至L509,其与PH20的实质功能无关。
表1.野生型PH20的氨基酸序列(SEQ ID NO:1)
具体地,根据本公开文本的药物组合物中包含的PH20变体或其片段包含具有SEQID NO:1的序列的野生型PH20中的一个或多个突变、优选选自S343E、M345T、K349E、L353A、L354I、N356E和I361T的氨基酸残基取代、以及最优选选自L354I和N356E的一个或多个氨基酸残基取代。
在本公开文本中,术语“PH20变体”旨在包含野生型人PH20的序列中的一些氨基酸残基的突变、优选氨基酸残基的取代;以及在N末端和/或C末端处的一些氨基酸残基的缺失连同氨基酸残基的这种取代,并且以与表述“PH20变体或其片段”大体相同的含义使用。
本公开文本的发明人已经证实,可以通过先前研究基于以下实验结果提供与野生型PH20相比具有提高的酶活性和热稳定性的新型PH20变体或其片段,在所述实验结果中,当人PH20的α-螺旋8区和在α-螺旋7与α-螺旋8之间的接头区的氨基酸序列部分地被具有高亲水性的Hyal1的α-螺旋8区和在α-螺旋7与α-螺旋8之间的接头区的氨基酸序列取代时,在中性pH下的酶活性和蛋白质聚集温度(Tagg)增加。
因此,根据本公开文本的药物组合物中包含的PH20变体包含野生型PH20(具有SEQID NO:1的氨基酸序列)、优选成熟野生型PH20(在SEQ ID NO:1的氨基酸序列中具有由L36至S490组成的序列)的氨基酸序列中的选自S343E、M345T、K349E、L353A、L354I、N356E和I361T的一个或多个氨基酸残基取代、优选选自L354I和N356E的一个或多个氨基酸残基取代,
其中在对应于α-螺旋区和/或其接头区的区域中、优选在α-螺旋8区(S347至C381)和/或在α-螺旋7与α-螺旋8之间的接头区(A333至R346)中、更优选在对应于T341至N363、T341至I361、L342至I361、S343至I361、I344至I361、M345至I361或M345至N363的氨基酸区域中的一个或多个氨基酸残基被取代。
特别地,在根据本公开文本的药物组合物中包含的PH20变体中,野生型PH20、优选成熟野生型PH20的α-螺旋8区(S347至C381)和/或在α-螺旋7与α-螺旋8之间的接头区(A333至R346)可以被具有序列SEQ ID NO:51(参见表2和表3)的Hyal1的相应区域的氨基酸序列中的一些氨基酸残基取代,但本公开文本不限于此。
表2.野生型Hyal1的氨基酸序列(SEQ ID NO:51)
表3.PH20与Hyal1的α螺旋和氨基酸序列之间的比较
更具体地,根据本公开文本的药物组合物中包含的PH20变体或其片段优选包含野生型PH20、优选成熟野生型PH20的氨基酸序列中的L354I和/或N356E的氨基酸残基取代,
并且优选在选自T341至N363的一个或多个位置处、特别是在选自T341、L342、S343、I344、M345、S347、M348、K349、L352、L353、D355、E359、I361和N363的一个或多个位置处进一步包含氨基酸残基取代,但本公开文本不限于此,并且
更优选进一步包含选自T341S、L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、D355K、E359D、I361T和N363G的一个或多个氨基酸残基取代,但本公开文本不限于此。
优选地,根据本公开文本的药物组合物中包含的PH20变体或其片段可以包含选自M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T的氨基酸残基取代,
并且可以进一步包含选自T341S、L342W、S343E、I344N和N363G的一个或多个氨基酸残基取代,但本公开文本不限于此。
更优选地,根据本公开文本的药物组合物中包含的PH20变体或其片段可以包含但不限于选自以下组的任何一个取代:
(a)T341S、L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
(b)L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
(c)M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
(d)M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D、I361T和N363G;
(e)I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;以及
(f)S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T。
在本公开文本中,用一个字母的氨基酸残基代码连同数字一起描述的表述诸如“S347”意指在SEQ ID NO:1的氨基酸序列中的相应位置处的氨基酸残基。
例如,“S347”意指在SEQ ID NO:1的氨基酸序列中的位置347处的氨基酸残基是丝氨酸。另外,“S347T”意指在SEQ ID NO:1的位置347处的丝氨酸被苏氨酸取代。
根据本公开文本的药物组合物中包含的PH20变体被解释为包括其中特定氨基酸残基位置处的氨基酸残基被保守取代的变体。
如本文所用,术语“保守取代”是指PH20变体的修饰,其涉及一个或多个氨基酸被具有相似生化特性的氨基酸取代,后者氨基酸不引起相应PH20变体的生物或生化功能的丧失。
“保守氨基酸取代”是这样的取代,其中氨基酸残基被具有相似侧链的氨基酸残基替代。具有相似侧链的氨基酸残基家族已经定义并且在本领域中是熟知的。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸和组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸和谷氨酸)、具有不带电的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸和半胱氨酸)、具有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸和色氨酸)、具有β-支化侧链的氨基酸(例如,苏氨酸、缬氨酸和异亮氨酸)以及具有芳香族侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸和组氨酸)。
预期在根据本公开文本的药物组合物中包含的PH20变体尽管具有保守氨基酸取代,但仍将保持其活性。
另外,根据本公开文本的药物组合物中包含的PH20变体或其片段被解释为包括如下PH20变体或其片段,所述PH20变体或其片段具有与根据本公开文本的PH20变体或其片段的功能和/或作用基本相同的功能和/或作用,并且与根据本公开文本的PH20变体或其片段具有至少80%或85%、优选至少90%、更优选至少95%、以及最优选至少99%的氨基酸序列同源性。
与成熟野生型PH20相比,根据本公开文本的PH20变体在动物细胞中具有增加的表达水平和增加的蛋白质重折叠率,从而具有提高的热稳定性。此外,尽管热稳定性提高,但PH20变体的酶活性超过或类似于成熟野生型PH20的酶活性。
同时,已知当成熟野生型PH20的C末端处的一些氨基酸(诸如S490)被另外切割时,酶活性降低,但是与成熟野生型PH20相比,根据本公开文本的PH20变体显示出提高的热稳定性和增加或类似的酶活性,即使成熟野生型PH20的C末端具有另外切割的序列。另外,当从N末端氨基酸切割多达五个氨基酸残基时,PH20变体维持其酶活性,这表明从N末端的P41开始的残基在蛋白质表达和酶活性方面起重要作用。
因此,根据本公开文本的药物组合物中包含的PH20变体包含野生型PH20的α-螺旋8区(S347至C381)和/或在α-螺旋7与α-螺旋8之间的接头区(A333至R346)中的一些氨基酸残基取代,并且进一步包含C末端和/或N末端处的一些氨基酸残基缺失,但本公开文本不限于此。
在一个实施方案中,根据本公开文本的药物组合物中包含的PH20变体可以包含由以下切割导致的N末端处的一些氨基酸残基缺失,所述切割在选自SEQ ID NO:1的氨基酸序列的N末端处的M1至P42的氨基酸残基之前、优选在氨基酸残基L36、N37、F38、R39、A40、P41或P42之前;和/或由以下切割导致的C末端处的一些氨基酸残基缺失,所述切割在选自C末端处的V455至W509的氨基酸残基之后、优选在选自V455至S490的氨基酸残基之后、以及最优选在氨基酸残基V455、C458、D461、C464、I465、D466、A467、F468、K470、P471、P472、M473、E474、T475、E476、P478、I480、Y482、A484、P486、T488或S490之后。
表述“在N末端处的L36、N37、F38、R39、A40、P41或P42之前切割”分别意指切割并去除SEQ ID NO:1的氨基酸序列中的L36之前紧邻的M1至T35的所有氨基酸残基、N37之前紧邻的M1至L36的所有氨基酸残基、F38之前紧邻的M1至N37的所有氨基酸残基、R39之前紧邻的M1至F38的所有氨基酸残基、A40之前紧邻的M1至R39的所有氨基酸残基、P41之前紧邻的M1至A40的所有氨基酸残基以及P42之前紧邻的M1至P41的所有氨基酸残基。表述“在SEQ IDNO:1的N末端处的M1之前切割”意指在N末端不发生切割。
另外,表述“在C末端处的V455、C458、D461、C464、I465、D466、A467、F468、K470、P471、P472、M473、E474、T475、E476、P478、I480、Y482、A484、P486、T488或S490之后切割”意指分别切割并去除SEQ ID NO:1序列中的V455、C458、D461、C464、I465、D466、A467、F468、K470、P472、M473、E474、T475、E476、P478、I480、Y482、A484、P486、T488或S490之后的氨基酸残基。例如,在S490之后切割意指在S490与A491之间切割。
优选地,根据本公开文本的药物组合物中包含的人PH20变体可以具有选自SEQ IDNOS:5至50的氨基酸序列的氨基酸序列,更优选地具有SEQ ID NO:44的氨基酸序列,但本公开文本不限于此。在根据本公开文本的特定实施方案中构建的PH20变体中,取代或切割的氨基酸序列示于下表4中。
表4.根据本公开文本的PH20变体的氨基酸序列及其取代/切割特性
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
同时,先前的研究报道了野生型PH20的酶活性根据位于C末端处的氨基酸残基的切割位置而变化。然而,在本公开文本中,形成PH20的二级结构的特定α螺旋被其他的人透明质酸酶的α螺旋取代,从而构建了比野生型PH20具有更高稳定性的PH20变体,并且在这些变体中,PH20的取代的α-螺旋结构域与其他二级结构之间的相互作用显示出与野生型PH20的模式不同的模式,因此不管C末端处的切割位置如何,所述变体都具有一定的或更高水平的酶活性。
另外,在本公开文本中,试图通过使用在动物细胞中展现出高蛋白质表达水平的其他蛋白质的信号肽代替人PH20的原始信号肽来增加重组PH20蛋白的表达。
因此,在另一个实施方案中,根据本公开文本的药物组合物中包含的PH20变体可以在其N末端处包含源自人透明质酸酶-1(Hyal1)、人生长激素或人血清白蛋白的信号肽代替由M1至T35组成的野生型PH20的信号肽,并且优选地可以包含如表5所示的具有根据SEQID NO:2的氨基酸序列MATGSRTSLLLAFGLLCLPWLQEGSA的人生长激素来源的信号肽、具有根据SEQ ID NO:3的氨基酸序列MKWVTFISLLFLFSSAYS的人血清白蛋白来源的信号肽、或具有根据SEQ ID NO:4的氨基酸序列MAAHLLPICALFLTLLDMAQG的人Hyal1来源的信号肽,但本公开文本不限于此。
表5.人生长激素、人血清白蛋白或人Hyal1的信号肽的氨基酸序列
在根据本公开文本的药物组合物中包含的PH20变体中,具有附接至C末端的6xHis标签的变体被称为HM,而没有6xHis标签的变体被称为HP。另外,具有附接至其C末端的6xHis标签的成熟野生型PH20(L36-S490)被称为WT,而没有6xHis标签且其中C末端在Y482之后被切割的成熟野生型PH20(L36至Y482)被称为HW2。
HP46(SEQ ID NO:44)是通过以下方法获得的人PH20变体:使用具有已知蛋白质三级结构的Hyal1(PDB ID:2PE4)(Chao等人,2007)对蛋白质结构进行建模,所述Hyal1是人透明质酸酶,然后用Hyal1的氨基酸序列取代α-螺旋8和在α-螺旋7与α-螺旋8之间的接头区的氨基酸序列,并且使N末端在F38处经历切割并且使C末端在F468之后经历切割。特别地,α-螺旋8位于PH20的蛋白质三级结构之外,并且与其他α螺旋相比,与相邻的α螺旋或β链的相互作用更少。通常,酶活性与热稳定性之间存在折衷(trade-off)关系,因此蛋白质的热稳定性越高,酶活性越低,并且当酶活性由于蛋白质结构的柔性的提高而增加时,热稳定性趋于降低。然而,通过浊度测定在pH 7.0下测得的HP46的比活性为约46单位/μg,其被评价为野生型PH20的比活性的约两倍,野生型PH20的比活性为约23单位/μg。
可以基于熔解温度Tm(在该温度下,50%的蛋白质三级结构变性)和聚集温度Tagg(在该温度下,蛋白质之间发生聚集)来评价蛋白质的热稳定性。通常,蛋白质的聚集温度倾向于低于其熔解温度。Hyal1的α-螺旋8比PH20的α-螺旋8具有更大的亲水性。Hyal1的取代的α-螺旋8提高HP46的蛋白质表面亲水性,从而引起由于疏水相互作用而发生的蛋白质之间聚集的延迟效应,因此聚集温度为51℃,观察到其与野生型PH20的聚集温度(46.5℃)相比升高了4.5℃。
HP46是这样的变体,其中α-螺旋8和在α-螺旋7与α-螺旋8之间的接头区中的氨基酸残基被取代,其中T341被丝氨酸取代。当氨基酸残基341为苏氨酸时,酶活性与野生型PH20的酶活性相似,但在被丝氨酸取代后,酶活性提高了约2倍,并且可以证实,即使在底物凝胶测定中,经所得变体水解的透明质酸比野生型PH20多5至6倍。底物凝胶测定涉及蛋白质变性和重折叠过程,这意味着与野生型PH20相比,HP46的蛋白质三级结构重折叠和恢复得到增强。
在根据本公开文本的药物组合物中的PH20变体的量为至少50单位/mL、优选在100单位/mL至20,000单位/mL的范围内、更优选在约150单位/mL至约18,000单位/mL的范围内、仍更优选在1,000单位/mL至16,000单位/mL的范围内、以及最优选在1,500单位/mL至12,000单位/mL的范围内。
根据本公开文本的药物组合物中包含的药物的例子包括但不限于蛋白质药物、抗体药物、小分子、适体、RNAi、反义物(antisense)和细胞治疗剂(诸如嵌合抗原受体(CAR)-T或CAR-自然杀伤细胞(NK)),并且不仅可以使用目前可商购的药物,而且还可以使用临床试验或开发中的药物。
作为药物,可以优选使用蛋白质药物或抗体药物。
根据本公开文本的药物组合物中包含的“蛋白质药物”是由氨基酸组成且因此通过蛋白质的活性展现出治疗或预防疾病的作用的药物;是由除了抗体药物以外的蛋白质组成的药物;并且可以选自细胞因子、治疗酶、激素、可溶性受体及其融合蛋白、胰岛素或其类似物、骨形态发生蛋白(BMP)、促红细胞生成素和血清来源的蛋白质,但本公开文本不限于此。
根据本公开文本的药物组合物中包含的细胞因子可以选自干扰素、白介素、集落刺激因子(CSF)、肿瘤坏死因子(TNF)和组织生长因子(TGF),但本公开文本不限于此。
治疗酶可以包括但不限于β-葡萄糖脑苷脂酶和半乳糖苷酶β(agalsidaseβ)。
根据本公开文本的药物组合物中包含的可溶性受体是受体的胞外结构域,并且其融合蛋白是其中抗体的Fc区等与可溶性受体融合的蛋白质。可溶性受体是与疾病相关的配体结合的受体的可溶性形式,并且其例子包括其中Fc区与TNF-α可溶性受体融合的形式(例如,含有成分依那西普的产物及与其相似的形式)、Fc区与VEGF可溶性受体融合的形式(含有成分阿法西普(alefacept)的产物及与其相似的形式)、Fc区与CTLA-4融合的形式(例如,含有成分阿巴西普或贝拉西普的产物及与其相似的形式)、Fc区与白介素1可溶性受体融合的形式(例如,含有成分利纳西普的产物及与其相似的形式)、以及Fc区与LFA3可溶性受体融合的形式(例如,含有成分阿法西普的产物及与其相似的形式),但本公开文本不限于此。
根据本公开文本的药物组合物中包含的激素是指为了治疗或预防由激素缺乏等引起的疾病而注射到体内的激素或其类似物,并且所述激素或其类似物的例子包括但不限于人生长激素、雌激素和孕酮。
根据本公开文本的药物组合物中包含的血清来源的蛋白质是血浆中存在的蛋白质,并且包括从血浆提取的蛋白质和产生的重组蛋白质两者,且其例子可以包括但不限于纤维蛋白原、血管性血友病因子(von Willebrand factor)、白蛋白、凝血酶、因子II(FII)、因子V(FV)、因子VII(FVII)、因子IX(FIX)、因子X(FX)和因子XI(FXI)。
根据本公开文本的药物组合物中包含的抗体药物可以是单克隆抗体药物或多克隆抗体药物。
根据本公开文本的单克隆抗体药物是含有能够特异性地结合至与特定疾病相关的抗原的单克隆抗体和单克隆抗体片段的蛋白质。单克隆抗体还包括双特异性抗体,并且含有单克隆抗体或其片段的蛋白质在概念上包括抗体-药物缀合物(ADC)。
与特定疾病相关的抗原的例子包括4-1BB、整联蛋白、β淀粉样蛋白、血管生成素(血管生成素1或2)、血管生成素类似物3、B细胞活化因子(BAFF)、B7-H3、补体5、CCR4、CD3、CD4、CD6、CD11a、CD19、CD20、CD22、CD30、CD33、CD38、CD52、CD62、CD79b、CD80、CGRP、紧密连接蛋白-18、补体因子D、CTLA4、DLL3、EGF受体、血友病因子、Fc受体、FGF23、叶酸受体、GD2、GM-CSF、HER2、HER3、干扰素受体、干扰素γ、IgE、IGF-1受体、白介素1、白介素2受体、白介素4受体、白介素5、白介素5受体、白介素6、白介素6受体、白介素7、白介素12/23、白介素13、白介素17A、白介素17受体A、白介素31受体、白介素36受体、LAG3、LFA3、NGF、PVSK9、PD-1、PD-L1、RANK-L、SLAMF7、组织因子、TNF、VEGF、VEGF受体和血管性血友病因子(vWF),但本公开文本不限于此。
以下是但不限于蛋白质,包括针对与特定疾病相关的抗原的单克隆抗体或单克隆抗体片段:
作为抗4-1BB抗体的乌托鲁单抗(utomilumab);
作为针对整联蛋白的抗体的那他珠单抗、埃特罗珠单抗、维多珠单抗和比格鲁玛单抗;
作为针对β淀粉样蛋白的抗体的巴匹珠单抗(bapineuzumab)、克雷内治单抗(crenezumab)、索拉珠单抗(solanezumab)、阿杜卡尼单抗(aducanumab)和甘特珠单抗(gantenerumab);
针对血管生成素的抗体,诸如针对血管生成素1和2的AMG780、针对血管生成素2的MEDI 3617和奈斯卡单抗、和作为针对血管生成素2和VEGF的双特异性抗体的万古珠单抗;
作为针对血管生成素类似物3的抗体的依伐单抗(evinacumab);
作为针对B细胞活化因子(BAFF)的抗体的他贝芦单抗(tabalumab)、拉那鲁单抗(lanalumab)和贝利木单抗(belimumab);
作为针对B7-H3的抗体的奥博妥单抗(omburtamab);
作为针对补体5的抗体的雷夫利珠单抗(ravulizumab)和依库丽单抗;
作为针对CCR4的抗体的莫利珠单抗(Mogamulizumab);
作为针对CD3的抗体的奥昔珠单抗(otelixizumab)、替利珠单抗(teplizumab)和莫罗单抗(muromonab),作为针对GP100和CD3的双特异性抗体的tebentafusp,作为针对CD19和CD3的双特异性抗体的博纳吐单抗(blinatumomab)以及作为针对CD20和CD3的双特异性抗体的REGN1979;
作为针对CD4的抗体的依巴珠单抗和扎木单抗(zanolimumab);
作为针对CD6的抗体的伊曲珠单抗(itolizumab);
作为针对CD11a的抗体的依法利珠单抗(efalizumab);
作为针对CD19的抗体的英比利珠单抗(inebilizumab)、他法西他单抗(tafasitamab)和替朗妥昔单抗(loncastuximab tesirine)(所述替朗妥昔单抗是ADC);
作为针对CD20的抗体的奥瑞珠单抗、乌妥昔单抗(ublituximab)、奥比妥珠单抗、奥法木单抗、利妥昔单抗、托西莫单抗和替伊莫单抗(ibritumomab tiuxetan)(所述替伊莫单抗是ADC);
作为针对CD22的抗体的依帕珠单抗(epratuzumab)、奥英妥珠单抗(inotuzumabozogamicin)(所述奥英妥珠单抗是ADC)和帕西妥莫单抗(moxetumomab pasudotox);
作为针对CD30的ADC的本妥昔单抗(brentuximab vedotin);
作为针对CD33的ADC的他立林-伐达妥昔单抗(vadastuximab talirine)和奥唑米星-吉妥珠单抗(gemtuzumab ozogamicin);
作为针对CD38的抗体的达雷木单抗(daratumumab)和伊沙妥昔单抗(isatuximab);
作为针对CD52的抗体的阿仑单抗;
作为针对CD62的抗体的立赞利珠单抗(crizanlizumab);
作为针对CD79b的ADC的泊洛妥珠单抗(Polaruzumab vedotin);
作为针对CD80的抗体的加利昔单抗;
作为针对CGRP的抗体的依普奈珠单抗(eptinezumab)、夫瑞奈组单抗(fremanezumab)、加卡珠单抗(galcanezumab)和厄恩诺单抗(erenumab);
作为针对紧密连接蛋白-18的抗体的佐洛昔单抗;
作为针对补体因子D的抗体的兰帕单抗;
作为针对CTLA4的抗体的曲美目单抗、泽弗利单抗(zalifrelimab)和伊匹单抗;
作为针对DLL3的ADC的罗伐普妥单抗(rovalpituzumab tesirine);
作为针对EGF受体的抗体的西妥昔单抗、达妥昔单抗(depatuxizumab)、扎鲁木单抗、耐昔妥珠单抗(necitumumab)和帕尼单抗;
作为针对凝血因子IX和因子X(它们是血友病因子)的双特异性抗体的艾米珠单抗(emicizumab);
作为针对Fc受体的抗体的尼泊卡利单抗(nipocalimab)和洛利昔珠单抗(rozanolixizumab);
作为针对FGF23的抗体的布罗沙单抗(burosumab);
作为针对叶酸受体的抗体的法鲁珠单抗(Farletuzumab)和作为针对叶酸受体的ADC的索星-米妥昔单抗(mirvetuximab soravtansine);
作为针对GD2的抗体的达妥昔单抗(dinutuximab)和那昔妥单抗(naxitamab);
作为针对GM-CSF的抗体的奥替利单抗;
作为针对HER2的抗体的马格妥昔单抗(margetuximab)、帕妥珠单抗和曲妥珠单抗,以及作为针对HER2的ADC的曲妥珠单抗-德鲁替康(trastuzumab deruxtecan)、曲妥珠单抗-美坦新(trastuzumab emtansine)和曲妥珠单抗-杜卡马嗪(trastuzumabduocarmazine);
作为针对HER3的抗体的帕曲妥单抗(patritumab);
作为针对干扰素受体的抗体的阿尼富路单抗(anifrolumab);
作为针对干扰素γ的抗体的依帕伐单抗(Emapalumab);
作为针对IgE抗体的利戈组单抗(ligelizumab)和奥马珠单抗;
作为针对IGF-1受体的抗体的达洛珠单抗(dalotuzumab)、芬妥木单抗(figitumumab)和替妥木单抗(teprotumumab);
作为针对白介素1的抗体的吉伏珠单抗(gebokizumab)和康纳单抗(canakinumab);
作为针对白介素2受体的抗体的达克珠单抗和巴利昔单抗;
作为针对白介素4受体的抗体的度匹鲁单抗(dupilumab);
作为针对白介素5的抗体的美泊珠单抗和瑞舒单抗;
作为针对白介素5受体的抗体的贝那利珠单抗;
作为针对白介素6的抗体的克拉吉珠单抗、奥洛吉珠单抗、司卢库单抗和司妥昔单抗;
作为针对白介素6受体的抗体的萨瑞鲁单抗、沙特拉珠单抗(satralizumab)、托珠单抗和REGN88;
作为针对白介素7的抗体的苏金单抗;
作为针对白介素12/23的抗体的优特克单抗和布雷奴单抗(briakinumab);
作为针对白介素13的抗体的乐比瑞克单抗(lebrikizumab)和曲罗芦单抗(tralokinumab);
作为针对白介素17A的抗体的依奇珠单抗(ixekizumab)和比美珠单抗(bimekizumab);
作为针对白介素17受体A的抗体的布罗达单抗(brodalumab);
作为针对白介素23的抗体的布拉兹库单抗(brazikumab)、古塞库单抗(guselkumab)、利散吉珠单抗(risankizumab)、替曲吉珠单抗(tildrakizumab)和米吉珠单抗(mirikizumab);
作为针对白介素31受体的抗体的奈莫珠单抗;
作为针对白介素36受体的抗体的佩索利单抗(spesolimab);
作为针对LAG3的抗体的瑞拉利单抗(relatlimab);
作为针对NASP2的抗体的纳索匹单抗(narsoplimab);
作为针对NGF抗体的法西单抗和他尼珠单抗(tanezumab);
作为针对PVSK9的抗体的阿利库单抗、依伏库单抗和伯考赛珠单抗(bococizumab);
作为针对PD-1的抗体的帕博利珠单抗(lambrolizumab)、巴斯替利单抗(balstilimab)、卡瑞利珠单抗(camrelizumab)、西米普利单抗(cemiplimab)、多塔利单抗(dostarlimab)、帕洛利单抗(prolgolimab)、西地单抗(shintilimab)、斯巴达珠单抗(spartalizumab)、替雷利珠单抗(tislelizumab)、派姆单抗和纳武单抗;
作为针对PD-L1的抗体的阿特珠单抗、阿维鲁单抗、恩沃利单抗(envafolimab)和度伐单抗,和作为针对TGFβ和PD-L1的双特异性抗体的bintrafuspα;
作为针对RANK-L的抗体的地诺单抗;
作为针对SLAMF7的抗体的艾洛珠单抗;
作为针对组织因子的抗体的康昔单抗(Concizumab)和马斯塔单抗(marstacimab);
针对TNF、特别是TNFα的抗体,包括英夫利昔单抗、阿达木单抗、戈利木单抗、抗体片段赛妥珠单抗(certolizumab pegol)和奥利组单抗(ozoralizumab)(所述奥利组单抗是针对TNF和白蛋白的双特异性抗体);
针对VEGF的抗体,包括布洛赛珠单抗(brolucizumab)、兰尼单抗、贝伐单抗和法瑞慈单抗(faricimab)(所述法瑞慈单抗是针对VEGF和Ang2的双特异性抗体);
作为针对VEGF受体的抗体的雷莫芦单抗;以及
作为针对vWF的抗体的卡普赛珠单抗(caplacizumab)。
同时,在约20%-25%的乳腺癌患者中观察到促进细胞分裂的人表皮生长因子受体2(HER2)的过表达,并且HER2过表达的乳腺癌进展迅速,具有侵袭性且与HER2低表达的乳腺癌相比对化疗的反应较低,因此其预后不良。曲妥珠单抗是靶向HER2的单克隆抗体药物,其与过表达HER2的癌细胞表面上的HER2特异性地结合,以抑制细胞复制和增殖的信号转导,从而减缓肿瘤进展。曲妥珠单抗于1998年被美国食品药品监督管理局(FDA)批准用于治疗乳腺癌,并于2003年被韩国食品药品管理局(KFDA)批准用于治疗乳腺癌。此后,曲妥珠单抗的功效在过表达HER2的胃癌中也得到认可,因此已被用作胃癌的治疗剂。
罗氏的赫赛汀静脉内注射配制品(商业名称:赫赛汀)由作为主要成分的440mg曲妥珠单抗组成,并将冻干的曲妥珠单抗与生理盐水混合并注入静脉中。另一方面,曲妥珠单抗的皮下注射配制品(商业名称:赫赛汀SC)是5mL液体配制品,并且含有600mg(120mg/mL)曲妥珠单抗作为主要成分,并且包含20mM组氨酸(pH 5.5)、210mM海藻糖、10mM蛋氨酸、0.04%聚山梨酯20和10,000单位的rHuPH20(2,000单位/mL,0.004%,40μg/mL)作为添加剂。
赫赛汀皮下注射配制品的保存期限为21个月。曲妥珠单抗的静脉内注射配制品呈冻干形式并且具有30个月的保存期限,但是曲妥珠单抗的皮下注射配制品呈液态并且具有21个月的短保存期限。为此,可以估计曲妥珠单抗和重组人透明质酸酶PH20中的一种或多种在液体配制品中的稳定性受到限制。
在这种情况下,在本公开文本中,鉴于根据本公开文本的PH20变体的特征,其中与从Halozyme获得的野生型人透明质酸酶PH20和重组人PH20相比,PH20变体不仅具有增加的酶活性,而且还具有测得的高蛋白质聚集温度,因此展现出提高的热稳定性,皮下注射配制品的保存期限被设定为长期,优选21个月或更长时间。
在根据本公开文本的药物组合物中的抗体药物的含量可以在以下范围内:5mg/mL至500mg/mL、优选20mg/mL至200mg/mL、更优选100mg/mL至150mg/mL、以及最优选120±18mg/mL,例如,约110mg/mL、约120mg/mL或约130mg/mL。
根据本公开文本的药物组合物中包含的多克隆抗体是优选从血清提取的血清抗体,诸如免疫球蛋白,但不限于此。
在小分子化合物的情况下,可以不受限制地使用需要快速预防或治疗作用的任何药物。例如,可以使用基于吗啡的止痛药(Thomas等人,2009)。另外,当用作针对由抗癌药引起的组织坏死的治疗剂时,小分子化合物可以单独使用或与解毒药诸如长春花生物碱和紫杉烷组合使用(Kreidieh等人,2016)。
根据本公开文本的药物组合物可以进一步包含选自缓冲液、稳定剂和表面活性剂的一种或多种。
可以不受限制地使用根据本公开文本的组合物中包含的缓冲液,只要它能够实现4至8、优选5至7的pH即可,并且缓冲液优选地是选自以下的一种或多种:苹果酸盐、甲酸盐、柠檬酸盐、乙酸盐、丙酸盐、吡啶、哌嗪、卡可酸盐、琥珀酸盐、2-(N-吗啉代)乙磺酸(MES)、组氨酸、Tris、bis-Tris、磷酸盐、乙醇胺、碳酸盐、哌嗪-N,N'-双(2-乙磺酸)(PIPES)、咪唑、BIS-TRIS丙烷、N,N-双(2-羟乙基)-2-氨基乙磺酸(BES)、3-(N-吗啉代)丙磺酸)(MOPS)、羟乙基哌嗪乙磺酸(HEPES)、焦磷酸盐和三乙醇胺,更优选地是组氨酸缓冲液,例如L-组氨酸/HCl,但不限于此。
缓冲液的浓度可以在以下范围内:0.001mM至200mM、优选1mM至50mM、更优选5mM至40mM、以及最优选10mM至30mM。
可以不受限制地使用根据本公开文本的组合物中的稳定剂,只要它们在本领域中通常用于稳定蛋白质的目的即可,并且优选地,稳定剂可以是例如选自以下的一种或多种:碳水化合物、糖或其水合物、糖醇或其水合物和氨基酸。
用作稳定剂的碳水化合物、糖或糖醇可以是选自以下的一种或多种:海藻糖或其水合物、蔗糖、糖精、甘油、赤藓糖醇、苏糖醇、木糖醇、阿拉伯糖醇、核糖醇、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇、庚七醇、异麦芽酮糖醇、麦芽糖醇、聚葡糖醇、环糊精、羟丙基环糊精和葡萄糖,但不限于此。
氨基酸可以是选自以下的一种或多种:谷氨酰胺、谷氨酸、甘氨酸、赖氨酸、赖氨酸、亮氨酸、蛋氨酸、缬氨酸、丝氨酸、硒代蛋氨酸、瓜氨酸、精氨酸、天冬酰胺、天冬氨酸、鸟氨酸、异亮氨酸、牛磺酸、茶氨酸、苏氨酸、色氨酸、酪氨酸、苯丙氨酸、脯氨酸、吡咯赖氨酸、组氨酸和丙氨酸,但不限于此。
在根据本公开文本的药物组合物中用作稳定剂的糖或糖醇的浓度可以在以下范围内:0.001mM至500mM、优选100mM至300mM、更优选150mM至250mM、以及最优选180mM至230mM,并且特别地可以为约210mM。
另外,在根据本公开文本的药物组合物中用作稳定剂的氨基酸的浓度可以在以下范围内:1mM至100mM、优选3mM至30mM、更优选5mM至25mM、以及最优选7mM至20mM,并且特别地可以在8mM至15mM的范围内。
根据本发明的组合物可以进一步包含表面活性剂。
优选地,表面活性剂可以是非离子表面活性剂,诸如聚氧乙烯-脱水山梨糖醇脂肪酸酯(聚山梨酯或吐温)、聚乙烯-聚丙二醇、聚氧乙烯-硬脂酸酯、聚氧乙烯烷基醚,例如聚氧乙烯单月桂基醚、烷基苯基聚氧乙烯醚[Triton-X]、和聚氧乙烯-聚氧丙烯共聚物[泊洛沙姆和普朗尼克]和十二烷基硫酸钠(SDS),但不限于此。
更优选地,可以使用聚山梨酯。聚山梨酯可以是聚山梨酯20或聚山梨酯80,但不限于此。
根据本公开文本的药物组合物中的非离子表面活性剂的浓度可以在以下范围内:0.0000001%(w/v)至0.5%%(w/v)、优选0.000001%(w/v)至0.4%(w/v)、更优选0.00001%(w/v)至0.3%(w/v)、以及最优选0.001%(w/v)至0.2%(w/v)。
在一个实施方案中,根据本公开文本的药物组合物可以包含50-350mg/mL的抗体(例如,抗HER2抗体或免疫检查点抗体)、组氨酸缓冲液(提供5.5±2.0的pH)、10-400mMα,α-海藻糖、1-50mM蛋氨酸和0.0000001%(w/v)至0.5%(w/v)的聚山梨酯。
在更特定的实施方案中,根据本公开文本的药物组合物可以包含120mg/mL的抗HER2抗体或免疫检查点抗体、20mM组氨酸缓冲液(提供5.5±2.0的pH)、210mMα,α-海藻糖、10mM蛋氨酸和2,000单位/mL的PH20变体,并且可以进一步包含0.005%(w/v)至0.1%(w/v)的聚山梨酯。
根据本公开的药物组合物可以通过静脉内注射、皮下注射、肌内注射、腹膜内注射、内皮给予、局部给予、鼻内给予、肺内给予、直肠内给予等来给予,并且皮下给予优选通过皮下注射来进行,并且更优选将药物组合物用作皮下注射的注射配制品。
因此,本公开文本的另一个实施方案提供了包含根据本公开文本的药物组合物的配制品,优选用于皮下注射的注射配制品。
用于皮下注射的注射配制品可以以立即注射的形式提供,而无需另外的稀释过程,并且可以在包含在预填充的注射器、玻璃安瓿或塑料容器中之后提供。
本公开文本还涉及一种使用根据本公开文本的药物组合物或配制品治疗疾病的方法。
可使用根据本公开文本的药物组合物或配制品治疗的疾病没有特别限制,并且只要它是可以用药物与根据本公开文本的PH20变体组合治疗的疾病,便对其没有限制。
可使用根据本公开文本的药物组合物或配制品治疗的疾病可以是癌症或自身免疫疾病,但不限于此。
可用根据本公开文本的药物组合物或配制品治疗的癌症或癌没有特别限制,并且包括实体癌和血液癌。此类癌症的例子包括皮肤癌(诸如黑色素瘤)、肝癌、肝细胞癌、胃癌、乳腺癌、肺癌、卵巢癌、支气管癌、鼻咽癌、喉癌、胰腺癌、膀胱癌、结直肠癌、结肠癌、子宫颈癌、脑癌、前列腺癌、骨癌、甲状腺癌、甲状旁腺癌、肾癌、食道癌、胆道癌、睾丸癌、直肠癌、头颈癌、子宫颈癌、输尿管癌、骨肉瘤、神经母细胞瘤、纤维肉瘤、横纹肌肉瘤、星形细胞瘤、神经母细胞瘤和神经胶质瘤,但不限于此。优选地,可用本公开文本的药物组合物或配制品治疗的癌症可以选自胃癌、结直肠癌、乳腺癌、肺癌和肾癌,但不限于此。
可用本公开文本的药物组合物或配制品治疗的自身免疫疾病包括类风湿性关节炎、哮喘、牛皮癣、多发性硬化症、过敏性鼻炎、克罗恩病、溃疡性结肠炎、系统性红斑狼疮、I型糖尿病、炎性肠病(IBD)和特应性皮炎,但不限于此。
本公开文本还提供了一种治疗疾病的方法,其包括向需要治疗的受试者给予根据本公开文本的药物组合物或配制品,并且本公开文本进一步提供了根据本公开文本的药物组合物或配制品用于治疗疾病的用途。
除非本文另外定义,否则本公开文本中使用的技术术语和科学术语具有本领域普通技术人员通常理解的含义。另外,将省略对与相关技术的技术配置和操作相同的技术配置和操作的重复描述。
在下文中,将参考以下实施例进一步详细描述本公开文本。提供这些实施例仅为了说明的目的,并且对于本领域的普通技术人员清楚的是,这些实施例不应被解释为限制本公开文本的范围。
实施例
实施例1.配制品开发
如表6所示,制备了四种曲妥珠单抗皮下注射配制品。配制品1至4通常含有120mg/mL曲妥珠单抗,并且由20mM组氨酸/组氨酸-HCl(pH 5.5)、210mM海藻糖、10mM蛋氨酸和PH20变体组成。配制品1-4之间的差异是非离子表面活性剂的浓度,其中配制品1:0%聚山梨酯20,配制品2:0.005%聚山梨酯20,配制品3:0.04%聚山梨酯20和配制品4:0.1%聚山梨酯20。
表6.配制品组成
实施例2.使用分光光度计的测量
将配制品1至4在45℃下放置14天,并使用由贝克曼(Beckman)制造的分光光度计分析蛋白质浓度的变化。用蒸馏水稀释每个样品,使得样品的浓度为0.4mg/mL,然后使用分光光度计测量蛋白质在280nm处的吸光度。在严苛条件下即在45℃下持续14天的稳定性测试中,配制品1至4的蛋白质浓度没有显著变化。然而,透明质酸酶的活性在45℃下迅速降低,因此,在本实施例中,未测量酶活性(参看图6)。
实施例3.使用尺寸排阻色谱法研究每种配制品中曲妥珠单抗的单体比率
对于尺寸排阻色谱法分析,使用可购自Shimadzu Prominence的HPLC系统和TSK-gel G3000SWXL(7.8X 300mm,5μm)和TSK保护柱(6.0x 4.0mm,7μm)。使用含0.25M氯化钾的0.2M磷酸钾(pH 6.2)作为流动相。通过以0.5mL/min的流速应用等度分离模式进行分析,持续35分钟。用分析溶剂稀释样品,使最终浓度为10mg/mL,并在将20μL注入HPLC柱后,记录柱洗脱液在280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在45℃下持续14天的稳定性测试中进行尺寸排阻色谱法分析时,配制品1至4显示出相似的变化模式。主要变化是高分子量(HMW)和低分子量(LMW)降解产物的增加以及单体含量的下降(约1.5%),并且根据配制品不存在显著差异。总之,作为在严苛条件下(即在45℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,根据聚山梨酯20的浓度(0-0.1%(w/v)),在配制品之间不存在稳定性特征的显著差异(参见图1)。
实施例4.含有曲妥珠单抗和HP46的配制品的蛋白质聚集温度的测量
将动态光散射(DLS)用于分析归因于热量的蛋白质的变性特性。在本实验中,测量根据温度变化的蛋白质分子大小的变化,并将其用于计算蛋白质聚集温度。对于DLS分析,使用可购自Malvern的Zetasizer-nano-ZS仪器和石英比色杯(ZEN2112)。在分析过程中,以1℃的间隔将温度从25℃升高到85℃,并且使用每种配制缓冲液将样品稀释至1mg/mL,然后将150μL样品添加到比色杯中进行分析。
不含聚山梨酯20的配制品1中的聚集温度为74℃,且配制品2至4中的聚集温度为76℃(参见图2)。
实施例5.含有曲妥珠单抗和HP46的配制品的WCX色谱法测量
对于WCX色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSKgel CM-STAT柱(4.6x 100mm,7μm)、TSKgel保护凝胶CMSTAT(3.2mm内径x 1.5cm)等作为柱。流动相A为10mM磷酸钠(pH 7.5),并且流动相B为含有0.1M NaCl的10mM磷酸钠(pH7.2)。在0-30%流动相B的线性浓度梯度下,以0.8mL/min的流速进行分析持续55分钟。用流动相A稀释样品,使最终浓度为1.0mg/mL,将80μL样品注入HPLC中,然后记录柱洗脱液在280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在45℃下进行14天的稳定性测试中进行WCX分析时,配制品1至4显示出相似的变化模式。具体变化包括酸性变体的相对含量的增加(经14天约30%的变化)、主峰相对含量的减少(经14天约44%的变化)和碱性变体的相对含量的增加(经14天约15%的变化),并且根据配制品,不存在显著差异。总之,在严苛条件下即在45℃下的稳定性测试中的WCX分析中,根据聚山梨酯20(0-0.1%)的蛋白质稳定性是相似的(参见图3)。
实施例6.配制品开发
如表7所述,制备了三种类型的曲妥珠单抗皮下注射配制品。配制品5至7通常包含120mg/mL曲妥珠单抗、20mM组氨酸/组氨酸-HCl(pH 5.5)、210mM海藻糖、10mM蛋氨酸和HP46。配制品5-7之间的差异是稳定剂3的成分:配制品5:0.04%聚山梨酯20,配制品6:50mmLys-Lys,以及配制品3:甘氨酸。
表7.配制品组成
实施例7.使用分光光度计的测量
将配制品5至7在45℃下放置14天,并使用由贝克曼制造的分光光度计分析蛋白质浓度的变化。用蒸馏水稀释每个样品,使得样品的浓度为0.4mg/mL,然后使用分光光度计测量蛋白质在280nm处的吸光度。在严苛条件下即在45℃下持续14天的稳定性测试中,配制品5至7的蛋白质浓度没有显著变化。然而,透明质酸酶的活性在45℃下迅速降低,因此,在本实施例中,未测量酶活性(参看图6)。
实施例8.使用尺寸排阻色谱法研究每种配制品中曲妥珠单抗的单体比率
对于尺寸排阻色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSK-gel G3000SWXL(7.8X 300mm,5μm)和TSK保护柱(6.0x 4.0mm,7μm)作为柱。使用含0.25M氯化钾的0.2M磷酸钾(pH 6.2)作为流动相。以0.5mL/min的流速应用等度分离模式持续35分钟。用分析溶剂稀释样品,使最终浓度为10mg/mL,并且在将20μL样品注入HPLC柱中后,测量280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在45℃下持续14天的稳定性测试中进行尺寸排阻色谱法分析时,配制品5至7显示出相似的变化模式。主要变化是高分子量(HMW)和低分子量(LMW)杂质的增加以及单体含量的减少(约1.5%),并且根据配制品,不存在显著差异。总之,作为在严苛条件下(即在45℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,0.04%聚山梨酯20、50mM Lys-Lys和50mM甘氨酸配制品显示出相似的蛋白质稳定性(参见图4)。
实施例9.含有曲妥珠单抗和HP46的配制品的WCX色谱法分析
对于WCX色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSKgel CM-STAT(4.6×100mm,7μm)、TSKgel保护凝胶CMSTAT(3.2mm内径x 1.5cm)等作为柱。流动相A为10mM磷酸钠(pH 7.5),并且流动相B为含有0.1M NaCl的10mM磷酸钠(pH7.2)。通过以0.8mL/min的流速应用0-30%的线性浓度梯度的分离模式进行分析持续55分钟。用流动相A稀释样品,使最终浓度为1.0mg/mL,将80μL样品注入HPLC中,然后记录在280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在45℃下进行14天的稳定性测试中进行WCX分析时,配制品5至7显示出相似的变化模式。具体变化包括酸性变体的相对含量的增加(经14天约30%的变化)、主峰相对含量的减少(经14天约44%的变化)和碱性变体的相对含量的增加(经14天约15%的变化),并且根据配制品,不存在显著差异。总之,作为在严苛条件下(即在45℃下)的稳定性测试中进行WCX分析的结果,0.04%聚山梨酯20、50mM Lys-Lys和50mM甘氨酸配制品显示出相似的蛋白质稳定性(参见图5)。
实施例10.在曲妥珠单抗和HP46的皮下注射配制品中根据40℃和45℃的温度评价HP46的稳定性
为了评估曲妥珠单抗皮下注射配制品中HP46的稳定性,将曲妥珠单抗(120mg/mL)和PH20(2000单位/mL)混合。此时,使用的缓冲液含有20mM组氨酸(pH 5.5)、210mM海藻糖、10mM蛋氨酸和0.04%聚山梨酯20。在第0天测量对照样品的酶活性,并将实验样品在40℃或45℃下放置1天,然后测量每个样品的酶活性。
将赫赛汀皮下注射配制品曲妥珠单抗+HW2和曲妥珠单抗+HP46各自在40℃下放置1天,然后测量透明质酸酶的活性,并且作为结果,各个情况分别展现出51%、47%和94%的活性,这表明HP46在40℃下具有最大的热稳定性(参见图6)。另外,将赫赛汀皮下注射配制品曲妥珠单抗+HW2和曲妥珠单抗+HP46在45℃下放置1天,然后测量透明质酸酶的活性,并且作为结果,赫赛汀皮下注射配制品和曲妥珠单抗+HW2没有酶活性,但曲妥珠单抗+HP46的酶活性保留(参见图6)。
实施例11.配制品开发
如表8所示,制备了三种曲妥珠单抗皮下注射配制品。配制品8至10通常含有120mg/mL曲妥珠单抗、20mM组氨酸/组氨酸-HCl(pH 5.5)、210mM海藻糖、10mM蛋氨酸和PH20变体。配制品8-10之间的差异是非离子表面活性剂的浓度,其中配制品8:0%聚山梨酯20,配制品9:0.005%聚山梨酯20,及配制品10:0.04%聚山梨酯20。
表8.配制品组成
实施例12.使用分光光度计的测量
将配制品8至10在40℃下放置14天,并使用由贝克曼制造的分光光度计分析蛋白质浓度的变化。用蒸馏水稀释每个样品,使得样品的浓度为0.4mg/mL,然后使用分光光度计测量蛋白质在280nm处的吸光度。在严苛条件下即在40℃下持续14天的稳定性测试中,配制品8至10的蛋白质浓度没有显著变化。
实施例13.使用尺寸排阻色谱法研究每种配制品中曲妥珠单抗的单体比率
对于尺寸排阻色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSK-gel G3000SWXL(7.8X 300mm,5μm)和TSK保护柱(6.0x 4.0mm,7μm)作为柱。使用含0.25M氯化钾的0.2M磷酸钾(pH 6.2)作为流动相。通过以0.5mL/min的流速应用等度分离模式进行分析,持续35分钟。用分析溶剂稀释样品,使最终浓度为10mg/mL,并且在将20μL样品注入HPLC柱中后,测量280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在40℃下持续14天的稳定性测试中进行尺寸排阻色谱法分析时,配制品8至10显示出相似的变化模式。主要变化是高分子量(HMW)和低分子量(LMW)降解产物的增加以及单体含量的减少(约小于1.0%),并且根据配制品,不存在显著差异。总之,作为在严苛条件下(即在40℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,根据聚山梨酯20的浓度(0-0.04%),配制品之间的稳定性概况没有显著差异(参见图7)。
实施例14.对于含有曲妥珠单抗和HP46的配制品的蛋白质聚集温度的测量
将动态光散射(DLS)用于分析蛋白质药物领域中归因于热量的蛋白质的变性特性。在本实验中,测量根据温度变化的蛋白质分子大小的变化,并将其用于计算蛋白质聚集温度。对于DLS分析,使用可购自Malvern的Zetasizer-nano-ZS仪器和石英比色杯(ZEN2112)。在分析过程中,以1℃的间隔将温度从25℃升高到85℃,并且使用每种配制缓冲液将样品稀释至1mg/mL,然后将150μL样品添加到比色杯中进行分析。
不含聚山梨酯20的配制品8的聚集温度为78.3℃,配制品9的聚集温度为77.3℃,且配制品10的聚集温度为77.7℃。在实施例13中,尽管不含聚山梨酯20,但蛋白质的单体比率未显示出变化,并且作为比较不含聚山梨酯20的情况与含聚山梨酯20的情况的结果,确认蛋白质之间的聚集没有差异。这些结果表明,曲妥珠单抗的皮下注射配制品不一定需要最小量的聚山梨酯20(参见图8)。
实施例15.含有曲妥珠单抗和HP46的配制品的WCX色谱法分析
对于WCX色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSKgel CM-STAT柱(4.6x 100mm,7μm)、TSKgel保护凝胶CMSTAT(3.2mm内径x 1.5cm)等作为柱。流动相A为10mM磷酸钠(pH 7.5),并且流动相B为含有0.1M NaCl的10mM磷酸钠(pH7.2)。在0-30%流动相B的线性浓度梯度下,以0.8mL/min的流速进行分析持续55分钟。用流动相A稀释样品,使最终浓度为1.0mg/mL,将80μL样品注入HPLC中,然后记录柱洗脱液在280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在40℃下进行14天的稳定性测试中进行WCX分析时,配制品8至10显示出相似的变化模式。具体变化包括酸性变体的相对含量的增加(经14天约10%的变化)、主峰相对含量的减少(经14天约40%的变化)和碱性变体的相对含量的增加(经14天约300%的变化),并且根据配制品,不存在显著差异。总之,在严苛条件下即在40℃下的稳定性测试中的WCX分析中,根据聚山梨酯20(0-0.04%)的蛋白质稳定性是相似的(参见图9)。
实施例16.含有曲妥珠单抗和HP46的配制品的酶活性测量
用于测量酶活性的浊度测定是一种通过吸光度来测量残留透明质酸与酸化白蛋白(BSA)结合的聚集体形成程度的方法,并且当透明质酸被PH20水解时,与白蛋白结合的程度降低,导致吸光度降低。将作为标准化产品的BTH(Sigma)稀释至1单位/mL、2单位/mL、5单位/mL、7.5单位/mL、10单位/mL、15单位/mL、20单位/mL、30单位/mL、50单位/mL和60单位/mL,并在每个试管中制备。将纯化的PH20变体样品用酶稀释缓冲液(20mM Tris·HCl pH7.0、77mM NaCl、0.01%(w/v)牛血清白蛋白)稀释至100X、300X、600X、1200X和2400X,并在每个试管中制备。在新鲜的试管中,将浓度为3mg/mL的透明质酸酶溶液稀释10倍至0.3mg/mL的浓度,以使每个试管的体积变为180μL。将60μL含有透明质酸酶的样品添加至稀释的透明质酸溶液中并与其混合,并且允许在37℃下反应45分钟。反应完成后,将50μL反应的酶和250μL酸性白蛋白溶液添加至96孔板的每个孔中并振荡10分钟,然后使用分光光度计测量600nm处的吸光度。
作为在严苛条件下即在40℃下持续14天的稳定性测试中进行活性分析的结果,证实了聚山梨酯20的浓度越高,活性随时间的降低越大(参见图10)。
实施例17.配制品开发
如表9所示,制备了三种曲妥珠单抗皮下注射配制品。配制品11至13通常含有120mg/mL曲妥珠单抗、20mM组氨酸/组氨酸-HCl(pH 5.5)、210mM海藻糖、10mM蛋氨酸和PH20变体。配制品11-13之间的差异是非离子表面活性剂的浓度,其中配制品11:0%聚山梨酯80,配制品12:0.005%聚山梨酯80,及配制品13:0.04%聚山梨酯80。
表9.配制品组成
当在严苛条件下即在40℃下持续14天的稳定性测试中进行尺寸排阻色谱法分析时,配制品11至13显示出相似的变化模式。主要变化是高分子量(HMW)和低分子量(LMW)降解产物的增加以及单体含量的减少(约小于1.0%),并且根据配制品,不存在显著差异。总之,作为在严苛条件下(即在40℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,根据聚山梨酯80的浓度(0-0.04%),配制品之间的稳定性特征没有显著差异(参见图11)。
实施例18.含有曲妥珠单抗和HP46的配制品的WCX色谱法分析
对于WCX色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSKgel CM-STAT柱(4.6x 100mm,7μm)、TSKgel保护凝胶CMSTAT(3.2mm内径x 1.5cm)等作为柱。流动相A为10mM磷酸钠(pH 7.5),并且流动相B为含有0.1M NaCl的10mM磷酸钠(pH7.2)。在0-30%流动相B的线性浓度梯度下,以0.8mL/min的流速进行分析持续55分钟。用流动相A稀释样品,使最终浓度为1.0mg/mL,将80μL样品注入HPLC中,然后记录柱洗脱液在280nm处的吸光度。计算曲妥珠单抗在HPLC色谱图中的单体比率并作图。
当在严苛条件下即在40℃下持续14天的稳定性测试中进行WCX分析时,配制品11至13显示出相似的变化模式。具体变化包括酸性变体的相对含量的增加(经14天约10%的变化)、主峰相对含量的减少(经14天约40%的变化)和碱性变体的相对含量的增加(经14天约300%的变化),并且根据配制品,不存在显著差异。总之,在严苛条件下即在40℃下的稳定性测试中的WCX分析中,根据聚山梨酯80(0-0.04%)的蛋白质稳定性是相似的(参见图12)。
实施例19.含有曲妥珠单抗和HP46的配制品的酶活性测量
用于测量酶活性的浊度测定是一种通过吸光度来测量残留透明质酸与酸化白蛋白(BSA)结合的聚集体形成程度的方法,并且当透明质酸被PH20水解时,与白蛋白结合的程度降低,导致吸光度降低。将作为标准化产品的BTH(Sigma)稀释至1单位/mL、2单位/mL、5单位/mL、7.5单位/mL、10单位/mL、15单位/mL、20单位/mL、30单位/mL、50单位/mL和60单位/mL,并在每个试管中制备。将纯化的蛋白质样品用酶稀释缓冲液(20mM Tris·HCl pH 7.0、77mM NaCl、0.01%(w/v)牛血清白蛋白)稀释至100X、300X、600X、1200X和2400X,并在每个试管中制备。在新鲜的试管中,将浓度为3mg/mL的透明质酸酶溶液稀释10倍至0.3mg/mL的浓度,以使每个试管的体积变为180μL。将60μL含有透明质酸酶的样品添加至稀释的透明质酸溶液中,与之混合,并且允许在37℃下反应45分钟。反应完成后,将50μL反应的酶和250μL酸性白蛋白溶液添加至96孔板的每个孔中并振荡10分钟,然后使用分光光度计测量600nm处的吸光度。
作为在严苛条件下即在40℃下持续14天的稳定性测试中进行活性分析的结果,证实了聚山梨酯80的浓度越高,活性随时间的降低越大(参见图13)。
实施例20.配制品开发
如表10所述,制备了三种类型的利妥昔单抗配制品。配制品14至16通常包含120mg/mL利妥昔单抗、20mM组氨酸/组氨酸-HCl(pH 5.5)、210mM海藻糖、10mM蛋氨酸和PH20变体。配制品14-16之间的差异是非离子表面活性剂的浓度:配制品14:0%聚山梨酯80,配制品15:0.005%聚山梨酯80,以及配制品16:0.06%聚山梨酯80。
表10.配制品组成
当在严苛条件下即在40℃下持续7天的稳定性测试中进行尺寸排阻色谱法分析时,配制品14至16显示出相似的变化模式。主要变化是高分子量(HMW)和低分子量(LMW)降解产物的增加以及单体含量的减少(小于约1.0%),并且根据配制品没有显著差异。总之,作为在严苛条件下(即在40℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,根据聚山梨酯80的浓度(0-0.06%),配制品之间的稳定性概况没有显著差异(参见图14)。
实施例21.含有利妥昔单抗和HP46的配制品的酶活性的测量
用于测量酶活性的浊度测定是一种通过吸光度来测量残留透明质酸与酸化白蛋白(BSA)结合的聚集体形成程度的方法,并且当透明质酸被PH20水解时,与白蛋白结合的程度降低,导致吸光度降低。将作为标准化产品的BTH(Sigma)稀释至1单位/mL、2单位/mL、5单位/mL、7.5单位/mL、10单位/mL、15单位/mL、20单位/mL、30单位/mL、50单位/mL和60单位/mL,并在每个试管中制备。将纯化的蛋白质样品用酶稀释缓冲液(20mM Tris·HCl pH 7.0、77mM NaCl、0.01%(w/v)牛血清白蛋白)稀释至100X、300X、600X、1200X和2400X,并在每个试管中制备。在新鲜的试管中,将浓度为3mg/mL的透明质酸酶溶液稀释10倍至0.3mg/mL的浓度,以使每个试管的体积变为180μL。将60μL含有透明质酸酶的样品添加至稀释的透明质酸溶液中,与之混合,并且允许在37℃下反应45分钟。反应完成后,将50μL反应的酶和250μL酸性白蛋白溶液添加至96孔板的每个孔中并振荡10分钟,然后使用分光光度计测量600nm处的吸光度。
作为在严苛条件下即在40℃下持续7天的稳定性测试中进行活性分析的结果,证实了聚山梨酯80的浓度越高,活性随时间的降低越大(参见图15)。
实施例22.不含聚山梨酯的可商购产品的配制品中酶活性的测量
如表11所述,制备了两种类型的可商购的利妥昔单抗配制品。配制品17是用于皮下注射配制品的可商购的缓冲液,并且配制品18是用于静脉内注射配制品的可商购的缓冲液。配制品17和18分别含有120mg/mL和100mg/mL的PH20变体和利妥昔单抗,但是与可商购产品的配制品不同,其不含聚山梨酯80。
表11.配制品组成
用于测量酶活性的浊度测定是一种通过吸光度来测量残留透明质酸与酸化白蛋白(BSA)结合的聚集体形成程度的方法,并且当透明质酸被PH20水解时,与白蛋白结合的程度降低,导致吸光度降低。将作为标准化产品的BTH(Sigma)稀释至1单位/mL、2单位/mL、5单位/mL、7.5单位/mL、10单位/mL、15单位/mL、20单位/mL、30单位/mL、50单位/mL和60单位/mL,并在每个试管中制备。将纯化的蛋白质样品用酶稀释缓冲液(20mM Tris·HCl pH 7.0、77mM NaCl、0.01%(w/v)牛血清白蛋白)稀释至100X、300X、600X、1200X和2400X,并在每个试管中制备。在新鲜的试管中,将浓度为3mg/mL的透明质酸酶溶液稀释10倍至0.3mg/mL的浓度,以使每个试管的体积变为180μL。将60μL含有透明质酸酶的样品添加至稀释的透明质酸溶液中,与之混合,并且允许在37℃下反应45分钟。反应完成后,将50μL反应的酶和250μL酸性白蛋白溶液添加至96孔板的每个孔中并振荡10分钟,然后使用分光光度计测量600nm处的吸光度。
作为在严苛条件下(即在40℃下)持续6天的稳定性测试中进行活性分析的结果,证实了甚至在不含聚山梨酯80的配制品中也能维持高活性,并且特别是配制品18维持了高活性(参见图16)。
实施例23:配制品开发
如表12所述,制备了四种类型的派姆单抗配制品。配制品19、20和21通常包含25mg/mL派姆单抗、10mM组氨酸(pH 5.5)、7%蔗糖、10mM蛋氨酸和PH20变体。配制品19-21之间的差异是非离子表面活性剂的浓度:配制品19:0%聚山梨酯80,配制品20:0.005%聚山梨酯80,以及配制品21:0.02%聚山梨酯80。配制品22含有25mg/mL派姆单抗,并且由10mM组氨酸(pH 5.5)、210mM海藻糖、10mM蛋氨酸,0.02%聚山梨酯80和PH20变体组成。
表12.配制品组成
实施例24.使用分光光度计的测量
将配制品19、20、21和22在40℃下放置7天,并使用由贝克曼制造的分光光度计分析蛋白质浓度的变化。用蒸馏水稀释每个样品,使得样品的浓度为0.4mg/mL,然后使用分光光度计测量蛋白质在280nm处的吸光度。
在严苛条件下即在40℃下持续7天的稳定性测试中,配制品19至22的蛋白质浓度没有显著变化。
实施例25.使用尺寸排阻色谱法研究每种配制品中派姆单抗的单体比率
对于尺寸排阻色谱法分析,使用可购自Shimadzu Prominence的HPLC系统,并使用TSK-gel G3000SWXL(7.8X 300mm,5μm)和TSK保护柱(6.0x 4.0mm,7μm)作为柱。使用含0.25M氯化钾的0.2M磷酸钾(pH 6.2)作为流动相。通过以0.5mL/min的流速应用等度分离模式进行分析,持续35分钟。用分析溶剂稀释样品,使最终浓度为10mg/mL,并且在将20μL样品注入HPLC柱中之后,测量柱洗脱液在280nm处的吸光度。计算HPLC色谱图中派姆单抗的单体比率并作图。
当在严苛条件下即在40℃下配制品持续7天的稳定性测试中进行尺寸排阻色谱法分析时,19、20、21和22显示出相似的变化模式。根据配制品,高分子量(HMW)和低分子量(LMW)降解产物的变化模式没有显著差异。总之,作为在严苛条件下(即在40℃下)的稳定性测试中进行尺寸排阻色谱法分析的结果,配制品19、20、21和22均未显示出任何显著差异,并且根据糖的类型也不存在差异(参见图17)。这些结果与根据先前实施例的曲妥珠单抗和利妥昔单抗的情况一致。
实施例26.含有派姆单抗和HP46的配制品的酶活性的测量
用于测量酶活性的浊度测定是一种通过吸光度来测量残留透明质酸与酸化白蛋白(BSA)结合的聚集体形成程度的方法,并且当透明质酸被PH20水解时,与白蛋白结合的程度降低,导致吸光度降低。将作为标准化产品的BTH(Sigma)稀释至1单位/mL、2单位/mL、5单位/mL、7.5单位/mL、10单位/mL、15单位/mL、20单位/mL、30单位/mL、50单位/mL和60单位/mL,并在每个试管中制备。将纯化的蛋白质样品用酶稀释缓冲液(20mM Tris·HCl pH 7.0、77mM NaCl、0.01%(w/v)牛血清白蛋白)稀释至100X、300X、600X、1200X和2400X,并在每个试管中制备。在新鲜的试管中,将浓度为3mg/mL的透明质酸酶溶液稀释10倍至0.3mg/mL的浓度,以使每个试管的体积变为180μL。将60μL含有酶的样品添加至稀释的透明质酸溶液中,与之混合,并且允许在37℃下反应45分钟。反应完成后,将50μL反应的酶和250μL酸性白蛋白溶液添加至96孔板的每个孔中并振荡10分钟,然后使用分光光度计测量600nm处的吸光度。
作为在严苛条件下即在40℃下持续7天的稳定性测试中进行活性分析的结果,证实了随着聚山梨酯80的浓度的增加,活性随时间的降低有所增大。还证实了当包含相同量的聚山梨酯80时,含海藻糖的配制品中的活性降低小于含蔗糖的配制品中的活性降低(参见图18)。
实施例27.HP46和野生型HW2的pH-活性曲线
对于为了确定HP46和野生型HW2的pH-活性曲线而进行的实验,使用了微浊度测定法。对于每个pH,制备用于溶解作为底物的透明质酸的透明质酸缓冲液和用于稀释酶的酶缓冲液。
总共准备三个96孔板用于酶与底物之间的反应,并且命名为A、B和C,并进行了实验。
使用20mM乙酸和70mM NaCl制备pH为4.0、4.5或5.0的透明质酸缓冲液,并且使用20mM磷酸钠和70mM NaCl制备pH为5.5、6.0、6.5、7.0或8.0的透明质酸溶液。将20mg透明质酸溶于10mL的各个制备的透明质酸缓冲液中以制备最终的透明质酸底物溶液,然后将其用根据pH制备的各个透明质酸缓冲液稀释至0.1mg/mL、0.25mg/mL、0.45mg/mL或0.7mg/mL的浓度以制备500μL所得溶液,并将100μL的各个溶液分配到命名为A的96孔板的每个孔中。将根据浓度稀释和制备的透明质酸缓冲液用作测量透明质酸浓度的校正曲线。
使用20mM乙酸、0.01%(w/v)BSA和70mM NaCl制备pH为4.0、4.5或5.0的酶缓冲液,并且使用20mM磷酸钠、0.01%(w/v)BSA和70mM NaCl制备pH为5.5、6.0、6.5、7.0或8.0的酶缓冲液。
将HP46和野生型HW2酶用根据pH制备的酶缓冲液稀释至10单位/mL,然后将50μL所得溶液分配到命名为B的96孔板的每个孔中。
将50μL样品从命名为A的96孔板的每个孔转移到命名为B的96孔板的每个孔中,然后允许在37℃振荡培养箱中反应45分钟。反应完成前15分钟,将200μL酸性白蛋白溶液分配到命名为C的96孔板的每个孔中并进行制备,并且当酶底物反应完成时,将40μL样品从命名为B的96孔板的每个孔转移到命名为C的96孔板的每个孔中,然后允许反应进行20分钟。20分钟后,测量600nm处的吸光度,并计算酶底物反应后残留的透明质酸的量,并且完成了根据pH的酶的活性曲线(参见图19)。
实施例28.在Sprague-Dawley大鼠中使用赫赛汀皮下注射配制品以及曲妥珠单抗和HP46的药代动力学测试
为了检查曲妥珠单抗和HP46的皮下注射配制品是否展现出与赫赛汀皮下注射配制品相同的药代动力学特性,使用9周龄的Sprague-Dawley大鼠进行实验。赫赛汀和曲妥珠单抗的给予剂量为18mg/kg大鼠体重,赫赛汀皮下注射配制品中包含的rHuPH20的量为100U,并且HP46的量也为100U。在药代动力学测试中,曲妥珠单抗和HP46显示出与赫赛汀皮下注射配制品的曲线下面积相同的曲线下面积(AUC)(参见图20)。
【工业实用性】
根据本公开文本的药物组合物可以用于皮下注射并且也非常稳定,并且PH20变体连同药物、优选抗体药物等的活性可以维持很长时间。因此,所述药物组合物不仅可以有助于减少皮下注射配制品的生产成本,而且还可以降低医疗成本,并且就患者的便利性而言非常有效。
尽管已经出于说明性目的公开了本公开文本的优选实施方案,但是本领域技术人员将理解,在不脱离如所附权利要求书中公开的本发明的范围和精神的情况下,可以进行各种修改、添加和替换。
参考文献
Bookbinder,L.H.,Hofer,A.,Haller,M.F.,Zepeda,M.L.,Keller,G.A.,Lim,J.E.,Edgington,T.S.,Shepard,H.M.,Patton,J.S.,and Frost,G.I.(2006).Arecombinant human enzyme for enhanced interstitial transport oftherapeutics.J Control Release 114,230-241.
Borders jr.,C.L.and Raftery,A.(1968)Purification and PartialCharacterization of Testicular Hyaluronidase.J Biol Chem 243,3756-3762
Chao,K.L.,Muthukumar,L.,and Herzberg,O.(2007).Structure of humanhyaluronidase-1,a hyaluronan hydrolyzing enzyme involved in tumor growth andangiogenesis.Biochemistry46,6911-6920.
Chen,K.J.,Sabrina,S.,El-Safory,N.S.,Lee,G.C.,and Lee,C.K.(2016)Constitutive expression of recombinant human hyaluronidase PH20 by Pichiapastoris.J Biosci Bioeng.122,673-678
Frost,G.I.(2007).Recombinant human hyaluronidase(rHuPH20):an enablingplatform for subcutaneous drug and fluid administration.Expert Opin DrugDeliv 4,427-440
Hofinger,E.S.,Bernhardt,G.,and Buschauer,A.(2007)Kinetics of Hyal-1and PH-20hyaluronidases:comparison of minimal substrates and analysis of thetransglycosylation reaction.Glycobiology 17,963-971
Kreidieh,F.Y.,Moukadem,H.A.,and Saghir,N.S.E.(2016)Overview,prevention and management of chemotherapy extravasation.World J Clin Oncol 7,87-97.
Thomas,J.R.,Yocum,R.C.,Haller,M.F.,and Flament J.(2009)The INFUSE-Morphine IIB Study:Use of Recombinant Human Hyaluronidase(rHuPH20)to Enhancethe Absorption of Subcutaneous Morphine in Healthy Volunteers.J Pain SymptomManag 38,673-682
文本文件
参见所附序列表
更具体地,本申请提供下列示例性的各项:
1.一种药物组合物,其包含:
药物;和
PH20变体,
其中所述PH20变体包含具有SEQ ID NO:1序列的野生型PH20中的选自S343E、M345T、K349E、L353A、L354I、N356E和I361T的一个或多个氨基酸残基取代。
2.根据项1所述的药物组合物,其中所述PH20变体包含选自L354I和N356E的一个或多个氨基酸残基取代。
3.根据项1所述的药物组合物,其中所述PH20变体进一步包含选自α螺旋区和对应于SEQ ID NO:1的野生型PH20的其接头区的区域的一个或多个区域中的一个或多个氨基酸残基取代。
4.根据项3所述的药物组合物,其中SEQ ID NO:1的野生型PH20的α螺旋区是α-螺旋8区(S347至C381),并且所述接头区是在α-螺旋7与α-螺旋8之间的接头区(A333至R346)。
5.根据项4所述的药物组合物,其中所述α-螺旋区和对应于其接头区的区域是SEQID NO:1的野生型PH20的T341至N363、T341至I361、L342至I361、S343至I361、I344至I361、M345至I361或M345至N363。
6.根据项4所述的药物组合物,其中选自SEQ ID NO:1的野生型PH20的α-螺旋8区(S347至C381)和在α-螺旋7与α-螺旋8之间的接头区(A333至R346)的一个或多个区域被Hyal1的相应区域的氨基酸序列的一个或多个氨基酸残基取代。
7.根据项1所述的药物组合物,其中所述PH20变体包含L354I和/或N356E的一个或多个氨基酸残基取代,并且进一步包含选自T341、L342、S343、I344、M345、S347、M348、K349、L352、L353、D355、E359、I361和N363的一个或多个位置处的一个或多个氨基酸残基取代。
8.根据项7所述的药物组合物,其中所述PH20变体包含L354I和/或N356E的一个或多个氨基酸残基取代,并且进一步包含选自由T341S、L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、D355K、E359D、I361T和N363G的一个或多个氨基酸残基取代。
9.根据项7所述的药物组合物,其中所述PH20变体包含M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T的氨基酸残基取代。
10.根据项9所述的药物组合物,其中所述PH20变体进一步包含选自T341S、L342W、S343E、I344N和N363G的一个或多个氨基酸残基取代。
11.根据项10所述的药物组合物,其中所述PH20变体包含选自以下组的任何一个氨基酸残基取代:
T341S、L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
L342W、S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;
M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D、I361T和N363G;
I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T;以及
S343E、I344N、M345T、S347T、M348K、K349E、L352Q、L353A、L354I、D355K、N356E、E359D和I361T。
12.根据项1至11中任一项所述的药物组合物,其中所述PH20变体进一步包含C末端和N末端的至少一个中的一个或多个氨基酸残基的缺失。
13.根据项12所述的药物组合物,其中在所述PH20变体中,一个或多个氨基酸残基通过在所述N末端处的选自M1至P42的氨基酸残基之前切割而缺失。
14.根据项13所述的药物组合物,其中在所述PH20变体中,一个或多个氨基酸残基通过在所述N末端处的氨基酸残基L36、N37、F38、R39、A40、P41或P42之前切割而缺失。
15.根据项12所述的药物组合物,其中在所述PH20变体中,一个或多个氨基酸残基通过在所述C末端的选自V455至L509的氨基酸残基之后切割而缺失。
16.根据项15所述的药物组合物,其中在所述PH20变体中,一个或多个氨基酸残基通过在所述C末端处的选自V455至S490的氨基酸残基之后切割而缺失。
17.根据项16所述的药物组合物,其中在所述PH20变体中,一个或多个氨基酸残基通过在所述C末端处的氨基酸残基V455、C458、D461、C464、I465、D466、A467、F468、K470、P471、P472、M473、E474、T475、E476、P478、I480、Y482、A484、P486、T488或S490之后切割而缺失。
18.根据项1至17中任一项所述的药物组合物,其中所述PH20变体在所述N末端进一步包含源自人透明质酸酶-1(Hyal1)、人生长激素或人血清白蛋白的信号肽。
19.根据项1至11中任一项所述的药物组合物,其中所述PH20变体具有选自氨基酸序列SEQ ID NO:5至SEQ ID NO:50的氨基酸序列。
20.根据项19所述的药物组合物,其中所述PH20变体具有SEQ ID NO:44的序列。
21.根据项1所述的药物组合物,其中所述药物是蛋白质药物、抗体、小分子、适体、RNAi、反义物或细胞治疗剂。
22.根据项21所述的药物组合物,其中所述药物是抗体、可溶性受体或其Fc融合蛋白。
23.根据项22所述的药物组合物,其中所述抗体与选自以下的一种或多种抗原结合:4-1BB、整联蛋白、β淀粉样蛋白、血管生成素、血管生成素类似物3、B细胞活化因子(BAFF)、B7-H3、补体5、CCR4、CD3、CD4、CD6、CD11a、CD19、CD20、CD22、CD30、CD33、CD38、CD52、CD62、CD79b、CD80、CGRP、紧密连接蛋白-18、补体因子D、CTLA4、DLL3、EGF受体、血友病因子、Fc受体、FGF23、叶酸受体、GD2、GM-CSF、HER2、HER3、干扰素受体、干扰素γ、IgE、IGF-1受体、白介素1、白介素2受体、白介素4受体、白介素5、白介素5受体、白介素6、白介素6受体、白介素7、白介素12/23、白介素13、白介素17A、白介素17受体A、白介素31受体、白介素36受体、LAG3、LFA3、NGF、PVSK9、PD-1、PD-L1、RANK-L、SLAMF7、组织因子、TNF、VEGF和vWF。
24.根据项22所述的药物组合物,其中所述抗体是选自以下的一种或多种:乌托鲁单抗、那他珠单抗、埃特罗珠单抗、维多珠单抗、比格鲁玛单抗、巴匹珠单抗、克雷内治单抗、索拉珠单抗、阿杜卡尼单抗、甘特珠单抗、AMG 780、MEDI 3617、奈斯卡单抗、万古珠单抗、依伐单抗、他贝芦单抗、拉那鲁单抗、贝利木单抗、奥博妥单抗、雷夫利珠单抗、依库丽单抗、莫利珠单抗、奥昔珠单抗、替利珠单抗、莫罗单抗、tebentafusp、博纳吐单抗、REGN1979、依巴珠单抗、扎木单抗、伊曲珠单抗、依法利珠单抗、英比利珠单抗、他法西他单抗、替朗妥昔单抗、奥瑞珠单抗、乌妥昔单抗、奥比妥珠单抗、奥法木单抗、利妥昔单抗、托西莫单抗、替伊莫单抗、依帕珠单抗、奥英妥珠单抗、帕西妥莫单抗、本妥昔单抗、他立林-伐达妥昔单抗、奥唑米星-吉妥珠单抗、达雷木单抗、伊沙妥昔单抗、阿仑单抗、立赞利珠单抗、泊洛妥珠单抗、加利昔单抗、依普奈珠单抗、夫瑞奈组单抗、加卡珠单抗、厄恩诺单抗、佐洛昔单抗、兰帕单抗、曲美目单抗、泽弗利单抗、伊匹单抗、罗伐普妥单抗、西妥昔单抗、达妥昔单抗、扎鲁木单抗、耐昔妥珠单抗、帕尼单抗、艾米珠单抗、尼泊卡利单抗、洛利昔珠单抗、布罗沙单抗、法鲁珠单抗、索星-米妥昔单抗、达妥昔单抗、那昔妥单抗、奥替利单抗、马格妥昔单抗、帕妥珠单抗、曲妥珠单抗、曲妥珠单抗-德鲁替康、曲妥珠单抗-美坦新、曲妥珠单抗-杜卡马嗪、帕曲妥单抗、阿尼富路单抗、依帕伐单抗、利戈组单抗、奥马珠单抗、达洛珠单抗、芬妥木单抗、替妥木单抗、吉伏珠单抗、康纳单抗、达克珠单抗、巴利昔单抗、度匹鲁单抗、美泊珠单抗、瑞舒单抗、贝那利珠单抗、克拉吉珠单抗、奥洛吉珠单抗、司卢库单抗、司妥昔单抗、萨瑞鲁单抗、沙特拉珠单抗、托珠单抗、REGN88、苏金单抗、优特克单抗、布雷奴单抗、乐比瑞克单抗、曲罗芦单抗、依奇珠单抗、比美珠单抗、布罗达单抗、布拉兹库单抗、古塞库单抗、利散吉珠单抗、替曲吉珠单抗、米吉珠单抗、奈莫珠单抗、佩索利单抗、瑞拉利单抗、纳索匹单抗、法西单抗、他尼珠单抗、阿利库单抗、依伏库单抗、伯考赛珠单抗、帕博利珠单抗、巴斯替利单抗、卡瑞利珠单抗、西米普利单抗、多塔利单抗、帕洛利单抗、西地单抗、斯巴达珠单抗、替雷利珠单抗、派姆单抗、纳武单抗、阿特珠单抗、阿维鲁单抗、恩沃利单抗、度伐单抗、bintrafuspα、地诺单抗、艾洛珠单抗、康昔单抗、马斯塔单抗、英夫利昔单抗、阿达木单抗、戈利木单抗、赛妥珠单抗、奥利组单抗、布洛赛珠单抗、兰尼单抗、贝伐单抗、法瑞慈单抗、雷莫芦单抗和卡普赛珠单抗。
25.根据项22所述的药物组合物,其中所述可溶性受体或在所述可溶性受体的Fc融合蛋白中包含的可溶性受体选自TNF-α可溶性受体、VEGF可溶性受体、CTLA-4、白介素1可溶性受体和LFA3可溶性受体。
26.根据项25所述的药物组合物,其中所述可溶性受体的Fc融合蛋白选自依那西普、阿柏西普、阿巴西普、贝拉西普、利纳西普和阿来西普。
27.根据项1所述的药物组合物,其中进一步包含选自缓冲液、稳定剂和表面活性剂的一种或多种。
28.根据项27所述的药物组合物,其中所述缓冲液包括选自以下的一种或多种:苹果酸盐、甲酸盐、柠檬酸盐、乙酸盐、丙酸盐、吡啶、哌嗪、卡可酸盐、琥珀酸盐、2-(N-吗啉代)乙磺酸(MES)、组氨酸、Tris、bis-Tris、磷酸盐、乙醇胺、碳酸盐、哌嗪-N,N'-双(2-乙磺酸)(PIPES)、咪唑、BIS-TRIS丙烷、N,N-双(2-羟乙基)-2-氨基乙磺酸(BES)、3-(N-吗啉代)丙磺酸)(MOPS)、羟乙基哌嗪乙磺酸(HEPES)、焦磷酸盐和三乙醇胺;
所述稳定剂包括选自以下的一种或多种:碳水化合物、糖或其水合物、糖醇或其水合物和氨基酸;并且
所述表面活性剂包括选自以下的一种或多种非离子表面活性剂:聚氧乙烯-脱水山梨糖醇脂肪酸酯、聚乙烯-聚丙二醇、聚氧乙烯-硬脂酸酯、聚氧乙烯烷基醚、聚氧乙烯-聚氧丙烯共聚物和十二烷基硫酸钠(SDS)。
29.根据项28所述的药物组合物,其中所述碳水化合物、所述糖或所述糖醇包括选自以下的一种或多种:海藻糖或其水合物、蔗糖、糖精、甘油、赤藓糖醇、苏糖醇、木糖醇、阿拉伯糖醇、核糖醇、甘露糖醇、山梨糖醇、半乳糖醇、岩藻糖醇、艾杜糖醇、肌醇、庚七醇、异麦芽酮糖、麦芽糖醇、聚葡糖醇、环糊精、羟丙基环糊精和葡萄糖,并且
所述氨基酸包括选自以下的一种或多种:谷氨酰胺、谷氨酸、甘氨酸、赖氨酸、赖氨酸、亮氨酸、蛋氨酸、缬氨酸、丝氨酸、硒代蛋氨酸、瓜氨酸、精氨酸、天冬酰胺、天冬氨酸、鸟氨酸、异亮氨酸、牛磺酸、茶氨酸、苏氨酸、色氨酸、酪氨酸、苯丙氨酸、脯氨酸、吡咯赖氨酸、组氨酸和丙氨酸。
30.根据项27所述的药物组合物,其中所述药物组合物包含提供5.5±2.0的pH的组氨酸缓冲液、海藻糖和蛋氨酸。
31.根据项27所述的药物组合物,其中所述药物组合物包含提供5.5±2.0的pH的组氨酸缓冲液、海藻糖、蛋氨酸和聚山梨酯。
32.根据项31所述的药物组合物,其中所述药物组合物包含提供5.5±2.0的pH的组氨酸缓冲液、10-400mMα,α-海藻糖、1-50mM蛋氨酸和0.0000001%(w/v)至0.5%(w/v)的聚山梨酯。
33.一种用于皮下注射的注射配制品,所述注射配制品包含根据项1至32中任一项所述的药物组合物。
- 一种取代的含硼的化合物及包含该化合物的药物组合物
- 包含药物组合物的片剂或胶囊剂
- 包含药物组合物的片剂或胶囊剂
- 用于皮下注射的包含人透明质酸酶PH20变体和药物的药物组合物
- 一种用于药物皮下注射制剂的透明质酸酶突变体
