用于调节TGF-B信号传导的细胞疗法组合物和方法
文献发布时间:2024-04-18 19:58:21
相关申请的交叉引用
本申请要求于2021年2月15日提交的美国临时申请第63/149,628号和于2022年2月04日提交的美国临时申请第63/306,836号的优先权,所述临时申请中每一者的公开内容特此通过引用整体并入。
背景技术
使用靶向癌症特定抗原的工程化细胞的免疫疗法已在一些癌症的治疗中显示功效。然而,恶性细胞会适应生成免疫抑制微环境来保护其免于免疫识别和消除。肿瘤微环境中的高TGFβ水平会促进一些类型的癌细胞的维持和进展。肿瘤微环境对于涉及刺激免疫反应的治疗方法造成重大挑战,例如靶向细胞疗法的情况下。因此,需要用于治疗癌症的新颖治疗策略。
发明内容
本发明尤其提供了一种供使用于治疗癌症(例如,实体瘤)的调节TGFβ信号传导的新颖系统。本发明部分基于以下发现:调节转化生长因子β(TGF-β)信号传导可增强过继性细胞治疗方法,例如靶向工程化嵌合抗原受体(CAR)疗法。调节TGF-β信号传导,例如受本文所述的抗体系统(例如抗TGFβ或抗TGFβR)、TGF-βR2的抗原结合片段或重组胞外结构域所影响,会减轻肿瘤中的免疫抑制微环境并增强免疫疗法的功效。
基于T细胞的免疫疗法已成为合成生物学的新前沿;多重启动子和基因产物经设计为使这些高效细胞转向肿瘤微环境,其中T细胞可避开负面的调节信号并介导有效肿瘤杀伤。通过用AP1903对诱导型半胱天冬酶9(caspase 9)进行药物诱导二聚可消除不需要的T细胞,表明一种可以药理学方式启动控制T细胞群体的强力开关的方法(Di Stasi A等人,N Engl J Med.2011;365(18):1673-83)。因此,虽然CAR呈现出可以类似于内源性T细胞受体的方式触发T细胞活化,但迄今为止,此技术的临床应用的主要阻碍在于CAR+T细胞的体内扩增有限,在输注后细胞快速消失,并且临床活性令人失望。因此,本领域中迫切需要发现使用可表现出特异性且有效的抗肿瘤作用而没有不期望的作用(即高毒性、功效不足)的方式来治疗癌症的新颖组合物和方法。
本发明通过提供包含CAR和表达于免疫细胞(例如T细胞)中的TGFβ信号通路调节剂的免疫调节系统来解决这些需求。包含所述免疫调节系统的组合物和治疗方法可用于治疗癌症和其他疾病和/或疾患。特别是,本发明提供了表达装甲化CAR的工程化免疫细胞,其可用于治疗与TGFβ的表达失调相关的疾病、病症或疾患(例如癌症、实体瘤)。共表达TGFβ调节剂的装甲化CAR T细胞表现出CAR在经转导的T细胞上的高度表面表达,和癌细胞的增强的细胞溶解。因此,本发明提供了使用包含调节TGF-b信号传导的多肽的免疫调节系统(例如,工程化CAR T细胞)来增强对于癌症和病原体的免疫反应的方法和组合物。
本发明部分地提供了包含TGFβ信号通路调节剂的改进型CAR多肽、编码此类多肽的核酸分子、经基因修饰以表达所述改进型CAR的细胞(例如T细胞),以及在治疗癌症(例如,实体瘤癌症)的过继性细胞疗法中使用所述经修饰细胞的方法。
在一些实施方案中,本发明提供了经修饰以表达TGFβ信号通路调节剂(在本文中也称为“TGFβ装甲化CAR-T细胞”)的CAR-T细胞,使得在向有需要的受试者施用时,所述细胞在相对于不表达TGFβ信号通路调节剂的CAR-T细胞(在本文中也称为“未装甲化CAR-T细胞”)下能够在所述受试者中引起免疫反应。
在一些方面,本发明提供了带有抗原受体的免疫反应性细胞(例如T细胞),所述抗原受体可为嵌合抗原受体(CAR),并且其包括调节TGF-b信号传导的多肽。这些工程化的免疫反应性细胞(例如CAR-T细胞)是针对抗原的并且可抵抗免疫抑制和/或具有增强的免疫活化特性。
在一个方面,本发明提供了一种基因工程T细胞群体,其包含识别癌症相关抗原的嵌合抗原受体(CAR)和TGFβ信号通路调节剂。
在一些实施方案中,所述细胞群体包含识别选自由以下组成的组的抗原的CAR:ADGRE2、CLEC12、CAIX、CEA、CD5、CD7、CD10、CD19、CD20、CD22、CD30、CD33、CD34、CD38、CD41、CD44、CD49f、CD56、CD74、CD133、CD138、巨细胞病毒(CMV)感染细胞抗原、CEACAM 5、紧密连接蛋白(Claudin)18.2、EGP-2、EGP-40、EpCAM、erb-B2,3,4、FBP、胎儿乙酰胆碱受体、叶酸受体-a、GCC(也称为GUCY2C)、GD2、GD3、HER-2、hTERT、IL-13R-a2、x-轻链、KDR、LeY、LI细胞粘附分子、MAGE-AI、MUC1、MUC13、间皮素、NKG2D配体、NY-ES0-1、肿瘤胚胎抗原(h5T4)、PSCA、PSMA、PTK7、ROR1、TAG-72、TROP2、VEGF-R2和WT-1。
在一些实施方案中,所述细胞群体包含CD19 CAR或GCC CAR。
在一些实施方案中,所述细胞群体包含与TGFβ或TGFβ受体结合的TGFβ信号通路调节剂。
在一些实施方案中,所述细胞群体包含有包含选自表1的氨基酸序列的TGFβ信号通路调节剂。
在一些实施方案中,所述细胞群体是自体的。
在一些实施方案中,所述细胞群体是同种异体的。
在一些实施方案中,所述细胞群体是原代细胞。在一些实施方案中,所述细胞群体衍生自诱导性多能干细胞(iPSC)。
在一些实施方案中,所述细胞群体是使用包含编码CAR多肽的第一核酸和编码TGFβ信号通路调节剂的第二核酸的载体进行基因修饰。
在一些实施方案中,所述细胞群体是使用两种载体进行基因修饰,第一载体包含编码CAR多肽的核酸,而第二载体包含编码TGFβ信号通路调节剂的核酸。
在一些实施方案中,所述细胞群体是使用Crispr进行基因修饰。在一些实施方案中,所述细胞群体是使用反转录病毒转导(包括g-反转录病毒)、慢病毒转导、转位子和转位酶(Sleeping Beauty和PiggyBac系统)、信使RNA转移介导的基因表达、基因编辑(基因插入或基因删除/破坏)、CRISPR-Cas9、ZFN(锌指核酸酶)、或TALEN(转录激活因子样效应物核酸酶)系统进行基因修饰。
在一些实施方案中,所述细胞群体包含有包含选自由以下组成的组的细胞内信号传导结构域的CAR:CD3ζ-链、CD97、2B4、GDI la-CD18、CD2、ICOS、CD27、CD154、CDS、OX40、4-1BB、DAP10、DAP12、CD28信号传导结构域、或其组合和变化。
在一些实施方案中,所述细胞群体包含有包含跨膜结构域的CAR,所述跨膜结构域衍生自选自由以下组成的组的跨膜结构域:CD3、CD8、CD28、OX40、CD27、4-1BB、DAP10、DAP12或其组合。
在一个方面,本发明提供了一种载体,所述载体包含编码CAR多肽的第一核酸和编码TGFβ信号通路调节剂的第二核酸。
在一些实施方案中,所述包含编码CAR多肽的第一核酸和编码TGFβ信号通路调节剂的第二核酸的载体包含内部核糖体进入位点。
在一些实施方案中,所述载体还包含2A核糖体序列。
在一个方面,本发明提供了一种用载体修饰的免疫细胞,所述载体包含编码CAR多肽的第一核酸和编码TGFβ信号通路调节剂的第二核酸。
在一些实施方案中,所述免疫细胞为T细胞。
在一个方面,本发明提供了一种调节宿主中的免疫反应的方法,所述方法包括向所述宿主施用基因工程T细胞群体,所述细胞群体包含识别癌症相关抗原的嵌合抗原受体(CAR)和TGFβ信号通路调节剂,其中免疫反应的调节包含通过宿主免疫细胞进行以下中的一者或多者:增加IFNγ产生;增加IL-2产生;增加抗原呈递;以及增加增殖。
在一个方面,本发明提供了一种包含基因工程T细胞群体的药物组合物,所述细胞群体包含识别癌症相关抗原的嵌合抗原受体(CAR)和TGFβ信号通路调节剂。
在一个方面,本发明提供了一种在有需要的受试者中治疗或预防癌症的方法,所述方法包括向所述受试者施用有效量的基因工程T细胞群体,所述细胞群体包含识别癌症相关抗原的嵌合抗原受体(CAR)和TGFβ信号通路调节剂。
在一些实施方案中,所述癌症选自由以下组成的组:白血病、急性白血病、急性淋巴细胞性白血病、急性髓细胞白血病、急性髓母细胞性白血病、急性早幼粒细胞白血病、急性髓单核细胞白血病、急性单核细胞白血病、急性红白血病、慢性白血病、慢性髓细胞白血病、多发性骨髓瘤、慢性淋巴细胞性白血病、真性红细胞增多症、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、华氏巨球蛋白血症(Waldenstrom's macroglobulinemia)、重链病、实体瘤、肉瘤、癌瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨源性肉瘤、索脊瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文氏瘤(Ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管源性癌、肾细胞癌、肝细胞瘤、肝细胞癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、威尔姆氏瘤(Wilm's tumor)、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、结直肠癌、上皮癌、神经胶质瘤、星状细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤、视网膜母细胞瘤和其转移瘤。
在一个方面,本发明提供了一种免疫调节系统,其包含编码嵌合抗原受体(CAR)的核酸序列;和编码调节TGF-b信号传导的多肽(例如,TGFβ信号传导调节剂)的核酸序列。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含可变重链(vH)。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含可变重链(vH)和可变轻链(vL)。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含选自由以下组成的组的抗原结合分子:IgA抗体、IgG抗体、IgE抗体、IgM抗体、双特异性或多特异性抗体、Fab片段、Fab'片段、F(ab')2片段、Fd'片段、Fd片段、经分离的CDR或其集合;单链可变片段(scFv)、多肽-Fc融合物、单域抗体(sdAb)、骆驼源化抗体;掩蔽抗体、小型模块免疫药物(“SMIPsTM”)、单链、串联双价抗体、VHH、抗运载蛋白(Anticalin)、纳米抗体、人源化抗体(humabody)、微型抗体、BiTE、锚蛋白(ankyrin)重复蛋白、DARPIN、Avimer、DART、TCR样抗体、Adnectin、Affilin、穿透抗体(Trans-body);亲和抗体(Affibody)、TrimerX、微型蛋白、Fynomer、Centyrin;以及KALBITOR,或其片段。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含单链可变片段(scFv)。在一些实施方案中,所述调节TGF-b信号传导的多肽包含单域抗体(sdAb)。在一些实施方案中,所述调节TGF-b信号传导的多肽包含仅重链抗体。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含选自表1的氨基酸序列。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含二聚体抗原结合剂。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b结合。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b受体结合。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b受体2(TGF-bR2)结合。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含TGF-b受体2(TGF-bR2)或其片段。
在一些实施方案中,所述调节TGF-b信号传导的多肽包含TGF-bR2(TGF-bR2)的胞外结构域。
在一些实施方案中,所述CAR与选自由以下组成的组的抗原结合:ADGRE2、CLEC12、CAIX、CEA、CD5、CD7、CD10、CD19、CD20、CD22、CD30、CD33、CD34、CD38、CD41、CD44、CD49f、CD56、CD74、CD133、CD138、巨细胞病毒(CMV)感染细胞抗原、CEACAM 5、紧密连接蛋白18.2、EGP-2、EGP-40、EpCAM、erb-B2,3,4、FBP、胎儿乙酰胆碱受体、叶酸受体-a、GCC(也称为GUCY2C)、GD2、GD3、HER-2、hTERT、IL-13R-a2、x-轻链、KDR、LeY、LI细胞粘附分子、MAGE-AI、MUC1、MUC13、间皮素、NKG2D配体、NY-ES0-1、肿瘤胚胎抗原(h5T4)、PSCA、PSMA、PTK7、ROR1、TAG-72、TROP2、VEGF-R2和WT-1。
在一些实施方案中,所述CAR与CD19或GCC结合。
在一些实施方案中,所述CAR包括选自由以下组成的组的细胞内信号传导结构域:CD3ζ-链、CD97、2B4、GDI la-CD18、CD2、ICOS、CD27、CD154、CDS、OX40、4-1BB、DAP10、DAP12、CD28信号传导结构域、或其组合和变化。
根据前述权利要求中任一项所述的免疫调节系统,其中所述CAR包含跨膜结构域,所述跨膜结构域衍生自选自由以下组成的组的跨膜结构域:CD3、CD8、CD28、OX40、CD27、4-1BB、DAP10、DAP12或其组合。
在某些实施方案中,所述经修饰的CD3z多肽缺乏全部或部分的免疫受体酪氨酸基活化基序(ITAM),其中所述ITAM为ITAM1、ITAM2和ITAM3。在某些实施方案中,所述经修饰的CD3z多肽进一步缺乏全部或部分的富碱性延伸(BRS)区,其中所述BRS区为BRS1、BRS2和BRS3。
在一个方面,本发明提供了一种包含本文所述的免疫调节系统的核酸,其中编码嵌合抗原受体(CAR)的序列以及编码调节TGF-b信号传导的多肽的序列存在于单一构建体上。
在一些实施方案中,编码嵌合抗原受体(CAR)的序列以及编码调节TGF-b信号传导的多肽的序列存在于不同的构建体上。
在一个方面,本发明提供了一种包含编码本文所述的免疫调节系统的核酸的载体。
在一些实施方案中,所述载体包含内部核糖体进入位点(IRES)。
在一些实施方案中,所述载体包含2A核糖体序列。在一些实施方案中,所述2A核糖体序列为P2A或T2A。
在一个方面,本发明提供了一种包含本文所述的免疫调节系统的免疫反应性细胞。
在一个方面,本发明提供了一种免疫反应性细胞,其包含:对于肿瘤相关抗原或应激配体具特异性的靶向剂,以及编码调节TGF-b信号传导的重组多肽的核酸。
在一些实施方案中,所述靶向剂与选自由以下组成的组的应激配体特异性结合:MIC-A、MIC-B、ULBP1-6;
在一个方面,本发明提供了一种免疫反应性细胞,其包含:嵌合抗原受体(CAR);以及编码调节TGF-b信号传导的重组多肽的核酸。
在一些实施方案中,所述CAR和所述编码调节TGF-b信号传导的多肽的核酸设在相同的多核苷酸上。
在一些实施方案中,所述CAR和所述编码调节TGF-b信号传导的多肽的核酸设在分开的多核苷酸上。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽是由所述细胞分泌。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含可变重链(vH)。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含可变重链(vH)和可变轻链(vL)。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含单链可变片段(scFv)。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含二聚体抗原结合剂。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b结合。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含TGF-b受体2(TGF-bR2)或其片段。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽包含TGF-bR2的胞外结构域。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b受体结合。
在一些实施方案中,所述调节TGF-b信号传导的多肽与TGF-b受体2(TGF-bR2)结合。
在一些实施方案中,所述免疫反应性细胞包含由载体、工程化mRNA表达,或整合至宿主细胞染色体中的CAR。在一些实施方案中,所述编码CAR的序列使用核酸内切酶整合至宿主细胞染色体中。在一些实施方案中,所述编码CAR的序列使用Crispr/Cas9、Cas12a或Cas13整合至宿主细胞染色体中。
在一些实施方案中,所述免疫反应性细胞包含调节TGF-b信号传导的重组多肽,其从载体、工程化mRNA表达或整合至宿主细胞染色体中。在一些实施方案中,所述编码调节TGF-b信号传导的多肽的序列使用Crispr/Cas9、Cas12a或Cas13整合至宿主细胞染色体中。
在一些实施方案中,所述免疫反应性细胞选自由以下组成的组:T细胞、自然杀手(NK)细胞、自然杀手(NK)T细胞、γδT细胞、细胞毒性T淋巴细胞(CTL)、调节性T细胞、人类胚胎干细胞、B细胞、巨噬细胞、以及可以从中分化出淋巴样细胞的多能干细胞(例如,衍生自iPSC的NK或T细胞)。
在一些实施方案中,所述免疫反应性细胞为工程化自体细胞。在一些实施方案中,所述免疫反应性细胞为工程化同种异体细胞。
在一些实施方案中,所述免疫反应性细胞包含与选自由以下组成的组的肿瘤抗原结合的CAR:ADGRE2、CLEC12、CAIX、CEA、CD5、CD7、CD10、CD19、CD20、CD22、CD30、CD33、CD34、CD38、CD41、CD44、CD49f、CD56、CD74、CD133、CD138、巨细胞病毒(CMV)感染细胞抗原、CEACAM5、紧密连接蛋白18.2、EGP-2、EGP-40、EpCAM、erb-B2,3,4、FBP、胎儿乙酰胆碱受体、叶酸受体-a、GCC(也称为GUCY2C)、GD2、GD3、HER-2、hTERT、IL-13R-a2、x-轻链、KDR、LeY、LI细胞粘附分子、MAGE-AI、MUC1、MUC13、间皮素、NKG2D配体、NY-ES0-1、肿瘤胚胎抗原(h5T4)、PSCA、PSMA、PTK7、ROR1、TAG-72、TROP2、VEGF-R2和WT-1。
在一些实施方案中,所述CAR与CD19或GCC结合。在一些实施方案中,所述CAR与GCC结合。
在一些实施方案中,所述CAR包括衍生自以下各者的细胞内信号传导结构域:CD3ζ、CD97、2B4、GDI la-CD18、CD2、ICOS、CD27、CD154、CDS、OX40、4-1BB、DAP10、DAP12、CD28信号传导结构域、或其组合和变化。
在一些实施方案中,所述CAR包含跨膜结构域,所述跨膜结构域衍生自选自由以下组成的组的跨膜结构域:CD3、CD8、CD28、OX40、CD27、4-1BB、DAP10、DAP12或其组合。
在某些实施方案中,所述经修饰的CD3z多肽缺乏全部或部分的免疫受体酪氨酸基活化基序(ITAM),其中所述ITAM为ITAM1、ITAM2和ITAM3。在某些实施方案中,所述经修饰的CD3z多肽进一步缺乏全部或部分的富碱性延伸(BRS)区,其中所述BRS区为BRS1、BRS2和BRS3。
在一些实施方案中,免疫反应性细胞包含嵌合共刺激受体(CCR)。在一些实施方案中,所述CAR包含共刺激结构域。在一些实施方案中,所述CAR不包含细胞内信号传导结构域。在一些实施方案中,所述CAR不包含CD3z结构域。
在一些实施方案中,所述调节TGF-b信号传导的重组多肽增强免疫反应性细胞的免疫反应。
在一个方面,本发明提供了一种包含有效量的本文所述免疫调节系统的药物组合物。
在一个方面,本发明提供了一种包含有效量的编码本文所述免疫调节系统的核酸序列的药物组合物。
在一个方面,本发明提供了一种包含有效量的编码本文所述免疫调节系统的载体的药物组合物。
在一个方面,本发明提供了一种包含有效量的本文所述免疫反应性细胞的药物组合物。
在一些实施方案中,所述药物组合物还包含药学上可接受的赋形剂。
在一个方面,本发明提供了一种用于治疗癌症的药盒,所述药盒包含有包含嵌合抗原受体(CAR)的免疫反应性细胞;以及编码调节TGF-b信号传导的重组多肽的核酸。
在一些实施方案中,所述药盒包含编码本文所述免疫调节系统的核酸或载体。
在一个方面,本发明提供了一种在受试者中治疗或预防癌症或其转移的方法,所述方法包括施用有效量的包含嵌合抗原受体(CAR)的免疫反应性细胞;以及编码调节TGF-b信号传导的重组多肽的核酸。
在一些实施方案中,本文所述的组合物可用于治疗造血性癌症。在其他实施方案中,本文所述的组合物可用于治疗实体瘤癌症。
在一些实施方案中,所述癌症选自由以下组成的组:白血病、急性白血病、急性淋巴细胞性白血病、急性髓细胞白血病、急性髓母细胞性白血病、急性早幼粒细胞白血病、急性髓单核细胞白血病、急性单核细胞白血病、急性红白血病、慢性白血病、慢性髓细胞白血病、多发性骨髓瘤、慢性淋巴细胞性白血病、真性红细胞增多症、淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、华氏巨球蛋白血症、重链病、实体瘤、肉瘤、癌瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨源性肉瘤、索脊瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管源性癌、肾细胞癌、肝细胞瘤、肝细胞癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、威尔姆氏瘤、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、结直肠癌、上皮癌、神经胶质瘤、星状细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤。
在一些实施方案中,所述方法还包括向所述受试者施用第二治疗剂。
在一些实施方案中,所述第二治疗剂以全身性方式施用于所述受试者。
在一些实施方案中,所述第二治疗剂与CAR和编码调节TGF-b信号传导的重组多肽的核酸分开施用
在一些实施方案中,所述第二治疗剂靶向PD1/PD-L1、CXCR2和/或IL-15。
在一些实施方案中,所述第二治疗剂为PD1/PD-L1抑制剂。
在一个方面,本发明提供了一种调节免疫细胞活性的方法,所述方法包括施用编码嵌合抗原受体(CAR)的核酸;以及编码调节TGF-b信号传导的重组多肽的核酸。
在一个方面,本发明提供了一种调节嵌合抗原受体(CAR)的活性的方法,所述方法包括施用编码嵌合抗原受体(CAR)的核酸;以及编码调节TGF-b信号传导的重组多肽的核酸。
在一个方面,本发明提供了一种降低受试者中的肿瘤负荷的方法,所述方法包括施用有效量的包含本文所述核酸、载体或免疫反应性细胞的免疫调节系统。
在一些实施方案中,所述方法降低了肿瘤细胞的数量。在一些实施方案中,所述方法降低了肿瘤尺寸。在一些实施方案中,所述方法根除了所述受试者中的肿瘤。
在一个方面,本发明提供了一种增加响应于受试者中的癌细胞的免疫活化细胞因子产生的方法,所述方法包括向所述受试者施用包含本文所述核酸、载体或免疫反应性细胞的免疫调节系统。
在一个方面,本发明提供了一种用于产生抗原特异性免疫反应性细胞的方法,所述方法包括将编码嵌合抗原受体(CAR)的核酸序列和编码调节TGF-b信号传导的重组多肽的核酸引入免疫反应性细胞中。
应理解,前述一般描述和以下详细描述都只是示例性和解释性的,而不限制如所要求保护的本发明。
附图说明
本文包括的附图,其由以下各图组成,仅用于说明目的而非限制。
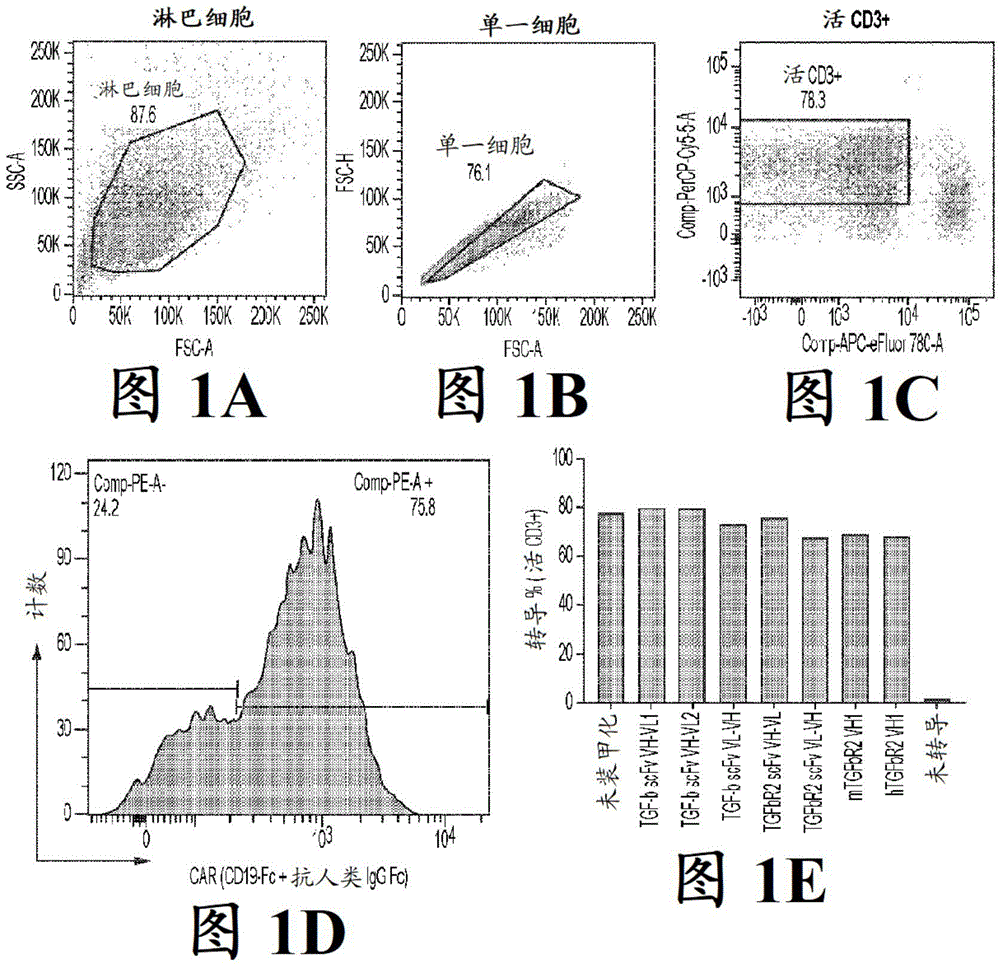
图1A-1E展示在免疫反应性细胞(例如,经转导T细胞)中的CAR和TGF-β信号传导调节剂的示例性表达。图1A说明淋巴细胞群体,图1B说明单一细胞群体,图1C绘示活CD3+细胞群体,并且图1D显示评价在表达TGF-β的装甲化人类CAR-T细胞中的CAR表达的示例性流式细胞术结果。图1E绘示直方图,其显示使用仅以CD19CAR转导的未装甲化细胞,和经以TGFbscFv VH-VL1(SEQ ID NO:1)、TGFb scFv VH-VL2(SEQ ID NO:2)、TGFb scFv VL-VH(SEQ IDNO:3)、TGFbR2 scFv VH-VL(SEQ ID NO:4)、TGFbR2 scFv VL-VH(SEQ ID NO:5)、mTGFbR2VH1(SEQ ID NO:6)和hTGFbR2 VH1(SEQ ID NO:8)装甲化的CD19 CAR-T细胞,或未经转导的细胞,以CAR染色阳性的活细胞%呈现的转导效率。
图2A-2B的曲线图展现共表达抗CD19 CAR和TGF-β信号传导调节剂的免疫反应性细胞对于CD19+Raji细胞(图2A)和CD19ko Raji细胞(图2B)的示例性体内杀伤测定结果,其使用的效应子是相对于以下各者的靶标:仅以CD19 CAR转导的未装甲化细胞,和经以TGFbscFv VH-VL1(SEQ ID NO:1)、TGFb scFv VH-VL2(SEQ ID NO:2)、TGFb scFv VL-VH(SEQ IDNO:3)、TGFbR2 scFv VH-VL(SEQ ID NO:4)、TGFbR2 scFv VL-VH(SEQ ID NO:5)、mTGFbR2VH1(SEQ ID NO:6)和hTGFbR2 VH1(SEQ ID NO:8)装甲化的CD19 CAR-T细胞,或未经转导的细胞。
图3A绘示的直方图绘示展现人类CAR-T细胞的TGF-β结合子分泌的示例性ELISA结果,并且图3B绘示的直方图绘示展现人类CAR-T细胞的TGFβR2结合子分泌的示例性ELISA结果,以及其与同源抗原结合的能力。
图4绘示的直方图绘示示例性荧光素酶测定结果,所述测定评价来自分泌构建体TGFb scFv VH-VL1(SEQ ID NO:1)、TGFb scFv VH-VL2(SEQ ID NO:2)、TGFb scFv VL-VH(SEQ ID NO:3)、TGFbR2 scFv VH-VL(SEQ ID NO:4)、TGFbR2 scFv VL-VH(SEQ ID NO:5)、mTGFbR2 VH1(SEQ ID NO:6)和hTGFbR2 VH1(SEQ ID NO:8)的CAR-T细胞的上清液对TGF-β信号传导的抑制。
图5A显示的直方图绘示示例性荧光素酶测定结果,所述测定评价来自分泌TGFb-scFv VH-VL1 G4S二聚体(SEQ ID NO:17)、TGFb-scFv VH-VL1 2xG4S二聚体(SEQ ID NO:18)、TGFb-scFv VH-VL1微型抗体(SEQ ID NO:21)、TGFb-scFv VH-VL1微型抗体+铰链(SEQID NO:19)的CAR-T细胞的上清液对TGF-β信号传导的抑制。图5B显示示例性TGF-β调节剂的示意图,其经设计并使用荧光素酶报告测定来筛选针对TGF-β的多聚结合子的分泌。图5C显示包含VHH结合结构域的示例性TGF-β调节剂的示意图。
图6A显示的直方图绘示示例性荧光素酶测定结果,所述测定评价在与仅表达CAR的未装甲化细胞相比下,共表达单体TGFb scFv VH-VL1(SEQ ID NO:1)和二聚TGFb-scFvVH-VL1 G4S二聚体(SEQ ID NO:17)结合子的装甲化CAR T细胞的相对阻断活性。图6B显示了直方图,其绘示示例性荧光素酶测定结果,所述测定评价TGFβR2VHH和scFv单体和二聚体构建体的相对阻断活性。未装甲化的CAR-T细胞、mTGFbR2 VH2单体、mTGFbR2 VH2 G4S二聚体、mTGFbR2 VH2 G4S三聚体、hTGFbR2 VH2单体、hTGFbR2 VH2 G4S二聚体、hTGFbR2 VH3单体、hTGFbR2 VH3 G4S二聚体、hTGFbR2scFv VH-VL单体、hTGFbR2 scFv VH-VL G4S二聚体。
图7A和图7B绘示的直方图绘示示例性ELISA结果,展现示例性TGFb调节剂与人类TGFbR2结合(图7A)但不与小鼠TGFbR2结合(图7B)。未装甲化的CAR-T细胞、mTGFbR2 VH2单体、mTGFbR2VH2 G4S二聚体、mTGFbR2 VH2 G4S三聚体、hTGFbR2 VH2单体、hTGFbR2 VH2 G4S二聚体、hTGFbR2 VH3单体、hTGFbR2 VH3 G4S二聚体、hTGFbR2 scFv VH-VL单体、hTGFbR2scFv VH-VL G4S二聚体。
图8A显示示例性注射时间表以评价如实施例6中所述的EMT6-hCD19-Fluc肿瘤细胞的肿瘤生长。图8B显示在相对于未装甲化CAR-T或未经转导的CAR-T细胞下,接受会分泌TGF-β结合子的CAR-T细胞的小鼠中的示例性肿瘤体积随时间的变化。图8C展现在相对于未装甲化或未经转导的CAR-T细胞下,用会分泌TGF-β结合子的CAR-T细胞治疗的小鼠中的示例性肝转移。图8D展现在相对于未装甲化或未经转导的CAR-T细胞下,用会分泌TGF-β结合子的CAR-T细胞治疗的小鼠中的示例性肺转移。图8E展现在肝和肺组织中表达荧光素酶的肿瘤细胞的示例性成像结果。
图9A和图9B绘示的直方图绘示比较了来自分泌不同TGF-b配体陷阱(TGF-b scFvVH-VL1至TGFbR2 ECD单体、同质二聚体(图9A)和异质二聚体(图9B))的装甲化小鼠CAR-T细胞与来自未装甲化CAR-T细胞的上清液的示例性SBE-Luc TGF-b报告测定结果。
图10A显示示例性注射时间表以评价EMT6-hCD19-Fluc肿瘤细胞的肿瘤生长。图10B显示在接受未经转导的T细胞或未装甲化CAR-T细胞(未共表达TGFβ信号传导调节剂的CAR-T细胞)的小鼠中的示例性肿瘤体积随时间的变化。图10C显示在接受共表达TGFbR1+2ECD二聚体的装甲化CAR-T细胞或未装甲化CAR-T细胞(未共表达TGFβ信号传导调节剂的CAR-T细胞)的小鼠中的示例性肿瘤体积随时间的变化。图10D显示在接受全身性抗TGFb抗体(1D11)或未装甲化CAR-T细胞(未共表达TGFβ信号传导调节剂的CAR-T细胞)的小鼠中的示例性肿瘤体积随时间的变化。
图11绘示的曲线图展现发展自表达CD19的MC38细胞的小鼠中的示例性肿瘤体积随时间的变化。小鼠接受未经转导的T细胞、未装甲化抗CD19 CAR-T细胞、或分泌抗TGF-b(TGF-b scFv VH-VL1)的抑制性结合子的CAR-T细胞。
图12绘示的曲线图显示示例性RNA Seq分析,其展现分泌抗TGF-b(TGF-b scFvVH-VL1(SEQ ID NO:1))的结合子的CAR-T细胞对宿主免疫反应的增强活化。
图13显示对于接受会分泌TGF-b scFv VH-VL1(SEQ ID NO:1)的CAR-T细胞的小鼠肿瘤中的肿瘤浸润T细胞(CD3d+,CD3e+,CD3g+)、CD8+T细胞(CD8a+)和细胞毒性T细胞(GzmB+)的示例性生物标志物评分。
图14显示示例性单样本基因集富集分析(GSEA),富集评分展现出接受分泌TGF-bscFv VH-VL1(SEQ ID NO:1)的CAR-T细胞的小鼠肿瘤中的T细胞特征和IFNg特征增加。
图15显示在接受未经转导的对照T细胞、未装甲化CD19 CAR-T细胞、或分泌抗TGF-b scFv VH-VL1(SEQ ID NO:1)单体的CAR-T细胞的小鼠中的包括TCRa/b、CD8a、CD4、CD25、CD62L、CD11b、Gr1、CD11c、CD45.1和CD45的示例性表面标志物分析。
图16A和图16B的曲线图绘示GSU异体移植模型的示例性体内分析,其展现出经以抗TGF-b或抗TGFbR2阻断抗体装甲化的人类GCC-CAR-T细胞的功能改善。
图17A至图17D展现出共表达TGF-b scFv VH-VL1和TGFbR2VHH的抗GCC CAR-T细胞所分泌的TGFb调节剂的肿瘤和/或血浆浓度,其是使用抗Flag免疫捕捉LC/MS测定法来测定的。
图18A至图18C的曲线图绘示在不存在TGFb(图18A)和存在TGFb(图18B)的情况下使用未装甲化抗GCC CAR-T细胞、抗TGFbR2 VHH单体装甲化的抗GCC CAR-T细胞、和抗TGFbR2 VHH二聚体装甲化的抗GCC CAR-T细胞的HT29-GCC阳性细胞中的示例性体外杀伤测定结果。图18C显示在TGFb存在和不存在下的CAR T细胞增殖。
图19描绘展现出重复抗原刺激后细胞上的PD-1/Lag3表达的示例性流式细胞术结果。
图20A至图20C绘示使用装甲化和未装甲化CAR-T细胞以及表达显性阴性TGFbR2(dnTGFbR2)的CAR-T细胞进行处理的GCC表达细胞GSU(图20A)、HT55(图20B)、和MDA-MB-231-FP4 Luc(图20C)的异种移植模型。
图21A-21C显示使用装甲化抗GCC CAR T细胞进行处理的HT55肝脏转移模型的示例性结果。
图22A显示在指定时间点通过流式细胞术计数的CAR-T细胞和进行的FACS表型分型。图22B显示抗Msln CAR-T细胞中的细胞毒性百分比,所述细胞共表达与TGFβ调节剂(例如TGFβR2-VH或dnTGFbR2)一起抗Msln的CAR,或者所述CAR与对照VH一起抗GFP(Msln-对照VH)。
定义
为使本发明更易于理解,首先在下文定义某些术语。以下术语和其他术语的额外定义在整个说明书中阐述。
除非上下文另外明确指示,否则如本说明书和所附权利要求中所使用,单数形式“一(a/an)”和“所述(the)”包括多个指示物。因此,例如,提及“方法”包括一种或多种方法,和/或本文所述类型的步骤,和/或本领域技术人员在阅读本公开时变得显而易见者,等等。
施用:如本文所用,向受试者“施用”组合物是指提供、施用或使所述组合物与所述受试者接触。施用可通过多种途径中的任一者实现,例如局部、口服、皮下、肌肉内、腹膜内、静脉内、鞘内和皮内。
过继性细胞疗法:如本文中可互换使用,术语“过继性细胞疗法”或“过继性细胞转移”或“细胞疗法”或“ACT”是指细胞(例如本文所述的基因修饰细胞群体)转移至有需要的患者中。所述细胞可衍生和繁殖自有需要的患者(即自体细胞),或可从非患者供体获得(即同种异体细胞)。在一些实施方案中,所述细胞为免疫细胞,例如淋巴细胞,其经修饰以表达CAR和TGFβ信号通路调节剂,如本文所描述(例如,TGFβ装甲化CAR-T细胞)。可使用各种细胞类型进行ACT,包括但不限于天然杀手(NK)细胞、T细胞、CD8+细胞、CD4+细胞、γδT细胞、调节型T细胞、诱导性多能干细胞(iPSC)、iPSC衍生的T细胞、iPSC衍生的NK细胞、造血干细胞(HSC)、间充质干细胞(MSC)和外周血单核细胞。
亲和力:如本文所用,术语“亲和力”是指结合部分(例如,抗原结合剂(例如,本文所描述的可变结构域)与靶标(例如,抗原(例如,TGFΒ或TGFBR))之间的结合相互作用特性,并且指示结合相互作用的强度。在一些实施方案中,亲和力的测量是以解离常数(K
亲合力:如本文所用,术语“亲合力”是两个分子在多个位点彼此结合的强度总和(例如考虑到所述相互作用的价数)。
动物:如本文所用,术语“动物”是指动物界的任何成员。在一些实施方案中,“动物”是指处于发育的任何阶段的人类。在一些实施方案中,“动物”是指处于发育的任何阶段的非人类动物。在某些实施方案中,所述非人类动物为哺乳动物(例如啮齿动物、小鼠、大鼠、兔、猴、狗、猫、绵羊、牛、灵长类动物和/或猪)。在一些实施方案中,动物包括但不限于哺乳动物、鸟类、爬虫类、两栖动物、鱼类、昆虫和/或蠕虫。在一些实施方案中,动物可为转基因动物、基因工程动物和/或克隆。
自体:如本文所用,术语“自体”是指衍生自同一个体的任何材料,稍后将其重新引入所述个体中。
同种异体:如本文所用,“同种异体”是指衍生自与引入材料的个体为相同物种的不同动物的任何材料。当一个或多个基因座上的基因不相同时,所述两个或更多个个体被称为彼此同种异体。在一些方面,来自相同物种的个体的同种异体材料在基因上的不同可能足以发生抗原相互作用。
抗体或抗原结合剂:如本文所用,术语“抗体”或“抗原结合剂”是指包括足以赋予特定靶抗原的特异性结合的典型免疫球蛋白序列元件的多肽。本领域技术人员将了解,所述术语可在本文中互换使用。在一些实施方案中,如本文中所使用,术语“抗体”或“抗原结合剂”还指包括完整抗体的一部分(例如抗体的抗原结合或可变区)的“抗体片段”或“多个抗体片段”。“抗体片段”的实例包括Fab、Fab'、F(ab')2和Fv片段;三抗体;四抗体;线性抗体;单链抗体分子;以及由抗体片段形成的多特异性抗体中所包括的含CDR部分。本领域技术人员应了解,术语“抗体片段”并不暗示并且不限于任何特定产生模式。抗体片段可经由使用任何适当方法制备,包括但不限于完整抗体的裂解、化学合成、重组生产等。如本领域中已知的,天然产生的完整抗体为大约150kD的四聚体剂,包含两个相同的重链多肽(各约50kD)和两个相同的轻链多肽(各约25kD)相互结合形成所谓的“Y形”结构。每个重链包含至少四个结构域(每个约110个氨基酸长),即氨基末端可变(V
出于本发明的目的,在某些实施方案中,包括在天然抗体中发现的足够免疫球蛋白域序列的任何多肽或多肽复合物,可被称为和/或用作“抗体”或“抗原结合剂”,不论此类多肽是天然产生的(例如,由对抗原有反应的生物体产生),或通过重组工程、化学合成或其他人工系统或方法产生。在一些实施方案中,抗体为单克隆抗体;在一些实施方案中,抗体为多克隆抗体。在一些实施方案中,抗体具有小鼠、兔子、灵长类动物或人类抗体特征性的恒定区序列。在一些实施方案中,如本领域中已知的,抗体序列元件为人源化、灵长类化、嵌合的等。此外,如本文使用的术语“抗体”或“抗原结合剂”将被理解为涵盖(除非另有说明或上下文显而易见)在适当的实施方案中,可以指任何本领域已知的或已开发的构建体或形式,用于在替代呈递中捕捉抗体结构性和功能性特征。例如,在一些实施方案中,所述术语可指双特异性或其它多特异性(例如,酶亲体等)抗体、小型模块免疫药物(“SMIPs
大约或约:如本文所用,术语“大约”或“约”如应用于所关注的一个或多个数值,是指类似于所陈述参考值的数值。在某些实施方案中,除非另外说明或者另外从上下文显而易见,否则术语“大约”或“约”是指在任一方向上(大于或者小于)落于所陈述参考值的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或者更小的数值范围内(但此数值将超出可能值的100%的情况除外)。应理解,当使用术语“约”或“大约”来修饰所陈述的参考值时,涵盖所陈述的参考值本身以及所陈述的参考值的任一侧接近所述参考值的数值。
装甲化CAR-T细胞:如本文所用,术语“装甲化CAR细胞”或“装甲化CAR-T细胞”是指具有躲避肿瘤免疫抑制和肿瘤诱导型CAR-T功能低下的能力的基因工程细胞。在一些实施方案中,装甲化CAR T细胞包含识别癌症相关抗原的嵌合抗原受体(CAR)和TGFβ信号通路调节剂。
互补决定区(CDR):可变结构域的“CDR”是在可变区内,根据Kabat、Chothia的定义、Kabat和Chothia二者的累积、AbM、接触和/或构象定义或本领域中众所周知的任何CDR测定方法所标识的氨基酸残基。抗体CDR可标识为最初由Kabat等人定义的高变区。参见例如Kabat等人,1992,Sequences of Proteins of Immunological Interest,第5版,PublicHealth Service,NIH,Washington D.C。CDR的位置还可标识为最初由Chothia和其他人描述的结构环结构。参见例如Chothia等人,Nature 342:877-883,1989。其他的CDR标识方法包括“AbM定义”,其为Kabat和Chothia之间的折衷并且是使用Oxford Molecular的AbM抗体模拟软件(现为
抗体依赖性细胞介导的细胞毒性或ADCC是指一种细胞毒性形式,其中所分泌的Ig结合至某些细胞毒性细胞(例如,自然杀手(NK)细胞、嗜中性粒细胞和巨噬细胞)上存在的Fc受体(FcR),使这些细胞毒性效应细胞能够特异性地结合至携带有抗原的靶细胞,并且随后以细胞毒素杀死所述靶细胞。所述抗体“武装”所述细胞毒性细胞,并且为通过这种机制杀伤靶细胞所必需。介导ADCC的主要细胞为NK细胞,其仅表达FcγRIII,而单核细胞则表达FcγRI、FcγRII和FcγRIII。造血细胞上的Fc表达概述于Ravetch和Kinet,Annu.Rev.Immunol.9:457-92(1991)的第464页的表3。为了评估所关注的分子的ADCC活性,可进行体外ADCC测定法,例如美国专利第5,500,362号或第5,821,337号中所述。用于此类测定法的可用效应细胞包括外周血单核细胞(PBMC)和自然杀手(NK)细胞。替代地或另外地,可在体内评估所关注的分子的ADCC活性,例如在动物模型中,例如在Clynes等人,PNASUSA 95:652-656(1998)中所公开的动物模型中。
抗原:如本文所用,术语“抗原”是指引发免疫反应的试剂;和/或当暴露或施用于生物体时,与T细胞受体(例如,当由MHC分子呈现时)或抗体(例如,由B细胞产生)结合的试剂。在一些实施方案中,抗原在生物体中引发体液反应(例如,包括抗原特异性抗体的产生);替代地或另外地,在一些实施方案中,抗原在生物体中引发细胞反应(例如,涉及其受体与所述抗原特异性相互作用的T细胞)。本领域技术人员将理解,特定抗原可在靶标生物体(例如,小鼠、兔、灵长类动物、人类)的一个或数个成员中,而非在所述靶标生物体物种的所有成员中,引发免疫反应。在一些实施方案中,抗原在靶标生物体物种的至少约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的成员中引发免疫反应。在一些实施方案中,抗原结合至抗体和/或T细胞受体,并且可能会或可能不会在生物体中诱发特定生理反应。在一些实施方案中,例如,抗原可在体外结合至抗体和/或T细胞受体,无论此相互作用是否在体内发生。在一些实施方案中,抗原与特定体液或细胞免疫的产物反应,包括由异源性免疫原诱发者。
相关联:作为本文使用的术语,如果两个事件或实体中的一者与另一者的存在、水平和/或形式相关,则此两个事件或实体彼此“相关联”。例如,如果特定实体(例如多肽)的存在、水平和/或形式与特定疾病、病症或疾患的发生率和/或易感性相关(例如在相关群体中),则所述特定实体被视为与所述特定疾病、病症或疾患相关联。在一些实施方案中,如果两个或更多个实体直接或者间接相互作用,以使得它们彼此物理上接近并保持物理上接近,则其彼此物理上“相关联”。在一些实施方案中,彼此物理上相关联的两个或更多个实体彼此共价连接;在一些实施方案中,彼此物理上相关联的两个或更多个实体彼此不共价连接,但以非共价形式相关联,例如借助于氢键、范德华相互作用(van der Waalsinteraction)、疏水相互作用、磁性和其组合。在一些实施方案中,提及“与癌细胞相关的抗原”时,术语“与……相关”是指癌细胞表面上存在特定抗原。
结合:应当理解,如本文所用的术语“结合”通常是指两个或更多个实体之间的非共价缔合。“直接”结合涉及实体或部分之间的物理接触;间接结合涉及通过与一个或多个中间实体进行物理接触的物理相互作用。两个或更多个实体之间的结合可在多种情况中的任一者下进行评估,包括相互作用的实体或部分在隔绝或在更复杂系统的情况下(例如,与载体实体和/或在生物系统或细胞中以共价或其他方式缔合)。如本文所用,“K
载体:如本文所用,术语“载体”是指与组合物一起施用的稀释剂、佐剂、赋形剂或媒介物。在一些示例性实施方案中,载体可包括无菌液体,例如水和油,包括石油、动物、植物或合成来源的油,例如花生油、大豆油、矿物油、芝麻油等。在一些实施方案中,载体为或包括一个或多个固体组分。
特征部分:如本文所用,术语“特征部分”在最广泛意义上用于指物质的一部分的存在(或不存在)与特定特征、属性或活性的存在(或不存在)相关联。在一些实施方案中,物质的特征部分是在所述物质和相关物质中发现共享特定特征、属性或活性的部分,而非不共享特定特征、属性或活性者。
嵌合抗原受体:如本文所用,术语“嵌合抗原受体”或“CAR”是指由细胞外靶标结合结构域(例如,衍生自抗体)、跨膜区与一个或多个细胞内效应结构域中的一者或多者所组成的工程化受体。CAR通常被引入免疫细胞如T细胞中,以重新定向所需细胞表面抗原或MHC-肽复合物的特异性。这些合成受体通常含有经由单个融合分子中的柔性接头与一个或多个信号传导结构域相关的靶标结合结构域。所述靶标结合结构域用于将免疫细胞(例如T细胞)导引至病理性细胞(例如,癌细胞)表面上的特定靶标,并且所述信号传导结构域含有用于免疫细胞(例如T细胞)活化和增殖的分子机制。通常穿过免疫细胞(例如T细胞)膜的柔性接头(即,形成跨膜结构域)允许细胞膜显示出CAR的靶标结合结构域。CAR已成功地使免疫细胞(T细胞)针对在来自各种恶性疾病(包括淋巴瘤和实体瘤)的肿瘤细胞表面处表达的抗原进行重新定向(Gross等人,(1989)Transplant Proc.,21(1Pt 1):127-30;Jena等人,(2010)Blood,116(7):1035-44)。CAR的胞外结合结构域可由衍生自使鼠类或人源化单克隆抗体的可变重链和轻链区融合的单链可变片段(scFv)构成。在一些实施方案中,所述胞外结合结构域包含单域抗体。或者,可使用衍生自Fab的scFv(而非衍生自例如获自Fab文库的抗体)。在多个实施方案中,此scFv与跨膜结构域融合并且接着与胞内信号传导结构域融合。
已开发出至少三代的CAR。第一代CAR包含附接至衍生自CD3ζ或Fc受体γ链的细胞质区的信号传导结构域的靶标结合结构域。已显示第一代CAR成功地将T细胞重新定向至选定靶标,但其未能在体内提供长期的扩增和抗肿瘤活性。第二代和第三代CAR聚焦于通过包括共刺激分子(例如CD28、OX-40(CD134)和4-1BB(CD137))来增强经修饰T细胞存活率并增加增殖。本文所述的实施方案部分聚焦于进一步改善含有CAR-T的免疫疗法,例如,通过用TGFβ信号通路调节剂来装甲化CAR-T,由此使免疫疗法在治疗癌症(尤其是实体瘤癌症)时更有效。相对于未装甲化的CAR-T细胞,本文所提供的装甲化CAR在面对不利的肿瘤微环境时可改善或增强CAR-T功能和存活率。
密码子优化:如本文所用,“密码子优化”的核酸序列是指已经改变以使得核酸序列的翻译和所得蛋白质的表达针对特定表达系统实现改进优化的核酸序列。“密码子优化”的核酸序列编码与所述“密码子优化”核酸序列所基于的未优化亲本序列相同的蛋白质。例如,核酸序列可经“密码子优化”,以在哺乳动物细胞(例如,CHO细胞、人类细胞、小鼠细胞等)、细菌细胞(例如,大肠杆菌)、昆虫细胞、酵母细胞或植物细胞中表达。
可比较:如本文所用,术语“可比较”是指两个或更多个试剂、实体、情形、条件组等,它们可能彼此不同但足够相似,以允许在它们之间进行比较,因而可根据观测到的差异或相似之处合理地得出结论。本领域普通技术人员将理解,在上下文中,在任何给定情况下需要何种程度的同一性,才能将两个或更多个此类试剂、实体、情形、条件组等视为具有可比较性。
对应于:如本文所用,术语“对应于”通常用于指定所关注多肽的氨基酸残基的位置/同一性。本领域普通技术人员将理解,为简要起见,多肽中的残基通常使用基于参考相关多肽的规范编号系统来命名,因此,“对应于”位置190残基的氨基酸,例如,实际上未必是特定氨基酸链中的第190个氨基酸,而是对应于所述参考多肽中第190个残基;本领域普通技术人员容易理解如何鉴定“相对应”的氨基酸。
衍生自:如本文所用,短语“衍生自”或“特异于指定序列”的序列是指包含大约至少6个核苷酸或至少2个氨基酸、至少约9个核苷酸或至少3个氨基酸、至少约10-12个核苷酸或4个氨基酸、或至少约15-21个核苷酸或5-7个氨基酸对应于(即,同一于或互补于)例如指定序列的连续区域的序列。在某些实施方案中,所述序列包含所有指定的核苷酸或氨基酸序列。如通过本领域中已知的技术确定,所述序列可与特定序列独特的序列区域互补(在多核苷酸序列的情况下)或同一。可衍生序列的区域包括但不限于:编码特异性表位的区域、编码CDR的区域、编码框架序列的区域、编码恒定结构域区域的区域、编码可变结构域区域的区域,以及非翻译和/或非转录区域。所述衍生序列不一定是从研究中的所关注的序列物理衍生而来,而可以任何方式产生,包括但不限于化学合成、复制、反转录或转录,其基于所述多核苷酸所衍生的区域中的碱基序列提供的信息。因此,它可以代表原始多核苷酸的同义或反义方向。此外,对应于指定序列的区域组合可以本领域中已知的方式进行修饰或组合,以符合预期用途。例如,序列可包含两个或更多个连续序列,其各自包含指定序列的一部分,并且被与指定序列不同但打算用于代表衍生自所述指定序列的序列的区域中断。关于抗体分子,“衍生自”包括与比较抗体在功能上或结构上相关的抗体分子,例如,“衍生自”包括具有相似或基本上相同的序列或结构,例如具有相同或类似的CDR、框架或可变区的抗体分子。抗体的“衍生自”还包括残基,例如一个或多个,例如2、3、4、5、6个或更多个残基,其可为连续或不连续,但根据编号方案或与比较序列的一般抗体结构或三维邻近性(即,在CDR或框架区内)的同源性而定义或标识。术语“衍生自”不限于物理性衍生,而是包括通过任何方式产生,例如通过使用来自比较抗体的序列信息来设计另一种抗体。
测定:本文所述的许多方法包括“测定”步骤。阅读本说明书的本领域普通技术人员将理解,此“测定”可利用本领域技术人员可获得的多种技术的任一者,包括例如本文明确提及的特定技术进行。在一些实施方案中,测定涉及物理样本的操作。在一些实施方案中,测定涉及对数据或信息的考虑和/或操作,例如利用适于执行相关分析的计算机或其他处理单元。在一些实施方案中,测定涉及从来源接收相关信息和/或材料。在一些实施方案中,测定涉及将样本或实体的一个或多个特征与可比较的参考物进行比较。
工程化:如本文所用,术语“工程化”描述已由人为设计或修饰和/或其存在和产生需要人为干预和/或活动的多核苷酸、多肽或细胞。例如,旨在设计用于引发特定效果并且与天然存在的相同类型细胞的效果不同的工程化细胞。在一些实施方案中,工程化细胞表达本文所述的嵌合抗原受体。
效应功能:如本文所用,术语“效应功能”是指可归因于本文所述的抗原结合剂的生物活性。抗体效应功能的实例包括:C1q结合和补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如,B细胞受体;和B细胞活化)的下调。“降低或最小化”抗体效应功能是指其相较于野生型或未修饰的抗体降低至少50%(或者60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)。抗体效应功能的测定可由本领域一般技术人员容易地确定和测量。在一些实施方案中,补体结合、补体依赖性细胞毒性和抗体依赖性细胞毒性的抗体效应功能受到影响。在一些实施方案中,效应功能经由在恒定区中消除糖基化的突变而消除,例如“无效应子突变”。在一个方面,所述无效应子突变为CH2区域中的N297A或DANA突变(D265A+N297A)。Shields等人,J.Biol.Chem.276(9):6591-6604(2001)。或者,导致效应功能降低或消除的额外突变包括:K322A和L234A/L235A(LALA)。或者,效应功能可通过生产技术而降低或消除,例如在无糖基化作用的宿主细胞(例如,大肠杆菌)中表达,或其中导致糖基化模式改变成在促进效应功能方面无效或效果较差(例如Shinkawa等人,J.Biol.Chem.278(5):3466-3473(2003))。
表位:如本文所用,术语“表位”包括被免疫球蛋白(例如,抗体或受体)结合组分全部或部分特异性识别的任何部分。在一些实施方案中,表位由抗原中的多个氨基酸组成。在一些实施方案中,当抗原采用相关三维构象时,此类氨基酸残基暴露于表面。在一些实施方案中,当抗原采用此种构象时,氨基酸残基在空间上彼此物理性接近或等高。在一些实施方案中,当抗原采用替代构象(例如,线性化;例如,非线性表位)时,至少一些氨基酸彼此呈物理上分隔。
赋形剂:如本文所用,术语“赋形剂”是指可包括在药物组合物中的非治疗剂,例如,以提供或有助于所需的稠度或稳定作用。合适的药物赋形剂包括例如淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。
表达:术语“表达”或“经表达”,当用于提及本文中的核酸时,其是指以下事件中的一者或多者:(1)DNA模板的RNA转录物产生(例如,通过转录作用);(2)RNA转录物的加工(例如,通过剪接、编辑、5'帽形成和/或3'端形成);(3)RNA翻译成多肽;和/或(4)多肽的翻译后修饰。
离体:如本文所用,术语“离体”意指细胞从活生物体移出并在生物体外部繁殖的过程(例如,在试管中,在培养袋中,在生物反应器中)。
融合蛋白:如本文所用,术语“融合蛋白”是指由编码两种不同(例如,异源性)蛋白质的至少一部分的核酸序列工程改造而得的核酸序列编码的蛋白质。技术人员无疑知道,为了产生融合蛋白,将核酸序列连接而使得所产生的读框不包含内部终止密码子。
宿主:术语“宿主”在本文中用于指人类或任何非人类动物(例如,小鼠、大鼠、兔、狗、猫、牛、猪、绵羊、马、非人类灵长类动物)或系统(例如细胞或细胞系)。在一些实施方案中,宿主是将被要施用本文所描述的表达CAR和/或TGFβ调节剂的细胞或细胞群体的生物体。在一些实施方案中,施用所述细胞群体导致宿主中的免疫反应改善。
宿主细胞:如本文所用,短语“宿主细胞”是指已引入外源性DNA(重组性或其他)的细胞。例如,宿主细胞可用于通过标准重组技术产生如本文所述的经修饰CAR分子。技术人员在阅读本公开内容后将理解,此类术语不仅是指特定受试者细胞,而且是指此种细胞的后代。由于某些修饰可能由于突变或环境影响而在子代中发生,因此,这类子代实际上可能不与亲本细胞完全同一,但仍包括在如本文所用的术语“宿主细胞”的范围内。
在一些实施方案中,宿主细胞是指人类细胞。在一些实施方案中,宿主细胞包括适合于表达外源性DNA(例如,重组性核酸序列)的任何原核和真核细胞。示例性细胞包括原核细胞和真核细胞(单细胞或多细胞)、细菌细胞(例如大肠杆菌、芽孢杆菌属、链霉菌属等的菌株)、分枝杆菌细胞、真菌细胞、酵母细胞(例如,酿酒酵母(S.cerevisiae)、粟酒裂殖酵母(S.pombe)、巴斯德毕赤酵母(P.pastoris)、甲醇毕赤酵母(P.methanolica)等)、植物细胞、昆虫细胞(例如,SF-9、SF-21、经杆状病毒感染的昆虫细胞、粉纹夜蛾(Trichoplusia ni)等)、非人类动物细胞、人类细胞或细胞融合体,例如杂交瘤或四重杂交瘤。在一些实施方案中,所述细胞为人类、猴、猿、仓鼠、大鼠或小鼠细胞。在一些实施方案中,所述细胞为真核细胞,并选自于以下细胞:CHO(例如,CHO K1、DXB-11CHO、Veggie-CHO)、COS(例如,COS-7)、视网膜细胞、Vero、CV1、肾(例如HEK293、HEK293T、293EBNA、MSR 293、MDCK、HaK、BHK)、HeLa、HepG2、WI38、MRC 5、Colo205、HB 8065、HL-60(例如BHK21)、Jurkat、Daudi、A431(表皮)、CV-1、U937、3T3、L细胞、C127细胞、SP2/0、NS-0、MMT 060562、支持细胞、BRL 3A细胞、HT1080细胞、骨髓瘤细胞、肿瘤细胞和衍生自前述细胞的细胞系。在一些实施方案中,所述细胞包含一种或多种病毒基因,例如表达病毒基因的视网膜细胞(例如PER.C6
免疫反应:如本文所用,术语“免疫反应”是指免疫系统的细胞如B细胞、T细胞、树突细胞、巨噬细胞或多形核细胞对于刺激如抗原或疫苗的反应。免疫反应可包括参与宿主防御反应的任何身体细胞,包括例如分泌干扰素或细胞因子的上皮细胞。免疫反应包括但不限于先天性和/或适应性免疫反应。测量免疫反应的方法是本领域中众所周知的,并且包括例如测量淋巴细胞(例如B或T细胞)的增殖和/或活性、细胞因子或趋化因子的分泌、炎症、抗体产生等。在一些实施方案中,免疫反应是指在施用本文所述的装甲化CAR-T细胞或未装甲化CAR-T细胞之后所观测到的免疫反应。在一些实施方案中,施用本文所述的装甲化CAR-T细胞之后所观察到的免疫反应是由以下中的一者或多者来测量:表达CAR的细胞的增殖增加、表达CAR的细胞的IFNg产生增加、表达CAR的细胞的IL-2产生增加、宿主免疫细胞的增殖增加、宿主免疫细胞的IL-2产生增加、宿主抗原呈递细胞的抗原呈递增加、宿主抗原呈递细胞的共刺激增加、内皮细胞的活化增加、或免疫细胞(例如NK细胞、T细胞、巨噬细胞)的肿瘤归巢增加。
体外:如本文所用,术语“体外”是指事件在人工环境中(例如在试管或反应器皿中)、在细胞培养物中等而非在多细胞生物体内发生。
体内:如本文所用,术语“体内”是指事件发生在例如人类和非人类动物的多细胞生物体内。在基于细胞的系统的情形下,所述术语可用于指事件发生在活细胞内(相对于例如体外系统)。
经分离:如本文所用,术语“经分离的”是指物质和/或实体(1)与最初生产时(无论是在自然界和/或在实验环境中)相缔合的至少一些组分分离,和/或(2)在人为干预下设计、生产、制备和/或制造。经分离的物质和/或实体可与其最初缔合的其他组分的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或超过约99%分离。在一些实施方案中,经分离的试剂的纯度为约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%,或超过约99%。如本文所用,如果所述物质基本上不含其他组分,则所述物质为“纯的”。在一些实施方案中,如本领域技术人员将理解的,物质在与某些其他组分(例如一种或多种载体或赋形剂(例如,缓冲液、溶剂、水等))组合之后,仍可视为“经分离的”或甚至“纯的”;在此类实施方案中,计算所述物质的分离百分比或纯度时不包括此类载体或赋形剂。仅作为一个实例,在一些实施方案中,当在以下情况下,自然界中存在的例如多肽或多核苷酸的生物聚合物被认为是“经分离的”:a)由于其起源或衍生来源不与一些或所有在自然状态下伴随其的组分缔合;b)其基本上不含来自于自然界产生它的物种的相同物种的其他多肽或核酸;c)由非来自于自然界产生它的物种的细胞或其他表达系统表达,或与所述细胞中的组分相缔合。因此,例如,在一些实施方案中,化学合成的或在不同于天然产生它的细胞系统中合成的多肽被认为是“经分离的”多肽。在一些实施方案中,细胞可为分离自自然伴随着细胞的分子和/或细胞组分的“经分离细胞”。替代地或另外地,在一些实施方案中,已进行一种或多种纯化技术的细胞在达到已与:a)自然界中与其相缔合;和/或b)最初产生时与其相缔合的其他组分分离的程度时,可视为“经分离的”细胞。
接头:如本文所用,术语“接头”是指共价附接两个或更多个多肽或核酸以使其彼此连接的官能团(例如,化学试剂或多肽)。如本文所用,“肽接头”是指用于将两种蛋白质偶联在一起(例如,偶联VH和VL结构域)的一个或多个氨基酸。
调节或调节剂:如本文所用,术语“调节”或“调节剂”是指组分对相关功能正向或负向改变的能力。示例性调节包括约1%、约2%、约5%、约10%、约25%、约50%、约75%或约100%的改变。例如,本文提供了能够改变或防止TGFβ受体发生信号传导的TGFB信号传导调节剂。本领域技术人员应了解,这可通过与激活TGFβR信号传导的细胞因子(即TGFβ)结合、或与其受体本身(例如TGFβ抗体或其片段、TGFBR抗体或其片段)结合来实现。因此,此术语涵盖了结合TGFβ的分子与结合TGFβR的分子的两种分子。在一个实施方案中,本公开的调节剂可通过TGFβRII来中和TGFβ信号传导。“中和”意指阻断TGFβ的正常信号传导作用,使得TGFβ的存在对TGFβRII信号传导具有中性作用。在一些实施方案中,TGFβ调节剂改善了宿主中的免疫反应。
核酸:如本文所用,短语“核酸”,在其最广泛意义上,是指其为寡核苷酸链或可并入寡核苷酸链中的任何化合物和/或物质。在一些实施方案中,核酸为寡核苷酸链或可经由磷酸二酯键联并入寡核苷酸链中的化合物和/或物质。从上下文可清楚地看出,在一些实施方案中,“核酸”是指各个核酸残基(例如,核苷酸和/或核苷);在一些实施方案中,“核酸”是指包含有各个核酸残基的寡核苷酸链。在一些实施方案中,“核酸”为RNA或包含RNA;在一些实施方案中,“核酸”为DNA或包含DNA。在一些实施方案中,核酸为一个或多个天然核酸残基、包含一个或多个天然核酸残基或由一个或多个天然核酸残基组成。在一些实施方案中,核酸为一种或多种核酸类似物、包含一种或多种核酸类似物或由一种或多种核酸类似物组成。在一些实施方案中,核酸类似物与核酸的不同之处在于它不利用磷酸二酯骨架。例如,在一些实施方案中,核酸为一种或多种“肽核酸”、包含一种或多种“肽核酸”或由一种或多种“肽核酸”组成,所述“肽核酸”是本领域中已知的并且在骨架中具有肽键而非磷酸二酯键,视为在本发明的范围内。替代地或另外地,在一些实施方案中,核酸具有一个或多个硫代磷酸酯和/或5'-N-亚磷酰胺键联而非磷酸二酯键。在一些实施方案中,核酸为以下、包含以下或由以下组成:一种或多种天然核苷(例如,腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)。在一些实施方案中,核酸为以下、包含以下或由以下组成:一种或多种核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并-嘧啶、3-甲基腺苷、5-甲基胞苷、C-5丙炔基-胞苷、C-5丙炔基-尿苷、2-氨基腺苷、C5-溴尿苷、C5-氟尿苷、C5-碘尿苷、C5-丙炔基-尿苷、C5-丙炔基-胞苷、C5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、O(6)-甲基鸟嘌呤、2-硫代胞苷、甲基化碱基、嵌入碱基和其组合)。在一些实施方案中,与天然核酸中的那些相比,核酸包含一个或多个经修饰的糖(例如,2'-氟核糖、核糖、2'-脱氧核糖、阿拉伯糖和己糖)。在一些实施方案中,核酸具有编码功能基因产物如RNA或蛋白质的核苷酸序列。在一些实施方案中,核酸包括一个或多个内含子。在一些实施方案中,核酸是通过从天然来源分离、以互补模板为基础进行聚合的酶合成(体内或体外)、在重组细胞或系统中繁殖、和化学合成中的一者或多者来制备。在一些实施方案中,核酸的长度为至少3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、20、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1500、2000、2500、3000、3500、4000、4500、5000或更多个残基。在一些实施方案中,核酸为单链的;在一些实施方案中,核酸为双链的。在一些实施方案中,核酸具有包含至少一个元件的核苷酸序列,所述元件编码多肽或为编码多肽的序列的互补序列。在一些实施方案中,核酸具有酶活性。
药学上可接受的媒介物:可用于本公开的药学上可接受的载体(媒介物)是常规的。Remington's Pharmaceutical Sciences,E.W.Martin,Mack Publishing Co.,Easton,PA,第15版(1975)中描述适用于以药物递送一种或多种治疗组合物的组合物和制剂。一般而言,载体的性质将取决于所采用的特定施用模式。例如,肠胃外制剂通常包含可注射流体,其包括药学上和生理学上可接受的流体,例如水、生理食盐水、平衡盐溶液、右旋糖水溶液、甘油等作为媒介物。对于固体组合物而言(例如,粉末、药丸、片剂或胶囊形式),常规的无毒固体载体可包括例如医药级的甘露糖醇、乳糖、淀粉或硬脂酸镁。除了生物中性载体之外,待施用的药物组合物可含有少量无毒性辅助物质,例如润湿剂或乳化剂、防腐剂和pH缓冲剂等,例如乙酸钠或单月桂酸脱水山梨糖醇。
多肽:“多肽”,一般而言,是一串通过肽键彼此连接的至少两个氨基酸。在一些实施方案中,多肽可包括至少3-5个氨基酸,每个氨基酸通过至少一个肽键连接到其他氨基酸。本领域普通技术人员将理解,多肽有时包括“非天然”氨基酸或其他实体,尽管如此,它们仍能够任选地整合到多肽链中。在一些实施方案中,术语“多肽”用于指多肽的特定功能类别,例如抗体、嵌合抗原受体或共刺激结构域多肽等。对于每个此种类别,本说明书提供和/或本领域已知所述类别内已知示例性多肽的氨基酸序列的数个实例;在一些实施方案中,一种或多种此类已知多肽是所述类别的参考多肽。在此类实施方案中,术语“多肽”是指显示出与相关参考多肽足够的序列同源性或同一性的类别的任何成员,本领域技术人员将理解所述参考多肽应包括在所述类别中。在许多实施方案中,代表性类别的成员也与所述参考多肽共享显著的活性。例如,在一些实施方案中,成员多肽显示出与参考多肽至少约30-40%的整体序列同源性或同一性程度,并且通常大于约50%、60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多,和/或包括至少一个区域(即保守区,通常包括特征性序列元件),其显示出非常高的序列同一性,通常大于90%,甚至95%、96%、97%、98%或99%。此类保守区通常涵盖至少3-4个并且经常多达20个或更多个氨基酸;在一些实施方案中,保守区涵盖至少一段至少2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多个连续氨基酸。
应理解,本发明的抗体和抗原结合剂可具有额外的保守或非必需氨基酸取代,其对多肽功能没有实质性影响。特定取代是否可被容忍,即不会不利地影响所需的生物学特性(例如结合活性),可如Bowie,J U等人,Science 247:1306-1310(1990)或Padlan等人,FASEB J.9:133-139(1995)中所述决定。“保守性氨基酸取代”是其中氨基酸残基被具有类似侧链的氨基酸残基置换的取代。具有类似侧链的氨基酸残基家族已在本领域中定义。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。
预防:如本文所用,术语“预防”是指预防、避免疾病表现、延迟发作和/或降低特定疾病、病症或疾患(例如癌症)的一种或多种症状的频率和/或严重程度。在一些实施方案中,预防是以群体为基础评估,如果在对疾病、病症或疾患易感的群体中观测到所述疾病、病症或疾患的一种或多种症状的发展、频率和/或强度在统计学上显著降低,则认为所述药剂“预防”所述特定疾病、病症或疾患。
纯的:如本文所用,如果试剂或实体基本上不含其他组分,则其为“纯的”。例如,包含超过约90%的特定试剂或实体的制剂通常被认为是纯制剂。在一些实施方案中,试剂或实体为至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的纯度。
重组:如本文所用,术语“重组”旨在是指通过重组方式设计、工程化、制备、表达、创造或分离出的多肽(例如,如本文所述的多肽),例如使用重组表达载体转染到宿主细胞中而表达的多肽,从重组、组合式多肽文库中分离出的多肽,或通过涉及将选定序列元件剪接成另一者的任何其他方式制备、表达、创造或分离出的多肽。在一些实施方案中,一种或多种此类的选定序列元件是在自然界中发现的。在一些实施方案中,一种或多种此类的选定序列元件和/或其组合是经计算机设计的。在一些实施方案中,一种或多种此类的选定序列元件是由多个(例如,两个或更多个)已知序列元件的组合产生,这些已知序列元件并非天然存在于相同的多肽中。
参考物:术语“参考物”在本文中经常用于描述标准或对照剂、个体、群体、样本、序列或数值,与所关注的试剂、个体、群体、样本、序列或数值进行比较。在一些实施方案中,参考剂、个体、群体、样本、序列或数值的测试和/或测定基本上与所关注的剂、个体、群体、样本、序列或数值的测试或测定同时进行。在一些实施方案中,参考剂、个体、群体、样本、序列或数值是经验参考物,任选地在有形介质中实施。通常,如本领域技术人员将理解的,参考剂、个体、群体、样本、序列或数值是在与用于测定或表征所关注的剂、个体、群体、样本、序列或数值的那些条件类似的条件下测定或表征。
单域抗体:如本文所用,术语“单域抗体(sdAb)”、“可变单域”或“免疫球蛋白单可变结构域(ISV)”、“单重链可变结构域(VH)抗体”是指与靶抗原结合的抗体的单一可变片段。这些术语在本文中可互换使用。sdAb为具有三个互补决定区(CDR)的单一抗原结合多肽。仅sdAb就能够结合抗原,而不与相对应的含CDR多肽配对。在一些情况下,单域抗体由骆驼源化HCAb工程改造而成,并且其重链可变结构域被称为“VHH”。某些VHH也可称为纳米抗体。骆驼源化sdAb是最小的已知抗原结合抗体片段之一(参见例如Hamers-Casterman等人,Nature 363:446-8(1993);Greenberg等人,Nature 374:168-73(1995);Hassanzadeh-Ghassabeh等人,Nanomedicine(Lond),8:1013-26(2013))。基本VHH从N末端至C末端具有以下结构:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,其中FR1至FR4分别是指框架区1至4,并且其中CDR1至CDR3是指互补决定区1至3。可根据本领域中可用的标准技术将骆驼源化VHH结构域人源化,并且此类结构域被视为“结构域抗体”。如本文中所用,VH包括骆驼源化VHH结构域,并且其术语VHH可用于指仅包含重链的人类或骆驼来源的结构域抗体。如下文所解释,本发明各方面的一些实施方案涉及结合剂,其包含单一重链可变结构域抗体/免疫球蛋白重链单一可变结构域,其可在不存在轻链的情况下与TGFΒ抗原结合。
受试者:如本文所用,术语“受试者”是指任何哺乳动物,包括人类。在本发明的某些实施方案中,受试者为成人、青少年或婴儿。在一些实施方案中,术语“个体”或“患者”被使用并且旨在可与“受试者”互换。本发明还涵盖药物组合物的施用和/或子宫内治疗方法的进行。例如,受试者可为患有癌症(例如胃肠来源)、癌症症状的患者(例如人类患者或动物患者),其中至少一些细胞表达TGFβ,或为有癌症倾向的患者,其中至少一些细胞表达TGFβ。除非另有说明,否则本发明的术语“非人类动物”包括所有非人类脊椎动物,例如非人类哺乳动物和非哺乳动物,例如非人类灵长类动物、绵羊、狗、牛、鸡、两栖动物、爬行动物等。
基本上:如本文所用,术语“基本上”是指具有所关注的特征或特性的全部或接近全部范围或程度的定性条件。生物学领域的普通技术人员将理解,生物和化学现象很少(如果有的话)完成和/或继续完成或达到或避免绝对的结果。因此,术语“基本上”在本文中用于包罗许多生物和化学现象中固有的潜在缺乏的完全性。
治疗剂:如本文所用,术语“治疗剂”是指具有生物活性的药剂(例如,抗原结合剂)。所述术语在本文中用于指称化合物、化合物的混合物、生物大分子或由生物材料制成的提取物。在一些实施方案中,所述治疗剂可为抗癌剂或化学治疗剂。如本文所用,术语“抗癌剂”或“化学治疗剂”是指具有抑制人类肿瘤,特别是恶性(癌性)病变,例如癌瘤、肉瘤、淋巴瘤或白血病的发展或进展的功能特性的药剂。抑制转移或血管生成通常是抗癌剂或化学治疗剂的特性。化学治疗剂可为细胞毒性剂或细胞抑制剂。术语“细胞抑制剂”是指抑制或压抑细胞生长和/或细胞增殖的药剂。
转化:如本文所用,是指将外源性DNA引入宿主细胞的任何过程。可使用本领域中众所周知的各种方法在自然或人工条件下进行转化。转化可依赖于将外源核酸序列插入原核或真核宿主细胞中的任何已知方法。在一些实施方案中,基于被转化的宿主细胞而选择特定的转化方法,并且可包括但不限于:病毒感染、电穿孔、交配、脂质转染。在一些实施方案中,“经转化的”细胞被稳定转化,因为插入的DNA能够作为自主复制质粒或作为宿主染色体的一部分而进行复制。在一些实施方案中,经转化的细胞在有限的时间段内暂时表达引入的核酸。
转化生长因子-β(TGFβ):如本文所用,术语“TGF-β”、“TGFb”、“TGFβ”和“转化生长因子-β”在本文中可互换使用,并且是指具有来自人类的任何TGF-β的全长天然氨基酸序列的分子家族,包括其潜在形式以及前体与成熟TGF-β(“潜在TGF-β”)的结合或未结合复合物。本文所提及的这类TGF-β将理解为提及目前已鉴定形式中的任一者,包括TGF-β1、TGF-β2、TGF-β3、TGF-β4和TGF-β5与其潜在形式,以及未来被鉴定的人类TGF-β种类,包括衍生自任何已知TGF-β的序列并与所述序列至少约75%、优选地至少约80%、更优选地至少约85%、又更优选地至少约90%和甚至更优选地至少约95%同源的多肽。特定术语“TGF-β1”、“TGF-β2”和“TGF-β3”,以及“TGF-β4”和“TGF-β5”是指在文献中所定义的TGF-β,例如Derynck等人,Nature,同上;Seyedin等人,J.Biol.Chem.,262,同上;和deMartin等人,同上。术语“TGF-β”是指编码人类TGF-β的基因。优选的TGF-β为人类TGF-β天然序列。
将TGF-β家族的成员定义为那些在分子的成熟部分中带有9个半胱氨酸残基、在成熟区与其它已知TGF-β序列共有至少65%同源性、并且可竞争相同受体的成员。此外,它们似乎均编码为较大的前体,所述前体在N末端附近共享高度同源区并且在稍后会通过加工除去的前体部分中显示出保留有三个半胱氨酸残基。此外,TGF-β似乎具有四个或五个氨基酸的加工位点。
转化生长因子-β受体(TGFβR):如本文所用,术语“TGF-bR”或“TGF-b受体”或“TGF-β受体”或“TGFβR”用于涵盖TGFβR家族的全部三个子类型(即TGFβR1、TGFβR2、TGFβR3)。TGFβ受体的特征为丝氨酸/苏氨酸激酶活性,并且存在于几种不同的同型或异型二聚同工型中。
TGFβ信号通路调节剂或TGFβ调节剂:如本文所用,在本文中可互换使用的术语“TGFβ信号通路调节剂”或“TGFβ调节剂”是指能够调节TGFβ信号通路(例如,具有抑制、阻断或中和作用)的分子(例如抗体或其片段),并且所述分子可结合TGFβ本身或其可与细胞上的TGFβ受体结合。在任一情况下,所述调节剂抑制了TGFβ信号通路(例如,通过结合细胞因子(即TGFβ)本身或通过结合TGFβ的受体)。因此,此术语涵盖了结合TGFβ和结合TGFβ受体的两种类型调节剂。在本文所述的多个实施方案中,TGFβ信号通路调节剂在经修饰的免疫细胞(例如CAR-T细胞)中与嵌合抗原受体一起表达。表达这类TGFβ信号通路调节剂的CAR-T细胞在本文中被称为TGFβ装甲化CAR-T细胞。
治疗:如本文所用,术语“治疗(treat)”或“治疗(treatment)”定义为将治疗剂施用于受试者,例如患者,或施用(例如通过施加)于从受试者中分离并返回至所述受试者的组织或细胞中。在一些实施方案中,所述治疗剂为装甲化CAR-T细胞(例如共表达TGFβ调节剂的工程化CAR T细胞)。治疗可为治愈、疗愈、缓解、减轻、改变、补救、改善、缓和、改进或影响病症、病症的症状或病症(例如癌症)的倾向。尽管不希望受理论束缚,但据认为治疗可在体外或体内引起细胞的抑制、消融或杀伤,或以其他方式降低细胞(例如异常细胞)介导病症,例如本文所述的病症(例如癌症)的能力。
本文所述的发明以“有效量”用于治疗性、防治性或预防性治疗。本文所述的装甲化CAR-T细胞(例如,共表达CAR和TGFβ信号传导调节剂的工程化细胞)的治疗有效量是可改善或降低一种或多种疾病症状或预防或治愈疾病(例如癌症)的有效量。
可变区或结构域:如本文所用,术语抗体的“可变区”或“可变结构域”是指抗体的重链或轻链的氨基末端结构域。重链和轻链的可变结构域可分别称为“VH”和“VL”。这些结构域通常是抗体中变化最大的部分(相对于同一类别的其他抗体)并包含抗原结合位点。仅重链的抗体具有单一重链可变区。
载体:如本文所用,术语“载体”是指能够传送与其连接的另一核酸的核酸分子。一种载体类型为“质粒”,其是指环状双链DNA环,其中可接合额外的DNA区段。另一种载体类型为病毒载体,其中额外的DNA区段可接合至病毒基因组中。某些载体能够在它们被引入的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体)。其他载体(例如,非附加型哺乳动物载体)可在引入宿主细胞后整合至宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够引导与其可操作地连接的基因的表达。此类载体在本文中称为“表达载体”。
具体实施方式
本发明提供使用了以调节TGFβ信号传导的多肽装甲化的经修饰的免疫细胞(例如CAR-T细胞)来增强对癌症的免疫反应的方法和组合物。本发明不限于所述的特定方法和实验条件,因为此类方法和条件可变化。还应理解,本文中所用的术语仅用于描述特定实施方案的目的,而非用于限制,除非指明,因为本发明的范围将仅受所附权利要求限制。
TGF-B/SMAD信号传导
转化生长因子β(TGF-β)是一种多功能细胞因子,最初以其将正常纤维母细胞转化为能够不依赖锚固生长的细胞的能力而命名。TGF-β信号传导控制了控制许多关键的细胞功能,包括增殖、分化、存活、迁移和上皮间质转化。其调节多种生物过程,例如细胞外基质形成、伤口愈合、胚胎发育、骨骼发育、造血、免疫和炎性反应,以及恶性转化。TGF-β的失调导致病理状况,例如出生缺陷、癌症、慢性炎症、以及自身免疫与纤维化疾病。
TGF-β主要由造血和肿瘤细胞产生,其可调节(即刺激或抑制)来自多种正常和肿瘤性组织来源的细胞的生长与分化(Spom等人,Science,233:532(1986)),并且刺激各种基质元件的形成与发展。TGF-β参与许多增殖性和非增殖性细胞过程,例如细胞增殖与分化、胚胎发育、细胞外基质形成、骨发育、伤口愈合、造血、以及免疫和炎性反应。
TGF-β也拥有免疫抑制活性,包括淋巴因子活化杀手细胞(LAK)、细胞毒性T淋巴细胞(CTL)抑制、降低B细胞淋巴细胞生成与κ轻链表达、造血的负调控、肿瘤细胞上HLA-DR表达的下调、以及对响应于B细胞生长因子的抗原活化B淋巴细胞增殖的抑制。许多人类肿瘤和许多肿瘤细胞系会产生TGF-β,表明了使那些肿瘤躲避正常免疫监视的可能机制。加上观察到某些已转化的细胞系已失去了以自分泌方式对于TGF-β会刺激基质形成并减低肿瘤免疫监视的TGF-β作出反应的能力,这种负向免疫调节作用表明有吸引力的赘瘤失调与增殖模型。
由于TGF-β信号传导对于健康细胞与癌症调控都是重要的,因此全身性地靶向TGF-β可造成不想要的副作用。特别就癌症而言,已知TGF-β家族的成员具有许多与肿瘤发生(包括血管生成)与转移相关的生物活性。TGF-β抑制许多细胞类型的增殖,包括毛细管内皮细胞和平滑肌细胞。TGF-β下调整合蛋白表达(涉及内皮细胞迁移的α1β1、α2β1和αvβ3)。整合蛋白涉及所有细胞的迁移,包括转移性细胞。TGF-β下调血管生成与转移所需的基质金属蛋白酶表达。TGF-β诱导血纤维蛋白溶酶原激活物抑制剂,其抑制血管生成与转移所需的蛋白酶级联。TGF-β诱导正常细胞来抑制转化细胞。参见例如Yingling等人,NatureReviews,3(12):1011-1022(2004),其公开了TGF-β的失调涉及多种疾病(包括癌症和纤维化)的发病机制,并且提出理论基础来评价TGF-β信号传导抑制剂作为癌症治疗剂、生物标志物/诊断剂、开发中的小分子抑制剂结构、以及应用于其开发的靶向药物开发模型。
如本文所用,术语“TGF-β信号通路”用于描述归因于TGF-β和TGF-β样配体的下游信号传导事件。例如,在一个信号通路中,TGF-β配体结合于II型TGF-β受体并使其活化。II型TGF-β受体招募并与I型TGF-β受体形成异二聚体。所得的异二聚体允许I型受体的磷酸化,其继而使SMAD蛋白家族的成员磷酸化和活化。如本领域技术人员所熟知,信号传导级联被触发并最终导致对涉及细胞生长、细胞分化、肿瘤形成、细胞凋亡和细胞稳态等的介体表达进行控制。也设想到其他TGF-β信号通路可根据本文所述的方法进行操作。
TGF-β信号通路调节剂
本发明提供了一种免疫调节系统,其包含TGF-β信号传导调节剂(例如调节TGF-β信号传导的多肽或编码调节TGF-β信号传导的多肽的核酸序列)。在一些实施方案中,TGF-β信号传导调节剂在与TGF-β或TGF-β受体结合时会引起细胞反应。在一些实施方案中,TGF-β信号传导调节剂是分泌自细胞。
在多个实施方案中,本发明提供了一起表达嵌合抗原受体与TGF-β信号传导调节剂的经修饰免疫细胞(例如T细胞)。这类调节剂可与TGF-β本身结合或与TGF-β受体结合。表达此类调节剂的CAR-T细胞在本文中被称为TGF-β装甲化CAR-T细胞。
抗TGFβ和抗TGFβR2抗原结合分子
在一些实施方案中,TGF-β信号传导调节剂为抗原结合分子(例如,抗体或其抗原结合片段)。在一些实施方案中,所述抗原结合分子(例如,抗体或其抗原结合片段)特异性地与TGF-β结合。在一些实施方案中,所述抗原结合分子(例如,抗体或其抗原结合片段)特异性地与TGF-β受体(TGFβR)(例如TGFβR1、TGFβR2)结合。
TGF-β信号传导调节剂(例如,抗TGFβ抗体分子或抗TGFβR抗体分子)可包含本文所述的CDR或重链的全部或抗原结合子集。本文所述的抗TGFβ或抗TGFβR2抗原结合剂的示例性氨基酸序列(包括可变区)示于表1中。其他的抗TGFβ或抗TGFβR2抗体也描述于美国专利第7,723,486号和第9,783,604号;美国专利申请公开第US20160017026A1号和第US20180105597号、第US20190119387号;以及国际专利申请第WO2012093125A1号、第WO2011/012609号、第WO 2017/141208 Al号;其每一者的全文特此通过引用并入。在本文所述免疫调节系统中有用的抗原结合剂包括(但不限于)特异性地与抗原(例如TGFβR表位)结合的抗体、例如(Fab′)2的二价片段、例如Fab的单价片段、单链抗体、单链Fv(scFv)、单域抗体、多价单链抗体、双价抗体、三价抗体等。
在一些实施方案中,所述免疫调节系统包含与表1中所提供序列至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的TGF-β信号传导调节剂(例如,抗TGFβ或抗TGFβR2抗原结合剂)。在一些实施方案中,所述免疫调节系统包含有包含一个或多个表1所述抗体或其片段的CDR序列的TGF-β信号传导调节剂。在一些实施方案中,本发明的TGF-b信号传导调节剂包含与表1中所提供的VH序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的重链可变区氨基酸序列。在一些实施方案中,TGF-β信号传导调节剂的VH为单域抗体(VH)。
在一些实施方案中,TGF-β信号传导调节剂包含前导序列。在一些实施方案中,所述TGF-β信号传导调节剂为单体。在一些实施方案中,所述TGF-β信号传导调节剂为二聚体。在一些实施方案中,所述TGF-β信号传导调节剂为三聚体。
在一些实施方案中,所述TGF-β信号传导调节剂包含串联连接结构域的接头。在一些实施方案中,所述接头包含GGGGS(SEQ ID NO:59)。在一些实施方案中,所述接头包含(GGGGS)
在一些实施方案中,所述TGF-β信号传导调节剂包含与表1所提供的VL序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的轻链可变区氨基酸序列。在一些实施方案中,本发明的抗TGFβ抗原结合剂包含与表1所提供的VH序列同一的重链可变区氨基酸序列。
在一些实施方案中,本发明的TGF-β信号传导调节剂包含与表1所提供的vH序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的重链可变区氨基酸序列。在一些实施方案中,本发明的TGF-β信号传导调节剂包含与表1所提供的vH序列同一的重链可变区氨基酸序列。
在一些实施方案中,所述TGF-β信号传导调节剂(例如,单域抗体)的VH包含与表1所提供者至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的前导序列。在一些实施方案中,所述vH抗TGFβ抗原结合剂(例如,单域抗体)包含表1所提供的前导序列。
表1.示例性抗TGFβ和抗TGFβR2抗原结合分子
/>
/>
/>
/>
/>
在一些实施方案中,所述抗TGFβ或抗TGFβR抗原结合剂为抗体。天然存在的哺乳动物抗体的典型结构单元为四聚体。每个四聚体由两对多肽链组成,每对具有一条“轻”链(约25kDa)和一条“重”链(约50-70kDa)。每条链的氨基末端部分包括主要负责抗原识别的约100至110个或更多个氨基酸的可变区。每条链的羧基末端部分限定主要负责效应功能的恒定区。人类轻链可分为κ和λ轻链。重链可分为μ、δ、γ、α或ε,并将抗体的同种型分别定义为IgM、IgD、IgG、IgA和IgE。在轻链和重链内,可变区和恒定区由约12个或更多个氨基酸的“J”区连接,其中重链还包括约10个以上的氨基酸的“D”区。通常参见Fundamental Immunology第7章(Paul,W.编,第2版,Raven Press,N.Y.(1989))。每个轻/重链对的可变区形成抗体结合位点。抗TGFβ抗体分子的优选同种型为IgG免疫球蛋白,其可分为四种亚型,IgG1、IgG2、IgG3和IgG4,各具有不同的γ重链。大多数治疗性抗体为IgG1类型的人类、嵌合或人源化抗体。在一个特定实施方案中,所述抗TGFβ抗体分子具有IgG1同种型。
每个重链和轻链对的可变区形成抗原结合位点。因此,完整的IgG抗体具有两个相同的结合位点。然而,双功能或双特异性抗体为人工杂交构建体,其具有两个不同的重/轻链对,产生两个不同的结合位点。
所述链都表现出由三个高变区(也称为互补决定区或CDR)连接的相对保守框架区(FR)的相同一般结构。来自每对两条链的CDR通过框架区对齐,而能够与特异性表位结合。从N末端到C末端,轻链和重链均包含结构域FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。每个结构域的氨基酸是依据下列文献的定义指定:Kabat Sequences of Proteins ofImmunological Interest(National Institutes of Health,Bethesda,Md.(1987和1991))或Chothia和Lesk J.Mol.Biol.196:901-917(1987);Chothia等人,Nature 342:878-883(1989)。如本文所用,CDR是指重链(HCDR1、HCDR2、HCDR3)和轻链(LCDR1、LCDR2、LCDR3)中的每一者。
因此,在一个实施方案中,所述抗体分子包括以下中的一者或两者:
(a)上述人类杂交瘤、选定淋巴细胞或鼠类抗体中的一者的轻链CDR(LCDR1、LCDR2和/或LCDR3)的一个、两个、三个或抗原结合数。在实施方案中,所述CDR可包含如下的LCDR1-3的一个或多个或全部的氨基酸序列:LCDR1或经修饰的LCDR1,其中一至七个氨基酸经保守性取代;LCDR2或经修饰的LCDR2,其中一个或两个氨基酸经保守性取代;或LCDR3或经修饰的LCDR3,其中一个或两个氨基酸经保守性取代;以及
(b)上述人类杂交瘤、选定淋巴细胞或鼠类抗体中的一者的重链CDR(HCDR1、HCDR2和/或HCDR3)的一个、两个、三个或抗原结合数。在实施方案中,CDR可包含如下的HCDR1-3中的一个或多个或全部的氨基酸序列:HCDR1或经修饰的HCDR1,其中一个或两个氨基酸经保守性取代;HCDR2或经修饰的HCDR2,其中一至四个氨基酸经保守性取代;或HCDR3或经修饰的HCDR3,其中一个或两个氨基酸经保守性取代。
在一些实施方案中,本发明的抗TGFβ抗体分子或抗TGFβR(例如,抗TGFβR2)抗体分子可使表达TGFβ的细胞(例如肿瘤细胞)产生抗体依赖性细胞毒性(ADCC)。由于其具有结合至Fc受体的能力,具有IgG1和IgG3同种型的抗体可用于引发抗体依赖性细胞毒性能力的效应功能。具有IgG2和IgG4同种型的抗体可用于使ADCC反应最小化,因为它们结合Fc受体的能力低。在相关实施方案中,可在抗体Fc区进行取代或糖基化组成的变化,例如通过在经修饰的真核细胞系中生长,以增强Fc受体识别、结合和/或介导抗TGFβ抗体或抗TGFβR(例如,抗TGFβR2)抗体结合的细胞的细胞毒性(参见例如美国专利第7,317,091号、第5,624,821号和包括WO 00/42072的公开,Shields等人,J.Biol.Chem.276:6591-6604(2001),Lazar等人,Proc.Natl.Acad.Sci.U.S.A.103:4005-4010(2006),Satoh等人,Expert OpinBiol.Ther.6:1161-1173(2006))。在某些实施方案中,抗体或抗原结合片段(例如,人源化抗体、人类抗体)可包括改变或裁剪功能(例如,效应功能)的氨基酸取代或置换。例如,人类来源恒定区(例如,γ1恒定区、γ2恒定区)可设计为降低补体活化和/或Fc受体结合。(参见例如美国专利第5,648,260号(Winter等人)、美国专利第5,624,821号(Winter等人)和美国专利第5,834,597号(Tso等人),其全部教导通过引用整体并入本文)。优选地,含有此类氨基酸取代或置换的人类来源恒定区氨基酸序列,与人类来源的未经改变恒定区的氨基酸序列在全长上至少约95%同一,更优选地,与人类来源的未经改变恒定区的氨基酸序列在全长上至少约99%同一。额外的抗TGFβ抗原结合分子进一步描述于美国专利第8,785,600号(Nam等人)中,其全部教导通过引用并入本文。
在又一个实施方案中,效应功能还可通过调节抗体的糖基化模式来改变。改变是指删除抗体中发现的一个或多个糖类部分,和/或添加一个或多个在抗体中不存在的糖基化位点。例如,在美国专利申请公开第2003/0157108号(Presta)中描述了具有增强的ADCC活性和成熟的糖类结构的抗体,所述结构缺乏连接到抗体Fc区的岩藻糖。还参见美国专利申请公开第2004/0093621号(Kyowa Hakko Kogyo Co.,Ltd)。Glycofi还开发出能够产生抗体特异性糖型的酵母细胞系。
另外地或替代地,可制备具有糖基化类型改变的抗体,例如具有降低量的岩藻糖基残基的低岩藻糖基化抗体、或具有增加的等分GlcNac结构的抗体。此种改变的糖基化模式已被证明可增加抗体的ADCC能力。此类糖类修饰可通过例如在具有经改变的糖基化机制的宿主细胞中表达所述抗体而实现。本领域已描述具有改变的糖基化机制的细胞,并且可用作宿主细胞,其中经工程化以表达本发明的重组抗体,从而产生具有改变的糖基化的抗体。例如,EP 1,176,195(Hang等人)描述了具有功能被破坏的FUT8基因的细胞系,所述基因编码岩藻糖基转移酶,使得在此类细胞系中表达的抗体表现出低岩藻糖基化。PCT公开第WO03/035835号(Presta)描述了一种变异性CHO细胞系,即Lec13细胞,其将岩藻糖连接至Asn(297)连接糖类上的能力降低,也导致在所述宿主细胞中表达的抗体呈现低岩藻糖基化(也参见Shields,R.L.等人,2002J.Biol.Chem.277:26733-26740)。PCT公开第WO 99/54342号(Umana等人)描述了经工程化以表达糖蛋白修饰糖基转移酶(例如,β(1,4)-N乙酰葡糖氨基转移酶III(GnTIII))的细胞系,使得在所述工程化细胞系中表达的抗体表现出增加的二等分GlcNac结构,这导致抗体的ADCC活性增加(也参见Umana等人,1999Nat.Biotech.17:176-180)。
人源化抗体还可使用CDR移植方法制备。产生此类人源化抗体的技术是本领域中已知的。通常,人源化抗体是通过获得编码与TGFβ结合的抗体的可变重链和可变轻链序列的核酸序列、鉴定所述可变重链和可变轻链序列中的互补决定区或“CDR”,并将所述CDR核酸移植至人类框架核酸序列上而产生。(参见例如美国专利第4,816,567号和第5,225,539号)。CDR和框架残基的位置可确定(参见Kabat,E.A.等人(1991)Sequences of Proteinsof Immunological Interest,第五版,U.S.Department of Health and Human Services,NIH出版号91-3242,以及Chothia,C.等人,J.Mol.Biol.196:901-917(1987))。
在一些实施方案中,本发明的免疫调节系统包含编码来自表1中所述抗体分子的CDR的抗TGFβ或抗TGFβR抗体分子的核酸序列。在一些实施方案中,来自表1的序列可并入用于本文所述治疗方法(例如,免疫调节系统、免疫反应性细胞或包含其的治疗方法)的识别TGFβ或TGFβR的分子中。选出的人类框架为一种适合体内施用的框架,这意味着它不表现出免疫原性。例如,此种决定可经由此类抗体的体内使用和氨基酸相似性研究的先前经验而进行。适宜框架区可选自如下人类源抗体:其在供体抗体(例如抗TGFβ抗体分子)的等效部分(例如框架区)的氨基酸序列内的框架区长度上具有至少约65%氨基酸序列同一性,并且优选地至少约70%、80%、90%或95%氨基酸序列同一性。可使用合适的氨基酸序列比对算法,例如CLUSTAL W,使用预设参数来决定氨基酸序列同一性。(Thompson J.D.等人,Nucleic Acids Res.22:4673-4680(1994))。
一旦鉴定出待人源化的克隆抗体的CDR和FR,便可鉴定出编码所述CDR的氨基酸序列,并将相对应的核酸序列移植到选定的人类FR上。这可使用已知的引物和接头来进行,其选择是本领域中已知的。特定人类抗体的所有CDR可被非人类CDR的至少一部分代替,或者仅一些CDR可被非人类CDR代替。仅需要代替所述人源化抗体与预定抗原结合所需的CDR数量。在CDR移植到选定的人类FR上后,所得的“人源化”可变重链和可变轻链序列经表达,以产生与TGFβ或TGFβR结合的人源化Fv或人源化抗体。优选地,经CDR移植的(例如,人源化的)抗体以与供体抗体的亲和力相似、基本上相同或更好的亲和力与TGFβ或TGFβR结合。通常,所述人源化可变重链和轻链序列表达为具有人类恒定结构域序列的融合蛋白,因此获得与TGFβ结合的完整抗体。然而,可产生不包含所述恒定序列的人源化Fv抗体。
其中特定氨基酸已经取代、删除或添加的人源化抗体也在本发明的范围内。特别地,人源化抗体可在框架区中具有氨基酸取代,例如以改进与抗原的结合。例如,经选定、小数目的人源化免疫球蛋白链的接受者框架残基,可被相对应的供体氨基酸代替。取代位置包括与CDR相邻的氨基酸残基,或能够与CDR相互作用的氨基酸残基(参见例如美国专利第5,585,089号或第5,859,205号)。接受者框架可为成熟的人类抗体框架序列或共有序列。如本文所用,术语“共有序列”是指在相关家族成员中的某一区域的序列的每个位置处最常见的或由最普通的残基设计的序列。有多种人类抗体共有序列可使用,包括人类可变区不同亚群的共有序列(参见Kabat,E.A.等人,Sequences of Proteins of ImmunologicalInterest,第五版,U.S.Department of Health and Human Services,U.S.GovernmentPrinting Office(1991))。Kabat数据库和其应用可在线免费获得,例如经由马里兰州贝塞斯达的国家生物技术信息中心(National Center for Biotechnology Information,Bethesda,Md.)的IgBLAST(也参见Johnson,G.和Wu,T.T.,Nucleic Acids Research 29:205-206(2001))。
在某些实施方案中,所述TGFβ或TGFβR抗体分子为人类抗TGFβ或抗TGFβR IgG1抗体。由于此类抗体具有与TGFβ或TGFβR分子所希望的结合,因此此类抗体中的任一者都可容易地进行同种型转换,以产生人类IgG4同种型,例如,同时仍具有相同的可变区(其限定所述抗体的特异性和亲和力,在一定程度上)。因此,当产生满足如上文所讨论的希望“结构”属性的抗体候选物时,它们通常可提供至少某些经由同种型转换所希望的额外“功能”属性。
单链抗体
单链抗体缺乏其所源自的完整抗体的一些恒定结构域或所有恒定结构域。因此,它们可克服一些与使用完整抗体相关的问题。例如,单链抗体倾向于不含有重链恒定区与其他生物分子之间的某些不想要的相互作用。另外,单链抗体显著小于完整抗体并且与完整抗体相比可具有较大渗透性,使得单链抗体更有效地定位并结合于靶抗原结合位点。此外,与完整抗体相比,单链抗体的相对较小的尺寸使其不太可能在接受者中引发不当免疫反应。
在一些实施方案中,所述TGFβ信号传导调节剂为特异性结合至TGFβ的单链抗原结合分子(例如scFv)。在一些实施方案中,所述TGFβ信号传导调节剂为特异性地与TGF-B受体(TGFβR)(例如TGFβR1、TGFβR2)结合的单链抗原结合分子(例如scFv)。
多个单链抗体(每个单链具有由第一肽接头所共价键联的一个VH和一个VL结构域)可通过至少一个或多个肽接头而共价键联,以形成多价单链抗体,并且其可以是单特异性或多特异性的。多价单链抗体的每一个链都包括可变轻链片段和可变重链片段,并且通过肽接头而键联到至少另一个链。所述肽接头由至少15个氨基酸残基组成。接头氨基酸残基的最大数目大约为100个。
两个单链抗体可经组合以形成也称为二价二聚物的双价抗体。双价抗体具有两条链和两个结合位点,并且可具有单特异性或双特异性。双价抗体的每条链包括与VL结构域连接的VH结构域。所述结构域与足够短的接头连接以防止在相同链上的结构域之间配对,由此促使不同链上的互补结构域之间配对,从而再产生两个抗原结合位点。
三个单链抗体可经组合以形成也称为三价三聚物的三价抗体。三价抗体由VL或VH结构域的氨基酸末端与VL或VH结构域的羧基末端直接融合(即无任何接头序列)而构成。三价抗体具有三个Fv头部,其中多肽以环状、头接尾方式排列。一种可能的三价抗体构象为平面的,其中三个结合位点以彼此成120度的角度位于一个平面中。三价抗体可具有单特异性、双特异性或三特异性。
单域抗体
单域抗体(sdAb)与常规4链抗体的不同之处在于具有单一单体抗体可变结构域。例如,骆驼科动物和鲨鱼产生称为仅重链的抗体(HcAb)的sdAb,其天生缺乏轻链。骆驼源化仅重链抗体的每个臂中的抗原结合片段具有单一重链可变结构域(VHH),它可以在没有轻链帮助的情况下对抗原具有高亲和力。骆驼源化VHH被称为最小的功能性抗原结合片段,分子量大约为15kD。
本申请的一个方面提供了一种特异性地结合至TGFβR(例如人类TGFβR2)的经分离单域抗体(本文称为“抗TGFβR sdAb”)。在一些实施方案中,所述抗TGFβR sdAb调节TGFβ活性。在一些实施方案中,所述抗TGFβR sdAb为拮抗剂抗体。进一步提供衍生自本文所述任一抗TGFβR sdAb的抗原结合片段,以及包含本文所述任一抗TGFβR sdAb的抗原结合蛋白。在一些实施方案中,所述抗TGFβR sdAb包含表1中提供的一个、二个和/或三个CDR序列。示例性抗TGFβR sdAb提供于表1中。
在一些实施方案中,一些或所有的CDR序列、重链,可用于另一抗原结合剂中,例如用于CDR移植、人源化或嵌合抗体分子中。实施方案包括包含足够的CDR(例如来自上述重链可变区之一的所有三个CDR)的抗体分子以使其与TGFβ结合。
在一些实施方案中,所述CDR(例如所有的HCDR)嵌入人类或人类衍生的框架区中。人类框架区的实例包括人类种系(germline)框架序列、已亲和力成熟化(体内或体外)的人类种系序列,或合成的人类序列,例如共有序列。在一个实施方案中,所述重链框架为IgG1或IgG2框架。
在一些实施方案中,本发明的TGFβ调节剂包含表1中提供的重链可变区氨基酸序列。在一些实施方案中,所述抗TGFβ抗原结合剂为仅具单域重链的抗体(例如,不包含免疫球蛋白轻链的抗原结合剂)。
用于体内治疗或诊断用途的抗体片段可受益于增强其血清半衰期的修饰。旨在用于增加所述抗体的体内血清半衰期的有机部分可包括一个、两个或更多个线性或分支部分,其选自:亲水性聚合物基团(例如,线性或分支聚合物(例如,聚烷二醇如聚乙二醇、单甲氧基-聚乙二醇等)、糖类(例如葡聚糖、纤维素、多糖等)、亲水性氨基酸的聚合物(例如聚赖氨酸、聚天冬氨酸等)、聚烷烃氧化物和聚乙烯吡咯烷酮)、脂肪酸基团(例如单羧酸或二羧酸)、脂肪酸酯基团、脂质基团(例如二酰基甘油基团、神经鞘脂基团(例如神经酰胺基))或磷脂基团(例如,磷脂酰乙醇胺基团)。优选地,所述有机部分结合至预定位点,与未缀合抗体部分相比,在所述位点处有机部分不会损害所得免疫缀合物的功能(例如,降低抗原结合亲和力)。所述有机部分可具有约500Da至约50,000Da,优选约2000、5000、10,000或20,000Da的分子量。用有机部分修饰多肽(例如抗体)的实施例和方法可见于例如美国专利第4,179,337号和第5,612,460号、PCT公开第WO 95/06058号和第WO 00/26256号,以及美国专利申请公开第20030026805号。
TGFβR胞外结构域
预期用于本文所述免疫调节系统的TGF-β受体可为任何TGF-β受体,包括来自活化素样激酶家族(ALK)、骨形态发生蛋白(BMP)家族、Nodal家族、生长和分化因子家族(GDF)、和TGF-β受体家族的受体。TGF-β受体为影响细胞中各种生长和分化途径的丝氨酸/苏氨酸激酶受体。在一些实施方案中,TGFβ信号传导调节剂为TGFβ受体(例如TGFβR1、TGFβR2)的工程化重组胞外结构域(ECD)。在一些实施方案中,可用于本文所述免疫调节系统的TGF-β受体为II型TGF-β受体(例如TGF-βR2)。
在一些实施方案中,所述TGFβ调节剂包含表2所提供的TGFβR。在一些实施方案中,所述TGFβ调节剂包含与表2所提供的序列至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%同一的序列。
表2.示例性TGFβR胞外结构域
/>
嵌合抗原受体
在一些方面,本发明提供了一种包含TGF-β信号传导调节剂(例如调节TGF-β信号传导的多肽或编码调节TGF-β信号传导的多肽的核酸序列)以及可与所关注抗原结合的嵌合抗原受体(CAR)的免疫调节系统。CAR是包含三个基本单元的杂合分子:(1)胞外抗原结合基序,(2)连接/跨膜基序,和(3)胞内T细胞信号传导基序(Long AH,Haso W M,Orentas RJ.Lessons learned from a highly-active CD22-specific chimeric antigenreceptor.Oncoimmunology.2013;2(4):e23621)。在一些实施方案中,本发明的CAR从N末端至C末端包含信号或前导肽、抗原结合结构域、跨膜和/或铰链结构域、共刺激结构域和胞内结构域。在一些实施方案中,CAR为“第一代CAR”,例如包括在抗原结合时仅提供CD3ζ信号的CAR。“第二代CAR”包括同时提供共刺激(例如CD28或CD137)与活化(CD3ζ)的CAR。“第三代CAR”包括提供多重共刺激(例如CD28和CD137)与活化(CD3)的CAR。在多个实施方案中,CAR经选择以对于抗原具有高亲和力或亲合力。
CAR的抗原结合基序通常在单链片段可变结构域(ScFv)、免疫球蛋白(Ig)分子的最小结合结构域或单域抗体之后形成(例如,WO2018/028647A1)。替代的抗原结合基序,例如受体配体(即,IL-13已经工程化以与肿瘤表达IL-13受体结合)、完整的免疫受体、文库衍生肽、和先天免疫系统效应分子(例如NKG2D)也经工程化。用于CAR表达的替代细胞靶标(例如NK或γ-δT细胞)也在开发中(Brown C E等人,Clin Cancer Res.2012;18(8):2199-209;Lehner M等人,PLoS One.2012;7(2):e31210)。
在一些实施方案中,所述CAR的抗原结合结构域为单链可变片段。在一些实施方案中,所述CAR的抗原结合结构域为单域抗体。在一些实施方案中,所述CAR从N末端到C末端包含信号或前导肽、vH、CD28跨膜和铰链、CD28共刺激结构域、和CD3ζ胞内结构域。
CAR的连接基序可为相对稳定的结构域,例如IgG的恒定结构域,或被设计为延伸的柔性接头。结构基序,例如衍生自IgG恒定结构域的那些,可用于将ScFv结合结构域延伸远离T细胞膜表面。这对于结合结构域特别靠近肿瘤细胞表面膜的某些肿瘤靶标可能很重要(例如二唾液酸神经节苷脂GD2;Orentas等人,未发表的观测结果)。迄今为止,CAR中使用的信号传导基序始终包括CD3-ζ链,因为此核心基序是T细胞活化的关键信号。首个报告的第二代CAR具有CD28信号传导结构域和CD28跨膜序列。此基序也用于含有CD137(4-1BB)信号传导基序的第三代CAR中(Zhao Y等人,J Immunol.2009;183(9):5563-74)。随着新技术的出现,以与抗CD3和抗CD28抗体键联的珠粒活化T细胞,以及来自CD28的经典“信号2”的出现,不再需要由CAR本身编码。使用珠粒活化,发现第三代载体在体外测定中并不优于第二代载体,并且它们在白血病小鼠模型中没有明显优于第二代载体(Haso W,Lee D W,Shah NN,Stetler-Stevenson M,Yuan C M,Pastan I H,Dimitrov D S,Morgan R A,FitzGeraldD J,Barrett D M,Wayne A S,Mackall C L,Orentas R J.Anti-CD22-chimeric antigenreceptors targeting B cell precursor acute lymphoblastic leukemia,Blood.2013;121(7):1165-74;Kochenderfer J N等人,Blood.2012;119(12):2709-20)。第二代CD28/CD3-ζ中的CD19特异性CAR(Lee D W等人,American Society of Hematology AnnualMeeting.New Orleans,La.;Dec.7-10,2013)和CD137/CD3-ζ信号传导格式(Porter D L等人,N Engl J Med.2011;365(8):725-33)的临床成功证明了这一点。除了CD137,其他肿瘤坏死因子受体超级家族成员如OX40也能够在CAR转导的T细胞中提供重要的持续信号(YvonE等人,Clin Cancer Res.2009;15(18):5852-60)。同样重要的是培养CAR T细胞群体的培养条件。
CAR的特征包括其以非MHC限制的方式,将T细胞特异性和反应性重新导向至所选目标,和利用单克隆抗体的抗原结合特性的能力。非MHC限制性抗原识别使表达CAR的T细胞能够识别与抗原加工无关的抗原,因此绕过肿瘤逃逸的主要机制。此外,当在T细胞中表达时,CAR会有利地不使外源性T细胞受体(TCR)α和β链进行二聚化。
胞外结构域
如本文中所描述,所述CAR包含靶标特异性结合元件,其也被称为抗原结合结构域或部分。结构域的选择取决于定义靶细胞表面的配体的类型和数目。例如,可选择所述抗原结合结构域来识别与特定疾病状态(例如癌症)相关的在靶细胞上作为细胞表面标志物的配体(例如癌症抗原)。因此,在CAR中可作为抗原结合结构域的配体的细胞表面标志物的实例包括与病毒性、细菌性和寄生虫感染、自身免疫疾病和癌细胞相关的那些。
在一些实施方案中,CAR的胞外结构域包含特异性地与癌症抗原结合的抗原结合剂。在某些实施方案中,CAR与肿瘤抗原结合。可将任何肿瘤抗原(抗原肽)用于本文所述的肿瘤相关实施方案中。抗原来源包括(但不限于)癌症蛋白。抗原可表达为肽或完整蛋白或其部分。完整蛋白或其部分可为天然或经诱变的。肿瘤抗原的非限制性实例包括碳酸酐酶IX(CA1X)、癌胚抗原(CEA)、CD8、CD7、CD 10、CD 19、CD20、CD22、CD30、CD33、CLL1、CD34、CD38、CD41、CD44、CD49f、CD56、CD74、CD133、CD138、CD123、CD44V6、巨细胞病毒(CMV)感染细胞的抗原(例如,细胞表面抗原)、上皮糖蛋白-2(EGP-2)、上皮糖蛋白-40(EGP-40)、上皮细胞粘附分子(EpCAM)、受体酪氨酸蛋白激酶erb-B2,3,4(erb-B2,3,4)、叶酸结合蛋白(FBP)、胎儿乙酰胆碱受体(AChR)、叶酸受体-a、神经节苷脂G2(GD2)、神经节苷脂G3(GD3)、鸟苷酸环化酶(Guanylyl cyclase)C(GCC)、人类表皮生长因子受体2(ITER-2)、人类端粒酶反转录酶(hTERT)、白细胞介素13受体亚基α-2(IL-l3Rcx2)、k-轻链、激酶插入结构域受体(KDR)、Lewis Y(LeY)、Ll细胞粘附分子(L1CAM)、黑色素瘤抗原家族A,1(MAGE-A1)、粘蛋白16(MUC16)、粘蛋白1(MUC1)、间皮素(MSLN)、ERBB2、MAGEA3、p53、MARTl,GPl00、蛋白酶3(PR1)、酪氨酸酶、存活蛋白、hTERT、EphA2、NKG2D配体、癌症-睾丸抗原NY-ES0-1、肿瘤胚胎抗原(h5T4)、前列腺干细胞抗原(PSCA)、前列腺特异性膜抗原(PSMA)、PTK7 ROR1、肿瘤相关糖蛋白72(TAG-72)、血管内皮生长因子R2(VEGF-R2)、和Wilms肿瘤蛋白(WT-l)、BCMA、NKCS1、EGF1R、EGFR-VIII、CD99、CD70、ADGRE2、CCR1、LILRB2、PRAME CCR4、CD5、CD3、TRBC1、TRBC2、TIM-3、整联蛋白B7、ICAM-l、CD70、Tim3、CLEC12A和ERBB。
在某些实施方案中,所述CAR与CD19多肽结合。在某些实施方案中,所述CAR与人类CD19多肽结合。在某些实施方案中,所述CAR与CD19蛋白的胞外结构域结合。在某些实施方案中,所述CD19 CAR包含表3所提供的序列。
在某些实施方案中,所述CAR与GCC多肽结合。在某些实施方案中,所述CAR与人类GCC多肽结合。在某些实施方案中,所述CAR与GCC蛋白的胞外结构域结合。在某些实施方案中,所述抗GCC CAR包含表3中提供的序列。
在某些实施方案中,所述CAR与间皮素多肽结合。在某些实施方案中,所述CAR与人类间皮素多肽结合。在某些实施方案中,所述CAR与间皮素蛋白的胞外结构域结合。
在某些实施方案中,所述CAR与病原体抗原结合,以例如用于治疗和/或预防例如免疫功能低下的受试者中的病原体感染或其他感染性疾病。病原体的非限制性实例包括病毒、细菌、真菌、寄生虫和能够引起疾病的原生动物。
病毒的非限制性实例包括反转录病毒科(例如人类免疫缺陷病毒,例如HIV-l(也称为HDTV-III、LAVE或HTLV-IIELAV、或HIV-III;以及其它分离株,例如HIV-LP);小核糖核酸病毒科(例如小儿麻痹病毒、甲型肝炎病毒、肠病毒、人类柯萨奇病毒、鼻病毒、埃可病毒(echovirus));杯状病毒科(例如引起肠胃炎的菌株);披衣病毒科(例如马脑炎病毒、德国麻疹病毒);黄病毒科(例如登革热病毒、脑炎病毒、黄热病毒);冠状病毒科(例如冠状病毒);杆状病毒科(例如水疱性口炎病毒、狂犬病病毒);丝状病毒科(例如埃博拉病毒);副粘液病毒科(例如副流感病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒);正粘液病毒科(例如流行性感冒病毒);布尼亚病毒科(Bungaviridae)(例如汉江病毒、班加(bunga)病毒、白蛉病毒属病毒(phlebovirus)和奈拉(Naira)病毒);沙状病毒科(出血热病毒);呼肠孤病毒科(例如呼肠孤病毒、环状病毒(orbivirus)和轮状病毒);双核糖核酸病毒科;肝炎病毒科(乙型肝炎病毒);细小病毒科(Parvoviridae)(细小病毒);乳多瘤病毒科(乳头状瘤病毒、多瘤病毒);腺病毒科(大多数腺病毒);疱疹病毒科(单纯疱疹病毒(HSV)1和2、水痘带状疱状病毒、巨细胞病毒(CMV)、疱疹病毒);痘病毒科(天花病毒、牛痘病毒、痘病毒);和虹彩病毒科(例如非洲猪瘟病毒);以及未分类的病毒(例如δ肝炎的病原体(被认为是乙型肝炎病毒的缺失性卫星)、非A非B型肝炎的病原体(第1类=内部传播;第2类=经肠胃外传播(即丙型肝炎);诺沃克(Norwalk)和相关病毒,以及星状病毒)。
细菌的非限制性实例包括巴斯德杆菌、葡萄球菌、链球菌、大肠杆菌、假单胞菌和沙门氏菌。感染性细菌的具体实例包括但不限于幽门螺杆菌、伯氏疏螺旋体(Boreliaburgdorferi)、嗜肺军团菌(Legionell a pneumophilia)、分枝杆菌属(例如结核分枝杆菌(M.tuberculosis)、鸟分枝杆菌(M.avium)、胞内分枝杆菌(M.intracellulare)、堪萨斯分枝杆菌(M.kansaii)、戈登分枝杆菌(M.gordonae))、金黄色葡萄球菌、淋病奈瑟菌(Neisseria gonorrhoeae)、脑膜炎奈瑟菌(Neisseria meningi tidis)、单核细胞增生李斯特菌、化脓性链球菌(A组链球菌)、无乳链球菌(B组链球菌)、链球菌(草绿色组)、粪链球菌、牛链球菌、链球菌(厌氧属)、肺炎链球菌、致病性弯曲杆菌属、肠球菌属、流感嗜血杆菌、炭疽杆菌、白喉杆菌、棒状杆菌属、红斑丹毒丝菌、产气荚膜梭菌(Clostridiumperfringers)、破伤风梭菌、产气肠杆菌、克雷伯氏肺炎杆菌、多杀性巴斯德杆菌(Pasturella multocida)、类杆菌属、具核梭杆菌(Fusobacterium nucleatum)、念珠状链杆菌(Streptobacillus mon iliformis)、梅毒螺旋体(Treponema palladium)、细弱螺旋体、钩端螺旋体、立克次氏体和以色列放线菌(Actinomyces israelii)。
在某些实施方案中,病原体抗原为存在于巨细胞病毒(CMV)中的病毒抗原、存在于爱泼斯坦巴尔病毒(Epstein Barr Virus,EBV)中的病毒抗原、存在于人类免疫缺陷病毒(HIV)中的病毒抗原、或存在于流感病毒中的病毒抗原。
在某些实施方案中,所述CAR的胞外结构域包含接头。在一些实施方案中,所述接头包含GGGGS(SEQ ID NO:59)。在一些实施方案中,所述接头包含(GGGGS)
在一些实施方案中,所述胞外抗原结合结构域包含IgA抗体、IgG抗体、IgE抗体、IgM抗体、双特异性或多特异性抗体、Fab片段、Fab'片段、F(ab')2片段、Fd'片段、Fd片段、经分离的CDR或其集合;单链可变片段(scFv)、多肽-Fc融合物、单域抗体(sdAb)、骆驼源化抗体;掩蔽抗体、小型模块免疫药物(“SMIPsTM”)、单链、串联双价抗体、VHH、抗运载蛋白、纳米抗体、人源化抗体、微型抗体、BiTE、锚蛋白重复蛋白、DARPIN、Avimer、DART、TCR样抗体、Adnectin、Affilin、穿透抗体;亲和抗体、TrimerX、微型蛋白、Fynomer、Centyrin;以及KALBITOR,或其片段。
在一些实施方案中,所述CAR的胞外抗原结合结构域包含单链可变片段(scFv)。在一些实施方案中,所述CAR的胞外抗原结合结构域包含单域抗体(sdAb)。在一些实施方案中,单域抗体(sdAb),
跨膜结构域
如本文所述,所述CAR包含跨膜结构域。关于跨膜结构域,所述CAR包含与CAR的胞外抗原结合结构域融合的一个或多个跨膜结构域。所述跨膜结构域可衍生自天然或合成来源。如果来源是天然的,则所述结构域可衍生自任何膜结合蛋白或跨膜蛋白。
用于本文所述的CAR中的跨膜区可衍生自(即,包含至少以下跨膜区)T细胞受体的α、β或ζ链、CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、间皮素、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154。或者,所述跨膜结构域可为合成性,在此情况下,它将主要包含疏水性残基,例如亮氨酸和缬氨酸。在一些实施方案中,在合成性跨膜结构域的每一端会发现苯丙氨酸、色氨酸和缬氨酸的三联体。任选地,短寡肽或多肽接头,长度优选在2至10个氨基酸之间,可形成跨膜结构域和CAR的细胞质信号传导结构域之间的键联。在一些实施方案中,所述接头为甘氨酸-丝氨酸双联体或丙氨酸三联体接头。
在一些实施方案中,除了如前述的跨膜结构域之外,还使用天然地与CAR的结构域之一缔合的跨膜结构域。在一些实施方案中,所述跨膜结构域可通过氨基酸取代来选择,以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,由此使与所述受体复合物的其他成员的相互作用最小化。
在一些实施方案中,本发明的CAR中的跨膜结构域为CD28跨膜结构域。在一些实施方案中,所述CD28跨膜结构域包含核酸序列FWVLVVVGGVLACYSLLVTVAFIIFWV SEQ ID NO:42。在一些实施方案中,CD28跨膜结构域包含编码氨基酸序列SEQ ID NO:42的核酸序列。在一些实施方案中,所述跨膜结构域包含的序列具有SEQ ID NO:42的氨基酸序列中至少一个、两个或三个修饰(例如,取代)但不超过20、10或5个修饰(例如,取代),或其序列与SEQID NO:42的氨基酸序列至少95%、96%、97%、98%或99%同一。
在CAR中,间隔子结构域(也称为铰链结构域)可配置在胞外结构域与跨膜结构域之间,或配置在胞内结构域与跨膜结构域之间。间隔子结构域意指任何用于连接跨膜结构域与胞外结构域和/或跨膜结构域与胞内结构域的寡肽或多肽。间隔子结构域包含至多300个氨基酸,优选10至100个氨基酸,并且最优选25至50个氨基酸。
在数个实施方案中,所述接头可包括间隔子元件,当存在时,其增加接头的大小,使得效应分子或可检测标志物与抗体或抗原结合片段之间的距离增加。示例性间隔子为本领域普通技术人员所已知,并且包括在美国专利第7,964,566号、第7,498,298号、第6,884,869号、第6,323,315号、第6,239,104号、第6,034,065号、第5,780,588号、第5,665,860号、第5,663,149号、第5,635,483号、第5,599,902号、第5,554,725号、第5,530,097号、第5,521,284号、第5,504,191号、第5,410,024号、第5,138,036号、第5,076,973号、第4,986,988号、第4,978,744号、第4,879,278号、第4,816,444号和第4,486,414号,以及美国专利公开第20110212088号和第20110070248号中所列的那些,所述文件中每一者都通过引用整体并入本文。
所述间隔子结构域优选具有促进CAR与抗原的结合并提高信号传导至细胞中的序列。预期促进结合的氨基酸的实例包括半胱氨酸、带电氨基酸、和潜在糖基化位点中的丝氨酸和苏氨酸,并且这些氨基酸可用作构成所述间隔子结构域的氨基酸。
在一些实施方案中,所述CAR包含铰链结构域。在一些实施方案中,所述铰链结构域包含核酸序列IEVMYPPPYLDNEKSNGTIIHV KGKHLCPSPLFPGPSKP(SEQ ID NO:41)。在一些实施方案中,所述铰链结构域包含编码氨基酸序列SEQ ID NO:41的核酸序列。在一些实施方案中,所述绞链域包含的序列具有SEQ ID NO:41的氨基酸序列中至少一个、两个或三个修饰(例如,取代)但不超过20、10或5个修饰(例如,取代),或其序列与SEQ ID NO:41的氨基酸序列至少95-99%同一。
在一些实施方案中,所述铰链结构域和跨膜结构域衍生自相同分子。在其他实施方案中,所述铰链和跨膜结构域衍生自不同分子(例如,CD8融合至CD28)。在一些实施方案中,所述CAR包含铰链结构域。在一些实施方案中,所述铰链结构域包含核酸序列IEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVV GGVLACYSLLVTVAFIIFWV(SEQ ID NO:43)。在一些实施方案中,所述铰链结构域包含编码氨基酸序列SEQ ID NO:43的核酸序列。在一些实施方案中,所述绞链域包含的序列具有SEQ ID NO:43的氨基酸序列中至少一个、两个或三个修饰(例如,取代)但不超过20、10或5个修饰(例如,取代)。
胞内结构域
CAR的细胞质结构域或细胞内信号传导结构域负责激活已安置有CAR的免疫细胞的至少一种正常效应功能。术语“效应功能”是指细胞的特殊功能。例如,T细胞的效应功能可为细胞溶解活性或辅助活性,包括细胞因子的分泌。因此,术语“细胞内信号传导结构域”是指转导效应功能信号并引导细胞执行特定功能的蛋白质的一部分。虽然通常可以使用完整细胞内信号传导结构域,但在许多情况下没有必要使用整个链。就使用细胞内信号传导结构域的截短部分而言,此类截短部分可用于代替完整链,只要它能转导效应功能信号即可。因此,术语细胞内信号传导结构域意在包括足以转导效应功能信号的细胞内信号传导结构域的任何截短部分。
用于CAR的细胞内信号传导结构域的实例包括T细胞受体(TCR)和共受体的细胞质序列,其共同作用以在抗原受体接合后启动信号转导,以及这些序列的任何衍生物或变体,和任何具有相同功能的合成序列。仅通过TCR产生的信号不足以完全激活T细胞,还需要次级或共刺激信号。因此,T细胞活化可被称为由两种不同类型的细胞质信号传导序列介导:经由TCR(初级细胞质信号传导序列)起始抗原依赖性初级活化的那些,以及以非抗原依赖性的方式发挥作用以提供次级或共刺激信号(次级细胞质信号传导序列)的那些。
初级细胞质信号传导序列以刺激方式或抑制方式调节TCR复合物的初级活化。以刺激方式作用的初级细胞质信号传导序列可包含信号传导基序,这些基序被称为免疫受体酪氨酸基活化基序或ITAM。本文公开的含有特别用于CAR的初级细胞质信号传导序列的ITAM实例包括衍生自TCRζ(CD3ζ)、FcRγ、FcRβ、CD3γ、CD3δ、CD3ε、CD5、CD22、CD79a、CD79b和CD66d的那些。ITAM的具体非限制性实例包括具有CD3ζ的氨基酸编号51至164(NCBIRefSeq:NP.sub.--932170.1)、Fcε.RI.γ的氨基酸编号45至86(NCBI RefSeq:NP.sub.--004097.1)、Fcε.RI.β的氨基酸编号201至244(NCBI RefSeq:NP.sub.--000130.1)、CD3γ的氨基酸编号139至182(NCBI RefSeq:NP.sub.--000064.1)、CD3δ的氨基酸编号128至171(NCBI RefSeq:NP.sub.--000723.1)、CD3ε的氨基酸编号153至207(NCBI RefSeq:NP.sub.--000724.1)、CD5的氨基酸编号402至495(NCBI RefSeq:NP.sub.--055022.2)、0022的氨基酸编号707至847(NCBI RefSeq:NP.sub.--001762.2)、CD79a的氨基酸编号166至226(NCBI RefSeq:NP.sub.--001774.1)、CD79b的氨基酸编号182至229(NCBI RefSeq:NP.sub.--000617.1)和CD66d的氨基酸编号177至252(NCBI RefSeq:NP.sub.--001806.2)的序列的肽,以及其与这些肽具有相同功能的变体。基于本文所述的NCBI RefSeq ID或GenBank的氨基酸序列信号的氨基酸编号是基于每个蛋白质的前体(包含信号肽序列等)的全长来编号。在一个实施方案中,CAR的细胞质信号传导分子包含衍生自CD3ζ的细胞质信号传导序列。
在一些实施方案中,CAR的胞内结构域可经设计以包含CD3-ζ信号传导结构域本身,或与CAR的上下文中可用的任何其他所需的细胞质结构域结合。例如,CAR的胞内结构域可包含CD3ζ链部分和共刺激信号传导区。所述共刺激信号传导区是指包含共刺激分子的胞内结构域的CAR的一部分。共刺激分子为抗原受体或其配体以外的细胞表面分子,其为淋巴细胞对抗原产生有效反应所必需。此类共刺激分子的实例包括CD27、CD28、4-1BB(CD137)、OX40、CD30、CD40、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1)、CD2、CD7、LIGHT、NKG2C、B7-H3和特异地与CD83结合的配体等。此类共刺激分子的具体非限制性实例包括具有下列序列的肽:CD2的氨基酸编号236至351(NCBI RefSeq:NP.sub.--001758.2)、CD4的氨基酸编号421至458(NCBI RefSeq:NP.sub.--000607.1)、CD5的氨基酸编号402至495(NCBIRefSeq:NP.sub.--055022.2)、CD8α的氨基酸编号207至235(NCBI RefSeq:NP.sub.--001759.3)、CD83的氨基酸编号196至210(GenBank:AAA35664.1)、CD28的氨基酸编号181至220(NCBI RefSeq:NP.sub.-006130.1)、CD137的氨基酸编号214至255(4-1BB,NCBIRefSeq:NP.sub.--001552.2)、CD134的氨基酸编号241至277(OX40,NCBI RefSeq:NP.sub.--003318.1)和ICOS的氨基酸编号166至199(NCBI RefSeq:NP.sub.--036224.1),以及其与这些肽具有相同功能的变体。因此,虽然本文公开内容主要使用4-1BB作为共刺激信号传导元件的示例,但其他共刺激元件也在本公开的范围内。
CAR的细胞质信号传导部分中的细胞质信号传导序列可以随机或指定顺序彼此连接。任选地,短寡肽或多肽接头,长度优选在2到10个氨基酸之间,可形成键联。在一些实施方案中,所述接头为甘氨酸-丝氨酸双联体或丙氨酸三联体接头。
在一些实施方案中,所述胞内结构域被设计成包含CD28共刺激信号传导结构域。在一些实施方案中,所述CAR的胞内结构域包含的氨基酸序列与RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPR DFAAYRS(SEQ ID NO:44)至少95%、96%、97%、98%、99%或100%同一。
在一些实施方案中,所述胞内结构域被设计成包含CD3-ζ的信号传导结构域和CD28的信号传导结构域。
在一些实施方案中,所述胞内结构域包含具有一个或多个经修饰的免疫受体酪氨酸基础活化基序(ITAM)的CD3-ζ。在一些实施方案中,所述胞内结构域包含CD3-ζ,其具有三个免疫受体酪氨酸基础活化基序(ITAM),其中第一个未经修饰,并且第二个和第三个ITAM经改变,命名为“1XX。”在一些实施方案中,所述CAR的胞内结构域包含的氨基酸序列与RVKFSRSADAPAYQQGQNQLYNELNLGRREEY DVLDKRRGRDPEMGGKPRRKNPQEGLFNELQKDKMAEAFSEIG MKGERRRGKGHDGLFQGLSTATKDTFDALHMQALPPR(SEQ ID NO:45)至少95%、96%、97%、98%、99%或100%同一。
在一些实施方案中,所述CAR包含的细胞内信号传导结构域包含经修饰的CD3z多肽(例如经修饰的人类CD3z多肽),所述经修饰的CD3z多肽包含天然ITAM1、天然BRS1、天然BRS2、天然BRS3、具有两个功能丧失突变的ITAM2变体、和具有两个功能丧失突变的ITAM3变体、以及包含CD28多肽(例如人类CD28多肽)的共刺激信号传导区。
在另一个实施方案中,所述胞内结构域被设计成包含CD3-ζ的信号传导结构域和4-1BB的信号传导结构域。在又一个实施方案中,所述胞内结构域被设计成包含CD3-ζ的信号传导结构域以及CD28和4-1BB的信号传导结构域。
在一些实施方案中,所述CAR的胞内结构域被设计成包含4-1BB的信号传导结构域和CD3-ζ的信号传导结构域。
在一些实施方案中,所述CAR包含的氨基酸序列与表3中所提供的氨基酸序列至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一。
表3.示例性嵌合抗原受体
/>
/>
/>
CAR的功能特征
本文中所公开的CAR的功能部分也明确包括在本发明的范围内。术语“功能部分”当用于指称CAR时,是指本文中所公开的一个或多个CAR的任何部分或片段,所述部分或片段保留所述部分的CAR(亲本CAR)的生物活性。功能部分涵盖例如CAR的那些部分,其与亲本CAR保持识别靶细胞或检测、治疗或预防疾病的能力的程度相似、程度相同或程度较高。关于亲本CAR,所述功能部分可包含例如约10%、25%、30%、50%、68%、80%、90%、95%或更多的亲本CAR。
所述功能部分可包含在所述部分的氨基或羧基末端或两个末端处的额外氨基酸,所述额外氨基酸在亲本CAR的氨基酸序列中并未发现。理想的是,所述额外氨基酸不干扰所述功能部分的生物功能,例如,识别靶细胞、检测癌症、治疗或预防癌症等。更理想的是,与亲本CAR的生物活性相比,所述额外氨基酸增强生物活性。
本公开的范围内包括本文中所公开的CAR的功能变体。如本文所用,术语“功能变体”是指具有与亲本CAR基本上或显著的序列同一性或相似性的CAR、多肽或蛋白质,所述功能变体保留由其变异的CAR的生物活性。功能变体涵盖例如本文所述的CAR(亲本CAR)的那些变体,其保留与亲本CAR程度相似、程度相同或程度较高的识别靶细胞的能力。关于亲本CAR,所述功能变体可与亲本CAR的氨基酸序列例如至少约30%、50%、75%、80%、90%、98%或更高同一。
功能变体可例如包含亲本CAR的氨基酸序列,其具有至少一个保守性氨基酸取代。替代地或另外地,功能变体可包含亲本CAR的氨基酸序列,其具有至少一个非保守性氨基酸取代。在这种情况下,非保守性氨基酸取代优选地不干扰或抑制所述功能变体的生物活性。非保守性氨基酸取代可增强所述功能变体的生物活性,使得功能变体的生物活性相比于亲本CAR有所增加。
所述CAR的氨基酸取代优选为保守性氨基酸取代。保守性氨基酸取代是本领域中已知的,并且包括氨基酸取代,其中具有特定物理和/或化学性质的氨基酸被交换成具有相同或类似化学或物理性质的另一种氨基酸。例如,所述保守性氨基酸取代可为酸性/负电荷极性氨基酸被另一酸性/负电荷极性氨基酸(例如Asp或Glu)取代、带有非极性侧链的氨基酸被另一带有非极性侧链的氨基酸(例如Ala、Gly、Val、He、Leu、Met、Phe、Pro、Trp、Cys、Val等)取代、碱性/正电荷极性氨基酸被另一种碱性/正电荷极性氨基酸(例如Lys、His、Arg等)取代、带有极性侧链的不带电氨基酸被另一种带有极性侧链的不带电氨基酸(例如Asn、Gin、Ser、Thr、Tyr等)取代、带有β分支侧链的氨基酸被另一种带有β分支侧链的氨基酸(例如He、Thr和Val)取代、带有芳香侧链的氨基酸被另一种带有芳香侧链的氨基酸(例如His、Phe、Trp和Tyr)取代等。
所述CAR基本上可由本文所述的一个或多个指定氨基酸序列组成,使得其他组分(例如,其他氨基酸)不实质改变所述功能变体的生物活性。
所述CAR(包括功能部分和功能变体)可具有任何长度,即,可包含任何数量的氨基酸,条件是所述CAR(或其功能部分或功能变体)保留其生物活性,例如,特异性结合至抗原的能力、检测哺乳动物中的患病细胞、或治疗或预防哺乳动物的疾病等。例如,所述CAR的长度可为约50至约5000个氨基酸,例如长度为50、70、75、100、125、150、175、200、300、400、500、600、700、800、900、1000或更多个氨基酸。
所述CAR(包括本发明的功能部分和功能变体)可包含合成氨基酸代替一种或多种天然存在的氨基酸。此类合成氨基酸是本领域中已知的,并包括例如:氨基环己烷羧酸、正亮氨酸、-氨基正癸酸、高丝氨酸、S-乙酰氨基甲基-半胱氨酸、反式-3-羟脯氨酸和反式-4-羟脯氨酸、4-氨基苯丙氨酸、4-硝基苯丙氨酸、4-氯苯丙氨酸、4-羧基苯丙氨酸、β-苯基丝氨酸β-羟基苯丙氨酸、苯基甘氨酸、a-萘丙氨酸、环己基丙氨酸、环己基甘氨酸、二氢吲哚-2-甲酸、1,2,3,4-四氢异喹啉-3-甲酸、氨基丙二酸、氨基丙二酸单酰胺、N'-苄基-N'-甲基-赖氨酸、N',N'-二苄基-赖氨酸、6-羟基赖氨酸、鸟氨酸、-氨基环戊烷甲酸、a-氨基环己烷甲酸、a-氨基环庚烷甲酸、a-(2-氨基-2-降冰片烷)-甲酸、γ-二氨基丁酸、β-二氨基丙酸、高苯丙氨酸和a-叔丁基甘氨酸。
所述CAR(包括功能部分和功能变体)可经糖基化、酰胺化、羧化、磷酸化、酯化、N-酰化、经由例如二硫桥环化、或转化为酸加成盐和/或任选地二聚化或聚合化或缀合。
取代和变体
在一些实施方案中,涵盖了本文提供的抗体的氨基酸序列变体。例如,可能希望提高抗体的结合亲和力和/或其他生物学特性。抗体的氨基酸序列变体可通过引入适当的修饰至编码所述抗体的核酸序列中、或通过肽合成而制备。此类修饰包括例如抗体氨基酸序列内残基的删除和/或插入和/或取代。可进行删除、插入和取代的任何组合,以完成最终构建体,条件是所述最终构建体具有希望的特征,例如抗原结合。
a)取代、插入和删除变体
在一些实施方案中,提供了具有一个或多个氨基酸取代的抗体变体。进行取代诱变的所关注位点包括HVR和FR。以下进一步描述氨基酸侧链类别。可将氨基酸取代引入至所关注的抗体中,并将产物进行希望的活性筛选,例如抗原结合保留/改进、免疫原性降低、或ADCC或CDC改进。
氨基酸可根据共同侧链特性来分组:
(1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)碱性:His、Lys、Arg;
(5)影响链定向的残基:Gly、Pro;
(6)芳族:Trp、Tyr、Phe。
非保守性取代需要将这些类别之一的成员交换为另一类别。
取代变体的一种类型涉及取代亲本抗体(例如,人源化或人类抗体)的一个或多个高变区残基。通常,经选择用于进一步研究的所得变体,相对于亲本抗体,在某些生物学特性(例如增加的亲和力、降低的免疫原性)方面将具有修饰(例如,改进),和/或将基本上保留所述亲本抗体的某些生物学特性。示例性取代变体为亲和力成熟的抗体,其可方便地产生,例如,使用基于噬菌体展示的亲和力成熟技术,如本文所述的那些。简言之,一个或多个HVR残基发生突变,而所述变异抗体展示在噬菌体上,并针对特定的生物活性(例如结合亲和力)进行筛选。
可在HVR中进行改变(例如,取代),以例如提高抗体亲和力。此类改变可在HVR“热点”中进行,即由在体细胞成熟过程中经历高频率突变的密码子编码的残基(参见例如Chowdhury,Methods Mol.Biol.207:179-196(2008)),和/或SDR(a-CDR),其中所得变体VH或VL的结合亲和力经测试。通过构建和从二级文库中重新筛选而实现亲和力成熟,已描述于例如Hoogenboom等人,Methods in Molecular Biology 178:1-37(O'Brien等人编,Human Press,Totowa,NJ(2001))。在亲和力成熟的一些实施方案中,通过多种方法中的任一者(例如,易错PCR、链改组、或寡核苷酸-定向诱变)在选定用于成熟化的可变基因中引入多样性。然后创建二级文库。然后筛选所述文库,以鉴定出具有所需亲和力的任何抗体变体。另一种引入多样性的方法涉及HVR-导向法,其中数个HVR残基(例如,一次4至6个残基)被随机化。参与抗原结合的HVR残基可被特异性鉴定出,例如,使用丙氨酸扫描诱变或建模。通常靶向特别是CDR-H3和CDR-L3。
在一些实施方案中,取代、插入或删除可发生在一个或多个HVR内,只要此类改变基本上不降低抗体结合抗原的能力即可。例如,可在HVR内进行基本上不会降低结合亲和力的保守性改变(例如,本文提供的保守性取代)。此类改变可能在HVR“热点”或CDR之外。在上文提供的变体VHH序列的一些实施方案中,每个HVR未经改变或含有不超过一个、两个或三个氨基酸取代。
一种用于鉴定抗体中可靶向用于诱变的残基或区域的可用方法被称为“丙氨酸扫描诱变”,如Cunningham和Wells(1989)Science,244:1081-1085所描述。在这种方法中,目标残基的一个残基或残基组(例如带电残基如Arg、Asp、His、Lys和Glu)被鉴定出并被中性或带负电的氨基酸(例如丙氨酸或聚丙氨酸)代替,以决定抗体与抗原的相互作用是否受到影响。其他取代可引入在显示出对初始取代的功能敏感性的氨基酸位置处。替代地或另外地,抗原-抗体复合物的晶体结构用于鉴定抗体和抗原之间的接触位点。此类接触残基和相邻残基可被靶向或消除,而作为取代的候选物。可筛选变体以确定其是否含有所希望的特性。
氨基酸序列插入包括氨基和/或羧基末端融合,长度范围从一个残基到含有一百个或更多个残基的多肽,以及单一或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰残基的抗体。所述抗体分子的其他插入型变体包括抗体的N末端或C末端与酶(例如,针对ADEPT)或增加所述抗体的血清半衰期的多肽的融合物。
b)糖基化变体
在一些实施方案中,本文提供的抗体经改变以增加或减少抗体被糖基化的程度。向抗体加入或删除糖基化位点可方便地通过改变氨基酸序列从而创造或去除一个或多个糖基化位点而实现。
在抗体包含Fc区时,与其相连的碳水化合物可被改变。哺乳动物细胞产生的天然抗体通常包含分支、双触角寡糖,其通常通过N键联至Fc区的CH2结构域的Asn297而连接。参见例如Wright等人,TIBTECH 15:26-32(1997)。寡糖可包括各种碳水化合物,例如甘露糖、N-乙酰葡糖胺(GlcNAc)、半乳糖和唾液酸,以及在双触角寡糖结构的“主干”中连接至GlcNAc的岩藻糖。在一些实施方案中,本申请的抗体可进行寡糖修饰,以创造具有某些改进特性的抗体变体。
在一些实施方案中,提供了具有糖类结构的抗体变体,所述糖类结构缺乏(直接或间接)连接到Fc区的岩藻糖。例如,此类抗体中岩藻糖的量可为1%至80%、1%至65%、5%至65%或20%至40%。岩藻糖的量是通过计算Asn297糖链内的岩藻糖平均量而决定的,相对于与Asn 297相连的所有糖结构(例如,复合、杂合和高度甘露糖结构)的总和,以MALDI-TOF质谱法测量,如例如WO 2008/077546中所述。Asn297是指位于Fc区约位置297的天冬酰胺残基(Fc区残基的EU编号);然而,由于抗体的微小序列差异,Asn297也可能位于位置297上游或下游约±3个氨基酸处,即介于位置294和300之间。此类岩藻糖基化变体可具有改进的ADCC功能。参见例如美国专利公开第US2003/0157108号(Presta,L.);第US2004/0093621号(Kyowa Hakko Kogyo Co.,Ltd)。与“去岩藻糖基化”或“岩藻糖缺失”抗体变体有关的公开的实例包括:US2003/0157108;WO 2000/61739;WO 2001/29246;US2003/0115614;US2002/0164328;US2004/0093621;US2004/0132140;US2004/0110704;US2004/0110282;US2004/0109865;WO 2003/085119;WO 2003/084570;WO 2005/035586;WO 2005/035778;WO2005/053742;WO2002/031140;Okazaki等人,J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人,Biotech.Bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括缺乏蛋白质岩藻糖基化的Lec13 CHO细胞(Ripka等人,Arch.Biochem.Biophys.249:533-545(1986);US专利申请第US 2003/0157108A1号,Presta,L;和WO 2004/056312 A1,Adams等人),以及敲除细胞系,例如α-1,6-岩藻糖基转移酶基因FUT8敲除CHO细胞(参见例如Yamane-Ohnuki等人,Biotech.Bioeng.87:614(2004);Kanda,Y.等人,Biotechnol.Bioeng.,94(4):680-688(2006);和WO2003/085107)。
抗体变体进一步具有二等分的寡糖,例如,其中连接到抗体Fc区的双触角寡糖被GlcNAc二等分。此类抗体变体可能具有降低的岩藻糖基化和/或改进的ADCC功能。此类抗体变体的实例描述于例如WO 2003/011878(Jean-Mairet等人);美国专利第6,602,684号(Umana等人);以及US2005/0123546(Umana等人)。还提供了在连接到Fc区的寡糖中具有至少一个半乳糖残基的抗体变体。此类抗体变体可具有改进的CDC功能。此类抗体变体描述于例如WO 1997/30087(Patel等人);WO 1998/58964(Raju,S.);和WO 1999/22764(Raju,S.)。
CAR(包括其功能部分和功能变体)可通过本领域中已知的方法获得。CAR可通过任何制备多肽或蛋白质的合适方法制备。从头合成多肽和蛋白质的合适方法描述于参考文献中,例如Chan等人,Fmoc Solid Phase Peptide Synthesis,Oxford University Press,Oxford,United Kingdom,2000;Peptide and Protein Drug Analysis,Reid,R.编,MarcelDekker,Inc.,2000;Epitope Mapping,Westwood等人编,Oxford University Press,Oxford,United Kingdom,2001;和美国专利第5,449,752号。此外,多肽和蛋白质可使用本文所述的核酸使用标准重组方法重组产生。参见例如Sambrook等人,Molecular Cloning:ALaboratory Manual,第3版,Cold Spring Harbor Press,Cold Spring Harbor,N.Y.2001;和Ausubel等人,Current Protocols in Molecular Biology,Greene PublishingAssociates and John Wiley&Sons,N Y,1994。此外,一些CAR(包括其功能部分和功能变体)可从来源,例如植物、细菌、昆虫、哺乳动物(例如大鼠、人类)等中分离和/或纯化出。分离和纯化的方法是本领域中众所周知的。或者,本文所述的CAR(包括其功能部分和功能变体)可由工厂商业合成。在这方面,CAR可为合成性、重组性、经分离和/或经纯化。
可检测标志物和标签
对本文公开的一种或多种抗原具特异性的CAR、表达CAR的T细胞、单克隆抗体、其抗原结合片段也可与标签蛋白一起表达(例如,共表达)。在一些实施方案中,弗林蛋白酶识别位点和下游2A核糖体序列,被设计用于所述标签序列和所述CAR序列的同时双顺反子表达。在一些实施方案中,所述2A序列包含核酸序列GSGATNFSLLK QAGDVEENPGPSEQ ID NO:58。在一些实施方案中,弗林蛋白酶和P2A序列包含编码氨基酸序列SEQ ID NO:58的核酸序列。在一些实施方案中,所述P2A标签包含SEQ ID NO:58的氨基酸序列或具有与其至少95%、至少96%、至少97%、至少98%、至少99%同一的序列。
对本文公开的一种或多种抗原具特异性的CAR、表达CAR的T细胞、单克隆抗体、其抗原结合片段也可与可检测标志物缀合;例如,能够通过ELISA、分光光度法、流式细胞术、显微术或诊断成像技术(例如计算机断层扫描(CT)、计算机轴向断层扫描(CAT)扫描、磁共振成像(MRI)、核磁共振成像(NMRI)、磁共振断层扫描(MTR)、超声波、光纤检查和腹腔镜检查)检测的可检测标志物。可检测标志物的具体非限制性实例包括荧光团、化学发光剂、酶联结、放射性同位素和重金属或化合物(例如用于通过MRI检测的超顺磁性氧化铁纳米晶体)。例如,可使用的可检测标志物包括荧光化合物,包括荧光素、异硫氰酸荧光素、罗丹明(rhodamine)、5-二甲胺-1-萘磺酰氯、藻红蛋白、镧系元素磷光体等。还可使用生物发光标志物,例如荧光素酶、绿色荧光蛋白(GFP)、黄色荧光蛋白(YFP)。CAR、表达CAR的T细胞、抗体或其抗原结合部分也可与用于检测的酶如辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶、葡萄糖氧化酶等缀合。当CAR、表达CAR的T细胞、抗体、其抗原结合片段与可检测的酶缀合时,可通过加入额外的试剂进行检测,所述酶使用所述额外试剂产生可辨别的反应产物。例如,当辣根过氧化物酶试剂存在时,加入过氧化氢和二氨基联苯胺会产生有色反应产物,所述产物可目视检测。CAR、表达CAR的T细胞、抗体或其抗原结合部分也可与生物素缀合,并经由抗生物素蛋白(avidin)或抗生蛋白链菌素(streptavidin)结合的间接测量来检测。应当注意的是,抗生物素蛋白本身可与酶或荧光标记缀合。
CAR、表达CAR的T细胞、抗体或其抗原结合片段可与顺磁性剂如钆缀合。顺磁性剂如超顺磁性氧化铁也可作为标记。抗体也可与镧系元素(例如铕和镝)和锰缀合。抗体或抗原结合片段也可标记有可被二级报告基因所识别的预定多肽表位(例如亮氨酸拉链对序列、二级抗体的结合位点、金属结合结构域、表位标签)。
CAR、表达CAR的T细胞、抗体或其抗原结合片段也可与经放射性标记的氨基酸缀合。放射性标记可用于诊断和治疗目的。例如,放射性标记可用于通过x射线、发射光谱或其他诊断技术检测本文公开的一种或多种抗原和表达抗原的细胞。此外,所述放射性标记可在治疗上作为毒素,以治疗受试者的肿瘤,例如治疗神经母细胞瘤。多肽的标记的实例包括但不限于以下放射性同位素或放射性核苷酸:
检测此类可检测标志物的方法是本领域技术人员众所周知的。因此,例如,放射性标记可使用照相底片或闪烁计数器检测,荧光标志物可使用光检测器检测发出的光线而检测。酶性标记通常通过提供酶与底物,并检测酶对底物作用产生的反应产物,并且通过简单地观察有色标记而检测所述显色标记来检测。
免疫反应性细胞和宿主细胞
本申请的一个方面提供了一种工程化免疫效应细胞(例如,免疫反应性细胞)。如本文所用,“免疫反应性细胞”是指在免疫反应中起作用的细胞或祖细胞或其子代。在一些实施方案中,所述免疫反应性细胞包含本文所述的免疫调节系统(例如,包含对于肿瘤相关抗原或应激配体具特异性的靶向剂的细胞;以及编码调节TGF-β信号传导的多肽的核酸序列)。在一些实施方案中,所述免疫反应性细胞包含本文所述的免疫调节系统(例如,编码嵌合抗原受体(CAR)的核酸序列;以及编码调节TGF-β信号传导的多肽的核酸序列)。
在一些实施方案中,所述免疫效应细胞为T细胞、NK细胞、外周血单核细胞(PBMC)、造血干细胞、多能干细胞或胚胎干细胞。在一些实施方案中,所述免疫反应性细胞为T细胞。
出于本文的目的,所述T细胞可为任何T细胞,例如经培养T细胞,例如原代T细胞,或来自经培养T细胞系,例如Jurkat、SupTl等的T细胞,或从哺乳动物获得的T细胞。如果从哺乳动物获得,则所述T细胞可从多种来源获得,包括但不限于血液、骨髓、淋巴结、胸腺或其他组织或液体。T细胞也可经富集或纯化。所述T细胞可为人类T细胞。所述T细胞可为分离自人类的T细胞。所述T细胞可为任何类型的T细胞并且可为任何发育阶段,包括但不限于:CD4+/CD8+双阳性T细胞、CD4+辅助T细胞(例如Th1和Th2细胞)、CD8+T细胞(例如,细胞毒性T细胞)、肿瘤浸润细胞、记忆T细胞、记忆干细胞(即Tscm)、原始T细胞等。所述T细胞可为CD8+T细胞或CD4+T细胞。
在一个实施方案中,如本文所述的CAR可用于合适的非T细胞中。此类细胞为具有免疫效应功能的那些,例如由多能干细胞产生的NK细胞和T-类似细胞。
一个实施方案进一步提供了包含本文所述的任何重组表达载体的宿主细胞。如本文所用,术语“宿主细胞”是指可含有本发明的重组表达载体的任何类型的细胞。所述宿主细胞可为真核细胞,例如植物、动物、真菌或藻类,或者可为原核细胞,例如细菌或原生动物。所述宿主细胞可为培养细胞或原代细胞,即直接从生物体例如人类分离出。所述宿主细胞可为附着细胞或悬浮细胞(即悬浮生长的细胞)。合适的宿主细胞在本领域中是已知的,并且包括例如DH5α大肠杆菌细胞、中国仓鼠卵巢细胞、猴VERO细胞、COS细胞、HEK293细胞等。为了扩增或复制所述重组表达载体目的,所述宿主细胞可为原核细胞,例如DH5a细胞。为了产生重组CAR的目的,所述宿主细胞可为哺乳动物细胞。所述宿主细胞可为人类细胞。当宿主细胞可为任何细胞类型、可衍生自任何类型的组织并且可处于任何发育阶段时,所述宿主细胞可为外周血淋巴细胞(PBL)或外周血单核细胞(PBMC)。所述宿主细胞可为T细胞。
一个实施方案还提供了包含至少一种本文所述的宿主细胞的细胞群体。所述细胞群体可为异质群体,其包含含有所述的任何重组表达载体的宿主细胞,以及至少一种其他细胞(例如不包含任何所述重组表达载体的宿主细胞(例如T细胞))、或T细胞以外的细胞,例如B细胞、巨噬细胞、嗜中性粒细胞、红细胞、肝细胞、内皮细胞、上皮细胞、肌肉细胞、脑细胞等。或者,所述细胞群体可为基本上均质群体,其中所述群体主要包含含有所述重组表达载体(例如基本上由其组成)的宿主细胞。所述群体也可为细胞的克隆群体,其中所述群体的所有细胞都是包含重组表达载体的单一宿主细胞的克隆,使得所述群体的所有细胞都包含所述重组表达载体。在本发明的一个实施方案中,所述细胞群体为包含宿主细胞的克隆群体,所述宿主细胞包含如本文所述的重组表达载体。
CAR(包括其功能部分和其变体)、核酸、重组表达载体、宿主细胞(包括其群体)和抗体(包括其抗原结合部分),可经分离和/或纯化。例如,经纯化(或经分离)的宿主细胞制备物是其中宿主细胞比其体内自然环境中的细胞更纯者。此类宿主细胞可例如通过标准纯化技术生产。在一些实施方案中,宿主细胞的制备物经纯化,使得宿主细胞占所述制备物的总细胞含量的至少约50%,例如至少约70%。例如,所述纯度可为至少约50%,可大于约60%、约70%或约80%,或可为约100%。
核酸和表达载体
本发明的一个实施方案进一步提供了一种核酸,所述核酸包含编码本文所述的任何CAR、抗体或其抗原结合部分(包括其功能部分和功能变体)的核苷酸序列。本发明的核酸可包含编码本文所述的前导序列、抗原结合结构域、跨膜结构域和/或细胞内T细胞信号传导结构域中的任一者的核苷酸序列。
在一些实施方案中,所述核苷酸序列可经密码子修饰。不受特定理论的束缚,据认为所述核苷酸序列的密码子优化可增加mRNA转录物的翻译效率。所述核苷酸序列的密码子优化可能涉及以天然密码子取代另一个编码相同氨基酸的密码子,但可通过细胞内更容易获得的tRNA翻译,因而提高翻译效率。所述核苷酸序列的优化还可降低会干扰翻译的二级mRNA结构,因而提高翻译效率。
在本发明的一个实施方案中,所述核酸可包含编码本发明CAR的抗原结合结构域的密码子修饰的核苷酸序列。在本发明的另一个实施方案中,所述核酸可包含编码本文所述CAR中的任一者(包括其功能部分和功能变体)的密码子修饰的核苷酸序列。
表达载体包括质粒、反转录病毒、粘粒、YAC、EBV衍生的附加体等。一种方便的载体为编码功能完整人类CH或CL免疫球蛋白序列的载体,其具有工程化的适当限制性位点,以便可以轻松插入和表达任何VH或VL序列。在此类载体中,剪接通常发生在插入J区的剪接供体位点和人类C区之前的剪接受体位点之间,并且也发生在人类CH外显子内的剪接区。合适的表达载体可包含许多组件,例如复制起点、可选择标记基因、一种或多种表达控制元件如转录控制元件(例如启动子、增强子或终止子)和/或一个或多个翻译信号、信号序列或前导序列等。聚腺苷酸化和转录终止发生在所述编码区下游的天然染色体位点。所得嵌合抗体可与任何强启动子连接。可使用的合适载体实例包括适用于哺乳动物宿主并以病毒复制系统为基础的那些,例如猿猴病毒40(SV40)、劳斯肉瘤病毒(RSV)、腺病毒2、牛乳头状瘤病毒(BPV)、乳多泡病毒BK突变体(BKV),或小鼠和人类巨细胞病毒(CMV),以及莫罗尼鼠类白血病病毒(MMLV)、天然Ig启动子等。多种合适的载体是本领域中已知的,包括维持在单拷贝或多拷贝、或整合到宿主细胞染色体中的载体,例如,经由LTR,或经由工程化而具有多个整合位点的人工染色体(Lindenbaum等人,Nucleic Acids Res.32:e172(2004),Kennard等人,Biotechnol.Bioeng.2009年5月20日在线)。合适载体的额外实例在后面章节中列出。
因此,本发明提供了一种或多种包含核酸的表达载体,所述核酸编码抗体、抗体的抗原结合片段(例如,人类、人源化、嵌合抗体或前述任何抗原结合片段)、抗体链(例如,重链、轻链)或与TGFβ或TGFβR结合的抗体链的抗原结合部分。在一些实施方案中,本发明提供了一种或多种包含TGFβR的核酸胞外结构域的表达载体。
在真核宿主细胞中的表达是有用的,因为此类细胞比原核细胞更有可能组装和分泌出正确折叠的和具有免疫学活性的抗体。然而,任何由于不当折叠而非活性的所产生抗体可根据已知方法重新恢复活性(Kim和Baldwin,“Specific Intermediates in theFolding Reactions of Small Proteins and the Mechanism of Protein Folding”,Ann.Rev.Biochem.51,第459-89页(1982))。宿主细胞可能会产生完整抗体的一部分,例如轻链二聚体或重链二聚体,其也为根据本发明的抗体类似物。
本发明还提供了一种核酸,其包含与编码本文所述CAR构建体的核酸至少约70%或更高,例如约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%同一的核苷酸序列。
在一个实施方案中,可将核酸并入重组表达载体中。在这方面,一个实施方案提供了包含所述核酸任一者的重组表达载体。出于本文目的,术语“重组表达载体”是指基因修饰的寡核苷酸或多核苷酸构建体,当所述构建体包含编码所述mRNA、蛋白质、多肽或肽的核苷酸序列时,其允许宿主细胞表达所述mRNA、蛋白质、多肽或肽,并且所述载体在足以在细胞内表达所述mRNA、蛋白质、多肽或肽的条件下与所述细胞接触。所述载体并非以一个整体天然存在。
然而,所述载体的一部分可为天然存在的。重组表达载体可包含任何类型的核苷酸,包括但不限于DNA和RNA,其可为单链或双链的,合成或部分获自天然来源,并且其可含有天然的、非天然的或经改变的核苷酸。所述重组表达载体可包含天然存在或非天然存在的核苷酸间键联,或这两种类型的键联。优选地,非天然存在或经改变的核苷酸或核苷酸间键联并不阻碍载体的转录或复制。
在一个实施方案中,所述重组表达载体可为任何合适的重组表达载体,并且可用于转化或转染任何合适的宿主细胞。合适的载体包括设计用于繁殖和扩增或用于表达或两者兼有的载体,例如质粒和病毒。所述载体可选自由以下组成的组:pUC系列(FermentasLife Sciences,Glen Burnie,Md.)、pBluescript系列(Stratagene,LaJolla,Calif.)、pET系列(Novagen,Madison,Wis.)、pGEX系列(Pharmacia Biotech,Uppsala,Sweden)和pEX系列(Clontech,Palo Alto,Calif.)。
还可使用噬菌体载体,例如λ、λZapII(Stratagene)、EMBL4和λNMI 149。植物表达载体的实例包括pBIO1、pBI101.2、pBHO1.3、pBI121和pBIN19(Clontech)。动物表达载体的实例包括pEUK-C1、pMAM和pMAMneo(Clontech)。重组表达载体可为病毒载体,例如反转录病毒载体或慢病毒载体。慢病毒载体是衍生自慢病毒基因组的至少一部分的载体,尤其包括自失活慢病毒载体,如Milone等人,Mol.Ther.17(8):1453-1464(2009)中所提供。可用于临床的慢病毒载体的其他实例包括例如但不限于来自Oxford BioMedica plc的
许多转染技术是本领域中通常已知的(参见例如Graham等人,Virology,52:456-467(1973);Sambrook等人,同上;Davis等人,Basic Methods in Molecular Biology,Elsevier(1986);和Chu等人,Gene,13:97(1981))。
转染方法包括磷酸钙共沉淀(参见例如Graham等人,同上)、直接微量注射到培养细胞中(参见例如Capecchi,Cell,22:479-488(1980))、电穿孔(参见例如Shigekawa等人,BioTechniques,6:742-751(1988))、脂质体介导的基因转移(参见例如Mannino等人,BioTechniques,6:682-690(1988))、脂质介导的转导(参见例如Feigner等人,Proc.Natl.Acad.Sci.USA,84:7413-7417(1987))和使用高速微弹的核酸递送(参见例如Klein等人,Nature,327:70-73(1987))。
在一个实施方案中,重组表达载体可使用例如Sambrook等人,同上和Ausubel等人,同上所描述的标准重组DNA技术制备。可制备环状或线性的表达载体的构建体,以包含在原核或真核宿主细胞中发挥作用的复制系统。复制系统可衍生自例如ColE1、2μ质粒、λ、SV40、牛乳头状瘤病毒等。
重组表达载体可包含调控序列,例如转录和翻译起始和终止密码子,适当时,并考虑所述载体是基于DNA还是基于RNA,其对于待引入所述载体的宿主细胞类型(例如细菌、真菌、植物或动物)具特异性。所述重组表达载体可包含限制性位点以促进克隆。
重组表达载体可包括一种或多种标记基因,其允许选择经转化或经转染的宿主细胞。标记基因包括杀生物剂抗性,例如对抗生素、重金属等的抗性,在营养缺陷型宿主中的互补,以提供原养型等。适用于本发明表达载体的标记基因包括例如新霉素/G418抗性基因、潮霉素抗性基因、组氨醇抗性基因、四环素抗性基因和氨苄青霉素抗性基因。
所述重组表达载体可包含天然或非天然启动子,其可操作地连接至编码所述CAR(包括其功能部分和功能变体)的核苷酸序列、或与编码所述CAR的核苷酸序列互补或杂交的核苷酸序列。启动子的选择,例如强、弱、可诱导、组织特异性和发育特异性,在技术人员的普通技能范围内。类似地,核苷酸序列与启动子的组合也在技术人员的技能范围内。所述启动子可为非病毒启动子或病毒启动子,例如巨细胞病毒(CMV)启动子、SV40启动子、RSV启动子、或在鼠类干细胞病毒的长末端重复序列中发现的启动子。
重组表达载体可设计为用于暂时表达、稳定表达或两者皆是。此外,重组表达载体可制备为用于组成型表达或诱导型表达。
此外,重组表达载体可制备为包括自杀基因。如本文所用,术语“自杀基因”是指导致表达所述自杀基因的细胞死亡的基因。自杀基因可为赋予表达基因的细胞对试剂(例如药物)的敏感性,并在细胞与试剂接触或暴露于试剂时导致细胞死亡的基因。自杀基因是本领域中已知的(参见例如Suicide Gene Therapy:Methods and Reviews,Springer,Caroline J.(Cancer Research UK Centre for Cancer Therapeutics at theInstitute of Cancer Research,Sutton,Surrey,UK),Humana Press,2004),并且包括例如单纯疱疹病毒(HSV)胸苷激酶(TK)基因、胞嘧啶脱氨酶、嘌呤核苷磷酸化酶和硝基还原酶。
治疗方法
本发明涉及治疗方法,其包括向受试者施用抗TGFβ、抗TGFβR抗原结合分子、或TGFβR的胞外结构域。在一些实施方案中,本文所公开的CAR和抗原结合分子可用于治疗或预防哺乳动物疾病的方法中。在这方面,一个实施方案提供了一种治疗或预防哺乳动物癌症的方法,其包括向哺乳动物施用有效治疗或预防哺乳动物癌症的量的CAR、核酸、重组表达载体、宿主细胞、细胞群体、抗体和/或其抗原结合部分,和/或药物组合物。
在一些实施方案中,CAR在供体细胞上表达,并且这些细胞分泌出抗TGFβ、抗TGFβR抗原结合分子、或TGFβR的胞外结构域。在一些实施方案中,用于T细胞疗法的供体T细胞获自患者(例如,用于自体T细胞疗法)。在其他实施方案中,用于T细胞疗法的供体T细胞获自非患者的受试者(例如,同种异体T细胞疗法)。CAR+T细胞可以治疗有效量施用。例如,治疗有效量的T细胞可为至少约10
在一些实施方案中,T细胞的治疗有效量为约10
在一些实施方案中,CAR阳性的活T细胞的治疗有效量介于约0.25X10
在一些实施方案中,CAR阳性的活T细胞的治疗有效量在约0.4x10
一个实施方案还包括在施用本文所公开的CAR之前,使哺乳动物进行淋巴耗竭。淋巴耗竭的实例包括但不限于:非清髓性淋巴耗竭化学疗法、清髓性淋巴耗竭化学疗法、全身照射等。
就其中施用宿主细胞或细胞群体的方法目的而言,细胞可为与所述哺乳动物同种异体或自体的细胞。在一些实施方案中,所述细胞为哺乳动物自体的。在一些实施方案中,所述细胞为哺乳动物同种异体的。如本文所用,同种异体是指衍生自与引入材料的个体相同物种的不同动物的任何材料。当一个或多个基因座上的基因不相同时,所述两个或更多个个体被称为彼此同种异体。在一些方面,来自同一物种个体的同种异体材料可能在基因上充分不同以进行抗原性相互作用。如本文所用,“自体”是指衍生自同一个体的任何材料,稍后将其重新引入所述个体中。
本文所提及的哺乳动物可为任何哺乳动物。如本文所用,术语“哺乳动物”是指任何哺乳动物,包括但不限于:啮齿目哺乳动物,例如小鼠和仓鼠,以及兔形目哺乳动物,例如兔。哺乳动物可来自食肉目,包括猫科动物(猫)和犬科动物(狗)。哺乳动物可来自偶蹄目,包括牛(母牛)和猪(猪),或来自偶蹄目,包括马(马)。哺乳动物可为灵长目、猿目(Ceboids)或猴目(Simoids)(猴子)或类人猿目(人类和猿)。在一些实施方案中,所述哺乳动物为人类。
关于所述方法,所述癌症可为任何癌症,包括急性淋巴细胞癌、急性骨髓性白血病、肺泡横纹肌肉瘤、膀胱癌(例如,膀胱肉瘤)、骨癌、脑癌(例如,神经管母细胞瘤)、乳腺癌、肛门癌、肛管癌或肛门直肠癌、眼癌、肝内胆管癌、关节癌、颈部癌、胆囊癌或胸膜癌、鼻癌、鼻腔癌,或中耳癌、口腔癌、外阴癌、慢性淋巴细胞性白血病、慢性骨髓癌、结肠癌、食道癌、宫颈癌、纤维肉瘤、胃肠道类癌瘤、头颈癌(例如头颈鳞状细胞癌)、霍奇金淋巴瘤、下咽癌、肾癌、喉癌、白血病、液体肿瘤、肝癌、肺癌(例如,非小细胞肺癌和肺腺癌)、淋巴瘤、间皮瘤、肥大细胞瘤、黑色素瘤、多发性骨髓瘤、鼻咽癌、非霍奇金淋巴瘤、B慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(ALL)和伯基特淋巴瘤(Burkitt's lymphoma)、卵巢癌、胰腺癌、腹膜癌、网膜癌和肠系膜癌、咽癌、前列腺癌、直肠癌、肾癌、皮肤癌、小肠癌、软组织癌、实体瘤、滑膜肉瘤、胃癌、睾丸癌、甲状腺癌和输尿管癌中的任一者。
在某些实施方案中,所述癌症是胃肠癌。在一些实施方案中,所述癌症是胃癌。在一些实施方案中,所述癌症是结直肠癌。在一些实施方案中,所述癌症是结肠癌。在一些实施方案中,所述癌症的TGFβ表达异常或TGFβ信号传导异常。
如本文所用,术语“治疗”和“预防”以及其衍生词不一定意味着100%或完全治疗或预防。相反,存在不同程度的治疗或预防,本领域普通技术人员认为其具有潜在益处或治疗效果。在这方面,所述方法可提供任何量或任何水平的哺乳动物癌症的治疗或预防。
此外,由所述方法提供的治疗或预防可包括治疗或预防一种或多种待治疗或预防的疾病(例如癌症)的疾患或症状。此外,出于本文目的,“预防”可涵盖延迟疾病或其症状或疾患的发作。
测试CAR识别靶细胞的能力和抗原特异性的方法是本领域中已知的。例如,Clay等人,J.Immunol,163:507-513(1999),教导了测量细胞因子(例如干扰素-γ、颗粒细胞/单核细胞集落刺激因子(GM-CSF)、肿瘤坏死因子a(TNF-α)或白细胞介素2(IL-2))释放的方法。此外,CAR功能可通过测量细胞的细胞毒性来评价,如Zhao等人,J.Immunol,174:4415-4423(2005)中所述。
另一个实施方案提供了本发明的CAR、核酸、重组表达载体、宿主细胞、细胞群体、抗体或其抗原结合部分和/或药物组合物的用途,用于治疗或预防哺乳动物的增殖性病症,例如癌症。所述癌症可为本文所述的任何癌症。
任何施用方法都可用于所公开的治疗剂,包括局部和全身施用。例如可使用局部、口服、血管内(例如静脉内)、肌肉内、腹膜内、鼻内、皮内、鞘内和皮下施用。特定的施用模式和给药方案将由主治临床医师选择,考虑到病例的细节(例如受试者、疾病、所涉及的疾病状态以及治疗是否为预防性)。在施用多于一种药剂或组合物的情况下,可使用一种或多种施用途径;例如,化学治疗剂可口服施用,并且抗体或抗原结合片段或缀合物或组合物可静脉内施用。施用方法包括注射,其中CAR、CAR T细胞、缀合物、抗体、抗原结合片段或组合物在无毒的药学上可接受的载体如水、生理食盐水、林格氏溶液、右旋糖溶液、5%人类血清白蛋白、非挥发性油、油酸乙酯或脂质体中提供。在一些实施方案中,可使用所公开的化合物的局部施用,例如通过将抗体或抗原结合片段施加至已去除肿瘤的组织区域,或怀疑倾向于发展肿瘤的区域。在一些实施方案中,包括治疗有效量的抗体或抗原结合片段的药物制剂的持续性肿瘤内(或肿瘤附近)释放可为有利的。在其他实例中,缀合物作为滴眼剂局部施加至角膜,或经玻璃体内施加至眼睛。
所公开的治疗剂可配制成适合精确剂量单独施用的单位剂型。此外,所公开的治疗剂可以单剂量或多剂量方案施用。多剂量方案为其中主要治疗过程可为多于一个单独的剂量,例如1至10个剂量,接着根据需要在后续时间间隔施用其他剂量,以维持或加强所述组合物的作用。治疗可涉及在几天至几个月甚至几年的时段内,每天一次或每天多次施用化合物。因此,所述给药方案也将至少部分地基于待治疗受试者的特定需要而决定,并将取决于施用医师的判断。
抗体或缀合物的典型剂量范围可为约0.01至约30mg/kg,例如约0.1至约10mg/kg。
在特定实例中,向受试者施用治疗性组合物,其包括缀合物、抗体、组合物、CAR、CAR T细胞或额外药剂中的一者或多者,以每天多次给药方案,例如至少连续两天、连续10天等,例如持续数周、数月或数年。在一个实例中,向受试者施用缀合物、抗体、组合物或额外药剂持续至少30天的时段,例如至少2个月、至少4个月、至少6个月、至少12个月、至少24个月、或至少36个月。
在一些实施方案中,所公开的方法包括向所述受试者提供手术、放射疗法和/或化学治疗剂,与所公开的抗体、抗原结合片段、缀合物、CAR或表达CAR的T细胞的组合(例如,依次、基本上同时或同时)。此类药剂和治疗的方法和治疗剂量是本领域技术人员已知的,并且可由熟练临床医师决定。额外药剂的制备和给药方案可根据制造商的指示或由熟练的专业人员凭经验决定。此类化学疗法的制备与给药方案也描述于Chemotherapy Service,(1992),M.C.Perry编,Williams&Wilkins,Baltimore,Md。
在一些实施方案中,所述组合疗法可包括向受试者施用治疗有效量的额外癌症抑制剂。可与所述组合疗法一起使用的额外治疗剂的非限制性实例包括微管结合剂、DNA嵌合剂或交联剂、DNA合成抑制剂、DNA和RNA转录抑制剂、抗体、酶、酶抑制剂、基因调节剂和血管生成抑制剂。这些药剂(其以治疗有效量施用)和治疗可单独或组合使用。例如,任何适合的抗癌或抗血管生成剂可与本文所公开的CAR、CAR-T细胞、抗体、抗原结合片段或缀合物组合施用。此类药剂的方法和治疗剂量是本领域技术人员已知的,并且可由熟练临床医师决定。
其他化学治疗剂包括但不限于:烷化剂,例如氮芥(例如苯丁酸氮芥(chlorambucil)、氯甲碱(chlormethine)、环磷酰胺、异环磷酰胺和美法仑(melphalan))、亚硝基脲(例如卡莫司汀(carmustine)、福莫司汀(fotemustine)、洛莫司汀(lomustine)和链脲佐菌素(streptozocin))、铂化合物(例如卡铂(carboplatin)、顺铂(cisplatin)、奥沙利铂(oxaliplatin)和BBR3464)、白消安(busulfan)、达卡巴嗪(dacarbazine)、氮芥(mechlorethamine)、丙卡巴肼(procarbazine)、替莫唑胺(temozolomide)、塞替派(thiotepa)和乌拉莫司汀(uramustine);抗代谢物,例如叶酸(例如甲氨蝶呤(methotrexate)、培美曲塞(pemetrexed)和雷替曲塞(raltitrexed))、嘌呤(例如克拉屈滨(cladribine)、氯法拉滨(clofarabine)、氟达拉滨(fludarabine)、巯基嘌呤(mercaptopurine)和硫鸟嘌呤(tioguanine))、嘧啶(例如卡培他滨(capecitabine))、阿糖胞苷(cytarabine)、氟尿嘧啶(fluorouracil)和吉西他滨(gemcitabine);植物生物碱,例如鬼臼属(例如依托泊苷(etoposide)和替尼泊苷(teniposide))、紫杉烷(例如多西紫杉醇(docetaxel)和紫杉醇(paclitaxel))、长春花(例如长春碱(vinblastine)、长春新碱(vincristine)、长春地辛(vindesine)和长春瑞滨(vinorelbine));细胞毒性/抗肿瘤抗生素,例如蒽环家族成员(例如道诺霉素(daunorubicin)、多柔比星(doxorubicin)、表柔比星(epirubicin)、伊达比星(epirubicin)、米托蒽醌(mitoxantrone)和伐柔比星(valrubicin))、博来霉素(bleomycin)、利福平(rifampicin)、羟基脲和丝裂霉素;拓扑异构酶抑制剂,例如拓扑替康(topotecan)和伊立替康(irinotecan);单克隆抗体,例如阿仑单抗(alemtuzumab)、贝伐单抗(bevacizumab)、西妥昔单抗(cetuximab)、吉姆单抗(gemtuzumab)、利妥昔单抗(rituximab)、帕尼单抗(panitumumab)、帕妥珠单抗(pertuzumab)和曲妥珠单抗(trastuzumab);光敏剂,例如氨基乙酰丙酸、氨基乙酰丙酸甲酯、泊芬钠(porfimer sodium)和维替泊芬(verteporfin);和其他药剂,如阿利维A酸(alitretinoin)、阿曲他明(altretamine)、安吖啶(amsacrine)、阿那格雷(anagrelide)、三氧化二砷、天冬酰胺酶、阿西替尼(axitinib)、贝沙罗汀(bexarotene)、贝伐单抗(bevacizumab)、硼替佐米(bortezomib)、塞来昔布(celecoxib)、地尼白介素(denileukindiftitox)、厄洛替尼(erlotinib)、雌莫司汀(estramustine)、吉非替尼(gefitinib)、羟基甲酰胺、伊马替尼(imatinib)、拉帕替尼(lapatinib)、帕唑帕尼(pazopanib)、喷司他丁(pentostatin)、马索普考(masoprocol)、米托坦(mitotane)、培门冬酶(pegaspargase)、他莫昔芬(tamoxifen)、索拉非尼(sorafenib)、舒尼替尼(sunitinib)、威罗非尼(vemurafinib)、凡德他尼(vandetanib)和维甲酸(tretinoin)。此类药剂的选择和治疗剂量是本领域技术人员已知的,并且可由熟练临床医师决定。
所述组合疗法可提供协同作用并且证明有协同性,即,当活性成分一起使用所导致的效果大于分开使用所述化合物的效果总和时所达到的作用。当活性成分如下述时,可达到协同效应:(1)共同配制并且在组合单位剂量制剂中同时施用或递送时;(2)作为单独的制剂交替或平行递送时;或(3)通过一些其他方案。当以交替方式递送时,可在依序施用或依序递送化合物时达到协同效应,例如通过在不同注射器中进行不同注射。一般而言,在交替期间,每个活性成分的有效剂量是依序施用的,而在组合疗法中,两种或更多种活性成分的有效剂量是一起施用的。
在多个实施方案中,所述包含有本文所述TGFβ信号传导调节剂的免疫调节系统可包括在还包括向受试者施用至少一种额外药剂的治疗过程中。在多个实施方案中,与包含有如本文所述TGFβ信号传导调节剂的免疫调节系统组合施用的额外药剂可为化学治疗剂。在多个实施方案中,与如本文所述的抗原结合剂组合施用的额外药剂可为抑制炎症的药剂。
在一些实施方案中,所述TGFβ信号传导调节剂为单域抗体或对于人类TGFβ具特异性的可分泌scFv。在一些实施方案中,所述TGFβ信号传导调节剂为单域抗体或对于人类TGFβR具特异性的可分泌scFv。在一些实施方案中,所述TGFβ信号传导调节剂可与治疗剂(例如化学治疗剂和放射性原子)缀合(例如连接),用以结合癌细胞、递送所述治疗剂至癌细胞,并杀伤表达人类TGFβ的癌细胞。在一些实施方案中,TGFβ信号传导调节剂与治疗剂连接。在一些实施方案中,治疗剂为化学治疗剂、细胞因子、放射性原子、siRNA或毒素。在一些实施方案中,所述治疗剂为化学治疗剂。在一些实施方案中,所述药剂为放射性原子。
在一些实施方案中,所述方法可与用于TGFβ信号传导异常病症的其他疗法结合进行。例如,所述组合物可在化学疗法之前或之后同时向受试者施用。在一些实施方案中,所述组合物可在采用过继性细胞疗法的同时、之前或之后向受试者施用。
在多个实施方案中,与所述包含有本文所述TGFβ信号传导调节剂的免疫调节系统组合施用的额外药剂可与所述TGFβ信号传导调节剂在相同时间、同一天或同一周施用。在多个实施方案中,与本文所述的TGFβ信号传导调节剂组合施用的额外药剂可以单一制剂形式与所述免疫调节系统一起施用。在某些实施方案中,以与如本文所述的TGFβ信号传导调节剂的施用在时间上分开的方式施用额外药剂,例如,在施用所述TGFβ信号传导调节剂之前或之后的一个或多个小时、之前或之后的一天或多天、之前或之后的一周或多周、之前或之后的一个或多个月。在多个实施方案中,一种或多种额外药剂的施用频率可与如本文所述TGFβ信号传导调节剂的施用频率相同、相似或不同。
在一些实施方案中,所述组合物可与一种或多种额外治疗剂一同配制,例如在受试者中治疗或预防TGFβ相关病症(例如癌症或自身免疫病症)的额外疗法。用于在受试者中治疗TGFβ相关病症的额外药剂将根据待治疗的特定病症而改变,但可包括(但不限于)利妥昔单抗、环磷酰胺、多柔比星、长春新碱、强的松(prednisone)、异环磷酰胺、卡铂、依托泊苷、地塞米松(dexamethasone)、阿糖胞苷、顺铂、环磷酰胺或氟达拉滨。
组合物
本文提供了用于基因疗法、免疫疗法和/或细胞疗法的组合物,其在载体(例如药学上可接受的载体)中包括一种或多种所公开的CAR或表达CAR的T细胞、抗体、抗原结合片段、缀合物、CAR或表达CAR的T细胞(其特异性结合至本文公开的一种或多种抗原)。所述组合物可以用于向受试者施用的单位剂型来制备。施用量和时间由主治临床医师酌情判断,以达到预期结果。所述组合物可经配制用于全身(例如静脉内)或局部(例如肿瘤内)施用。在一个实例中,所公开的CAR或表达CAR的T细胞、抗体、抗原结合片段、缀合物被配制用于肠胃外施用,例如静脉内施用。包括如本文所公开的CAR或表达CAR的T细胞、缀合物、抗体或抗原结合片段的组合物,可用于例如治疗和检测肿瘤,例如并且不限于神经母细胞瘤。在一些实例中,所述组合物可用于治疗或检测癌瘤。包括如本文所公开的CAR或表达CAR的T细胞、缀合物、抗体或抗原结合片段的组合物也用于例如检测病理性血管生成。
用于施用的组合物可包括溶于药学上可接受的载体(例如水性载体)中的CAR或表达CAR的T细胞、缀合物、抗体或抗原结合片段的溶液。可使用各种水性载体,例如,缓冲生理食盐水等。这些溶液是无菌的并且通常不含不希望的物质。这些组合物可通过常规的众所周知的灭菌技术来灭菌。所述组合物可根据需要含有药学上可接受的辅助物质以接近生理条件,例如pH调节剂和缓冲剂、毒性调节剂、佐剂等,例如乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。在这些制剂中的CAR或表达CAR的T细胞、抗体或抗原结合片段或缀合物的浓度可广泛地变化,并且将主要根据所选择的特定施用模式和受试者的需要来选择,主要基于流体体积、粘度、体重等。制备用于基因疗法、免疫疗法和/或细胞疗法的此类剂型的实际方法,对于本领域技术人员而言是已知的或将是显而易见的。
用于静脉内施用的典型组合物包括每名受试者每天约0.01至约30mg/kg的抗体或抗原结合片段或缀合物(或CAR、或表达CAR的T细胞、或包括抗体或抗原结合片段的缀合物的对应剂量)。用于制备可施用组合物的实际方法将为本领域技术人员所已知或显而易见,并且更详细描述于例如Remington's Pharmaceutical Science,第19版,Mack PublishingCompany,Easton,Pa.(1995)的出版物中。
受控释放肠胃外制剂可制成植入物、油性注射液或微粒系统。有关蛋白质递送系统的广泛概述,参见Banga,A.J.,Therapeutic Peptides and Proteins:Formulation,Processing,and Delivery Systems,Technomic Publishing Company,Inc.,Lancaster,Pa.,(1995)。微粒系统包括微球体、微颗粒、微胶囊、纳米胶囊、纳米球和纳米颗粒。微胶囊含有治疗性蛋白质,如细胞毒素或药物,作为中心核心。在微球体中,所述治疗剂分散在整个颗粒中。小于约1μm的颗粒、微球体和微胶囊通常分别称为纳米颗粒、纳米球体和纳米胶囊。毛细血管具有约5μm的直径,因此只有纳米颗粒可静脉内施用。微粒通常直径约100μm并且经皮下或肌肉内施用。参见例如Kreuter,J.,Colloidal Drug Delivery Systems,J.Kreuter编,Marcel Dekker,Inc.,New York,N.Y.,第219-342页(1994);以及Tice和Tabibi,Treatise on Controlled Drug Delivery,A.Kydonieus编,Marcel Dekker,Inc.New York,N.Y.,第315-339页(1992)。
聚合物可用于本文公开的CAR或表达CAR的T细胞、抗体、或抗原结合片段、或缀合物组合物的离子控制释放。用于受控药物递送的各种可降解和不可降解的聚合物基质是本领域中已知的(Langer,Accounts Chem.Res.26:537-542,1993)。例如,嵌段共聚物polaxamer407,在低温下以粘稠但流动的液体形式存在,但在体温下形成半固体凝胶。它已被证明为重组白细胞介素-2和脲酶的配制和持续递送的有效媒介物(Johnston等人,Pharm.Res.9:425-434,1992;和Pec等人,J.Parent.Sci.Tech.44(2):58-65,1990)。或者,羟基磷灰石已被使用作为蛋白质控制释放的微载体(Ijntema等人,Int.J.Pharm.112:215-224,1994)。在又一方面,脂质体用于脂质包裹药物的受控释放以及药物靶向(Betageri等人,Liposome Drug Delivery Systems,Technomic Publishing Co.,Inc.,Lancaster,Pa.(1993))。已知用于治疗性蛋白质的受控递送的多种额外系统(参见美国专利第5,055,303号;第5,188,837号;第4,235,871号;第4,501,728号;第4,837,028号;第4,957,735号;第5,019,369号;第5,055,303号;第5,514,670号;第5,413,797号;第5,268,164号;第5,004,697号;第4,902,505号;第5,506,206号;第5,271,961号;第5,254,342号和第5,534,496号)。
药盒
在一个方面,还提供了使用本文所公开的CAR的药盒。例如,用于治疗受试者的肿瘤,或制造表达本文所公开的一种或多种CAR的CAR T细胞的药盒。所述药盒通常将包括如本文所公开的抗体、抗原结合片段、缀合物、核酸分子、CAR或表达CAR的T细胞。多于一种的所公开的抗体、抗原结合片段、缀合物、核酸分子、CAR或表达CAR的T细胞可包括在所述药盒中。
所述药盒可包括容器和在所述容器上或与其相连的标签或包装插页。合适的容器包括例如瓶子、小瓶、注射器等。容器可由各种材料如玻璃或塑料形成。所述容器通常容置组合物,其包含所公开的抗体、抗原结合片段、缀合物、核酸分子、CAR或表达CAR的T细胞中的一者或多者。在数个实施方案中,所述容器可具有无菌入口(例如,容器可为静脉内溶液袋,或具有可被皮下注射针刺穿的塞子的小瓶)。标签或包装插页指示所述组合物用于治疗特定疾患。
标签或包装插页通常将进一步包括所公开的抗体、抗原结合片段、缀合物、核酸分子、CAR或表达CAR的T细胞的使用说明,例如,用于治疗或预防肿瘤或制造CAR T细胞的方法中。包装插页通常包括常规包含在治疗产品的商业包装中的说明,所述说明包含有关使用此类治疗产品的适应症、用法、剂量、施用、禁忌症和/或警告的信息。所述说明书材料可为书面的,呈电子形式(例如计算机硬盘或光盘)或视觉形式(例如可视文件)。所述药盒还可包括额外组件,以促进药盒设计的特定应用。因此,例如,所述药盒可额外地含有检测标记(例如用于酶标记的酶底物、用于检测荧光标记的过滤组、适当的二级标记(例如二级抗体)等)的装置。所述药盒可额外包括缓冲液和常规用于实施特定方法的其他试剂。此类药盒与适当内容物是本领域技术人员众所周知的。
除非另有说明,否则本文使用的所有技术和科学术语和短语与本领域普通技术人员通常理解的相同含义。尽管在本发明的实施或测试中可使用与本文描述的那些相似或等效的任何方法和材料,但现在描述优选的方法和材料。本文提及的所有出版物都通过引用并入本文。
标准技术可用于重组DNA、寡核苷酸合成以及组织培养和转化(例如,电穿孔、脂质转染)。酶反应和纯化技术可根据制造商的说明书或如本领域中通常完成者或如本文所述进行。前述技术和程序通常可根据本领域中众所周知并如整个本说明书中引用和讨论的各种一般性和更具体的参考文献中所描述的常规方法进行。参见例如Sambrook等人,Molecular Cloning:A Laboratory Manual(第2版,Cold Spring Harbor LaboratoryPress,Cold Spring Harbor,N.Y.(1989)),其出于任何目的通过引用并入本文。
本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入本文。本发明将通过参考以下实施例而更充分理解。
实施例
这些实施例的提出是为了帮助理解本发明,但并非旨在并且也不应解释为以任何方式限制其范围。实施例不包括对本领域普通技术人员已知的常规方法(分子克隆技术等)的详细描述。
实施例1.共表达嵌合抗原受体(CAR)和TGF-B信号传导调节剂的免疫反应性细胞
此实施例说明在人类T细胞中使用免疫调节系统来共表达TGF-β信号传导调节剂和CAR。将编码TGF-B信号传导调节剂(例如,抗TGFβ和抗TGFβR2)和抗人类CD19 CAR(SJ25C1胞外抗原结合结构域)的免疫调节构建体包装以用于反转录病毒递送。使Phoenix A反转录病毒包装细胞系(ATCC)在DMEM 20% FBS与青霉素/链霉素中生长到50-70%汇合。根据制造商方案,使用编码TGF-B信号传导调节剂和CAR构建体的各个质粒、辅助质粒gag-pol以及pVSVG和转导试剂Fugene HD(Promega)来制备DNA复合物。在转染20-48小时后,收集病毒上清液、等分并冷冻供进一步使用。
使用密度梯度由Leukopaks分离出人类PBMC并冷冻直到进一步使用。由先前冷冻的PBMC通过磁性选择分离出人类T细胞(T细胞分离试剂盒;Stemcell)。将经纯化的人类T细胞在含有2ng/ml人类IL-2(Miltenyi)与T细胞Transact珠粒(Miltenyi)的完全Optimizer培养基(Optimizer基础培养基(ThermoFisher#A10221-01)+26ml OptiMizer补充剂(ThermoFisher#A10484-02)+20ml ICSR(CTS免疫细胞SR),ThermoFisher#A25961-01)+10ml的200mM L-谷氨酰胺,(Gibco25030-081)+PenStrep,(Gibco 15140-122))中培养2天。
将T细胞转移到涂覆有retronectin的板(Takara;40ug/ml retronectin)中并与适当的病毒量进行旋转转导。通过流式细胞术在不同时间点确认和量化转导。简言之,将细胞在4'C下在FACS缓冲液中与250ng hCD19-hFc蛋白(RnD Systems)或内部产生的hGCC-Fc蛋白一起温育1小时。在用FACS缓冲液洗涤后,在室温下使细胞重悬于抗人类FC的二级抗体(Biolegend)中20分钟。在一些实验中添加了抗CD4、CD8或其他表面标志物的抗体。使用可固定活力染料(Thermofisher)将死细胞排除在分析之外。在通过流式细胞术(FACSFortessa,BD Biosciences)分析之前,将细胞固定在PBS2% FCS 4%甲醛中。转导效率显示为对CAR染色呈阳性的活细胞%。流式细胞术结果显示,87.6%淋巴细胞、76.1%单一细胞、78.3%活CD3+细胞和75.8%细胞的群体显示CAR表达(图1A-1D)。转导效率显示为对CAR染色呈阳性的活细胞%(图1E)。
实施例2.使用TGF-β调节型人类CAR-T细胞进行体外杀伤
此实施例说明通过共表达TGF-β信号传导调节剂的人类CAR-T细胞进行体外杀伤。装甲化人类CAR-T细胞的体外杀伤与未装甲化CAR-T细胞相当。
根据制造商的方案将Raji(ATCC CD19阳性)或Raji CD19ko(人类CD19阴性)用增殖染料efluor 450(Thermofisher)染色并涂铺在96孔板中至少2小时,之后添加实施例1所述的TGF-β调节型CAR-T细胞。以效应子:靶标为0:1、0.3:1、1:1、3:1、9:1的比率与仅添加T细胞来添加CAR-T细胞,并在37℃下温育过夜。第二天,使用抗人类CD107a(LAMP-1)(Biolegend)、TCRα/β(Biolegend)的荧光染料缀合抗体以及人类CD4抗体(Biolegend)来进行FACS染色。根据制造商的方案,在4℃下将细胞与抗体一起温育30分钟,用PBS洗涤,并用可固定活力染料(Thermofisher)染色。将细胞用1x Annexin V结合缓冲液(Biolegend)洗涤并用Annexin V FITC染色。将细胞固定在cytofix(BD Biosciences)中,之后在FACSFortessa(BD Biosciences)上获取。TGF-β调节型CD19 CAR-T细胞对CD19阳性Raji细胞展现出靶标特异性体外杀伤(图2A),但对CD19阴性对照细胞(Raji CD19ko)则没有(图2B)。
实施例3.由免疫反应性细胞分泌TGF-β调节剂
此实施例展现TGF-β调节型CAR-T细胞分泌共表达的TGF-β调节剂(例如,与TGF-β结合的抗TGF-β以及与TGFβR2结合的抗TGFβR2)。
来自TGF-β调节型CAR-T细胞的上清液是通过ELISA测定以检测抗TGF-β和抗TGFβR2抗体。在4℃下将Maxisorp 96孔板以100μl包被缓冲液中的重组人类TGF-β(4;RnDSystemμg/ml)或hTGFβR2-Fc(0.1mg/ml;RnD System)进行包被过夜。将板以1x洗涤缓冲液洗涤,并在室温下用试剂稀释剂封闭1小时。添加CAR-T上清液、重组TGFβR2-flag、或重组TGF-β-flag抗体并在室温下温育2小时。
在另一次洗涤步骤后,添加缀合有HRP的flag标签抗体并在室温下温育30分钟。将板洗涤并添加TMB底物持续10-20分钟。使用终止试剂终止反应并使用Pherastar读板器以450nm读取板。与以TGF-b scFv VL-VH使用抗flag标签HRP抗体进行结合子检测相比,使用包被的TGF-b的ELISA检测到高水平的TGF-b scFv VH-VL1和TGF-b scFv VH-VL2(图3A)。使用包被的TGFbR2-Fc的ELISA检测到高水平的来自人类CAR-T的TGFbR2 scFv VH-VL、TGFbR2scFv VL-VH和hTGFbR2 VH1,但无法检测到mTGFbR2 VH1(图3B)。TGF-β结合子和TGFβR2结合子由TGF-β调节型CAR-T细胞分泌并结合至其同源抗原。
实施例4.人类CAR-T细胞分泌抗TGF-β/TGFβR2的中和抗体
此实施例说明在TGF-β调节型CAR-T上清液中存在抗TGF-β/TGFβR2的中和抗体。
使用SBE-Luc报告细胞(在Smad结合元件(SBE)(BPS Biosciences)的控制下表达萤火虫荧光素酶的HEK293细胞)进行CAR-T细胞上清液中的TGF-β阻断结合子的功能性评估,其被设计来监测TGF-β/SMAD信号通路的活性。TGF-β蛋白结合于其在细胞表面上的同源受体,引发信号传导级联而导致SMAD2与SMAD3的磷酸化与活化,然后与SMAD4形成复合体。所述SMAD复合体移位至细胞核并与SMAD结合元件(SBE)结合,导致TGF-β/SMAD反应型基因的转录与表达。阻断结合子的存在以其在SBE-Luc报告细胞中抑制TGF-β诱导型荧光素酶表达的能力来检测。评价抑制TGF-β诱导型报告活性的效力的示例性测定进行如下。
以每孔100μl新鲜培养基(含有1x青霉素/链霉素的X-VIVO15)中1x10
第二天,移出100μl培养上清液,并添加100μl的含有Luciferin-D的检测试剂(ONE-Step
使用下列方程式来计算抑制活性(%):
抑制(%)=(1-样本的CPM/经TGF-β(1ng/ml)处理的样本的最大CPM)X100
结果显示来自分泌构建体TGF-βscFv VH-VL1(SEQ ID NO:1)与TGF-βscFv VH-VL2(SEQ ID NO:2)的CAR-T细胞的上清液抑制了TGF-β信号传导(图4)。设计了另外的构建体并使用荧光素酶报告测定来筛选抗TGF-β或TGFβR2的多聚结合子的分泌(图5和图6)。鉴定分泌抗TGF-β与TGFβR2的多聚抗体的TGF-β调节型CAR-T细胞。无论接头如何,人类CAR-T细胞可分泌多聚TGF-b结合子并抑制TGF-b信号传导。如下图所示,分析了四种不同的接头。使用抗GCC CAR-T细胞观测到类似的结果(数据未示出)。
实施例5.TGF-B调节型CAR-T细胞分泌抗TGF-β或TGFβR2的多聚结合子
此实施例说明分泌抗TGF-β或TGFβR2的多聚结合子的小鼠CAR-T细胞的筛选和鉴定。为了产生小鼠CAR-T细胞,使Platinum-E反转录病毒包装细胞系在DMEM 20% FBS与青霉素/链霉素中生长到50-70%汇合。根据制造商的方案,使用编码CAR构建体和TGFB调节剂(例如,抗TGF-b scFv单体、抗TGF-b scFv二聚体)的免疫调节系统质粒、包装构建体和转导试剂Fugene HD来制备DNA复合物。将溶液混合并在室温下温育10分钟,并且每10cm
在4℃下将细胞与250ng hCD19-hFc蛋白在FACS缓冲液中一起温育1小时。在用FACS缓冲液洗涤后,在室温下使细胞与抗人类FC的二级抗体一起重悬20分钟。在一些实验中,添加了抗CD4、CD8或其他表面标志物的抗体。使用可固定活力染料将死细胞排除在分析之外。通过流式细胞术(FACS Fortessa)分析之前,将细胞固定在PBS2% FCS、4%甲醛中。转导效率显示为对CAR染色呈阳性的活细胞百分比(%)。
流式细胞术结果显示出未装甲化T细胞、TGF-β单体、TGF-β二聚体和未转导细胞的相对比例。在转导后d+2所收集的来自小鼠CAR-T细胞的上清液经探测其在SBE-Luc TGF-b报告测定中的TGF-b信号传导抑制作用(如实施例4所述的方法)。基于荧光素酶报告活性,来自分泌TGF-b scFv单体与二聚体的小鼠CAR-T的上清液抑制了TGF-b信号传导。鉴定分泌抗TGF-β与TGFβR2的多聚抗体的小鼠CAR-T细胞。
在转导后两天收集上清液并冷冻在-80'C直到用于ELISA。如实施例3所述进行ELISA。使用人类重组TGFbR2-Fc蛋白以捕捉抗人类TGFbR2的结合子,并使用小鼠重组TGFbR2-Fc蛋白来探测TGFbR2结合子与小鼠TGFbR2的结合。使用抗flag HRP抗体与个别底物来检测结合。如图7所示,结合子hTGFbR2-VH2和hTGFbR2-VH3单体与二聚体的分泌以及TGFbR2 scFv VH-VL的单体与二聚体与人类TGFbR2结合。所测试上清液中没有任何一个结合子会与小鼠TGFbR2结合,证实了对于人类TGFBR2的特异性。
实施例6.分泌TGF-β信号传导调节剂的CAR-T细胞的体内抗肿瘤功效
此实施例说明分泌抗TGF-βmAb的CAR-T细胞的体内抗肿瘤功效。小鼠装甲化CAR-T细胞(共表达抗人类CD19 CAR与TGFb信号传导调节剂)相比于未装甲化CAR-T细胞更好地抑制了同基因的EMT6-hCD19肿瘤生长。另外,装甲化CAR-T细胞降低了肝脏与肺的转移。生成了过度表达作为CAR-T靶抗原的人类CD19和萤火虫荧光素酶的EMT6乳腺癌细胞系。EMT6细胞以带有编码在EF1a启动子控制下的人类CD19的质粒并具嘌呤霉素抗性的病毒进行转导。使用嘌呤霉素正向选择EMT6-hCD19细胞并进一步通过FACS分选纯化。在聚凝胺存在下,EMT6-hCD19细胞用带有编码在EF1a启动子控制下的萤火虫荧光素酶的质粒并具新霉素抗性(Amsbio)的病毒以5x10
以0.2x10
每周测量肿瘤尺寸两次并使用以下公式计算肿瘤体积:肿瘤体积(mm
相对于未装甲化CAR-T或未转导CAR-T细胞,分泌TGF-β结合子的CAR-T细胞显示出高的抗肿瘤功效。通过注射荧光素并通过IVIS成像,对肝脏和肺进行表达萤火虫荧光素酶的肿瘤细胞进行成像。将D-荧光素溶液(D-荧光素,Vivo Glo
分泌出抗TGF-β(TGF-b scFv VH-VL1)的抑制性抗体的抗人类CD19的小鼠CAR-T相比于未装甲化CAR-T细胞更好地抑制了同基因的EMT6-hCD19肿瘤生长并降低了肝脏与肺的转移。先前已滴定分析CAR-T细胞的数量以得到对于未装甲化CAR-T的次优效果,以鉴定装甲化CAR-T细胞的改进活性。
实施例7.分泌TGFbR2胞外结构域(ECD)的装甲化小鼠CAR-T细胞抑制TGFb信号传
进行了SBE-Luc TGF-β报告测定,其比较来自分泌不同TGF-β配体陷阱(TGF-βscFvVH-VL1至TGFbR2 ECD单体、同质二聚体(图9A)和异质二聚体(图9B))的装甲化小鼠CAR-T的上清液与未装甲化CAR-T的上清液。SBE-Luc TGF-β报告测定显示出来自分泌TGFβR2胞外结构域(ECD)二聚体的抗人类CD19的装甲化小鼠CAR-T的上清液有很好的抑制效果(但分泌单体的则无),并显示出分泌TGF-βscFv VH-VL1二聚体的也有相当抑制效果。在转导后2天收集上清液。评估包括TGFβR2 ECD和TGFβR1 ECD的TGFβR2 ECD异质二聚体抑制作用。鉴定出抑制TGF-b信号传导的TGFβR2 ECD异质二聚体比TGF-βscFV VH-VL1更为有效。示例性TGFβR2 ECD序列示于表4中。
表4.示例性TGFβR2 ECD序列
/>
实施例8.分泌TGF-β信号传导调节剂的装甲化CAR-T细胞的抗肿瘤功效
此实施例说明分泌抗TGFβmAb或TGFβR2-ECD的CAR-T细胞在体内的相对抗肿瘤功效。
与未装甲化CAR-T细胞相比,分泌TGFβR2 ECD1+2二聚体的小鼠CAR-T显示出在体内改进的抗肿瘤作用。以0.2x10
分泌TGF-β配体陷阱(mTGFbR2 ECD1+2二聚体1)的抗人类CD19的小鼠CAR-T相比于未装甲化CAR-T细胞更好地抑制了同基因的EMT6-hCD19肿瘤生长,与接受未装甲化CAR-T或未转导的T细胞、或用全身性抗TGF-β抗体治疗(1D11,10mg/kg,每周3x i.v.)的对照小鼠中的没有完全反应相比,其诱导了3个完全反应。(图10)。
实施例9.分泌TGF-β信号传导调节剂的装甲化CAR-T细胞在同基因的肿瘤模型
此实施例说明分泌抗TGFβmAb或TGFβR2-ECD的CAR-T细胞在体内的相对抗肿瘤功效。用抗TGF-b mAb(TGF-b scFv VH-VL1)装甲化的小鼠CAR-T细胞在不同的同基因肿瘤模型(MC38-hCD19)中有改进的作用。
生成了过度表达作为CAR-T靶抗原的人类CD19和萤火虫荧光素酶的MC38结直肠癌细胞系并用于进行成像。简言之,MC38细胞以带有编码在EF1a启动子控制下的人类CD19的质粒并具嘌呤霉素抗性(CD19_FL_WT_pLVX-EF1a-IRES-Puro)的病毒进行转导。使用嘌呤霉素正向选择MC38-hCD19细胞。MC38-hCD19细胞以带有编码在EF1a启动子控制下的萤火虫荧光素酶的质粒并具新霉素抗性(Amsbio,目录号LVP435-PBS,以5x10^7IFU/mL,MOI=10)的病毒在聚凝胺的存在下进行转导。使用G418(遗传霉素)正向选择MC38-hCD19-Fluc细胞。
以0.2x10
分泌抗TGF-β(TGF-b scFv VH-VL1)的抑制性结合子的CAR-T细胞显示出优于未装甲化CAR-T的功效,与接受等量的未装甲化CAR-T或未转导的T细胞的对照组的没有完全反应相比,其在8只经治疗小鼠中诱导了7个完全反应。(图11)。
实施例10.分泌TGF-β信号传导调节剂的CAR-T细胞增强了宿主免疫反应的活化
此实施例展现了RNA Seq,显示出宿主免疫反应受到分泌抗TGF-β的结合子的CAR-T细胞而增强活化。
以0.2x10
在第+12天将小鼠安乐死并采集肿瘤,速冻并保持在-80'C。提取RNA并且进行RNA-Seq和接着计算分析,如图12所示。
与来自其他组的小鼠相比,来自接受分泌TGF-βscFv VH-VL1的CAR-T的小鼠的肿瘤的肿瘤浸润性T细胞(CD3d+,CD3e+,CD3g+)评分显著增加,特别是CD8+T细胞(CD8a+)和细胞杀伤T细胞(GzmB+)(图13)
ssGSEA富集评分显示出来自接受分泌TGF-βcFv VH-VL1的CAR-T的小鼠肿瘤中的T细胞特征和IFNg特征增加,指示CAR-T细胞的浸润增加和/或内源性免疫系统的活化增加。在来自接受分泌TGF-βscFv VH-VL1的CAR-T的小鼠肿瘤中的经活化内皮细胞、共刺激和抗原呈递的特征增加,清楚显示出内源性免疫系统的活化。因此,以阻断抗体(或其他结合子)来装甲化CAR-T细胞抑制了TGF-β通路抗肿瘤功效,至少部分地通过改善内源性免疫反应。(图14)。
实施例11.来自用未装甲化CAR-T细胞治疗的EMT6-hCD19小鼠的肿瘤样本的FACS
以0.2x10
在第+7天将小鼠安乐死并采集肿瘤,称重并进行FACS分析。简言之,将肿瘤切成小片并根据制造商的说明使用小鼠肿瘤解离试剂盒(Miltenyi)消化。使样本重悬于PBS2%FCS中,过滤并接种到96孔板中进行FACS染色。阻断Fc受体(TruStain FcX(抗小鼠CD16/32)抗体;Biolegend)并且在4'C下使用rhuCD19(RnD Systems)标记CAR持续1小时,其后使用抗人类IgG Fc抗体标记hCD19-Fc,表面标志物包括TCRa/b、CD8a、CD4、CD25、CD62L、CD11b、Gr1、CD11c、CD45.1和CD45,使用可固定活力染料(ebioscience)对活细胞染色,并且包括GzmB、Ki67和FoxP3的胞内抗原是使用eBioscience Foxp3/转录因子染色缓冲液组(Thermofisher)进行染色。将样本过滤并在BD Fortessa流式细胞仪上获取。
如图15所示,与接受未转导的细胞或未装甲化CAR-T的对照组相比,FACS染色显示出来自接受分泌TGF-βscFv VH-VL的CAR-T的小鼠的样本中的hCD19+肿瘤细胞减少,并且T细胞浸润(每mg肿瘤组织)增加。对CD45.1+和CD45.1-T细胞进行门控显示内源性T细胞浸润(CD45.1-)特别增加。来自这些样本的转移CAR-T细胞(CD45.1+)的CAR表达水平较高,并且CD8+T细胞显示CD25表达较高,表示活化增加。来自宿主T细胞(CD45.1-)的CD8+T细胞的GzmB表达较高,表示细胞毒性较高。总而言之,这些FACS数据表示以抗TGF-β的结合子装甲化CAR-T细胞增强了CAR-T细胞的作用和内源性免疫反应。
实施例12.异种移植模型显示以抗TGF-β或抗TGFβR2阻断抗体装甲化的人类GCC-
以2x10
TGFβ调节剂的肿瘤和血浆浓度是使用抗Flag免疫捕捉LC/MS测定法来测定的。如图17A-17D所示,以装甲化CAR-T细胞处理的小鼠的循环中有少量TGF-β抗体或抗TGFbR2抗体分泌。使用EDTA管从以指定量的装甲化或未装甲化抗GCC CAR-T细胞处理的小鼠收集血浆。
如图20A-20C所示,装甲化CAR-T细胞在GCC阳性GSU、HT55和MDA-MB-231-FP4 Luc异种移植模型中也展现出抗肿瘤活性。
使用脾内注射HT55肿瘤细胞并且接着静脉内注射CAR-T细胞来评价肝脏转移。相对于同种型对照,装甲化CAR-T细胞减缓了向肝脏的转移(图21A-21C)
实施例13.GCC阳性肿瘤中的重复抗原刺激
将未装甲化或装甲化(共表达抗GCC CAR和TGFβ调节剂(例如,TGFβR2-VHH))的100,000个抗GCC CAR-T细胞与200,000个HT29-GCC或HT29亲本(GCC阴性)肿瘤细胞在TGF-β(1ng/ml或10ng/ml)存在或不存在下一式两份地共培养。每3-4天在相同条件下将每孔一半的CAR-T细胞转移到新的肿瘤细胞板(存在或不存在TGF-β1ng/ml或10ng/ml)。收集上清液并且冷冻以供以后评价。评价细胞的细胞计数和FACS染色分析。
根据制造商的方案,使用CellTiterGlo(Promega)评估肿瘤细胞。
使用Pherastar读板器分析板。使用以下公式评估杀伤百分比:
杀伤%=(1–(测试孔信号/对照孔信号))*100
对照孔含有与来自相同供体的未转导的T细胞(用于CAR-T细胞)共培养的肿瘤细胞。FACS染色使用抗人类CD4、CD8、CD25和耗竭标志物PD-1、TIM-3、Lag-3和TIGIT抗体(Biolegend)的荧光染料缀合抗体每周进行一次。使用可固定活力染料efluor 506(Thermofisher;根据制造商的方案)来排除死细胞。表达CAR的细胞在4'C下与GCC-hFc一起温育1小时,用PBS2% FCS洗涤并用二级小鼠抗人类IgG抗体(30分钟,4'C)进行检测。
在与靶细胞再刺激几轮(模拟慢性抗原活化)后,TGF-β诱导对CAR-T细胞功能的抑制。只有分泌TGFβ调节剂(例如,TGFβR2 VHH二聚体)的CAR-T细胞受到保护,免于TGF-β(1ng/ml或10ng/ml)刺激的抑制作用(图18A-18C)。对CAR-T杀伤的抑制效果与耗竭标志物Lag3的增殖与诱导的抑制相关。
实施例14.间皮素(Msln)阳性肿瘤中的重复抗原刺激
将大约100,000个iPSC衍生的抗Msln CAR-T细胞(共表达抗Msln的CAR与TGFβ调节剂(例如,TGFβR2-VH或dnTGFbR2))或抗GFP的对照VH(Msln-对照VH)与40,000个过度表达人类Msln的MiaPaca-2肿瘤细胞在TGF-β(R&D Systems,10ng/ml)存在或不存在下一式两份地共培养。TGFβR2-VH由CAR-T细胞分泌,而dnTGFbR2与CAR-T细胞膜结合。每3-4天在相同条件下将每孔一半的CAR-T细胞转移到新的肿瘤细胞板(存在或不存在TGF-β10ng/ml)。收集上清液并且冷冻以供以后评价。在选定时间点通过流式细胞术对CAR-T细胞进行计数并且进行FACS表型分型(图22A)。
根据制造商的方案,使用CellTiterGlo(Promega)评估肿瘤细胞的存活率。使用Pherastar读板器分析板。使用以下公式评估杀伤百分比:
对照孔仅含有肿瘤细胞但不含效应子(即CAR-T)细胞。细胞毒性百分比示于图22B中。
使用Sytox Red染料(Thermofisher,根据制造商的方案)排除死细胞以进行细胞计数,并且在Fortessa流式细胞仪(BD Biosciences)上使用HTS单元获取等体积的细胞悬浮液。通过对活细胞、单一细胞和大小进行门控来计数活CAR-T细胞。将结果外推以获得每孔的细胞数。
观测到在与靶细胞进行几轮再刺激(模拟慢性抗原活化)后,TGF-β诱导对CAR-T细胞功能(即杀伤)的抑制并抑制CAR-T细胞增殖。只有表达TGFβ调节剂(例如,分泌TGFβR2 VH二聚体或表达膜结合dnTGFbR2)的CAR-T细胞受到保护,免于TGF-β(10ng/ml)的抑制作用,但对照VH则没有。
序列表
下表5提供了本文所公开的描述与序列。
表5.序列表
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
等同方案和范围
本领域技术人员将认识到或者能够仅使用常规实验即可确定本文所描述的本发明特定实施方案的许多等同方案。本发明的范围并不旨在受限于以上描述,而实际上如所附权利要求中所阐述。
已描述本发明的至少一个实施方案的几个方面,应当理解,各种变更、修饰和改进对于本领域技术人员来说将是显而易见的。此类变更、修饰和改进旨在成为本公开的一部分,并且旨在落入本发明的精神和范围内。因此,前面的描述和附图仅作为示例,并且本发明由所附的权利要求书详细描述。
在权利要求书中使用例如“第一”、“第二”、“第三”等序数术语来修饰权利要求要件本身,并不意味着某一权利要求要件相对于另一个权利要求要件的任何优先、先行或顺序,或方法执行的时间顺序,而仅作为标示,以将具有特定名称的一个权利要求要件与具有相同名称(但使用所述序数术语)的另一个要件区分开来,以区分各权利要求要件。
如本文在说明书和权利要求中使用的冠词“一(a)”和“一(an)”,除非明确相反指出,否则应理解为包括多个提及物。除非另有说明,否则如果所述群组的一个、超过一个或所有成员存在于、使用于或以其他方式相关于给定产品或过程,则在一个或多个群组成员之间包括“或”的权利要求或描述被视为已满足,除非上下文相反或以其他方式明显指出。本发明包括其中所述群组中恰好有一个成员存在于、使用于或以其他方式相关于给定产品或过程的实施方案。本发明还包括其中多于一个或整个群组成员存在于、使用于或以其他方式相关于给定产品或过程的实施方案。此外,应当理解,本发明涵盖所有变化、组合和排列,其中来自所列权利要求的一者或多者的限制、要件、子句、描述性术语等,被引入另一从属权利要求中相同的基本权利要求(或相关的任何其他权利要求)中,除非另有说明或除非本领域普通技术人员可明显看出矛盾或不一致。在要件以列表形式呈现的情况下(例如,以马库什组(Markush group)或类似格式),应当理解,还公开了所述要件的每个子组,并且可从所述群组中去除任一要件。应当理解,一般而言,本发明或本发明方面被称为包含特定要件、特征等的情况下,本发明的某些实施方案或本发明的各方面由或基本上由此类要件、特征等组成。为了简单起见,在本文中这些实施方案并未在每种情况下以如此多的词语具体阐述。还应当理解,本发明的任何实施方案或方面都可明确地从权利要求中排除,而不论特定的排除是否在说明书中有陈述。用于描述本发明的背景并提供关于其实施的额外细节所引用的出版物、网站和其他参考文献材料特此通过引用并入。
- 用于抑制WNT信号传导的组合物和方法
- 用于选择抗细胞凋亡信号传导细胞的装置和方法及其用途
- 用于癌症免疫疗法的CRISPR-CPF1相关方法、组合物和组分
- 用于通过光疗法来治疗牛皮癣的方法、组合物和设备
- 结合诱导的Notch信号传导的过继T细胞疗法的方法和组合物
- 用于调节单核细胞和巨噬细胞发炎表型的组合物和方法以及其免疫疗法用途
