体外诱导NK细胞扩增试剂盒及体外诱导NK细胞扩增方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于细胞培养技术领域,具体涉及一种体外诱导NK细胞扩增试剂盒及体外诱导NK细胞扩增的方法。
背景技术
过继性细胞免疫治疗是将淋巴细胞经体外刺激培养后回输给肿瘤病人,直接杀伤肿瘤细胞或激发机体免疫反应来杀伤肿瘤细胞,进行肿瘤治疗的一种生物治疗方法。自然杀伤细胞(NK细胞)作为机体免疫的第一道防线,不仅可以在天然系统上发挥其主要杀瘤效应,而且在免疫反应的早期可以分泌不同的细胞因子和各种趋化因子来调节机体获得性免疫应答,是机体发挥免疫效应不可或缺的效应细胞。但人外周血中NK细胞仅占单个核细胞总数的5%-20%,用于过继性细胞免疫治疗其细胞数远远不够。所以需要一款NK细胞诱导扩增试剂盒,用于体外扩增外周血NK细胞。
Stefan Carlens,et al.,A new method for in vitro expansion ofcytotoxic human CD3-CD56+natural killer cells,Human Immunology,2001,62(10):1092-1098公开了一种细胞毒性人CD3
CN201710791174.8公开了一种生产自然杀伤细胞的方法,其方法可以得到纯度达99.8%的NK细胞,不足之处是诱导NK细胞扩增前需要使用NK细胞富集试剂盒将NK细胞从PBMC中纯化出来,该方法操作繁琐,且NK细胞富集试剂盒价格昂贵。
Denman C J,et al.Membrane-Bound IL-21 Promotes Sustained Ex VivoProliferation of Human Natural Killer Cells[J].Plos One,2012公开了一种以人白血病K562细胞作为滋养层细胞扩增自然杀伤细胞的方法,其方法可以获得大量、高纯度的NK细胞,但K562作为肿瘤细胞,虽然经过辐照处理已经不再具备增殖能力,但其潜在风险难以证明可以完全排除。
发明内容
本发明克服了现有技术中想要从外周血PBMC中诱导、扩增出大量高纯度NK细胞要么使用滋养层细胞要么在培养前需纯化的缺点,提供了一种体外诱导NK细胞扩增试剂盒及体外诱导NK细胞扩增的方法。
本发明提供了一种不使用滋养层细胞且无需提前富集自然杀伤细胞的情况下,安全、高效、稳定地扩增自然杀伤细胞的方法:CD3抗体、CD16抗体、NKG2D抗体和2B4抗体被用作激活抗体,其中CD3抗体、CD16抗体作为第一个激活信号,NKG2D抗体和2B4抗体作为第二个激活信号,四个抗体结合可以最大程度激活NK细胞;IL-2、IL-15、IL-21被用作活化因子;IL-2还被用作扩增因子;贝拉西普被用作T细胞抑制剂,有效提高NK的纯度。
根据本发明的一个方面,本发明涉及一种体外诱导NK细胞扩增试剂盒,其含有:
A组合物,含有CD3抗体、CD16抗体、NKG2D抗体和2B4抗体;
B组合物,含有贝拉西普;
C组合物,含有IL-15和IL-21。
优选地,进一步含有IL-2。
优选地,所述A组合物在缓冲液中含有1-5ng的CD3抗体、0.2-1μg的CD16抗体、10-50μg的NKG2D抗体和0.1-0.5μg的2B4抗体;
优选地,所述B组合物在缓冲液中含有20-100μg的贝拉西普;
优选地,所述C组合物在缓冲液中含有5-20μg的IL-15和5-20μg的IL-21。
优选地,进一步含有50-200万IU的IL-2。
在一个优选的实施方案中,所述试剂盒含有:
A组合物,其在缓冲液中含有2.5-10ng/mL的CD3抗体、0.5-2μg/mL的CD16抗体、25-100μg/mL的NKG2D抗体和0.25-1μg/mL的2B4抗体;
B组合物,其在缓冲液中含有50-200μg/mL的贝拉西普;
C组合物,其在缓冲液中含有5-10μg/mL的IL-15和5-10μg/mL的IL-21。
优选地,进一步含有50-200万IU的IL-2。
在进一步优选的实施方案中,所述A组合物中,CD3抗体的浓度为5ng/mL,CD16抗体的浓度为1μg/mL,NKG2D抗体的浓度为50μg/mL,2B4抗体的浓度为0.5μg/mL;所述B组合物中,贝拉西普的浓度为100μg/mL;所述C组合物中,IL-15的浓度为6.67μg/mL,IL-21的浓度为6.67μg/mL。优选地,进一步含有100万IU的IL-2。
在更进一步优选的实施方案中,所述A组合物为500μL,所述B组合物为500μL,所述C组合物为1.5mL。
优选地,本发明的试剂盒由上述物质组成。
优选地,缓冲液为PBS缓冲液。
优选地,所述NK细胞来自人外周血。
本领域技术人员可以理解,各种抗人CD3抗体、抗人CD16抗体、抗人NKG2D抗体和抗人2B4抗体均可用于本发明,例如,鼠抗人、羊抗人、兔抗人等等。优选单克隆抗体。
本领域技术人员可以理解,本发明试剂盒中可以含有单次扩增用量,也可以含有多次扩增用量。例如,体外诱导扩增约3E7的PBMC细胞(一般分离自20-30mL人外周血),需要500μL的A组合物、500μL的B组合物、1.5mL的C组合物,100万IU的IL-2。
本发明的试剂盒与NK细胞无血清培养基配合使用。本领域技术人员可以理解,各种NK细胞无血清培养基都可与本发明的试剂盒配合使用,例如友康生物科技(北京)股份有限公司生产的NK细胞无血清培养基4.0版、
根据本发明的另一个方面,本发明涉及上述试剂盒的制备方法,包括如下步骤:将CD3抗体、CD16抗体、NKG2D抗体和2B4抗体溶于缓冲液中,0.22μm滤膜过滤;将贝拉西普溶于缓冲液中,0.22μm滤膜过滤;将IL-15和IL-21溶于缓冲液中,0.22μm滤膜过滤。
根据本发明的另一个方面,本发明涉及一种使用上述试剂盒体外诱导NK细胞扩增的方法,包括以下步骤:
(1)在NK细胞无血清培养基中加入IL-2,混匀得培养基A;在NK细胞无血清培养基中加入IL-2和C组合物,混匀得培养基B。
优选地,培养基A中IL-2的浓度为25-100万IU/L,更优选50万IU/L。
优选地,培养基B中IL-2的浓度为25-100万IU/L,更优选50万IU/L;C组合物的体积百分比为0.05-0.3%,更优选0.15%。
(2)第0天,用A组合物包被培养容器。
优选地,在培养容器中加入缓冲液和A组合物,孵育,弃去上清。
优选地,进一步在弃去上清后用缓冲液清洗至少1次。
优选地,A组合物的用量为100μL-2mL,更优选500μL。
优选地,缓冲液为PBS缓冲液。
优选地,于37℃、5%CO
(3)第0天,在步骤(2)培养容器中加入培养基A、B组合物、血浆和PBMC细胞,于37℃、5%CO
优选地,细胞密度为1E6/mL-2E6/mL,更优选1.5E6/mL。
优选地,B组合物的用量为100μL-2mL,更优选500μL。
优选地,血浆在培养物中的体积百分比为10%。
(4)第14-16天,收获细胞,培养期间补加培养液。
在一个实施方案中,所述培养液由培养基B和/或培养基A组成。
在一个实施方案中,所述培养液由血浆,以及培养基B和/或培养基A组成。
优选地,分别于第3、5、7、9、11天补加培养液。
优选地,第3、5、7天补加的培养液中含有血浆;更优选地,第3、5天补加的培养液中含有以体积百分比计5%的血浆;第7天补加的培养液中含有以体积百分比计1%的血浆。
优选地,第3、5天以1:1.5-2.5补加培养液;第7天以1:0.5-2.5补加培养液;第9、11天以1:0.5-1.5补加培养液。
优选地,第13天以1:0.2-0.6补加培养液。
优选地,培养容器为TC处理的培养瓶或培养袋。
在一个优选的实施方案中,本发明的体外诱导NK细胞扩增的方法,包括以下步骤:
(1)配置含有25-100万IU IL-2的NK细胞无血清培养基1L,得培养基A;配置含有25-100万IU IL-2、以体积百分比计0.05-0.3%C组合物的NK细胞无血清培养基1L,得培养基B。
优选地,培养基A中含有50万IU IL-2。
优选地,培养基B中含有50万IU IL-2,C组合物的体积百分比为0.15%。
(2)第0天,在培养容器中加入缓冲液和100μL-2mL A组合物,于37℃、5%CO
优选地,进一步在弃去上清后用缓冲液清洗至少1次。
优选地,A组合物的用量为500μL。
优选地,缓冲液为PBS缓冲液。
(3)第0天,在步骤(2)培养容器中加入培养基A、B组合物100μL-2mL、血浆2mL和PBMC细胞,共计20mL,于37℃、5%CO
优选地,细胞密度为1E6/mL-2E6/mL,更优选1.5E6/mL。
优选地,B组合物的用量为500μL。
(4)第3天,补加血浆和培养基B共40mL,其中血浆2mL;
(5)第5天,补加血浆和培养基B共120mL,其中血浆6mL;
(6)第7天,细胞密度≥1.5E6/mL的,补加血浆和培养基B共360mL,其中血浆3.6mL;细胞密度<1.5E6/mL的,补加血浆和培养基B共180mL,其中血浆1.8mL;
(7)第9天,步骤(6)中细胞密度≥1.5E6/mL的,补加剩余的培养基B和培养基A共计540mL;步骤(6)中细胞密度<1.5E6/mL的,补加培养基B 360mL;
(8)第11天,步骤(6)中细胞密度≥1.5E6/mL的,补加剩余的培养基A;步骤(6)中细胞密度<1.5E6/mL的,补加剩余的培养基B和培养基A共计720mL;
(9)第13天,步骤(6)中细胞密度<1.5E6/mL的,补加剩余的培养基A;
(10)第14-16天,收获细胞。
本领域技术人员可以理解,血浆和PBMC可以来自于同一个体,也可以来自于不同个体。优选地,血浆和PBMC来自于同一个体。更优选地,来自于人外周血。
本发明中,上述方法并非以疾病的诊断和治疗为目的。
本发明的有益效果在于:
1、不使用滋养层细胞,组成成分均为为临床治疗级别药物或因子;
2、无需提前富集NK,直接接种PBMC;
3、培养流程简单,稳定性好,样本容错率高,初始NK占比低至5%也可实现90%以上阳性率,降低T细胞污染而导致的细胞因子风暴的风险;
4、使用20-30mL外周血、接种约3E7的PBMC即可获得50-60亿足够的输注量细胞,NK细胞扩增达1000-3000倍;
5、高表达CD56等杀伤性表面蛋白,对癌细胞杀伤效果好。
附图说明
图1显示了实施例2中培养第3天细胞生长图
图2显示了实施例2中培养第5天细胞生长图
图3显示了实施例2中培养第7天细胞生长图
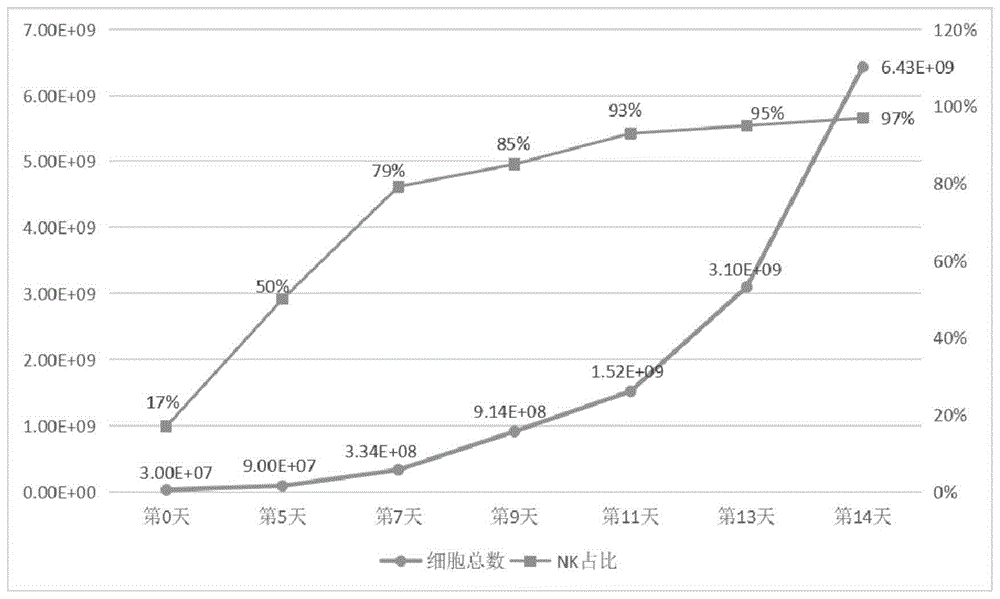
图4显示了实施例2中培养14天细胞生长曲线图
图5显示了实施例2中培养14天流式检测结果图
图6显示了实施例3中NK细胞以不同比例与K562靶细胞孵育后对K562杀伤率
图7显示了实施例4中NK细胞以不同比例与K562靶细胞孵育后CD107a表达率
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明所记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本发明所限定的范围。
实施例1.制备体外诱导NK细胞扩增试剂盒
本发明克服了现有技术中想要从外周血PBMC中诱导、扩增出大量高纯度NK细胞要么使用滋养层细胞要么进行培养前纯化的缺点,提供了一种体外诱导NK细胞扩增试剂盒,通过以下方法制备:
配制A组合物:取250ng CD3抗体(Biolegend,clone OKT3)、50μg CD16抗体(BD,clone 3G8)、2.5mg NKG2D抗体(RD,clone 149810)和25μg 2B4抗体(RD,clone C1.7)溶于PBS溶液中,再用PBS溶液定容至50mL,0.22μm滤膜过滤,分装,500μL/支。
配制B组合物:取5mg贝拉西普溶于PBS溶液中,再用PBS溶液定容至50mL,0.22μm滤膜过滤,分装,500μL/支。
配制C组合物:取1mg IL-15和1mg IL-21溶于PBS溶液中,再用PBS溶液定容至150mL,0.22μm滤膜过滤,分装,1.5mL/支。
以上A、B、C组合物各1支组成体外诱导NK细胞扩增试剂盒,于-20℃冻存。试剂盒中还可以进一步含有100万IU IL-2。
实施例2.使用体外诱导NK细胞扩增试剂盒培养外周血PBMC
本发明克服了现有技术中想要从外周血PBMC中诱导、扩增出大量高纯度NK细胞要么使用滋养层细胞要么进行培养前纯化的缺点,提供了一种体外诱导NK细胞扩增的方法,包括以下步骤:
1.采集健康成年人外周血(46岁男性)30mL,通过下述步骤分离血浆、提取PBMC,计数、备用:
(1)将外周血置于50mL离心管中,室温700g离心15min,取上层淡黄色液体置于50mL离心管中,水浴下于56℃灭活30min。
(2)室温900g离心10min,取上清于-20℃放置15min,再次室温900g离心10min,上清即血浆,于4℃保存。
(3)取步骤(1)下层红色液体用等体积生理盐水稀释并混匀,将混匀后的细胞加到等体积的淋巴细胞分离液(GE Ficolll Paque PREMIUM,17-5442-03)上层,使其和淋巴细胞分离液形成明显的分层,室温700g离心30min。
(4)吸取单个核细胞(白膜层)并置于50mL离心管中,加入等体积生理盐水,室温700g离心10min,弃上清,再加入40mL生理盐水,室温200g离心10min,弃上清。用37℃的NK细胞无血清培养基(4.0版,友康生物科技(北京)股份有限公司,货号AN0102.2,批号NC11211201,下同)重悬细胞,备用,同时取少量细胞悬液测细胞密度。
2.配制培养基A:NK细胞无血清培养基1L中加入50万IU IL-2,混匀备用。
3.配制培养基B:NK细胞无血清培养基1L中加入50万IU IL-2和实施例1制备的C组合物1支,混匀备用。
4.第0天培养瓶包被:在2个TC处理的T25培养瓶中分别加入5mL PBS溶液和250μL实施例1制备的A组合物,混匀后于37℃、5%CO
5.第0天PBMC接种:在每个培养瓶中分别加入培养基A、250μL实施例1制备的B组合物、体积比为10%的自体血浆(1mL,前述步骤1(2)获得,下同)和PBMC细胞(前述步骤1(4)获得),总体积分别为10mL,细胞密度为1.5E6/mL。
6.第3天:在每个培养瓶中分别补加19mL培养基B和体积比为5%的自体血浆(1mL)。
7.第5天:将2个培养瓶中的培养基和细胞转移至1个TC处理的T175培养瓶中,补加114mL培养基B和体积比为5%的自体血浆(6mL)。
8.第7天:将培养瓶中的培养基和细胞转移至培养袋中,取样计数,密度在≥1.5E6/mL,1:2补液,补加356.4mL培养基B和体积比为1%的自体血浆(3.6mL)。如果密度在<1.5E6/mL,1:1补液,补加178.2mL培养基B和体积比为1%的自体血浆(1.8mL);如果血浆不足1%则添加全部剩余血浆。
9.第9天:1:1补液,补加培养基B,培养基B不够用培养基A补足。
10.第11天:补加剩余的培养基A。如果步骤8中细胞密度<1.5E6/mL,1:1补液,补加培养基B,培养基B不够用培养基A补足。
11.第13天:如果步骤8中细胞密度<1.5E6/mL,补加剩余的培养基A。
12.第14天收获细胞。
分别于第5、7、9、11、13、14天测细胞密度,计算细胞总数,并测定CD3
以上结果表明,使用本发明的试剂盒无需滋养层细胞,也无需事先从外周血PBMC中诱导、扩增出高纯度NK细胞的情况下就能够在体外诱导NK细胞扩增出大量的高纯度NK细胞,细胞总扩增倍数超过200倍。
实施例3.NK细胞对K562细胞的杀伤效果检测
使用实施例2培养至第14天所得细胞用于K562杀伤能力检测,步骤如下:
1.将K562靶细胞离心去除上清,用PBS溶液重悬至细胞密度为1E6/mL;
2.取5mL细胞重悬液加入5μL CFSE(Thermo Fisher,货号C34554),于37℃染色10min,加入5倍体积含10%FBS的RPMI 1640再孵育5min,离心去除上清后用NK细胞无血清培养基重悬至细胞密度为1E6/mL;
3.将5E4个K562靶细胞(即50μL)加入到96孔板中,设3个复孔,分别以0:1、0.5:1、1:1、2:1的效靶比(效应细胞:K562靶细胞)加入实施例2培养至第14天所得的效应细胞(将效应细胞密度调整为1E6/mL,分别加入0μL、25μL、50μL、100μL),其中0:1组再加5E4个K562靶细胞(即50μL),用NK细胞无血清培养基将总体积调整为200μL/孔;
4.于37℃、5%CO
5.将96孔板中细胞全部取出,使用C6流式细胞仪计数;
6.计算:NK细胞对K562靶细胞杀伤率=(K562细胞接种数-孵育4h后K562细胞残余数)/K562细胞接种数,其中,K562细胞接种数-孵育4h后K562细胞残余数为K562杀伤数。
本实施例结果如下表所示:
以上结果表明,使用本发明的试剂盒诱导扩增的NK细胞保持了良好的活性。
实施例4.NK细胞CD107a脱颗粒能力检测
使用实施例2培养至第14天所得细胞用于NK细胞脱颗粒能力检测,步骤如下:
1.将K562靶细胞离心去除上清,用NK细胞无血清培养基重悬至细胞密度为2.5E5/mL,96孔板中每孔添加80μL,每孔种2E4个细胞。
2.实施例2培养至第14天所得细胞离心去除上清,用NK细胞无血清培养基重悬细胞,将浓度调整为6.7E6/ml,按照效靶比(效应细胞:K562靶细胞)为5:1、2.5:1、1:1、1:5分别每孔添加15、7.5、3、0.6μL的效应细胞,并用NK细胞无血清培养基将总体系调整为200μL/孔。
3.于37℃、5%CO
4.细胞混合物中加入CD3-FITC(PEPROTECH,货号05131-50,下同)、CD56-APC(PEPROTECH,货号08613-80,下同)和CD107a-PE(Biolegend,328608)各5μL,孵育15min,离心去除上清后用PBS重悬细胞,使用C6流式细胞仪检测CD107a表达率。
5.计算:NK脱颗粒比例=K562靶细胞刺激后NK细胞的CD107a表达率(%)-未经K562靶细胞刺激的NK细胞的CD107a自发表达率(%)。
本实施例的结果如下表所示:
实施例5.使用体外诱导NK细胞扩增试剂盒培养不同样本外周血PBMC
随机采集健康成年人(样本一为25岁男性、样本二为35岁女性、样本三为30岁男性)外周血各30mL,按照实施例2相同的方法提取PBMC并检测其初始NK细胞占比:
1.取2E5个PBMC,1500rpm,离心5min;
2.弃上清,用200μL PBS溶液重悬细胞,分别加入CD3-FITC和CD56-APC各5μL,混合均匀;
3.避光室温孵育15min;
4.1500rpm,离心5min;弃上清,用200μL PBS溶液重悬细胞;
5.重复步骤4两次,弃上清,用200μL PBS溶液重悬细胞,使用C6流式细胞仪检测CD3
6.按照实施例2相同的方法培养PBMC诱导NK细胞扩增,测定细胞密度并计算总扩增倍数,按照上述方法检测CD3
本实施例三个样本初始NK细胞占比见下表:
本实施例三个样本培养14天后细胞总扩增倍数及最终NK细胞占比见下表
上述实验结果表明,使用本发明的试剂盒和本发明的方法,培养各种NK细胞占比的样本,均能获得大量高纯度NK细胞,细胞总扩增倍数超过180倍,NK占比均超过90%。
实施例6.使用不同方法体外诱导NK细胞扩增
抽取45岁健康男性外周血60mL,按照实施例2相同的方法分离血浆、提取PBMC,用于以下三种体外诱导NK细胞扩增方法的培养。
本专利:
按照实施例2相同的方法培养PBMC诱导NK细胞扩增,测定细胞密度并计算总扩增倍数,按照实施例5的方法检测NK细胞占比。
珠海贝索的NK高效诱导培养试剂盒(3.0A)(T20202N2):
1.取1mLA因子包被液,加入9ml PBS配制成包被液,用于包被T75培养瓶,轻轻摇晃培养瓶,让混合液在培养瓶表面均匀分布;
2.在室温下放置60分钟,使用前取出,移除包被液;
3.用10mL PBS清洗培养瓶一次;
4.取1mLB因子加入200ml ALyS505NK-AC培养基内,配制成A培养基;
5.取20mL含10%自体血浆的A培养基重新悬浮PBMC细胞,使细胞密度为1.3E6/mL;
6.在步骤3培养瓶中,加入以上细胞悬浮液,置于5%CO2、37℃培养;
7.B培养基配制:添加IL-2到ALyS505NK-EX无血清培养基中,使IL-2的终浓度为1000IU/mL;
8.第3天加入A培养基40mL,第5天加入A培养基140mL和14mL自体血浆,第7天加入B培养基400mL,第9天加入B培养基700mL,第11天加入B培养基700mL,此时总体积2000mL。
9.培养至第14天收集细胞,按照实施例5的方法检测NK细胞占比。
JP2006340698A专利:
1.含100ng/mL OKT3和20μg/mL CD52的500μL PBS加到24孔板中,4℃静置一夜,使用前将24孔板用PBS清洗2次;
2.将PBMC以1E6/mL的密度重悬到KBM581无血清培养基中(含500U/mL IL-2),1mL/孔接种,添加10%的自体血浆。
3.第3、5、7、9、11天,分别补加2mL、6mL、18mL、54mL、19mL KBM581无血清培养基(含500U/mL IL-2),第3、5、7天,分别加入补液体积5%、5%、1%的自体血浆,第11天补液后总体积100mL。
4.培养至第14天收集细胞,按照实例5的方法检测NK细胞占比。
三种体外诱导NK细胞扩增方法培养结果如下:
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种用于NK细胞体外扩增的培养基体系及NK细胞体外扩增的方法
- 一种用于NK细胞体外扩增的培养基体系及NK细胞体外扩增的方法
