一种担载活细胞的模块化生物活性支架及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物材料领域,具体涉及一种担载活细胞的模块化生物活性支架及其制备方法和应用。
背景技术
天然的人体器官及组织是由数量巨大且种类繁多的体细胞构成的。这些细胞以高度有序的方式分布在具有复杂空间结构的三维组织微环境中。而且不同种类的细胞之间存在广泛的交流,并通过旁分泌细胞因子来激活相应的信号通路从而相互影响各自的行为及命运。基于这些重要的发现,科研人员希望通过构建多细胞组织工程支架来重现人体组织内的复杂三维生态位。然而,在大多数研究中,人们仅仅将多种细胞无序地混合在一起然后将之担载到多细胞组织工程支架中。而且,这些研究很难阐明多细胞组织工程支架中各种细胞间的相互作用关系以及不同细胞各自的贡献。因此,构建一个各种细胞在空间上有序分布的多细胞组织工程支架对于系统性研究细胞间相互交流以及复杂组织工程的发展具有深远的意义。
近年来,包括生物打印、微流控芯片及微凝胶组装技术在内的技术的发展使得对多种细胞在空间上分布的调控成为可能。然而,基于这些技术的多细胞构建体仍然有一些不足之处。首先,这些技术的适用材料被限制为水凝胶或者其他柔软的有机生物材料。其次,基于这些技术的多细胞构建体是被一体化制备出来的,且无法被拆卸成单独的部分以研究每种细胞各自的贡献。而且,通过微流控技术制备的多细胞构建体无法用作组织工程植入体用于进一步验证其在体内的促修复效果。因此,对于现有的技术来说,构建一个在再生医学领域具有广泛适用性多细胞组织工程支架仍然具有极大的挑战。
发明内容
针对上述问题,本发明旨在提供一种担载活细胞的模块化生物活性支架及其制备方法和应用。本发明首次提出并制备了担载活细胞的模块化生物活性支架,实现了对不同细胞在支架内部三维空间中分层分布的调控,还利用担载活细胞的模块化生物活性支架构建了多细胞共培养系统。本发明通过模块化组装的策略成功构建出模拟体内骨软骨组织生理结构且兼具促进组织修复功能的多细胞组织工程支架。
第一方面,本发明提供一种担载活细胞的模块化生物活性支架,是将负载活细胞的支架模块形成载细胞模块并对载细胞模块进行组装构建具有定制化三维结构的多细胞组织工程支架,优选包括多层支架模块构成的支架整体框架以及在所述支架整体框架的三维空间中呈现分层分布的多种细胞;进一步优选所述模块化生物活性支架通过调整不同载细胞模块来调控其内部担载的各种细胞的空间分布。
模块化组装能够通过组装不同的载细胞模块构建具有复杂结构的多细胞组织工程支架,而且精准调控不同细胞在支架内部三维空间上的分布。由于模块化生物活性支架可以通过调整不同载细胞模块来精确调控其内部担载的各种细胞的空间分布,所以这种担载活细胞的模块化生物活性支架对于细胞间相互交流的研究及复杂组织工程的发展具有重要的意义。而且这种多细胞模块化支架还能被拆卸成单独的模块以研究每种细胞在系统的贡献。因此,基于模块化组装策略的生物活性支架具有被用作复杂组织修复材料的巨大潜力。
较佳地,所述组装是拼接组装,优选可拆卸的拼接组装。
较佳地,通过不同支架模块的结构形成嵌接配合进行拼装。
较佳地,所述支架模块之间具有足够的空间以利于担载细胞的增殖和分化。
较佳地,不同支架模块上具有支柱以及与所述支柱形成嵌接配合的凹槽。
较佳地,所述支架模块的材质独立地选自生物活性陶瓷、有机物、生物惰性陶瓷中的一种或几种的复合物;优选地,所述支架模块的材质为β相的磷酸三钙、光敏树脂、氧化锆、聚己内酯复合磷酸三钙中的任意一种。
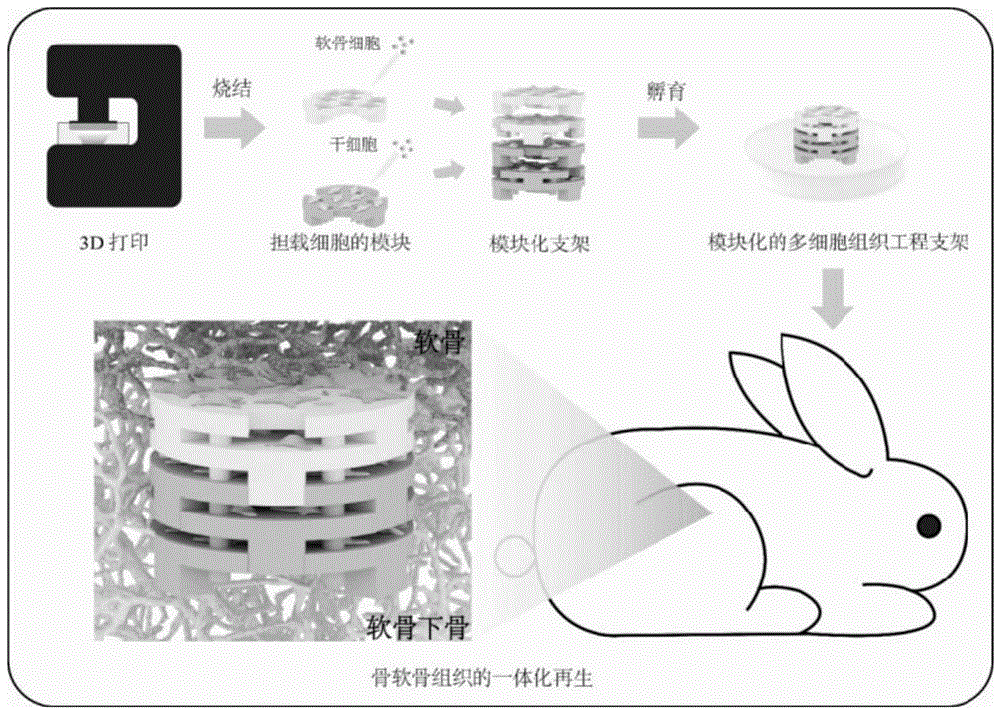
较佳地,所述担载活细胞的模块化生物活性支架由担载软骨细胞的聚己内酯/磷酸三钙复合物基载细胞模块和担载骨髓间充质干细胞的磷酸三钙陶瓷基载细胞模块组装而成;优选地,所述担载活细胞的模块化生物活性支架由五层载细胞模块拼接组装而成,其上两层为担载软骨细胞的聚己内酯/磷酸三钙复合物基载细胞模块,下三层为担载骨髓间充质干细胞的磷酸三钙陶瓷基载细胞模块。该支架的特点在于两种细胞有序分布在支架内部的三维分层结构中,从而模拟人体骨软骨组织的生理结构。软骨细胞分布在支架的上两层,代表软骨组织的主要细胞构成;骨髓间充质干细胞分布在支架的下三层,代表软骨下骨组织中的重要组成细胞。基于以上特点,这种担载活细胞的模块化生物活性支架能够模拟人体内天然骨软骨组织的分层梯度结构,有利于研究细胞间的相互串扰。并且这种模块化生物活性支架还可以作为组织工程植入体用于骨软骨组织的修复。因此,这种担载活细胞的模块化生物活性支架在研究细胞间交流、药物筛选及复杂组织再生等领域具有广阔的应用前景。
第二方面,本发明提供一种担载活细胞的模块化生物活性支架的制备方法。所述制备方法包括:制备支架模块;将细胞接种在支架模块上以形成载细胞模块;将载细胞模块进行组装构建具有定制化三维结构的多细胞组织工程支架。优选地,所述制备方法包括:制备支架模块;将各种细胞接种在支架模块上以形成不同的载细胞模块;将担载有不同活细胞的载细胞模块进行组装构建具有多层结构且多种细胞在空间上有序分布的多细胞组织工程支架。
较佳地,制备支架模块的方法为将支架模块的材料和光敏树脂配制成充分混匀的打印浆料;将打印浆料通过光固化3D打印机制备出支架生坯;将打印出来的支架生坯高温保温烧结得到支架模块;优选地,所述方法还包括将高温保温烧结前的支架模块进行紫外光交联。
第三方面,本发明还提供上述任一项所述的担载活细胞的模块化生物活性支架在再生医学领域尤其是药物筛选、多细胞共培养模型、复杂组织再生方面的应用。
附图说明
图1为本发明中各种模块化的生物支架的设计图及示意图。包括(A)圆形模块化支架。(B)具有汉诺塔结构的模块化支架。(C)方形模块支架。
图2为本发明中圆形支架模块的设计示意图。
图3为本发明中模块化组装的生物陶瓷支架的大体外观和三维重建模型。包括(A)圆形模块化生物陶瓷支架。(B)方形模块化生物陶瓷支架。(C)模块化组装的具有汉诺塔结构的生物陶瓷支架。(D)模块化组装的生物陶瓷支架可以组装成定制的结构,如“SIC”。(E)、(F)圆形模块化生物陶瓷支架的三维重建模型的不同视图。
图4为本发明中基于不同材料体系的模块的外观照片、显微图像及扫描电镜图像。3D打印磷酸三钙模块的(A)照片及(B)显微图像。(C)、(D)不同放大倍数的3D打印磷酸三钙模块的扫描电镜图像。3D打印氧化锆模块的(E)照片及(F)显微图像。(G)、(H)不同放大倍数的3D打印氧化锆模块的扫描电镜图像。聚己内酯/磷酸三钙复合模块的(I)照片及(J)显微图像。(K)、(L)不同放大倍数的聚己内酯/磷酸三钙复合模块的扫描电镜图像。
图5为本发明中不同模块化生物活性支架的力学性能的表征。包括(A)、(B)不同模块化支架的表面硬度和弹性模量。(C)不同模块化组装支架的抗压强度。
图6为本发明中模块化组装支架担载软骨细胞(RCs)与骨髓间充质干细胞(RBMSCs)的共培养和单培养系统用于骨软骨组织一体化修复。(A)软骨细胞与骨髓间充质干细胞的共培养系统的示意图。(B)软骨细胞与骨髓间充质干细胞的共培养和单培养系统在五天内的增殖情况。(C)软骨细胞与骨髓间充质干细胞的共培养和单培养系统的软骨细胞成熟相关基因表达水平。(D)软骨细胞与骨髓间充质干细胞的共培养和单培养系统的成骨基因表达水平。(E)不同组软骨细胞中COL-II蛋白免疫荧光蛋白染色图像。(F)不同组骨髓间充质干细胞中COL-I蛋白的免疫荧光蛋白染色图像。
图7为本发明中担载软骨细胞及骨髓间充质干细胞的模块化组装支架用于细胞间串扰的机制的研究。(A)共培养系统中软骨细胞上调了NFAT1基因的表达。(B)普卡霉素(mithramycin,MTM)处理能够下调共培养系统中骨髓间充质干细胞的RCN2基因的表达。(C)经MTM处理后的骨髓间充质干细胞与软骨细胞共培养后,软骨细胞的NFAT1基因的表达显著上调。(D)经RCN2蛋白,软骨细胞的NFAT1基因的表达明显下调。(E)不同组软骨细胞中NFAT1蛋白的免疫荧光蛋白染色图像。
图8为本发明中模块化组装支架担载巨噬细胞(RAW264.7)与骨髓间充质干细胞(RBMSCs)的共培养和单培养系统用于构建免疫成骨微环境。(A)巨噬细胞与骨髓间充质干细胞的共培养系统的示意图。(B)巨噬细胞骨髓间充质干细胞的共培养和单培养系统在五天内的增殖情况。(C)巨噬细胞与骨髓间充质干细胞的共培养和单培养系统的炎症相关基因表达水平。(D)巨噬细胞与骨髓间充质干细胞的共培养和单培养系统的成骨基因表达水平。(E)不同组巨噬细胞细胞中Arg-1蛋白的免疫荧光蛋白染色图像。(F)不同组巨噬细胞细胞中IL-6蛋白的免疫荧光蛋白染色图像。(G)不同组骨髓间充质干细胞中BSP蛋白的免疫荧光蛋白染色图像。
图9为本发明中模块化组装支架担载脐静脉内皮细胞(HUVECs)与骨髓间充质干细胞(RBMSCs)的共培养和单培养系统用于血管化骨再生。(A)脐静脉内皮细胞与骨髓间充质干细胞的共培养系统的示意图。(B)脐静脉内皮细胞与骨髓间充质干细胞的共培养和单培养系统在五天内的增殖情况。(C)脐静脉内皮细胞与骨髓间充质干细胞的共培养和单培养系统的血管生成基因表达水平。(D)脐静脉内皮细胞与骨髓间充质干细胞的共培养和单培养系统的成骨基因表达水平。(E)不同组脐静脉内皮细胞中CD31蛋白的免疫荧光蛋白染色图像。(F)不同组骨髓间充质干细胞中OPN蛋白免疫荧光蛋白染色图像。
图10为本发明中模块化组装支架担载三种不同体细胞(软骨细胞、骨髓间充质干细胞及脐静脉内皮细胞)构建的多细胞组织工程支架。
图11为本发明中担载软骨细胞和骨髓间充质干细胞的模块化组装支架促进软骨下骨组织再生的体内生物学评价。其中Blank为空白缺损组,Control为纯支架组,Mono-RCs为软骨细胞单培养组,Mono-RBMSCs为骨髓间充质干细胞单培养组,Co-culture为软骨细胞与骨髓间充质干细胞共培养组。(A)术后8周采集的兔子股骨的外观照片。(B)植入支架和新形成的骨的Micro-CT重建图像。(C)统计分析新骨体积与缺损区总体积的比值。(D)不同组的新生骨组织切片的Van-Gieson染色。(E)新骨面积的统计分析。
图12为本发明中担载软骨细胞和骨髓间充质干细胞的模块化组装支架促进软骨再生的体内生物学评价。
图13为本发明从载细胞模块化生物活性支架的制备到细胞实验及动物实验的全部工作流程的示意图。
具体实施方式
通过下述实施方式进一步说明本发明,应理解,下述实施方式仅用于说明本发明,而非限制本发明。
本发明提供一种担载活细胞的模块化生物活性支架。担载活细胞的模块化生物活性支架是将负载活细胞的支架模块形成载细胞模块并对载细胞模块进行组装构建具有定制化三维结构的多细胞组织工程支架,优选包括多层支架模块构成的支架整体框架以及在所述支架整体框架的三维空间中呈现分层分布的多种细胞;进一步优选所述模块化生物活性支架通过调整不同载细胞模块来调控其内部担载的各种细胞的空间分布。
所述模块化生物活性支架由多个模块组装而成。模块形状、尺寸及材质可以根据实际需求来设计,并且可以被组装成各种具有定制化三维结构的模块化支架。例如,所述支架模块可以根据生物活性支架不同的需求及应用场景设计成不同材质、不同的形状及尺寸参数或者担载不同种类的活细胞。
本发明对模块化生物活性支架的材质没有特别限定,例如可为磷酸三钙、羟基磷灰石等生物活性陶瓷,也可为氧化锆及二氧化钛等生物惰性陶瓷,还可以为金属、有机物或者复合材料等。作为示例,支架模块的材质包括但不限于生物活性陶瓷、有机物、生物惰性陶瓷或者有机物与生物活性陶瓷的复合物。优选为β相的磷酸三钙(Ca
本发明对支架模块的形状也没有特别限定。由于主要通过不同支架模块的结构形成嵌接配合进行拼装,所以优选地,支架模块上具有可以互相形成嵌接配合的结构。
单个支架模块的形状不受限制,可以为三角形、圆形、方形及其他复杂形状。根据复杂的现实需求,操作人员还可以设计更定制化的模块化生物活性支架,比如具有汉诺塔结构的支架。
一些实施方式中,支架模块包括支架模块本体和与所述支架模块本体形成嵌接的配合体。所述支架模块本体的结构包括但不限于圆柱体、长方体、棱柱体、多边形柱体等。与所述支架模块本体形成嵌接的配合体的结构包括但不限于键型凹槽、键型大支柱等。作为优选的技术方案,还可以在支架模块上设置其他结构。例如,圆形孔是有利于上下层模块间的液体、气体交流。圆柱状小支柱是确保上下层模块间保持一定的空间有利于细胞生长。
作为示例,支架模块包括第一圆柱状本体和位于所述第一圆片状本体表面的圆形孔、圆柱状小支柱、键型凹槽、键型大支柱。作为该示例的进一步限制,所述第一圆柱状本体的直径为5-20mm,高度为1-2mm;所述圆形孔直径为0.8-1.5mm;所述圆柱状小支柱直径为1-1.5mm,高度为0.8-1.5mm;所述键型凹槽宽为1.5-3mm,长为1-2mm;所述键型大支柱槽宽为1.5-3mm,长为1-2mm,高度为1.5-3mm。
作为另一示例,所述支架模块上具有支柱以及与所述支柱对应嵌接的凹槽。如图2所示,本发明中的支架模块具有四个核心部位,分别是大支柱、小支柱、小孔及凹槽。其中两个支架模块之间的大支柱和凹槽可以相应地组装起来,以确保模块化生物活性支架在生物实验过程中不会散架。小孔的直径约为800μm,可促进不同支架模块上细胞间氧气和营养物质的交换。小支柱能够确保两个支架模块之间有足够的空间从而有利于担载在支架上的细胞的增殖和分化。
一些技术方案中,可以根据实际的力学性能需求来调整模块化生物活性支架的材料选择及结构设计。作为示例,生物活性支架的抗压强度可为2-3MPa。
如前所述,组装是拼接组装,尤其是通过支架模块的结构形成嵌接配合进行拼装。如图3所示,本发明中的模块化生物活性支架可以直接通过预先制备好的模块组装得到。不同的支架模块的组装方式有所不同。例如,圆形模块只能在纵向上堆积形成圆柱型模块化生物活性支架;而方形模块能够在三个方向上拼接形成更复杂的形状,比如字母“SIC”。
作为具体实施方式之一,所述担载活细胞的模块化生物活性支架由担载软骨细胞的聚己内酯/磷酸三钙复合物基载细胞模块和担载骨髓间充质干细胞的磷酸三钙陶瓷基载细胞模块组装而成;优选地,所述担载活细胞的模块化生物活性支架由五层载细胞模块拼接组装而成,其上两层为担载软骨细胞的聚己内酯/磷酸三钙复合物基载细胞模块,下三层为担载骨髓间充质干细胞的磷酸三钙陶瓷基载细胞模块。在该类型的模块化生物活性支架的制备中,首先在上两层的聚己内酯/磷酸三钙复合基支架模块中接种软骨细胞,下三层的磷酸三钙基支架模块中接种骨髓间充质干细胞,然后将所有支架模块组装成完整的担载支活细胞的模块化生物活性架。
天然的骨软骨组织具有明显的梯度分层结构。软骨组织中富含软骨细胞以及二型胶原纤维为主要成分的细胞外基质。过渡区域为钙化软骨,其中的无机矿物含量逐渐增高。处于最下方的是软骨下骨组织。骨组织中无机成分主要为磷酸钙矿物,如羟基磷灰石;而有机成分主要为一型胶原纤维。骨组织中还存在种类繁多的驻留细胞,如骨髓间充质干细胞、造血干细胞、免疫细胞、成骨细胞、破骨细胞等。参考已报道的文献,具有仿生软骨-软骨下骨结构的多细胞生物支架对于骨软骨组织修复展现出显著促进效果。因此,本发明的重点之一在于模拟天然骨软骨组织的结构从而构建多细胞组织工程支架用于系统性研究细胞间相互交流以及骨软骨组织的一体化再生。
该担载活细胞的模块化生物活性支架的特点在于两种细胞(软骨细胞和骨髓间充质干细胞)在支架内的三维空间中有序分层分布,能够模拟人体骨软骨组织的细胞分布及上下分层明显的生理结构。软骨细胞分布在上两层支架模块,代表软骨层的主要细胞构成;骨髓间充质干细胞分布在下三层支架模块,代表软骨下骨组织中起到促进组织再生修复的主要细胞。本发明中采用软骨细胞在上,骨髓间充质干细胞在下的空间分布目的是模拟人体骨软骨组织的生理结构。本发明中细胞在支架内部的分布与天然组织类似,故而能够很好的发挥促修复功能。本发明所述支架通过构建多细胞共生微环境显著促进骨软骨组织修复,对于关节磨损、关节炎导致的软骨缺损的治疗展现出广阔的应用前景。
作为具体实施方式之一,担载活细胞的模块化生物活性支架为氧化锆基模块化支架。所述氧化锆基模块化支架为生物惰性的支架,不会通过释放离子影响细胞的行为。相比于当前市场上的商用的塑料多细胞培养装置,本发明中的氧化锆基模块化支架具有诸多优点:氧化锆模块可以根据实际需求被设计成定制化结构,并且很容易被组装成多层支架。担载活细胞的氧化锆模块化支架可以很容易被拆卸成不同模块用于研究每个模块上的细胞在共培养系统中的贡献。相比于塑料多细胞培养装置,氧化锆模块化支架是开放多孔结构,更容易使细胞培养液中的细胞旁分泌因子形成浓度梯度,从而模拟细胞在体内的三维共生微环境。所述的担载活细胞的氧化锆模块化支架还可以被用作组织工程植入体来探究不同细胞共培养模型在生物体内的表现。所述的氧化锆模块化支架在再生医学领域尤其是药物筛选、多细胞共培养模型方面具有极大的应用前景。
本发明还提供了一种担载活细胞的模块化生物活性支架的制备方法。所述制备方法包括:制备支架模块;将细胞接种在支架模块上以构建载细胞模块;将载细胞模块组装以形成具有定制化三维结构的模块化支架。
制备支架模块。可通过光固化的3D打印制备支架模块。将模块材质和光敏树脂配制成浆料并充分混匀,形成打印浆料;将打印浆料通过光固化3D打印机制备出支架生坯;将打印出来的支架生坯高温保温烧结得到支架模块。作为示例,将含有不同陶瓷粉及光敏树脂的浆料通过行星球磨机充分混匀,从而形成打印浆料。然后通过光固化3D打印机制备出支架生坯。通过计算机软件设计调整支架模块的形状及尺寸参数可以调控最终打印出来的支架的各种参数。将打印出来的支架生坯通过高温炉保温烧结得到所述的支架模块。优选地,所述方法还包括烧结前将支架模块紫外光交联。一些实施方式中,光敏树脂支架还包括将支架模块置于近紫外光下深度光交联30分钟的步骤;聚己内酯/磷酸三钙复合支架还包括将烧结后的磷酸三钙支架模块置入10%w/v的聚己内酯/二氯甲烷溶液中浸泡1小时然后在通风橱中风干过夜,从而在磷酸三钙支架模块表面形成聚己内酯涂层的步骤。
在优选的技术方案中,所述制备方法包括:制备支架模块;将细胞接种在支架模块上以构建载细胞模块;将担载有不同细胞的载细胞模块组装成具有定制化三维结构且各种细胞在空间上有序分布的模块化支架。不同于一体化制备3D打印支架然后将细胞均匀接种在支架表面的方式,本发明中先制备不同的支架模块,并将各种细胞接种在支架模块上,然后将担载有不同活细胞的支架模块拼接组装成具有多层结构且多种细胞在空间上有序分布的完整支架。在接种细胞之前,可以对支架模块进行杀菌处理。例如纯陶瓷支架模块利用高温高压灭菌锅灭菌;聚己内酯/磷酸三钙复合基支架模块利用体积分数70%的无水乙醇灭菌。
以下示例性说明所述担载活细胞的模块化生物活性支架的制备方法。
(1)打印浆料配制:向球磨罐中加入光敏树脂及原料粉体,然后通过行星球磨机将浆料充分混匀。其中,浆料中各成分质量比为原料粉体:光敏树脂=1:(1.22~2.2)。光敏树脂支架则直接用光敏树脂打印。
(2)打印流程:将配制好的浆料倒入打印机料槽中,在打印机系统上载入预先编写的打印文件打印出支架模块。
(3)后处理:将打印好的生坯经高温烧结后得到陶瓷支架模块。不同的打印浆料制备的支架模块需要通过不同的烧结温度来处理。磷酸三钙支架模块烧结温度为1150℃,保温时间为3小时。氧化锆支架模块烧结温度为1600℃,保温时间为3小时。光敏树脂支架模块需要在近紫外光下光照交联30分钟。制备聚己内酯/磷酸三钙复合基模块时,需要将磷酸三钙模块浸渍在10%w/v聚己内酯/二氯甲烷溶液中1小时,之后将支架模块风干得到复合材料基模块。
(4)担载活细胞:将所得的支架模块经过灭菌拿到无菌超净台中备用。准备软骨细胞,将其分散在低糖DMEM培养基中制成细胞悬液A;准备骨髓间充质干细胞,将其分散在α培养基中制成细胞悬液B。细胞悬液中的细胞浓度范围为10000-200000个/mL,优选为100000个/mL。将各组支架模块放入无菌的24孔板中,然后取细胞悬液以每孔1mL的方式滴加到相应的孔中。将24孔板放入细胞培养箱中孵育过夜,等细胞沉积并黏附在支架模块上后得到担载细胞的支架模块。
(5)组装模块化支架:将孵育后的24孔板拿到超净台中备用。取一块新的24孔板及培养皿。将担载活细胞的支架模块放入培养皿中,用无菌的镊子夹取支架模块(两块担载软骨细胞的模块及三块担载骨髓间充质干细胞的模块)并将其组装成多层的模块化生物活性支架。将组装好的模块化生物活性支架放入新的24孔板,加入2mL混合细胞培养基(DMEM培养基:α培养基=1mL:1mL)。然后将24孔板放入细胞培养箱中进行体外培养,隔天换液。
本发明还提供一种如上所述的担载活细胞的模块化生物活性支架在研究多种细胞间相互交流以及骨软骨再生领域中的应用。
综上,本发明能够轻易将不同材质的支架模块拼接组装起来,从而制备出多材料、多功能复合生物支架。同时,本发明能够调控不同细胞在陶瓷支架内部空间中的分布,从而构建多种细胞共培养系统,促进不同细胞相互交流。因此,在支架内部的细胞表现出相互促进的增殖情况,例如支架担载的软骨细胞与骨髓间充质干细胞之间的相互作用为实现支架的骨软骨修复提供了基础。此外,在共培养一段时间后,所述的支架还可以被拆卸成单独的支架模块,用于研究各种细胞在共培养体系中的贡献。这一点是一体化制备的3D打印支架难以办到的。
下面进一步列举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
实施例1
磷酸三钙基圆形模块化生物活性支架的制备
(1)称取45gβ相的磷酸三钙陶瓷粉以及55g光敏树脂加入到球磨罐中,通过行星球磨机搅拌2小时,得到均匀的3D打印浆料。所述的光敏树脂为深圳光华伟业股份有限公司生产的eSUN牌可水洗光敏树脂。
(2)将浆料倒入光固化3D打印机的料槽中,通过载入预先编写的打印圆形支架模块的程序打印出磷酸三钙基圆形支架模块生坯。用超纯水清洗残留在支架模块表面的浆料。将清洗后的支架模块干燥后置于蓝光下深度交联。所述的光固化3D打印机为北京十维科技有限责任公司生产的基于DLP(Digital light processing)原理的3D打印机。
(3)将处理后的支架生坯以2℃每分钟的速率升温至1150℃烧结,保温时间为3小时。
(4)将烧结后的支架模块拼接组装成完整的圆形模块化生物活性支架。
实施例2
磷酸三钙基具有汉诺塔结构的模块化生物活性支架的制备
(1)称取45gβ相的磷酸三钙陶瓷粉以及55g光敏树脂加入到球磨罐中,通过行星球磨机搅拌2小时,得到均匀的3D打印浆料。
(2)将浆料倒入光固化3D打印机的料槽中,通过载入预先编写的打印具有汉诺塔结构的支架模块的程序打印出支架模块生坯。用超纯水清洗残留在支架模块表面的浆料。将清洗后的支架模块干燥后置于蓝光下深度交联。
(3)将处理后的支架生坯以2℃每分钟的速率升温至1150℃烧结,保温时间为3小时。
(4)将烧结后的支架模块组装成完整的具有汉诺塔结构的模块化生物活性支架。
实施例3
磷酸三钙基方形模块化生物活性支架的制备
(1)称取45gβ相的磷酸三钙陶瓷粉以及55g光敏树脂加入到球磨罐中,通过行星球磨机搅拌2小时,得到均匀的3D打印浆料。
(2)将浆料倒入光固化3D打印机的料槽中,通过载入预先编写的打印方形支架模块的程序打印出磷酸三钙基方形支架模块生坯。用超纯水清洗残留在支架模块表面的浆料。将清洗后的支架模块干燥后置于蓝光下深度交联。
(3)将处理后的支架生坯以2℃每分钟的速率升温至1150℃烧结,保温时间为3小时。
(4)将烧结后的支架模块拼接组装成完整的方形模块化生物活性支架。
实施例4
聚己内酯复合磷酸三钙的支架模块的制备
(1)通过实施例1的方法得到烧结后的磷酸三钙基圆形支架模块。
(2)称取1g的分子量为80000的聚己内酯加入到10mL二氯甲烷中,利用磁力搅拌器充分混匀得到10%wv的聚己内酯/二氯甲烷溶液。
(3)将磷酸三钙基支架模块置入聚己内酯/二氯甲烷溶液中,浸渍1小时,然后将支架模块取出晾干,得到表面具有聚己内酯涂层的支架模块。
如图5所示,本发明中的磷酸三钙基支架模块具有非常高的硬度及弹性模量,能够提供高硬度的力学微环境,从而有利于成骨细胞等骨来源细胞的生长及定向分化。同时,本发明中的聚己内酯/磷酸三钙复合支架具有很低的表面硬度及弹性模量,能够模拟软组织中细胞外基质的力学性能,从而有利于软骨细胞等软组织来源细胞的增殖及再生。
实施例5
氧化锆基圆形模块化生物活性支架的制备
(1)称取100g氧化锆陶瓷粉、10g 45S5生物玻璃粉以及50g光敏树脂加入到球磨罐中,通过行星球磨机搅拌2小时,得到均匀的3D打印浆料。
(2)将浆料倒入光固化3D打印机的料槽中,通过载入预先编写的打印圆形支架模块的程序打印出氧化锆基圆形支架模块生坯。用超纯水清洗残留在支架模块表面的浆料。将清洗后的支架模块干燥后置于蓝光下深度交联。
(3)将处理后的支架生坯以2℃每分钟的速率升温至1600℃烧结,保温时间为3小时。
(4)将烧结后的支架模块拼接组装成完整的氧化锆基圆形模块化生物活性支架。
实施例6
担载软骨细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架的制备
(1)通过实施例1的方法得到磷酸三钙基圆形支架模块。通过实施例4的方法得到聚己内酯/磷酸三钙复合基支架模块。通过70%乙醇溶液将所有的支架模块灭菌。
(2)将灭菌后的支架模块放入超净台用无菌的超纯水清洗三遍。然后将支架模块置入24孔细胞培养板,一个孔放一个支架模块。将培养中的软骨细胞均匀分散于完全低糖DMEM培养基,细胞密度为100000个/mL,得到软骨细胞悬液。将培养中的骨髓间充质干细胞均匀分散于完全α培养基,细胞密度为100000个/mL,得到骨髓间充质干细胞悬液。将两种细胞悬液以每孔1mL的方式加入到放有支架模块的孔板中。其中软骨细胞悬液滴加到含有聚己内酯/磷酸三钙复合基支架模块的孔中。而骨髓间充质干细胞悬液滴加到含有磷酸三钙基支架模块的孔中。部分含有支架模块的孔仅加入不含细胞的完全培养基。然后将24孔板放入37℃恒温培养箱中培养。
(3)在培养箱中孵育一天后,取出24孔板。如图6中的A所示,将两层担载软骨细胞的支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载软骨-干细胞共培养系统的模块化生物活性支架(Co-culture)。将两层无细胞的聚己内酯/磷酸三钙复合基支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)。将然后将两层担载软骨细胞的支架模块与三层无细胞的磷酸三钙支架模块依次拼接组装成担载软骨细胞单培养系统的模块化生物活性支架(Mono-RCs)。将组装好的模块化生物活性支架放入新的24孔培养板,每孔加入2mL混合培养基。其中混合培养基由完全低糖培养基和完全α培养基以体积比为1:1的比例混合得到。将装有担载活性的模块化生物活性支架的24孔板放入培养箱中继续培养,隔天换液。
实施例7
担载软骨细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架用于研究软骨细胞与骨髓间充质干细胞相互交流
通过实施例6的方法分别得到担载软骨-干细胞共培养系统的模块化生物活性支架(Co-culture),担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)以及担载软骨细胞单培养系统的模块化生物活性支架(Mono-RCs)。各组支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用CCK-8试剂盒检测支架上细胞在1/3/5天的增殖活性。图6中的(B)表明支架上的细胞都能正常增殖。其中共培养组的软骨细胞在第3天及第5天的时候增殖速率显著高于单培养组。共培养组的骨髓间充质干细胞在第5天的时候增殖速率显著高于单培养。这些结果表明共培养组中软骨细胞和骨髓间充质干细胞能够互相促进,最终加快两种细胞的增殖。
使用RT-PCR实验表征支架上细胞的成骨相关基因表达及软骨成熟相关基因的表达水平。图6中的(C)表明相比于单培养组的细胞,共培养组中的软骨成熟相关基因(COL-II,SOX9)表达显著上调。图6中的(D)表明相比于单培养组的细胞,共培养组中的成骨相关基因(COL-I,OPN)表达明显上调。所有这些结果表明,相比于单培养组,共培养组的软骨细胞及骨髓间充质干细胞能够相互促进,形成一个有益的细胞共生微环境。
使用免疫荧光染色实验表征支架上细胞的成骨及成软骨分化蛋白的表达水平。图6中的(E)表明共培养组软骨细胞的COL-II蛋白表达显著高于单培养组的。图6中的(F)表明共培养组骨髓间充质干细胞的COL-I蛋白表达显著高于单培养组的。所有这些结果表明,与基因表达结果一致,共培养组的两种细胞能够相互促进。
上述结果表明担载软骨细胞及骨髓间充质干细胞的模块化生物活性支架能够构建一个有益的细胞共生微环境,促进两种细胞的增殖及分化,在加速骨软骨组织再生方面具有极大的应用潜力。
实施例8
担载活细胞的模块化生物活性支架用于研究骨髓间充质干细胞促进软骨细胞成熟的信号通路
(1)通过实施例6的方法得到担载软骨细胞-干细胞共培养系统的模块化生物活性支架(Co-culture),担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)以及担载软骨细胞单培养系统的模块化生物活性支架(Mono-RCs)。将支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用RT-PCR实验表征支架上细胞的信号通路相关基因的表达水平。图7中(A)表明相比于单培养组,共培养组软骨细胞的NFAT1基因表达明显上调。
(2)通过实施例6的方法得到担载软骨细胞的支架模块以及担载骨髓间充质干细胞的支架模块。在细胞完全沉积并黏附在支架模块上后,用含有普卡霉素(MTM)的完全α培养基处理担载有骨髓间充质干细胞的支架模块并孵育1天。将两层担载软骨细胞的模块与三层经普卡霉素处理后的担载骨髓间充质干细胞的模块组装成处理组的模块化生物活性支架(处理组)。将两层担载软骨细胞的模块与三层担载骨髓间充质干细胞的模块组装成未处理组的模块化生物活性支架(未处理组)。将支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用RT-PCR实验表征支架上细胞的信号通路相关基因的表达水平。图7中(B)表明相比于未处理组,处理组骨髓间充质干细胞的RCN2基因表达明显下调。图7中(C)表明相比于未处理组,处理组软骨细胞的NFAT1基因表达明显上调。
(3)通过实施例6的方法得到担载软骨细胞的支架模块。在细胞完全沉积并黏附在支架模块上后,用含有RCN2蛋白的完全低糖DMEM培养基处理部分担载软骨细胞的支架模块。RCN2蛋白处理后的模块为处理组。未经处理的模块为未处理组。将支架模块置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用RT-PCR实验表征支架上细胞的信号通路相关基因的表达水平。图7中(D)表明相比于未处理组,处理组软骨细胞的NFAT1基因表达明显下调。
使用免疫荧光染色实验表征支架上细胞的信号通路相关蛋白的表达水平。图7中E表明相比于未处理组,处理组软骨细胞的NFAT1蛋白表达明显下调。
上述结果表明担载软骨细胞及骨髓间充质干细胞的模块化生物活性支架能够构建一个多细胞共培养培养用于系统性研究细胞间相互交流。
实施例9
担载巨噬细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架的制备
(1)通过实施例1的方法得到烧结后的磷酸三钙基圆形支架模块。通过高温高压灭菌器将所有的支架模块灭菌。
(2)将灭菌后的支架模块置入24孔细胞培养板,一个孔放一个支架模块。将培养中的巨噬细胞均匀分散于完全高糖培养基,细胞密度为300000个/mL,得到巨噬细胞悬液。将培养中的骨髓间充质干细胞均匀分散于完全α培养基,细胞密度为100000个/mL,得到骨髓间充质干细胞悬液。将两种细胞悬液以每孔1mL的方式加入到放有支架模块的孔板中。部分含有支架模块的孔仅加入不含细胞的完全培养基。然后将24孔板放入37℃恒温培养箱中培养。
(3)在培养箱中孵育一天后,取出24孔板。如图8中的(A)所示将两层担载巨噬细胞的支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载巨噬细胞-干细胞共培养系统的模块化生物活性支架(Co-culture)。将两层无的磷酸三钙支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)。将两层担载巨噬细胞的支架模块与三层无细胞的磷酸三钙支架模块依次拼接组装成担载巨噬细胞单培养系统的模块化生物活性支架(Mono-RAW)。然后将支架放入新的24孔培养板,每孔加入2mL混合培养基。其中混合培养基由完全高糖培养基和完全α培养基以体积比为1:1的比例混合得到。将装有模块化生物活性支架的24孔板放入培养箱中继续培养,隔天换液。
实施例10
担载巨噬细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架用于研究软骨细胞与骨髓间充质干细胞相互交流
通过实施例9的方法分别得到担载巨噬细胞-干细胞共培养系统的模块化生物活性支架(Co-culture),担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)以及担载巨噬细胞单培养系统的模块化生物活性支架(Mono-RAW)。各组支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用CCK-8试剂盒检测支架上细胞在1/3/5天的增殖活性。图8中的(B)表明支架上的细胞都能正常增殖。其中共培养组的巨噬细胞在第3天及第5天的时候增殖速率显著高于单培养组。共培养组的骨髓间充质干细胞在第5天的时候增殖速率显著高于单培养。这些结果表明共培养组中巨噬细胞和骨髓间充质干细胞能够互相促进,最终加快两种细胞的增殖。
使用RT-PCR实验表征支架上细胞的成骨相关基因表达及炎症相关基因的表达水平。图8中的(C)表明相比于单培养组,共培养组中的巨噬细胞表达的抗炎相关基因明显上调,如Arg-1、IL-1ra及IL-10。而且,共培养组的巨噬细胞相比于单培养组下调了促炎相关基因的表达,如OSM及IL-1β。图8中的(D)表明相比于单培养组的细胞,共培养组中的成骨相关基因(RUNX2,OPN及BMP-2)表达明显上调。所有这些结果表明,相比于单培养组,共培养组的巨噬细胞及骨髓间充质干细胞能够相互促进,形成一个有益的细胞共生微环境。
使用免疫荧光染色实验表征支架上细胞的成骨分化及炎症相关蛋白的表达水平。图8中的(E)表明共培养组巨噬细胞的抗炎因子Arg-1蛋白表达显著高于单培养组。而且图8中的(F)表明共培养组巨噬细胞的促炎因子IL-6蛋白表达显著低于单培养组。图8中的(G)表明共培养组骨髓间充质干细胞的BSP蛋白表达显著高于单培养组的。所有这些结果表明,两种细胞能够相互调控。
上述结果表明担载软骨细胞及骨髓间充质干细胞的模块化生物活性支架能够构建一个有益的免疫调节微环境,促进两种细胞的增殖及交流。这种免疫调控微环境能加速巨噬细胞表型调控及骨组织再生,在骨缺损修复领域具有极大的应用潜力。
实施例11
担载脐静脉内皮细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架的制备
(1)通过实施例1的方法得到烧结后的磷酸三钙基圆形支架模块。通过高温高压灭菌器将所有的支架模块灭菌。
(2)将灭菌后的支架模块置入24孔细胞培养板,一个孔放一个支架模块。将培养中的脐静脉内皮细胞均匀分散于内皮细胞培养基(ECM培养基),细胞密度为300000个/mL,得到脐静脉内皮细胞悬液。将培养中的骨髓间充质干细胞均匀分散于完全α培养基,细胞密度为100000个/mL,得到骨髓间充质干细胞悬液。将两种细胞悬液以每孔1mL的方式加入到放有支架模块的孔板中。部分含有支架模块的孔仅加入不含细胞的完全培养基。然后将24孔板放入37℃恒温培养箱中培养。
(3)在培养箱中孵育一天后,取出24孔板。如图9中的(A)所示将两层担载脐静脉内皮细胞的支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载脐静脉内皮细胞-干细胞共培养系统的模块化生物活性支架(Co-culture)。将两层无的磷酸三钙支架模块与三层担载骨髓间充质干细胞的支架模块依次拼接组装成担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)。将两层担载脐静脉内皮细胞的支架模块与三层无细胞的磷酸三钙支架模块依次拼接组装成担载脐静脉内皮细胞单培养系统的模块化生物活性支架(Mono-HUVECs)。然后将支架放入新的24孔培养板,每孔加入2mL混合培养基。其中混合培养基由ECM培养基和完全α培养基以体积比为1:1的比例混合得到。将装有模块化生物活性支架的24孔板放入培养箱中继续培养,隔天换液。
实施例12
担载脐静脉内皮细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架用于研究脐静脉内皮细胞与骨髓间充质干细胞相互交流
通过实施例11的方法分别得到担载脐静脉内皮细胞-干细胞共培养系统的模块化生物活性支架(Co-culture),担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)以及担载脐静脉内皮细胞单培养系统的模块化生物活性支架(Mono-HUVECs)。各组支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
使用CCK-8试剂盒检测支架上细胞在1/3/5天的增殖活性。图9中的(B)表明支架上的细胞都能正常增殖。其中共培养组的脐静脉内皮细胞在第3天及第5天的时候增殖速率显著高于单培养组。共培养组的骨髓间充质干细胞在第5天的时候增殖速率显著高于单培养。这些结果表明共培养组中脐静脉内皮细胞和骨髓间充质干细胞能够互相促进,最终加快两种细胞的增殖。
使用RT-PCR实验表征支架上细胞的成骨相关基因表达及炎症相关基因的表达水平。图9中的(C)表明相比于单培养组,共培养组中的脐静脉内皮细胞表达的成血管相关基因(VEGF-165,HIF-1α,bFGF及bFGFR)明显上调。图9中的(D)表明相比于单培养组的细胞,共培养组中的成骨相关基因(BMP-2,OPN及COL-I)表达明显上调。所有这些结果表明,相比于单培养组,共培养组的脐静脉内皮细胞及骨髓间充质干细胞能够相互促进,形成一个有益的细胞共生微环境。
使用免疫荧光染色实验表征支架上细胞的成骨分化及成血管相关蛋白的表达水平。图9中的(E)表明共培养组脐静脉内皮细胞的CD31蛋白表达显著高于单培养组。图9中的(F)表明共培养组骨髓间充质干细胞的OPN蛋白表达显著高于单培养组的。所有这些结果表明,两种细胞能够相互促进。
上述结果表明担载脐静脉内皮细胞及骨髓间充质干细胞的模块化生物活性支架能够构建一个仿生微环境,在促进骨组织再生,加速血管生成方面具有潜在的应用价值。
实施例13
担载软骨细胞、骨髓间充质干细胞及脐静脉内皮细胞共培养系统的模块化生物活性支架的制备
(1)通过实施例1的方法得到烧结后的磷酸三钙基圆形支架模块。通过实施例4的方法得到聚己内酯/磷酸三钙复合基支架模块。通过70%乙醇溶液将所有的支架模块灭菌。
(2)将灭菌后的支架模块放入超净台用无菌的超纯水清洗三遍。然后将支架模块置入24孔细胞培养板,一个孔放一个支架模块。将培养中的软骨细胞均匀分散于完全低糖DMEM培养基,细胞密度为100000个/mL,得到软骨细胞悬液。将培养中的骨髓间充质干细胞均匀分散于完全α培养基,细胞密度为100000个/mL,得到骨髓间充质干细胞悬液。将培养中的脐静脉内皮细胞均匀分散于ECM培养基,细胞密度为300000个/mL,得到脐静脉内皮细胞悬液。将三种细胞悬液以每孔1mL的方式加入到放有支架模块的孔板中。其中软骨细胞悬液滴加到含有聚己内酯/磷酸三钙复合基支架模块的孔中。骨髓间充质干细胞悬液滴加到含有磷酸三钙基支架模块的孔中。而脐静脉内皮细胞悬液滴加到含有磷酸三钙基支架模块的孔中。然后将24孔板放入37℃恒温培养箱中培养。
(3)在培养箱中孵育一天后,取出24孔板。如图10所示,将两层担载软骨细胞的支架模块、两层担载骨髓间充质干细胞的支架模块及两层担载脐静脉内皮细胞的支架模块依次拼接组装成担载软骨细胞、骨髓间充质干细胞及脐静脉内皮细胞共培养系统的模块化生物活性支架。将组装好的模块化生物活性支架放入新的24孔培养板,每孔加入2mL混合培养基。其中混合培养基由完全低糖培养基、完全α培养基及ECM培养基以体积比为1:1:1的比例混合得到。将装有担载活性的模块化生物活性支架的24孔板放入培养箱中继续培养,隔天换液。
实施例14
担载软骨细胞与骨髓间充质干细胞单培养及共培养系统的模块化生物活性支架用于骨软骨组织一体化修复
通过实施例6的方法分别得到担载软骨-干细胞共培养系统的模块化生物活性支架(Co-culture),担载干细胞单培养系统的模块化生物活性支架(Mono-RBMSCs)以及担载软骨细胞单培养系统的模块化生物活性支架(Mono-RCs)。通过实施例1的方法得到烧结后的磷酸三钙基圆形支架模块。通过实施例4的方法得到聚己内酯/磷酸三钙复合基支架模块。通过70%乙醇溶液将所有的支架模块灭菌。将灭菌后的支架模块放入超净台用无菌的超纯水清洗三遍。将两层聚己内酯/磷酸三钙复合基支架模块与三层磷酸三钙基圆形支架模块组装成无细胞的模块化支架(Control)。各组支架置于24孔板中,并加入足量混合培养基。将孔板放入细胞培养箱中进行体外培养,隔天换液。
在新西兰大白兔(雄性,2.5kg)的股骨建立骨软骨缺损模型。麻醉兔子后,取出兔子腿部毛发,暴露腿部皮肤并消毒。用手术刀暴露兔子股骨,然后用带有直径6mm钻头的电钻在兔子关节软骨处制造一个直径6mm、深度6mm的骨软骨缺损。将各组模块化支架植入骨软骨缺损部位。没有植入支架的兔子被定义为空白组(Blank)。然后用手术缝合线将伤口缝合。术后经过8周时间,将所有的实验用兔牺牲掉并取材进行组织学分析(如图11中的A所示)。
如图11中的(B)所示,在所有骨组织样品的micro-CT重建模型中,红色代表支架,绿色代表新生骨组织。可以发现担载软骨细胞与干细胞共培养系统的模块化支架内部充满了新生骨组织。而且micro-CT统计分析结果也表明担载软骨细胞与干细胞共培养系统的模块化支架的新生骨体积比(BV/TV,新生骨体积/缺损部位总体积)显著高于其他实验组及空白组(图11的C)。同时,如图11中的(D)所示,组织切片的VG染色结果表明担载软骨细胞与干细胞共培养系统的模块化支架的表面有更多的新生骨组织。通过Image J软件统计分析,担载软骨细胞与干细胞共培养系统的模块化支架的切片中新生骨组织面积显著高于其他实验组及空白组(图11的E)。这些结果表明担载软骨细胞与干细胞共培养系统的模块化支架能够显著促进软骨下骨组织的再生。
如图12所示,组织切片的番红固绿染色结果表明担载软骨细胞与干细胞共培养系统的模块化支架的表面有更多新生软骨组织(红色)。而其他实验组及空白组的缺损部位被大面积的纤维化组织覆盖。这些结果表明担载软骨细胞与干细胞共培养系统的模块化支架能够显著促进软骨组织的再生。
上述结果表明,担载软骨细胞与干细胞共培养系统的模块化支架能够同时促进软骨组织与软骨下骨的一体化修复,在骨关节炎及骨关节退行性病变的治疗中具有极大的潜力。
- 一种高生物活性细胞膜仿生微囊泡及其制备方法与应用
- 一种具有抗肾透明细胞癌活性的熊果酸衍生物及其制备方法与应用
- 一种活性丝素蛋白生物组织工程支架的溶喷制备方法
- 一种活细胞内原位加速的DNA马达及其制备方法和应用
- 担载梯度浓度生物活性分子的有序纤维支架、制法及应用
- 担载梯度浓度生物活性分子的有序纤维支架、制法及应用
