用于癌症治疗的诱导细胞损伤的治疗药物
文献发布时间:2024-04-18 19:58:30
本申请是国际申请号PCT/JP2017/007033,国际申请日2017年2月24日,中国申请号201780025881.4,发明名称为“用于癌症治疗的诱导细胞损伤的治疗药物”的专利申请的分案申请。
技术领域
本发明涉及多特异性抗原结合分子、其用途等等。
背景技术
抗体由于其在血浆中的高稳定性和极少的不利反应而作为药物引人注目(非专利文献1和2)。已知抗体不仅引起抗原结合作用,激动作用,和拮抗作用,而且还引起效应子介导的细胞毒性活性(也被称为效应子功能)如抗体依赖性细胞细胞毒性(ADCC),抗体依赖性细胞噬菌作用(ADCP),和补体依赖性细胞毒性(CDC),并且显示针对癌细胞的抗肿瘤作用(非专利文献3)。ADCC是效应子细胞对抗体结合的靶癌细胞展现的细胞毒性,其经由抗体Fc区与效应子细胞如NK细胞和巨噬细胞上存在的Fc受体的结合。补体复合物结合抗体结构中存在的补体结合位点。CDC是由细胞破裂导致的细胞毒性,其中通过复合物中存在的补体组分在抗体结合细胞的细胞膜上形成孔从而促进水和离子流入细胞中。已经开发了若干显示优异抗肿瘤效果的治疗性抗体作为用于癌症治疗的药物(非专利文献4);并且虽然现有的治疗性抗体已经显示优异的作用,但施用这些抗体所实现的治疗结果仍然不令人满意。
为了使抗体显示ADCC、ADCP和CDC,有必要的是抗体Fc区,存在于效应子细胞如NK细胞和巨噬细胞上的抗体受体(FcγR)和各种补体组分结合。在人中,同种型FcγRIa、FcγRIIa、FcγRIIb、FcγRIIIa和FcγRIIIb作为FcγR蛋白家族的成员已被报道,并且也已经报道了各自的同种异型(非专利文献5)。在这些同种型中,FcγRIa、FcγRIIa和FcγRIIIa带有在胞内结构域中的被称为免疫受体基于酪氨酸的激活基序(ITAM)的结构域,并且发送激活信号。另一方面,仅FcγRIIb带有在胞内结构域中的被称为免疫受体基于酪氨酸的抑制基序(ITIM)的结构域,并且发送抑制信号。已知每一种FcγR都经由通过免疫复合物等的交联来发送信号(非专利文献6)。当抗体实际上对癌细胞发挥效应子功能时,效应子细胞膜上的FcγR在癌细胞膜上结合的若干抗体的Fc区处形成簇,并且效应子细胞发出激活信号。杀细胞作用因此被发挥,但是因为此时FcγR仅在癌细胞附近存在的效应子细胞中交联,所以显示免疫激活局部地发生在癌细胞中(非专利文献7)。
天然存在的免疫球蛋白在其可变区处结合抗原,并且在其恒定区处结合受体如FcγR、FcRn、FcαR和FcεR以及补体。FcRn是在IgG Fc区处相互作用的结合分子之一,并且因为抗体重链中的每个结合一个FcRn分子,据报道两个FcRn分子结合一个IgG型抗体分子。然而,与FcRn等不同,FcγR在抗体铰链区和CH2结构域处相互作用,并且仅一个FcγR分子结合一个IgG型抗体分子(非专利文献8)。此外,普通的天然存在的IgG型抗体经由其可变区(Fab)识别并结合单个表位;因此,其仅可以结合一个抗原。另一方面,已知多种蛋白质参与癌症和炎症,并且在这些蛋白质之间可能存在干扰。例如,已知若干炎症细胞因子(TNF、IL1和IL6)参与免疫学疾病(非专利文献9)。此外,已知在获得药物抗性方面,其他受体的激活是癌症机制之一(非专利文献10)。在这样的情况中,识别单个表位的普通抗体将不能够抑制多种蛋白质。
利用一个分子结合两种以上抗原的抗体(双特异性抗体)作为抑制多个靶标的分子正在被研究。可能的是通过修饰天然存在的IgG型抗体给予对两种不同抗原(第一抗原和第二抗原)的结合活性(非专利文献11)。因此,不仅存在单个分子中和两种以上的抗原,而且还存在由于具有细胞毒性活性的细胞与癌细胞之间的交联所致的抗肿瘤活性的增强。作为双特异性抗体的分子形式,目前已报道了包含添加到抗体的N或C末端的抗原结合位点的分子(DVD-Ig和scFv-IgG),具有针对两种抗体Fab区的不同序列的分子(共有L-链双特异性抗体和杂交的杂交瘤),一个Fab区识别两种抗原的分子(二合一IgG),以及具有CH3区环位点作为新的抗原结合位点的分子(Fcab)(非专利文献12和13)。因为所有双特异性抗体都在其Fc区处与FcγR相互作用,所以抗体效应子功能得以保存。因此,双特异性抗体结合其识别的任何抗原并且同时结合FcγR,并且显示针对表达所述抗原的细胞的ADCC活性。
如果双特异性抗体识别的所有抗原都是癌症中特异性表达的抗原,则所述双特异性抗体在其与任何所述抗原结合时显示对癌细胞的细胞毒性活性。因此,与识别一种抗原的常规抗体药物相比,由此种抗体可以预期更有效的抗肿瘤效果。然而,在双特异性抗体所识别的抗原中的任一种表达在正常组织或细胞中表达在免疫细胞上的情况中,由于与FcγR的交联而发生对正常组织的破坏或细胞因子的释放(非专利文献14)。结果,引起强烈的不利反应。
利用细胞毒性动员T细胞作为效应子细胞作为其抗肿瘤作用的机制的T细胞重新引导抗体作为双特异性抗体自1980年代起已为人所知(非专利文献15、16和17)。与利用ADCC动员NK细胞或巨噬细胞作为效应子细胞作为其抗肿瘤作用的机制的抗体不同,T细胞重新引导抗体是针对构成T细胞上的T细胞受体(TCR)复合物的任一种亚基的抗体,并且具体是包含结合CD3ε链的抗体和结合靶癌细胞上的抗原的抗体的双特异性抗体。经由T细胞重新引导抗体同时结合CD3ε链和癌症抗原,T细胞接近癌细胞。结果,认为通过T细胞具有的细胞毒性活性发挥针对癌细胞的抗肿瘤作用。
已知作为T细胞重新引导抗体的卡妥索单抗(catumaxomab)在两个Fab处各自结合癌症抗原(EpCAM)和T细胞上表达的CD3ε链。卡妥索单抗通过同时结合癌症抗原和CD3ε引起T细胞介导的细胞毒性活性,并且通过同时结合癌症抗原和FcγR诱导由抗原递呈细胞如NK细胞和巨噬细胞介导的细胞毒性活性。通过利用这两种细胞毒性活性,卡妥索单抗通过腹膜内施用而显示对恶性腹水的高的疗效并且因此在欧洲已经被批准(非专利文献18)。此外,存在这样的例子,其中据报道施用卡妥索单抗产生癌细胞反应性抗体,这清楚地证明引起获得性免疫(非专利文献19)。由此结果,具有T细胞介导的细胞毒性活性和通过细胞如NK细胞或巨噬细胞的FcγR介导的活性的抗体(这些抗体被特别地称为三功能抗体)受到关注,因为可以预期强的抗肿瘤作用和引起获得性免疫。
然而,即使不存在癌症抗原,三功能抗体也同时结合CD3ε和FcγR并且因此即使在不存在癌细胞的环境中也会使表达CD3ε的T细胞与表达FcγR的细胞交联,这导致产生大量的多种细胞因子。此种不依赖于癌症抗原的多种细胞因子产生的引发限制了目前将三功能抗体施用于腹膜内途径(非专利文献20)。由于严重的细胞因子风暴样不利反应,三功能抗体的全身施用是非常困难的。实际上,在将卡妥索单抗全身性施用于非小细胞肺癌患者的I期临床试验中,非常低的5μg/全身的剂量是可耐受的最大剂量,并且据报道施用更大的剂量导致多种严重的不利反应(非专利文献21)。
同样,通过常规技术的双特异性抗体在其与FcγR结合时可以同时结合两种抗原,作为癌症抗原(EpCAM)的第一抗原和作为CD3ε的第二抗原;并因此,考虑到其分子结构,不可能避免由同时结合FcγR和第二抗原CD3ε引起的不利反应。
同时,不同于卡妥索单抗,BiTE由于不具有Fcγ受体-结合部位,因此其不会以独立于癌抗原的方式使表达于T细胞和诸如NK细胞和巨噬细胞的细胞上的受体发生交联。因此,显示出BiTE不会引起在施用了卡妥索单抗的情况下可观察到的癌抗原非依赖性的细胞因子的诱导。然而,由于BiTE为欠缺Fc区的低分子量型的修饰抗体分子,因此与通常用作治疗用抗体的IgG型抗体相比较,存在给予患者后的血中半衰期明显短的问题。实际上,已经显示:活体内施用的BiTE的血中半衰期为数小时左右(非专利文献22和23)。在blinatumomab的临床试验中,通过使用微泵(minipump)的持续静脉内输注来进行施用。这样的施用对于患者来说不仅为便利性明显差的施用法,也有装置故障等引起的医疗事故的潜在风险。因此,不能说这样的施用方法是理想的。
近几年,使用具有减小的FcγR结合活性的Fc区已经能够保持BiTE所具有的强抗肿瘤活性和不以独立于癌症抗原的方式引起细胞因子风暴的优异安全性质,并且提供了在血液中具有长半衰期的新的多肽装配(专利文献1)。
另一方面,当通过常规技术表达双特异性抗体时,因为表达两种H链和两种L链,所以可预期十种组合。其中,产生的组合中仅一种具有想要的结合特异性。因此,为了获得想要的双特异性抗体,必须自十种抗体中纯化想要的一种抗体,这是非常低效且困难的。
通过将氨基酸置换引入IgG H-链CH3区中而优先分泌具有H链的异源二聚组合(例如,针对抗原A的H链和针对抗原B的H链的组合)的IgG的方法已经作为用于解决该问题的方法被报道(专利文献2、3、4、5、6、7以及非专利文献24和25)。利用物理干扰即“突出(knob)”和“孔(hole)”的方法以及利用电荷排斥的方法已经作为此种方法被报道。
为了以更佳的效率获得目标分子,已经报道了使用能够结合两种不同抗原的L链(虽然所述L链具有相同的氨基酸序列)的方法(专利文献8和9)。然而,抗原亲和力可能随着共有L链的使用而极大下降,并且难以找到保持抗原亲和力的共有L链。
作为BiTE的兰妥莫单抗(blinatumomab)已被批准用于急性淋巴细胞白血病(ALL),并且还在血液癌症(例如非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL))的临床试验中进行测试。AMG330(一种靶向CD33的BiTE)的临床试验也开始用于急性髓细胞白血病(AML)的测试。此外,针对实体瘤的BiTE正在开发中。AMG211(靶向CEA的BiTE),AMG110(靶向EpCAM的BiTE),AMG212(靶向PSMA的BiTE)等正在进行临床试验。然而,BiTE对实体瘤的应答性仍未得到证实(非专利文献26)。
近年来,已经证明免疫治疗剂(其代表是靶向免疫检查点分子例如CTLA-4,PD-1和PD-L1的抑制剂)在临床环境中具有药物效力。然而,这些药剂不是对每个患者都有效,并且需要进一步提高药物效力。关于多种免疫疗法的组合使用,已经发现与单独的伊匹单抗(ipilimumab)相比,Nivlolumab和伊匹单抗的组合使用实现了针对黑素瘤的增强的药效(非专利文献27)。
引用列表
[专利文献]
[专利文献1]WO2012/073985
[专利文献2]WO96/27011
[专利文献3]WO2006/106905
[专利文献4]WO2007/147901
[专利文献5]WO2009/089004
[专利文献6]WO2010/129304
[专利文献7]WO2013/065708
[专利文献8]WO98/050431
[专利文献9]WO2006/109592
[非专利文献]
[非专利文献1]Nat.Biotechnol.(2005)23,1073-1078
[非专利文献2]Eur J Pharm Biopharm.(2005)59(3),389-396
[非专利文献3]Drug Des Devel Ther(2009)3,7-16
[非专利文献4]Clin Cancer Res.(2010)16(1),11-20
[非专利文献5]Immunol.Lett.(2002)82,57-65
[非专利文献6]Nat.Rev.Immunol.(2008)8,34-47
[非专利文献7]Ann.Rev.Immunol.(1988).6.251-81
[非专利文献8]J.Bio.Chem.,(20001)276,16469-16477
[非专利文献9]Nat.Biotech.,(2011)28,502-10
[非专利文献10]Endocr Relat Cancer(2006)13,45-51
[非专利文献11]MAbs.(2012)Mar 1,4(2)
[非专利文献12]Nat.Rev.(2010)10,301-316
[非专利文献13]Peds(2010),23(4),289-297
[非专利文献14]J.Immunol.(1999)Aug 1,163(3),1246-52
[非专利文献15]Nature(1985)314(6012),628-31
[非专利文献16]Int J Cancer(1988)41(4),609-15
[非专利文献17]Proc Natl Acad Sci USA(1986)83(5),1453-7
[非专利文献18]Cancer Treat Rev.(2010)Oct 36(6),458-67
[非专利文献19]Future Oncol.(2012)Jan 8(1),73-85
[非专利文献20]Cancer Immunol Immunother.(2007)56(9),1397-406
[非专利文献21]Cancer Immunol Immunother.(2007)56(10),1637-44
[非专利文献22]Cancer Immunol Immunother.(2006)55(5),503-14
[非专利文献23]Cancer Immunol Immunother.(2009)58(1),95-109
[非专利文献24]Protein Engineering.(1996)vol.9,p.617-621
[非专利文献25]Nature Biotechnology.(1998)vol.16,p.677-681
[非专利文献26]Immunological Reviews.(2016)vol.270,p.193-208
[非专利文献27]N Eng J Med(2015)vol.373,p.23-34
发明概述
[发明解决的问题]
考虑到以上情况而完成本发明。本发明的目的是提供抗癌剂,其包含多特异性抗原结合分子作为活性成分,所述多特异性抗原结合分子使T细胞接近靶癌细胞,并且可以通过T细胞针对含表达磷脂酰肌醇聚糖3的细胞的靶癌症组织的细胞毒性活性治疗癌症,并且是能够以高效率制备的分子形式。本发明的另一个目的是提供使用多特异性抗原结合分子和其他药剂的组合疗法。
[解决问题的方式]
本发明人发现了包含结合磷脂酰肌醇聚糖3的抗体可变区的结构域和包含结合T细胞受体复合物的抗体可变区的结构域所共有的L链,其中所述共有L链能够改善对两种抗原的亲和力。这允许制备可以高效率制备的分子形式,并且进一步发现保持T细胞重新引导抗体如BiTE所具有的强抗肿瘤活性和不以独立于癌症抗原的方式引起细胞因子风暴的优异安全性质并且在血液中还具有长的半衰期的新的多特异性抗原结合分子。此外,本发明人发现包含共有L链的多特异性抗原结合分子靶向表达磷脂酰肌醇聚糖3的癌细胞并且引起细胞毒性。基于该发现,本发明人阐明了本发明的多特异性抗原结合分子引起对含有表达磷脂酰肌醇聚糖3的癌细胞的癌症组织的损伤。发明人揭示了包含多特异性抗原结合分子作为活性成分的抗癌剂;通过组合使用多特异性抗原结合分子和另外的抗癌剂来治疗或预防癌症的方法;多特异性抗原结合分子,抗癌剂或包含多特异性抗原结合分子和抗癌剂的组合的药物组合物,其各自是在组合疗法中使用。
具体地,本发明提供以下各项:
[1]抗癌剂,其包含下述(a)至(c)中任一项的双特异性抗体作为活性成分,所述双特异性抗体包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区:
(a)双特异性抗体,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区域的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其具有:抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和共有L链,所述共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[2]抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体包含具有磷脂酰肌醇聚糖3结合活性的SEQ ID NO:385的抗体H链,具有CD3结合活性的SEQ ID NO:402的抗体H链,和SEQ ID NO:410的共有L链。
[3][1]或[2]的抗癌剂,其中所述癌症是磷脂酰肌醇聚糖3阳性癌症。
[4][3]的抗癌剂,其中所述磷脂酰肌醇聚糖3阳性癌是其中每个细胞细胞表面上的磷脂酰肌醇聚糖3抗原数目为100或更多的癌症。
[5][1]至[4]中任一项的抗癌剂,其中所述癌症是选自由以下组成的组的任何癌症:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌(Merkel cell carcinoma),膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
[6][1]至[5]中任一项的抗癌剂,其用于治疗患有利用免疫检查点抑制剂的治疗难治的癌症的患者。
[7]与另外的抗癌剂组合使用的药物组合物,所述药物组合物包含下述(a)至(c)中任一项的双特异性抗体作为活性成分,所述双特异性抗体包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区:
(a)双特异性抗体,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区域的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和共有L链,所述共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[8]药物组合物,其包含双特异性抗体作为活性成分,所述双特异性抗体具有:具有磷脂酰肌醇聚糖3结合活性的SEQ ID NO:385的抗体H链,具有CD3结合活性的SEQ ID NO:402的抗体H链,和SEQ ID NO:410的共有抗体L链,其中所述药物组合物用于与另外的抗癌剂组合使用。
[9][7]或[8]的药物组合物,其中所述双特异性抗体与所述另外的抗癌剂同时施用。
[10][7]或[8]的药物组合物,其中所述双特异性抗体在施用所述另外的抗癌剂之前或之后施用。
[11][7]-[10]中任一项的药物组合物,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[12][11]的药物组合物,其中所述化疗剂是抗代谢物,植物生物碱或铂化合物。
[13][11]的药物组合物,其中所述T细胞活化激动剂是针对TNFRSF的激动剂抗体。
[14][11]的药物组合物,其中所述免疫检查点抑制剂是PD1抗体,PDL1抗体,TIM3抗体或LAG3抗体。
[15][11]的药物组合物,其中所述血管生成抑制剂是VEGFR2抗体。
[16]用于诱导细胞毒性的试剂,用于阻遏细胞增殖的试剂,用于抑制细胞增殖的试剂,用于激活免疫应答的试剂,用于治疗癌症的试剂或用于预防癌症的试剂,其包含[7]-[15]中任一项的药物组合物。
[17][1]的抗癌剂,其中CDR1、CDR2和CDR3是基于Kabat编号的CDR1、CDR2和CDR3区。
还提供以下发明:
[2-1]抗癌剂,其包含多特异性抗原结合分子作为活性成分,所述多特异性抗原结合分子包含:
(1)包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域,
(2)包含具有T细胞受体复合物结合活性的抗体可变区的结构域,和
(3)包含具有减小的对Fcγ受体的结合活性的Fc区的结构域,
其中包含在(1)的可变区和(2)的可变区中的L链可变区具有共有氨基酸序列;其中所述多特异性抗原结合分子具有的细胞毒性活性等于或大于双特异性抗体GPC3_ERY22_rCE115的细胞毒性活性,所述双特异性抗体GPC3_ERY22_rCE115含有:包含SEQ ID NO:47和48的磷脂酰肌醇聚糖3结合结构域和包含SEQ ID NO:49和50的T细胞受体复合物结合结构域。
[2-2][2-1]的抗癌剂,其中细胞毒性活性是T细胞依赖性细胞毒性活性。
[2-3][2-1]或[2-2]的抗癌剂,其中T细胞受体复合物结合活性是对T细胞受体的结合活性。
[2-4][2-1]至[2-3]中任一项的抗癌剂,其中T细胞受体复合物结合活性是对CD3ε链的结合活性。
[2-5][2-1]至[2-4]中任一项的抗癌剂,其中[1]中的(1)的抗体可变区是包含选自以下(a1)至(a5)的H链CDR1、CDR2和CDR3的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(a1)与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(a2)与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(a3)与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(a4)与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和
(a5)与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3。
[2-6][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]中的(2)的抗体可变区是包含选自以下(b1)至(b15)的H链CDR1、CDR2和CDR3氨基酸序列的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(b1)与包含在SEQ ID NO:52中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b2)与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b3)与包含在SEQ ID NO:122中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b4)与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b5)与包含在SEQ ID NO:129中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b6)与包含在SEQ ID NO:132中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b7)与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b8)与包含在SEQ ID NO:144中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b9)与包含在SEQ ID NO:164中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b10)与包含在SEQ ID NO:168中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b11)与包含在SEQ ID NO:421中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b12)与包含在SEQ ID NO:424中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b13)与包含在SEQ ID NO:426中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(b14)与包含在SEQ ID NO:429中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和
(b15)与包含在SEQ ID NO:430中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3。
[2-7][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]中的(1)和(2)的抗体可变区是包含选自以下(c1)至(c19)的H链CDR1、CDR2和CDR3的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(c1)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:52中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c2)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:421中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c3)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:426中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c4)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:429中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c5)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:40中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:430中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c6)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c7)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c8)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:144中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c9)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:164中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c10)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:168中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c11)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c12)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:144中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c13)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:164中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c14)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:168中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c15)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c16)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:122中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c17)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:129中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(c18)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:132中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和
(c19)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:424中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3。
[2-8][2-5]至[2-7]中任一项的抗癌剂,其中CDR1、CDR2和CDR3是基于Kabat编号的CDR1、CDR2和CDR3区。
[2-9][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]中的(1)的抗体可变区是包含选自以下(a1)至(a5)的H链可变区中任一的抗体可变区,或与其功能等效的抗体可变区:
(a1)具有SEQ ID NO:40的氨基酸序列的H链可变区;
(a2)具有SEQ ID NO:197的氨基酸序列的H链可变区;
(a3)具有SEQ ID NO:206的氨基酸序列的H链可变区;
(a4)具有SEQ ID NO:211的氨基酸序列的H链可变区;和
(a5)具有SEQ ID NO:215的氨基酸序列的H链可变区。
[2-10][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]中的(2)的抗体可变区是包含选自以下(b1)至(b15)的H链可变区中任一的抗体可变区,或与其功能等效的抗体可变区:
(b1)具有SEQ ID NO:52的氨基酸序列的H链可变区;
(b2)具有SEQ ID NO:103的氨基酸序列的H链可变区;
(b3)具有SEQ ID NO:122的氨基酸序列的H链可变区;
(b4)具有SEQ ID NO:128的氨基酸序列的H链可变区;
(b5)具有SEQ ID NO:129的氨基酸序列的H链可变区;
(b6)具有SEQ ID NO:132的氨基酸序列的H链可变区;
(b7)具有SEQ ID NO:142的氨基酸序列的H链可变区;
(b8)具有SEQ ID NO:144的氨基酸序列的H链可变区;
(b9)具有SEQ ID NO:164的氨基酸序列的H链可变区;
(b10)具有SEQ ID NO:168的氨基酸序列的H链可变区;
(b11)具有SEQ ID NO:421的氨基酸序列的H链可变区;
(b12)具有SEQ ID NO:424的氨基酸序列的H链可变区;
(b13)具有SEQ ID NO:426的氨基酸序列的H链可变区;
(b14)具有SEQ ID NO:429的氨基酸序列的H链可变区;和
(b15)具有SEQ ID NO:430的氨基酸序列的H链可变区。
[2-11][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]中的(1)和(2)的抗体可变区是包含选自以下(c1)至(c19)的H链可变区的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(c1)具有SEQ ID NO:40的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:52的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c2)具有SEQ ID NO:40的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:421的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c3)具有SEQ ID NO:40的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:426的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c4)具有SEQ ID NO:40的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:429的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c5)具有SEQ ID NO:40的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:430的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c6)具有SEQ ID NO:197的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:128的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c7)具有SEQ ID NO:206的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:142的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c8)具有SEQ ID NO:206的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:144的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c9)具有SEQ ID NO:206的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:164的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c10)具有SEQ ID NO:206的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:168的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c11)具有SEQ ID NO:211的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:142的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c12)具有SEQ ID NO:211的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:144的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c13)具有SEQ ID NO:211的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:164的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c14)具有SEQ ID NO:211的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:168的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c15)具有SEQ ID NO:215的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:103的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c16)具有SEQ ID NO:215的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:122的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c17)具有SEQ ID NO:215的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:129的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;
(c18)具有SEQ ID NO:215的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:132的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区;和
(c19)具有SEQ ID NO:215的氨基酸序列的[2-1]中的(1)的抗体可变区中包含的H链可变区;和具有SEQ ID NO:424的氨基酸序列的[2-1]中的(2)的抗体可变区中包含的H链可变区。
[2-12][2-1]至[2-11]中任一项的抗癌剂,其中[2-1]的共有L链是包含选自以下(d1)至(d11)的CDR1、CDR2和CDR3的组合中任一个的共有L链,或与其功能等效的共有L链:
(d1)与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d2)与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d3)与包含在SEQ ID NO:299中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d4)与包含在SEQ ID NO:301中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d5)与包含在SEQ ID NO:302中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d6)与包含在SEQ ID NO:304中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d7)与包含在SEQ ID NO:306中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d8)与包含在SEQ ID NO:307中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d9)与包含在SEQ ID NO:309中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(d10)与包含在SEQ ID NO:310中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和
(d11)与包含在SEQ ID NO:319中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3。
[2-13][2-1]至[2-11]中任一项的抗癌剂,其中[2-1]的L链可变区是选自以下(d1)至(d11)的L链氨基酸序列中任一个的可变区:
(d1)包含SEQ ID NO:53的氨基酸序列的L链;
(d2)包含SEQ ID NO:223的氨基酸序列的L链;
(d3)包含SEQ ID NO:299的氨基酸序列的L链;
(d4)包含SEQ ID NO:301的氨基酸序列的L链;
(d5)包含SEQ ID NO:302的氨基酸序列的L链;
(d6)包含SEQ ID NO:304的氨基酸序列的L链;
(d7)包含SEQ ID NO:306的氨基酸序列的L链;
(d8)包含SEQ ID NO:307的氨基酸序列的L链;
(d9)包含SEQ ID NO:309的氨基酸序列的L链;
(d10)包含SEQ ID NO:310的氨基酸序列的L链;和
(d11)包含SEQ ID NO:319的氨基酸序列的L链。
[2-14][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]的(1)和(2)的抗体可变区和共有L链可变区是包含选自以下(e1)至(e25)的H链CDR1、CDR2和CDR3和L链CDR1、CDR2和CDR3的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(e1)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e2)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:299中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e3)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:310中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e4)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:197中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:128中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:319中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e5)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e6)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:144中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e7)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:164中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e8)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:206中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:168中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e9)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e10)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:142中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:299中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e11)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:144中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e12)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:164中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e13)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:211中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:168中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:223中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e14)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e15)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:299中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e16)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:301中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e17)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:302中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e18)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:304中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e19)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:306中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e20)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:307中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e21)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:103中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:309中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e22)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:122中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e23)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:129中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;
(e24)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:132中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和
(e25)包含在[2-1]中的(1)的抗体可变区中并且与包含在SEQ ID NO:215中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;包含在[2-1]中的(2)的抗体可变区中并且与包含在SEQ ID NO:424中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3;和包含在所述共有L链的抗体可变区中并且与包含在SEQ ID NO:53中的CDR1、CDR2和CDR3区的氨基酸序列相同的CDR1、CDR2和CDR3。
[2-15][2-1]至[2-4]中任一项的抗癌剂,其中[2-1]的(1)和(2)的抗体可变区和共有L链可变区是包含选自以下(f1)至(f26)的可变区的组合中任一个的抗体可变区,或与其功能等效的抗体可变区:
(f1)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:197的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:128的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f2)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:197的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:128的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:299中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f3)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:197的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:128的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:310中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f4)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:197的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:128的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:319中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f5)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:206的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:142的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f6)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:206的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:144的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f7)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:206的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:164的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f8)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:206的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:168的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f9)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:211的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:142的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f10)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:211的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:142的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:299中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f11)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:211的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:144的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f12)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:211的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:164的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f13)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:211的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:168的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:223中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f14)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f15)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:299中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f16)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:301中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f17)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:302中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f18)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:304中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f19)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:306中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f20)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:307中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f21)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:103的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:309中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f22)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:122的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f23)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:129的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f24)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:132的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;
(f25)包含在[2-1]中的(1)的抗体可变区中并且与SEQ ID NO:215的氨基酸序列相同的H链可变区;包含在[2-1]中的(2)的抗体可变区中并且与SEQ ID NO:424的氨基酸序列相同的H链可变区;和与包含在SEQ ID NO:53中的可变区的氨基酸序列相同的共有L链的抗体可变区;和
(f26)多特异性抗原结合分子,其结合与(f1)至(f25)中任一的多特异性抗原结合分子所结合的在磷脂酰肌醇聚糖3和T细胞受体复合物上的表位中的每个重叠的表位,并且其具有共有L链。
[2-16][2-1]至[2-15]中任一项的抗癌剂,其中[2-1]中的(3)的Fc区是在SEQ IDNO:23至26(IgG1至IgG4)的Fc区组成氨基酸中的任一个处具有氨基酸突变的Fc区。
[2-17][2-16]的抗癌剂,其中[2-1]中的(3)的Fc区是具有选自由EU编号指定的以下氨基酸位置的至少一个氨基酸的突变的Fc区:
位置220、位置226、位置229、位置231、位置232、位置233、位置234、位置235、位置236、位置237、位置238、位置239、位置240、位置264、位置265、位置266、位置267、位置269、位置270、位置295、位置296、位置297、位置298、位置299、位置300、位置325、位置327、位置328、位置329、位置330、位置331和位置332。
[2-18][2-16]的抗癌剂,其中[2-1]中的(3)的Fc区是包含选自由EU编号指定的以下氨基酸的至少一个氨基酸的Fc区:
氨基酸位置234处的Arg,氨基酸位置235处的Ala或Arg,氨基酸位置239处的Lys,和氨基酸位置297处的Ala。
[2-19][2-16]至[2-18]中任一项的抗癌剂,其中[2-1]中的(3)的Fc区还包含用于促进形成异源二聚体Fc区的氨基酸突变。
[2-20][2-19]的抗癌剂,其中所述异源二聚体Fc区是以下(g1)或(g2)的氨基酸序列组合:
(g1)与包含SEQ ID NO:57的氨基酸序列的恒定区的Fc区相同的氨基酸序列和与包含SEQ ID NO:58的氨基酸序列的恒定区的Fc区相同的氨基酸序列的组合;以及
(g2)与包含SEQ ID NO:60或62的氨基酸序列的恒定区的Fc区相同的氨基酸序列和与包含SEQ ID NO:61的氨基酸序列的恒定区的Fc区相同的氨基酸序列的组合。
[2-21][2-1]至[2-20]中任一项的抗癌剂,其中所述多特异性抗原结合分子是双特异性抗体。
[2-22]抗癌剂,其包含以下(h1)至(h25)中任一项的双特异性抗体作为活性成分:
(h1)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:424的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h2)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h3)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:299的氨基酸序列的共有抗体L链;
(h4)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:301的氨基酸序列的共有抗体L链;
(h5)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:302的氨基酸序列的共有抗体L链;
(h6)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:304的氨基酸序列的共有抗体L链;
(h7)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:306的氨基酸序列的共有抗体L链;
(h8)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:307的氨基酸序列的共有抗体L链;
(h9)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:103的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:309的氨基酸序列的共有抗体L链;
(h10)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:122的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h11)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:129的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h12)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:215的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:132的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h13)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:197的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:128的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:299的氨基酸序列的共有抗体L链;
(h14)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:197的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:128的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:310的氨基酸序列的共有抗体L链;
(h15)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:197的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:128的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:319的氨基酸序列的共有抗体L链;
(h16)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:197的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:128的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:53的氨基酸序列的共有抗体L链;
(h17)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:211的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:142的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:299的氨基酸序列的共有抗体L链;
(h18)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:211的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:142的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h19)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:211的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:144的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h20)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:206的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:144的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h21)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:206的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:142的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h22)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:206的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:164的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h23)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:206的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:168的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;
(h24)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:211的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:164的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链;和
(h25)双特异性抗体,所述双特异性抗体具有:包含具有SEQ ID NO:211的氨基酸序列的抗体H链可变区和具有SEQ ID NO:61的氨基酸序列的恒定区的具有磷脂酰肌醇聚糖3结合活性的抗体H链;包含具有SEQ ID NO:168的氨基酸序列的抗体H链可变区和具有SEQID NO:60或62的氨基酸序列的恒定区的具有T细胞受体复合物结合活性的抗体H链;和具有SEQ ID NO:223的氨基酸序列的共有抗体L链。
此外,本发明涉及包含多特异性抗原结合分子作为活性成分的抗癌剂,所述多特异性抗原结合分子包含以下结构域:
(3-1)包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域;
(3-2)包含具有T细胞受体复合物结合活性的抗体可变区的结构域;
其中包含在(3-1)和(3-2)的可变区中的L链可变区具有共有的氨基酸序列。本发明还涉及包含(3-1)的结构域作为活性成分的抗癌剂,所述结构域更具体地是包含具有磷脂酰肌醇聚糖3结合活性的抗体重链和/或轻链可变区,并且包含在多特异性抗原结合分子中的结构域。本发明还涉及包含(3-2)的结构域作为活性成分的抗癌剂,所述结构域更具体地是包含具有T细胞受体复合物结合活性的抗体可变区,并且包含在多特异性抗原结合分子中的结构域。(3-1)和(3-2)的结构域的细节可以包括以上提及的[2-1]至[2-22]中描述的那些。多特异性抗原结合分子可以是双特异性抗体。此外,多特异性抗原结合分子还可以含有包含Fc区的结构域,并且所述Fc区可以具有减小的Fcγ受体结合活性。包含Fc区的结构域的细节可以包括以上提及的[2-1]至[2-22]中描述的那些。此外,本发明涉及抗癌剂,所述抗癌剂包含所述多特异性抗原结合分子和药用载体。所述抗癌剂可以引起细胞毒性,所述细胞毒性可以是T细胞依赖性细胞毒性,并且所述抗癌剂可以用于施用给需要所述多特异性抗原结合分子的患者。
本发明还提供抗癌剂,所述抗癌剂包含以下多特异性抗原结合分子作为活性成分:结合与以上提及的[2-14]的(e1)至(e25)中任一的多特异性抗原结合分子所结合的磷脂酰肌醇聚糖3和T细胞受体复合物中的每个上的表位重叠和/或竞争的表位的多特异性抗原结合分子,以及结合与以上提及的[2-15]的(f1)至(f25)中任一的多特异性抗原结合分子所结合的磷脂酰肌醇聚糖3和T细胞受体复合物中的每个上的表位重叠和/或竞争的表位的多特异性抗原结合分子。
关于以上提及的[2-20]的(g1)和(g2),在两个Fc区中,前一个Fc区可以包含在具有磷脂酰肌醇聚糖3结合活性的抗体H链中,而后一个Fc区可以包含在具有T细胞受体复合物结合活性的抗体H链中;或前一个Fc区可以包含在具有T细胞受体复合物结合活性的抗体H链中,而后一个Fc区可以包含在具有磷脂酰肌醇聚糖3结合活性的抗体H链中。
本发明还提供了抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体结合与双特异性抗体(其具有:具有磷脂酰肌醇聚糖3结合活性的SEQ ID NO:385的抗体H链,具有CD3结合活性的SEQ ID NO:402的抗体H链,和SEQ ID NO:410的共有抗体L链)所结合的磷脂酰肌醇聚糖3和T细胞受体复合物中的每个上的表位重叠和/或竞争的表位。
还提供以下发明:
[4-1]包含另外的抗癌剂作为活性成分的药物组合物,所述药物组合物与下述(a)至(c)中任一项的双特异性抗体组合使用:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-2][4-1]的药物组合物,其中所述另外的抗癌剂与所述双特异性抗体同时施用。
[4-3][4-1]的药物组合物,其中所述另外的抗癌剂在施用所述双特异性抗体之前或之后施用。
[4-4]用于治疗或预防癌症的药物组合物,其包含下述(a)至(c)中任一项的双特异性抗体与另外的抗癌剂的组合:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-5][4-4]的药物组合物,其是组合制剂。
[4-6][4-4]的药物组合物,其中所述双特异性抗体和所述另外的抗癌剂分开施用。
[4-7][4-6]的药物组合物,其中所述双特异性抗体和所述另外的抗癌剂同时或依次施用。
[4-8][4-1]-[4-7]中任一项的药物组合物,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[4-9][4-1]至[4-8]中任一项的药物组合物,其用于治疗或预防选自由以下组成的组的任何癌症:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
[4-10]用于诱导细胞毒性的试剂,用于阻遏细胞增殖的试剂,用于抑制细胞增殖的试剂,用于激活免疫应答的试剂,用于治疗癌症的试剂或用于预防癌症的试剂,其包含[4-1]-[4-9]中任一项的药物组合物。
还提供以下发明:
[4-11]以下(a)至(c)中任一项的双特异性抗体与另外的抗癌剂的组合:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-12][4-11]的组合,其中所述双特异性抗体与所述另外的抗癌剂同时施用。
[4-13][4-11]的组合,其中所述双特异性抗体在施用所述另外的抗癌剂之前或之后施用。
[4-14][4-11]-[4-13]中任一项的组合,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[4-15][4-11]至[4-14]中任一项的组合物,其用于治疗或预防选自由以下组成的组的任何癌症:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
[4-16]用于诱导细胞毒性的试剂,用于遏制细胞增殖的试剂,用于抑制细胞增殖的试剂,用于激活免疫应答的试剂,用于治疗癌症的试剂或用于预防癌症的试剂,其包含[4-11]-[4-15]中任一项的组合。
还提供以下发明:
[4-17]在个体中诱导细胞毒性,阻遏细胞增殖,抑制细胞增殖,激活免疫应答,治疗癌症或预防癌症的方法,其包括施用有效量的以下(a)至(c)中任一项的双特异性抗体和有效量的另外的抗癌剂:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-18]组合使用以下(a)至(c)中任一项的双特异性抗体在个体中诱导细胞毒性,阻遏细胞增殖,抑制细胞增殖,激活免疫应答,治疗癌症或预防癌症的方法,其包括施用给所述个体有效量的另外的抗癌剂:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-19]组合使用另外的抗癌剂在个体中诱导细胞毒性,阻遏细胞增殖,抑制细胞增殖,激活免疫应答,治疗癌症或预防癌症的方法,其包括施用给所述个体有效量的以下(a)至(c)中任一项的双特异性抗体:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-20]通过以下(a)至(c)中任一项的双特异性抗体在个体中增强诱导细胞毒性,阻遏细胞增殖,抑制细胞增殖,激活免疫应答,治疗癌症或预防癌症的效果的方法,其包括施用给所述个体有效量的另外的抗癌剂:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-21]通过另外的抗癌剂在个体中增强诱导细胞毒性,阻遏细胞增殖,抑制细胞增殖,激活免疫应答,治疗癌症或预防癌症的效果的方法,其包括施用给所述个体有效量的以下(a)至(c)中任一项的双特异性抗体:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-22][4-17]-[4-21]中任一项的方法,其中所述双特异性抗体和所述另外的抗癌剂分开施用。
[4-23][4-17]-[4-22]中任一项的方法,其中所述双特异性抗体和所述另外的抗癌剂同时或依次施用。
[4-24][4-17]-[4-23]中任一项的方法,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[4-25][4-17]-[4-24]中任一项的方法,其中所述癌症是选自由以下组成的组的任何癌症:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
还提供以下发明:
[4-26]试剂盒,其包含:
(A)药物组合物,其包含下述(a)至(c)中任一项的双特异性抗体;
(B)容器;和
(C)指示双特异性抗体和至少一种类型的另外的抗癌剂组合施用给个体以治疗或预防所述个体的癌症的说明书或标签;
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-27]试剂盒,其包含:
(A)另外的抗癌剂;
(B)容器;和
(C)指示所述另外的抗癌剂和包含至少一种类型的下述(a)至(c)的双特异性抗体的药物组合物组合施用给个体以治疗或预防所述个体癌症的说明书或标签;
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-28]试剂盒,其包含:
(A)药物组合物,其包含下述(a)至(c)中任一项的双特异性抗体:
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性;
(B)容器;和
(C)另外的抗癌剂。
[4-29][4-26]至[4-28]的试剂盒,其中所述双特异性抗体与所述另外的抗癌剂同时施用。
[4-30][4-26]至[4-28]的试剂盒,其中所述双特异性抗体在施用所述另外的抗癌剂之前或之后施用。
[4-31][4-26]-[4-30]中任一项的试剂盒,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[4-32][4-26]-[4-31]中任一项的试剂盒,其中所述癌症是选自由以下组成的组的任何癌症:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
还提供以下发明:
[4-33]通过使癌细胞与下述(a)至(c)中任一项的双特异性抗体和另外的抗癌剂接触,诱导对癌细胞或包含癌细胞的肿瘤组织的损伤的方法,或阻遏癌细胞增殖或包含癌细胞的肿瘤组织生长的方法;
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-34]方法,其用于评估双特异性抗体和另外的抗癌剂是否诱导对癌细胞或包含癌细胞的肿瘤组织的损伤,或阻遏癌细胞增殖或包含癌细胞的肿瘤组织生长,所述方法是通过使癌细胞与下述(a)至(c)中任一项的双特异性抗体和另外的抗癌剂接触;
(a)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,其包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区,其中所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和抗体共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
[4-35][4-33]或[4-34]的方法,其中所述另外的抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
[4-36][4-33]-[4-35]中任一项的方法,其中所述癌细胞是选自由以下组成的组的任何癌细胞:胃癌,头颈癌,食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌,肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症。
还提供以下发明:
[5-1][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加和/或维持个体中CD3ε链的表达。
[5-2][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于扩增个体中的T细胞群。
[5-3][5-2]中的药物组合物,其中所述T细胞群是活化的T细胞群。
[5-4][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中细胞因子和/或趋化因子的表达。
[5-5][5-4]的药物组合物,其中细胞因子和/或趋化因子是一种或多种选自由IFNγ,IL2,IL6,IL7,IL8,IL10,IL17A,TNF,CXCL9,和CXCL10组成的组的细胞因子和/或趋化因子。
[5-6][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)-(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中参与细胞死亡的基因的表达。
[5-7][5-6]的药物组合物,其中参与细胞死亡的基因是选自由TNFSF10,FAS,FASL,半胱天冬酶8和半胱天冬酶7组成的组的一种或多种基因。
[5-8][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)-(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于抑制个体中参与细胞周期促进的基因。
[5-9][5-8]的药物组合物,其中参与细胞周期促进的基因是选自由PCNA,CCNA2和CDK4组成的组的一种或多种基因。
[5-10][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中参与细胞周期阻遏的基因的表达。
[5-11][5-10]的药物组合物,其中参与细胞周期阻遏的基因是p21。
[5-12][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)-(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中的白细胞标志物。
[5-13][5-12]的药物组合物,其中所述白细胞标志物是CD45。
[5-14][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中的T细胞标志物和/或T细胞活化标志物。
[5-15][5-14]的药物组合物,其中所述T细胞标志物和/或T细胞活化标志物是选自由CD3,CD4,CD8a,GZB,PRF1,和IFNγ组成的组的一种或多种T细胞标志物和/或T细胞活化标志物。
[5-16][7]至[12]和[4-1]至[4-9]中任一项的药物组合物,与单独施用[7](a)至(c)中任一项的双特异性抗体或所述另外的抗癌剂相比较,所述药物组合物用于增加个体中免疫检查点基因的表达。
[5-17][5-16]的药物组合物,其中所述免疫检查点基因是选自由PD-L1,PD-1,TIM3,LAG3和CTLA4组成的组的一种或多种免疫检查点基因。
在上述[4-1]至[4-36]的每项中,“另外的抗癌剂”是指包含与每项中所述的双特异性抗体不同的物质作为活性成分的抗癌剂。具体地,术语“另外的抗癌剂”仅表示每项的发明被指定为其中其他/另外的抗癌剂是包含不同于双特异性抗体的物质作为活性成分的抗癌剂的发明,并且本发明不限于使用双特异性抗体作为抗癌剂的发明。例如,即使当[4-1]至[4-36]的每个发明叙述术语“另外的抗癌剂”时,本发明还包括不使用除“另外的抗癌剂”之外的其它抗癌剂的实施方案,并且在这种情况下,本发明包括其中双特异性抗体用作其他抗癌剂的增强剂,组合药物,赋形剂等的实施方案。
[发明效果]
本发明提供具有可以高效率制备的分子形式的新的多特异性抗原结合分子,其保持BiTE所具有的强抗肿瘤活性和不以癌症抗原依赖性方式引起细胞因子风暴的优异安全性质等,并且在血液中具有长的半衰期。包含本发明的多特异性抗原结合分子作为活性成分的抗癌剂和使用多特异性抗原结合分子和另外的抗癌剂的组合疗法靶向含有表达磷脂酰肌醇聚糖3的癌细胞的癌组织以引起细胞毒性,并且可以治疗或预防各种癌症。本发明使得不仅具有高水平的安全性而且还具有减小的身体负担并且对患者来说非常方便的理想治疗成为可能。
附图简述
图1-1是显示当衍生自各种癌症类型的细胞系用作靶细胞时抗体38的细胞毒活性的图。
图1-2是显示当衍生自各种癌症类型的细胞系用作靶细胞时抗体38的细胞毒活性的图(图1-1的延续)。
图1-3是显示当衍生自各种癌症类型的细胞系用作靶细胞时抗体38的细胞毒活性的图(图1-2的延续)。
图2是显示抗体38对人T细胞移植模型中来自各种癌症类型的异种移植肿瘤的抗肿瘤活性的图。
图3是显示抗体39和抗体40在人T细胞移植模型中针对PC-10异种移植肿瘤的抗肿瘤活性的图。
图4是显示在人T细胞移植模型中抗体30,抗体31,抗体32和抗体33在人T细胞移植模型中针对SK-HEP-1/hGPC3(SK-pca31a)异种移植肿瘤的抗肿瘤活性的图。
图5是显示抗体38在人源化NOG小鼠模型中针对PC-10异种移植肿瘤的抗肿瘤活性的图。
图6是显示抗体38和抗人GPC3抗体,抗小鼠CTLA-4抗体,抗小鼠PD-1抗体或抗小鼠PD-L1抗体在人CD3εδγ基因修饰的小鼠模型中针对LLC1/hGPC3同系肿瘤的抗肿瘤活性的图。
图7是显示在人T细胞移植模型中由抗体和卡培他滨,顺铂或紫杉醇的单一或组合针对MKN45异种移植肿瘤产生的抗肿瘤活性的图。
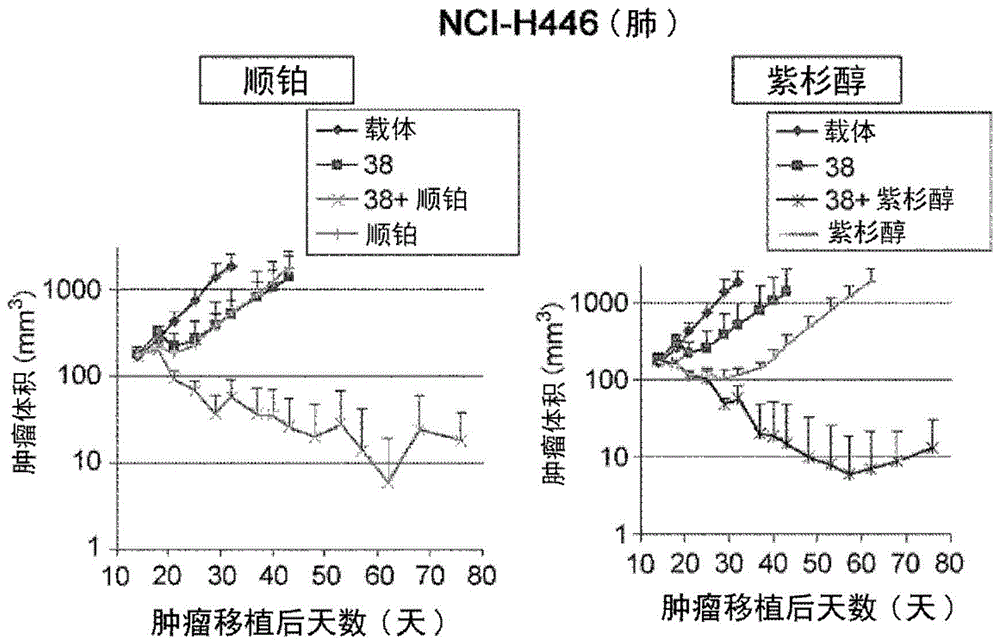
图8是显示在人T细胞移植模型中由抗体和顺铂或紫杉醇的单一或组合针对NCI-H446异种移植肿瘤产生的抗肿瘤活性的图。
图9是显示在人CD3εδγ基因修饰的小鼠模型中由抗体38和抗小鼠TIM-3抗体,抗小鼠LAG-3抗体,抗小鼠CD137抗体或抗小鼠VEGFR2抗体的单一或组合针对Hepa1-6/hGPC3同系肿瘤产生的抗肿瘤活性的图。
图10是显示在人CD3εδγ基因修饰的小鼠模型中由抗体38和抗小鼠CD137抗体的单一或组合针对LLC1/hGPC3同系肿瘤产生的抗肿瘤活性的图。
图11是显示在人CD3ε基因修饰的小鼠模型中抗体38和抗小鼠PD-1抗体或抗小鼠PD-L1抗体的单一或组合针对Hepa1-6/hGPC3同系肿瘤的抗肿瘤活性的图。
图12显示a:ERY22和b:ERY27的示意图。
图13是这样的图,其显示当将NCI-H446用作靶细胞时GPC3_ERY22_rCE115和GPC3_ERY27_hCE115的细胞毒性活性。实心菱形(v)和实心三角形(▲)分别指示GPC3_ERY22_rCE115和GPC3_ERY27_hCE115的细胞毒性活性。
图14是这样的图,其显示当将PC-10用作靶细胞时GPC3_ERY22_rCE115和GPC3_ERY27_hCE115的细胞毒性活性。实心菱形(◆)和实心三角形(▲)分别指示GPC3_ERY22_rCE115和GPC3_ERY27_hCE115的细胞毒性活性。
图15是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图16是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图17是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图18是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图19是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图20是这样的图,其显示当将NCI-H446用作靶细胞时优化的抗体的细胞毒性活性。
图21显示当将PC-10用作靶细胞时优化的抗体的体内抗肿瘤作用。
图22显示当将NCI-H446用作靶细胞时优化的抗体的体内抗肿瘤作用。
图23显示组成IgG1、IgG2、IgG3和IgG4的Fc区的氨基酸残基之间的关系以及KabatEU编号系统(本文中,也被称为EU索引)。
图24-1显示重链可变区序列及其根据Kabat等的编号。
图24-2显示重链可变区序列及其根据Kabat等的编号。
图25显示轻链可变区序列及其根据Kabat等的编号。
图26A显示含有小鼠Cd3ε,Cd3δ和Cd3γ基因的基因组DNA的结构(1),通过修饰含有整个基因区的细菌人工染色体(BAC)克隆构建的小鼠Cd3基因修饰载体(2),使用上述载体已经将loxP和Rox序列插入靶位置的基因组DNA的结构(3),以及由Cre和Dre重组酶的作用产生的Cd3ε,Cd3δ和Cd3γ基因缺陷等位基因的结构(4)。
图26B表示含有人CD3ε,CD3δ和CD3γ基因的BAC克隆的结构(a);5'-修饰盒(b)和3'-修饰盒(c),两者都用于修饰BAC克隆;和使用上述而修饰构建的人CD3基因区导入载体(d)。
图27显示了用于建立小鼠Cd3基因修饰的ES细胞的PCR分析的代表性实例。
图28显示了通过向小鼠Cd3基因修饰的ES细胞中引入人CD3基因区导入载体以及Cre表达载体和Dre表达载体而获得的ES细胞克隆的基因型的PCR分析的代表性实例。图28A显示了检测小鼠Cd3基因区缺陷的PCR结果的代表性实例。
图28B显示了检测人CD3基因区导入的PCR结果的代表性实例。
图29显示了从人CD3基因置换的小鼠,Cd3基因缺陷的小鼠,野生型和导入人CD3ε基因的小鼠的每个已建立系中收集的胸腺的代表性宏观照片。显示了从12至13周龄雄性中摘除的胸腺的各自基因型。
图30显示了从人CD3基因置换的小鼠,Cd3基因缺陷的小鼠,野生型和人CD3ε基因导入的小鼠的每个建立系中收集的脾和胸腺的组织重量的测量结果。计算组织重量/体重的比率,并且通过黑点绘制每个个体获得的值,并且通过柱显示平均值。
图31显示了通过RT-PCR检查人CD3基因置换的小鼠,Cd3基因缺陷的小鼠,野生型小鼠和人CD3ε基因导入的(hCD3εTg)小鼠的每个建立系中每个人CD3分子和每个小鼠Cd3基因的表达的结果。在建立的人CD3基因置换的小鼠的系中,在系编号1C3和8I12中检测到对hCD3ε,hCD3δ和hCD3γ特异的信号。在系编号3B1和2A4中未检测到信号。
图32显示了对人CD3基因置换的小鼠(1C3,8I12和4HH3)的每个建立系的胸腺(A)和脾(B)进行的CD3的免疫组织学染色的代表性实例。在两种组织中,仅在野生型小鼠中的T细胞区中观察到染色。此外,在Cd3基因缺陷的小鼠中未观察到染色,这表明人CD3基因置换的小鼠中的染色是由于导入的人CD3基因的表达。
图33显示了人CD3置换的小鼠的每个建立系的胸腺中成熟T细胞的丰度比的FACS分析的代表性结果。
图34显示了在用OVA免疫的人CD3置换的小鼠的每个建立系中测量鸡卵清蛋白(OVA)特异性IgG1和IgE血清浓度的结果。每个个体的OVA特异性血清IgG1和IgE浓度显示为条形图。条形图下方的数字表示个体识别编号。
图35-1显示了紫杉醇和抗体38组合使用时肿瘤组织的综合RNA分析结果。
图35-2显示了紫杉醇和抗体38组合使用时肿瘤组织的综合RNA分析结果(图35-1的延续)。
图35-3显示了紫杉醇和抗体38组合使用时肿瘤组织的综合RNA分析结果(图35-2的延续)。
图35-4显示了卡培他滨和抗体38组合使用时肿瘤组织的综合RNA分析结果。
图35-5显示了卡培他滨和抗体38组合使用时肿瘤组织的综合RNA分析结果(图35-4的延续)。
图35-6显示了卡培他滨和抗体38组合使用时肿瘤组织的综合RNA分析结果(图35-5的延续)。
图36-1显示了紫杉醇和抗体38组合使用时肿瘤组织的肿瘤浸润淋巴细胞(TIL)分析结果。
图36-2显示了当顺铂和抗体38组合使用时肿瘤组织的肿瘤浸润淋巴细胞(TIL)分析结果。
具体实施方式
提供以下定义以帮助理解本文中阐述的发明。
抗体
在本说明书中,“抗体”是指天然的免疫球蛋白或者通过部分或完全合成而制备的免疫球蛋白。抗体可从天然存在该抗体的血浆或血清等的天然资源、或者产生抗体的杂交瘤细胞的培养上清中分离。备选地,可通过使用基因重组等的技术部分或完全地合成。优选的抗体包括,例如,免疫球蛋白的同种型或这些同种型的亚类的抗体。已知人免疫球蛋白包括IgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE、IgM这9种类别(同种型)。在这些同种型中,本发明的抗体可以包括IgG1、IgG2、IgG3、IgG4。
制作具有所需结合活性的抗体的方法是本领域技术人员已知的。下面,例示与属于GPI锚定型受体家族的磷脂酰肌醇聚糖3(下文中,也被称为GPC3)(Int J Cancer.(2003)103(4),455-65)结合的抗体(抗GPC3抗体)的制作方法。与T细胞受体复合物结合的抗体也可以根据下述例示来制备。
抗GPC3抗体可以使用公知的方法以多克隆或单克隆抗体的形式获得。作为抗GPC3抗体,可以优选制备来源于哺乳动物的单克隆抗体。这些来源于哺乳动物的单克隆抗体包含由杂交瘤产生的抗体或由宿主细胞所产生的抗体,所述宿主细胞通过基因工程技术用携带抗体基因的表达载体转化。
产生单克隆抗体的杂交瘤,可以通过使用公知技术,例如以如下方式来制作。具体地,使用GPC3蛋白质作为致敏性抗原,按照常规的免疫方法对哺乳动物进行免疫。利用常规的细胞融合法使获得的免疫细胞与公知的亲本细胞相融合。然后,利用常规的筛选法,通过筛选产生单克隆抗体的细胞,可以选择产生抗GPC3抗体的杂交瘤。
具体而言,单克隆抗体的制作例如以如下方式来进行。首先,表达在RefSeq登记号NM_001164617.1(SEQ ID NO:1)中公开了其核苷酸序列的GPC3基因以产生用于制备抗体的致敏性抗原的RefSeq登记号NP_001158089.1(SEQ ID NO:2)所表示的GPC3蛋白质。即,将编码GPC3的基因序列插入到已知的表达载体中,并用该载体转化适当的宿主细胞。用公知的方法从该宿主细胞中或培养上清中纯化所需的人GPC3蛋白质。为了从培养上清中获得可溶型的GPC3,例如,代替SEQ ID NO:2所表达的GPC3蛋白质,使从SEQ ID NO:2所表示的GPC3多肽序列中缺失了构成相当于为了使GPC3锚定于细胞膜上所使用的GPI锚定序列的疏水区的564-580氨基酸的蛋白质表达。另外,经纯化的天然的GPC3蛋白质也同样可以用作致敏性抗原。
纯化的GPC3蛋白可被用作致敏性抗原以用于哺乳动物中的免疫。GPC3的部分肽也可被用作致敏性抗原。在此情况中,所述部分肽也可以通过化学合成自人GPC3氨基酸序列获得。此外,其也可以通过将GPC3基因的一部分整合到表达载体中并将其表达而获得。此外,其也可以通过使用蛋白酶将GPC3蛋白降解获得,但是用作部分肽的GPC3肽的区域和尺寸不特别地受限于具体实施方案。作为优选的区域,可以选择来自对应于SEQ ID NO:2的氨基酸序列中的位置524至563处的氨基酸的氨基酸序列的任何序列,或更优选地来自对应于SEQ ID NO:2的氨基酸序列中的位置537至563处的氨基酸的氨基酸序列的任何序列。优选地,可以自不含有对应于SEQ ID NO:2的氨基酸序列中的位置550至663处的氨基酸的氨基酸序列的区域的氨基酸序列选择任何序列。优选地,可以自对应于SEQ ID NO:2的氨基酸序列中的位置544至553的氨基酸序列选择任何序列,并且更优选地,可以自对应于SEQ IDNO:2的氨基酸序列中的位置546至551的氨基酸序列选择任何序列。组成被用作致敏性抗原的肽的氨基酸的数目为至少五个以上,或优选地例如,六个以上,或七个以上。更具体地,由8至50个残基或优选地10至30个残基组成的肽可被用作致敏性抗原。
备选地,可以将GPC3蛋白质的所需的部分多肽或肽与不同的多肽融合而成的融合蛋白质作为致敏性抗原来利用。为了制备用作致敏性抗原的融合蛋白质,例如可以优选利用抗体的Fc片段和肽标签等。表达融合蛋白质的载体可以通过使编码所需的两种或其以上的多肽片段的基因在符合读框内进行融合,并将该融合基因如上述插入到表达载体中来制作。融合蛋白质的制作方法记载于Molecular Cloning 2nd ed.(Sambrook,J等,MolecularCloning 2nd ed.,9.47-9.58(1989)Cold Spring Harbor Lab.Press)中。用作致敏性抗原的GPC3的获得方法和使用GPC3的免疫方法也具体地记载于WO2003/000883、WO2004/022754、WO2006/006693中。
作为用该致敏性抗原免疫的哺乳动物,不限于特定的动物。但优选考虑与用于细胞融合的亲本细胞的适合性来进行选择。一般来说优选使用啮齿类的动物如小鼠、大鼠和仓鼠、兔和猴。
按照公知的方法利用致敏性抗原对上述的动物进行免疫。例如,作为一般的方法,通过向哺乳动物的腹腔内或皮下注射给予致敏性抗原来实施免疫。具体地,用PBS(磷酸盐缓冲盐水),生理盐水等适当稀释致敏抗原。如果需要,将常规佐剂如弗氏完全佐剂与抗原混合,并将混合物乳化。然后,以4至21天的间隔将致敏抗原多次给予哺乳动物。在致敏性抗原的免疫时可以使用适当的载体。特别是在使用分子量较小的部分肽作为致敏性抗原的情况下,将与白蛋白、钥孔虫戚血兰素等的载体蛋白质结合而成的该致敏性抗原肽用于免疫有时也为理想的情况。
另外,产生所需抗体的杂交瘤也可以使用DNA免疫以如下方式来制作。DNA免疫是指,在施用了以在免疫动物中使编码抗原蛋白质的基因能够表达的方式构建的载体DNA的该免疫动物中,通过使致敏性抗原在该免疫动物的活体内表达,而赋予免疫刺激的免疫方法。与对免疫动物施用蛋白质抗原的一般免疫方法相比较,DNA免疫期待以下的优越性:
-维持GPC3这样的膜蛋白质的结构而能够赋予免疫刺激;以及
-无需纯化免疫抗原。
为了通过DNA免疫获得本发明的单克隆抗体,首先,对免疫动物施用表达GPC3蛋白质的DNA。编码GPC3的DNA可以通过PCR等公知的方法来合成。所得DNA被插入到适当的表达载体中,并对免疫动物进行施用。作为表达载体,可以适合利用例如pcDNA3.1等市售的表达载体。作为将载体施用到活体内的方法,可以利用通常使用的方法。例如,通过将吸附有表达载体的金颗粒用基因枪导入到免疫动物个体的细胞内来进行DNA免疫。识别GPC3的抗体的制作也可以使用国际公开WO 2003/104453所记载的方法来制作。
在如上所述免疫哺乳动物后,在血清中证实了GPC3结合抗体滴度的增加。然后,从哺乳动物收集免疫细胞,然后进行细胞融合。作为优选的免疫细胞,特别是可以使用脾细胞。
作为与上述免疫细胞相融合的细胞,可以使用哺乳动物的骨髓瘤细胞。骨髓瘤细胞优选具备用于筛选的适当的选择标记。选择标记是指在特定的培养条件下能够(或者不能够)存活的特性。公知的选择标记有:缺乏次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(以下省略为缺乏HGPRT)、或者缺乏胸苷激酶(以下省略为缺乏TK)等。具有缺乏HGPRT或TK的细胞具有次黄嘌呤-氨基蝶呤-胸苷敏感性(以下省略为HAT敏感性)。HAT敏感性的细胞虽然在HAT选择培养中不能进行DNA合成而死亡。但如果与正常的细胞相融合,则利用正常细胞的补救途径可以持续DNA的合成,因此在HAT选择培养中也可以增殖。
缺乏HGPRT或缺乏TK的细胞分别可以在含有6-硫鸟嘌呤、8-氮鸟嘌呤(以下省略为8AG)、或者5'-溴脱氧尿苷的培养基中选择。将这些嘧啶类似物摄入到DNA中的正常细胞将死亡。同时,不摄入这些嘧啶类似物的、缺乏这些酶的细胞可以在选择培养中存活。此外被称为G418抗性的选择标记通过新霉素抗性基因赋予对2-脱氧链霉胺类抗生素(庆大霉素类似物)的抗性。适合于细胞融合的各种骨髓瘤细胞是公知的。
例如,可以优选使用包括以下细胞的骨髓瘤细胞:P3(P3x63Ag8.653)(J.Immunol.(1979)123(4),1548-1550);
P3x63Ag8U.1(Current Topics in Microbiology and Immunology(1978)81,1-7);
NS-1(C.Eur.J.Immunol.(1976)6(7),511-519);
MPC-11(Cell(1976)8(3),405-415);
SP2/0(Nature(1978)276(5685),269-270);
FO(J.Immunol.Methods(1980)35(1-2),1-21);
S194/5.XX0.BU.1(J.Exp.Med.(1978)148(1),313-323);
R210(Nature(1979)277(5692),131-133)等。
基本上是按照公知的方法、例如Kohler和Milstein等人的方法(MethodsEnzymol.(1981)73,3-46)等,来进行上述免疫细胞与骨髓瘤细胞的细胞融合。
更具体而言,例如可以在细胞融合促进剂的存在下,在常规的营养培养液中实施上述细胞融合。融合促进剂包括例如聚乙二醇(PEG)和仙台病毒(HVJ)。根据需要可以添加例如二甲亚砜等的辅助剂以进一步提高融合效率。
免疫细胞与骨髓瘤细胞的使用比例可以任意设定。例如,相对于骨髓瘤细胞优选使用1~10倍的免疫细胞。作为用于上述细胞融合的培养液,可以使用例如适合于上述骨髓瘤细胞株增殖的RPMI1640培养液、MEM培养液、以及该种的细胞培养中使用的常规的培养液。并且可以适合添加胎牛血清(FCS)等的血清补液。
就细胞融合而言,可以将上述免疫细胞与骨髓瘤细胞的规定量在上述培养液中充分混合。再以通常30%~60%(w/v)的浓度添加预先加热到37℃左右的PEG溶液(例如平均分子量1,000~6,000左右)。通过对混合液进行缓慢混合可以形成所需的融合细胞(杂交瘤)。接着,逐渐添加上述例举的适当培养液到细胞中,并且将其重复离心以除去上清。可以除去不利于杂交瘤生长的细胞融合剂等。
如此获得的杂交瘤可以用常规的选择培养液、例如HAT培养液(含有次黄嘌呤、氨基喋呤和胸苷的培养液)进行培养来选择。使用上述HAT培养液的培养持续到所需杂交瘤以外的细胞(非融合细胞)死亡的足够时间。通常,所述足够的时间为数天至数周。接着,可以利用常规的有限稀释法实施产生所需抗体的杂交瘤的筛选和单一克隆。
如此获得的杂交瘤可以通过利用基于在细胞融合中使用的骨髓瘤所具有的选择标记的选择培养液来进行选择。例如具有缺乏HGPRT或TK的细胞可以通过用HAT培养液(含有次黄嘌呤、氨基喋呤和胸苷的培养液)进行培养来选择。即,在将HAT敏感性的骨髓瘤细胞用于细胞融合的情况下,在HAT培养液中,与正常细胞成功进行细胞融合的细胞可以选择性地增殖。使用上述HAT培养液的培养持续到使所需杂交瘤以外的细胞(非融合细胞)死亡的足够时间。具体而言,通常可以通过数天至数周的培养,选择所需的杂交瘤。接着,可以利用常规的有限稀释法实施产生所需抗体的杂交瘤的筛选和单一克隆。
可以通过基于抗原抗体反应的公知筛选方法来实施所需抗体的筛选和单一克隆。例如,结合于GPC3的单克隆抗体,可以结合于在细胞表面表达的GPC3。这样的单克隆抗体,例如可以通过荧光激活细胞分选术(FACS)进行筛选。FACS是指通过用激光分析与荧光抗体接触的细胞,测定各细胞所发出的荧光进而使结合于细胞表面的抗体的测定成为可能的系统。
为了通过FACS对产生本发明的单克隆抗体的杂交瘤进行筛选,首先制备表达GPC3的细胞。用于筛选的优选细胞为强制表达GPC3的哺乳动物细胞。用作对照,可以使用未转化的哺乳动物细胞作为宿主细胞来选择性地检测对细胞表面的GPC3的抗体的结合活性。即,通过选择产生不结合于宿主细胞、结合于强制表达GPC3的细胞的抗体的杂交瘤,可以获得产生GPC3单克隆抗体的杂交瘤。
备选地,抗体对于固定的表达GPC3的细胞的结合活性可以基于ELISA的原理进行评价。例如,使表达GPC3的细胞固定在ELISA板的孔内。通过使杂交瘤的培养上清与孔内的固定的细胞相接触,来检测结合于固定细胞上的抗体。当单克隆抗体为小鼠由来的情况下,结合于细胞上的抗体可以通过抗小鼠免疫球蛋白抗体来检测。通过上述筛选而选择的、具有抗原结合能的、产生所需抗体的杂交瘤,可以通过有限稀释法等进行克隆。
如此制作的产生单克隆抗体的杂交瘤可以在常规的培养液中继代培养。另外,该杂交瘤可以在液态氮中长期保存。
将该杂交瘤按照常规的方法进行培养,可以从其培养上清中获得所需的单克隆抗体。或者将杂交瘤施用于与其具有适应性的哺乳动物并进行增殖,可以从其腹水中获得单克隆抗体。前者的方法适合于获得高纯度的抗体。
由从该杂交瘤等的抗体产生细胞克隆的抗体基因所编码的抗体也可以被适合地利用。通过将克隆的抗体基因插入到适当的载体并导入到宿主中,由该基因所编码的抗体得以表达。用于抗体基因的分离、向载体插入基因、以及宿主细胞的转化的方法,例如通过Vandamme等人已经确立(Eur.J.Biochem.(1990)192(3),767-775)。如下所述,重组抗体的制备方法也是公知的。
例如,可以从表达抗GPC3抗体的杂交瘤细胞中制备编码抗GPC3抗体的可变区(V区)的cDNA。为此,通常先从杂交瘤中提取总RNA。作为用于从细胞提取mRNA的方法,可以利用例如以下所述的方法:
-胍超速离心法(Biochemistry(1979)18(24),5294-5299);和
-AGPC法(Anal.Biochem.(1987)162(1),156-159)。
所提取的mRNA可以使用mRNA提纯试剂盒(GE Healthcare Bioscience)等来进行纯化。或者,如QuickPrep mRNA提纯试剂盒(GE Healthcare Bioscience)等这样的用于从细胞直接提取总mRNA的试剂盒也得以市售。可以使用这样的试剂盒从杂交瘤中获得mRNA。可以使用逆转录酶由所制备的mRNA合成编码抗体V区的cDNA。cDNA可以使用AMV ReverseTranscriptase First-strand cDNA Synthesis Kit(生化学工业社)等来合成。另外,为了合成和扩增cDNA,可以适当利用SMART RACE cDNA扩增试剂盒(Clontech)和基于PCR的5'-RACE法(Proc.Natl.Acad.Sci.USA(1988)85(23),8998-9002;Nucleic Acids Res.(1989)17(8),2919-2932)。并且,在这样的cDNA的合成的过程中,可以在cDNA的两末端导入后述的适当的限制酶位点。
由所得PCR产物纯化作为目标的cDNA片段,接着使其与载体DNA相连接。如此,重组载体得以制作,将其导入到大肠杆菌等中。选择菌落后,可以由形成该菌落的大肠杆菌制备所需的重组载体。而且,关于该重组载体是否具有作为目标的cDNA核苷酸序列,可以利用公知的方法、例如双脱氧核苷酸链终止法等来确认。
为了分离编码可变区的基因,利用使用了可变区基因扩增用引物的5'-RACE法是简便的。首先以由杂交瘤细胞提取的RNA为模板合成cDNA,获得5'-RACE cDNA文库。可以适当使用SMART RACE cDNA扩增试剂盒等市售的试剂盒来合成5'-RACE cDNA文库。
以所得5'-RACE cDNA文库为模板,通过PCR法扩增抗体基因。基于公知的抗体基因序列可以设计小鼠抗体基因扩增用引物。这些引物的核苷酸序列依赖于免疫球蛋白的亚类而不同。因此,优选地是预先使用Iso Strip小鼠单克隆抗体同种型试剂盒(RocheDiagnostics)等的市售试剂盒来决定亚类。
具体而言,可以利用能够扩增编码作为重链的γ1、γ2a、γ2b、γ3、作为轻链的κ链和λ链的基因的引物以分离编码小鼠IgG的基因。为了扩增IgG的可变区基因,通常可以利用在与可变区相近的恒定区位点退火的引物作为3'侧引物。另一方面,连接到5'RACE cDNA文库构建试剂盒的引物用作5'侧引物。
利用如此扩增的PCR产物,可以重构由重链和轻链的组合而组成的免疫球蛋白。以重构的免疫球蛋白的GPC3结合活性为指标,可以筛选所需的抗体。例如以分离对抗GPC3的抗体为目的时,进一步优选的是抗体与GPC3的结合为特异性的。与GPC3结合的抗体例如可以通过以下步骤进行筛选:
(1)将含有由杂交瘤分离的cDNA所编码的V区的抗体与表达GPC3的细胞相接触;
(2)检测表达GPC3的细胞与抗体结合;和
(3)选择与表达GPC3的细胞结合的抗体。
检测抗体与表达GPC3的细胞结合的方法是公知的。具体而言,能够通过前面所述的FACS等技术检测到抗体与表达GPC3的细胞的结合。为了评价抗体的结合活性可以适当利用表达GPC3的细胞的固定样品。
作为以结合活性为指标的抗体的筛选方法还包括使用噬菌体载体的淘选方法。在抗体基因是从表达多克隆抗体的细胞群的重链和轻链亚类文库分离的情况下,利用噬菌体载体的筛选方法是有利的。编码重链和轻链的可变区的基因可以通过用适当的接头序列进行连接来形成单链Fv(scFv)。通过将编码scFv的基因插入到噬菌体载体可以获得scFv呈现于表面的噬菌体。该噬菌体与目的抗原接触。通过收集与抗原结合的噬菌体,可以分离编码具有目标结合活性的scFv的DNA。根据需要重复该过程,可以浓缩具有所需结合活性的scFv。
分离编码目标抗GPC3抗体的V区的cDNA后,通过识别插入到该cDNA两末端的限制酶位点的限制酶来消化该cDNA。优选的限制酶识别并切割出现在抗体基因的核苷酸序列中的频率低的核苷酸序列。并且优选将赋予粘性末端的限制酶切位点导入到载体中以将单拷贝的消化片段以正确的方向插入。如上所述消化编码抗GPC3抗体的V区的cDNA,并将其插入合适的表达载体中以构建抗体表达载体。在这种情况下,如果编码抗体恒定区(C区)的基因和编码上述V区的基因符合读框地融合,则获得嵌合抗体。本文中,“嵌合抗体”是指恒定区的起点不同于可变区的起点。因此,除了小鼠-人等的异种嵌合抗体之外,人-人同种嵌合抗体也包含在本发明的嵌合抗体中。通过向已经具有恒定区的表达载体中插入上述V区基因,可以构建嵌合抗体表达载体。具体地,例如,切除上述V区基因的限制酶的识别序列可以适当地置于携带编码所需抗体恒定区(C区)的DNA的表达载体的5'侧。通过使利用相同组合的限制酶消化的两基因符合读框的融合来构建嵌合抗体表达载体。
为了制备抗GPC3单克隆抗体,抗体基因被插入到表达载体中使所述基因在表达控制区的控制下表达。用于表达抗体的表达控制区包含例如增强子和启动子。另外,可以在氨基末端附加适当的信号序列使得表达的抗体分泌到细胞外。在后面记载的参比例中,使用具有氨基酸序列MGWSCIILFLVATATGVHS(SEQ ID NO:3)的肽作为信号序列。此外还附接其他适合的信号序列。所表达的多肽在上述序列的羧基末端部分被切割,并且产生的多肽可以作为成熟多肽分泌到细胞外。接着,通过用该表达载体来转化适当的宿主细胞,可以获得表达编码抗GPC3抗体的DNA的重组细胞。
为了表达抗体基因,编码抗体重链(H链)和轻链(L链)的DNA分别被插入到不同的表达载体中。通过用插入有H链和L链的载体共转染相同的宿主细胞,可以表达具备H链和L链的抗体分子。或者能够利用其中插入编码H链和L链的DNA的单一表达载体转化宿主细胞(参照国际公开WO 94/11523)。
通过将所分离的抗体基因导入到适当的宿主用来制备抗体的宿主细胞/表达载体的各自组合是公知的。这些表达系统均可以应用于包含本发明的抗体可变区的结构域的分离。用作宿主细胞的适当的真核细胞包括动物细胞、植物细胞、或者真菌细胞。具体而言,动物细胞包括例如以下细胞:
(1)哺乳类细胞:CHO、COS、骨髓瘤、幼仓鼠肾(BHK)、Hela、Vero等;
(2)两栖类细胞:非洲爪蟾卵母细胞等;和
(3)昆虫细胞:sf9、sf21、Tn5等。
此外,作为植物细胞,使用来源于烟草(Nicotiana)属如烟草(Nicotianatabacum)的细胞的抗体基因表达系统是已知的。愈伤组织培养的细胞可以适当地用于转化植物细胞。
此外,以下细胞可用作真菌细胞:
酵母:酵母属(Saccharomyces)如酿酒酵母(Saccharomyces serevisiae)、毕赤酵母属(Pichia)如巴斯德毕赤酵母(Pichia pastoris);
丝状真菌:曲霉属(Aspergillus)如黑曲霉(Aspergillus niger)。
另外,利用原核细胞的抗体基因表达系统也是公知的。例如,使用细菌细胞的情况下,可以适当利用大肠杆菌(E.coli)、枯草杆菌等的细菌细胞。通过转化向这些细胞中导入包含目标抗体基因的表达载体。通过将所转化的细胞在体外进行培养,可以从该转化细胞的培养物中获得所需的抗体。
除了上述宿主细胞外,转基因动物也可用于产生重组抗体。即,从导入了编码所需抗体的基因的动物可以获得该抗体。例如,抗体基因可以通过符合读框的插入到编码乳汁中固有产生的蛋白质的基因的内部来构建融合基因。作为分泌到乳汁中的蛋白质,可以利用例如山羊β酪蛋白等。含有插入了抗体基因的融合基因的DNA片段被注入到山羊的胚胎中,并且然后该胚胎被导入到雌性山羊体内。由接受了胚胎的山羊生出转基因山羊,从该转基因山羊(或其后代)产生的乳汁中可以作为与乳汁蛋白质的融合蛋白质获得所需抗体。另外,为了使转基因山羊产生的含有所需抗体的乳汁量增加,可以对转基因山羊施用激素(Ebert,K.M等,Bio/Technology(1994),12(7),699-702)。
当将本文中所述的抗原结合分子施用于人时,来源于已被人工修饰而减小针对人等的异源抗原性的遗传重组抗体的结构域可被合适地用作包含抗体可变区的抗原结合分子的结构域。此种遗传重组的抗体包括,例如,人源化抗体。这些经修饰的抗体通过已知方法被合适地制备。
用于产生包括本文所述的抗体可变区的抗原结合分子的结构域的抗体可变区通常由三个互补决定区(CDR)形成,所述三个互补决定区由四个框架区(FR)分开。CDR实质上是决定抗体的结合特异性的区。CDR的氨基酸序列富有多样性。另一方面,构成FR的氨基酸序列,即使在具有不同的结合特异性的抗体之间,也大多显示出高的同一性。因此,通常认为通过移植CDR可以将某抗体的结合特异性移植到其他抗体。
人源化抗体也被称为重构(reshaped)人抗体。具体而言,将非人动物抗体、例如小鼠抗体的CDR移植到人抗体的人源化抗体等是公知的。也已知为了获得人源化抗体的常规的基因重组方法。具体而言,作为将小鼠的抗体的CDR移植到人的FR的方法,例如重叠序列延伸PCR(overlap extension PCR)是公知的。在重叠序列延伸PCR中,在用于合成人抗体的FR的引物上附加编码想要移植的小鼠抗体CDR的核苷酸序列。对于4个FR分别准备引物。通常认为当将小鼠CDR移植到人FR中时,选择与小鼠的FR同一性高的人FR对于维持CDR的功能是有利的。即,通常优选利用包含与想要移植的小鼠CDR相邻的FR的氨基酸序列同一性高的氨基酸序列的人FR。
另外,要连接的核苷酸序列设计成相互符合读框的相接连。利用各自的引物合成各自的人FR。其结果,获得在各FR上附加了编码小鼠CDR的DNA的产物。各产物的编码小鼠CDR的核苷酸序列设计成相互重叠。然后,进行互补链合成反应以使用人抗体基因作为模板使合成的产物的重叠CDR区退火。经由该反应通过小鼠CDR序列连接人FR。
使用与其5'或3'末端退火的引物(其添加有合适的限制酶识别序列)扩增其中最终连接三个CDR和四个FR的全长V区基因。人源化抗体的表达载体可以通过将如上所述获得的DNA和编码人抗体C区的DNA插入表达载体中以使它们符合读框地连接来产生。将重组载体转染宿主以建立重组细胞后,培养重组细胞,表达编码人源化抗体的DNA,在细胞培养物中产生人源化抗体(参见欧洲专利公开号EP 239400和国际专利公开号WO 1996/002576)。
通过定性或定量测量和评估如上所述产生的人源化抗体的抗原结合活性,可以适当地选择人抗体FR,其允许CDR在通过CDR连接时形成有利的抗原结合位点。FR中的氨基酸残基可以根据需要被置换,使得重构的人抗体的CDR形成合适的抗原结合位点。例如,通过应用用于将小鼠CDR移植到人FR中的PCR方法,可以将氨基酸序列突变引入FR。具体而言,可以将部分核苷酸序列突变导入到FR退火的引物中。核苷酸序列突变被导入到利用这样的引物合成的FR中。通过将取代了氨基酸的突变型抗体的抗原结合活性利用上述的方法进行测定和评估,可以选择具有所需性质的突变FR序列(Sato,K.等,Cancer Res,1993,53,851-856)。
备选地,将具有人抗体基因的所有组成成分(repertorie)的转基因动物(参照国际专利公开号WO1993/012227、WO1992/003918、WO1994/002602、WO1994/025585、WO1996/034096、WO1996/033735)作为免疫动物,通过DNA免疫可以获得所需的人抗体。
此外,还已知使用人抗体文库通过淘选制备人抗体的技术。例如,通过噬菌体展示方法将人抗体的V区表达为噬菌体表面上的单链抗体(scFv)。可以选择表达与抗原结合的scFv的噬菌体。编码与抗原结合的人抗体V区的DNA序列可以通过分析所选噬菌体的基因来确定。测定与抗原结合的scFv的DNA序列。通过使该V区序列与所需人抗体C区的序列符合读框的融合并且插入到适当的表达载体中,能够制作表达载体。将表达载体导入适于表达的细胞,例如上述那些。可以通过在细胞中表达人编码抗体的基因来产生人抗体。这些方法是已经公知的(参照国际专利公开号WO1992/001047、WO1992/020791、WO1993/006213、WO1993/011236、WO1993/019172、WO1995/001438、WO1995/015388)。
包含具有磷脂酰肌醇聚糖3(GPC3)结合活性的抗体可变区的结构域
本文中,短语“包含具有磷脂酰肌醇聚糖3(GPC3)结合活性的抗体可变区的结构域”是指以下抗体部分,其包含特异性结合上述GPC3蛋白或GPC3蛋白的部分肽的全部或部分并且还与其互补的区域。可以从一种或多种抗体的可变结构域提供包含抗体可变区的结构域。优选地,包含抗体可变区的结构域包含抗体轻链和重链可变区(VL和VH)。此种包含抗体可变区的结构域的合适的实例包括“单链Fv(scFv)”、“单链抗体”、“Fv”、“单链Fv 2(scFv2)”、“Fab”、“F(ab’)2”等。
包含具有T细胞受体复合物结合活性的抗体可变区的结构域
本文中,短语“包含具有T细胞受体复合物结合活性的抗体可变区的结构域”是指结合T细胞受体复合物的抗体部分,其包含特异性结合T细胞受体复合物的全部或部分并且还与其互补的区域。T细胞受体复合物可以是T细胞受体自身,或与T细胞受体一起构成T细胞受体复合物的衔接头分子。CD3适合作为衔接头分子。
包含具有T细胞受体结合活性的抗体可变区的结构域
本文中,短语“包含具有T细胞受体结合活性的抗体可变区的结构域”是指通过包括特异性结合T细胞受体的全部或部分并且还与其互补的区域产生的结合T细胞受体的抗体部分。
T细胞受体与本发明的结构域结合的部分可以是可变区或恒定区,但是存在于恒定区中的表位是优选的。恒定区序列的实例包括RefSeq登记号CAA26636.1(SEQ ID NO:4)的T细胞受体α链,RefSeq登记号C25777(SEQ ID NO:5)的T细胞受体β链,RefSeq登记号A26659(SEQ ID NO:6)的T细胞受体γ1链,RefSeq登记号AAB63312.1(SEQ ID NO:7)的T细胞受体γ2链,以及RefSeq登记号AAA61033.1(SEQ ID NO:8)的T细胞受体δ链。
包含具有CD3结合活性的抗体可变区的结构域
本文中,短语“包含具有CD3结合活性的抗体可变区的结构域”是指通过包括特异性结合CD3的全部或部分并且还与其互补的区域制备的结合CD3的抗体部分。优选地,所述结构域包含抗CD3抗体的轻链和重链可变区(VL和VH)。此种结构域的合适的实例包括“单链Fv(scFv)”、“单链抗体”、“Fv”、“单链Fv 2(scFv2)”、“Fab”、“F(ab’)2”等。
本发明的包含具有CD3结合活性的抗体可变区的结构域可以是任何表位结合结构域,只要所述表位存在于构成人CD3的γ-链、δ-链或ε-链序列中即可。在本发明中,优选地,合适地使用包含结合存在于人CD3复合物的ε链的胞外区中的表位的抗CD3抗体轻链可变区(VL)和抗CD3抗体重链可变区(VH)的结构域。除了参比例中描述的抗CD3抗体轻链可变区(VL)和抗CD3抗体重链可变区(VH)以外,多种已知的含有结合CD3的抗体轻链可变区(VL)和结合CD3的抗体重链可变区(VH)的CD3结合结构域以及OKT3抗体的那些(Proc.Natl.Acad.Sci.USA(1980)77,4914-4917)被合适地用作此种结构域。可以适当地使用来源于具有所需性质的抗CD3抗体的含抗体可变区的结构域,所述抗体是通过上述方法使用构成人CD3的γ-链、δ-链或ε-链免疫目标动物获得的。如上所述的人抗体和合适地人源化的抗体可以被合适地用作抗CD3抗体以产生包含具有CD3结合活性的抗体可变区的结构域。关于构成CD3的γ-链、δ-链或ε-链的结构,其多核苷酸序列显示在SEQ ID NO:9(NM_000073.2)、10(NM_000732.4)和11(NM_000733.3)中,并且其多肽序列显示在SEQ ID NO:12(NP_000064.1)、13(NP_000723.1)和14(NP_000724.1)中(RefSeq登记号显示在括号中)。
本发明的抗原结合分子中的含抗体可变区的结构域可以结合相同的表位。本文中,相同的表位可以存在于包含SEQ ID NO:2或14的氨基酸序列的蛋白质中。备选地,本发明的抗原结合分子中的含抗体可变区的结构域可以分别结合不同的表位。本文中,不同的表位可以存在于包含SEQ ID NO:2或14的氨基酸序列的蛋白质中。
特异性
术语“特异性”表示参与特异性结合的分子之一不显示任何与不同于结合伙伴分子中的一个或数个的分子的显著结合。此外,在含抗体可变区的结构域对抗原中的多个表位中的特定表位具有特异性时,也使用该术语。当含抗体可变区的结构域所结合的表位被包含在数个不同抗原中时,包含含抗体可变区的结构域的抗原结合分子可以结合具有所述表位的各种抗原。
表位
“表位”意指抗原中的抗原决定簇,并且是指在本说明书中公开的包含抗体可变区的抗原结合分子的结构域所结合的抗原位点。因此,例如可以根据其结构来定义表位。另外,也可以根据识别该表位的抗原结合分子中的抗原结合活性来定义该表位。当抗原是肽或多肽时,表位可以由形成表位的氨基酸残基指定。或者,当表位是糖链时,表位可以通过其特定的糖链结构来确定。
线性表位是含有其一级氨基酸序列被识别的表位的表位。这种线性表位通常在其特定序列中含有至少三个,最常见的至少五个,例如约8至10或6至20个氨基酸。
与线性表位相反,“构象表位”是其中含有表位的一级氨基酸序列不是识别的表位的唯一决定簇的表位(例如,构象表位的一级氨基酸序列不一定被表位限定抗体识别)。与线性表位相比,构象表位可含有更多数量的氨基酸。构象表位识别抗体识别肽或蛋白质的三维结构。例如,当蛋白质分子折叠并形成三维结构时,形成构象表位的氨基酸和/或多肽主链变得对齐,并且表位可被抗体识别。用于确定表位构象的方法包括例如X射线晶体学,二维核磁共振,位点特异性自旋标记和电子顺磁共振,但不限于此。例如参考EpitopeMapping Protocols in Methods in Molecular Biology(1996),Vol.66,Morris(ed.)。
下面举例说明用于确认测试抗原结合分子与表位结合的方法,所述测试抗原结合分子包含含有具有GPC3结合活性的抗体可变区的结构域,以及也可以根据下面的实施例适当地进行确认测试抗原结合分子与表位结合的方法,所述测试抗原结合分子包含含有具有T细胞受体复合物结合活性的抗体可变区的结构域。
例如,下面可以确认包含含有具有GPC3结合活性的抗体可变区的结构域的测试抗原结合分子对GPC3分子中存在的线性表位的识别。为了上述目的,合成包含构成GPC3细胞外结构域的氨基酸序列的线性肽。所述肽可以是化学合成的。备选地,其可以通过使用编码对应于胞外结构域的氨基酸序列的GPC3的cDNA中的区域的遗传工程方法获得。接下来,评估包含构成细胞外结构域的氨基酸序列的线性肽和包含含有具有GPC3结合活性的抗体可变区的结构域的测试抗原结合分子之间的结合活性。例如,使用固定的线性肽作为抗原的ELISA能够评估抗原结合分子对肽的结合活性。备选地,可以基于线性肽在抗原结合分子与表达GPC3的细胞的结合中引起的抑制水平来阐明对线性肽的结合活性。这些测试可以阐明抗原结合分子对线性肽的结合活性。
此外,以下可以确认包含含有具有GPC3结合活性的抗体可变区的结构域的测试抗原结合分子对表位的三维结构的识别。制备表达GPC3的细胞以用于上述目的。例如,当包含含有具有GPC3结合活性的抗体可变区的结构域的测试抗原结合分子接触表达GPC3的细胞时,其与所述细胞紧密结合,但是另一方面,存在这样的情况,其中抗原结合分子基本上不结合固定的包含构成GPC3的胞外结构域的氨基酸序列的线性肽。在这些情况中,“基本上不结合”是指,相对于对表达人GPC3的细胞的结合活性,结合活性为80%以下,通常为50%以下,优选为30%以下,并且特别优选为15%以下。
作为测定含有GPC3抗原结合结构域的测试抗原结合分子与表达GPC3的细胞的结合活性的方法,例如可以举出:Antibodies:A Laboratory Manual记载的方法(Ed Harlow,David Lane,Cold Spring Harbor Laboratory(1988)359-420)。即,可以基于使用表达GPC3的细胞为抗原的ELISA或荧光激活细胞分选术(FACS)的原理进行评价。
在ELISA格式中,含有GPC3抗原结合结构域的测试抗原结合分子与表达GPC3的细胞的结合活性可以通过比较由酶反应生成的信号水平来定量地进行评价。即,在固定有表达GPC3的细胞的ELISA板上加入测试抗原结合分子。然后,利用识别测试抗原结合分子的酶标记抗体检测与细胞结合的测试抗原结合分子。或者,当使用FACS时,制备测试抗原结合分子的稀释系列,可以确定表达GPC3的细胞的抗体结合效价,以比较测试抗原结合分子对表达GPC3的细胞的结合活性。
可以使用流式细胞仪检测测试抗原结合分子与悬浮在缓冲液等中的细胞表面上表达的抗原的结合。作为流式细胞仪,已知例如以下的装置:
FACSCanto
FACSAria
FACSArray
FACSVantage
FACSCalibur
EPICS ALTRAHyPerSort
Cytomics FC 500
EPICS XL-MCLADC EPICS XL ADC
Cell Lab Quanta/Cell Lab Quanta SC(均为Beckman Coulter的商品名)。
用于测定含有GPC3抗原结合结构域的测试抗原结合分子对抗原的结合活性的优选方法包括,例如,以下方法。首先,使表达GPC3的细胞与测试抗原结合分子反应,然后用识别多肽复合物的FITC标记的第二抗体染色。用合适的缓冲液适当稀释测试抗原结合分子,以制备所需浓度的复合物。例如,以10μg/ml至10ng/ml之间的任意浓度来使用。接着,使用FACSCalibur(BD)测定荧光强度和细胞计数。通过使用CELL QUEST软件(BD)分析获得的荧光强度,即几何平均值,反映了与细胞结合的抗体的量。也就是说,测试抗原结合分子的结合活性(由结合的测试抗原结合分子的量表示)可以通过测量几何平均值来确定。
可以基于两个复合物之间对相同表位的竞争来评估含有GPC3抗原结合结构域的测试抗原结合分子是否与另一个抗原结合分子共享共同表位。抗原结合分子之间的竞争由交叉阻断测定等来检测。例如,竞争性ELISA测定是优选的交叉阻断测定。
具体地,在交叉阻断测定中,将固定在微量滴定板孔中的GPC3蛋白在存在或不存在候选竞争物抗原结合分子的情况下预温育,然后向其中加入测试抗原结合分子。在孔中与GPC3蛋白结合的测试抗原结合分子的量与竞争结合相同表位的候选竞争物抗原结合分子的结合能力间接相关。即,竞争物抗原结合分子与相同表位的亲和力越大,测试抗原结合分子与包被有GPC3蛋白质的孔的结合活性越降低。
经由GPC3蛋白质与孔结合的测试抗原结合分子的量能通过预先标记抗原结合分子容易地测定。例如,使用抗生物素蛋白/过氧化物酶缀合物和适当的底物测定生物素标记的抗原结合分子。利用过氧化物酶等的酶标记的交叉阻断测定特别被称为“竞争性ELISA测定”。抗原结合分子能够利用能被检测或者测量的其他标记物质来标记。具体而言,放射标记或者荧光标记等是公知的。
在不存在竞争物抗原结合分子的情况下进行的对照实验中的结合活性相比,当候选竞争物抗原结合分子能将含有GPC3抗原结合结构域的测试抗原结合分子的结合阻断至少20%,优选至少20至50%,更优选至少50%时,确定测试抗原结合分子基本上结合竞争物抗原结合分子结合的相同表位,或竞争结合相同表位。
当已经鉴定出由含有GPC3抗原结合结构域的测试抗原结合分子结合的表位的结构时,可以通过比较测试和对照抗原结合分子针对通过将氨基酸突变导入形成表位的肽中而制备的肽的结合活性来评估这两种抗原结合分子是否共享共同表位。
为了测量上述结合活性,例如,在上述ELISA形式中比较测试和对照抗原结合分子对导入突变的线性肽的结合活性。除了ELISA方法之外,还可以通过在柱中流动测试和对照抗原结合分子,然后定量在洗脱溶液中洗脱的抗原结合分子来确定对与柱结合的突变肽的结合活性。用于将突变肽吸附到柱上的方法,例如,以GST融合肽的形式,是已知的。
备选地,当鉴定的表位是构象表位时,可以通过以下方法评估测试和对照抗原结合分子是否共享共同表位。首先,制备表达GPC3的细胞和表达具有导入表位的突变的GPC3的细胞。将测试和对照抗原结合分子加入到通过将这些细胞悬浮在合适的缓冲液如PBS中制备的细胞悬浮液中。然后,用缓冲液适当洗涤细胞悬浮液,并向其中加入识别测试和对照抗原结合分子的FITC标记的抗体。使用FACSCalibur(BD)测定荧光强度和用标记抗体染色的细胞数。使用合适的缓冲液适当稀释测试和对照多肽复合物,并以所需浓度使用。例如,它们可以以10μg/ml至10ng/ml的浓度使用。通过使用CELL QUEST软件(BD)分析确定的荧光强度,即几何平均值,反映了与细胞结合的标记抗体的量。也就是说,测试和对照抗原结合分子的结合活性(由结合的标记抗体的量表示)可以通过测量几何平均值来确定。
在上述方法中,抗原结合分子是否“基本上不与表达突变体GPC3的细胞结合”可以通过例如以下方法评估。首先,用标记的抗体染色与表达突变体GPC3的细胞结合的测试和对照抗原结合分子。然后,确定细胞的荧光强度。当FACSCalibur用于通过流式细胞术进行荧光检测时,可以使用CELL QUEST软件分析测定的荧光强度。根据存在和不存在抗原结合分子的几何平均值,可以根据下式计算比较值(ΔGeo-平均),以确定由于抗原结合分子结合的结果荧光强度增加的比率。
ΔGeo-平均=Geo-平均(在抗原结合分子存在下)/Geo-平均(在不存在抗原结合分子的情况下)
通过上述分析确定的几何平均值比较值(突变体GPC3分子的ΔGeo-平均)(反映了与表达突变体GPC3的细胞结合的测试抗原结合分子的量)与ΔGeo-平均比较值(反映了与表达GPC3的细胞结合的测试抗原结合分子的量)进行比较。在这种情况下,用于确定表达GPC3的细胞和表达突变体GPC3的细胞的ΔGeo-平均比较值的测试抗原结合分子的浓度特别优选调整为相等或基本相等。已经证实识别GPC3中的表位的抗原结合分子用作对照抗原结合分子。
如果表达突变体GPC3的细胞的测试抗原结合分子的ΔGeo-平均比较值小于表达GPC3的细胞的测试抗原结合分子的ΔGeo-平均比较值至少80%,优选50%,更优选30%,特别优选15%,则测试多肽复合物“基本上不与表达突变体GPC3的细胞结合”。用于确定Geo-平均(几何平均)值的公式在CELL QUEST软件用户指南(BD biosciences)中描述。当比较显示比较值基本相等时,可以确定测试和对照抗原结合分子的表位相同。
可变片段(Fv)
本文中,术语“可变片段(Fv)”是指抗体衍生的抗原结合结构域的最小单位,其由一对抗体轻链可变区(VL)和抗体重链可变区(VH)构成。1988年,Skerra和Pluckthun发现,通过在细菌信号序列下游插入抗体基因并在大肠杆菌中诱导该基因的表达,可以从大肠杆菌周质部分制备同源和活性抗体(Science(1988)240(4855),1038-1041)。在由周质级分制备的Fv中,VH以与抗原结合的方式与VL结合。
在此,Fv优选包括,例如,一对作为抗原结合分子等的Fv,其包含:
(1)作为二价scFv的二价抗原结合结构域,其中二价scFv的一个单价scFv通过形成CD3结合结构域的重链Fv片段与形成Fc结构域的一个多肽连接,而另一个单价scFv通过形成CD3结合结构域的轻链Fv片段与另一个形成Fc结构域的其他多肽连接;
(2)包含Fc结构域的结构域,所述Fc结构域不具有Fcγ受体结合活性,并且衍生自形成IgG1,IgG2a,IgG3或IgG4的Fc结构域的氨基酸;和
(3)至少一个单价CD3结合域,
其中轻链和重链Fv片段缔合形成CD3结合结构域,使得它能结合CD3抗原。
scFv,单链抗体和sc(Fv)2
本文中,术语“scFv”,“单链抗体”和“sc(Fv)2”均指单个多肽链的抗体片段,其含有源自重链和轻链的可变区,但没有恒定区。通常,单链抗体还在VH和VL结构域之间含有多肽接头,这使得能够形成被认为允许抗原结合的所需结构。Pluckthun在“ThePharmacology of Monoclonal Antibodies,Vol.113,Rosenburg and Moore,eds.,Springer-Verlag,New York,269-315(1994)”中详细讨论了单链抗体。还参见国际专利公开WO 1988/001649;美国专利号4,946,778和5,260,203。在具体实施方案中,单链抗体可以是双特异性的和/或人源化的。
scFv是构成Fv的VH和VL由肽接头连接而成的抗原结合结构域(Proc.Natl.Acad.Sci.U.S.A.(1988)85(16),5879-5883)。VH和VL可以通过肽接头保持紧密靠近。
sc(Fv)2为两个VL和两个VH的4个可变区由肽接头等的接头连接而构成一条单链的单链抗体(J Immunol.Methods(1999)231(1-2),177-189)。两个VH和两个VL可以衍生自不同的单克隆抗体。例如,如Journal of Immunology(1994)152(11),5368-5374中所公开的,这种sc(Fv)2优选包括识别单个抗原中存在的两个表位的双特异性sc(Fv)2。sc(Fv)2可以通过本领域技术人员已知的方法制备。例如,sc(Fv)2可以通过连接子(例如肽接头)连接scFv来产生。
本文中,形成sc(Fv)2的抗原结合结构域的形式包括其中两个VH单元和两个VL单元从单链多肽的N末端开始以VH,VL,VH和VL([VH]-接头-[VL]-接头-[VH]-接头-[VL])的顺序排列的抗体。两个VH单元和两个VL单元的顺序不限于上述形式,它们可以以任何顺序排列。下面列出了这些形式的示例顺序。
[VL]-接头-[VH]-接头-[VH]-接头-[VL]
[VH]-接头-[VL]-接头-[VL]-接头-[VH]
[VH]-接头-[VH]-接头-[VL]-接头-[VL]
[VL]-接头-[VL]-接头-[VH]-接头-[VH]
[VL]-接头-[VH]-接头-[VL]-接头-[VH]
sc(Fv)2的分子形式也在WO 2006/132352中详细描述。根据这些描述,本领域技术人员可以适当地制备所需的sc(Fv)2以产生本文公开的抗原结合分子。
此外,本发明的抗原结合分子可以与载体聚合物如PEG或有机化合物如抗癌剂缀合。备选地,优选将糖链添加序列插入多肽复合物中,使得糖链产生所需效果。
有待用于连接抗体的可变区的接头包含可以通过基因工程导入的任意的肽接头和例如Protein Engineering,9(3),299-305,1996中公开的合成接头。然而,肽接头在本发明中是优选的。肽接头的长度没有特别限制,可以根据目的由本领域技术人员适当选择。长度优选为5个氨基酸或更多(没有特别限制,上限通常为30个氨基酸或更少,优选20个氨基酸或更少),特别优选15个氨基酸。当sc(Fv)2含有三个肽接头时,它们的长度可以全部相同或不同。
例如,这种肽接头可以包括:
Ser
Gly·Ser
Gly·Gly·Ser
Ser·Gly·Gly
Gly·Gly·Gly·Ser(SEQ ID NO:15)
Ser·Gly·Gly·Gly(SEQ ID NO:16)
Gly·Gly·Gly·Gly·Ser(SEQ ID NO:17)
Ser·Gly·Gly·Gly·Gly(SEQ ID NO:18)
Gly·Gly·Gly·Gly·Gly·Ser(SEQ ID NO:19)
Ser·Gly·Gly·Gly·Gly·Gly(SEQ ID NO:20)
Gly·Gly·Gly·Gly·Gly·Gly·Ser(SEQ ID NO:21)
Ser·Gly·Gly·Gly·Gly·Gly·Gly(SEQ ID NO:22)
(Gly·Gly·Gly·Gly·Ser(SEQ ID NO:17))n
(Ser·Gly·Gly·Gly·Gly(SEQ ID NO:18))n
其中n是1或更大的整数。根据目的,本领域技术人员可以相应地选择肽接头的长度或序列。
合成接头(化学交联剂)通常用于交联肽,并且是例如:
N-羟基琥珀酰亚胺(NHS),
二琥珀酰亚胺基辛二酸酯(DSS),
二(磺基琥珀酰亚胺基)辛二酸酯(BS
二硫代双(琥珀酰亚胺基丙酸酯)(DSP),
二硫代双(磺基琥珀酰亚胺基丙酸酯)(DTSSP),
双(琥珀酰亚胺基琥珀酸)乙二醇酯(EGS),
双(磺基琥珀酰亚胺基琥珀酸)乙二醇酯(磺基-EGS),
二琥珀酰亚胺基酒石酸盐(DST),二磺基琥珀酰亚胺基酒石酸盐(磺基-DST),
双[2-(琥珀酰亚胺氧基羰基氧基)乙基]砜(BSOCOES),
以及双[2-(磺基琥珀酰亚胺氧基羰基氧基)乙基]砜(磺基-BSOCOES)等。这些交联剂可商购获得。
通常,需要三个接头将四个抗体可变区连接在一起。要使用的接头可以是相同类型或不同类型。
Fab,F(ab’)2和Fab'
“Fab”由单个轻链和来自单个重链的CH1结构域和可变区组成。Fab分子的重链不能与另一个重链分子形成二硫键。
“F(ab’)2”和“Fab'”是通过将免疫球蛋白(单克隆抗体)蛋白质分解酶例如胃蛋白酶或者番木瓜蛋白酶进行处理来制备,并且是指通过在存在于两条H链每一个的铰链区之间的二硫键的附近消化免疫球蛋白(单克隆抗体)而生成的抗体片段。例如,木瓜蛋白酶在存在于两个H链的每个中的铰链区之间的二硫键上游切割IgG,以产生两个同源抗体片段,其中包含VL(L链可变区)和CL(L链恒定区)的L链通过其C末端区域的二硫键与包含VH(H链可变区)和CHγ1(H链恒定区中的γ1区)的H链片段连接。这两个同源抗体片段中的每一个称为Fab'。
“F(ab’)2”由两条轻链和两条重链组成,所述两条重链包含CH1结构域的恒定区和一部分CH2结构域,从而在两条重链之间形成二硫键。形成本文公开的抗原结合分子的F(ab’)2可以优选如下产生。包含所需抗原结合结构域的完整单克隆抗体等用蛋白酶如胃蛋白酶部分消化;并且通过吸附到蛋白A柱上除去Fc片段。蛋白酶没有特别限制,只要它能以选择性方式切割整个抗体以在适当的设置酶反应条件如pH下产生F(ab’)2。这些蛋白酶包括例如胃蛋白酶和无花果蛋白酶。
Fc结构域
形成本文公开的抗原结合分子的Fc结构域可以优选以下列方式产生。用例如胃蛋白酶的蛋白酶部分消化例如单克隆抗体的抗体。然后,将得到的片段吸附到蛋白A或蛋白G柱上,并用适当的洗脱缓冲液洗脱。蛋白酶没有特别限制,只要它可以在适当的设置酶反应条件例如pH下切割抗体例如单克隆抗体即可。这些蛋白酶包括例如胃蛋白酶和无花果蛋白酶。
本文所述的抗原结合分子包含具有降低的Fcγ受体结合活性的Fc结构域,其包括形成IgG1,IgG2,IgG3或IgG4的Fc结构域的氨基酸。
根据恒定区的结构确定抗体同种型。同种型IgG1,IgG2,IgG3和IgG4的恒定区分别称为Cγ1,Cγ2,Cγ3和Cγ4。形成人Cγ1,Cγ2,Cγ3和Cγ4的Fc结构域多肽的氨基酸序列分别在SEQ ID NO:23,24,25和26中举例说明。形成每个氨基酸序列的氨基酸残基与Kabat的EU编号(本文也称为EU索引)之间的关系如图23所示。
Fc结构域是指除F(ab’)2之外的区域,其包含两条轻链和两条重链,所述两条重链包含恒定区的一部分(所述恒定区包含CH1结构域和CH1和CH2结构域之间的区域)从而在两条重链之间形成二硫键。形成本文公开的抗原结合分子的Fc结构域可以优选如下产生。用蛋白酶例如胃蛋白酶部分消化单克隆IgG1,IgG2,IgG3或IgG4抗体等,然后洗脱吸附在蛋白A柱上的级分。蛋白酶没有特别限制,只要它能以选择性方式切割整个抗体以在适当的设置酶反应条件例如pH下产生F(ab’)2即可。这样的蛋白酶包括例如胃蛋白酶和无花果蛋白酶。
Fcγ受体
Fcγ受体是指能够结合单克隆IgG1,IgG2,IgG3或IgG4抗体的Fc结构域的受体,并且包括属于基本上由Fcγ受体基因编码的蛋白质家族的所有成员。在人中,该家族包括FcγRI(CD64),包括同种型FcγRIa,FcγRIb和FcγRIc;FcγRII(CD32)包括同种型FcγRIIa(包括同种异型H131和R131),FcγRIIb(包括FcγRIIb-1和FcγRIIb-2)和FcγRIIc;和FcγRIII(CD16),包括同种型FcγRIIIa(包括同种异型V158和F158)和FcγRIIIb(包括同种异型FcγRIIIb-NA1和FcγRIIIb-NA2);以及所有未鉴定的人FcγR,FcγR同种型及其同种异型。然而,Fcγ受体不限于这些实施例。不限于此,FcγR包括衍生自人,小鼠,大鼠,兔和猴的那些。FcγR可以源自任何生物。小鼠FcγR包括但不限于FcγRI(CD64),FcγRII(CD32),FcγRIII(CD16)和FcγRIII-2(CD16-2),以及所有未鉴定的小鼠FcγR,FcγR同种型及其同种异型。这种优选的Fcγ受体包括,例如,人FcγRI(CD64),FcγRIIA(CD32),FcγRIIB(CD32),FcγRIIIA(CD16)和/或FcγRIIIB(CD16)。FcγRI的多核苷酸序列和氨基酸序列分别记载于SEQ ID NO:27(NM_000566.3)和28(NP_000557.1)中、FcγRIIA的多核苷酸序列和氨基酸序列分别记载于SEQ ID NO:29(BC020823.1)和30(AAH20823.1)中、FcγRIIB的多核苷酸序列和氨基酸序列分别记载于SEQ ID NO:31(BC146678.1)和32(AAI46679.1)中、FcγRIIIA的多核苷酸序列和氨基酸序列分别记载于SEQ ID NO:33(BC033678.1)和34(AAH33678.1)中、以及FcγRIIIB的多核苷酸序列和氨基酸序列分别记载于SEQ ID NO:35(BC128562.1)和36(AAI28563.1)中(括号内表示RefSeq登记号)。Fcγ受体在IgG1、IgG2、IgG3、IgG4单克隆抗体的Fc区是否具有结合活性可以除上述所记载的FACS或ELISA格式以外还利用ALPHA筛选(放大的发光邻近同相测定(Amplified Luminescent ProximityHomogeneous Assay))或基于表面等离子共振(SPR)的BIACORE法等来评估(Proc.Natl.Acad.Sci.USA(2006)103(11),4005-4010)。
另外,“Fc配体”或“效应配体”是指结合于抗体Fc结构域形成Fc/Fc配体复合物的分子。所述分子可以由来于任何生物。Fc配体与Fc的结合优选诱导一种或多种效应子功能。此类Fc配体包括但不限于Fc受体,FcγR,FcαR,FcεR,FcRn,C1q和C3,甘露聚糖结合凝集素,甘露糖受体,葡萄球菌蛋白A,葡萄球菌蛋白G和病毒FcγR。Fc配体还包括Fc受体同源物(FcRH)(Davis等.,(2002)Immunological Reviews 190,123-136),其是与FcγR同源的Fc受体家族。Fc配体还包括与Fc结合的未鉴定的分子。
Fcγ受体结合活性
Fc结构域对Fcγ受体FcγI、FcγIIA、FcγIIB、FcγIIIA和/或FcγIIIB中任一个的结合活性的降低可以通过上述所记载的FACS或ELISA格式、以及利用ALPHA筛选(放大的发光邻近同相测定(Amplified Luminescent Proximity Homogeneous Assay))或基于表面等离子共振(SPR)的BIACORE法等来评估(Proc.Natl.Acad.Sci.USA(2006)103(11),4005-4010)。
ALPHA筛选通过ALPHA技术基于下述原理使用两种类型的珠子进行:供体珠和受体珠。仅当与供体珠连接的分子跟与受体珠连接的分子在生物学上相互作用时以及当两种珠子位于非常接近时,才检测到发光信号。通过激光束激发,供体珠中的光敏剂将珠周围的氧转化为激发的单线态氧。单态氧向供体珠周边扩散并到达接近的受体珠时引起珠内的化学发光反应。该反应最终导致放出光。如果与供体珠连接的分子不跟与受体珠连接的分子相互作用,则供体珠产生的单线态氧不会到达受体珠,并且不会发生化学发光反应。
例如,将生物素标记的抗原结合分子固定在供体珠上,并将谷胱甘肽S-转移酶(GST)标记的Fcγ受体固定在受体珠上。在不存在包含竞争性突变Fc结构域的抗原结合分子的情况下,Fcγ受体与包含野生型Fc结构域的抗原结合分子相互作用,诱导520至620nm的信号。具有未标记的突变Fc结构域的抗原结合分子与包含野生型Fc结构域的抗原结合分子竞争与Fcγ受体的相互作用。可以通过量化竞争导致的荧光减少来确定相对结合亲和力。使用磺基-NHS-生物素等将抗原结合分子例如抗体生物素化的方法是已知的。将GST标签添加至Fcγ受体的适当方法包括涉及符合读框地融合编码Fcγ和GST的多肽、使用导入了携带该基因的载体的细胞表达融合基因、然后使用谷胱甘肽柱纯化的方法。能够优选地分析诱导信号,例如,通过使用诸如GRAPHPAD PRISM(GraphPad;San Diego)的软件基于非线性回归分析而拟合到单点竞争模型。
观察它们相互作用的物质之一作为配体固定在传感器芯片的金薄层上。当光在传感器芯片的后表面上脱落使得在金薄层和玻璃之间的界面处发生全反射时,反射光的强度在某个位置部分地减小(SPR信号)。用于观察它们相互作用的另一种物质作为分析物注入传感器芯片的表面。当分析物与配体结合时,固定化配体分子的质量增加。这改变了传感器芯片表面上溶剂的折射率。折射率的变化引起SPR信号的位置偏移(相反,解离将信号转移回原始位置)。在Biacore系统中,在垂直轴上绘制上述偏移量(即,传感器芯片表面上的质量变化),因此质量随时间的变化显示为测量数据(传感器图)。动力学参数(结合速率常数(ka)和解离速率常数(kd))由传感图曲线确定,并且亲和力(KD)由这两个常数之间的比率确定。抑制测定优选用于BIACORE方法。抑制测定法的例子记载于Proc.Natl.Acad.Sci.USA(2006)103(11),4005-4010中。
本文中,“Fcγ受体结合活性降低”是指,例如,基于上述分析方法,测试抗原结合分子的竞争活性为对照抗原结合分子的竞争活性的50%或更低,优选45%或更低,40%或更低,35%或更低,30%或更低,20%或更低,或15%或更低,特别优选10%或更低,9%或更低,8%或更低,7%或更低,6%或更低,5%或更低,4%或更低,3%或更低,2%或更低,或1%或更低。
包含单克隆IgG1,IgG2,IgG3或IgG4抗体的Fc结构域的抗原结合分子能适当地用作对照抗原结合分子。Fc结构域的结构显示于SEQ ID NO:37(A加入RefSeq登录号AAC82527.1的N末端),38(A加入RefSeq登录号AAB59393.1的N末端),25(A加入到RefSeq登录号CAA27268.1的N末端,和39(A加到RefSeq登录号AAB59394.1的N末端)。此外,当使用包含特定同种型抗体的Fc结构域突变体的抗原结合分子作为测试物质时,使用包含相同同种型的Fc结构域的抗原结合分子作为对照来评估突变体突变对Fcγ受体结合活性的影响。如上所述,适当地制备包含Fc结构域突变体的抗原结合分子,所述Fc结构域突变体的Fcγ受体结合活性被判断为降低。
此类突变体的实例包括例如,具有231A-238S(按照EU编号)氨基酸缺失的突变体(WO 2009/011941)、以及突变体C226S,C229S,P238S,(C220S)(J.Rheumatol(2007)34,11);C226S和C229S(Hum.Antibod.Hybridomas(1990)1(1),47-54);C226S,C229S,E233P,L234V和L235A(Blood(2007)109,1185-1192)。
具体地,优选的抗原结合分子包括那些包含在形成特定同种型抗体的Fc结构域的氨基酸中的位置220,226,229,231,232,233,234,235,236,237,238,239,240,264,265,266,267,269,270,295,296,297,298,299,300,325,327,328,329,330,331,或332(EU编号)具有氨基酸置换的Fc结构域。Fc结构域起源的抗体的同种型没有特别限制,可以使用来自单克隆IgG1,IgG2,IgG3或IgG4抗体的合适的Fc结构域。优选使用衍生自IgG1抗体的Fc结构域。
优选的抗原结合分子包括,例如,包含具有下述任何一个置换的Fc结构域的那些,这些置换的位置根据形成IgG1抗体Fc结构域的氨基酸中的EU编号指定(每个数字代表EU编号中氨基酸残基的位置;数字前面的单字母氨基酸符号表示置换前的氨基酸残基,而数字后面的单字母氨基酸符号表示置换前的氨基酸残基):
(a)L234F,L235E,P331S;
(b)C226S,C229S,P238S;
(c)C226S,C229S;
(d)C226S,C229S,E233P,L234V,L235A;
(e)L234A,L235A或L235R,N297A;
(f)L235A或L235R,S239K,N297A
以及在位置231-238具有氨基酸序列缺失的Fc结构域的那些。
此外,优选的抗原结合分子还包括具有Fc结构域的那些,所述Fc结构域具有如下所示的任何一个置换,其位置根据形成IgG2抗体的Fc结构域的氨基酸中的EU编号来指定:
(g)H268Q,V309L,A330S,和P331S;
(h)V234A;
(i)G237A;
(j)V234A和G237A;
(k)A235E和G237A;
(l)V234A,A235E,和G237A。每个数字代表EU编号中氨基酸残基的位置;数字前的单字母氨基酸符号代表置换前的氨基酸残基,而数字后的单字母氨基酸符号代表置换前的氨基酸残基。
此外,优选的抗原结合分子还包括具有Fc结构域的那些,所述Fc结构域具有如下所示的任何一个置换,其位置根据形成IgG3抗体的Fc结构域的氨基酸中的EU编号来指定:
(m)F241A;
(n)D265A;
(o)V264A。每个数字代表EU编号中氨基酸残基的位置;数字前的单字母氨基酸符号代表置换前的氨基酸残基,而数字后的单字母氨基酸符号代表置换前的氨基酸残基。
此外,优选的抗原结合分子还包括具有Fc结构域的那些,所述Fc结构域具有如下所示的任何一个置换,其位置根据形成IgG4抗体的Fc结构域的氨基酸中的EU编号来指定:
(p)L235A,G237A,和E318A;
(q)L235E;
(r)F234A和L235A。每个数字代表EU编号中氨基酸残基的位置;数字前的单字母氨基酸符号代表置换前的氨基酸残基,而数字后的单字母氨基酸符号代表置换前的氨基酸残基。
其他优选的抗原结合分子包括,例如,包含Fc结构域的那些,其中形成IgG1抗体Fc结构域的氨基酸中的位置233,234,235,236,237,327,330,或331(EU编号)的任何氨基酸被相应的IgG2或IgG4中EU编号的相应位置的氨基酸置换。
优选的抗原结合分子还包括,例如,包含Fc结构域的那些,其中形成IgG1抗体的Fc结构域的氨基酸中的位置234,235和297位(EU编号)中的任何一个或多个氨基酸被其他氨基酸置换。置换后的氨基酸的种类没有特别限定,然而,特别优选包含Fc结构域的抗原结合分子,其中位置234,235和297的任何一个或多个氨基酸被丙氨酸置换。
优选的抗原结合分子还包括,例如,包含Fc结构域的那些,其中形成IgG1抗体的Fc结构域的氨基酸中的位置265(EU编号)氨基酸被另一个氨基酸置换。置换后的氨基酸的种类没有特别限定,然而,特别优选包含Fc结构域的抗原结合分子,其中位置265的氨基酸被丙氨酸置换。
多特异性抗原结合分子
本发明的“多特异性抗原结合分子”的优选实施方案的实例包括多特异性抗体。当将具有减小的Fcγ受体结合活性的Fc区用作多特异性抗体Fc区时,可以合适地使用来源于多特异性抗体的Fc区。作为本发明的多特异性抗体,双特异性抗体是特别优选的。在此情况中,双特异性抗体是具有两种不同特异性的抗体。IgG型双特异性抗体可以由杂交的杂交瘤(quadroma)分泌,所述杂交的杂交瘤通过将产生IgG抗体的两种类型的杂交瘤融合制备(Milstein等,Nature(1983)305,537-540)。
此外,IgG型双特异性抗体通过以下方式分泌:将构成两种目的类型的IgG的L链和H链的基因(即,总计四种基因)引入到细胞中,并将其共表达。然而,通过这些方法可以产生的IgG的H链和L链的组合的数目在理论上是十种组合。因此,难以从十种类型的IgG中纯化包含所需的H链和L链的组合的IgG。此外,理论上,具有所需组合的IgG的分泌量将显著减小,并且因此将需要大规模培养,并且生产成本将进一步增加。
因此,用于促进H链之间以及具有所需组合的L链和H链之间的结合的技术可以应用于本发明的多特异性抗原结合分子。
例如,通过在抗体H链的第二恒定区或第三恒定区(CH2或CH3)的界面处引入静电排斥以抑制非所需的H链缔合的技术可以应用于多特异性抗体缔合(WO2006/106905)。
在通过在CH2或CH3的界面处引入静电排斥以抑制非所需的H链缔合的技术中,在H链的其他恒定区的界面处接触的氨基酸残基的实例包括对应于CH3区中的EU编号位置356、439、357、370、399和409处的残基的区域。
更具体地,实例包括包括这样的抗体,所述抗体包含两种类型的H-链CH3区,其中选自以下(1)至(3)中指示的氨基酸残基对的第一H链CH3区中的一至三对氨基酸残基带有相同类型的电荷:(1)包含在H链CH3区中在EU编号位置356和439处的氨基酸残基;(2)包含在H链CH3区中在EU编号位置357和370处的氨基酸残基;和(3)包含在H链CH3区中在EU编号位置399和409处的氨基酸残基。
此外,所述抗体可以是这样的抗体,其中不同于上述第一H链CH3区的第二H链CH3区中的氨基酸残基对选自上述(1)至(3)的氨基酸残基对,其中对应于上述第一H链CH3区中的带有相同类型电荷的上述(1)至(3)的氨基酸残基对的一至三对氨基酸残基带有与上述第一H链CH3区中对应的氨基酸残基相反的电荷。
以上(1)至(3)中指示的各氨基酸残基在缔合期间彼此接近。本领域技术人员可以通过同源性建模等使用可商购的软件找到所需的H链CH3区或H链恒定区中对应于上述(1)至(3)的氨基酸残基的位置,并且这些位置的氨基酸残基可以进行适当修饰。
在上述抗体中,“带电荷的氨基酸残基”优选地选自例如以下各组之一中包括的氨基酸残基:
(a)谷氨酸(E)和天冬氨酸(D);和
(b)赖氨酸(K)、精氨酸(R)和组氨酸(H)。
在上述抗体中,短语“带有相同的电荷”表示,例如,两个或更过个氨基酸残基都选自上述组(a)和(b)之一中包括的氨基酸残基。短语“带有相反的电荷”表示,例如,当两个或更多个氨基酸残基中的至少一个氨基酸残基选自上述组(a)和(b)中的任一个中包括的氨基酸残基时,剩余的氨基酸残基选自其他组中包括的氨基酸残基。
在优选的实施方案中,上述抗体可以具有通过二硫键交联的第一H链CH3区和第二H链CH3区。
在本发明中,进行修饰的氨基酸残基不限于上述抗体可变区或抗体恒定区的氨基酸残基。本领域技术人员可以通过同源性建模等使用可商购的软件确定在突变体多肽或异源多聚体中形成界面的氨基酸残基;并且这些位置的氨基酸残基之后可以进行修饰以调节缔合。
其他已知的技术也可以用于本发明的多特异性抗体的缔合。包含不同氨基酸的含Fc区的多肽可以通过以下方式有效地彼此缔合:用较大的侧链(突出)取代抗体的H-链Fc区之一中存在的氨基酸侧链,并且用较小的侧链(孔)取代其他H链的相应Fc区中存在的氨基酸侧链,从而允许将突出置于孔内(WO1996/027011;Ridgway JB等.,Protein Engineering(1996)9,617-621;Merchant A.M.等.Nature Biotechnology(1998)16,677-681;和US20130336973)。
此外,其他已知的技术也可以用于形成本发明的多特异性抗体。具有不同序列的多肽的缔合可以通过以下方式有效地引起:使用通过将抗体的一个H链CH3的部分变成相应的来源于IgA的序列产生的链互换改造的结构域CH3并且将相应的来源于IgA的序列引入到另一条H链CH3的互补部分的CH3的互补缔合(Protein Engineering Design&Selection,23;195-202,2010)。该已知的技术也可用于有效地形成目的多特异性抗体。
此外,如WO 2011/028952、WO2014/018572和Nat Biotechnol.2014Feb;32(2):191-8中所述的利用抗体CH1和CL的缔合和VH和VL的缔合的抗体制备技术;如WO2008/119353和WO2011/131746中所述的组合地利用分开制备的单克隆抗体来制备双特异性抗体的技术(Fab臂交换);如WO2012/058768和WO2013/063702中所述的调节抗体重链CH3之间的缔合的技术;如WO2012/023053中所述的制备由两种类型的轻链和一种类型的重链组成的双特异性抗体的技术;如Christoph等(Nature Biotechnology Vol.31,p 753-758(2013))所述的使用分别表达包含单个H链和单个L链的抗体链之一的两种细菌细胞株制备双特异性抗体的技术;等等,可以用于多特异性抗体的形成。
多特异性抗体形成的实施方案包括通过在还原剂存在下混合两种类型的单克隆抗体以裂解核心铰链区中的二硫键,然后如上所述重新缔合异二聚化(FAE)来获得双特异性抗体的方法。同时,在CH3区的相互作用界面处引入静电相互作用(WO2006/106905)可以在再缔合过程中诱导甚至更有效的异二聚化(WO2015/046467)。在使用天然存在的IgG的FAE中,重新缔合随机发生;并且因此理论上,双特异性抗体只能以50%的效率获得;然而在该方法中,可以高产率产生双特异性抗体。
备选地,即使当不能有效形成目的多特异性抗体时,本发明的多特异性抗体也可以通过自制备的抗体分离和纯化目的多特异性抗体来获得。例如,已经报道了能够通过离子交换色谱法通过将氨基酸置换引入到两种类型的H链的可变区中以产生等电点差异纯化目的抗体的同源多聚和异源多聚形式的两种类型的方法(WO2007114325)。目前,作为纯化异源多聚抗体的方法,已经报道了使用A蛋白来纯化包含结合A蛋白的小鼠IgG2a H链和不结合A蛋白的大鼠IgG2b H链的异源二聚体抗体的方法(WO98050431和WO95033844)。此外,异源二聚体抗体本身可以通过以下方式被有效纯化:使用包含在作为IgG-A蛋白结合位点的EU编号位置435和436处的利用作为产生不同A蛋白亲和力的氨基酸的Tyr、His等的氨基酸残基置换的H链,或使用根据参比例9的方法获得的具有不同A蛋白亲和力的H链,以改变各H链与A蛋白的相互作用,然后使用A蛋白柱。
备选地,可以获得能够给多个不同H链提供结合能力的共有L链并将其用作多特异性抗体的共有L链。多特异性IgG的有效表达可以通过将此种共有L链和多个不同H链的基因引入到细胞中以表达IgG来实现(Nature Biotechnology(1998)16,677-681)。当选择共有H链时,也可以使用用于选择对不同H链中的任一种显示强结合能力的共有L链的方法(WO2004/065611)。
此外,Fc区C端异源性已被改善的的Fc区可以被合适地用作本发明的Fc区。更具体地,本发明提供通过以下方法制备的Fc区:使如由EU编号指示的位置446处的甘氨酸和位置447处的赖氨酸从构成来源于IgG1、IgG2、IgG3或IgG4的Fc区的两种多肽的氨基酸序列中缺失。
这些技术中的多个(如两个以上的)可以组合使用。此外,这些技术可以合适地且分别地应用于要缔合的两条H链。此外,这些技术可以与上述对Fcγ受体具有减小的结合活性的Fc区组合使用。此外,基于进行上述修饰的抗原结合分子,本发明的抗原结合分子可以是分开制备的分子,以致其具有相同的氨基酸序列。
本发明的非限制性实施方案提供抗癌剂,其包含下述(a)~(c)中任一项的双特异性抗体作为活性成分,所述双特异性抗体包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3结合活性的抗体可变区:
(a)双特异性抗体,其中包含在具有磷脂酰肌醇聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3是分别与SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列具有至少80%同一性的序列;
(b)双特异性抗体,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是与SEQ IDNO:206的氨基酸序列具有至少80%同一性的序列;具有CD3结合活性的抗体可变区是与SEQID NO:168的氨基酸序列具有至少80%同一性的序列;并且共有L链的抗体可变区是与SEQID NO:223的氨基酸序列具有至少80%同一性的序列;和
(c)双特异性抗体,所述双特异性抗体具有抗体H链,所述抗体H链具有磷脂酰肌醇聚糖3结合活性,并且与SEQ ID NO:385的氨基酸序列具有至少80%的同一性;抗体H链,所述抗体H链具有CD3结合活性,并且与SEQ ID NO:402的氨基酸序列具有至少80%的同一性;和共有L链,所述抗体共有L链与SEQ ID NO:410的氨基酸序列具有至少80%同一性。
在上述(a)至(c)中任一项的双特异性抗体中,每个指定的重链和轻链CDR1,CDR2和CDR3,重链可变区,轻链可变区,整个重链和整个轻链的氨基酸序列同一性优选为至少75%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,或90%或更高,并且更优选至少91%,92%,93%,94%,95%,96%,97%,98%,或99%或更高。
在本文中,序列同一性计算为与序列比对后确定的重链可变区或轻链可变区的原始氨基酸序列中的残基相同的残基的百分比,并且视需要适当地导入缺口以使序列同一性最大化。
在上述(a)至(c)中任一项的双特异性抗体中,只要抗体具有磷脂酰肌醇聚糖3结合活性或CD3结合活性,可以在重链和轻链CDR1,CDR2和CDR3,和重链可变区,轻链可变区,整个重链和整个轻链的氨基酸序列中置换,缺失,添加和/或插入一个或多个氨基酸。本领域技术人员熟知的用于制备其中一个或多个氨基酸被置换,缺失,添加和/或插入的氨基酸序列的方法包括将突变引入蛋白质的方法。例如,本领域技术人员可以通过使用定点诱变(Hashimoto-Gotoh,T,Mizuno,T,Ogasahara,Y,和Nakagawa,M.(1995)Anoligodeoxyribonucleotide-directed dual amber method for site-directedmutagenesis.Gene 152,271-275;Zoller,MJ,和Smith,M.(1983)Oligonucleotide-directed mutagenesis of DNAfragments cloned into M13 vectors.MethodsEnzymol.100,468-500;Kramer,W,Drutsa,V,Jansen,HW,Kramer,B,Pflugfelder,M,和Fritz,HJ(1984)The gapped duplex DNA approach to oligonucleotide-directedmutation construction.Nucleic Acids Res.12,9441-9456;Kramer W和Fritz HJ(1987)Oligonucleotide-directed construction of mutations via gapped duplex DNAMethods.Enzymol.154,350-367;Kunkel,TA(1985)Rapid and efficient site-specificmutagenesis without phenotypic selection.Proc Natl Acad Sci U S A.82,488-492)等将突变适当地引入具有磷脂酰肌醇聚糖3结合活性或CD3结合活性的抗体的氨基酸序列中来制备功能上等同于以下双特异性抗体的重链或轻链可变区的突变体,所述双特异性抗体具有:具有磷脂酰肌醇聚糖3结合活性的SEQ ID NO:385的抗体H链,具有CD3结合活性的SEQ ID NO:402的抗体H链,以及SEQ ID NO:410的抗体共有L链。在本发明中,短语“功能等效”表示对抗原的结合亲和力是等效的,或备选地,该短语表示当将其用作多特异性抗原结合分子时,针对表达磷脂酰肌醇聚糖3的细胞或含有这些细胞的组织是等效的。结合亲和力和细胞毒性活性可以基于本文中的描述测量。细节在下文中描述。
待改变的氨基酸的数量不受限制,并且例如为40或更少,30或更少,20或更少,优选18或更少,16或更少,15或更少,12或更少,10或更少,9或更少,8或更少,7或更少,6或更少,5或更少,4或更少,3或更少,或2或更少。
当氨基酸残基被改变时,氨基酸优选被突变成保留氨基酸侧链性质的不同的氨基酸。氨基酸侧链性质的实例有:疏水性氨基酸(A、I、L、M、F、P、W、Y和V)、亲水性氨基酸(R、D、N、C、E、Q、G、H、K、S和T)、具有脂肪族侧链的氨基酸(G、A、V、L、I和P)、具有含羟基侧链的氨基酸(S、T和Y)、具有含硫原子侧链的氨基酸(C和M)、具有含羧酸和酰胺侧链的氨基酸(D、N、E和Q)、具有碱性侧链的氨基酸(R、K和H)以及具有芳香性侧链的氨基酸(H、F、Y和W)(括号中氨基酸由单字母编码表示)。这些组中的每个内的氨基酸置换被称为保守性置换。已知的是,具有修饰的氨基酸序列(其中给定氨基酸序列中的一个或多个氨基酸残基被缺失、添加和/或置换成其他氨基酸)的多肽可以保持原生物学活性(Mark,D.F.等,Proc.Natl.Acad.Sci.USA (1984)81:5662-6;Zoller,M.J.和Smith,M.,Nucleic AcidsRes.(1982)10:6487-500;Wang,A.等,Science(1984)224:1431-3;Dalbadie-McFarland,G.等,Proc.Natl.Acad.Sci.USA(1982)79:6409-13)。
备选地,在CDR区,重链可变区,轻链可变区,整个重链区或整个轻链区的氨基酸序列中具有一个或多个氨基酸的置换,缺失,添加和/或插入的具有磷脂酰肌醇聚糖3结合活性或CD3结合活性的氨基酸序列可以从以下核酸获得,所述核酸在严格条件下与包含对CDR区,重链可变区,轻链可变区,整个重链区或整个轻链区的氨基酸序列进行编码的核苷酸序列的核酸杂交。用于分离在严格条件下与包含编码CDR区,重链可变区,轻链可变区,整个重链区或整个轻链区的氨基酸序列的核苷酸序列的核酸杂交的核酸的严格杂交条件包括,例如,6M尿素,0.4% SDS,0.5x SSC和37℃的条件,或与其严格等效的杂交条件。在更严格的条件(例如,6M尿素,0.4% SDS,0.1x SSC和42℃的条件)下,预期可以分离具有更高同源性的核酸。杂交后的洗涤条件为,例如,在60℃使用0.5x SSC(1x SSC是0.15M NaCl和0.015M柠檬酸钠,pH7.0)和0.1% SDS的洗涤,更优选为在60℃使用0.2x SSC和0.1% SDS的洗涤,甚至更优选为在62℃使用0.2x SSC和0.1% SDS的洗涤,甚至更优选为在65℃使用0.2xSSC和0.1% SDS的洗涤,并且更优选为在65℃使用0.1x SSC和0.1% SDS的洗涤。可以适当地调节洗涤时间和洗涤次数,例如,可以进行三次20分钟洗涤。分离的核酸的序列可通过下述已知方法测定。分离的核酸的整体核苷酸序列同源性为至少50%以上,优选地70%以上,75%以上,80%以上,85%以上,并且更优选为90%以上(例如,91%,92%,93%,94%,95%,96%,97%,98%,99%以上)序列同一性。
除了使用杂交技术的上述方法,也可以使用基因扩增方法,例如聚合酶链式反应(PCR)(使用基于对CDR区,重链可变区,轻链可变区,整个重链区或整个轻链区的氨基酸序列进行编码的核苷酸序列的信息合成的引物)来分离在严格条件下与包含编码所述区域的氨基酸序列的核苷酸序列的核酸杂交的核酸。
一个核苷酸序列或氨基酸序列与另一个核苷酸序列或氨基酸序列的同一性可以使用Karlin和Altschul(Proc.Natl.Acad.Sci.USA(1993)90:5873-7)的算法BLAST确定。基于该算法开发出了被称为BLASTN和BLASTX的程序(Altschul等,J.Mol.Biol.(1990)215:403-10)。用于通过基于BLAST的BLASTN分析核苷酸序列的参数包括例如得分=100和字长=12。另一方面,用于通过基于BLAST的BLASTX分析氨基酸序列的参数包括,例如,得分=50和字长=3。当使用BLAST和Gapped BLAST程序时使用各程序的缺省参数。用于此种分析的具体技术是已知的(参见National Center for Biotechnology Information(NCBI)的网站,Basic Local Alignment Search Tool(BLAST);http://www.ncbi.nlm.nih.gov)。
本发明的非限制性实施方案提供了抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体具有实施例和参比例中描述的样品编号38(表17)的抗体的两条H链和共有L链。本发明的非限制性实施方案还提供了抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体具有样品编号38的抗体的两条H链和共有L链的可变区并具有磷脂酰肌醇聚糖3结合活性和CD3结合活性。本发明的非限制性实施方案还提供了抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体具有包含在样品编号38的抗体的两个H链和共有L链中的CDR1,CDR2和CDR3区域的相应氨基酸序列并具有磷脂酰肌醇聚糖3结合活性和CD3结合活性。
本发明的非限制性实施方案提供抗癌剂,其包含双特异性抗体作为活性成分,所述双特异性抗体具有以下:具有磷脂酰肌醇蛋白聚糖3结合活性的SEQ ID NO:385的抗体H链,具有CD3结合活性的SEQ ID NO:402的抗体H链,和SEQ ID NO:410的抗体共有L链。
本发明的非限制性实施方案提供抗癌剂,其包含双特异性抗体作为活性成分,其中包含在具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区中的CDR1,CDR2和CDR3分别是SEQ ID NO:206中包含的CDR1,CDR2和CDR3区的氨基酸序列;包含在具有CD3结合活性的抗体可变区中的CDR1,CDR2和CDR3分别是SEQ ID NO:168中包含的CDR1,CDR2和CDR3区的氨基酸序列;并且包含在共有L链的抗体可变区中的CDR1,CDR2和CDR3分别是SEQ ID NO:223中包含的CDR1,CDR2和CDR3区的氨基酸序列。
包含在抗体可变区中的CDR1,CDR2和CDR3的氨基酸序列可以通过本领域技术人员已知的方法鉴定,并且这些方法没有特别限制。CDR1,CDR2和CDR3区域可以是基于本领域技术人员已知的编号(例如Kabat,Chothia或Contact编号)的那些,或者可以是基于其他标准的那些。在本发明的非限制性实施方案中,SEQ ID NO:206中包含的CDR1,CDR2和CDR3区分别包含位置31至35(SEQ ID NO:456),位置50至66(SEQ ID NO:457)和位置99至104(SEQ IDNO:458)的氨基酸序列区(Kabat编号);位置26至32(SEQ ID NO:459),位置52至57(SEQ IDNO:460)和位置97至104(SEQ ID NO:461)的氨基酸序列区(Chothia编号);以及位置30至35(SEQ ID NO:462),位置47至59(SEQ ID NO:463)和位置97至103(SEQ ID NO:464)的氨基酸序列区(Contact编号);然而,CDR区可以是基于其他标准的CDR区。
在本发明的非限制性实施方案中,SEQ ID NO:168中包含的CDR1,CDR2和CDR3区分别包含位置31至35(SEQ ID NO:465),位置50至68(SEQ ID NO:466)和位置101至111(SEQID NO:467)的氨基酸序列区(Kabat编号);位置26至32(SEQ ID NO:468),位置52至59(SEQID NO:469)和位置99至111(SEQ ID NO:470)的氨基酸序列区(Chothia编号);以及位置30至35(SEQ ID NO:471),位置47至61(SEQ ID NO:472)和位置99至110(SEQ ID NO:473)的氨基酸序列区(Contact编号);然而,CDR区可以是基于其他标准的CDR区。
在本发明的非限制性实施方案中,SEQ ID NO:223中包含的CDR1,CDR2和CDR3区分别包含位置24至39(SEQ ID NO:474),位置55至61(SEQ ID NO:475)和位置94至102(SEQ IDNO:476)的氨基酸序列区(Kabat编号和Chothia编号);以及位置35至41(SEQ ID NO:477),位置51至56(SEQ ID NO:478)和位置94至101(SEQ ID NO:479)的氨基酸序列区(Contact编号);然而,CDR区可以是基于其他标准的CDR区(参见附图24-1,24-2和25)。
本发明的非限制性实施方案提供了抗癌剂,其包含双特异性抗体作为活性成分,其中具有磷脂酰肌醇聚糖3结合活性的抗体可变区是SEQ ID NO:206的氨基酸序列;具有CD3结合活性的抗体可变区是SEQ ID NO:168的氨基酸序列;共有L链的抗体可变区是SEQID NO:223的氨基酸序列。
包含在本发明的抗癌剂或药物组合物中的合适的多特异性抗原结合分子包含
(1)包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域;
(2)包含具有T细胞受体复合物结合活性的抗体可变区的结构域;和
(3)包含上述具有减小的Fcγ受体结合活性的Fc区的结构域,其结构没有限制。
在本发明中,上述各结构域可以直接通过肽键连接。例如,当使用F(ab’)
包含在本发明的抗癌剂或药物组合物中的含在具有磷脂酰肌醇聚糖3结合活性的抗体中的优选抗体H链可变区的实例包含表1的抗体H链可变区,或具有与表1的H链可变区中含有的CDR1、CDR2和CDR3氨基酸序列相同的CDR1、CDR2和CDR3氨基酸序列的CDR序列的抗体H链可变区,或与上述可变区功能等效的抗体H链可变区。
表1
包含在本发明的抗癌剂或药物组合物中的具有T细胞受体复合物结合活性的优选抗体可变区的实例包括具有T细胞受体结合活性的抗体可变区。在T细胞受体中,CD3是优选的,并且CD3ε是特别优选的。含在此种抗体可变区中的抗体H链可变区的实例包括表2中的抗体H链可变区,具有CDR1、CDR2和CDR3氨基酸序列与表2的抗体H链可变区中含有的CDR1、CDR2和CDR3氨基酸序列相同的CDR序列的抗体H链可变区,以及与上述可变区功能等效的抗体H链可变区。
表2
/>
构成抗体H链氨基酸序列的氨基酸残基的CDR区与Kabat编号之间的关系显示在图24(图24-1和24-2)中。
对于包含在本发明的抗癌剂或药物组合物中的具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有T细胞受体复合物结合活性的抗体可变区中含有的抗体L链可变区,优选的是获得可以给具有磷脂酰肌醇聚糖3结合活性的H链提供结合活性并且可以给具有T细胞受体复合物的H链提供结合活性的共有L链,并且将其用作多特异性抗原结合分子的共有L链可变区。
本发明中使用的共有L链可变区的实例包括表3的L链可变区,具有CDR1、CDR2和CDR3氨基酸序列与表3的抗体L链可变区中含有的CDR1、CDR2和CDR3氨基酸序列相同的CDR序列的抗体L链可变区,以及与上述可变区功能等效的抗体L链可变区。
表3
构成抗体L链氨基酸序列的氨基酸残基的CDR区与Kabat编号之间的关系显示在图25中。
在本发明中,短语“功能等效”表示对抗原的结合亲和力是等效的,或备选地,该短语表示当将其用作多特异性抗原结合分子时,针对表达磷脂酰肌醇聚糖3的细胞或含有这些细胞的组织是等效的。结合亲和力和细胞毒性活性可以基于本文中的描述测量。用于测量细胞毒性活性的细胞可以是所需的表达GPC3的细胞或所需的含有这些细胞的组织,并且例如,可以使用作为表达GPC3的人癌细胞系的PC-10或NCI-H446。关于抗体恒定区,该短语可以表示Fcγ受体结合活性的降低是等效的。
例如,与本文中描述的抗体H链可变区(即,原H链可变区)功能等效的抗体H链可变区表示当将其与同原H链成对的本文中描述的抗体L链可变区组合时该区域具有相同的结合亲和力,或备选地当被用于多特异性抗原结合分子时所述区域具有相同的对表达磷脂酰肌醇聚糖3的细胞或含有这些细胞的组织的细胞毒性活性。此外,与本文中所述的抗体L链可变区(即,原L链可变区)功能等效的抗体L链可变区表示当将其与同原L链成对的本文中描述的抗体H链可变区组合时该区域具有相同的结合亲和力,或备选地当被用于多特异性抗原结合分子时所述区域具有相同的对表达磷脂酰肌醇聚糖3的细胞或含有这些细胞的组织的细胞毒性活性。
术语“等效”不一定表示相同的活性程度,并且活性可以被增强。具体地,对于抗原结合亲和力,实例包括这样的情况,其中通过与充当对照的抗体可变区的结合亲和力(亲本KD值)比较获得的值(KD值/亲本KD值)为1.5以下。KD值/亲本KD值的值优选为1.3以下,更优选为1.2以下、1.1以下、1.0以下、0.9以下、0.8以下、0.7以下、0.6以下或0.5以下。虽然没有下限,但实例包括10
此外,对于细胞毒性活性,实例包括这样的情况,其中通过与50%细胞增殖抑制所需的原多特异性抗原结合分子的浓度(50%细胞增殖抑制所需的亲本浓度)比较获得的值(50%细胞增殖抑制所需的浓度/50%细胞增殖抑制所需的亲本浓度)为1.5或更低。50%生长抑制浓度是指与未添加多特异性抗原结合分子时相比细胞增殖速率降低至一半所需的多特异性抗原结合分子的浓度。“50%细胞增殖抑制所需的浓度/50%细胞增殖抑制所需的亲本浓度”的值优选为1.3以下,更优选为1.2以下、1.1以下、1.0以下、0.9以下、0.8以下、0.7以下、0.6以下或0.5以下。虽然没有下限,但所述值可以例如为10
关于包含具有GPC3结合活性的抗体可变区的结构域,对GPC3(例如,人GPC3)的KD值可以为,例如,5x 10
关于包含具有T细胞受体复合物结合活性的抗体可变区的结构域,对人T细胞受体复合物如人T细胞受体,或更具体地例如人CD3ε的KD值可以为,例如,2x 10
本发明的多特异性抗原结合分子具有的对人GPC3和人T细胞受体复合物(例如,人CD3ε链)的KD值优选分别为5x 10
在本发明中,“功能等效的”抗体可变区不受特别限制,只要其是满足上述条件的抗体H-链和/或抗体L链可变区即可。此种抗体可变区的实例包括通过将一个以上氨基酸(例如,1、2、3、4、5或10个氨基酸)的置换、缺失、添加和/或插入引入到上述表1至3的可变区的氨基酸序列中产生的区域。本领域技术人员熟知的用于将一个以上氨基酸置换、缺失、添加和/或插入引入到氨基酸序列中的方法是将突变引入蛋白质中的方法。例如,本领域技术人员可以通过使用方法如定点诱变(Hashimoto-Gotoh,T.,Mizuno,T.,Ogasahara,Y.,和Nakagawa,M.(1995)An oligodeoxyribonucleotide-directed dual amber method forsite-directed mutagenesis.Gene 152,271-275;Zoller,M.J.,和Smith,M.(1983)Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13vectors.Methods Enzymol.100,468-500;Kramer,W.,Drutsa,V.,Jansen,H.W.,Kramer,B.,Pflugfelder,M.,和Fritz,H.J.(1984)The gapped duplex DNA approach tooligonucleotide-directed mutation construction.Nucleic Acids Res.12,9441-9456;Kramer,W.,和Fritz,H.J.(1987)Oligonucleotide-directed construction ofmutations via gapped duplex DNA Methods.Enzymol.154,350-367;和Kunkel,T.A.(1985)Rapid and efficient site-specific mutagenesis without phenotypicselection.Proc Natl Acad.Sci.U S A.82,488-492)合适地将突变引入到氨基酸序列中制备与具有上述功能的抗体可变区功能等效的可变区。
当氨基酸残基被改变时,氨基酸优选被突变成保留如上所述的氨基酸侧链性质的不同的氨基酸。氨基酸侧链性质的实例有:疏水性氨基酸(A、I、L、M、F、P、W、Y和V)、亲水性氨基酸(R、D、N、C、E、Q、G、H、K、S和T)、含脂肪族侧链的氨基酸(G、A、V、L、I和P)、含有含羟基侧链的氨基酸(S、T和Y)、含有含硫原子侧链的氨基酸(C和M)、含有含羧酸和酰胺侧链的氨基酸(D、N、E和Q)、含碱性侧链的氨基酸(R、K和H)以及含芳香性侧链的氨基酸(H、F、Y和W)(括号中氨基酸由单字母编码表示)。这些组中的每个内的氨基酸置换被称为保守性置换。已知的是,含有修饰的氨基酸序列(其中给定氨基酸序列中的一个以上氨基酸残基被缺失、添加和/或置换成其他氨基酸)的多肽可以保持原生物学活性(Mark,D.F.等.,Proc.Natl.Acad.Sci.USA;(1984)81:5662-6;Zoller,M.J.和Smith,M.,Nucleic AcidsRes.(1982)10:6487-500;Wang,A.等.,Science(1984)224:1431-3;Dalbadie-McFarland,G.等.,Proc.Natl.Acad.Sci.USA(1982)79:6409-13)。含此种氨基酸修饰的本发明的可变区的氨基酸序列与修饰前的可变区的CDR序列、FR序列或整个可变区的氨基酸序列具有至少70%,更优选地至少75%,甚至更优选地至少80%,更优选地至少85%,更优选地至少90%,并且最优选地至少95%的同一性。本文中,序列同一性被定义为序列比对后确定的与原H链可变区或L链可变区的氨基酸序列中的残基相同的残基的百分比,并且当需要时适当地引入空隙以最大化序列同一性。氨基酸序列的同一性可以通过下述方法确定。
此外,“功能等效的抗体可变区”可以例如获得自在严格条件下与包含编码上述表1至3中的可变区的氨基酸序列的核苷酸序列的核酸杂交的核酸。用于分离在严格条件下与包含编码可变区的氨基酸序列的核苷酸序列的核酸杂交的核酸的严格杂交条件包括,例如,6M尿素,0.4% SDS,0.5x SSC和37℃的条件,或与其严格等效的杂交条件,如上所述。在更严格的条件(例如,6M尿素,0.4% SDS,0.1x SSC和42℃的条件)下,预期可以分离具有更高同源性的核酸。杂交后的洗涤条件为,例如,在60℃使用0.5x SSC(1x SSC是0.15M NaCl和0.015M柠檬酸钠pH7.0)和0.1% SDS的洗涤,更优选为在60℃使用0.2x SSC和0.1% SDS的洗涤,甚至更优选为在62℃使用0.2x SSC和0.1%SDS的洗涤,甚至更优选为在65℃使用0.2x SSC和0.1% SDS的洗涤,并且更优选为在65℃使用0.1x SSC和0.1% SDS的洗涤,如上所述。分离的核酸的序列可以通过下述的已知方法确定。分离的核酸的整体核苷酸序列同源性为至少50%以上,优选地70%以上,并且更优选为90%以上(例如,95%、96%、97%、98%、99%以上)序列同一性。
在严格条件下与包含编码可变区的氨基酸序列的核苷酸序列的核酸杂交的核酸也可以通过使用杂交技术、基因扩增方法如利用基于编码可变区氨基酸序列的核苷酸序列的信息合成的引物的聚合酶链反应(PCR)代替上述方法来分离。
一个核苷酸序列或氨基酸序列与另一个核苷酸序列或氨基酸序列的同一性可以使用如上所述的Karlin和Altschul(Proc.Natl.Acad.Sci.USA(1993)90:5873-7)的算法BLAST确定。基于该算法开发出了被称为BLASTN和BLASTX的程序(Altschul等,J.Mol.Biol.(1990)215:403-10)。为了根据基于BLAST的BLASTN分析核苷酸序列,将参数设定为,例如,得分=100和字词宽度=12。另一方面,用于通过基于BLAST的BLASTX分析氨基酸序列的参数包括,例如,得分=50和字词宽度=3。当使用BLAST和Gapped BLAST程序时使用各程序的缺省参数。用于此种分析的具体技术是本领域中已知的(参见National Center forBiotechnology Information(NCBI)的网站,Basic Local Alignment Search Tool(BLAST);http://www.ncbi.nlm.nih.gov)。
如包含在本发明的多特异性抗原结合分子(其包含在本发明的抗癌剂或药物组合物中)中的具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有T细胞受体复合物结合活性的抗体可变区的组合不受特别限制只要其具有上述活性即可。然而,在本发明中,多特异性抗原结合分子的细胞毒性活性优选为等于或大于参比例3中所述的双特异性抗体GPC3_ERY22_rCE115的细胞毒性活性。此处,术语“等效的”不一定表示与上述相同程度的活性,并且活性可以被增强。与GPC3_ERY22_rCE115等效是,例如,当相对于GPC3_ERY22_rCE115的细胞增殖抑制率(细胞增殖抑制率(GPC3_ERY22_rCE115))的值(细胞增殖抑制率/细胞增殖抑制率(GPC3_ERY22_rCE115))为0.7以上,优选地0.8以上、0.9以上、1.0以上、1.2以上、1.5以上、2以上、3以上、5以上、10以上或20以上。虽然没有上限,所述值可以为,例如,10、10
此外,实例包括以下的情况,其中通过与GPC3_ERY22_rCE115细胞的50%生长抑制浓度(50%细胞增殖抑制浓度(GPC3_ERY22_rCE115))比较获得的值(50%细胞增殖抑制浓度/50%细胞增殖抑制浓度(GPC3_ERY22_rCE115))为1.5以下。“50%细胞增殖抑制浓度/50%细胞增殖抑制浓度(GPC3_ERY22_rCE115)”的值优选为1.3以下,更优选为1.2以下、1.1以下、1.0以下、0.9以下、0.8以下、0.7以下、0.6以下或0.5以下。虽然没有下限,但所述值可以为例如,10
对于人GPC3和人T细胞受体复合物(例如,人CD3ε链),优选的具体KD值也是如上所述的。显示GPC3表达的理想细胞或包含这些细胞的理想组织可以用于所述细胞,并且例如,可以使用作为表达GPC3的人癌细胞系的PC-10或NCI-H446。
具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有T细胞受体复合物结合活性的抗体可变区的此种组合的实例包括表4中所示的抗体H链可变区的组合,CDR序列的CDR1、CDR2和CDR3氨基酸序列与表4的抗体H链可变区所带有的CDR1、CDR2和CDR3氨基酸序列相同的抗体H链可变区的组合,以及与这些可变区功能等效的抗体H链可变区的组合。此处,“功能等效”具有与上述相同的含义。
表4
用于具有磷脂酰肌醇聚糖3结合活性的抗体可变区和具有T细胞受体复合物结合活性的抗体可变区的此种组合的优选的共有L链包括,例如,L0000、L0011、L0201、L0203、L0204、L0206、L0208、L0209、L02l1、L0212、L0222,以及具有的CDR序列(CDR1、CDR2和CDR3氨基酸序列)与以上共有L链中的CDR1、CDR2和CDR3氨基酸序列相同的共有L链。具体组合包括,例如,表5中所示的抗体H链可变区和共有L链的组合,具有的CDR序列(CDR1、CDR2和CDR3氨基酸序列)与表5的抗体可变区和共有L链所带有的CDR1、CDR2和CDR3的氨基酸序列相同的抗体可变区的组合,以及与这些可变区功能等效的抗体H链可变区和共有L链的组合。此处,“功能等效”具有与上述相同的含义。
表5
包含在多特异性抗原结合分子(其包含在本发明的抗癌剂或药物组合物中)中的Fc区不受特别限制,只要其是具有减弱的Fc γ受体结合活性的Fc区即可,但是本发明的Fc区的优选实例包括E22Hh的Fc区部分和E22Hk的Fc区部分的组合,E2702GsKsc的Fc区部分和E2704sEpsc的Fc区部分的组合,以及E2702sKsc的Fc区部分和E2704sEpsc的Fc区部分的组合。
包含在本发明的抗癌剂或药物组合物中的多特异性抗原结合分子的优选实例包括包含磷脂酰肌醇聚糖3结合活性的抗体可变区和具有CD3ε结合活性的抗体可变区的双特异性抗体。更优选地,细胞毒性活性等于或大于GPC3_ERY22_rCE115双特异性抗体的细胞毒性活性。此种双特异性抗体的实例包括包含表17中所述的H和L链的双特异性抗体,以及结合与以上抗体所结合的表位重叠的表位并且含有具有减小的Fc γ受体结合活性的Fc区的双特异性抗体。
抗体是否识别与另一个抗体所识别的表位重叠的表位可以通过两个针对所述表位的抗体之间的竞争来确认。抗体之间的竞争可以通过竞争性结合测定使用手段如酶联免疫吸附测定(ELISA)、荧光能量转移法(FRET)和荧光计微体积测定技术(FMAT(注册商标))来评估。与抗原结合的抗体的量与竞争性结合重叠的表位的候选竞争性抗体(测试抗体)的结合能力间接相关。换言之,当测试抗体的量或针对重叠的表位的亲和力增加时,与抗原结合的抗体的量减少,并且与抗原结合的测试抗体的量增加。具体地,将适当标记的抗体和待评估的抗体同时添加至抗原,并且使用所述标记检测因此结合的抗体。与抗原结合的抗体的量可以容易地通过预先标记抗体来确定。该标记不受特别限制,并且可以根据使用的测定技术来选择标记方法。具体地,标记方法包括荧光标记、放射性标记、酶标记等。
例如,荧光标记的抗体和未标记的抗体或测试抗体被同时添加至固定有GPC3或CD3ε的小珠,并且通过荧光计微体积测定技术来检测标记的抗体。
本文中,“结合重叠的表位的抗体”是指在使结合的标记的抗体的量减少50%的未标记的抗体的浓度(IC
具有结合与上述抗体所结合的表位重叠的表位的抗体的抗原结合位点的多特异性抗原结合分子可以产生优异的细胞毒性活性。
本发明的多特异性抗原结合分子通过与上述用于制备重组抗体的技术相同的技术制备。
组合疗法和药物组合物
在本发明的非限制性实施方案中,本发明的组合疗法提供破坏细胞,阻遏细胞增殖,激活对癌细胞或包含癌细胞的肿瘤组织的免疫力,治疗癌症或预防癌症的方法,每种方法包括施用有效量的上述双特异性抗体和另外的抗癌剂。在若干实施方案中,与使用上述双特异性抗体或其他抗癌剂的单一疗法相比,本发明的组合疗法高度有效地破坏细胞,阻遏细胞增殖,激活对癌细胞或包含癌细胞的肿瘤组织的免疫力,治疗癌症或预防癌症。在另一个实施方案中,本发明的组合疗法对破坏细胞,阻遏细胞增殖,激活对癌细胞或包含癌细胞的肿瘤组织的免疫力,治疗癌症或预防癌症具有协同效果或累加效果。
在若干实施方案中,本发明中的术语“有效量”是指上述双特异性抗体和/或另外的抗癌剂的剂量,其有效治疗或预防个体的疾病。该疾病没有特别限制,但优选为癌症。
在若干实施方案中,本发明中的“治疗/进行治疗/治疗的”是指本发明的组合疗法减少个体中癌细胞的数量,阻遏癌细胞增殖,减小肿瘤大小,阻遏癌细胞向外周器官的浸润,阻遏癌细胞转移,或改善由癌症引起的各种症状。此外,在一些实施方案中,本发明中的“预防/进行预防/预防的”是指由于已经降低癌细胞的群体恢复而抑制癌细胞数量的增加,抑制已经阻遏增殖的癌细胞的群体恢复,以及抑制尺寸减小的肿瘤再次变大。
在若干实施方案中,本发明的组合疗法提供了通过使用上述双特异性抗体在用其他抗癌剂的癌症治疗或预防中增强其他抗癌剂的治疗或预防效果的方法。在另一个实施方案中,本发明的组合疗法提供了通过使用其他抗癌剂在用双特异性抗体的癌症治疗或预防中增强上述双特异性抗体的治疗或预防效果的方法。在此,增强治疗或预防效果是指,例如,治疗的有效率增加,用于治疗的抗癌剂的施用量减少,和/或用抗癌剂治疗期时间缩短,但不限于此。在另一个实施方案中,本发明的组合疗法提供了延长个体无进展存活的方法,所述方法包括施用有效量的上述双特异性抗体和另外的抗癌剂。
在若干实施方案中,本发明的组合疗法包括施用上述双特异性抗体和另外的抗癌剂。双特异性抗体和其他抗癌剂可以通过本领域已知的任何适当方法施用。例如,双特异性抗体和其他抗癌剂可以平行(即同时)或相继(即在不同的时间点)施用。在若干实施方案中,当相继施用双特异性抗体和其他抗癌剂时(即,在不同的时间点),双特异性抗体和其他抗癌剂的施用之间的间隔不受特别限制,并且可以通过考虑例如施用途径和剂型等因素确定所述间隔。间隔例如为0至168小时,优选0至72小时,更优选0至24小时,甚至更优选0至12小时,但不限于此。
在若干实施方案中,同时施用上述双特异性抗体和其他抗癌剂。在若干实施方案中,间隔(即间歇地)施用双特异性抗体。在若干实施方案中,双特异性抗体在施用其他抗癌剂之前施用。在若干实施方案中,双特异性抗体在施用其他抗癌剂之后施用。
在若干实施方案中,间隔(即间歇地)施用其他抗癌剂。在若干实施方案中,其他抗癌剂在施用双特异性抗体之前施用。在若干实施方案中,其他抗癌剂在施用双特异性抗体后施用。
在若干实施方案中,本文所述的双特异性抗体和已知或本文描述的抗癌剂可以在使用双特异性抗体和其他抗癌剂的上述组合疗法中使用。
在若干实施方案中,除了使用上述双特异性抗体和另外的抗癌剂的组合疗法之外,还可以进行另外的疗法。在若干实施方案中,添加至本发明的组合疗法的疗法可包括另外施用双特异性抗体和/或其他抗癌剂。
本发明的非限制性实施方案提供用于诱导细胞毒性的试剂,用于阻遏细胞增殖的试剂(用于抑制细胞增殖的试剂),用于激活对癌细胞或包含癌细胞的肿瘤组织的免疫应答的试剂,用于治疗癌症的试剂,和用于预防癌症的试剂(下文中,称为药物组合物等),其各自包含上述双特异性抗体,另外的抗癌剂,或双特异性抗体和其他抗癌剂的组合。在若干实施方案中,本发明的药物组合物等可用于本发明的组合疗法。在若干实施方案中,与使用双特异性抗体或其他抗癌剂的单一疗法相比,本发明的药物组合物等由于上述双特异性抗体和其他抗癌剂的组合使用对于破坏细胞,阻遏细胞增殖,激活对癌细胞或包含癌细胞的肿瘤组织的免疫力,治疗癌症或预防癌症非常有效。在另一个实施方案中,本发明的药物组合物由于上述双特异性抗体和其他抗癌剂的组合使用对破坏细胞,阻遏细胞增殖,激活对癌细胞或包含癌细胞的肿瘤组织的免疫力,治疗癌症或预防癌症具有协同作用或累加效应。
在若干实施方案中,“包含双特异性抗体和另外的抗癌剂的组合”的根据本发明的药物组合物等是指以下药物组合物等,其中上述双特异性抗体和其他抗癌剂组合用于在治疗或预防疾病中同时、分开或依次施用。例如,本发明的药物组合物等可以以含有双特异性抗体和另外的抗癌剂的组合制剂的形式提供。备选地,例如,作为本发明的药物组合物等,可以单独提供含有双特异性抗体的药剂和含有另外的抗癌剂的药剂,并且这些药剂可以同时或依次使用。疾病没有特别限制,但优选为癌症。
在若干实施方案中,本发明提供药物组合物等,其与另外的抗癌剂组合使用,所述组合物包含上述双特异性抗体作为活性成分。
在若干实施方案中,本发明提供药物组合物等,其与上述双特异性抗体组合使用,所述组合物包含另外的抗癌剂作为活性成分。
在若干实施方案中,本发明提供药物组合物等,其用于通过使用上述双特异性抗体与所述另外的抗癌剂组合,来增强所述另外的抗癌剂在用其治疗癌症中的治疗效果。
在若干实施方案中,本发明提供药物组合物等,其通过使用另外的抗癌剂与双特异性抗体组合,来增强上述双特异性抗体在用其治疗癌症中的治疗效果。
在若干实施方案中,本发明提供上述双特异性抗体和/或另外的抗癌剂在制备药物组合物等中的用途,所述药物组合物等包含双特异性抗体和/或另外的抗癌剂作为活性成分。
在本发明中,“包含上述双特异性抗体和/或另外的抗癌剂作为活性成分”是指“含有双特异性抗体和/或其他(另外的)抗癌剂作为主要活性成分”,并且不限制双特异性抗体和/或其他抗癌剂的含量。
在若干实施方案中,本文所述的双特异性抗体和本文已知或描述的其他抗癌剂可用于上述药物组合物等。
在本发明的非限制性实施方案中,上述其他抗癌剂包括但不限于氮芥类似物,烷基磺酸酯,亚乙基亚胺,亚硝基脲,环氧化物,其他烷基化剂,叶酸类似物,嘌呤类似物,嘧啶类似物,其他抗代谢物,长春花生物碱或类似物,鬼臼毒素衍生物,喜树碱类似物,秋水仙碱衍生物,紫杉烷类,其他植物生物碱或天然物质,放线菌素,蒽环类或相关物质,其它细胞毒性抗生素,铂化合物,甲基肼,激酶抑制剂,血管生成抑制剂,激素制剂,DNA修饰酶抑制剂,免疫刺激剂,蛋白酶体抑制剂,酶,组蛋白去乙酰化酶抑制剂,DNA修饰酶抑制剂,细胞因子制剂,维甲酸类,免疫检查点抑制剂,吲哚胺2,3-双加氧酶(IDO)抑制剂,共刺激性分子激活剂,自然杀伤细胞激活剂,单克隆抗体,其他分子靶向试剂和其他抗癌试剂。在非限制性实施方案中,本发明中的其他抗癌剂包括但不限于例如WO2015/174439和WO2015/156268中描述的抗体。
在若干实施方案中,本发明的“免疫检查点”是指在免疫活性细胞(包括T细胞)上表达并与配体结合从而转换成抑制免疫应答的免疫活性细胞信号的分子。免疫检查点及其配体的实例包括但不限于分子,如PD-1、CTLA-4、TIM3、LAG3、PD-L1、PD-L2、BTNL2、B7-H3、B7-H4、CD48、CD80、2B4、BTLA、CD160、CD60、CD86、和VISTA。在若干实施方案中,本发明的“免疫检查点抑制剂”是指抑制免疫检查点与其配体之间结合从而抑制免疫检查点介导的信号转导的药剂。
本发明的非限制性实施方案提供药物组合物等,其中其他抗癌剂是化疗剂,T细胞活化激动剂,免疫检查点抑制剂或血管生成抑制剂。
在本发明的非限制性实施方案中,化疗剂包括但不限于抗代谢物,植物生物碱和铂化合物。抗代谢物的优选实例包括但不限于依诺他滨,卡培他滨,卡莫氟,吉西他滨,阿糖胞苷,替加氟,替加氟尿嘧啶,奈拉滨,氟尿嘧啶,氟达拉滨,培美曲塞,喷司他丁和甲氨蝶呤。特别优选的抗代谢物包括例如卡培他滨。植物生物碱的优选实例包括但不限于伊立替康,依托泊苷,索布佐生(sobuzoxane),多西他赛,nogitecan,紫杉醇,长春瑞滨,长春新碱,长春地辛和长春碱。特别优选的植物生物碱包括例如紫杉醇。铂化合物的优选实例包括但不限于奥沙利铂,卡铂,顺铂和奈达铂。特别优选的铂化合物包括例如顺铂。
在本发明的非限制性实施方案中,T细胞活化激动剂包括但不限于TNF受体超家族(TNFRSF)激动剂抗体和针对的共刺激分子激动剂抗体。“TNF受体超家族激动剂抗体”的靶分子没有特别限制,只要它们是激活表达TNF受体超家族的细胞(例如,T细胞和NK细胞)的因子,但优选属于“TNF超家族”或“TNF受体超家族”的因子。属于“TNF超家族”或“TNF受体超家族”的已知因子包括具有三聚体结构的配体和具有配体结合的三聚体结构的受体,其有助于各种免疫细胞的活化(Nat.Rev.Immunol.,2012,12,339-51)。属于TNF超家族或TNF受体超家族的因子的实例包括CD137,CD137L,CD40,CD40L,OX40,OX40L,CD27,CD70,HVEM,LIGHT,RANK,RANKL,CD30,CD153,GITR,GITRL,TNFRSF25和TL1A。优选的因子包括例如CD137。CD137激动剂抗体的实例包括Urelumab(CAS No.934823-49-1),PF-05082566和各种已知的CD137激动剂抗体。
属于共刺激分子的因子包括TMIGD2,HHLA2,ICOS,ICOS配体,CD28,CD80,CD86等。OX40激动剂抗体的实例包括MOXR0916,MEDI6469,MEDI0562,MEDI6383,PF-04518600,GSK-3174998和各种已知的OX40激动剂抗体。CD40激动剂抗体的实例包括RG-7876,ADC-1013,SEA-CD40,APX005M,达西珠单抗(Dacetuzumab)和各种已知的CD40激动剂抗体。GITR激动剂抗体的实例包括AMG228,AMK-1248,MK-4166,BMS-986156,TRX518和各种已知的GITR激动剂抗体。CD27激动剂抗体的实例包括Varlilumab(CAS No.1393344-72-3)和各种已知的CD27激动剂抗体。
在本发明的非限制性实施方案中,免疫检查点抑制剂的优选实例包括但不限于PD1抗体,PDL1抗体,CTLA-4抗体,TIM3抗体和LAG3抗体。PD-1抗体的实例包括派姆单抗(Pembrolizumab)(CAS No.1374853-91-4),纳武单抗(Nivolumab)(CAS No.946414-94-4),MEDI0680,PDR001,BGB-A317,REGN2810,SHR-1210,PF-06801591,和各种已知的PD1抗体。PD-L1抗体的实例包括阿特朱单抗(Atezolizumab)(CAS No.1380723-44-3),Avelumab(CASNo.1537032-82-8),Durvalumab(CAS No.1428935-60-7),MDX-1105和各种已知的PD-L1抗体。CTLA-4抗体的实例包括伊匹单抗(Ipilimumab)(CAS No.477202-00-9),Tremelimumab(CAS No.745013-59-6)和各种已知的CTLA-4抗体。TIM3抗体的实例包括MBG452和各种已知的TIM3抗体。LAG3抗体的实例包括BMS-986016,LAG525和各种已知的LAG3抗体。
在本发明的非限制性实施方案中,血管生成抑制剂的优选实例包括但不限于VEGFR2抗体。血管生成抑制剂的实例包括贝伐珠单抗(Bevacizumab),索拉非尼(Sorafenib),依维莫司(Everolimus),替西罗莫司(Temsirolimus)和各种已知的血管生成抑制剂。
在若干实施方案中,本发明的其他抗癌剂没有特别限制,可以使用任何抗癌剂,只要当与本发明的双特异性抗体组合使用时,其他抗癌剂的治疗效果或预防效果得到增强或双特异性抗体的治疗效果或预防效果得到增强。
在本发明的非限制性实施方案中,本发明的组合疗法可包含上述双特异性抗体和至少一种其他治疗剂,免疫调节剂,治疗性癌症疫苗,过继性T细胞疗法,Treg耗竭,等等,但疗法不限于此。优选的治疗性癌症疫苗包括但不限于全肿瘤细胞疫苗,肿瘤抗原疫苗,基于载体的疫苗,溶瘤病毒疫苗和树突细胞疫苗。除了上述疗法之外,可以使用外科手术,放射治疗或其组合进行多模式疗法。
在本发明的非限制性实施方案中,可以使用上述双特异性抗体与细胞因子疗法(使用细胞因子作为抗肿瘤免疫应答增强剂)组合来进行本发明的组合疗法。在这种治疗中,细胞因子包括但不限于IL-2,IL-7,IL-12,IL-15,IL-17,IL-18,IL-21,IL-23,IL-27,GM-CSF,干扰素-α(IFNα),IFNα-2b,IFNβ和IFNγ。
本发明的非限制性实施方案提供用于诱导细胞毒性的试剂,用于阻遏细胞增殖的试剂,用于抑制细胞增殖的试剂,用于激活免疫应答的试剂,用于治疗癌症的试剂和用于预防癌症的试剂,每种试剂包含上述药物组合物。
在若干实施方案中,施用上述双特异性抗体和/或另外的抗癌剂的“个体”是指人或非人动物,例如哺乳动物,例如牛,马,狗,羊,或猫。个体优选是人。个体包括患者(包括人和非人哺乳动物)。在若干实施方案中,个体是具有癌细胞或包含癌细胞的肿瘤组织的患者。成为本发明的抗癌剂或组合疗法的靶标的癌细胞或包含癌细胞的肿瘤组织没有特别限制,只要它们表达磷脂酰肌醇聚糖3即可。在本发明中,优选的表达磷脂酰肌醇聚糖3的细胞,即磷脂酰肌醇聚糖3阳性细胞,是癌细胞。更优选的癌症类型包括但不限于例如胃癌,头颈癌(H&N),食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌,子宫癌,胆管癌,梅克尔细胞癌,膀胱癌,甲状腺癌,神经鞘瘤,肾上腺癌(肾上腺),肛门癌,中枢神经系统肿瘤,神经内分泌组织瘤,阴茎癌,胸膜肿瘤,唾液腺肿瘤,外阴癌,胸腺瘤和儿童期癌症(肾母细胞瘤(Wilms tumor),神经母细胞瘤,肉瘤,肝母细胞瘤和生殖细胞肿瘤)。更优选的癌症类型包括但不限于胃癌,头颈癌(H&N),食道癌,肺癌,肝癌,卵巢癌,乳腺癌,结肠癌,肾癌,皮肤癌,肌肉肿瘤,胰腺癌,前列腺癌,睾丸癌和子宫癌(Tumori.(2012)98,478-484;Tumor Biol.(2015)36,4671-4679;Am J Clin Pathol(2008)130,224-230;Adv Anat Pathol(2014)21,450-460;Med Oncol(2012)29,663-669;Clinical Cancer Research(2004)10,6612-6621;Appl Immunohistochem Mol Morphol(2009)17,40-46;Eur J Pediatr Surg(2015)25,138-144;J Clin Pathol(2011)64,587-591;Am J Surg Pathol(2006)30,1570-1575;Oncology(2007)73,389-394;DiagnosticPathology(2010)64,1-6;Diagnostic Pathology(2015)34,1-6;Am J Clin Pathol(2008)129,899-906;Virchows Arch(2015)466,67-76)。
在若干实施方案中,患者是在使用双特异性抗体和另外的抗癌剂的组合疗法之前已经接受上述双特异性抗体和/或某种抗癌剂治疗的患者。在若干实施方案中,患者是那些不能接受标准疗法或标准疗法无效的患者。在若干实施方案中,患者患有的癌症是早期或终末期。
如本文所用,“癌症”不仅指上皮恶性肿瘤例如卵巢癌或胃癌,还指非上皮恶性肿瘤,包括造血肿瘤,例如慢性淋巴细胞白血病或霍奇金淋巴瘤。在本文中,术语“癌症”,“癌”,“肿瘤”,“瘤”等彼此不区分并且可相互互换。
同时,在若干实施方案中,成为本发明的抗癌剂或药物组合物(组合疗法)的靶标的癌症类型优选为其中细胞表面上的磷脂酰肌醇聚糖-3抗原的数量/细胞为100或更多的那些,更优选细胞表面上的磷脂酰肌醇聚糖-3抗原数量/细胞是200或更多,300或更多,400或更多,500或更多,600或更多,700或更多,800或更多,900或更多,1000或更多,1200或更多,1400或更多,1600或更多,1800或更多,或2000或更多的那些,并且还更优选其中细胞表面上的磷脂酰肌醇聚糖-3抗原数量/细胞是3000或更多,4000或更多,5000或更多,6000或更多,7000或更多,8000或更多,9000或更多,10000或更多,20000或更多,30000或更多,40000或更多,或50000或更多的那些。
细胞表面上的磷脂酰肌醇聚糖-3抗原数量/细胞可以使用本文所述的方法或本领域技术人员已知的方法适当地确定,例如,通过使用QIFIKIT(DAKO)的流式细胞术计算细胞表面上GPC3的抗体结合能力(ABC)。可以确定从靶候选物中分离的组织样品中的细胞表面上的磷脂酰肌醇聚糖-3抗原数量/细胞,以便评估候选物是否可以是施用本发明抗癌剂或药物组合物(组合疗法)的靶标。当在样品中细胞表面上的磷脂酰肌醇聚糖-3抗原数量/细胞符合上述标准时,样品所来源于的靶标可以是施用本发明的抗癌剂或药物组合物(组合疗法)的靶标。
在本发明的一个非限制性实施方案中,本发明的抗癌剂可用于治疗患有利用免疫检查点抑制剂的治疗难治的癌症的患者。例如,可以用本发明的抗癌剂治疗患有磷脂酰肌醇聚糖3阳性癌症的患者,其中免疫检查点抑制剂的施用未能达到所需的药物效力。换句话说,已经用免疫检查点抑制剂治疗的磷脂酰肌醇聚糖3阳性癌症可以用本发明的抗癌剂治疗。
在本发明的非限制性实施方案中,本发明的药物组合物(组合疗法)可用于治疗患有利用免疫检查点抑制剂的治疗难治的癌症的患者。例如,可以用本发明的药物组合物(组合疗法)治疗患有GPC阳性癌症的患者,其中免疫检查点抑制剂的施用未能达到所需的药物效力。换句话说,已经用免疫检查点抑制剂治疗的磷脂酰肌醇聚糖3阳性癌症可以用本发明的药物组合物(组合疗法)治疗。包含在药物组合物中的另外的抗癌剂的优选实例包括免疫检查点抑制剂,但不限于此。
在本发明的非限制性实施方案中,本发明的药物组合物(组合疗法)可用于治疗患有利用本发明的抗癌剂的治疗难治的癌症的患者。例如,患有GPC阳性癌症的患者(其在施用本发明的抗癌剂后对所述抗癌剂变得具有抗性或者在其中施用本发明的抗癌剂未能达到所需的药物效力)可以用本发明的药物组合物(组合疗法)治疗。换句话说,已经用本发明的抗癌剂治疗的磷脂酰肌醇聚糖3阳性癌症可以用本发明的药物组合物(组合疗法)治疗。包含在药物组合物中的另外的抗癌剂的优选实例包括免疫检查点抑制剂,但不限于此。
关于磷脂酰肌醇聚糖3阳性癌症(经证实表达磷脂酰肌醇聚糖3的癌症),本领域技术人员可以使用本领域技术人员已知的方法如免疫组织化学染色或流式细胞术适当检查磷脂酰肌醇聚糖3的阳性。
从另一个角度,本发明提供包含多特异性抗原结合分子作为活性成分的抗癌剂,所述多特异性抗原结合分子包含:(1)包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域,(2)包含具有T细胞受体复合物结合活性的抗体可变区的结构域,和(3)包含具有减小的对Fcγ受体的结合活性的Fc区的结构域。
在本发明中,“包含多特异性抗原结合分子作为活性成分,所述多特异性抗原结合分子包含(1)包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域,(2)包含具有T细胞受体复合物结合活性的抗体可变区的结构域,和(3)包含具有减小的对Fcγ受体的结合活性的Fc区的结构域”表示包含所述抗原结合分子作为主要活性组分,其中对所述抗原结合分子的含量比没有限制。
如果需要,本发明的多特异性抗原结合分子可以被包封在微胶囊(例如,由羟甲基纤维素、明胶和聚(甲基丙烯酸甲酯)制成的微胶囊)中,或被结合成胶状药物递送系统(例如,脂质体、清蛋白微球、微乳液、纳米颗粒和纳米胶囊)的组分(参见,例如,“Remington’sPharmaceutical Science第16版”,Oslo Ed.(1980))。用于将药剂制成受控释放药剂的方法也是已知的,并且此种方法可以应用于本发明的多特异性抗原结合分子(J.Biomed.Mater.Res.(1981)15:267-277;Chemtech.(1982)12:98-105;美国专利号3,773,719;欧洲专利申请公布号EP 58,481和EP 133,988;Biopolymers(1983)22:547-556)。
本发明的药物组合物或抗癌剂可以通过口服或肠胃外施用而施用给患者,并且优选肠胃外施用。施用方法的具体实例包括注射施用、经鼻施用、经肺施用和经皮施用。注射施用的实例包括静脉内注射、肌肉内注射、腹膜内注射和皮下注射。本发明的药物组合物或抗癌剂可以全身或局部施用,例如通过注射施用。可以根据患者的年龄和症状适当地选择施用方法。对于单次施用,可以自0.0001mg至1000mg/公斤体重的范围选择剂量。备选地,例如,所述剂量可以选自0.001mg/身体至100000mg/身体/患者的范围。剂量可以定义为例如包含在药物组合物中作为活性成分的本发明的多特异性抗原结合分子的量。然而,本发明的药物组合物或抗癌剂不限于这些剂量。
本发明的药物组合物或抗癌剂可以根据常规方法配制(例如,Remington’sPharmaceutical Science,最新版,Mark Publishing Company,Easton,U.S.A),并且还可以含有药用载体和添加剂。实例包括,但不限于表面活性剂、赋形剂、着色剂、香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等张剂、粘合剂、崩解剂、润滑剂、流动促进剂和调味剂;并且可以合适地使用其他常用的载体。载体的具体实例包括轻质无水硅酸、乳糖、晶体纤维素、甘露醇、淀粉、羧甲纤维素钙、羧甲纤维素钠、羟丙基纤维素、羟丙甲纤维素、聚乙烯缩醛二乙基氨基乙酸酯、聚乙烯吡咯烷酮、明胶、中链脂肪酸三甘油酯、聚氧乙烯硬化蓖麻油60、蔗糖、羧甲基纤维素、玉米淀粉、无机盐等。
本发明的非限制性实施方案还提供用于损害表达磷脂酰肌醇聚糖3抗原的细胞或含表达所述抗原的细胞的肿瘤组织的方法,或用于抑制这些细胞或肿瘤组织生长的方法,所述方法是通过将表达磷脂酰肌醇聚糖3抗原的细胞与结合所述抗原的本发明的多特异性抗原结合分子和另外的抗癌剂接触。结合所述抗原的多特异性抗原结合分子是如以上对于包含在本发明的抗癌剂中的结合所述抗原的本发明的抗原结合分子所述的。结合所述抗原的本发明的多特异性抗原结合分子所结合的细胞不受特别限制,只要其是表达所述抗原的细胞即可。
在本发明中,例如通过将结合所述抗原的本发明的多特异性抗原结合分子和另外的抗癌剂添加至体外培养的表达GPC3抗原的细胞的培养基中来进行“接触”。在此情况中,通过冻干等获得的液体或固体可以被合适地用作添加的抗原结合分子和/或另外的抗癌剂的形式。当作为水溶液添加时,其可以是简单地仅含有本发明的多特异性抗原结合分子的水溶液,或其可以是还含有,例如,上述表面活性剂、赋形剂、着色剂、香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等张剂、粘合剂、崩解剂、润滑剂、流动促进剂和调味剂的溶液。进行添加的浓度不受特别限制,但是培养溶液中合适的终浓度优选为1pg/ml至1g/ml,更优选为1ng/ml至1mg/ml,并且甚至更优选为1μg/mL至1mg/mL。
此外,在另一个实施方案中,本发明的“接触”还通过将本发明的抗原结合分子和另外的抗癌剂施用于体内移植有表达GPC3抗原的细胞的非人动物,以及带有固有表达所述抗原的细胞的动物来进行。施用方法可以是口服或肠胃外的,并且肠胃外施用是特别优选的。施用方法的具体实例包括注射施用、经鼻施用、经肺施用和经皮施用。注射施用的实例包括静脉内注射、肌肉内注射、腹膜内注射和皮下注射。本发明的药物组合物或抗癌剂可以全身或局部施用,例如通过注射施用。可以根据测试动物的年龄和症状适当地选择施用方法。当作为水溶液施用时,可以使用仅简单地含有本发明的多特异性抗原结合分子的水溶液,或可以使用还含有上述表面活性剂、赋形剂、着色剂、香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等张剂、粘合剂、崩解剂、润滑剂、流动促进剂和调味剂等的溶液。对于单次施用,可以自0.0001mg至1000mg/公斤体重的范围选择剂量。备选地,例如,所述剂量可以选自0.001mg/身体至100000mg/身体/患者的范围。剂量可以定义为例如包含在药物组合物中作为活性成分的本发明的多特异性抗原结合分子的量。然而,施用的本发明的多特异性抗原结合分子的量不限于这些剂量。
以下方法被合适地用作用于评估或测量作为将表达磷脂酰肌醇聚糖3抗原(其被构成抗原结合分子的包含具有磷脂酰肌醇聚糖3结合活性的抗体可变区的结构域所结合)的细胞与本发明的多特异性抗原结合分子或另外的抗癌剂接触的结果的所述细胞中引起的细胞毒性的方法。用于体外评估或测量细胞毒性活性的方法的实例包括用于测量细胞毒性T细胞活性的方法等。本发明的多特异性抗原结合分子是否具有T细胞细胞毒性可以通过已知方法(例如,Current protocols in Immunology,第7章.Immunologic studies inhumans,编辑,John E.Coligan等,John Wiley&Sons,Inc.,(1993)等)测量。对于活性测量,结合不同于磷脂酰肌醇聚糖3的抗原(其是在用于检查的细胞中不表达的抗原)的抗原结合分子可以与本发明的多特异性抗原结合分子相同的方式用作对照,并且当与在将所述抗原结合分子用作对照时相比,本发明的多特异性抗原结合分子显示更强的细胞毒性活性时,可以确定存在活性。
为了体内评估或测量细胞毒性活性,例如,将表达磷脂酰肌醇聚糖3抗原的细胞经皮内或皮下移植到非人测试动物中,然后自移植之日或第二天起每日或以数日为间隔静脉内或腹膜内施用测试抗原结合分子和/或另外的抗癌剂。可以通过测量肿瘤大小和观察肿瘤大小变化的差异确定细胞毒性活性。以与体外评估类似的方式,当施用对照抗原结合分子显示进行本发明的抗原结合分子施用的组中的肿瘤大小显著小于进行对照抗原结合分子施用的组中的肿瘤大小时,可以确定存在本发明的抗原结合分子的细胞毒性活性。
作为用于评估或测量对表达磷脂酰肌醇聚糖3抗原的细胞的增殖的抑制效果的方法,可以合适地使用测量同位素标记的胸苷到细胞中的吸收的方法或MTT法。作为用于体内评估或测量细胞增殖抑制活性的方法,可以合适地使用上述用于体内评估或测量细胞毒性活性的相同方法。
试剂盒
在若干实施方案中,本发明提供了试剂盒,其包括:
(1)上述双特异性抗体;
(2)容器;和
(3)指示双特异性抗体和至少一种类型的抗癌剂组合施用给测试受试者以治疗个体癌症的说明书或标签。在另一个实施方案中,本发明提供了试剂盒,其包括:
(1)另外的抗癌剂;
(2)容器;和
(3)指示所述另外的抗癌剂和至少一种类型的上述双特异性抗体组合施用给个体以治疗所述个体癌症的说明书或标签。
在另一个实施方案中,本发明提供了试剂盒,其包括:
(1)上述双特异性抗体;
(2)另外的抗癌剂;
(3)容器;和
(4)指示所述双特异性抗体和其他抗癌剂组合施用给个体以治疗所述个体癌症的说明书或标签。
在若干实施方案中,试剂盒还包含药用载体。试剂盒可进一步包含无菌稀释剂,其优选储存在单独的另外的容器中。试剂盒还可以包括涉及用于治疗或预防癌症的组合疗法的说明书。
在若干实施方案中,“说明书”是指通常包含在携带药物的市售盒子中的书面说明,并且可包括关于药物使用的适应症,用法,剂量,施用,禁忌症和/或警告的信息。
试剂盒可以是专门用于组合使用本发明的双特异性抗体和另外的抗癌剂的试剂盒。备选地,试剂盒可以是用于其他目的的试剂盒,只要它们用于组合使用本发明的双特异性抗体和另外的抗癌剂的目的。例如,只要本发明的试剂盒的说明书或标签指示双特异性抗体和其他抗癌剂组合施用给个体,所述说明书或标签可指示其他实施方案,例如,其中单独使用双特异性抗体或其他抗癌剂。
本发明还涉及具有GPC3结合活性的分子,所述分子含有结构域,所述结构域包含本发明的抗癌剂或药物组合物中所包含的多特异性抗原结合分子的具有GPC3结合活性的抗体可变区。此外,本发明涉及具有GPC3结合活性的分子,所述分子包含含在所述分子中的分别包含H和L链的三个CDR(总共六个CDR)的H和L链的抗体可变区。本发明还涉及具有T细胞受体复合物结合活性的分子,所述分子含有结构域,所述结构域包含本发明的抗癌剂或药物组合物中所包含的多特异性抗原结合分子的具有T细胞受体复合物结合活性的抗体可变区。此外,本发明涉及具有T细胞受体复合物结合活性的分子,所述分子包含含在所述分子中的分别包含H和L链的三个CDR(总共六个CDR)的H和L链的抗体可变区。此种分子可以是抗体或包含抗体的抗原结合片段的多肽。本发明还涉及抗体,所述抗体结合与这些分子或包含其抗原结合片段的多肽重叠或竞争的表位。此种包含抗体的抗原结合片段的多肽的合适实例包括scFv、单链抗体、Fv、单链Fv 2(scFv2)、Fab和F(ab’)
这些分子包括包含本文参比例中所详细例示的多特异性抗原结合分子(其包含具有GPC3结合活性的H链可变区和共有L链可变区)的包含具有GPC结合活性的抗体可变区的结构域的分子,包含本文参比例中所例示的多特异性抗原结合分子(其包含具有T细胞受体复合物结合活性的H链可变区和共有L链可变区)的包含具有T细胞受体复合物结合活性的抗体可变区的结构域的分子,并且还包括这样的分子,所述分子具有与相同抗原性的蛋白质(GPC3或T细胞受体复合物)结合的活性,其包含含在以上分子中的H和L链中每个的三个CDR(总共六个CDR)。
这些分子具有的CDR与本发明的多特异性抗原结合分子的CDR一样;并且因此,预期其结合与本发明的多特异性抗原结合分子的表位重叠的表位。因此,当与本发明的多特异性抗原结合分子共存时,这些分子可以与本发明的多特异性抗原结合分子竞争。因此,这些分子可以被用作,例如,抑制本发明的多特异性抗原结合分子的活性(如抗原结合活性、细胞毒性活性和抗肿瘤活性)的调节剂。此外,此种分子可以预先结合靶蛋白(GPC3或T细胞受体复合物),并且当添加本发明的多特异性抗原结合分子时,可以检测通过竞争解离的分子。以此方式,所述分子可用作用于检测本发明的多特异性抗原结合分子与靶蛋白的结合的试剂。此处,此种分子可以被适当地标记以荧光物质等。备选地,这些分子可用于筛选结合与本发明的多特异性抗原结合分子所结合的表位重叠的表位的新抗体。如上所述,此种分子可以预先结合靶蛋白(GPC3或T细胞受体复合物),并且当添加测试抗体时,如果结合的分子解离,则测试抗体为针对与本发明的多特异性抗原结合分子所结合的表位重叠的表位的抗体的候选。这将使新多特异性抗原结合分子的有效筛选成为可能。
作为本文实例作为本发明的多特异性抗原结合分子的各CDR的组合呈现的组合可以被直接用作这些分子中的H-链和L链可变区的CDR的具体组合。这些分子的抗原亲和力(KD值)优选为本文中例示为本发明的多特异性抗原结合分子的KD值的值,但是不限于此。
在本发明中,不定冠词“一种”或“一个”是指由不定冠词引用的一个或两个或更多个(即至少一个)语法对象。例如,“一个(一种)组分”是指一个组分或两个或更多个组分。
本领域技术人员自然会理解,本文所述的一个或多个实施方案的任何组合也包括在本发明中,只要它们基于本领域技术人员的普通技术知识在技术上不矛盾。
本文中引用的所有现有技术文献都通过引用结合在本说明书中。
实施例
下文中,将关于实施例来具体描述本发明,但是本发明不视为限于此。
[实施例1]使用人外周血单核细胞作为效应细胞时的各试验抗体的T细胞依赖性细胞毒性(TDCC活性)
通过下述方法测量每种测试抗体的TDCC活性。使用人外周血单核细胞(下文称为人PBMC)作为效应细胞并且如下测量每种测试抗体的TDCC活性。
(1)制备人PBMC溶液
使用预装有500μl 5000单位/5ml肝素溶液的注射器在Chugai PharmaceuticalCo.Ltd.从健康人收集50ml外周血。将用PBS稀释2倍的外周血分成4个等分试样并加入到Leucosep管中用于淋巴细胞分离(GE Healthcare),所述Leucosep管已装载15ml Ficoll-Paque PLUS并预先离心。将含有等分外周血的分离管在室温下以1000g的速度离心10分钟,然后收集单核细胞级分。用含有10%FBS的RPMI-1640(SIGMA)(以下称为10%FBS/RPMI-1640)洗涤各层级分中含有的细胞一次后,将细胞以2×10
(2)LDH释放测定(TDCC活性)
通过LDH释放方法(LDH细胞毒性检测试剂盒,TAKARA)评估TDCC活性。首先,用每种靶细胞培养基稀释抗体溶液至浓度(0.000004,0.00004,0.0004,0.004,0.04,0.4,4和40μg/ml),其浓度是最终浓度的4倍,并且将50μl的各浓度的抗体溶液的等分试样加入96孔圆底板的每个孔中。然后,将对于每种靶细胞在培养基中以2×10
等式:
细胞毒性(TDCC)(%)=((A-B)-C))x 100/(D-C)
基于该等式确定细胞毒活性。
这里,A表示靶细胞,效应细胞和抗体的混合物的吸光度;B代表效应细胞的吸光度;C代表靶细胞的吸光度;D代表添加Triton X-100的靶细胞的吸光度。
结果,清楚地观察到抗人CD3ε链和抗人GPC3双特异性抗体(参比例3的表17中描述的样品编号38的抗体)的TDCC(图1)。
[实施例2]确定每个细胞系中细胞表面上表达的GPC3的量
使用QIFIKIT(DAKO)通过流式细胞术计算每个细胞系的细胞表面上的GPC3的抗体结合能力(ABC)。
用补充有0.5%BSA的CellWASH(BD Bioscience)(下文称为FACS/PBS)洗涤后,针对每个细胞系在50μl含有小鼠抗人GPC抗体或对照抗体的溶液中制备5×10
计算每个细胞系的细胞表面上的GPC3的ABC,并显示在表6中。
表6
[实施例3]体内药物效力(抗人CD3ε链和抗人GPC3双特异性抗体)的评估(当参比例3的表17中记载的样品编号30,31,32,33和38的抗体或样品编号39和40的抗体被用作单一试剂时的药物效力评估研究)
使用一些细胞系(其中通过实施例1中描述的体外测定观察到细胞毒性活性)的肿瘤携带模型以及体内传代系评估体内药物效力。
称为NOD scid/T细胞注射模型,人源化NOG小鼠模型和人CD3εδγ基因修饰小鼠模型的方法用于体内药物效力评估。使用NOD scid/T细胞注射模型的测定如下进行。将在体外测定中观察到细胞毒活性的一些细胞系和体内传代的细胞系移植到NOD scid小鼠中。将利用体外培养的人PBMC扩增的T细胞注射到具有确认建立肿瘤的NOD scid小鼠中。通过施用双特异性抗体38和双特异性抗体30,31,32或33来治疗小鼠。使用人源化NOG小鼠模型的测定如下进行。将源自脐带血的CD34阳性造血干细胞通过尾静脉注射移植到NOG小鼠中。在小鼠中不断地供给人T细胞,称为人源化NOG小鼠。将PC-10细胞系移植到人源化NOG小鼠中。通过施用抗体38处理已确认建立PC-10肿瘤的人源化NOG小鼠。使用人CD3εδγ基因修饰的小鼠模型的测定如下进行。将被迫表达人GPC3的小鼠来源细胞系的细胞移植到人CD3εδγ基因修饰的小鼠模型中,该小鼠模型已根据参比例10制备。通过施用抗体38处理具有确认的肿瘤建立的人CD3εδγ基因修饰的小鼠。
如下进行NOD scid/T细胞注射模型中双特异性抗体38和双特异性抗体30,31,32和33的药物效力评估研究。使用从健康人和T细胞活化/扩增试剂盒/人收集的血液中分离的PBMC扩增培养T细胞。将每个人癌细胞系(MKN74,FU-97,SNU-1,SCC152,KYSE70,PC-10,HuH-7,TOV-21G,RMG-1,和SK-pca31a(SK-HEP-1/hGPC3))与Matrigel
通过尾静脉以1mg/kg(PC-10)施用双特异性抗体39和40。只进行了一次施用。实验中使用的抗体39和40具有不同的恒定区序列,但它们共享CD3结合可变区,GPC3结合可变区和共有L链可变区的相同氨基酸序列(CD3结合可变区:SEQ ID NO:433,GPC结合可变区:SEQID NO:434,共有L链可变区:SEQ ID NO:435)。通过本领域技术人员已知的方法产生抗体。
结果,与载体施用组相比,双特异性抗体38产生明显的抗肿瘤效果(图2)。
结果,与载体施用组相比,双特异性抗体39和40产生明显的抗肿瘤效果(图3)。
结果,与载体给药组相比,双特异性抗体30,31,32和33产生明显的抗肿瘤效果(图4)。
如下进行人源化NOG小鼠模型中抗体38的药物效力评估研究。向NOG小鼠(In-VivoScience Inc.,♀)照射2.5Gy的X射线。第二天,通过尾静脉注射将源自脐带血的1×10
结果,与载体施用组相比,在抗体38施用组中产生明显的剂量依赖性抗肿瘤效果(图5)。
使用人CD3εδγ基因修饰的小鼠模型进行的测定中抗体38的药物效力评估研究如下进行。将具有过表达人GPC3的小鼠来源的癌细胞系LLC1/hGPC3癌细胞皮下移植到人CD3εδγ基因修饰的小鼠(Chugai Pharmaceutical Co.Ltd.,♀)中。移植的当天被定义为第0天。在第11天,基于肿瘤大小和体重将小鼠分成组。通过尾静脉以5mg/kg施用抗体38。抗体38施用两次(第11天和第14天)。通过尾静脉以25mg/kg施用抗人GPC3抗体(WO2006/006693,克隆名称:GC33),抗小鼠CTLA-4抗体(BioXCell,目录号BE0032),抗小鼠PD-1抗体(BioXCell,目录号BE0146)和抗小鼠PD-L1抗体(BioXCell,目录号BE0101)(其是用作对照的药剂)。将抗人GPC3抗体,抗小鼠CTLA-4抗体,抗小鼠PD-1抗体和抗小鼠PD-L1抗体施用两次(第11天和第14天)。
结果,与溶剂施用组或抗人GPC3抗体,抗小鼠CTLA-4抗体,抗小鼠PD-1抗体和抗小鼠PD-L1抗体相比,抗体38产生明显的抗肿瘤效果(图6)。
[实施例4]体内药物效力的评估(抗体38与其他试剂组合的药物效力评估研究)
使用携带肿瘤的模型进行抗体38和其他试剂组合的体内药物效力评估研究。使用实施例3中描述的NOD scid/T细胞注射模型,实施例3中描述的人CD3εδγ基因修饰的小鼠模型或人CD3ε基因修饰的小鼠模型评估组合的体内药物效力。使用NOD scid/T细胞注射模型的组合研究如下进行。将MKN45或NCI-H446细胞系移植到NOD scid小鼠中。将利用体外培养的人PBMC扩增的T细胞注射到具有确认建立明显肿瘤的NOD scid小鼠中。通过施用抗体38与卡培他滨,顺铂或紫杉醇的组合来治疗小鼠。使用人CD3εδγ基因修饰的小鼠模型的组合研究如下进行。将LLC1/hGPC3癌细胞或Hepa1-6/hGPC3细胞(其是被迫表达人GPC3的小鼠来源的细胞系)移植到人CD3εδγ基因修饰的小鼠中。通过抗体38与抗小鼠TIM-3抗体(BioXCell,目录号BE0115),抗小鼠LAG-3抗体(BioXCell,目录号BE0174),抗小鼠CD137抗体(BioXCell,目录号BE0169),或抗小鼠VEGFR2抗体(BioXCell,目录号#BP0060)组合施用治疗具有确认的明显肿瘤建立的人CD3基因εδγ修饰小鼠。使用人CD3ε基因修饰的小鼠模型的组合研究如下进行。将Hepa1-6/hGPC3癌细胞(其是被迫表达人GPC3的小鼠来源的癌细胞系)移植到人CD3ε基因修饰的小鼠中。通过将抗体38与抗小鼠PD-1抗体(BioXCell,目录号BE0146)或抗小鼠PD-L1抗体(BioXCell,目录号BE0101)组合施用来治疗具有确认的明显肿瘤建立的人CD3ε基因修饰的小鼠。
使用NOD scid/T细胞注射模型的抗体38和其他试剂的药物效力评估研究如下进行。使用从健康人和T细胞活化/扩增试剂盒/人收集的血液中分离的PBMC扩增培养T细胞。将每个人癌细胞系(MKN45和NCI-H446)与Matrigel
表7
结果,与单独使用抗体38或用于组合使用的药剂的组相比,施用抗体38和用于组合使用的药剂的组合组的抗肿瘤效果增强(图7至8)。
在施用紫杉醇,顺铂或卡培他滨和抗体38后从肿瘤样品中提取RNA。使用nCounter的全面RNA分析,肿瘤浸润淋巴细胞(TIL)分析和病理学分析如下进行。
肿瘤样品如下制备。当在人源化NOG小鼠模型中抗体38与化疗剂组合使用时的肿瘤样品通过下述方法制备。向NOG小鼠(In-Vivo Science Inc.,♀)照射2.5Gy的X射线。第二天,通过尾静脉注射将源自脐带血的1×10
当肿瘤建立时,基于肿瘤大小和体重将小鼠分成组。根据表21中所述的剂量和给药方案施用抗体38和用于组合使用的药剂。在表21中描述的时间对小鼠实施安乐死,并切除肿瘤并保存用于肿瘤浸润淋巴细胞(TIL)分析,病理分析或RNA分析。
表21
RNA分析如下进行。从上述肿瘤样品中提取RNA(miRNeasy Mini Kit,QIAGEN)并测定RNA浓度(NanoDrop,Thermo Fisher Scientific)。使用nCounter PanCancer PathwayPanel和PanCancer Immune Profiling Panel(NanoStrng)对100ng RNA进行全面(人)RNA表达分析。使用Panel中包含的管家基因进行标准化。使用的分析软件是nSolver(NanoStrng)。
结果表明,与单独施用抗体-38或化疗剂的组相比,当抗体-38与化疗剂,紫杉醇或卡培他滨组合使用时,免疫细胞标志物,趋化因子,细胞因子,参与细胞死亡的基因,参与细胞周期调控的基因的表达增加,并且参与细胞周期进程的基因表达受到抑制(图35-1至35-6)。
TIL分析如下进行。使用温和的MACS
结果表明,与单独施用抗体-38或化疗剂的组相比,当抗体-38与化疗剂,紫杉醇或卡培他滨组合使用时,表达T细胞标志物,活化T细胞标志物和参与细胞毒活性的蛋白质的细胞群增加(图36-1和36-2)。
关于肿瘤组织的组织学分析,将抗体38和紫杉醇施用后6天的小鼠肿瘤样品固定在10%甲醛中性缓冲溶液中。然后,根据常规方法制备HE染色的样品,并使用光学显微镜进行组织病理学评估。
结果,当施用抗体38时,在肿瘤周围观察到免疫细胞浸润,并且当抗体38与紫杉醇组合使用时,浸润区域扩大。
使用人CD3εδγ基因修饰的小鼠模型的抗体38和其他试剂的药物效力评估研究如下进行。将Hepa1-6/hGPC3和LLC1/hGPC3癌细胞系(其是具有人GPC3过表达的小鼠癌细胞系)皮下移植到人CD3εδγ基因修饰的小鼠(Chugai Pharmaceutical Co.Ltd.)中。移植的当天被定义为第0天。当确认明显的肿瘤建立时,基于肿瘤大小和体重将小鼠分成组。通过将抗体38与抗小鼠TIM-3抗体,抗小鼠LAG-3抗体,抗小鼠CD137抗体或抗小鼠VEGFR2抗体组合施用来进行治疗。与抗体38组合使用的每种药剂的剂量示于表8中。
表8
结果,与单独使用抗体38或用于组合使用的药剂的组相比,施用抗体38和用于组合使用的药剂的组合组的抗肿瘤效果增强(图9和图10)。
人CD3ε基因修饰的小鼠模型中抗体38与其他试剂的药物效力评估研究如下进行。将具有过表达人GPC3的小鼠癌细胞系Hepa1-6/hGPC3癌细胞系皮下移植到人CD3ε基因修饰小鼠(Chugai Pharmaceutical Co.Ltd.)中。移植的当天被定义为第0天。在第15天,基于肿瘤大小和体重将小鼠分成组。通过将抗体38与抗小鼠PD-1抗体或抗小鼠PD-L1抗体组合施用来进行治疗。与抗体38组合使用的每种药剂的剂量示于表9中。
表9
结果,与单独使用抗体38或用于组合使用的药剂的组相比,施用抗体38和用于组合使用的药剂的组合组的抗肿瘤效果增强(图11)。
参比例
[参比例1]制备GPC3_ERY22_rCE115和测量细胞毒性活性
(1-1)制备GPC3_ERY22_rCE115
使用针对癌症抗原(GPC3)的IgG作为基础结构,制备Fab之一被替代为CD3ε结合结构域的分子。在此情况中,用作基础结构的IgG Fc是沉默的Fc,其具有减弱的对FcgR(Fcγ(Fc gamma)受体)的亲和力。将抗GPC3抗体H0000(SEQ ID NO:40)/GL4(SEQ ID NO:41)用作GPC3结合结构域。将抗CD3抗体rCE115H/rCE115L(SEQ ID NO:42/SEQ ID NO:43)用作CD3结合结构域。
将通过除去IgG1的C末端处的Gly和Lys制备的G1d用作抗体H链恒定区,并将此与H0000/GL4和rCE115H/rCE115L组合使用。当抗体H链恒定区被命名为H1时,对应于可变区中携带H0000的抗体的H链的序列被显示为H0000-H1。此处,氨基酸改变被显示为,例如,D356K。第一个字母(对应于D356K中的D)是修饰前的氨基酸残基的单字母编码表示,之后的数字(对应于D356K中的356)是EU编号所指示的修饰的位置,并且最后的字母(对应于D356K中的K)是修饰后的氨基酸残基的单字母编码表示。通过除去IgG1的C末端处的Gly和Lys制备的G1dh(SEQ ID NO:44),通过将L234A/L235A/Y349C/T366W突变引入G1dh中制备的ERY22_Hk(SEQ ID NO:45),以及通过将L234A/L235A/D356C/T366S/L368A/Y407V突变引入G1dh中制备的ERY22_Hh(SEQ ID NO:46)根据参比例5的方法制备。L234A和L235A突变被引入到相应的H链中以减弱对FcgR(Fcγ受体)的亲和力,并且Y349C/T366W和D356C/T366S/L368A/Y407V突变被引入以在生产包含两种类型的H链的异源二聚体抗体时有效地形成各H链的杂聚体。
通过用针对GPC3的Fab的VH和VL结构域置换而制备的异源二聚体抗体GPC3_ERY22_rCE115是根据参比例5制备的(图12a)。
插入有编码GL4-ERY22_Hk(SEQ ID NO:47),H0000-ERY22_L(SEQ ID NO:48),rCE115H-ERY22_Hh(SEQ ID NO:49),和rCE115L-k0(SEQ ID NO:50)中的每个的多核苷酸的一系列表达载体是通过本领域技术人员已知的方法制备的,如使用添加有与上述方法中的那些序列类似的适当序列的引物的PCR法。
将表达载体的以下组合引入到FreeStyle 293-F细胞中用于瞬时表达各靶分子。
靶分子:GPC3_ERY22_rCE115
由插入到表达载体中的多核苷酸编码的多肽:GL4-ERY22_Hk,H0000-ERY22_L,rCE115H-ERY22_Hh,rCE115L-k0。
(1-2)纯化GPC3_ERY22_rCE115
将获得的培养物上清添加至抗FLAG M2柱(Sigma),然后洗涤所述柱,之后使用0.1mg/mL的FLAG肽(Sigma)洗脱。将含目的分子的级分添加至HisTrap HP柱(GEHealthcare),然后洗涤所述柱,之后使用咪唑浓度梯度洗脱。使用超滤膜将含目的分子的级分浓缩,然后将所述级分添加至Superdex 200柱(GE Healthcare),并且通过仅从洗脱的溶液收集单体的级分获得各纯化的目的分子。
(1-3)使用人外周血单核细胞测量GPC3_ERY22_rCE115的细胞毒性活性评测GPC3_ERY22_rCE115的体外细胞毒性活性。
(1-3-1)制备人外周血单核细胞(PBMC)溶液
使用预先装载有100μL 1,000单位/mL肝素溶液(注射用Novo Heparin,5000单位,Novo Nordisk)的注射器,自每个健康的志愿者(成年个体)收集50mL外周血。将该外周血两倍稀释于PBS(-)中,分成四个等分试样,并将其添加到已装载有15mL Ficoll-Paque PLUS并预先进行离心的用于淋巴细胞分离的Leucosep管(货号227290,Greiner Bio-One)中。将该分离管离心(2150rpm,十分钟,室温),然后收集单核细胞级分。将单核细胞级分中的细胞用含10%FBS的Dulbecco’s Modified Eagle’s Medium(SIGMA制造,下文中称为10%FBS/D-MEM)洗涤一次,然后使用10% FBS/D-MEM制备成具有4x 10
(1-3-2)测量细胞毒性活性
使用xCELLigence实时细胞分析仪(Roche Diagnostics)根据细胞增殖抑制率来评价细胞毒性活性。将表达人GPC3的NCI-H446人癌细胞系或PC-10人癌细胞系用作靶细胞。使NCI-H446或PC-10从培养皿解离,然后将细胞以100μL/孔的等分试样置于E-Plate 96(Roche Diagnostics)中,调节细胞至1x10
细胞增殖抑制率(%)=(A-B)x 100/(A-1)
A表示未添加抗体(仅含靶细胞和人PBMC)的孔中细胞指标值的平均值,而B表示各孔中细胞指标值的平均值。一式三份地进行检测。
当将由人血液制备的外周血单核细胞(PBMC)用作效应子细胞以测量GPC3_ERY22_rCE115的细胞毒性时,观察到极强的活性(图13)。
[参比例2]抗CD3抗体rCE115的H链的人源化以及共有L链的共享
(2-1)设计hCE115HA,人源化的rCE115 H链可变区
将抗CD3抗体rCE115的H链可变区(SEQ ID NO:42)人源化。确定如Kabat(Kabat编号)限定的CDR和FR。
首先,通过将数据库中的人抗体可变区序列与rCE115大鼠可变区序列比较,选择人FR序列。将IMGT Database(http://www.imgt.org/)和NCBI GenBank(http://www.ncbi.nlm.nih.gov/genbank/)用作所述数据库。通过将rCE115可变区的H链CDR序列与选择的人FR序列相连,设计人源化的H链可变区序列。这产生人源化的H链可变区序列,hCE115HL(SEQ ID NO:51)。
Kabat编号指示的位置93处的氨基酸残基在所选的人H-链FR3序列中是Ala,但是在rCE115可变区序列中是Arg。使用大鼠和人生殖细胞系序列数据库(IMGT Database(http://www.imgt.org/)),发现仅若干序列在该位点处含Arg。据报道,Kabat编号指示的位置94处的氨基酸残基有助于通过形成上部核心而稳定抗体结构(Ewert等.Methods.2004Oct;34(2):184-99)。基于此信息,重新设计人源化的H链可变区序列,其中H链FR3中的Kabat位置93和94处的氨基酸残基被置换成rCE115可变区序列中存在的那些残基。这即为人源化的H链可变区序列hCE115HA(SEQ ID NO:52)。
(2-2)设计rCE115抗CD3抗体和抗GPC3抗体的共有L链L0000
进行rCE115抗CD3抗体的L链可变区rCE115L(SEQ ID NO:43)和抗GPC3抗体的L链可变区GL4(SEQ ID NO:41)的FR/CDR改组(shuffling)。
将GL4的FR序列选为L链FR序列。对于rCE115L和GL4,L链CDR2是相同的。分别地,L链CDR1选自GL4的CDR序列,并且L链CDR3选自rCE115L的CDR序列。此外,重新设计通过将所选L链CDR3的Kabat位置94处的氨基酸残基Asp置换为GL4存在的Val残基制备的L链CDR3。
通过连接上述选择的FR和CDR,设计人源化的L链可变区序列。这提供人源化的L链可变区序列L0000(SEQ ID NO:53)。
(2-3)评估对人GPC3的亲和力
当使用GL4(SEQ ID NO:41)和L0000(SEQ ID NO:53)作为L链可变区时,评估结合人GPC3的活性。这使用通过突出入孔技术(knobs-into-hole technique)异源二聚化的人IgG1的Fc区处具有单个Fab的单臂抗体的分子形式进行。将H0000(SEQ ID NO:40)用于抗GPC3抗体H链可变区。
抗GPC3抗体对抗原的亲和力和结合速率常数是通过表面等离子共振测定的多循环动力学方法、使用Biacore
表10
(2-4)评估对人CD3的亲和力
当使用hCE115HA(SEQ ID NO:52)作为H链可变区并且使用L0000(SEQ ID NO:53)作为L链可变区时,评估结合人CD3的活性。这使用通过突出入孔技术异源二聚化的人IgG1的Fc区处具有单个Fab的单臂抗体的分子形式进行。
通过表面等离子共振测定的单循环动力学方法,使用Biacore
表11
(2-5)制备GPC3_ERY27_hCE115
将针对癌症抗原(GPC3)的IgG4用作基础结构以制备ERY27分子(图12b),其中Fab中的一个的H链可变区被替换成CD3ε结合结构域,并且L链为两个Fab共有。在此情况中,用作基础结构的IgG4 Fc是沉默的Fc,其具有减弱的对FcgR(Fcγ受体)的亲和力。将H0000(SEQ ID NO:40)用作GPC3结合结构域的H链可变区,并将hCE115HA(SEQ ID NO:52)用作CD3结合结构域的H链可变区。将L0000(SEQ ID NO:53)用作L链可变区。当制备包含两种类型的H链的异源二聚体抗体时,引入被引入到相应H链中的D356K和K439E突变以用于各H链的有效的异源聚合体形成(WO2006/106905)。H435R是妨碍与A蛋白的结合的修饰,并且被引入以用于有效分离异源聚合体和同源聚合体(WO/2011/078332)。
通过已知的方法制备插入有编码H0000-ERY27_HK(SEQ ID NO:54)、hCE115HA-ERY27_HE(SEQ ID NO:55)和L0000-k0(SEQ ID NO:56)中的每一个的多核苷酸的一系列表达载体。
将表达载体的以下组合引入到FreeStyle 293-F细胞中以用于瞬时表达各靶分子。
靶分子:GPC3_ERY27_hCE115
插入到表达载体中的多核苷酸编码的多肽:H0000-ERY27_HK、hCE115HA-ERY27_HE和L0000-k0。
(2-6)纯化GPC3_ERY27_hCE115
通过参比例1-2中所述的方法纯化各目的分子。
(2-7)使用人外周血单核细胞测量细胞毒性活性
(2-7-1)制备人外周血单核细胞(PBMC)溶液
通过参比例1-3-1中所述的方法制备所述溶液。
(2-7-2)测量细胞毒性活性
通过参比例1-3-2中所述的方法测量细胞毒性活性。
当将由人血液制备的PBMC用作效应子细胞以测量GPC3_ERY27_hCE115的细胞毒性时,作为rCE115的H链的人源化和共有L链的共享的结果,观察到活性减小(图13)。
[参比例3]制备和评估人源化的双特异性抗体变体以改善各种性质
参比例2中获得的人源化的抗人CD3ε(CD3 epsilon)链和抗人GPC3双特异性抗体GPC3_ERY27_hCE115(SEQ ID NO:54、55和56)的T细胞依赖性细胞毒性活性低于GPC3_ERY22_rCE115(SEQ ID NO:47、48、49和50)的T细胞依赖性细胞毒性活性。这可能是由于作为人源化和共有L链的共享的结果的对GPC3和CD3ε链的亲和力减弱所致。关于具有独立序列的GPC3和CD3ε链抗原,目前没有关于通过使用共有抗体L链增强了T细胞依赖性细胞毒性活性并且提高了对两种抗原的亲和力的人源化的双特异性抗体的报道。因此认为,获得具有双重特异性并且显示等于或大于GPC3_ERY22_rCE115的药物效力的药物效力的人源化抗体是困难的。
在此种情况下,申请人通过本领域技术人员已知的方法制备了对人GPC3和人CD3ε链具有改良的亲和力的经修饰的人源化的双特异性抗体,所述方法包括将抗体基因编码的氨基酸残基全面置换以产生针对人GPC3和人CD3ε-链抗原两者的抗体变体,以及通过筛选进行各种评估。此外,使用类似方法来产生具有改良的理化性质的经修饰的人源化的双特异性抗体。此外,通过组合对改良亲和力和理化性质有效的氨基酸残基的置换,在人源化之前制备TDCC活性等于或大于GPC3_ERY22_rCE115的T细胞依赖性细胞细胞毒性的优化的双特异性抗体。
通过与参比例1和2中的那些类似的方法进行人源化的双特异性抗体的优化中的点突变的引入、抗体的表达和纯化、抗原亲和力测量以及T细胞依赖性细胞细胞毒性的确定。根据Kabat定义(Kabat编号)确定CDR和FR。
根据目的,将以下用作抗体H链恒定区(数字指示EU编号):通过将L234A/L235A/N297A/D356C/T366S/L368A/Y407V/G446缺失/K447缺失突变引入到人IgG1中制备的E22Hh(SEQ ID NO:57);通过将L234A/L235A/N297A/Y349C/T366W/G446缺失/K447缺失突变和在位置118之前紧挨着的Ser-Ser插入突变引入到人IgG1中制备的E22Hk(SEQ ID NO:58);通过将D356C/T366S/L368A/Y407V/G446缺失/K447缺失突变引入到人IgG1中制备的G1dh;通过将118-215缺失和C220S/Y349C/T366W/H435R突变引入到人IgG1中制备的none-Hi-Kn010G3;通过将L235R/S239K/N297A/E356K/R409K/H435R/L445P/G446缺失/K447缺失突变引入到人IgG4中制备的E2702GsKsc(SEQ ID NO:60);通过将K196Q/L235R/S239K/N297A/R409K/K439E/L445P/G446缺失/K447缺失突变引入到人IgG4中制备的E2704sEpsc(SEQ IDNO:61);和通过将L235R/S239K/N297A/E356K/R409K/L445P/G446缺失/K447缺失突变引入到人IgG4中制备的E2702sKsc(SEQ ID NO:62)。此外,将通过将R108A/T109S突变引入到人κ链中制备的人κ(kappa)链k0(SEQ ID NO:63)和E22L(SEQ ID NO:432)用作抗体L链恒定区。
当制备异源多聚抗体时,在EU编号位置356处用Cys置换Asp的突变,在EU编号位置366处用Ser置换The的突变,在EU编号位置368处用Ala置换Leu的突变,在EU编号位置407处用Val置换Tyr的突变,在EU编号位置349处用Cys置换Tyr的突变,在EU编号位置366处用Trp置换Thr的突变,以及在位置118之前紧邻地插入Ser-Ser的突变是用于有效形成各H链的异源二聚体分子的突变。类似地,当制备异源多聚抗体时,在EU编号位置356处用Lys置换Glu的突变和在EU编号位置439处用Glu置换Lys的突变也是用于有效形成各H链的异源二聚体分子的突变。预期其提高双特异性抗体生产的效率。
在EU编号位置234处用Ala置换Leu的突变,在EU编号位置235处用Ala或Arg置换Leu的突变,在EU编号位置239处用Lys置换Ser的突变,以及在EU编号位置297处用Ala置换Asn的突变是用于减弱对Fcγ受体和补体(C1q)的亲和力的突变。预期其抑制Fab与CD3的结合以及Fc介导的Fcγ受体或补体的交联,并且避免伴随非特异性效应子功能增强的细胞因子释放综合征。
在EU编号位置118至215处引入有缺失突变的H链可以与全长H链序列组合以产生仅具有一个Fab的抗体(单价抗体),并且其可用于亲和力评估。
在EU编号位置409处用Lys置换Arg的突变和在EU编号位置435处用Arg置换His的突变是用于改变抗体性质以分别与人IgG1和人IgG3的性质接近的突变。
(3-1)通过点突变改变人源化的抗CD3抗体的亲和力
首先,将点突变导入到参比例2中制备的人源化的抗人CD3ε链抗体序列hCE115HA-ERY27_HE(SEQ ID NO:55)的FR1、FR2、FR3、CDR1、CDR2和CDR3中以制备修饰的抗体。接下来,确定这些修饰的抗体对可溶性人CD3ε链的亲和力。将具有亲和力增强效果的位点组合,产生具有表12中所示亲和力的修饰的抗体。
表12
/>
/>
(3-2)改变人源化的抗GPC3抗体的亲和力
首先,将点突变导入到参比例2中制备的抗人GPC3双特异性抗体序列H0000-ERY27_HK(SEQ ID NO:54)的CDR1、CDR2和CDR3中以制备修饰的抗体。接下来,确定这些修饰的抗体对可溶性人GPC3的亲和力。将具有亲和力增强效果的位点组合,产生具有表13中所示亲和力的修饰的抗体。
表13
/>
/>
(3-3)通过点突变改变pI
在双特异性抗体的商业制备中,要求高水平的纯度。据报道,当使用离子交换色谱法时,改变分子等电点(pI)是有效的(PLoS One.2013;8(2):e57479)。因此,将用于改变pI的点突变导入到参比例2中制备的人源化的抗人GPC3抗体序列H0000-ERY27_HK(SEQ IDNO:54)的CDR1、CDR2和CDR3中以制备修饰的抗体。接下来,确定这些修饰的抗体对可溶性人GPC3的亲和力。
结果发现,可以降低pI同时保持对人GPC3的亲和力的氨基酸改变是根据Kabat编号的位置19、43、53和61处的氨基酸。
将显示保持对人GPC3的亲和力并降低pI的效果的位点组合,产生具有表14中所示亲和力和pI值的抗体。
表14
(3-4)通过点突变改变胞外基质结合能力
已报道,与胞外基质(ECM)等的非特异性结合可能对药物动力学有影响(MAbs.2012Nov-Dec;4(6):753-60)。因此,通过参比例8中所述的方法确定参比例中获得的修饰的抗体的ECM结合能力。结果,确认人源化的抗人CD3ε链和抗人GPC3双特异性抗体GPC3_ERY27_hCE115(SEQ ID NO:54、55和56)具有高ECM结合能力。因此,经研究参比例3-1、3-2和3-3中对于人源化的抗人CD3ε链抗体序列hCE115HA-ERY27_HE(SEQ ID NO:55)所检测的任一点突变是减小ECM结合能力的一种组合。结果,发现Kabat编号位置11、16、52a、53、98和100处的氨基酸有助于保持对CD3ε的亲和力并且对ECM结合能力的减小有影响,并且获得与人源化的抗人CD3ε链和抗人GPC3双特异性抗体的抗体变体GPC3_ERY27_hCE115的ECM结合能力相比具有减小的ECM结合能力的抗体(表15)。
表15
(3-5)通过点突变改变与SuRe
抗体与A蛋白的结合取决于其可变区序列(VH3)的实例是已知的(J BiomolTech.2011Jul;22(2):50-2)。在人源化的抗人CD3ε链和抗人GPC3双特异性抗体的A蛋白纯化中,去除同源多聚抗CD3抗体对于抑制经由CD3的非特异性反应是重要的。因此认为需要抑制同源多聚抗CD3抗体与A蛋白的结合。推测起来,商业生产中将使用SuRe
表16
(3-6)通过组合导致各种性质改善的点突变,制备优化的双特异性抗体
可以通过组合如参比例3-1至3-5中所述的导致各种性质改善的点突变来制备优化的修饰的抗体。作为此种修饰的抗体的实例,制备表17中所述的抗体,并使用与参比例1的方法类似的方法对其进行T细胞依赖性细胞细胞毒性(TDCC)评估。结果显示在图15至20中。结果获得显示T细胞依赖性细胞细胞毒性等于或大于人源化前的GPC3_ERY22_rCE115的T细胞依赖性细胞细胞毒性的优化的人源化的抗人CD3ε链和抗人GPC3双特异性抗体。
表17
/>
参比例3-1至3-6显示以下氨基酸残基,例如,对于保持显示T细胞依赖性细胞细胞毒性等于或大于人源化前的GPC3_ERY22_rCE115的T细胞依赖性细胞细胞毒性的优化的抗人CD3ε链和抗人GPC3双特异性抗体的性质是重要的。
在抗人CD3ε链抗体中,所述实例为位置11处的Leu,位置16处的Gly,位置52a处的Asp,位置53处的Gln,位置72处的Ala,位置78处的Ile,位置98处的Ala,位置100处的Gly和位置102处的Ile。在抗人GPC3抗体中,所述实例为位置19处的Thr,位置43处的Glu,位置52a处的Gly,位置53处的Pro或Glu,位置55处的Pro,和位置61处的Glu。此外,在共有抗体L链中,所述实例为位置25处的Pro,位置27a处的Pro,位置27b处的Pro,位置33处的Ile,位置34处的Gln,位置56处的Arg或Trp,和位置89处的Tyr。(所有位置都由Kabat编号指示)。
[参比例4]评估体内效力
使用荷瘤模型评估一些上述抗体的体内效力。
对由参比例3-6中所述的体外测定确认为具有细胞毒性活性的表17所示的那些抗体中的代表性抗体进行体内效力评估。在体内效力评估中,考虑由肿瘤聚集体形成所致的微环境的差异引起的对评估结果的任何影响。因此,将对抗体药物效力有不同敏感度的两种类型的人癌细胞系(即,PC-10和NCI-H446)用于评估,即使这些细胞系的GPC3表达水平基本相同。将所述细胞系移植到NOD scid小鼠中,并对确认建立有肿瘤的NOD scid小鼠进行通过体外培养人PBMC生长的T细胞的注射。通过施用优化的抗人CD3ε链和抗人GPC3双特异性抗体来处理所述小鼠(被称为T细胞注射模型)。
更具体地,在使用PC-10T细胞注射模型的优化的抗人CD3ε链和抗人GPC3双特异性抗体的药物效力测试中,进行以下测试。使用分离自从健康志愿者收集的血液的PBMC和T细胞活化/扩增试剂盒/人(MACS Miltenyi biotec),将T细胞扩增培养。将人癌细胞系PC-10(1x 10
结果,与溶剂施用组相比,在优化的抗人CD3ε链和抗人GPC3双特异性抗体施用组中,更明显地观察到抗肿瘤活性(图21a、b)。
通过类似方法进行NCI-H446 T细胞注射模型上的优化的抗人CD3ε链和抗人GPC3双特异性抗体的药物效力测试。针对NCI-H446通过尾静脉以5mg/kg静脉内施用优化的抗人CD3ε链和抗人GPC3双特异性抗体一次。
结果,与溶剂施用组相比,在优化的抗人CD3ε链和抗人GPC3双特异性抗体施用组中,更明显地观察到抗肿瘤活性(图22a、b)。
[参比例5]抗体表达载体的制备以及抗体表达和纯化
通过本领域技术人员已知的方法,如使用QuikChange定点诱变试剂盒(Site-Directed Mutagenesis Kit)(Stratagene)、PCR或In-fusion Advantage PCR克隆试剂盒(TAKARA),引入氨基酸置换以构建表达载体。通过本领域技术人员已知的方法确定获得的表达载体的核苷酸序列。将制备的质粒瞬时引入到来源于人胚胎肾癌的细胞系HEK293H(Invitrogen)或FreeStyle293(Invitrogen)的细胞中以表达抗体。使用rProteinASepharose
[参比例6]各测试抗体的使用人外周血单核细胞作为效应子细胞的ADCC活性
根据以下方法确定各测试抗体的ADCC活性。
将人外周血单核细胞(下文中称为人PBMC)用作效应子细胞以如下测量各测试抗体的ADCC活性。
(1)制备人PBMC溶液
使用预装填有200μL 1000单位/mL肝素溶液(Novo-Heparin Injection5000单位,Novo Nordisk)的注射器,自Chugai Pharmaceutical Co.Ltd.的健康志愿者(成年男性)收集50mL外周血。将外周血用PBS(-)稀释两倍,分成四个等分试样,并且添加到已装填有15mLFicoll-Paque PLUS并提前进行离心的Leucosep淋巴细胞分离管(Greiner Bio-one)中。将该含外周血等分试样的分离管以2150rpm在室温离心十分钟,然后收集单核细胞级分。将各级分中的细胞用含10% FBS的Dulbecco’s Modified Eagle's Medium(SIGMA)(下文中称为10% FBS/D-MEM)洗涤一次,然后以5x 10
(2)铬释放测定(ADCC活性)
根据铬释放法由铬释放比速率评估ADCC活性。首先,将制备成各浓度(0、0.004、0.04、0.4、4和40μg/mL)的抗体溶液以50μL/孔添加到96孔U形底平板中。接下来,将靶细胞以50μL/孔(1x 10
铬释放比速率(%)=(A-C)x 100/(B-C)
在该等式中,A表示各孔中的100μL培养物上清的放射性(cpm)的平均值;B表示其中已经向靶细胞添加了100μL 2% NP-40水溶液(Nonidet P-40,Nacalai Tesque)和50μL10% FBS/D-MEM的孔中的100μL培养物上清的放射性(cpm)的平均值;而C表示已经向靶细胞添加了150μL 10%FBS/D-MEM的孔中的100μL培养物上清的放射性(cpm)的平均值。一式三份地进行检测并且计算各测试抗体的反映ADCC活性的上述检测中铬释放比速率(%)的平均值和标准差。
[参比例7]通过差异扫描荧光计评估修饰的抗体的Tm
在该检测中,通过差异扫描荧光计使用Rotor-Gene Q(QIAGEN)评估修饰的抗体的Tm(热变性温度)值。据报道,该方法与使用作为用于评估抗体的热稳定性的方法而广为人知的差异扫描量热计的Tm评估具有有利的关联性(Journal of Pharmaceutical Science2010;4:1707-1720)。
将5000x浓缩的SYPRO
使用Rotor-Gene Q Series软件(QIAGEN)分析数据以计算观察到荧光跃迁的温度,并将该温度定义为Tm。
[参比例8]评估ECM结合能力
根据WO2012093704中所述的方法进行所述评估。具体地,使用TBS(Takara,#T903)将BD Matrigel(BD Biosciences,#356237)制成2mg/mL,将此以5μL/孔分配到96孔测量平板(Meso Scale Discovery,#L15XB-3(High Bind))中,然后使其在凉的平板中静置过夜。然后,将150μL ECL封闭缓冲液(含0.05% Tween20,0.5% BSA和0.01%叠氮化钠的PBS)分配到平板的各孔中,然后使其在室温静置两小时以上。
利用MSD SULFO-TAG NHS Ester(Meso Scale Discovery,#R91AN-2)通过附带的使用说明对山羊抗人IgG(γ)(Invitrogen,#628400)进行钌标记。将此稀释在ECL稀释缓冲液(含0.01% Tween20,0.1% BSA和0.01%叠氮化钠的PBS)中至终浓度2μg/mL。此外,将标准抗体和测试抗体稀释在PBS-T(含0.05% Tween 20和0.01%叠氮化钠的PBS)中至终浓度3μg/mL。
向96孔反应平板(Thermo scientific,Nunc#145399)相继加入10μL ECL稀释缓冲液,20μL标准抗体和测试抗体(3μg/mL),以及30μL钌标记的抗体(2μg/mL),并使其在室温在黑暗中在搅拌下反应一小时。
通过倾斜将ECL封闭缓冲液从96孔测量平板中除去,加入来自96孔反应平板的50μL样品溶液,并使其在黑暗中在室温静置一小时。这之后通过倾斜将样品溶液从96孔测量平板中除去,并且在添加150μL 2x T缓冲液(使用ECL稀释缓冲液两倍稀释的4x MSD ReadBuffer T(Meso Scale Discovery))后立即进行ECL测量。将SECTOR Imager 2400(MesoScale Discovery)用于进行测量。
通过将测试抗体的荧光强度除以标准抗体的荧光强度,通过将标准抗体的值限定为1计算并比较强度来进行分析。
[参比例9]评估SuRe
通过使用Biacore
对应于参考例中提及的SEQ ID NO的序列显示在下表中。
表18
/>
[参比例10]人CD3基因置换小鼠的制备
(1)构建小鼠Cd3基因区修饰载体(图26A)
使用细菌人工染色体(BAC)克隆,其中已经克隆了小鼠CD3ε,CD3δ和CD3γ基因所在的基因组区域。将loxP序列插入该BAC中编码小鼠Cd3ε的基因区5’上游约3.5kb左右的位置,并除去更上游的基因组区域,留下约3.1kb。此时,将loxP序列与新霉素抗性(neo)基因盒一起导入,并使用Red/ET系统(GeneBridges)通过同源重组进行插入。在这种情况下,从在补充卡那霉素的培养基中生长的大肠杆菌克隆中,选择聚合酶链式反应(PCR)方法产生正确扩增的克隆。接下来,将loxP序列和Rox序列置于BAC上Cd3γ基因的3’下游。更具体地,将loxP序列和Rox序列与潮霉素抗性(Hyg)基因盒一起导入,并使用Red/ET系统通过同源重组进行插入。在这种情况下,从在补充潮霉素的培养基中生长的大肠杆菌克隆中,通过PCR方法选择其中如期望地插入loxP序列和Rox序列的克隆。接下来,除去Hyg基因盒3’下游的基因组区域,留下约3.4kb。
(2)将小鼠Cd3基因区修饰载体导入小鼠胚胎干细胞(ES细胞)(图26A)
通过电穿孔将上述小鼠Cd3基因区修饰载体导入小鼠ES细胞(C57BL/6N小鼠来源细胞)中,用G418选择性培养后,得到耐药性克隆。从这些克隆中,通过PCR方法进行同源重组体的筛选。对于电穿孔,将60μg小鼠Cd3基因区修饰载体用NotI线性化,或将NotI未处理的环状载体用苯酚/氯仿提取,用乙醇沉淀,然后溶解在PBS中。
将筛选中使用的ES细胞在96孔板上培养,每孔用200μl PBS溶液洗涤两次。然后,在加入具有下列组成的细胞裂解缓冲液(5μl的10x LA缓冲液II(用于Taq的TAKARA LA),5μl的25mM MgCl
PCR反应混合物由以下构成:1μl的样品,2.5μl的10x LA缓冲液II,2.5μl的25mMMgCl
使用以下引物。引物为HygF1474(其作为正向引物放置于Hyg基因盒内)和g4989R(其作为反向引物放置于小鼠Cd3基因修饰载体中3'同源臂3'下游侧的小鼠基因组区域)(参见图27)。在发生同源重组的ES细胞样品中,扩增了约4kb的条带。HygF1474(正向)5'-TATCAGAGCTTGGTTGACGG-3'(SEQ ID NO:436);和g4989R(反向)5'-ACTCGTTGTGGCTTAGAAGCAGTAACAATACC-3'(SEQ ID NO:437)。此外,使用不同的引物组对使用上述引物组获得扩增信号的克隆进行验证。更具体地,将e27248F作为正向引物放置于小鼠Cd3基因修饰载体中5'同源臂的5'上游侧的小鼠基因组区域,并将Neo0635R作为反向引物放置于Neo基因盒内。在发生同源重组的ES细胞样品中,扩增了约4kb的条带。e27248F(正向)5'-ACTGTAATCCTAGTACTTAGGAGGCTGAGG-3'(SEQ ID NO:438);和Neo0635R(反向)5'-AATCCATCTTGTTCAATGGCCGATCC-3'(SEQ ID NO:439)。
(3)构建人CD3基因区导入载体(图26B)
使用BAC克隆,其中已经克隆了人CD3ε,CD3δ和CD3γ基因所在的基因组区域。在该BAC中,在编码人CD3ε的基因区的5'上游插入loxP序列。此时,将loxP序列与Hyg基因盒一起引入,并使用Red/ET系统(GeneBridges)通过同源重组进行插入。在这种情况下,从在补充卡潮霉素的培养基中生长的大肠杆菌克隆中,选择PCR方法产生正确扩增的克隆。接下来,在BAC中人CD3γ基因的3’下游,将两端侧接Frt序列的嘌呤霉素抗性(Puro)基因与Neo基因盒一起导入,以进一步在下游放置Rox序列,并使用Red/ET系统通过同源重组进行插入。在这种情况下,从在补充卡那霉素的培养基中生长的大肠杆菌克隆中,通过PCR方法选择其中如期望地插入Frt序列,Puro基因,Rox序列和Neo基因的克隆。
(4)将人CD3基因区导入载体和重组酶表达载体导入Cd3基因区修饰的小鼠ES细胞
通过电穿孔将人CD3基因区导入载体,Cre重组酶表达载体和Dre重组酶表达载体导入ES细胞克隆(1D4,5H1,6I5和3A5),其中loxP序列和Rox序列正确插入上述步骤中小鼠Cd3基因区的靶位点;在用嘌呤霉素选择性培养后,对生长的ES细胞克隆进行基因分型。
首先,进行PCR筛选以选择克隆,其中位于小鼠Cd3基因区的loxP序列之间和Rox序列之间的重组通过Cre和Dre的作用发生,并且缺失了来自Cd3ε至Cd3γ的基因组区域。用于筛选的ES细胞在96孔板上培养,每孔用200μl PBS洗涤两次,在加入具有下列组成的细胞裂解缓冲液(5μl的10x LA缓冲液II(用于Taq的TAKARA LA),5μl的25mM MgCl
PCR反应混合物由以下构成:1μl的样品,2.5μl的10x LA缓冲液II,2.5μl的25mMMgCl
进行PCR筛选以选择克隆,其中从缺乏小鼠Cd3基因区的ES细胞克隆导入人CD3基因区。筛选用于检测小鼠Cd3基因区缺失的PCR样品。PCR反应混合物由以下构成:1μl的样品,2.5μl的10x LA缓冲液II,2.5μl的25mM MgCl
(5)小鼠Cd3基因缺陷型和人CD3基因导入型小鼠的制备
通过胰蛋白酶处理悬浮同源重组ES克隆,并用ES细胞培养基洗涤。通过以48小时的间隔腹膜内施用5IU马绒毛膜促性腺激素(eCG)和人绒毛膜促性腺激素(hCG)进行超排卵处理的雌性BALB/c小鼠与相同品种的雄性小鼠杂交。在雌性小鼠中确认阴道栓的那天被认为是第0.5天。在妊娠第3.5天,通过灌注子宫收集的胚泡期胚胎用作宿主胚胎,其中注射10至15个ES细胞。注射后的胚胎在第2.5天假妊娠时转移到ICR受体雌性的子宫中,并且在17天后获得它们的后代。基于通过将ES细胞注射到胚泡而获得的后代的毛色进行筛选,得到具有重组ES细胞(黑色)和宿主胚泡来源细胞(白化)的混合物的嵌合小鼠。在性成熟后,将雄性嵌合小鼠与C57BL/6N-雌性小鼠杂交,并使用从第二代小鼠的组织中提取的基因组DNA作为模板通过PCR方法确认敲入等位基因向下一代的传递。通过上述用于筛选ES细胞的方法进行PCR。结果,获得了检测到人CD3基因区特异性5.5kb信号和小鼠Cd3基因区缺陷特异性0.7kb信号的个体,并且确认人CD3基因区等位基因和小鼠Cd3基因区缺陷等位基因传递给这些个体。此外,培育具有上述基因型的小鼠产生以下小鼠个体,其小鼠Cd3基因区是纯合缺失的并且具有人CD3基因区,即获得人CD3基因区取代的小鼠。根据Wang等的报道(Wang等(1994)PNAS.91:9402-9406),制备了单独导入人CD3ε的转基因小鼠(下文称为hCD3εTg小鼠),在后面的实验中对它们进行了比较检查。
(6)人CD3基因取代小鼠的胸腺重量和脾脏重量
从小鼠(12至14周龄,雄性)收集脾和胸腺,并测量组织重量。如图29所示,人CD3取代的小鼠的胸腺未显示出总体上的异常。计算组织重量/体重用于分析。测量每组中四只雄性小鼠的体重和组织重量(脾和胸腺),并表示为图。计算组织重量/体重比,通过黑点绘制每个个体获得的值,并且通过柱显示平均值(图30)。关于脾脏重量,与其他基因型的小鼠相比,在Cd3基因缺陷小鼠中观察到增加趋势,但没有观察到显着差异。另一方面,关于胸腺重量,与野生型相比,Cd3基因缺陷小鼠显示减少至三分之一左右。在通过将人CD3基因导入Cd3基因缺陷小鼠而产生的人CD3基因置换的小鼠中,观察到胸腺重量的恢复,特别是在系编号1C3的个体中,胸腺重量甚至恢复到与野生型小鼠相当的水平。如Wang等报道的,在hCD3εTg小鼠中观察到胸腺萎缩(Wang等(1994)PNAS.91:9402-9406)。
(7)确认人CD3和小鼠Cd3在人CD3基因置换小鼠的各个系中的表达
-使用血细胞RNA通过RT-PCR方法确认-
使用血细胞RNA通过RT-PCR分析人CD3ε,人CD3δ,人CD3γ,小鼠Cd3ε,小鼠Cd3δ和小鼠Cd3γ的表达。使用Catrimox-14RNA分离试剂盒(TaKaRa Bio),从跖背静脉或腹腔静脉采集的血液制备总RNA。通过使用Oligo dT(20)引物用SuperScript III First StrandcDNA合成试剂盒(Invitrogen)进行逆转录反应,将各总RNA的1μg部分用作模板以合成cDNA。通过使用合成的cDNA作为模板进行PCR,检测人CD3ε,人CD3δ,人CD3γ,小鼠Cd3ε,小鼠Cd3δ和小鼠Cd3γ。设计蛋白质编码区的引物以检测所有基因的表达。使用正向引物E0333F(5'-AAGAAATGGGTGGTATTACACAGACACC-3'(SEQ ID NO:444))和反向引物E0912R(5'-TGGGCCAGCGGGAGGCAGTGTTCTCCAGAGG-3'(SEQ ID NO:445))的组合检测人CD3ε。使用正向引物D0092F(5'-TAGTTCGGTGACCTGGCTTTATCTACTGG-3'(SEQ ID NO:446))和反向引物D0685R(5'-ATGGCTGCTTCTAGAAGCCACCAGTCTCAGG-3'(SEQ ID NO:447))的组合检测人CD3δ。使用正向引物G0048F(5'-TGCTCCACGCTTTTGCCGGAGGACAG-3'(SEQ ID NO:448))和反向引物G0666R(5'-TAGGAGGAGAACACCTGGACTACTC-3'(SEQ ID NO:449))的组合检测人CD3γ。另一方面,使用正向引物e0065F(5'-AGCATTCTGAGAGGATGCGGTGGAACAC-3'(SEQ ID NO:450))和反向引物e0699R(5'-TGCTCGGAGGGCTGGATCTGGGTCCACAG-3'(SEQ ID NO:451)的组合检测小鼠Cd3ε。使用正向引物d055F(5'-TCATCCTGTGGCTTGCCTCTATTTGTTGC-3'(SEQ ID NO:452))和反向引物d651R(5'-TTGCTATGGCACTTTGAGAAACCTCCATC-3'(SEQ ID NO:453))的组合检测小鼠Cd3δ。使用正向引物g080F(5'-AATACTTCTACTGGAGAAGCAAAGAG-3'(SEQ ID NO:454))和反向引物g316R(5'-TAGTTGCATTTAGAGGACTTATTATGC-3'(SEQ ID NO:455))的组合检测小鼠Cd3γ。
PCR反应溶液(总共25μl)的组成由以下构成:1μl的样品,2.5μl的10x Ex缓冲液,2μl的dNTP(2.5mM),引物各0.1μl(各50μM),0.25μl的Ex Taq(TAKARA),和19.05μl的蒸馏水。人CD3δ,人CD3γ,小鼠Cd3δ和小鼠Cd3γ的PCR条件包括在94℃预热2分钟,35个扩增循环(94℃30秒,60℃30秒,和72℃2分钟),以及在72℃再加热5分钟。对于人CD3ε和小鼠Cd3ε的PCR条件包括在94℃预热2分钟,40个扩增循环(94℃30秒,60℃30秒,和72℃2分钟),以及在72℃再加热5分钟。设计PCR引物,使检测到的人CD3ε,人CD3δ和人CD3γ的扩增产物分别为580bp,594bp和620bp,小鼠Cd3ε,小鼠Cd3δ和小鼠Cd3γ的扩增产物分别为635bp,597bp和237bp。
在Cd3基因缺陷小鼠中,未检测到对应小鼠Cd3分子来源的PCR信号。仅检测到人CD3ε,人CD3δ和人CD3γ,从通过将人CD3基因区引入Cd3基因缺陷小鼠而产生人CD3基因置换小鼠系(系编号1C3,3B1,8I12和2A4)中的上述系的系1C3和8I12衍生的样品中未检测到小鼠Cd3ε,小鼠Cd3δ和小鼠Cd3γ(图31)。从来自野生型小鼠的样品中,未检测到人CD3ε,人CD3δ和人CD3γ,并且检测到小鼠Cd3ε,小鼠Cd3δ和小鼠Cd3γ(图31)。这些结果证实,按设计获得了表达人CD3ε,CD3δ和CD3γ而不是小鼠Cd3ε,Cd3δ和Cd3γ的小鼠。在个体(其中小鼠Cd3等位基因是野生型并且已经导入了人CD3基因)中分析图31中的品系4HH3,并且检测到对应人CD3分子和对应小鼠Cd3分子。随后,将其与Cd3缺陷小鼠杂交以建立小鼠Cd3等位基因缺陷的和表达人CD3基因的系。
-免疫组织染色分析-
使用抗CD3抗体作为第一抗体检查组织分布。在来自Cd3缺陷小鼠的任何组织中未观察到CD3染色,而对于通过将人CD3基因导入Cd3缺陷小鼠而产生的人CD3置换小鼠观察到与野生型小鼠相当的CD3特异性染色。更具体地,在胸腺(图32A)和脾(图32B)中的T细胞区中观察到特异性染色。在所有组织中,仅在T细胞区中观察到染色,类似于野生型小鼠。此外,在Cd3基因缺陷小鼠中未观察到染色,表明人CD3基因置换小鼠中的染色是由于导入的人CD3基因的表达。此外,主要器官中CD3的检测与野生型相同,未观察到异位染色(表19)。
表19
(8)评估人CD3基因置换小鼠中成熟T细胞的丰度比
使用脾细胞进行FACS分析。从小鼠(12至14周龄,雄性)收集脾脏,并使用70μm筛网分离细胞。通过添加溶血剂(由SIGMA制造)裂解红细胞。使用Fc封闭溶液封闭后,对2×10
成熟T细胞的丰度比
表20
该表显示了对应的标志物呈阳性的细胞相对于脾细胞的表达比(单位%)。除了人CD3s置换小鼠#4HH3之外,每个实验组显示来自四个个体的平均值,并且对于品系#4HH3显示两个个体的表达比。(标准偏差显示在括号中。)ND:未检测到。
[参比例11]评估人CD3基因置换小鼠的免疫功能
(1)检查响应对外来抗原的免疫产生特异性抗体的能力
为了产生针对外来抗原的特异性抗体,必须存在功能性辅助T细胞,其可以与抗原呈递细胞(如树突细胞)表面上的主要组织相容性复合物(MHC)抗原一起呈递的抗原肽结合,并且T细胞必须具有向产生抗体的细胞发出指令以产生合适抗体的功能。检查上述人CD3基因置换小鼠是否携带具有正常功能的辅助T细胞并响应对外来抗原的免疫产生特异性抗体。使用鸡卵清蛋白(OVA)作为致敏抗原和弗氏佐剂进行免疫。以4周的间隔对OVA进行两次免疫。更具体地,通过将每只动物100μg的OVA与完全弗氏佐剂皮下施用于背部区域来进行第一次免疫,并且四周后,通过将抗原与不完全弗氏佐剂皮下施用于背部区域来进行类似的免疫。作为人CD3基因置换小鼠,选择两个系(系编号1C3和8I12),每个系衍生自不同的修饰的ES细胞克隆,并与人CD3ε过表达的小鼠进行比较。此外,作为对照,选择野生型小鼠和Cd3基因缺陷小鼠并进行类似的抗原免疫。
在第二次免疫后一周,在异氟烷麻醉下对动物进行剖腹手术,并且然后通过收集全血并使腹腔静脉出血而实施安乐死。从收集的血液中分离血清,测量OVA特异性IgG1和OVA特异性IgE的浓度(图34)。
结果,从小鼠Cd3缺陷小鼠的血清中未检测到IgG1型和IgE型OVA特异性抗体,而在人CD3基因置换小鼠的两个系中检测到OVA特异性IgG1和IgE,并且它们的水平与野生型小鼠相当。这些结果表明,人CD3基因置换小鼠具有响应外来抗原免疫产生抗体的正常能力。
工业实用性
本发明提供抗癌剂和与另外的抗癌剂组合施用的药物组合物,所述抗癌剂和组合物包含新的多特异性抗原结合分子,其保持BiTE所具有的强抗肿瘤活性和不独立于癌症抗原地引起细胞因子风暴等的优异安全性质,并且还在血液中具有长的半衰期。包含本发明的抗原结合分子作为活性成分的抗癌剂和药物组合物可以靶向表达磷脂酰肌醇聚糖3的细胞和含有这些细胞的肿瘤组织并且引起细胞毒性。向患者施用本发明的多特异性抗原结合分子使得理想的治疗成为可能,所述治疗不仅具有高水平的安全性而且还具有减小的身体负担,并且是高度方便的。
- 用于癌症治疗的诱导细胞损伤的治疗药物
- 具有诱导癌症特异性免疫反应的能力的树突状细胞的制备方法,包含该树突状细胞的用于预防或治疗癌症或者抑制癌症转移的药物组合物及试剂盒(KIT)
