一种微拟球藻ACE抑制肽、制备方法及其应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物活性肽技术领域,尤其涉及一种微拟球藻ACE抑制肽、制备方法及其应用。
背景技术
高血压是一种高发性心血管疾病,影响着全球约10亿成年人的健康。长期高血压会增加心肌梗塞、肾衰竭和中风等疾病的致病风险。近年来,每年有900多万人死于高血压相关疾病。肾素-血管紧张素系统(renin–angiotensin system,RAS)和激肽-一氧化氮系统(kinin–nitric oxide System,KNOS)对人体血压的调节至关重要。
血管紧张素转换酶(Angiotensin Converting Enzyme,ACE)抑制肽又称ACE抑制肽。它能同时作用于血管收缩的肾素-血管紧张素系统(Renin–Angiotensin System,RAS)和血管舒张的激肽释放酶-激肽-系统(Kallikrein–Kinin System,KKS)两个系统,常作为临床上治疗高血压的靶点。当前临床上使用的治疗高血压的药物多针对ACE靶点开发。比如:卡托普利、依那普利和赖诺普利等治疗高血压的药物均是ACE抑制剂,但这些ACE抑制剂大多是合成类药物,服用时常会伴有许多毒副作用:如咳嗽、皮肤瘙痒、味觉紊乱或血压过低。
生物活性肽是由短的氨基酸序列组成,其结构简单、生物穿透性好、易于被细胞吸收,且不容易与其他药物分子结合而产生副作用。藻类因富含不饱和脂肪酸、功能性多糖和多肽等营养物质,在食品和医药中的应用历史久远。近年来藻类蛋白作为植物蛋白的一个新来源而备受欢迎。藻类蛋白可以直接食用,也可以通过水解制备功能性多肽。藻类蛋白生物多肽表现出抗氧化、抗高血压、抗癌等活性功效。
微拟球藻(Nannochloropsis),又称拟微球藻,是一种单细胞绿藻。微拟球藻中富含多不饱和脂肪酸、蛋白质、多糖等营养成分,在水产养殖、食品、医疗保健、化妆品等行业有着广泛的应用前景。拟微球藻的油脂含量可以达到细胞生物量的60%以上,其中二十碳五烯酸(Eicosapentaenoic acid,EPA)含量可达30%。EPA是一种ω-3长链多不饱和脂肪酸,具有降低胆固醇、降低血液粘稠度、增进血液循环的功能。由于生长速度快、生物量高,环境耐受性强,微拟球藻被认为是最具潜力实现大规模培养的产油微藻。近年来越来越多的研究发现藻类蛋白来源的多肽具有抗氧化、抗高血压、抗癌等生物活性。然而,有关拟微球藻中的蛋白质和多肽的应用研究比较有限。近年来对藻类来源的生物多肽的制备、分离纯化和功能筛选的研究越来越多,但鲜有从微拟球藻中分离得到ACE抑制肽的报道。
发明内容
有鉴于此,本发明的目的在于提供一种微拟球藻ACE抑制肽及其制备方法。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种微拟球藻ACE抑制肽,所述微拟球藻ACE抑制肽序列为Pro-Gly-Pro-Ala-IIe-Phe,Gly-Pro-Gly-Pro-Phe-Thr-Val-Phe或Trp-Asp-Pro-Leu-Gly-Phe。
本发明还提供了一种微拟球藻ACE抑制肽提取物,包括序列为Pro-Gly-Pro-Ala-IIe-Phe,Gly-Pro-Gly-Pro-Phe-Thr-Val-Phe和Trp-Asp-Pro-Leu-Gly-Phe的ACE抑制肽。
本发明还提供了一种微拟球藻ACE抑制肽提取物的制备方法,包括以下步骤:
1)将微拟球藻藻粉和水混合超声,静置,在0.1-0.3Mpa高压处理20-40min,调节pH值至5-7,加入纤维素酶酶解得到酶解液;
2)调节酶解液的pH值至10-14后超声水浴提取,离心,收集上清液和沉淀;
3)将离心后得到的沉淀与水混合按步骤2)重复提取1-3次,收集上清液;
4)将步骤2)和3)得到的上清液合并后除杂,第一次调节pH值至2-5,静置,离心,收集沉淀后加水并第二次调节pH值至8-12,在-60~-100℃下预冻,然后冷冻干燥得到微拟球藻粗蛋白粉末;
5)将微拟球藻粗蛋白粉末与水混合搅拌后调节pH值至7-9,加入胰蛋白酶酶解,酶解后离心,收集上清液,除杂,浓缩后冷冻干燥得到拟球藻粗多肽粉末;
6)将微拟球藻粗多肽粉末加水溶解得到微拟球藻粗多肽溶液,依次使用10kDa和3kDa的超滤膜包进行超滤分离,得到分子量<3kDa的微拟球藻ACE抑制肽提取物。
优选的,所述微拟球藻藻粉和水的混合比例为(60-100)g:(600-1000)mL;
步骤1)中所述超声的功率为500W-1000W,所述超声的时间为10-30min;所述静置的时间为8-12h;所述高压处理的温度为100-150℃;
所述纤维素酶的酶活为30-70U/mg,所述纤维素酶的用量为1.5-3g;
所述酶解的温度为30-50℃,所述酶解的时间为1.5-3h。
优选的,步骤2)中所述超声的时间为20-40min;所述水浴提取的温度为30-50℃,所述水浴提取的时间为4-8h;所述水浴提取过程中进行搅拌,所述搅拌的速度为100-300rpm。
优选的,步骤4)中所述静置的温度为2-6℃,所述静置的时间为20-30h;所述冷冻干燥的压力为10-30Pa,所述冷冻干燥的时间为48h-72h。
优选的步骤5)中所述微拟球藻粗蛋白粉末与水的混合比例为(15-25)g:(300-500)mL;所述胰蛋白酶的酶活为2000-3000U/mg,所述胰蛋白酶的用量为0.1-0.3g;所述酶解的温度为40-60℃,所述酶解的时间为4-8h。
优选的,步骤5)中所述浓缩的压力为0.070-0.095MPa,所述浓缩的温度为50~70℃;所述冷冻干燥的压力为10-30Pa,所述冷冻干燥的时间为48h-72h。
优选的,步骤2)、4)和5)中所述离心的速度为6000-8000rpm,所述离心的时间为20-40min。
本发明还提供了一种微拟球藻ACE抑制肽、微拟球藻ACE抑制肽提取物或由微拟球藻ACE抑制肽提取物的制备方法制备获得的微拟球藻ACE抑制肽提取物在制备治疗和/或预防高血压制品中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明制备的多肽能够有效抑制ACE的活性,且该多肽均为小分子肽(氨基酸数小于10个),易于被吸收利用。本发明采用超声辅助、高压蒸汽、纤维素酶解三种方法对微藻进行预处理,提高了粗蛋白溶出率,对大分子蛋白进行初步水解,同时高压蒸汽处理还能消除内源酶对后续外源酶酶解带来的影响。本发明制备得到的多肽PGPAIF、GPGPFTVF、WDPLGF具有很好的ACE抑制活性,且其消化稳定性好,可用于制作降低高血压的辅助治疗或者应用于针对高血压患者的产品的开发。
附图说明
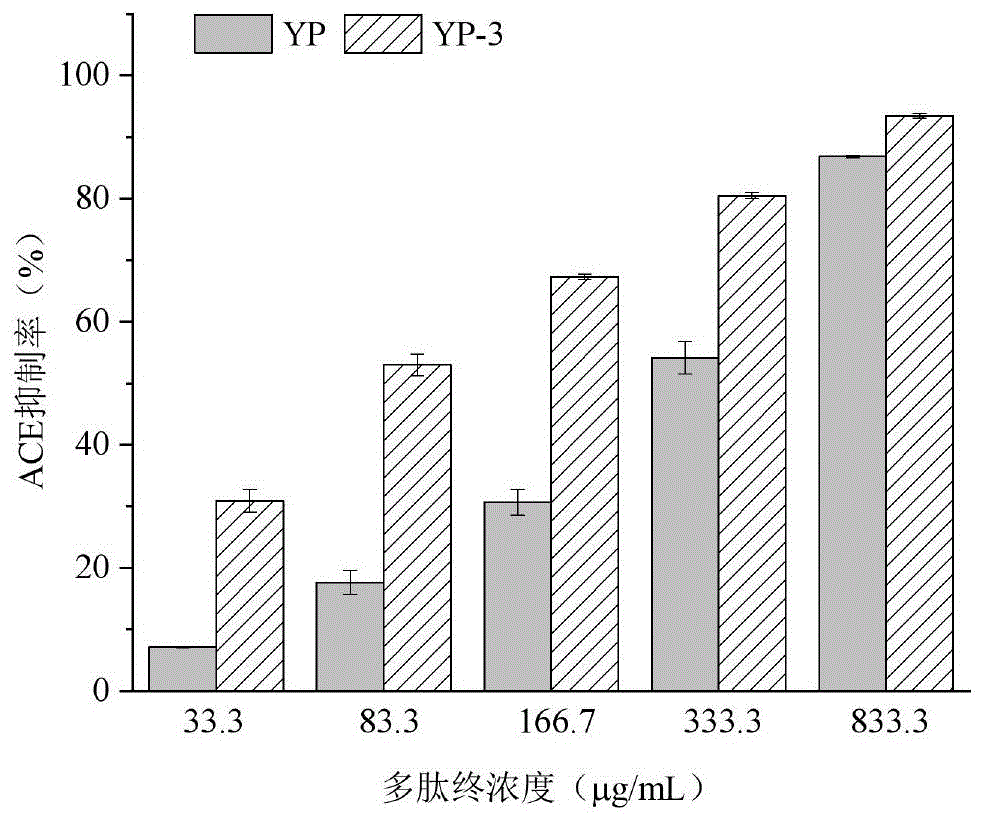
图1超滤前后多肽组分(YP和YP-3)对ACE的抑制活性;
图2筛选多肽的ACE抑制活性;
图3PGPAIF、GPGPFTVF、WDPLGF质谱图;
图4PGPAIF、GPGPFTVF、WDPLGF体外ACE抑制活性;
图5PGPAIF、GPGPFTVF、WDPLGF模拟胃肠消化稳定性。
具体实施方式
本发明提供了一种微拟球藻ACE抑制肽,所述微拟球藻ACE抑制肽序列为Pro-Gly-Pro-Ala-IIe-Phe,Gly-Pro-Gly-Pro-Phe-Thr-Val-Phe或Trp-Asp-Pro-Leu-Gly-Phe。
本发明还提供了一种微拟球藻ACE抑制肽提取物,包括序列为Pro-Gly-Pro-Ala-IIe-Phe,Gly-Pro-Gly-Pro-Phe-Thr-Val-Phe和Trp-Asp-Pro-Leu-Gly-Phe的ACE抑制肽。
本发明还提供了一种微拟球藻ACE抑制肽提取物的制备方法,包括以下步骤:
1)将微拟球藻藻粉和水混合超声,静置,在0.1-0.3Mpa高压处理20-40min,调节pH值至5-7,加入纤维素酶酶解得到酶解液;
2)调节酶解液的pH值至10-14后超声水浴提取,离心,收集上清液和沉淀;
3)将离心后得到的沉淀与水混合按步骤2)重复提取1-3次,收集上清液;
4)将步骤2)和3)得到的上清液合并后除杂,第一次调节pH值至2-5,静置,离心,收集沉淀后加水并第二次调节pH值至8-12,在-60~-100℃下预冻,然后冷冻干燥得到微拟球藻粗蛋白粉末;
5)将微拟球藻粗蛋白粉末与水混合搅拌后调节pH值至7-9,加入胰蛋白酶酶解,酶解后离心,收集上清液,除杂,浓缩后冷冻干燥得到拟球藻粗多肽粉末;
6)将微拟球藻粗多肽粉末加水溶解得到微拟球藻粗多肽溶液,依次使用10kDa和3kDa的超滤膜包进行超滤分离,得到分子量<3kDa的微拟球藻ACE抑制肽提取物。
在本发明中,将微拟球藻藻粉和水混合超声,静置,在0.1-0.3Mpa高压处理20-40min,调节pH值至5-7,加入纤维素酶酶解得到酶解液;所述微拟球藻藻粉和水的混合比例优选为(60-100)g:(600-1000)mL,进一步优选为(70-90)g:(700-9000)mL;所述超声在水浴的条件下进行,所述超声的功率优选为500W-1000W,进一步优选为700W-900W,所述超声的时间优选为10-30min,进一步优选为15-25min;所述静置的时间优选为8-12h,进一步优选为9-11h;所述高压处理的时间进一步优选为25-35min;所述高压处理的温度优选为100-150℃,进一步优选为110-130℃;所述调节pH值前自然冷却至室温,所述调节pH值的溶液优选为氢氧化钠溶液,所述调节pH值进一步优选至5.5-6.5;所述纤维素酶的酶活优选为30-70U/mg,进一步优选为40-60U/mg;所述纤维素酶的用量优选为1.5-3g,进一步优选为1.8-2.6;所述酶解在水浴条件下进行,所述酶解的温度优选为30-50℃,进一步优选为35-45℃;所述酶解的时间优选为1.5-3h,进一步优选为1.8-2.8h;所述酶解过程中进行搅拌,所述搅拌的速度优选为100-300rpm,进一步优选为150-250rpm。
在本发明中,调节酶解液的pH值至10-14后超声水浴提取,离心,收集上清液和沉淀;所述调节酶解液pH值的溶液优选为氢氧化钠溶液;所述调节酶解液的pH值进一步至11-13;所述超声的时间优选为20-40min,进一步优选为25-35min;所述水浴提取的温度优选为30-50℃,进一步优选为35-45℃,所述水浴提取的时间优选为4-8h,进一步优选为5-7h;所述水浴提取过程中进行搅拌,所述搅拌的速度优选为100-300rpm,进一步优选为150-250rpm;所述离心的速度优选为6000-8000rpm,进一步优选为6500-7500rpm;所述离心的时间优选为20-40min,进一步优选为25-35min。
在本发明中,将离心后得到的沉淀与水混合按步骤2)重复提取1-3次,收集上清液;所述提取次数优选为2次。
在本发明中,将得到的上清液合并后除杂,第一次调节pH值至2-5,静置,离心,收集沉淀后加水并第二次调节pH值至8-12,在-60~-100℃下预冻,然后冷冻干燥得到微拟球藻粗蛋白粉末;所述除杂的方式优选为减压抽滤,所述减压抽滤的压力为0.07-0.09Mpa,所述减压抽滤所用滤膜的规格优选为0.45μm;所述第一次调节pH值所用溶液优选为盐酸溶液,所述第一次调节pH值进一步至2.5-3.5;所述静置的温度优选为2-6℃,进一步优选为3-5℃;所述静置的时间优选为20-30h,进一步优选为22-26h;所述离心的速度优选为6000-8000rpm,进一步优选为6500-7500rpm;所述离心的时间优选为20-40min,进一步优选为25-35min;所述第二次调节pH值的溶液优选为氢氧化钠溶液,所述第二次调节pH值进一步至9-11;所述预冻的温度进一步优选为-70~-90℃;所述冷冻干燥的压力优选为10-30Pa,进一步优选为15-25Pa;所述冷冻干燥的时间优选为48h-72h,进一步优选为54-66h。
在本发明中,将微拟球藻粗蛋白粉末与水混合搅拌后调节pH值至7-9,加入胰蛋白酶酶解,酶解后离心,收集上清液,除杂,浓缩后冷冻干燥得到拟球藻粗多肽粉末;所述微拟球藻粗蛋白粉末与水的混合比例优选为(15-25)g:(300-500)mL,进一步优选为(18-22)g:(350-450)mL;所述胰蛋白酶的酶活优选为2000-3000U/mg,进一步优选为2200-2700U/mg;所述胰蛋白酶的用量优选为0.1-0.3g;所述酶解的温度优选为40-60℃,进一步优选为45-55℃;所述酶解的时间优选为4-8h,进一步优选为5-7h;所述酶解过程中进行搅拌,所述搅拌的速度优选为100-300rpm,进一步优选为150-250rpm;所述酶解结束后置于沸水浴加热10-15min,使酶失活,所述加热时间进一步优选为12-14min;所述离心的速度优选为6000-8000rpm,进一步优选为6500-7500rpm;所述离心的时间优选为20-40min,进一步优选为25-35min;所述除杂的方式优选为减压抽滤,所述减压抽滤的压力为0.07-0.09Mpa,所述减压抽滤所用滤膜的规格优选为0.45μm;所述浓缩的压力优选为0.070-0.095MPa,进一步优选为0.080-0.090MPa,更进一步优选为0.085MPa;所述浓缩的温度优选为50~70℃,进一步优选为55-65℃;所述浓缩至上清液体积为原体积的1/4~1/3时停止;所述冷冻干燥前进行预冻,所述预冻的温度优选为-60~-100℃,进一步优选为-70~-90℃;所述冷冻干燥的压力优选为10-30Pa,进一步优选为15-25Pa;所述冷冻干燥的时间优选为48h-72h,进一步优选为54-66h。
在本发明中,将微拟球藻粗多肽粉末加水溶解得到微拟球藻粗多肽溶液,依次使用10kDa和3kDa的超滤膜包进行超滤分离,得到分子量<3kDa的微拟球藻ACE抑制肽提取物。
本发明还提供了一种微拟球藻ACE抑制肽、微拟球藻ACE抑制肽提取物或由微拟球藻ACE抑制肽提取物的制备方法制备获得的微拟球藻ACE抑制肽提取物在制备治疗和/或预防高血压制品中的应用。
在本发明中,所述制品包括治疗和/或预防高血压的药品。
在本发明中,所述制品包括辅助治疗或辅助缓解高血压的食品或保健品。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
ACE抑制肽的制备(YP和YP-3):
取80g微拟球藻藻粉,加入800mL去离子水搅拌均匀,水浴超声辅助处理20min(超声功率800W)后,静置10h。然后将上述混合液于高压(0.20Mpa,120℃)处理30min。自然冷却至室温后,用氢氧化钠调节pH至6.0,加入2.4g纤维素酶(50U/mg),并在37℃下水浴酶解2h,期间以200rpm的速度不停搅拌。上述酶解后的溶液,用饱和氢氧化钠调节pH至12.0,先置于水浴超声辅助处理30min,然后转至水浴提取6h(37℃下,200rpm搅拌)。上述提取液离心(7000rpm离心30min),收集上清液;上述沉淀加入适量去离子水,重复提取1次,收集上清液。合并两次提取上清液,减压抽滤除去杂质(0.45μm,0.08Mpa)。所得滤液用盐酸调节pH至3.0,于4℃下静置24h。将静置后的提取液离心(7000rpm离心30min),收集沉淀;将上述所得沉淀中加入适量去离子水溶解,并用饱和氢氧化钠调节pH至10.0。所得溶液先于-80℃下预冻,然后冷冻干燥(20Pa)60h,得到微拟球藻粗蛋白粉末。取20g上述所得微拟球藻粗蛋白粉末,加入400ml去离子水搅拌均匀,制得0.05g/ml的粗蛋白溶液。调节pH至8.0,加入0.2g胰蛋白酶(酶活2500U/mg),于50℃下水浴酶解6h,酶解期间低速搅拌(200rpm)。上述酶解结束后,溶液置于沸水浴加热12min,使酶失活。所得溶液冷却至室温后,以7000rpm的速度离心30min,收集上清液。上清液减压抽滤除去杂质(0.45μm,0.08Mpa)。将上清液在60℃,0.085MPa的条件下浓缩,待上清液体积浓缩至原体积的1/4~1/3时停止。上述浓缩液所得溶液先于-80℃下预冻,然后冷冻干燥(20Pa)60h,得到微拟球藻粗多肽粉末(即为YP)。将上述所得粗多肽粉末配置成5g/L的溶液,依次使用10kDa和3kDa的超滤膜包进行超滤分离,得到分子量<3kDa的组分(YP-3)。
实施例2
微拟球藻水解物(YP和YP-3)的ACE抑制活性:
取实施例1制备得到的YP溶液和YP-3溶液10μL分别与30μL底物(马尿酰-组氨酰-亮氨酸,HHL,2.5mM)混合均匀,于37℃水浴预热5min;然后加入20μLACE溶液(0.1U/mL),于37℃水浴反应60min;然后加入80μL盐酸溶液(1M)终止反应。对照组和空白组以等体积的硼酸缓冲液(0.1M,pH=8.3)代替样品,空白组在加入ACE溶液之前加入80μL 1M的盐酸。上述所有溶液均采用硼酸缓冲液(0.1M,pH=8.3)作为溶剂。
反应液采用高效液相色谱法进行检测。检测条件为:
色谱柱:C18柱(
其中,A对照——对照组马尿酸的峰面积;A样品——样品组马尿酸的峰面积;A空白——空白组马尿酸的峰面积。
实验结果:如图1所示。当浓度为33.3μg/mL时YP和YP-3对ACE的抑制率为分别为(7.11±0.07)%和(30.90±1.82)%。可见,YP-3的活性明显高于YP。两种多肽对ACE的抑制率均随浓度的增加而增加,并且在低浓度时,YP-3对ACE的抑制率显著高于YP。随着多肽浓度越高,两个组分对ACE的抑制作用均趋于饱和。采用DoseResponse拟合得到YP和YP-3对ACE活性的半抑制浓度(IC
实施例3
YP-3多肽序列鉴定和ACE抑制寡肽的筛选:
采用LC-MS/MS鉴定YP-3多肽的氨基酸序列,将样品溶解于含有0.1%甲酸的超纯水中,并将2μL样品溶液上样于nanoViper C18(AcclaimPepMap100,75μm×2cm)柱。在线色谱分离在EasynLC 1200系统上进行,使用20μL的100%流动相A(含0.1%甲酸的超纯水)进行捕获和脱盐。然后,利用分析柱(AcclaimPepMap RSLC,75μm×25cm C18-2μm
共鉴定出3233条多肽序列,选取序列≤9的寡肽(1151条)为研究对象。依次通过PeptideRanker(≥0.85)、亲水性(Gravy≤1.5)选取潜在生物活性较高且水溶性较佳的多肽,将其与ACE酶(1O8A)进行分子对接,选取(p<0.001),且丰度最高的前8条多肽进行化学合成和后续活性验证,多肽序列见表1。
表1计算机模拟筛选ACE抑制肽的理化特性
实施例4
筛选所得8条多肽的合成及活性验证:
采用固相法合成上述筛选所得8条潜在的具有ACE抑制活性的多肽。固相法合成:委托生工生物工程(上海)股份有限公司将筛选所得8条多肽通过Fmoc固相合成法进行合成,纯度≥95%。合成主要由3个循环组成:去保护、激活和交联、洗脱和脱保护。
活性验证结果:由图2所示,筛选所得8条多肽均表现出不同程度的抑制ACE活性的能力。当各多肽浓度为166.7μg/mL时,FLSQPF、WDPLGF、GPGPFTVF、FTPGTF、GSPLFDPR、FGPLG、FGPIG、PGPAIF对ACE活性的抑制率分别为:(23.70±1.70)%、(64.52±0.65)%、(90.20±0.52)%、(39.04±2.26)%、(60.14±5.81)%、(5.44±0.70)%、(32.83±0.64)%、(78.73±0.26)%。其中,对ACE抑制效果最佳的前三条多肽为PGPAIF、GPGPFTVF、WDPLGF。
实施例5
进一步研究了前述活性最佳的三条多肽PGPAIF、GPGPFTVF、WDPLGF在不同浓度下对ACE的抑制作用。
实验结果:三条多肽的质谱图如图3所示,其对ACE的抑制活性见图4。随着浓度的增加,各多肽对ACE的抑制活性逐渐增加。当多肽浓度为333.3μg/mL时,PGPAIF、GPGPFTVF、WDPLGF对ACE的抑制率分别为84.36±1.33%,97.19±2.49%,73.33±1.54%。并且,以上三条多肽的对ACE的半抑制浓度分别为31.26±1.32μg/mL、32.65±1.16μg/mL、79.22±3.55μg/mL。由于PGPAIF、GPGPFTVF、WDPLGF分子量分别为600.20、820.15、733.20,三条多肽的半抑制浓度换算成μmol/L,以上三条多肽的对ACE的半抑制浓度分别为52.03±2.19μmol/L、39.77±1.42μmol/L、107.96±4.84μmol/L。半抑制浓度越低说明其抑制能力越好。可见,GPGPFTVF对ACE的抑制活性最佳,PGPAIF次之,WDPLGF第三。
实施例6
将PGPAIF、GPGPFTVF、WDPLGF三条活性肽进行体外模拟胃肠消化,研究其对消化酶的稳定性。分别配置1mg/mL的PGPAIF、GPGPFTVF和WDPLGF溶液,然后加入等体积的人工胃液在37℃下模拟胃消化90min,然后再加入等体积人工肠液模拟消化180min。每隔30min取样测定其ACE抑制率。
实验结果:如图5所示。由图5A可知,PGPAIF经过胃液和肠液消化后,ACE抑制活性变化不大,波动范围小于3%,较为稳定。由图5B可知,GPGPFTVF在经胃液消化30min后,其ACE抑制活性上升约15%,随着时间的延长,活性趋于稳定;经肠液消化后,ACE抑制活性有所下降。经胃肠液消化后,ACE抑制活性下降至84.69%。由图5C可知,WDPLGF在经胃液消化30min后,ACE抑制活性上升约15%,随着时间的延长,其ACE抑制活性趋于稳定;继续经肠液消化,60min后其ACE抑制活性上升,随着时间的延长,其ACE抑制活性上升至117.50%,且趋于稳定,波动范围小于20%。
PGPAIF经胃肠消化后,ACE抑制活性保持稳定,WDPLGF经胃肠消化后,ACE抑制率反而有所上升,GPGPFTVF消化稳定性虽然稍差,经胃肠消化后ACE抑制活性下降了15.31%,但下降幅度可以接受。
由以上实施例可知,本发明微拟球藻ACE抑制肽提取物的制备方法得到的微拟球藻ACE抑制肽提取物和分离筛选得到的多肽PGPAIF、GPGPFTVF、WDPLGF对ACE具有良好的抑制作用,且其消化稳定性好,可用于制作降低高血压的辅助治疗或者应用于针对高血压患者的产品的开发。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种血管紧张素转化酶ACE抑制肽及其制备方法
- 一种食源性牛蹄筋ACE抑制肽、果蔬咀嚼片及其制备方法
- 一种用固定化酶生产牡蛎ACE抑制肽的方法
- 一种西兰花蛋白来源的ACE抑制肽、ACE抑制肽酶切代谢产物及其制备方法和应用
- 一种西兰花蛋白来源的ACE抑制肽、ACE抑制肽酶切代谢产物及其制备方法和应用
