大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于植物基因工程技术领域,具体涉及大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用。
背景技术
随着非农业建设用地迅速扩张,废弃物排放量以及农业化肥使用量增加,土壤重金属污染逐渐成为世界性环境问题。镉(Cd)是一种生物毒性很强的重金属,其半衰期非常长,摄入过量会导致肾脏和骨骼的病变(Nawrot等,2006)。
大豆是农业生产上具有较高经济价值的农作物,其含有丰富的蛋白质和油脂,与人类的生活息息相关。然而,大豆极易积累重金属(Wolnik等,1983),这不仅严重影响植物的生长和发育,而且还会通过食物链危及人类的健康。
乙烯响应因子(Ethyleneresponsefactor,ERF)是植物特有的转录因子家族。该转录因子主要参与调控植物的生长发育(Park等.2016;Thagun等,2016;Tan等,2018),在调节植物生物(Lorenzo等,2003)和非生物(Xu等,2006;Zhang等,2010;Huang等,2020)胁迫中起着重要的作用。目前,在水稻、小麦、番茄等植物中ERF类基因的研究较多,至今尚未有报道披露大豆乙烯响应因子在应答镉胁迫中的相关作用。
发明内容
本发明的目的在于提供大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用,具有显著提高烟草对镉的耐受性的特点。
大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用,所述大豆乙烯响应因子GmERF113蛋白的氨基酸序列如1)或2)所示:1)SEQ ID NO:2所示的氨基酸;2)将SEQID NO:2所示的氨基酸序列中的一个或多个氨基酸残基进行取代和/或缺失和/或添加的氨基酸序列;所述多个氨基酸残基的数量≤10。
优选的,通过增加所述大豆乙烯响应因子GmERF113蛋白在所述植物中的含量来提高植物的耐镉胁迫。
本发明还提供了含有大豆乙烯响应因子GmERF113的生物材料在提高植物耐镉胁迫中的应用。
优选的,所述生物材料包括下述A1~A7中的任意一种:
A1:编码权利要求1所述大豆乙烯响应因子GmERF113蛋白的核酸分子;
A2:含有A1所述核酸分子的重组载体;
A3:含有A1所述核酸分子的重组微生物;
A4:含有A2所述重组载体的重组微生物;
A5:含有A1所述核酸分子的转基因植物细胞系;
A6:含有A1所述核酸分子的转基因植物组织;
A7:含有A1所述核酸分子的转基因植物器官;
优选的,A1所述核酸分子的核苷酸序列如SEQ ID NO.1所示。
优选的,所述植物包括单子叶植物和/或双子叶植物。
此外,本申请还提供了一种耐镉性植物的培育方法,包括如下步骤:增加目的植物中大豆乙烯响应因子GmERF113蛋白的含量或促进目的植物中所述大豆乙烯响应因子GmERF113编码基因的表达,得到所述耐镉性植物。
优选的,所述耐镉性植物是通过向所述目的植物中导入所述大豆乙烯响应因子GmERF113的编码基因得到的植物。
优选的,所述大豆乙烯响应因子GmERF113的编码基因的核苷酸序列如SEQ ID NO:1所示。
优选的,扩增所述大豆乙烯响应因子GmERF113的引物,包括正向引物和反向引物;
所述正向引物的核苷酸序列如SEQ ID NO:3所示;
所述反向引物的核苷酸序列如SEQ ID NO:4所示。
有益效果:
本发明提供了大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用,所述大豆乙烯响应因子GmERF113蛋白的氨基酸序列如1)或2)所示:1)SEQ ID NO:2所示的氨基酸;2)将SEQ ID NO:2所示的氨基酸序列中的一个或多个氨基酸残基进行取代和/或缺失和/或添加的氨基酸序列;所述多个氨基酸残基的数量≤10。通过探索大豆乙烯响应因子基因在非生物胁迫条件的表达分析,进一步为转基因技术培育耐镉性大豆新品种奠定基础,不仅有利于揭示大豆的抗镉机制,还可以有效弥补常规育种技术的不足,从而加速大豆抗性新品种的选育进程。实验表明,与野生型烟草相比,将来自Williams82大豆的乙烯响应因子GmERF113导入到烟草中进行镉胁迫后,其在根系中的表达量是野生型根系中该基因表达量的3.8倍。
基于上述技术优势,本发明还提供了一种耐镉性植物的培育方法,通过增加目的植物中大豆乙烯响应因子GmERF113的含量或促进目的植物中所述大豆乙烯响应因子GmERF113编码基因的表达,得到耐镉性植物,具有较高的应用价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
图1为实施例2中大豆乙烯响应因子GmERF113结构域分析图;
图2为实施例3中GmERF113进化树分析图;
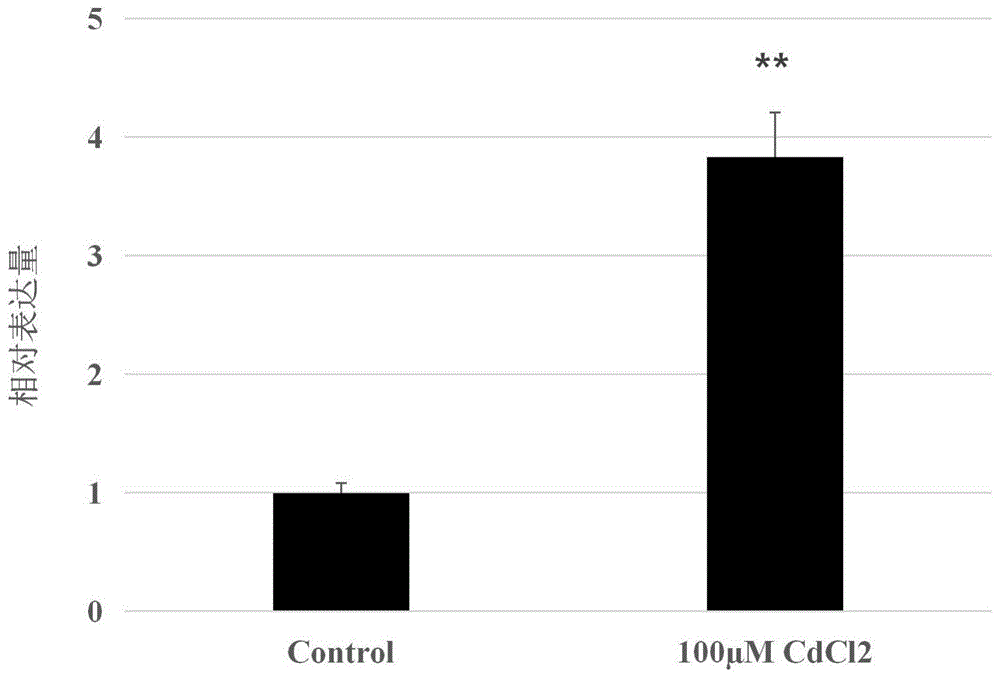
图3为实施例4中CdCl
图4为实施例5中GmERF113基因的过表达载体图;
图5为实施例5中经镉胁迫后植物根长的变化情况;
图6为实施例5中经镉胁迫后植物叶绿素含量的变化情况。
具体实施方式
本发明提供了大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用,所述大豆乙烯响应因子GmERF113蛋白包含261个氨基酸,所述氨基酸的序列如SEQ ID NO:2所示,具体为:MHPINTGDDSTLSSPIPQYGQISNSCLIETQDPSLQPLNQGGNGRKRHYRGVRQRPWGKWAAEIRDPKKAARVWLGTFDTAEAAAAAYDAAALKFKGSKAKLNFPEHVLLPPPPISSSSPPCNNNNNHHSYYYGSSALAPLAPPPQHVYDQTPPPQQQPLLSSSAQEEGFPNLMQYAQLLWSRDDDDLQRIASGLHQHHHHNEAFYDSSSSTLFSSTSTTYSMTVSDQQQNIGDDTSTPKGAEYNYGGCFFRGSDFHDKN*。在本发明中,所述大豆乙烯响应因子GmERF113蛋白的氨基酸序列为:将SEQ ID NO:2所示的氨基酸序列中的一个或多个氨基酸残基进行取代和/或缺失和/或添加且具有转录激活功能、调控植物抗逆性的氨基酸序列,进一步优选为如SEQ ID NO:2所示的氨基酸序列。本发明所述多个氨基酸残基优选为≤10。通过增加所述大豆乙烯响应因子GmERF113蛋白在所述植物中的含量来提高植物的耐镉胁迫。
本发明还提供了含有大豆乙烯响应因子GmERF113的生物材料在提高植物耐镉胁迫中的应用。在本发明中,所述生物材料优选包括下述A1~A7中的任意一种:A1:编码所述大豆乙烯响应因子GmERF113蛋白的核酸分子;A2:含有A1所述核酸分子的重组载体;A3:含有A1所述核酸分子的重组微生物;A4:含有A2所述重组载体的重组微生物;A5:含有A1所述核酸分子的转基因植物细胞系;A6:含有A1所述核酸分子的转基因植物组织;A7:含有A1所述核酸分子的转基因植物器官。
在本发明中,编码所述大豆乙烯响应因子GmERF113蛋白的核酸分子优选为大豆乙烯响应因子GmERF113基因,所述大豆乙烯响应因子GmERF113的核苷酸全长为783bp,所述核苷酸序列优选如SEQ ID NO.1所示,具体为:5’-ATGCATCCAATCAATACTGGTGATGATAGCACCCTTTCTTCACCAATTCC ACAATATGGGCAAATAAGCAATTCTTGCTTGATTGAGACTCAGGACCCATCCCTACAGCCTTTAAATCAAGGAGGAAATGGGAGAAAAAGACATTATAGAGGAGTTAGGCAGAGACCGTGGGGCAAATGGGCTGCCGAAATCCGCGACCCTAAAAAGGCTGCTAGAGTGTGGCTTGGCACGTTTGACACGGCAGAGGCTGCTGCTGCTGCTTATGATGCTGCTGCTTTGAAGTTCAAAGGCTCCAAAGCCAAGCTCAATTTCCCTGAACATGTTCTTCTTCCTCCTCCTCCAATATCATCATCATCACCACCTTGCAATAATAATAATAATCATCATAGTTATTATTATGGTTCTTCAGCTCTTGCACCTCTTGCACCACCACCACAACATGTTTATGATCAAACACCACCACCACAACAACAACCCTTGCTATCATCATCAGCACAAGAAGAAGGGTTTCCAAATCTAATGCAGTACGCGCAGCTTCTTTGGAGTAGGGATGATGATGATCTACAGCGTATTGCTTCAGGCCTTCATCAACATCATCATCACAATGAGGCTTTTTATGATTCAAGTTCTTCAACTTTGTTCTCATCAACTTCCACTACTTATTCTATGACTGTGTCTGATCAACAGCAGAATATTGGAGATGACACGAGTACTCCCAAGGGGGCAGAATATAATTATGGTGGCTGCTTTTTTAGAGGGAGTGATTTTCATGACAAGAATTGA-3’。
在本发明中,用于构建所述重组载体的表达载体的初始载体优选包括质粒,进一步优选为BGV003、pBI121或pCAMBIA,更优选为BGV003。本发明优选包括对所述表达载体进行加工;所述加工优选包括加入具有抗性的抗生素标记物、加入抗化学试剂标记基因或加入可产生颜色变化的酶或蛋白;所述具有抗性的抗生素标记物优选包括卡那霉素标记物或潮霉素标记物;所述抗化学试剂标记基因优选包括抗除草剂bar基因;所述可产生颜色变化的酶优选包括GUS基因;所述可产生颜色变化的蛋白优选包括绿色荧光蛋白(GFP)。
在本发明中,所述重组载体优选包括BGV003-GmERF113。本发明所述BGV003-GmERF113优选将SEQ ID NO.1所示的核苷酸序列导入载体BGV003得到;所述BGV003-GmERF113可以表达SEQ ID NO.2所示的大豆乙烯响应因子GmERF113蛋白。本发明构建所述重组载体时,优选在GmERF113转录起始的核苷酸前加上启动子,所述启动子优选包括组成型、组织特异型、诱导型或增强型。在本发明的实施例中所述启动子为CaMV35S。
本发明用于构建所述重组微生物的初始微生物优选为酵母、细菌、藻或真菌;所述细菌优选为大肠杆菌或根癌农杆菌。本发明所述重组微生物优选通过载体BGV003将所述大豆乙烯响应因子GmERF113导入到初始微生物中得到。本发明对导入的方法没有特殊的要求,采用本领域熟知的技术即可。
本发明所述转基因植物细胞系、转基因植物组织和转基因植物器官优选通过将所述重组微生物导入到目的植物中得到。本发明所述导入的方法优选包括农杆菌转化法、基因枪法或花粉管通道法,如本发明实施例中使用的是农杆菌转化法。
本发明所述植物优选包括单子叶植物和/或双子叶植物,进一步优选为双子叶植物,更优选为烟草。
本发明还提供了一种耐镉性植物的培育方法,包括如下步骤:增加目的植物中大豆乙烯响应因子GmERF113蛋白的含量或促进目的植物中所述大豆乙烯响应因子GmERF113编码基因的表达,得到所述耐镉性植物。
本发明所述耐镉性植物优选为通过向所述目的植物中导入所述大豆乙烯响应因子GmERF113的编码基因得到的植物。在本发明中,所述导入的方法优选包括农杆菌转化法。
本发明所述大豆乙烯响应因子GmERF113的核苷酸序列优选如SEQ ID NO:1所示。在本发明中,扩增所述大豆乙烯响应因子GmERF113的核苷酸序的引物优选包括正向引物和反向引物;所述正向引物的核苷酸序列优选如SEQ ID NO:3所示,具体为:5’-ATGCATCCAATCAATACT-3’;所述反向引物的核苷酸序列优选如SEQ ID NO:4所示,具体为:5’-TCAATTCTTGTCATGAAAATC-3’。
本发明所述目的植物优选包括单子叶植物或双子叶植物,进一步优选为双子叶植物,更优选为烟草。
通过增加目的植物中大豆乙烯响应因子GmERF113蛋白的含量或促进目的植物中所述大豆乙烯响应因子GmERF113编码基因的表达,得到耐镉性植物。实验表明,与野生型植物相比,经镉胁迫后,转入大豆乙烯响应因子GmERF113基因的植物,其根系中大豆乙烯响应因子GmERF113基因的表达量是野生型根系中该基因表达量的3.8倍。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的大豆乙烯响应因子GmERF113蛋白在提高植物耐镉胁迫中的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
除非另有说明,下列实施例中所使用的术语具有本领域普通技术人员通常理解的含义,未注明的实验方法均可按照常规方法进行,例如参照J.萨姆布鲁克(SambrookJ.)和D.W.拉塞尔(RussellD.W.)著《分子克隆实验指南》(科学出版社,2005)或者按照生物试剂生产厂商的使用说明中记载的条件。另外,下列实施例中所使用的仪器、材料、试剂均可通过常规商业手段获得。
实施例1
大豆乙烯响应因子GmERF113的克隆
采用SVTotalRNAlysis试剂盒(Promega公司,美国)提取Williams82大豆根系的总RNA。
按照TaKaRa公司提供的方法,采用PrimeScriptTM逆转录酶合成出cDNA,并以其作为模板进行PCR扩增。根据NCBI中已知的GmERF113序列设计并合成引物,该过程由上海生物工程公司完成,其中上游引物P1和下游引物P2的核苷酸序列分别如下所示:
P1:5’-ATGCATCCAATCAATACT-3’(SEQ ID NO:3);
P2:5’-TCAATTCTTGTCATGAAAATC-3’(SEQ ID NO:4);
通过RT-PCR方法扩增获得GmERF113基因完整的开放阅读框(ORF)片段,具体如下:
PCR反应总体系为25μL,具体如下:含MgCl
PCR反应条件:95℃预变性5min;95℃变性30s,58℃复性45s,72℃延伸1min,30个循环后,72℃延伸10min。
将扩增得到的大约783bp的DNA片段进行琼脂糖凝胶电泳分离,按照凝胶回收试剂盒中提供的方案进行切胶回收得到GmERF113片段,将GmERF113片段克隆到pEASY-T1(Clontech)载体上,转化大肠杆菌进行测序分析,序列如SEQ ID NO.1所示,与NCBI中的序列完全相同。其中,凝胶回收试剂盒购买于杭州爱思进生物技术有限公司,序列由上海invitrogen公司完成。
实施例2
大豆乙烯响应因子GmERF113蛋白结构域分析
使用SMART在线工具对大豆乙烯响应因子GmERF113的氨基酸序列进行分析。结果显示,GmERF113拥有一个AP2结构域,属于AP2家族转录因子(见图1),因此推测GmERF113能参与应答镉胁迫。
实施例3
利用ClustalX软件进行多重序列比对分析。
由图2可以得出:通过与其他植物的同源蛋白GhERF2(Gossypiumhirsutum,AAV51937)、GmERF5(Glycinemax,AEQ55265)、GmERF3(Glycinemax,NP001238300)、GmERF7(Glycinemax,AEQ55266)、AtERF4(Arabidopsisthaliana,NP188139)、GmERF4(Glycinemax,ACE76905)、Pit4(Solanumtuberosum,ACF5785799)、AtERF1(Arabidopsisthaliana,NP188965)、AtERF5(Arabidopsis thaliana,NP568679)、SlERF4(Solanumlycopersicum,NP001234313)的多序列比对后进行系统发育树分析发现,大豆乙烯响应因子GmERF113蛋白与拟南芥(Arabidopsisthaliana)AtERF4和大豆(Glycinemax)GmERF4蛋白同源性最近,它们一同被归为ERF家族第II亚类,此亚类中ERF蛋白含有1个AP2/ERF结构域和一个EAR基序,转基因烟草中GmERF4的组成性表达增加了对盐和干旱胁迫的耐受性,因此推测GmERF113在逆境胁迫中也起着一定的作用。
实施例4
Cd胁迫对GmERF113基因表达的影响
采用半定量PCR的方法检测GmERF113基因在Cd胁迫下的表达模式,具体如下:
选取大小一致、饱满的大豆种子,播于湿润的蛭石中,在光照培养箱内催芽(催芽条件为:温度25℃,空气相对湿度60%~70%)。当幼苗长至两叶一心时,选取生长一致的幼苗移至Hoagland营养液中培养,7d后,再换成用Hoagland营养液配制的镉处理液(终浓度为100μM的CdCl
分别提取CdCl
反转录cDNA的过程如下:取1μg总RNA并加入DNaseI1uL,于室温放置30min以除去基因组DNA的污染;之后加入1μL200mM停止缓冲液(内含50mMEDTA),于70℃加热10min变性DNaseI和RNA;然后按照反转录试剂盒中说明书记载的方法进行反转录,每个样品取1μg总RNA,于42℃反应1h,于70℃加热10min后取出,置于冰上10min,以使反转录酶失活,得到反转录产物,其中DNaseI购买于美国Sigma公司,反转录试剂盒购买于宝生物工程(大连)有限公司。
引物设计如下:半定量PCR的上下游引物为P1和P2,具体序列如SEQ ID NO:3~SEQID NO:4所示;以大豆激动蛋白(GmActin)cDNA作为内参,内参引物为P3和P4,具体序列如下:
P3(actin-F):5’-CGGTGGTTCTATCTTGGCATC-3’(SEQ ID NO:5);
P4(actin-R):5’-GTCTTTCGCTTCAATAACCCTA-3’(SEQ ID NO:6)。
荧光定量PCR扩增的反应体系为20μL,具体如下:10μM的上下游引物各0.8μL,TBGreenPremixExTaqⅡ(2×)10μL,ROX0.4μL,cDNA1μL,灭菌水7μL。
荧光定量PCR扩增反应程序:95℃30s;95℃5s,60℃30s,40个循环。
结果如图3所示,从图3中可以得出,经镉胁迫后,根系中GmERF113基因的表达量显著上升,是对照组根系中该基因表达量的3.8倍。
实施例5
GmERF113基因的植物表达载体的构建及转基因植物对Cd的耐受性检测
(1)植物表达载体的构建:
以GmERF113cDNA全长序列为模板,根据BGV003过表达载体构建试剂盒说明书设计带有15bp末端的引物(其中,BGV003过表达载体构建试剂盒购买自百格基因科技(江苏)有限公司)。
引物的核苷酸序列如下:
P5:5′-CAGTGGTCTCACTCTATGCATCCAATCAATACT-3’(SEQ ID NO:7);
P6:5′-CAGTGGTCTCACTGCTCAATTCTTGTCATGAAAATC-3’(SEQ ID NO:8)。
PCR扩增目标片段并纯化,酶切处理扩增片段,反应体系:10×BufferA0.5μL,InsertDNA50ng,EnzymesA0.5μL,ddH
向上一步反应体系中直接加入如下成分进行连接:EnzymesB0.5μL,BGV0031μL,10×BufferB0.5μL,ddH
取5μL的上述反应液转化大肠杆菌DH5α感受态细胞,将转化后的大肠杆菌DH5α细胞悬液涂布在含有80mg/L氨苄青霉素的平板上,将对抗氨苄青霉素的阳性克隆进行扩增并提取质粒,通过生物公司测序的方法验证连接的正确性,得到植物表达载体BGV003::GmERF113(如图4所示),并将该植物表达载体转入根癌农杆菌EHA105中备用。
(2)根癌农杆菌介导的烟草叶盘法遗传转化与筛选鉴定
在超净工作台中将无菌烟苗叶片剪下,再用灭菌过的不锈钢打孔器避开叶脉把叶片打成圆形小叶盘,将叶盘放入含有目的基因GmERF113的EHA105农杆菌重悬液中侵染8~10min,侵染结束后,用滤纸吸干叶盘表面水分,叶盘正面朝下移入共培养基中,将培养皿用封口膜包好放入25℃培养室中暗培养3d。取出暗培养后的叶片,将其转移到培养基上(MS+1.5mg/L6-BA+0.1mg/LNAA+30mg/L潮霉素+100mg/L头孢)在25℃光照条件下培养。待叶盘周围长出烟草幼芽,将小芽剪出来转移到壮苗培养基(MS+0.1mg/L6-BA+0.01mg/LNAA+30mg/L潮霉素+100mg/L头孢)进行培养。约一周左右后,挑出长出根的烟草苗转移到生根培养基(MS+30mg/L潮霉素+100mg/L头孢)上继续进行培养。
烟草苗PCR鉴定:采用实施例1中提供的方式提取转基因烟草和野生型烟草的基因组DNA,并用GmERF113的特异性引物P1和P2进行PCR扩增。
扩增后收集大约783bp的DNA片段进行琼脂糖凝胶电泳分离,按照凝胶回收试剂盒中提供的方案进行回收,并克隆到pEASY-T1(Clontech)载体上,转化大肠杆菌进行测序分析(由上海invitrogen公司完成),测序结果和NCBI中的GmERF113基因序列完全相同的植株为转基因阳性植株。
将阳性植株移栽于温室盆钵中,收取T2代烟草种子,用于功能分析。
(3)基因功能分析:
将转GmERF113基因的烟草种子(分别记为L1、L2、L3)和野生型烟草种子分别接种于含有20μMCdCl
表1各处理组对植物的相对平均根长的影响
表2各处理组对植物的相对平均叶绿素含量的影响
结合表1和图5可以看出,与未进行镉胁迫的处理相比,经镉胁迫后,野生型烟草的根长显著减少了21%,而虽然L1和L2的根长也有所下降,但差异并不显著;且经镉胁迫后,转基因株系L3的根长反而有些许上升。
结合表2和图6可以看出,与未进行镉胁迫的处理相比,经镉胁迫后,野生型烟草的叶片中叶绿素含量明显下降,而转基因株系L1和L2的叶片中叶绿素含量虽然也有所下降,但差异并不显著,且转基因株系L3的叶片中的叶绿素含量还稍微上升。
由此可见,在经镉胁迫后,植物中的GmERF113基因能够提高烟草对Cd的耐受性。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- NtNRAMP2蛋白的应用、提高烟草对镉胁迫敏感性的方法和获得耐镉胁迫烟草植株的方法
- 大豆ABC转运蛋白基因GmALS3在耐低磷和抗铝毒胁迫植物育种中的应用
