RUNX2多肽突变体在制备评估颅锁骨发育不良患者的试剂盒中的应用
文献发布时间:2024-04-18 19:58:53
本申请是申请日为
技术领域
本公开涉及分子生物学技术领域,具体涉及一种检测样本中RUNX2多肽突变体在制备评估颅锁骨发育不良患者的试剂盒中的应用。
背景技术
骨骼的形成和重建主要是骨祖细胞和软骨祖细胞的分化、增殖和细胞外基质的形成,这些过程离不开一些列相关基因的激活和抑制,转录因子对这些基因起着重要的调控作用。成骨细胞和破骨细胞间的动态平衡是保证牙齿正常萌出的基础,若平衡失调可能会导致牙齿萌出障碍。颅锁骨发育不良(Cleidocranial Dysplasia,CCD)是一种典型的牙齿萌出障碍性疾病,属于累及牙齿和骨骼的常染色体显性遗传性疾病,具有高外显率和不同的表型,有明显的家族聚集性,男女发病率无明显差别。颅锁骨发育不良典型的临床症状包括囟门闭合延迟,颅骨缝增宽,锁骨钙化不良、缺失,锥形胸,耻骨联合增宽而致骨盆发育不良,身材矮小,上颌骨发育不足,有多生牙,乳牙滞留,恒牙萌出延迟等。
RUNX2基因(RUNX家族转录因子2)又称为核心结核因子α1、多瘤病毒增强子结合蛋白或急性髓系白血病因子,其位于人常染色体6p21,长约220kb。RUNX2属于RUNXx相关因子(RUNt-related gene)家族,RUNXx相关因子是一类转录因子的总称,它们都是由α和β亚单位构成的异二聚体,RUNXx家族主要包括RUNX1基因、RUNX2基因和RUNX3基因,RUNX2具有和其他家族成员相似的RUNT结构域。RUNX2是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,RUNX2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最特异性的标志基因,RUNX2包括N端的多谷氨酰胺/丙氨酸重复序列结构域(Q/A)、中部的RUNT结构域以及C端的富含脯氨酸、丝氨酸及苏氨酸的PST结构域。RUNX2基因的错义突变、无义突变、基因插入/缺失突变或者移码突变等都是造成颅锁骨发育不良的重要原因。
虽然现在已有较多颅锁骨发育不良致病与RUNX2基因的研究,但是,目前该疾病致病基因突变的筛选和验证分析工作远远不够,仍存在未知致病基因位点。鉴定新的颅锁骨发育不良的致病基因位点,无论对于疾病早期诊断、管理还是指导优生优育都具有重要意义。因此,本领域迫切需要开发新的颅锁骨发育不良致病基因及其相关的致病突变位点。
发明内容
本公开有鉴于上述现有技术的状况而完成,其目的在于提供一种新的颅锁骨发育不良相关致病基因突变位点。
为此,本公开第一方面提供了一种检测样本中RUNX2基因突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用,所述基因突变为RUNX2 c.1550delT,也即所述基因突变为野生型RUNX2基因的核苷酸序列的第1550位碱基T的缺失。在本公开中,通过RUNX2c.1550delT这一基因突变作为标志物,能够对筛查颅锁骨发育不良患者进行筛查,进而提供了一种检测样本中RUNX2基因突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用。
在本公开第一方面所涉及的应用中,可选地,所述试剂盒可以应用于以下技术的至少一种:DNA测序、限制性酶切片段长度多态性、单链构象多态性、变性高效液相色谱、SNP芯片、微流控芯片技术、TaqMan探针技术和Sequenom MassArray技术。由此,能够应用这些技术对RUNX2基因突变位点进行检测。
在本公开第一方面所涉及的应用中,可选地,所述试剂盒包括用于扩增RUNX2基因的引物对和/或用于检测RUNX2 c.1550delT的探针。由此,能够使用该引物对和/或探针对RUNX2基因进行检测。
在本公开第一方面所涉及的应用中,可选地,所述检测RUNX2c.1550delT的探针根据人基因组中RUNX2基因编码区第1550位碱基的序列进行设计。由此,能够对RUNX2c.1550delT这一突变进行检测。
在本公开第一方面所涉及的应用中,可选地,所述试剂盒还包括dNTPs、DNA聚合酶和PCR反应缓冲液。由此,能够对RUNX2基因进行扩增。
在本公开第一方面所涉及的应用中,可选地,所述试剂盒包括实时荧光定量检测试剂,所述实时荧光定量检测试剂包含用于实时荧光定量检测RUNX2新突变位点基因表达的引物,上游引物的序列包括5’-CTCTTCCCAAAGCCAGAGTG-3’,下游引物的序列包括5’-GCAGACAGCTCACAAAACCAG-3’。
在本公开第一方面所涉及的应用中,可选地,所述样本来自于被检测者的外周血、唾液、组织样本的至少一种,且所述RUNX2基因突变是指RUNX2基因的胚系突变。由此,通过采集被检测者的外周血、唾液或组织样本,能够对被检测者的RUNX2基因的胚系突变进行的检测。
本公开第二方面提供了一种检测样本中RUNX2基因突变的试剂在制备检测颅锁骨发育不良易感性的试剂盒中的应用,其特征在于,所述基因突变为野生型RUNX2基因的核苷酸序列的第1550位碱基T的缺失。
本公开第三方面提供了一种检测样本中RUNX2基因突变的试剂在制备检测与颅锁骨发育不良易相关的单核苷酸多态性或基因型的产品中的应用,其特征在于,所述基因突变为野生型RUNX2基因的核苷酸序列的第1550位碱基T的缺失。
本公开第四方面提供了一种检测样本中RUNX2多肽突变体的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用,其特征在于,所述多肽突变体为RUNX2 p.W518Gfs。
根据本公开,能够提供一种新的颅锁骨发育不良相关致病基因突变。
附图说明
图1是示出了本公开实施例所涉及的先证者的口腔X射线图像。
图2是示出了本公开实施例所涉及的先证者的胸部X射线图像。
图3是示出了本公开实施例所涉及的基因测序峰图。
图4是示出了本公开实施例所涉及的RUNX2结构域。
图5是示出了本公开实施例所涉及的建立的野生型RUNX2蛋白和W518Gfs-RUNX2蛋白的结构模型示意图。
图6是示出了本公开实施例所涉及的RUNX2在不同物种中的序列比对图。
图7是示出了本公开实施例所涉及的先证者的RUNX2基因表达水平检测结果示意图。
图8是示出了本公开实施例所涉及的原位免疫荧光显微镜观察RUNX2野生型和RUNX2 W518Gfs突变的亚细胞定位结果示意图。
图9是示出了本公开实施例所涉及的RUNX2 p.W518Gfs变异诱导的骨钙素启动子活性检测结果示意图。
具体实施方式
以下,参考附图,详细地说明本公开的优选实施方式。在下面的说明中,对于相同的部件赋予相同的符号,省略重复的说明。另外,附图只是示意性的图,部件相互之间的尺寸的比例或者部件的形状等可以与实际的不同。
需要说明的是,本公开中的术语“包括”和“具有”以及它们的任何变形,例如所包括或所具有的一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可以包括或具有没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
另外,在本公开的下面描述中涉及的小标题等并不是为了限制本公开的内容或范围,其仅仅是作为阅读的提示作用。这样的小标题既不能理解为用于分割文章的内容,也不应将小标题下的内容仅仅限制在小标题的范围内。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本公开所属领域中的普通技术人员的一般理解相同的意义。
还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
本技术领域技术人员可以理解,除非特意声明,这里使用的单数形式“一”、“一个”、“所述”和“该”也可包括复数形式。应该进一步理解的是,本公开的说明书中使用的措辞“包括”是指存在所述特征、整数、步骤、操作、元件和/或组件,但是并不排除存在或添加一个或多个其他特征、整数、步骤、操作、元件和/或它们的组。
为便于理解本公开,下面结合附图与具体实施例对本公开作进一步解释说明,且附图或具体实施例并不构成对本公开实施例的限定。本领域技术人员应该理解,附图只是实施例的示意图,附图中的部件并不一定是实施本公开所必须的。
本公开涉及下述任一应用:
一种检测样本中RUNX2基因突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用;
一种检测样本中RUNX2基因突变的试剂在制备检测颅锁骨发育不良易感性的试剂盒中的应用;
一种检测样本中RUNX2基因突变的试剂在制备检测与颅锁骨发育不良易相关的单核苷酸多态性或基因型的产品中的应用;
一种检测样本中RUNX2基因突变在制备鉴定或辅助鉴定与颅锁骨发育不良相关的单核苷酸多态性的产品中的应用;
一种检测样本中RUNX2多肽突变体的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用。
根据本公开的上述应用,能够提供一种颅锁骨发育不良的致病突变位点,有助于辅助筛查颅锁骨发育不良的患者,以便于进行优生优育指导、以及疾病的早期发现、预防与治疗。
在一些示例中,在本公开所涉及的上述应用中,可以通过检测被检测者的外周血、唾液、组织样本的至少一种样本对RUNX2基因进行检测。在一些示例中,被检测者可以为普通人群、疑似颅锁骨发育不良的个体或颅锁骨发育不良的高风险人群。
在一些示例中,可以对RUNX2基因的胚系突变进行检测。胚系突变又叫生殖细胞突变,是来源于精子或卵子等生殖细胞所携带的突变。
在一些示例中,可以通过提取被检测者的gDNA(基因组DNA)并对基因组DNA进行检测,来获得RUNX2基因的胚系突变结果。
在一些示例中,可以对RUNX2基因的第1550位碱基的突变进行检测。进一步地,可以对RUNX2 c.1550delT突变进行检测。RUNX2c.1550delT,也就是指野生型RUNX2基因的核苷酸序列的第1550位碱基T的发生了缺失。
在本实施方式中,通过RUNX2 c.1550delT这一基因突变作为标志物,能够对筛查颅锁骨发育不良患者进行筛查,进而提供了一种检测样本中RUNX2基因突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用。
在一些示例中,被检测者的RUNX2基因中只要存在一个RUNX2c.1550delT突变,就可以辅助诊断被检测者为颅锁骨发育不良患者。换言之,检测到被检测者的RUNX2c.1550delT为杂合突变时,可以辅助诊断该被检测者为颅锁骨发育不良患者。当然,检测到被检测者的RUNX2 c.1550delT为纯合突变时,也可以辅助诊断该被检测者为颅锁骨发育不良患者。
在一些示例中,相应地,RUNX2 c.1550delT这一基因突变导致RUNX2的氨基酸序列也发生了突变,产生了RUNX2 p.W518fs这一氨基酸变异(也可以称为氨基酸突变或多肽突变体)。具体地,RUNX2p.W518fs是指野生型RUNX2基因编码的氨基酸序列的第518位处发生移码突变,氨基酸序列的第518、519、520、521位的色氨酸、精氨酸、脯氨酸、酪氨酸均被替换。在本实施方式中,通过RUNX2 p.W518fs这一氨基酸突变作为标志物,能够对筛查颅锁骨发育不良患者进行筛查,进而提供了一种检测样本中RUNX2氨基酸突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用。
在一些示例中,还可以对除RUNX2 c.1550delT突变外的其他突变位点进行检测。在一些示例中,其他突变可以包括颅锁骨发育不良目前已知的全部致病突变和疑似致病突变。由此,能够对颅锁骨发育不良的相关位点均进行检测,有利于对颅锁骨发育不良进行更加全面的筛查。
在一些示例中,在本公开所涉及的上述应用中,试剂盒的形式可以为试剂或试剂套装的形式。在一些示例中,试剂盒还可以包括仪器所组成的系统。例如,在一些示例中,试剂盒可以是由引物和DNA测序仪组成的系统;由PCR试剂和DNA测序试剂和DNA测序仪组成的系统;由TaqMan探针、PCR引物对、定量PCR仪和进行基因分型的模块以及TaqMan探针技术所需要的其他试剂组成的系统;由探针、PCR引物对以及连接酶检测反应(LDR)所需要的其他试剂和仪器组成的系统;由PCR引物对、单碱基延伸引物、芯片、PCR仪、进行基因分型的模块和/或Sequenom MassArray技术所需要的其他试剂和仪器组成的系统。
在本公开的一具体实施方式中,可以应用Taqman(Thermo Fisher)基因分型平台对RUNX2 c.1550delT进行分型检测。将包含RUNX2c.1550位点区域的DNA模板通过PCR技术扩增,再使用探针进行检测。
在一些示例中,试剂盒可以包括用于扩增RUNX2基因的引物对和/或用于检测RUNX2 c.1550delT的探针。由此,能够对RUNX2c.1550delT这一基因突变进行检测。
在一些示例中,引物对可以是用于捕获/扩增包括RUNX2 c.1550这一区域在内的人类基因组DNA片段的引物或引物对。在一些示例中,引物或引物对在序列上可以没有特殊要求,只要能扩增出包括RUNX2c.1550在内的基因组DNA片段即可。
在一些示例中,探针可以是指用于检测RUNX2 c.1550delT的探针。在一些示例中,探针可根据人基因组中RUNX2 c.1550上下游的核苷酸序列进行设计,探针的序列覆盖人基因组中RUNX2 c.1550delT的核苷酸。
在一些示例中,试剂盒还包括dNTPs(脱氧核糖核苷三磷酸)、DNA聚合酶和PCR反应缓冲液。由此,能够对RUNX2基因片段进行扩增。
在一些示例中,可以采用引物对包括RUNX2 c.1550这一区域在内的基因组DNA片段进行PCR扩增,得到PCR扩增产物。由此,能够将RUNX2基因的编码区第1550位碱基进行捕获与富集。在一些示例中,可以再以得到的PCR扩增产物为模板,采用检测RUNX2c.1550delT的探针对得到的PCR扩增产物的序列进行检测。由此,能够确定RUNX2基因编码区第1550位碱基处是否存在RUNX2c.1550delT的缺失突变。
在一些示例中,试剂盒可以应用于以下技术的至少一种:DNA测序、限制性酶切片段长度多态性、单链构象多态性、变性高效液相色谱、SNP芯片、微流控芯片技术、TaqMan探针技术和Sequenom MassArray技术。换言之,可以使用以下技术的至少一种对样本中的RUNX2基因突变进行检测:DNA测序、限制性酶切片段长度多态性、单链构象多态性、变性高效液相色谱、SNP芯片、微流控芯片技术、TaqMan探针技术和Sequenom MassArray技术。由此,能够应用这些技术对RUNX2基因突变进行检测。
在一些示例中,试剂盒可以包括以下任一种成分:
(a)利用Sequenom MassArray技术确定RUNX2 c.1550delT的多态性或基因型所需的试剂和/或仪器,其包括以下成分的至少一种:PCR引物对、基于单碱基延伸反应的延伸引物、磷酸酶、树脂、芯片、MALDI-TOF(matrix-assisted laser desorption/ionization-time of flight,基质辅助激光解吸附电离飞行时间质谱)和/或Sequenom MassArray技术所需要的其他试剂和仪器。
(b)利用SNP芯片技术确定RUNX2 c.1550delT的多态性或基因型所需的试剂和/或仪器,其包括以下成分的至少一种:基于核酸杂交反应的芯片、基于单碱基延伸反应的芯片、基于等位基因特异性引物延伸反应的芯片、基于“一步法”反应的芯片、基于引物连接反应的芯片、基于限制性内切酶反应的芯片、基于蛋白DNA结合反应的芯片和/或基于荧光分子DNA结合反应的芯片。
(c)利用微流控芯片技术确定RUNX2 c.1550delT的多态性或基因型所需的试剂和/或仪器,其包括以下成分的至少一种:DNA提取微流控模块及试剂、DNA扩增模块及PCR引物对、核酸标记模块及相关试剂、SNP芯片及相关的杂交、洗脱和扫描微流控模块及试剂。
(d)实时荧光定量检测试剂。在一些示例中,实时荧光定量检测试剂可以包括用于实时荧光定量检测RUNX2 c.1550delT的引物,包括上游引物和下游引物。
在一些示例中,用于实时荧光定量检测RUNX2 c.1550delT的上游引物可以是如下a1至a4中的任一种单链DNA:
a1)5’-CTCTTCCCAAAGCCAGAGTG-3’;
a2)在a1的5’端和/或3’端添加一个或几个核苷酸得到的单链DNA;
a3)与a1或a2限定的单链DNA具有85%以上的同一性的单链DNA;
a4)在严格条件下与a1或a2限定的单链DNA杂交的单链DNA;
在一些示例中,用于实时荧光定量检测RUNX2 c.1550delT的下游引物可以是如下b1至b4中的任一种单链DNA:
b1):5’-GCAGACAGCTCACAAAACCAG-3’。
b2)在b1的5’端和/或3’端添加一个或几个核苷酸得到的单链DNA;
b3)与b1或b2限定的单链DNA具有85%以上的同一性的单链DNA;
b4)在严格条件下与b1或b2限定的单链DNA杂交的单链DNA。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。在本实施方式中,“同一性”是指包括与本公开的a1的序列或b1的序列所示的核苷酸序列具有85%或更高,或90%或更高,或95%或更高的同一性的核苷酸序列。同一性可以通过人工或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
在本实施方式中,严格条件是指在2×SSC(柠檬酸钠)、0.1%SDS(十二烷基硫酸钠)的溶液中,在68℃下杂交并洗膜2次,每次5min;又于0.5×SSC、0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min。或者,在0.1×SSPE(saline sodium phosphate EDTA,生理盐水磷酸钠EDTA)、0.1%SDS的溶液中,65℃条件下杂交并洗膜。或者,在0.1×SSC、0.1%SDS的溶液中,65℃条件下杂交并洗膜。
在一些示例中,85%以上同一性,例如可以为85%、90%或95%等的同一性。
在一些示例中,在实际应用中,还可将检测RUNX2 c.1550delT突变的试剂成分与其它成分(其他成分例如可以为检测其它的与颅锁骨发育不良相关的基因突变的试剂成分)联合在一起用于制备筛查颅锁骨发育不良患者的试剂盒。
在一些示例中,在本公开所涉及的上述应用中,RUNX2多肽突变体可以为RUNX2p.W518Gfs。其中,RUNX2 p.W518Gfs是指野生型RUNX2基因编码的氨基酸序列的第518、519、520、521位的色氨酸、精氨酸、脯氨酸、酪氨酸被替换。
在一些示例中,检测样本中RUNX2多肽突变体的所使用的检测方法可以包括以下的至少一种:蛋白质和肽段的序列分析技术,包括N末端序列测定的化学方法Edman法、C末端酶解方法、C末端化学降解法等;与质谱相关的蛋白质检测技术,如基质辅助激光解吸电离/飞行时间质谱测量法(MALDI-TOF MS)和电子喷雾电离质谱测量法(electro sprayion-ization mass spectrometry,ESI-MS);基于抗体的检测方法,例如制备可识别不同突变体的抗体,应用免疫印迹(如western blot)和/或酶联免疫吸附(ELISA)检测蛋白变异。由此,能够对RUNX2多肽突变体进行检测。
下面结合实施例来对本公开提供的检测样本中RUNX2基因突变的试剂在制备筛查颅锁骨发育不良患者的试剂盒中的应用进行详细的说明,但是不应把它们理解为对本公开保护范围的限定。
[实施例]
临床案例:
患者(先证者):出生时正常,没有明显的临床症状。2岁时发现比同龄人生长缓慢。12岁时出现乳牙脱落,至15岁更替3颗牙齿。15岁时患者被临床诊断为颅锁骨发育不良(Cleidocranial Dysplasia,CCD)。临床表现:反应可,智力正常。在患者的体格检查中,观察到典型的颅锁骨发育不良的特征,如前额中线凹陷,肩下垂,身材矮小。
图1是示出了本公开实施例所涉及的先证者的口腔X射线图像,图2是示出了本公开实施例所涉及的先证者的胸部X射线图像。对先证者进行了口腔X线检查,如图1所示,显示混合齿列及乳牙滞留、阻生牙。对先证者进行了胸部X线检查,如图2所示,现右侧三分之二锁骨外侧发育不全,左侧三分之一锁骨外侧发育不全,锥形胸,脊柱侧凸,肋骨变形。
患者父亲,未发现具有颅锁骨发育不良的临床表现。
患者母亲,未发现具有颅锁骨发育不良的临床表现。
家族中其他成员,未发现具有颅锁骨发育不良的临床表现。
样本检测:
颅锁骨发育不良是一种累及骨骼和牙齿的常染色体显性遗传性疾病。采集了先证者及其父亲、母亲的静脉血样,对三人静脉血样的白细胞gDNA(基因组DNA)进行全外显子测序(WES)。具体地,先提取先证者及其父亲、母亲的静脉血样中的基因组DNA片段,然后使用全外显子检测试剂对基因组DNA中全部基因的外显子及其相邻内含子中的50bp的区域进行捕获,捕获后进行扩增和纯化,然后通过Illumina HiSeq测序平台进行测序,最后进行测序数据分析。上述检测和分析均由北京福君基因生物技术有限公司提供。
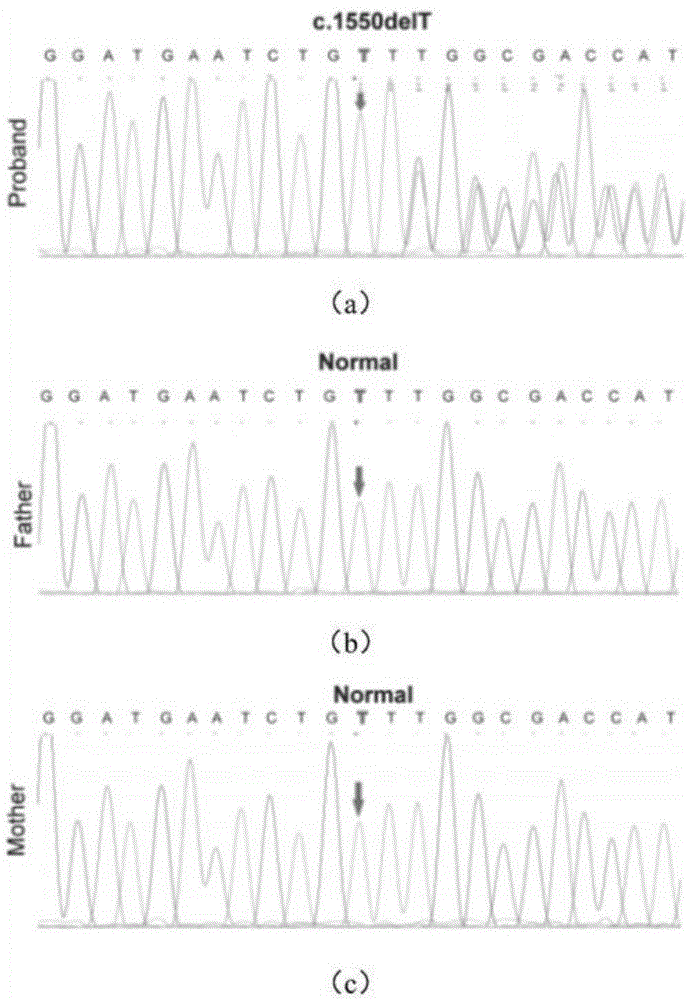
测序的结果如图3所示,图3是示出了本公开实施例所涉及的基因测序峰图,其中,图3的(a)为先证者RUNX2基因的部分序列图,使用箭头显示c.1550delT突变(GenBank登录号:NM_001024630);图3的(b)为父亲RUNX2基因的部分序列图,箭头显示c.1550处为正常未突变的状态;图3的(c)为母亲RUNX2基因的部分序列图,箭头显示c.1550处为正常未突变的状态。如图3所示,先证者检测到RUNX2(c.1550delT)突变体,在其父母中均未检测到,提示患者检测到的RUNX2(c.1550delT)突变体可能是一种有临床意义的新发突变。
功能分析:
(1)功能影响预测:
RUNX2 c.1550delT是一种移码缺失突变,这种移码突变导致RUNX2从氨基酸第518位开始的氨基酸合成发生变化(RUNX2p.Trp518Glyfs),因此,该突变可能对RUNX2蛋白的功能产生影响。
在本实施例中,利用phyer2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对WT-RUNX2(wild-type-RUNX2,野生型RUNX2多肽)和W518Gfs-RUNX2(携带p.W518Gfs突变的RUNX2多肽)的结构构象进行综合分析和预测,图4是示出了本公开实施例所涉及的RUNX2结构域,如图4所示,RUNX2 c.1550delT突变聚集在高度保守的PST域末端的VWRPY,因此,该突变可能会影响RUNX2的蛋白功能。
RUNX2移码突变分析:分别采用线程法和重头预测法对WT-RUNX2和W518Gfs-RUNX2结构构型进行综合分析和预测,并建立WT-RUNX2和W518Gfs-RUNX2结构模型。
另外,还使用SAVE5.0 3D结构查看器(https://saves.mbi.ucla.edu/)来可视化3D结构,图5是示出了本公开实施例所涉及的建立的野生型RUNX2蛋白和W518Gfs-RUNX2蛋白的结构模型示意图。据预测,如图5所示,该位点的突变可能改变蛋白的结构,从而影响RUNX2的蛋白活性。
图6是示出了本公开实施例所涉及的RUNX2在不同物种中的序列比对图。如图6所示,RUNX2的第518位氨基酸这一位点具有跨物种保守性。
(2)功能影响验证:
细胞培养和转染:人胚胎肾293(HEK293)细胞在添加10%胎牛血清(FBS,Gbico,10099141)、青霉素(100IU/mL)和链霉素(100μg/mL)的DMEM培养基(Gbico,C11995500BT)中培养。用LipofectamineTM 2000(Invitrogen公司)将携带所需基因的质粒转染细胞,研究蛋白表达及其他相关研究。
Western blot分析:使用人胚胎肾293(HEK293)细胞研究WT-RUNX2和W518Gfs-RUNX2的表达。在进行Western blotting分析时,将细胞接种在10cm
为了验证RUNX2突变核定位,将pGFP-RUNX2-WT和pGFP-RUNX2-W518Gfs质粒转染到HEK293T细胞中。原位免疫荧光显微镜观察野生型RUNX2和RUNX2 p.W518Gfs突变的亚细胞定位。图8是示出了本公开实施例所涉及的原位免疫荧光显微镜观察RUNX2野生型和RUNX2p.W518Gfs突变的亚细胞定位结果示意图,如图8所示,RUNX2 p.W518Gfs突变和RUNX2野生型均在HEK293T细胞的细胞核中积累,这表明RUNX2 p.W518Gfs突变的亚细胞分隔不受影响。
荧光素酶报告分析:将HEK-293细胞接种到96孔培养板中,10000/孔,加入200ul细胞悬液,于37℃,5%CO
需要说明的是,如无特别指明,本实施例中所使用的试剂或仪器均为市售。
上述结果显示,RUNX2 c.1550delT突变或RUNX2 p.W518Gfs突变会损害RUNX2蛋白的功能。因此,RUNX2 c.1550delT突变是本实施例中的颅锁骨发育不良家系的致病突变。本实施例发现RUNX2c.1550delT是新的颅锁骨发育不良的致病基因,且呈常染色体显性遗传。
此外,对本公开实施例中发现颅锁骨发育不良的患者家系进行了遗传咨询,利于优生优育。
颅锁骨发育不良有不同的表现型,轻症仅有牙齿异常,临床诊断困难,通过基因检测可以进行基因诊断。根据本公开的实施方式,能够提供一种新的颅锁骨发育不良相关致病基因突变位点。由此,能够有利于丰富颅锁骨发育不良致病突变库,从而利于对颅锁骨发育不良进行基因诊断。有助于辅助筛查颅锁骨发育不良的患者,以便于进行优生优育指导、以及疾病的早期发现、预防与治疗。
上述虽然结合附图对本公开的具体实施方式进行了描述,但并非对本公开保护范围的限制,所属领域技术人员应该明白,在本公开公开的技术方案的基础上,本领域技术人员在不需要付出创造性劳动即可做出的各种修改或变形,都应涵盖在本公开的保护范围之内。
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
虽然以上结合附图和实施方式对本公开进行了具体说明,但是可以理解,上述说明不以任何形式限制本公开。本领域技术人员在不偏离本公开的实质精神和范围的情况下可以根据需要对本公开进行变形和变化,这些变形和变化均落入本公开的范围内。
- D-丝氨酸作为标志物在制备抑郁症诊断试剂盒中的应用及抑郁症诊断试剂盒
- 一组蛋白作为肿瘤标志物在制备恶性肿瘤诊断试剂和试剂盒中的用途
- RUNX2基因突变在制备筛查颅锁骨发育不良患者的试剂盒中的应用
- RUNX2基因突变在制备筛查颅锁骨发育不良患者的试剂盒中的应用
