一种猴头菇不溶性膳食纤维包埋葛根素的体内递送微胶囊及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及医药技术领域,尤其涉及一种一种猴头菇不溶性膳食纤维包埋葛根素的体内递送微胶囊及其制备方法和应用。
背景技术
葛根素亦称葛根黄素。是从食药两用植物葛根中分离的具有扩冠作用的黄酮类衍生物,具有扩张脑血管、增加脑血流量、抑制血小板聚集、降低血液黏稠度、改善微循环、退热、镇静、调节脂质代谢等作用,对垂体后叶素引起的急性心肌出血有保护作用。
葛根素在临床上常以口服剂形式用于冠心病心绞痛、高血压、神经性头痛等疾病治疗。由于葛根素在胃肠道液体中的溶解度较低,且经口服进入胃部后,葛根素受胃酸等消化液影响容易发生降解。因此,葛根素的生物利用度通常较低。高剂量服用葛根素容易对肠胃造成刺激和损伤,低剂量服用葛根素又限制了其功效的发挥。
有鉴于此,特提出本发明。
发明内容
为解决上述技术问题,本发明提供一种葛根素微胶囊及其制备方法和应用。所述葛根素微胶囊由葛根素、猴头菇不溶性膳食纤维、海藻酸钠和卡拉胶制备得到,能够减少体内消化液对葛根素的降解,使之在胃阶段释放率较低,而在肠道阶段能够迅速释放,使葛根素在肠道吸收部位达到有效浓度,具有良好的生物利用度,且在肠道缓控释的功能表现良好。
具体的,本发明的技术方案如下:
第一方面,本发明提供了一种葛根素微胶囊,包括葛根素和壁材,所述壁材由包括以下质量份的原料制得:猴头菇不溶性膳食纤维0.30-0.70份,海藻酸钠0.10-0.20份,卡拉胶0.05-0.15份。
膳食纤维(Dietary Fiber,DF)是许多植物性食品和膳食补充剂中的主要成分,包括细胞壁多糖、纤维素、木质素及一些相关的化合物,如酚类化合物,具有降低心血管疾病、代谢综合征、糖尿病、肥胖和癌症的风险,是预防慢性疾病的饮食因素。猴头菇不溶性膳食纤维属于不可溶性膳食纤维(Insoluble Dietary Fiber,IDF)的一种。本发明使用猴头菇不溶性膳食纤维作为主要壁材成分,配合海藻酸钠和卡拉胶,制得葛根素微胶囊。葛根素在猴头菇不溶性膳食纤维的包裹下,可在胃肠道中从纤维基质内在特定部位释放,进而在胃肠道中创造一个持续缓释的环境,其生物活性功效也会相应增加并延长。
由于不溶性膳食纤维具有疏松多孔的结构和粗糙的表面,使小分子活性物质通过吸附或包埋的形式附着在不溶性膳食纤维分子上,可作为构建稳定体系的惰性基质。本发明使用猴头菇不溶性膳食纤维作为主要壁材成分,配合海藻酸钠和卡拉胶,制得葛根素微胶囊,能够减少体内消化液对葛根素的降解,使之在胃阶段释放率较低,而在肠道阶段能够迅速释放,使葛根素在肠道吸收部位达到有效浓度,实现肠道缓控释功能。
另外,本发明所述葛根素微胶囊中,葛根素与猴头菇不溶性膳食纤维的互作下,其晶体结构发生改变,进而提高了葛根素的生物利用度。
优选地,本发明所述壁材由包括以下质量份的原料制得:猴头菇不溶性膳食纤维0.30-0.50份,海藻酸钠0.10-0.15份,卡拉胶0.05-0.1份。
优选地,本发明所述壁材由包括以下质量份的原料制得:猴头菇不溶性膳食纤维0.50-0.70份,海藻酸钠0.15-0.20份,卡拉胶0.1-0.15份。
更优选地,本发明所述壁材由包括以下质量份的原料制得:猴头菇不溶性膳食纤维0.5份,海藻酸钠0.15份,卡拉胶0.1份。
本发明对所述葛根素微胶囊的各原料组分来源不作特别限定,本领域常规市售来源,或者采取本领域一般方法制备得到的相关原料产品均可。
在本发明提供的较为具体的可选实施方式中,所述猴头菇不溶性膳食纤维经碱提取法、复合酶提取法或超声辅助提取法制备得到。
优选地:
所述猴头菇不溶性膳食纤维的持水力为4.50-6.80g/g;
和/或,所述猴头菇不溶性膳食纤维的膨胀率为12.00-14.00mL/g;
和/或,所述猴头菇不溶性膳食纤维的持油力为2.20-3.10g/g;
和/或,所述猴头菇不溶性膳食纤维的肠环境胆固醇吸附力为4.30-8.50mg/g;
和/或,所述猴头菇不溶性膳食纤维的胃环境胆固醇吸附力为1.80-4.60mg/g;
和/或,所述猴头菇不溶性膳食纤维的葡萄糖吸附力为100.00-160.00mg/g;
和/或,所述猴头菇不溶性膳食纤维的粒径为80-200目,优选为100目。
在本发明所述葛根素微胶囊中,所述葛根素的质量份优选为0.005-0.015份,更优选为0.008-0.012份,更优选为0.01份。
第二方面,本发明提供了一种用于制备所述葛根素微胶囊的方法,包括如下步骤:
S1、将所述猴头菇不溶性膳食纤维、所述海藻酸钠和所述卡拉胶溶于水中,得到预混液A;将所述葛根素溶于乙醇溶液,得到预混液B;将所述预混液A和所述预混液B混合,得到预混液C;
S2、将所述预混液C与CaCl
本发明提供的制备方法工艺简单,适合工业化生成。
优选地,步骤S1所述乙醇溶液的体积百分浓度为4%-6%,更优选为5%;和/或,步骤S2所述CaCl
优选地,步骤S1所述水的用量优选为4-6份;乙醇溶液的用量优选为4-6份;步骤S2所述CaCl
优选地,步骤S1所述预混液A和所述预混液B的混合体积比例为1-2:1-2。
上述优选方案制备得到的微胶囊具有更好的生物利用度及缓释效果。
第三方面,本发明提供了所述葛根素微胶囊,或者所述制备方法制备得到的葛根素微胶囊在制备缓释药物或功能性食品中的应用。
有益效果:
本发明提供了一种葛根素微胶囊及其制备方法和应用。所述葛根素微胶囊由葛根素、猴头菇不溶性膳食纤维、海藻酸钠和卡拉胶制备得到。本发明所述葛根素微胶囊改变了葛根素的晶体结构,提高了葛根素的生物利用度,延缓了葛根素的抗氧化特性。同时,本发明所述葛根素微胶囊能够减少体内消化液对葛根素的降解,使之在胃阶段释放率较低,而在肠道阶段能够迅速释放,使葛根素在肠道吸收部位达到有效浓度,实现肠道缓控释功能。
附图说明
为了更清楚地说明本发明或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图进行说明。
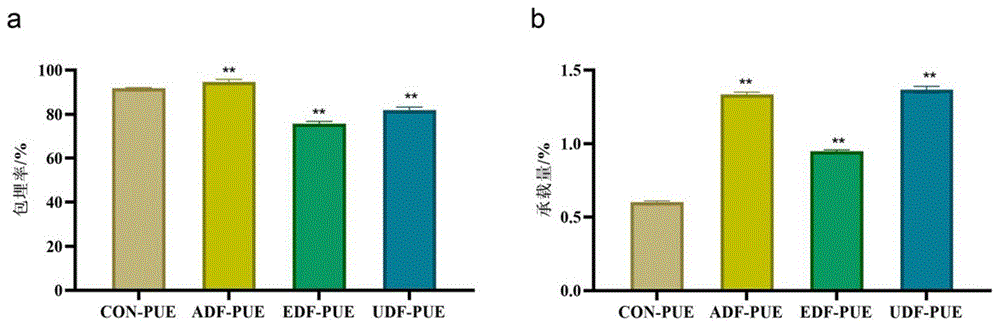
图1为本发明实施例4中不同壁材包埋的葛根素微胶囊的包埋率和包埋效率实验结果。其中,a图为包埋率结果,b图为包埋效率结果。图1中各图从左到右依次为空白组(CON-PUE)、碱法所提取的猴头菇不溶性膳食纤维包埋葛根素(ADF-PUE)、复合酶法所提取的猴头菇不溶性膳食纤维包埋葛根素(EDF-PUE)和超声辅助法所提取的猴头菇不溶性膳食纤维包埋葛根素(UDF-PUE)。
图2为本发明实施例4中不同壁材包埋的葛根素微胶囊的抗氧化性能实验结果。其中,a图为DPPH自由基清除率结果,b图为ABTS自由基清除率结果。图2中各图从左到右依次为消化前空白组(CON-PUE)、消化前碱法所提取的猴头菇不溶性膳食纤维包埋葛根素(ADF-PUE)、消化前复合酶法所提取的猴头菇不溶性膳食纤维包埋葛根素(EDF-PUE)、消化前超声辅助法所提取的猴头菇不溶性膳食纤维包埋葛根素(UDF-PUE)、消化后空白组(CON-PUE)、消化后碱法所提取的猴头菇不溶性膳食纤维包埋葛根素(ADF-PUE)、消化后复合酶法所提取的猴头菇不溶性膳食纤维包埋葛根素(EDF-PUE)和消化后超声辅助法所提取的猴头菇不溶性膳食纤维包埋葛根素(UDF-PUE)。
图3为本发明实施例4中不同壁材包埋的葛根素微胶囊的模拟体外消化的释放率实验结果。其中包括:葛根素(PUE)、空白组(CON-PUE)、碱法所提取的猴头菇不溶性膳食纤维包埋葛根素(ADF-PUE)、复合酶法所提取的猴头菇不溶性膳食纤维包埋葛根素(EDF-PUE)和超声辅助法所提取的猴头菇不溶性膳食纤维包埋葛根素(UDF-PUE)。
图4为本发明实施例4中不同材料的扫描电镜图像。其中包括:葛根素(A和B)、海藻酸钠(C和D)、卡拉胶(E和F)、超声辅助提取法所得猴头菇不溶性膳食纤维(G和H)、不添加不溶性膳食纤维的葛根素微胶囊(I和J)和添加了不溶性膳食纤维的葛根素微胶囊(K和L)。
图5为本发明实施例4中不同材料的FTIR光谱。其中包括:葛根素(PUE)、海藻酸钠(SA)、卡拉胶(Car)、超声辅助提取法所得猴头菇不溶性膳食纤维(U-IDF)、不添加不溶性膳食纤维的葛根素微胶囊(CON-PUE)和添加了不溶性膳食纤维的葛根素微胶囊(UDF-PUE)。
图6为本发明实施例4中不同材料的XRD曲线图。其中包括:葛根素(PUE)、海藻酸钠(SA)、卡拉胶(Car)、超声辅助提取法所得猴头菇不溶性膳食纤维(U-IDF)、不添加不溶性膳食纤维的葛根素微胶囊(CON-PUE)和添加了不溶性膳食纤维的葛根素微胶囊(UDF-PUE)。
具体实施方式
下面结合实施例对本发明提供的技术方案进行详细说明,但是不能把它们理解为对本发明保护范围的限定。若未特别指明,实施例中所使用的实验方法均为常规方法;所用的材料、试剂等均可从商业途径得到。
本发明实施例中所用到的材料和仪器包括:
98%葛根素纯品(上海麦克林生化科技股份有限公司);卡拉胶(上海麦克林生化科技股份有限公司);海藻酸钠(北京索莱宝科技有限公司);5%的CaCl
猴头菇不溶性膳食纤维,分别采用碱提取法、复合酶提取法、超声辅助提取法制得。
碱提取法IDF:精确称量猴头菇粉末20.0g,按1:20的比例添加浓度为2%的NaOH溶液,搅拌均匀后于40℃恒温水浴浸提2h。以5000r/min的速度对碱液离心10min,复纯水洗涤两次,提取离心沉淀。湿IDF经-20℃预冻后,冷冻干燥48h得到A-IDF,制备的A-IDF密封-20℃保存。
复合酶提取法IDF:精确称量猴头菇粉末20.0g,以1:20的比例添加纯水,搅拌均匀后调节溶液pH=6.0。先加入1.2%的中性蛋白酶于50℃恒温水浴酶解2h;其次加入1.5%的中温a-淀粉酶于65℃恒温水浴酶解2h,酶解完毕后于100℃恒温水浴10min灭酶。以5000r/min的速度对酶解液离心10min,复纯水洗涤两次,提取离心沉淀。湿IDF经-20℃预冻后,冷冻干燥48h得到E-IDF,制备的E-IDF密封-20℃保存。
超声辅助提取法精确称量猴头菇粉末20.0g,以1∶20的比例添加纯水,搅拌均匀后调节溶液6pH=6.0。先加入1.2%的中性蛋白酶于50℃、200W超声2h;其次加入1.5%的中温a-淀粉酶于65℃、200W超声2h,超声完毕后沸水浴10min灭酶。以5000r/min离心10min,复纯水洗涤沉淀,冷冻干燥后得到U-IDF。
表1猴头菇膳食纤维参数
冷冻干燥机(上海-恒科学仪器有限公司,HWS-28);粉碎机(武义海纳电器有限公司,SS-1022);超声波清洗机(昆山市超声仪器有限公司,KQ-500DE);磁力搅拌器(浙江科学仪器有限公司,HS5C);多功能酶标仪(赛默飞世尔科技(中国)有限公司,Multiskan GO);扫描电子显微镜(卡尔蔡司光学(中国)有限公司,Sigma500、Supra55);高速冷冻离心机(上海安亭科学仪器厂,TDL-5000bR);X-射线衍射仪(德国布鲁克AXS公司,BrukerAXSD8Advance);傅里叶红外光谱仪(FTIR)(赛默飞世尔科技(中国)有限公司,美国Nicolet 670)
实施例1
本实施例提供了一种葛根素微胶囊,其制备方法为:
准确称取卡拉胶(Car,0.1g)、海藻酸钠(SA,0.15g)、猴头菇不溶性膳食纤维0.5g(碱法提取的A-IDF)溶于5ml去离子水中,于磁力搅拌器上搅拌均匀(450rpm,25℃,30min),再加入5ml经过常温超声溶有10mg葛根素的5%乙醇溶液,再通过磁力搅拌器搅拌均匀(450rpm,25℃,30min)之后,与10-20ml配置好的5%的CaCl
实施例2
本实施例提供了一种葛根素微胶囊,其制备方法参考实施例1。
本实施例与实施例1的唯一区别在于:猴头菇不溶性膳食纤维选自复合酶法提取的E-IDF。
实施例3
本实施例提供了一种葛根素微胶囊,其制备方法参考实施例1。
本实施例与实施例1的唯一区别在于:猴头菇不溶性膳食纤维选自超声辅助法提取的U-IDF。
实施例4
本实施例以包埋率、抗氧化性以及模拟体内消化释放率为考察指标,对不溶性猴头菇膳食纤维包埋葛根素的微胶囊的特性及微观形态进行实验分析。
一、实验部分
(1)葛根素标准曲线的绘制
称取20.0mg葛根素标准品(北京索莱宝科技有限公司)置于烧杯中,用95%乙醇溶解后转移到50mL容量瓶中,再用95%乙醇进行定容,得到4mg/mL的储备液。分别制备0、0.002、0.004、0.008、0.012、0.016、0.02mg/mL标准溶液。用95%乙醇做空白对照,分别在多功能酶标仪250nm处测定其吸光度。以浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)葛根素微胶囊的装载能力和装载效率的测定
葛根素微胶囊的质量由初始加入的葛根素的质量减去自由葛根素的质量计算得出。50mg的微胶囊溶于1ml的95%乙醇中,经过超声提取40min,后离心10min(4000rpm,4℃)。96孔板每孔吸取200ul上清液于多功能酶标仪250nm检测吸光度,根据标准曲线计算上清液中葛根素的浓度,装载能力和装载效率的计算公式如下:
装载能力=(M
装载效率=(M
其中M
(3)扫描电镜(SEM)分析
采用扫描电子显微镜(Scanning Electron Microscope,SEM)观察并拍摄样品的微观形貌。取少量(葛根素PUE、超声辅助法提取的猴头菇不溶性膳食纤维U-IDF、卡拉胶Car、海藻酸钠SA、微胶囊(CON-PUE、UDF-PUE))样品固定于带有特殊的导电双面胶的样品台上,经离子溅射仪喷金后进行拍摄,加速电压设为电压10.0kV,放大倍数为1500-2500。
(4)X射线衍射(XRD)分析
采用Kα射线衍射仪在2-50°内测定(葛根素PUE、超声辅助法提取的猴头菇不溶性膳食纤维U-IDF、卡拉胶Car、海藻酸钠SA、微胶囊(CON-PUE、UDF-PUE))样品的XRD谱。
(5)傅里叶变换红外光谱(FTIR)分析
通过FTIR观察猴头菇不溶性膳食纤维-葛根素相互作用后猴头菇不溶性膳食纤维-葛根素二级结构的变化。使用真空冷冻干燥机将样品冷冻干燥。将2mg样品(葛根素PUE、超声辅助法提取的猴头菇不溶性膳食纤维U-IDF、卡拉胶Car、海藻酸钠SA、微胶囊(CON-PUE、UDF-PUE))与200mg溴化钾混合,并在玛瑙研钵中研磨制备透明样薄片,压片后进行测定,使用溴化钾作为空白对照。扫描条件设置为:扫描范围为400cm-1-4000cm-1,分辨率量4cm-1,扫描次数为16次。
(6)模拟口腔胃肠道消化分析
参考Minekus等人公开的方法(MINEKUS M,ALMINGER M,ALVITO P,et al.Astandardised static in vitro digestion method suitable for food-aninternational consensus[J].Food Funct,2014,5:1113-1124.),采用静态体外胃肠道模型分别评估葛根素和葛根素微胶囊的体外生物可及性。
先对模拟口腔液、模拟胃液和模拟小肠液进行预热处理。
口服相:将100mg样品固体粉末加入到预热后的模拟口腔液(10ml)中,混合物在37℃,pH 7下孵育5min,恒温摇床(DKZ-450B,中国)的振荡速率设置为100rpm。
胃相:在结束口腔消化后,使用1mol/L的HCL将PH调节至2后加入10ml预热的模拟胃液,在37℃恒温摇床100rpm消化时间2h。
肠期:将胃糜用1mol/L的NaoH调至PH为7,后加入10ml预热的模拟胃液,在37℃恒温摇床100rpm消化时间2h。
生物可及性测定:葛根素的体外生物可及性被认为是胃肠道液体中在混合胶束中溶解的部分。将通过模拟小肠相的混合物在4000rpm下离心10min,在250nm下用紫外-可见光谱测定胶束中葛根素的含量。
生物可及性表示为:
生物可及性(%)=Ma/Ms×100%
其中Ms为胶束分数中葛根素的添加量,Ma为葛根素的添加量。
(7)葛根素微胶囊的抗氧化特性分析
样品对DPPH自由基的清除率参照孙国玉等人公开的方法(孙国玉.铁蛋白—芦丁包埋物的制备与理化性质的研究[D],天津科技大学,2017,19-37.[SUN G Y.Preparationand Physicochemical Property Analysis of Ferritin-rutin Composites[D].TianjinUniversity of Science and Technology,2017,19-37.])。将95%乙醇所得的样品提取液和样品消化液,取100μL样品液加入300μL DPPH乙醇溶液(0.04mg/mL),摇匀。暗处孵育30min后,4000r/min离心10min。取上清液于517nm处测其吸光度。
DPPH自由基清除率按照公式计算:
DPPH自由基清除率/%=(1-(A-A
其中,A 指样品吸光度,A
参考唐玉妹等人公开的方法(唐玉妹.竹笋膳食纤维-多酚复合物的构建及其性能的研究[D].中南林业科技大学,2022.[TANG Y M.The Study on the Construction andPerformance of Bamboo Shoots Dietary Fibers-polyphenol Complex[D].CentralSouth University of Forestry and Technology,2022.])。先按试剂盒将ABTS配成工作液,暗处放置16h。然后用PBS将其稀释至734nm处吸光度为0.70±0.02的ABTS工作液。将样品溶液加入到3mL的ABTS工作液中,混匀,静置30min,于734nm处测定其吸光度。相同体积PBS与ABTS工作液混合,放置30min,测定空白吸光度AC。
ABTS+抗氧化活性按下式计算:
ABTS+清除率(%)=(A
式中,A
(8)统计分析
所有实验均进行3次独立重复实验,实验数据采用SPSS19.0软件进行单因素方差及显著性分析,其中p<0.05视为显著,图像采用GraphPad Prism 9进行绘制。
二、实验结果
(1)葛根素-猴头菇不溶性膳食纤维微胶囊的形成
葛根素溶液在250nm处的回归方程为y=2.7398x+3.4432,R
包埋效率决定了壁面材料保持生物活性小分子在其中空结构内的保留能力。如图1,显示了不同方法提取的猴头菇不溶性膳食纤维包埋葛根素的的包埋效率。所有组的包埋率值均大于75.81%,说明猴头菇不溶性膳食纤维具有良好的包封性能。其中超声辅助提取所得的猴头菇不溶性膳食纤维的葛根素承载量是最高的,达到1.37%,显著高于不添加猴头菇不溶性膳食纤维的葛根素微胶囊。这一现象可能是因为膳食纤维可以在形成复合物过程中为芯材的吸附和固定化提供固体表面。
(2)猴头菇不溶性膳食纤维对葛根素抗氧化作用的延缓自由基是一类含有未配对电子的高活性化学基团,包括活性氧(ROS)、加氧自由基和脂质过氧化物。一旦体内的自由基平衡遭到了破坏,就会对机体造成重大的损害,如脂质过氧化损伤、酶、蛋白质和氨基酸的氧化损伤,并对免疫系统造成破坏。
本发明通过DPPH自由基清除和ABTS自由基清除能力来评价添加和未添加猴头菇不溶性膳食纤维所制备的葛根素微胶囊的抗氧化性能。实验结果如图2所示,葛根素微胶囊的抗氧化活性于消化前和消化后均存在显著性差异(*P<0.05),消化前,与不添加猴头菇不溶性的膳食纤维的抗氧化性相比,添加了猴头菇不溶性膳食纤维的几个组的抗氧化能力均明显降低,这可能是由于部分葛根素被猴头菇不溶性膳食纤维紧密包裹,进入猴头菇不溶性膳食纤维的片层状结构和孔隙中,在制备样液时未能通过研磨将葛根素完全暴露出来溶解于溶剂中,导致测量时抗氧化活性降低。消化后,不添加膳食纤维的葛根素微胶囊比添加了膳食纤维的葛根素微胶囊的抗氧化活性高,有可能与猴头菇不溶性膳食纤维的存在有关系,说明猴头菇不溶性膳食纤维的添加能够避免了葛根素过早释放并且暴露在胃肠消化环境中,使得其酚羟基接受质子的能力下降,进而导致其自由基清除能力的下降。
(3)猴头菇不溶性膳食纤维对葛根素的体内释放率的影响
包埋的目的是保护葛根素免受胃酸的降解和与体内其他成分的相互作用,直到其顺利到达目标吸收部位。
本发明将纳米封装的葛根素置于模拟口腔、胃和肠消化条件下,研究它们从包埋基质中的释放行为以及研究当葛根素暴露于口腔、胃、肠道消化过程中是如何从纳米封装结构中释放的。图3显示了每100毫克粉末样品通过口腔、胃和肠道消化过程转运时释放的葛根素的含量,从微胶囊的释放曲线来看,在胃液中,葛根素的释放分为两个阶段,第一个阶段是葛根素被迅速释放,大约17%的葛根素被释放出,其中不添加膳食纤维的葛根素微胶囊的葛根素释放率甚至达到了约35%,这是因为部分葛根素只是吸附在微胶囊的表面,而不是进入纳米颗粒的内部疏水核心,实验开始后这部分葛根素迅速溶于模拟胃液中。第二阶段是缓慢在胃液中释放,吸附在表面的葛根素已经被完全释放出来,由于微胶囊内外葛根素浓度的差异,包裹在微胶囊内部的葛根素会随着微胶囊自身结构的溶解而逐渐溶解。此外,葛根素是一种弱酸,其溶解度依赖于pH值;溶解度随着pH值的增加而增加。由于在酸性条件下,葛根素溶解度较低的原因,导致微胶囊内部的葛根素在胃液中的溶解速度较慢。又因为膳食纤维基体对葛根素微胶囊的释放有影响,游离的葛根素在口腔、胃肠道中迅速被释放,葛根素-猴头菇不溶性膳食纤维所制备的葛根素微胶囊在胃中的释放率要明显的低于未用猴头菇不溶性膳食纤维包埋的葛根素微胶囊对照组。在模拟肠液中,药物会被突然释放,在2小时内几乎能完全释放。这可能是因为微胶囊壁材和芯材间的氢键断裂,导致葛根素被迅速释放于模拟肠液中。从本实验可以看出,加有猴头菇不溶性膳食纤维的葛根素微胶囊中的葛根素能够通过胃液的损害快速在肠道中释放并迅速达到平衡,而未加膳食纤维的在胃中的释放速度要显著高于添加了膳食纤维的,而在肠道中的释放和平衡则相对较慢,这种现象可能是由于功效分子和基体之间的结合力强度不同所致。此外,猴头菇不溶性膳食纤维可以增加葛根素的溶解速率(分子与载体的相互作用可能会阻碍分子再结晶,导致快速溶解)。由于口服化合物必须溶解在消化液中,游离的葛根素并不能够完全溶于模拟口腔液、胃液、甚至是肠液中,而微胶囊可以提高葛根素的吸收率,特别是在肠道中的溶出率,显著提高了葛根素的生物利用度。同时,比表面积的增加也可能是溶解性提高的一个原因,与后续电镜扫描所得的结果一致。
(4)膳食纤维对葛根素的表观影响
通过扫描电镜分别对游离葛根素、海藻酸钠、卡拉胶、游离的猴头菇不溶性膳食纤维和两种微胶囊的表面形貌进行了表征。图4显示了葛根素独特的形态和猴头菇不溶性膳食纤维的形态特征,游离的葛根素呈大小不规则颗粒,表面光滑的片状晶体,猴头菇不溶性膳食纤维晶体不规则,表面粗糙,呈片层状。在不添加猴头菇不溶性膳食纤维的微胶囊中,有片状葛根素颗粒,呈现表面折叠的大小不规则球形物质漂浮在表面。而添加了猴头菇不溶性膳食纤维的微胶囊,表面光滑,有少许的孔隙。添加了猴头菇不溶性膳食纤维的微胶囊形态发生了显著变化,与游离的葛根素、猴头菇不溶性膳食纤维、卡拉胶以及海藻酸钠不同,说明芯材和壁材的相互作用可能改变了未加工的材料的物理形式,证明了微胶囊的形成。葛根素的加载对猴头菇膳食纤维的形貌和葛根素的结构都有显著的影响,微胶囊让原始葛根素的晶体状结构消失。说明猴头菇不溶性膳食纤维有助于缓解/减少纳米颗粒的团聚/生长。同时,也可能是因为该实验选取的猴头菇不溶性膳食纤维是通过超声辅助法提取所得的,而超声辅助提取过程中酶的水解对其淀粉和蛋白质的降解作用进而导致不溶性膳食纤维具有疏松、片层状的网络结构、折叠结构被打开,使得其能够更好的与葛根素紧密结合,让游离的葛根素的嵌入猴头菇不溶性膳食纤维的片层状结构和孔隙中,增加了葛根素与猴头菇不溶性膳食纤维的接触面积,增强了猴头菇不溶性膳食纤维的包埋效果。
(5)葛根素通过与膳食纤维形成氢键进行修饰
傅里叶红外光谱可以研究壁材与芯材之间的相互作用,以及壁材与壁材之间的相互作用。图5列出了葛根素、卡拉胶、海藻酸钠、猴头菇不溶性膳食纤维、以及微胶囊的光谱图。1631.48cm
(6)用猴头菇不溶性膳食纤维配制的微胶囊改变葛根素晶体
分别对游离葛根素、海藻酸钠、卡拉胶、游离的猴头菇不溶性膳食纤维和两种微胶囊进行XRD分析,各自的XRD模式如图6所示。葛根素在10-35°范围内2θ值为6.46°、11.64°、18.99°、19.62°、23.39°处显示出多个尖锐的和特征性的强衍射峰,表明了它高度结晶状态。而猴头菇不溶性膳食纤维则表现为无衍射峰的宽频带聚合物,表明其为无定形的化合物。葛根素的特征峰在含有猴头菇不溶性膳食纤维的葛根素微胶囊中几乎消失,说明葛根素在猴头菇不溶性膳食纤维的葛根素微胶囊中含有葛根素或葛根素的无晶化,形成了典型的无定形X射线衍射图谱。相比之下,不添加猴头菇不溶性膳食纤维的葛根素微胶囊则保留了一定的葛根素晶体衍射峰,表明葛根素未被完全包封。配合物的整体非晶体形式是一个很好的属性,能够使得结晶物质的晶格能减弱,进而使得结晶物质的溶解度提高。用膳食纤维配制的微胶囊破坏了葛根素晶体,从而导致葛根素的晶格能的降低,进而提高了葛根素的溶解度,因此膳食纤维具有较高的表面无序度可能是使晶体物质结晶度降低和饱和溶解度升高原因。相应晶体的非晶结构引起的化学势增加也是其水溶性提高的原因之一,在溶解过程中,不发生相变的非晶固体比晶体形式具有更高的瞬态溶解度,微囊化使得葛根素从其高度结晶的晶体结构向非晶体结构转变,进而使得包埋后的葛根素的水溶性增强,这与模拟体内释放的结果一致。
具有晶体形式的功效成分在胃肠道液体中的溶解度较低,这通常会导致其口服生物利用度较低,而复合材料中结晶度的降低增加了其水溶性,这成为提高生物利用度的先决条件。研究结果表明,添加有猴头菇不溶性膳食纤维的葛根素微胶囊在消化液中的溶解速率被提高可能是由于微胶囊制备过程中葛根素颗粒与膳食纤维基体的相互作用所致。因为疏水化合物的非晶型比结晶形式具有更高的溶解速率、溶解度和生物可及性,使得添加了膳食纤维的微胶囊比原始材料的生物可及性更高。
综上,本发明提供的葛根素微胶囊中,葛根素的晶体结构在制作成葛根素-猴头菇不溶性膳食纤维微胶囊后发生转变,葛根素晶体结构的特征峰减弱或是消失,且在消化前后的抗氧化活性均被减弱,表明猴头菇不溶性膳食纤维的添加形成了更有利于溶解、吸收的微胶囊包埋体系,从而有利于提高葛根素生物利用度。同时,本发明发现含有猴头菇不溶性膳食纤维的微胶囊中葛根素在胃阶段释放率较低,在肠道阶段能够快速释放,使葛根素迅速达到有效浓度,实现肠道缓控释功能。研究结果表明提高葛根素的水溶性可以显著提高其生物可及性,猴头菇不溶性膳食纤维的添加在葛根素包埋体系形成中和提高葛根素的生物利用度中发挥了重要作用。因此,基于不溶性膳食纤维的葛根素微胶囊可能是一种提高葛根素生物利用率的很好的选择。这为葛根作为一种保健产品的研究和开发提供了基础。
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 一种包埋钙盐微胶囊及其制备方法和应用
- 一种基于不溶性膳食纤维的微胶囊递送系统
- 基于香菇可溶性膳食纤维的益生菌递送微胶囊及制备方法
