沙门氏菌噬菌体RDP-SA-17119及其应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于食品安全领域,尤其涉及一种沙门氏菌噬菌体RDP-SA-17119及其应用。
背景技术
肠炎沙门氏菌(Salmonella enteritidis)可感染人和动物。肠炎沙门氏菌是食源性疾病暴发的主要原因,感染后的畜禽可将细菌传至其制品,与其他食物交叉感染造成食源性疾病传播。抗生素是主要的抗菌药物,但因抗生素广泛使用,细菌的耐药性正逐渐显现。在全球替抗的背景下,开发新型抗菌药物成为热点研究方向。噬菌体是细菌的天然杀手,数量丰富、分布广泛。噬菌体侵入细菌体内进行自身繁殖,通过释放酶类物质裂解细菌,释放子代噬菌体。因抗生素耐药特异性与细菌互作性在多数细菌物种中的发展传播,噬菌体疗法再次受到人们的关注,并应用于动物和人类的食源性、环境病原体的生物控制。对噬菌体生物学和遗传学的深入研究,有助于探索噬菌体的进化规律并更好地解释其与宿主细菌相互作用的分子机制。
噬菌体是生物界最丰富的生物群体,能够感染细菌并进行复制,具有杀菌特异性强、开发成本低、易于分离、自我限制、副作用少以及可杀灭耐药性菌株等潜在优点。近年来抗生素耐药危机使噬菌体疗法再次成为研究热点,但其疗效可能受到以下因素的制约:(1)免疫原性,(2)噬菌体抗性,(3)抗菌谱较窄。鉴于抗生素耐药性增加及单独使用噬菌体的局限性,噬菌体和抗生素联合应用可能是更加合理且有效的方法。但是针对肠炎沙门氏菌,未见相关噬菌体和抗生素联合应用的报道。
发明内容
本发明针对肠炎沙门氏菌缺乏行之有效的噬菌体和抗生素联用方法的技术问题,提出一种沙门氏菌噬菌体RDP-SA-17119及其应用。
为了达到上述目的,本发明采用的技术方案为:
沙门氏菌噬菌体RDP-SA-17119,其分类学命名为沙门氏菌噬菌体,保藏编号为CGMCC No.45263,于2022年8月31日保藏于中国微生物菌种保藏管理委员会普通微生物中心。
在一实施方式中,所述沙门氏菌噬菌体RDP-SA-17119具有一多面体立体对称的头部及与所述头部相连的尾部,所述头部内包裹核酸,所述头部直径为50nm,所述尾部长度为120nm。
在一实施方式中,沙门氏菌噬菌体RDP-SA-17119的全基因组长度为42908bp,其基因序列如SEQ ID No.1所示。
在一实施方式中,通过将所述沙门氏菌噬菌体RDP-SA-17119与不同抗生素联合使用,降低抗生素对肠炎沙门氏菌的抑菌浓度。
在一实施方式中,所述不同抗生素包括阿米卡星、头孢曲松钠、头孢噻肟钠、氨苄青霉素和阿莫西林。
一种沙门氏菌噬菌体RDP-SA-17119在裂解食品中肠炎沙门氏菌、鼠伤寒沙门氏菌、斯坦利沙门氏菌、鸡白痢沙门氏菌、不在A-E群沙门菌、甲型副伤寒沙门氏菌、乙型副伤寒沙门氏菌、山夫登堡沙门氏菌以及肯坦基沙门氏菌中的应用。
饲料添加剂,包含上述任一实施方式所述的沙门氏菌噬菌体RDP-SA-17119。
消毒剂或清洁剂,包含上述任一实施方式所述的沙门氏菌噬菌体RDP-SA-17119,用于防治禽类养殖环境中的肠炎沙门氏菌污染。
在一实施方式中,所述消毒剂或清洁剂的剂型为液体、冻干粉或片剂。
与现有技术相比,本发明的优点和积极效果在于:
1、本发明提供一种沙门氏菌噬菌体RDP-SA-17119,该噬菌体的酸碱稳定性和热稳定较强、裂解率较高、较宽的裂解谱、对宿主生长的抑制时间较长、不含有毒力基因和溶原性基因、含多个裂解酶的基因;
2、本发明提供一种沙门氏菌噬菌体RDP-SA-17119,该噬菌体能够与不同种类抗生素进行联合使用,二者协同增效,从而显著降低抗生素的最低药敏浓度(MIC),减少抗生素的使用量;
3、本发明提供一种沙门氏菌噬菌体RDP-SA-17119能够用于裂解食品中的多种病原菌,还能够作为饲料添加剂、消毒剂或清洁剂,从而防治禽类养殖环境中的病原菌。
附图说明
图1为本发明所提供的沙门氏菌噬菌体RDP-SA-17119的电镜图;
图2为本发明所提供的沙门氏菌噬菌体RDP-SA-17119的热稳定性曲线;
图3为本发明所提供的沙门氏菌噬菌体RDP-SA-17119的酸碱稳定性曲线;
图4为本发明所提供的沙门氏菌噬菌体RDP-SA-17119遗传稳定性曲线;
图5为本发明所提供的沙门氏菌噬菌体RDP-SA-17119的一步生长曲线;
图6为本发明所提供的沙门氏菌噬菌体RDP-SA-17119对宿主裂解曲线;
图7为本发明所提供的沙门氏菌噬菌体RDP-SA-17119的存储稳定性试验测定结果。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为了更清楚详细地介绍本发明实施例所提供的沙门氏菌噬菌体RDP-SA-17119及其应用,下面将结合具体实施例进行描述。
实施例1
本实施例为沙门氏菌噬菌体RDP-SA-17119的分离与鉴定过程,具体为:
(1)致病性肠炎沙门氏菌S7(简称“S7”)的分离及其鉴定:
从山东潍坊发病养殖鸡场采样,无菌操作取病鸡肝脏,在选择性培养基(SS琼脂培养基)上划线,37℃培养18-24h后,在培养基上形成圆形、扁平、边缘整齐、表面光滑湿润的黑色菌落,挑取典型菌落继续划线纯化3次,然后挑取单菌落接种于5mL LB肉汤中,37℃,200rpm振荡培养8h,得到均匀浑浊的细菌悬浮液。再通过16sRNA分子鉴定确定为沙门氏菌属,进一步通过PCR和血清鉴定确定其肠炎沙门氏菌,进一步通过PCR检查,发现S7含有多个毒力基因,具有较强的致病感染力。根据实验室命名规则将其命名为S7,用20%的甘油保存于-80℃冰箱。
(2)噬菌体分离及鉴定:
(2.2)肝脏处理:取病鸡肝脏1-2g置于灭菌后的离心管中,加入3个钢珠后研磨2min,加入1-2mL生理盐水,10000rpm,5min离心,取上清液过0.22μm滤器,收集过滤清液备用。
(2.2)制备混合菌悬液:取0.2mL菌悬液和0.3mL过滤液加入5mL LB肉汤中,37℃,200rpm振荡培养过夜,然后10000rpm,5min离心,取上清液过0.22μm滤器,收集过滤清液备用;
(2.3)噬菌体分离:采用双平板法分离噬菌体,取混合菌悬液过滤液0.3mL和S7菌悬液0.1mL混合均匀后,37℃水浴10min,然后铺双平板,37℃培养8-12h后,观察结果。若有噬菌体,平板上会有透亮噬菌斑。挑取单个噬菌斑于1mL生理盐水中,37℃水浴10min后,10000rpm,5min离心,将上清液过0.22μm的滤器,取0.1mL过滤液和0.2mL菌悬液37℃水浴10min,铺双平板,37℃培养箱培养8-12h纯化,照此步骤纯化3-4次,至噬菌斑大小均匀为止,得到一株噬菌体,将其命名为RDP-SA-17119。RDP-SA-17119在双平板形成的噬菌斑直径在2mm-3mm。
(3)噬菌体保藏:
将噬菌体增殖液与40%的甘油按照1:1的比例混合均匀后,于液氮中保存。
实施例2
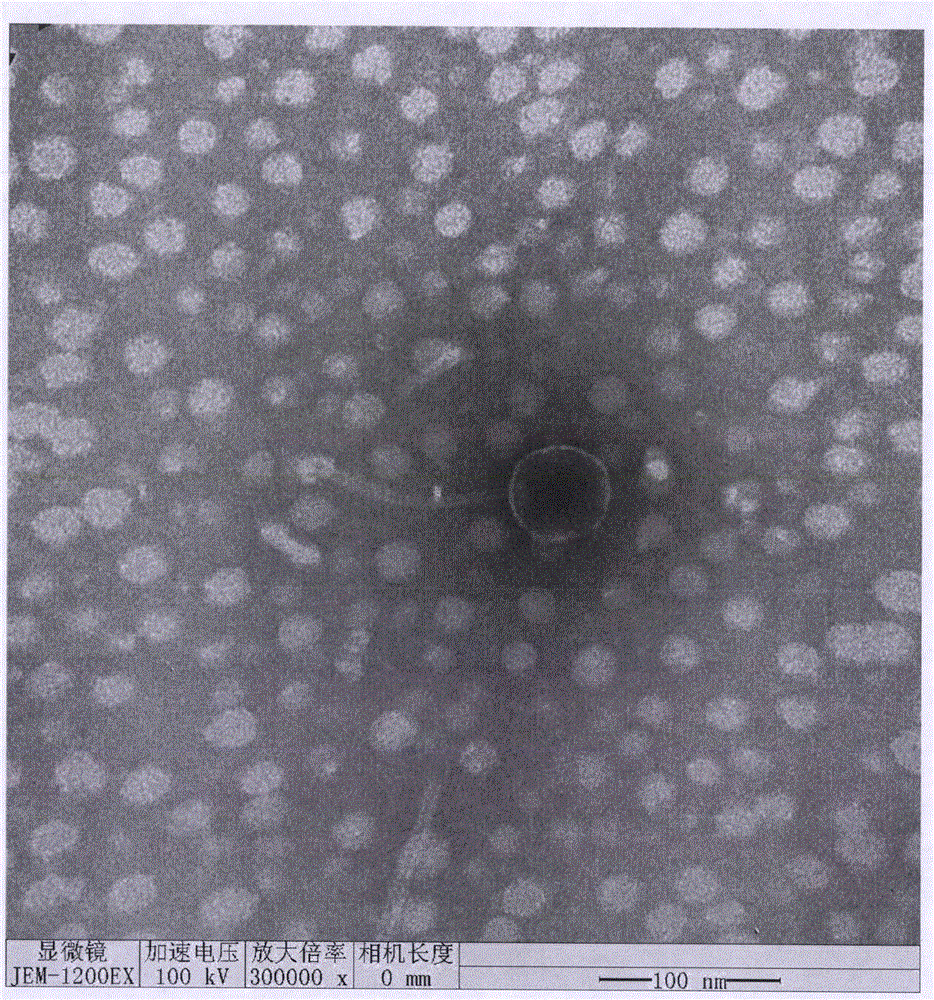
本实施例为沙门氏菌噬菌体RDP-SA-17119的电镜观察,具体为:
取20μL含噬菌体粗制颗粒的液体滴于铜网上,自然沉淀15min,并用滤纸从侧面吸去多余液体,加一滴2%的磷钨酸(PTA)于铜网上对噬菌体染色10min,然后用滤纸从侧面吸去染色液,待样品干燥后用电子显微镜观察噬菌体形态。
如图1所示,沙门氏菌噬菌体RDP-SA-17119具有一个多面体立体对称的头部,包裹着核酸,直径约61nm,有尾。
实施例3
本实施例为噬菌体RDP-SA-17119热稳定性的测定,具体为:
将噬菌体原液分装到50毫升灭菌离心管中,分别在35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、80℃和90℃的条件下孵育30min和60min,然后用生理盐水10倍梯度稀释后,铺双平板测定其效价。
沙门氏菌噬菌体RDP-SA-17119热稳定性曲线如图2所示,由图2可知随温度的升高和时间的延长,该噬菌体效价逐渐下降,在50℃条件下处理30min和60min,该噬菌体效价仅下降1个数量级,效价仍然在10
实施例4
本实施例为沙门氏菌噬菌体RDP-SA-17119的酸碱稳定性测定,具体为:
用稀盐酸和稀NaOH溶液调节生理盐水的酸碱度,配成pH值为2、3、4、5、6、7、8、9、10、11、12的缓冲液,再用配置好的缓冲溶液将噬菌体稀释成1*10
该噬菌体酸碱稳定性曲线如图3所示,在pH为5~9的条件下,37℃培养1h后,其效价仅下降1个数量级,效价仍保持在10
实施例5
本实施例为沙门氏菌噬菌体RDP-SA-17119的稳定性遗传实验,具体为:
将沙门氏菌噬菌体RDP-SA-17119连续传代30次,每代培养基中加入等量的沙门氏菌噬菌体RDP-SA-17119和肠炎沙门氏菌S7,每代培养时间6h,然后铺双平板,测定其效价。
沙门氏菌噬菌体RDP-SA-17119遗传稳定性曲线如图4所示,将RDP-SA-17119连续传30代后,测定其效价,其效价稳定在10
实施例6
本实施例为沙门氏菌噬菌体RDP-SA-17119生长曲线的绘制过程,具体为:
取对数生长期的肠炎沙门氏菌悬液,按照最佳感染复数的比例接种肠炎沙门氏菌S7和沙门氏菌噬菌体RDP-SA-17119,在37℃的条件下,水浴10min,然后常温下12000r/min离心5min,弃上清液,除去未吸附在宿主上的游离噬菌体,如此用LB肉汤培养基洗涤两次。再将沉淀重悬于37℃的LB肉汤培养基中,迅速置于37℃,200r/min的摇床中振荡培养并计时。定时取样测定其效价,以时间为横坐标,噬菌体效价对数值为纵坐标,绘制生长曲线,得出噬菌体的潜伏期、裂解期,并计算出平均裂解量,计算公式如下:
平均裂解量=暴发末期噬菌体滴度/感染初期宿主菌浓度。
沙门氏菌噬菌体RDP-SA-17119的一步生长曲线如图5所示,由该图可知,噬菌体感染宿主菌后的30min内效价没有明显变化,表明其潜伏期约20min,感染后20-60min内噬菌体的滴度明显上升,之后趋于稳定,表明噬菌体裂解期约为40min。通过计算,噬菌体裂解量约为196PFU/感染细胞,表明噬菌体RDP-SA-17119具有潜伏期短、裂解力强和高复制的特点。
实施例7
本实施例为沙门氏菌噬菌体RDP-SA-17119最佳感染复数的测定,具体为:
按照感染复数为10:1、1:1、1:10、1:100、1:1000、1:10000的比例将噬菌体增殖液和宿主加入LB肉汤中,并且确保培养体系的总体积相同。于37℃条件下200rpm振荡培养8h后,常温下12000r/min离心5min,取上清液铺双平板测定其效价,测定结果如表1所示:
表1噬菌体效价测定结果
上述结果显示,当感染复数为1:1000时,培养8h后,增殖液较为清澈,效价最高,说明噬菌体RDP-SA-17119的最佳感染复数为1:1000。
实施例8
本实施例为沙门氏菌噬菌体RDP-SA-17119的裂解率实验,具体为:
无菌条件下,分别取1mL样品和1mL宿主菌菌液(1×10
噬菌体裂解率=(1-处理组菌落数/对照组菌落数)×100%。
经计算,沙门氏菌噬菌体RDP-SA-17119的裂解率达99%,对宿主有较好的裂解效果,适合在养殖过程中使用。
实施例9
本实施例为沙门氏菌噬菌体RDP-SA-17119的裂解谱实验,具体为:
选择实验室已鉴定好的31株沙门氏菌(5株鼠伤寒沙门氏菌、4株鸡白痢沙门氏菌、4株斯坦利沙门氏菌、1株甲型副伤寒沙门氏菌、1株乙型副伤寒沙门氏菌、1株伤寒沙门氏菌、7株肠炎沙门氏菌、1株汤卜逊沙门氏菌、2株山夫登堡沙门氏菌、4株肯坦基沙门氏菌)和沙门氏菌NKS-50,进行裂解谱实验,结果见表2:
表2噬菌体效价测定结果
由上表数据可知,噬菌体在5株鼠伤寒沙门氏菌、4株鸡白痢沙门氏菌、4株斯坦利沙门氏菌、1株甲型副伤寒沙门氏菌、1株乙型副伤寒沙门氏菌、1株伤寒沙门氏菌、1株山夫登堡沙门氏菌、7株肠炎沙门氏菌、4株肯坦基沙门氏菌和沙门氏菌S7平板上均能形成噬菌斑,裂解谱可达93.55%,说明噬菌体RDP-SA-17119裂解谱较为广泛,裂解谱对肉鸡养殖中常见的沙门氏菌均能裂解,可有效预防和治疗禽类沙门氏菌疾病,具有广泛的生产使用价值。
此外,本实施例还采用同样的方法,验证实验室其它20株沙门氏菌噬菌体的裂解谱,其裂解谱在80-92%之间,其它20株裂解谱的范围不如沙门氏菌噬菌体RDP-SA-17119广,说明该噬菌体具有较好的生物学特性和应用价值。
实施例10
本实施例为沙门氏菌噬菌体RDP-SA-17119的对宿主裂解曲线,具体为:
在宿主S7菌悬液中加入噬菌体RDP-SA-17119,由于噬菌体对宿主的裂解作用,导致OD
沙门氏菌噬菌体RDP-SA-17119对宿主裂解曲线如图6所示,由该图可知,沙门氏菌噬菌体RDP-SA-17119加入到宿主菌S7菌悬液中,因为噬菌体对宿主有较强的裂解作用,接入噬菌体后OD
实施例11
本实施例为沙门氏菌噬菌体RDP-SA-17119与不同抗生素联用实验,具体为:
使用LB培养基配制浓度为1.024%的抗生素溶液(其中氟苯尼考、多西环素、黏菌素、泰乐军属、新霉素浓度为0.1024%)于96孔板中先加入100uL灭菌LB培养基,于第1列孔中分别加入配好的药液100uL,依次倍比稀释至第11列,弃去,最后一列为阳性对照。再分别加入100uL纯化菌株菌悬液(增殖液稀释100倍)和再分别加入100uL菌和噬菌体,于37度恒温培养箱培养过夜,12-16小时后记录结果。结果如表3:
表3抗生素单独使用及噬菌体与抗生素联合使用的测定结果
由上表数据可知,沙门氏菌噬菌体RDP-SA-17119与7类14种抗生素协同作用后,都可以有效降抗生素的抑菌浓度,其中与安普霉素、阿米卡星、金霉素、土霉素和黏菌素的作用更为明显,可以将其抗生素的最低抑菌浓度降低至原来的1/4,其余9种抗生素的最低抑菌浓度降低1/2。沙门氏菌噬菌体RDP-SA-17119与常用的多种抗生素都有相互协调作用,两者配合使用,可以有效降低抗生素的MIC,在生产使用中可以有效降低抗生素的使用量,减少耐药菌的产生,保证食品健康安全,且降低生产成本,提高养殖效益。
采用同样的方法,检测实验室其它20株沙门氏菌噬菌体和抗生素的协同作用,其协同作用有限,可将抗生素的MIC降至原来的0-50%,可见其它20株沙门氏菌噬菌体不如沙门氏菌噬菌体RDP-SA-17119的协同效果显著。
实施例12
本实施例为沙门氏菌噬菌体RDP-SA-17119的生产方法,具体为:
步骤一、种子制备
(1)宿主种子制备:无菌环境下挑取单菌落接种于5mL的LB液体培养基,37℃,200-300rpm培养4-5h,将培养后的宿主菌以3%的接种量接种于100mL的LB液体培养基,37℃,200rpm培养4-6h,再以3-4%的接种量接种于1000mL的LB液体培养基,37℃,150-200rpm培养4-5h,培养好的宿主菌种子置于4℃冰箱备用。
(2)噬菌体种子制备:将保存的噬菌体种子适当稀释后,取100μL与100μL宿主菌置于上层培养基(LB培养基+0.5%的琼脂)中,倒双层平板,37℃,培8-12h,选取噬菌斑呈现云雾状的平板,用5mL的LB液体培养基洗下上层培养基,然后12000rpm,10min离心,过0.22μm的滤膜,收集清液。
清液与宿主分别以3%的比例接种于5mL的LB培养基,37℃,200rpm培养4-6h(培养至增殖液变澄清或者出现絮状物为止),将培养好的噬菌体和宿主各以3%的接种量同时接种于100mL的LB液体培养基,37℃,200rpm培养4-6h,再将培养好的噬菌体和宿主各以3%的接种量同时接种于1000mL的LB液体培养基,37℃,200rpm培养4-8h,培养好的噬菌体种子置于4℃冰箱备用。
步骤二、噬菌体增殖:
将制备好的宿主菌以3-4%的比例接种于种子发酵罐中,培养3-3.5h后,OD600值在0.8-0.9,将宿主菌通过移种管道接种于发酵罐,接种量为3-4%,宿主在种子罐中培养3-3.5h,OD在0.7-0.9时以最佳感染复数的接种量接入噬菌体,增殖3h后,以流加的方式加入增殖液体积8-9%的宿主菌,流加的宿主的种龄3-6h,流加时间控制是1-2h,然后再培养6-8h,待溶氧反升,pH趋于稳定,结束增值。(注:发酵罐参数:种子罐200-300rpm,37℃,通气1:0.6-0.8vvm。发酵罐:120-150pm,37℃,通气1:0.6-0.8vvm。)
培养基成分:酵母浸粉2.5%,甘油0.5%,氯化钠0.5%,磷酸二氢钾0.2%,磷酸氢二钾0.2%,氯化镁20ppm,氯化钙20ppm,pH7.2。
步骤三、噬菌体后处理工艺:
(1)离心:将增殖完成的噬菌体,用碟式离心机离心,6000rpm,流速≤200L/H,去除未裂解的宿主和细菌碎片等,然后再用管式离心机离心,17000rpm,流速≤80L/H,进一步去除宿主菌菌和细胞碎片。
(2)采用800nm的陶瓷膜进一步过滤除菌。
(3)过滤除菌:浓缩后的噬菌体采用三级过滤(聚丙烯0.45μm,聚醚砜0.45μm,聚醚砜0.22μm)除菌。
(4)在过滤除菌后的清液中,添加6%水溶性淀粉、2%海藻糖、2%吡咯烷酮K-30、0.5%维生素C,在45℃的条件下,采用超低温浓缩至原来体积的1/4-1/5。
(5)干燥:采用带式真空机干燥,干燥过程中温度控制的45℃以下,干燥后的水分低于6%。
(6)真空带式干燥机与冻干机生产的样品存储稳定实验,将样品置于4℃条件下,定期测定其活性,结果如图7所示。
由图7可知,两个样品都有较好的稳定性,在4℃条件下,存储25个月后,其活性仅下降2个数量级,说明超低温浓缩和真空带干燥都适合噬菌体干燥,与超低温浓缩和真空带式干燥工艺相比真空冷冻干燥产能较低,且设备投资较大,生产运营成本较大。从产品的稳定性、生产成本、生产效率和设备投资上比对,该工艺更适合噬菌体的干燥。
- 一种基于PMF-FFT算法在FPGA上实现信号捕获的方法
- 基于低成本FPGA实现PMF-FFT捕获算法的方法
